HAL Id: dumas-03111371
https://dumas.ccsd.cnrs.fr/dumas-03111371
Submitted on 15 Jan 2021HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Clostridioides difficile et les perturbations du microbiote
intestinal
Annabelle Salas
To cite this version:
Annabelle Salas. Clostridioides difficile et les perturbations du microbiote intestinal. Sciences du Vivant [q-bio]. 2020. �dumas-03111371�
UNIVERSITÉ CLERMONT AUVERGNE UFR DE PHARMACIE
Année : 2020 N°
THÈSE D'EXERCICE pour le
DIPLÔME D’ÉTAT DE DOCTEUR EN PHARMACIE
Présentée et soutenue publiquement le 25 Septembre 2020
par
Annabelle SALAS
CLOSTRIDIOIDES DIFFICILE ET LES
PERTURBATIONS DU MICROBIOTE
INTESTINAL
Directeur de thèse : Mme Sylvie MIQUEL Jury
Président : Mme Christiane FORESTIER Professeur
UFR Pharmacie de Clermont-Ferrand Membres : Mme Sylvie MIQUEL Maître de conférences,
UFR Pharmacie de Clermont-Ferrand Mme Catherine COUDERT Maître de conférences,
UFR Pharmacie de Clermont-Ferrand M. Jean-Pierre DELORT Docteur en Pharmacie,
Aurillac (15)
M. Julien SCANZI Gastroentérologue,
UNIVERSITÉ CLERMONT AUVERGNE UFR DE PHARMACIE
Année : 2020 N°
THÈSE D'EXERCICE pour le
DIPLÔME D’ÉTAT DE DOCTEUR EN PHARMACIE
Présentée et soutenue publiquement le 25 Septembre 2020
par
Annabelle SALAS
CLOSTRIDIOIDES DIFFICILE ET LES
PERTURBATIONS DU MICROBIOTE
INTESTINAL
Directeur de thèse : Mme Sylvie MIQUEL Jury
Président : Mme Christiane FORESTIER Professeur
UFR Pharmacie de Clermont-Ferrand Membres : Mme Sylvie MIQUEL Maître de conférences,
UFR Pharmacie de Clermont-Ferrand Mme Catherine COUDERT Maître de conférences,
UFR Pharmacie de Clermont-Ferrand M. Jean-Pierre DELORT Docteur en Pharmacie,
Aurillac (15)
M. Julien SCANZI Gastroentérologue,
REMERCIEMENTS
À Madame Sylvie Miquel, Docteur en Microbiologie, Maitre de conférences à l’UFR Pharmacie de Clermont-Ferrand, et directrice de cette thèse. Je vous remercie de m’avoir aiguillée dans le choix de ce sujet. Vous m’avez fait l’honneur de guider ce travail, de m’avoir orientée et corrigée durant toute la rédaction de ma thèse.
Merci pour votre grande implication, ainsi que pour votre disponibilité.
À Madame le Professeur Christiane Forestier, vous m’avez guidée dans la réalisation de cette thèse que vous me faites l’honneur de juger. A Madame le Docteur Catherine Coudert, je suis honorée de votre présence au sein de ce jury. À Monsieur le Docteur Jean-Pierre Delort. Je vous remercie d’avoir accepté de juger ce travail. Je suis sensible à l’honneur que vous me faites. À Monsieur le Docteur Julien Scanzi, Je vous remercie d’avoir partagé vos grandes connaissances avec moi, ainsi que pour votre disponibilité. Au Docteur Isabelle Miyazawa, qui a su inspirer le sujet de cette thèse. C’est grâce à votre pédagogie, à la passion dévouée que vous portez à votre métier, ainsi qu’à toute l’équipe du Professeur Furukawwa à Sendai, que je me suis intéressée à C.difficile. À mon amie Claire. Merci pour ton aide précieuse lors de cette rédaction. Comme toujours, merci d’avoir été présente pour moi. Tu as ma toute ma reconnaissance, et ma plus grande admiration. À mes parents et à ma sœur, merci pour votre indéfectible soutien tout au long de mes études. Je n’y serai pas arrivée sans votre bienveillance, et à tout l’amour que vous me portez.
À mes grands-parents, à toute ma famille, Je vous remercie pour votre amour. À ma cousine Sophie et à Antonin, mille mercis pour votre soutien si particulier cette année. À mes amies Anouk et Marina. J’ai tant de souvenirs avec vous. Merci pour tous ces bons moments. Merci pour votre fidélité. À Arnaud, merci pour tout le soutien dont tu m’as fait part tout au long de cette rédaction.
SOMMAIRE
LISTE DES FIGURES 8 LISTE DES TABLEAUX 12 LISTE DES ABRÉVIATIONS 13 INTRODUCTION 15 I. CLOSTRIDIOIDES DIFFICILE 18
A. PRÉSENTATION DE LA BACTÉRIE 18
1. FACTEURS DE VIRULENCE 22
2. PROCESSUS DE RÉSISTANCE ET COLONISATION 23
B. PATHOLOGIE : L’INFECTION À CLOSTRIDIOIDES DIFFICILE 26
1. EPIDEMIOLOGIE 26
2. DIAGNOSTIC 29
3. TRANSMISSION, PREVENTION DE L’INFECTION 35
4. FACTEURS DE RISQUE ET DE RECIDIVES 38
II. LE MICROBIOTE INTESTINAL 44
A. HISTOIRE DU MICROBIOTE 44
B. MÉTHODES D’ÉTUDE 47
C. COMPOSITION DU MICROBIOTE INTESTINAL 48
D. RÔLES 52
1. FONCTIONS IMMUNITAIRES 52
2. FONCTION DE BARRIÈRE, DE PROTECTION 53
3. FONCTIONS MÉTABOLIQUES 53
E. EVOLUTION DU MICROBIOTE AU COURS DE LA VIE 58
1. NAISSANCE ET PREMIERS MOIS DE VIE 58
2. EVOLUTION DU MICROBIOTE INTESTINAL APRÈS 6 MOIS, ET DYSBIOSES 60
F. DYSBIOSES ET INFECTION À CLOSTRIDIOIDES DIFFICILE 62
1. LES FACTEURS DE DYSBIOSE ASSOCIÉS À L’ICD 64
2. MODULATION DU METABOLISME DU MICROBIOTE INTESTINAL ET DEVELOPPEMENT
D’ICD : 67
A. ANTIBIOTHÉRAPIE 73
1. RÉSISTANCE AUX ANTIBIOTIQUES 73
2. TRAITEMENT DE L’ICD VIA ANTIBIOTHÉRAPIE 76
3. ANTIBIOTIQUE À SPECTRE ÉTROIT : LE RIDINILAZOLE 80
B. TRAITEMENTS ALTERNATIFS DE L’ICD 81
1. LA TRANSPLANTATION DE MICROBIOTE FÉCAL 81
2. LES AUTRES ALTERNATIVES 86
IV. ENQUÊTE SUR LES TRAITEMENTS CONDUISANT À DES ICD TRAITÉES
PAR TMF 91 A. ORIGINE DU TRANSPLANT ET PROCÉDURE D’INOCULATION 91 B. COHORTE DE PATIENTS ET FACTEURS DE RISQUE 92 C. EFFICACITÉ DE LA TMF ET EFFETS SECONDAIRES 95 CONCLUSION 97 BIBLIOGRAPHIE 98 ANNEXES 106
LISTE DES FIGURES
FIGURE I : ASPECT MORPHOLOGIQUE DE C. DIFFICILE AU MICROSCOPE
OPTIQUE APRES COLORATION DE GRAM 18
FIGURE II : LE LOCUS AGRA REGULE POSITIVEMENT LES NIVEAUX DE TOXINE
A (4). 22
FIGURE III : POURCENTAGES DE SURVIE DES BACTERIES (SESSILES OU PLANCTONIQUES) APRES 1 OU 3 JOURS DE TRAITEMENT ANTIBIOTIQUE PAR VANCOMYCINE 20MG/ML (SOIT 100 FOIS LA CMI DE LA SOUCHE
HYPERVIRULENTE BI/NAP1/027/R20291).(11) 24
FIGURE IV : CYCLE DE COLONISATION PAR C. DIFFICILE DU TUBE DIGESTIF DE
L’HOMME (12) 25
FIGURE V : PATHOGENESE DE C. DIFFICILE (2) 26
FIGURE VI : POIDS DES ICD EN EUROPE ET AUX ÉTATS-UNIS (15) 27 FIGURE VII : NOMBRE DE SEJOURS EN ETABLISSEMENTS DE SANTE POUR ICD
EN FRANCE (8) 27
FIGURE VIII : INCIDENCE DES ICD EN FRANCE ET EN EUROPE (14) 29
FIGURE IX : ÉCHELLE DE BRISTOL 29
FIGURE X : PHOTOGRAPHIE DE COLITE PSEUDOMEMBRANEUSE 30 FIGURE XI : METHODES DE DETECTION DANS LES SELLES 32 FIGURE XII : EXEMPLE DE TEST DE DEPISTAGE DE LA GDH (18) 33 FIGURE XIII : ALGORITHMES RECOMMANDES POUR LE DIAGNOSTIC DES ICD
EN LABORATOIRE (12) 35
FIGURE XIV : CONDUITE A TENIR CHEZ LES PORTEURS DE C. DIFFICILE EN
FIGURE XV : RISQUE RELATIF D’ICD AU 7EME JOUR D’ANTIBIOTHERAPIE EN
FONCTION DES ANTIBIOTIQUES UTILISES (21) 39
FIGURE XVI : INCIDENCE D’ICD POUR 1000 RESIDENTS EN FONCTION DES
TRAITEMENTS ANTIBIOTIQUES UTILISES. (21) 39
FIGURE XVII : POURCENTAGE DE RISQUE DE RECIDIVES D’ICD EN FONCTION DU NOMBRE D’EPISODES D’ICD AYANT DEJA EU LIEU (21). 41 FIGURE XVIII : DELAI DE RECURRENCE D’ICD EN FONCTION DE L’AGE DES
PATIENTS (21) 41
FIGURE XIX : ALTERNANCE DES SEQUENCES CONSERVEES ET VARIABLES DES
GENES DE L’ARNR 16S (28) 47
FIGURE XX : LES DIFFERENTS PHYLA DU MICROBIOTE INTESTINAL CHEZ
L’ADULTE (37) 49
FIGURE XXI : REPARTITION DES BACTERIES COMPOSANT LE MICROBIOTE
INTESTINAL (30) 50
FIGURE XXII : LES ENTEROTYPES (39) 50
FIGURE XXIII : METABOLISME DES GLUCIDES 54
FIGURE XXIV : FERMENTATION DES GLUCIDES PAR LE MICROBIOTE
INTESTINAL (43) 55
FIGURE XXV : CYCLE ENTEROHEPATIQUE DES ACIDES BILIAIRES (46) 57 FIGURE XXVI : DEVELOPPEMENT DU MICROBIOTE INTESTINAL A LA
NAISSANCE (53) 59
FIGURE XXVII : DIFFERENTES CAUSES DE DYSBIOSE INTESTINALE (58) 63 FIGURE XXVIII : ALTERATIONS DU MICROBIOTE INTESTINAL EN FONCTION
FIGURE XXIX : QUANTITES D’ACETATE, BUTYRATE, PROPIONATE, LACTATE ET SUCCINATE DETECTEES DANS LES SELLES AVANT TRAITEMENT PAR
STREPTOMYCINE (CONV) ET APRES 3 JOURS DE TRAITEMENT PAR
STREPTOMYCINE (ABX) (72). 69
FIGURE XXX : DENSITE DE C. DIFFICILE DANS LES SELLES DE SOURIS
ASSOCIEES A BACTEROIDES THETAIOTAOMICRON ET INFECTEES PAR C. DIFFICILE SAUVAGE (BT+CD) OU INFECTEES PAR C. DIFFICILE MUTEE DANS LE TRANSPORT DU SUCCINATE (BT+CD-CD2344-) 1 JOUR APRES
L’INFECTION ET SOUS CONDITIONS STANDARDS DE NUTRITION.(72) 69 FIGURE XXXI : IMPACT DU MICROBIOTE INTESTINAL ET DES METABOLITES
INTESTINAUX SUR L’ICD (66). 71
FIGURE XXXII : DIFFERENTS MODES D’ACTIONS DES ANTIBIOTIQUES EN
FONCTION DE LEURS CLASSES 73
FIGURE XXXIII : PERTURBATION DE L’HOMEOSTASIE DU MICROBIOTE
INTESTINAL PAR LES ANTIBIOTIQUES ET L’INFECTION A C. DIFFICILE ET CORRECTION DE LA DYSBIOSE SUITE A LA TRANSPLANTATION FECALE
(89) 81
FIGURE XXXIV : QUESTIONNAIRE DE PRESELECTION POUR LE DON DE SELLES
(81) 84
FIGURE XXXV : NOMBRE DE RECIDIVES D’ICD CHEZ LES PARTICIPANTS
DURANT LES 12 SEMAINES SUIVANT LES TRAITEMENTS (88) 88 FIGURE XXXVI : PART DES PATIENTS AYANT REÇU UNE TMF EN FONCTION DE
L’ANTIBIOTHERAPIE OU DE L’ABSENCE D’ANTIBIOTHERAPIE AYANT PU
FIGURE XXXVII : PART DES PATIENTS AYANT REÇU UNE TMF EN FONCTION DES CLASSES D'ANTIBIOTIQUES POTENTIELLEMENT INCRIMINES DANS
L’ICD 93
FIGURE XXXVIII : DIFFERENTES ANTIBIOTHERAPIES REÇUES PAR LES PATIENTS DE LA COHORTE (ETANT PREALABLEMENT SOUS
ANTIBIOTHERAPIE 94
FIGURE XXXIX : POURCENTAGES DE PATIENTS PRESENTANT DES EFFETS
LISTE DES TABLEAUX
TABLEAU 1 : RESUME DES FACTEURS DE VIRULENCE PRESUMES ASSOCIES
AUX INFECTIONS RECURRENTES A C. DIFFICILE (3) 21
TABLEAU 2 : DIFFERENTS CRITERES DE SEVERITE DE L’ICD (10) 31 TABLEAU 3 : CLASSIFICATION DES ANTIBIOTIQUES EN FONCTION DE LEUR
IMPLICATION DANS LES ICD 38
TABLEAU 4 : RESISTANCE AUX ANTIBIOTIQUES DE C. DIFFICILE :
RECENSEMENT DE 46 ETUDES PUBLIEES ENTRE 2012 ET 2017 (17) 74 TABLEAU 5 : RECOMMANDATIONS POUR LE TRAITEMENT DES ICD(14) 76 TABLEAU 6 : TAUX DE GUERISON DES DIARRHEES ASSOCIEES A C. DIFFICILE
EN FONCTION DE LA SEVERITE DE L’ICD ET DU TRAITEMENT (74) 77 TABLEAU 7 : RESULTATS DES TRAITEMENTS AVEC FIDAXOMICINE VERSUS
VANCOMYCINE SUR LES 922 PATIENTS (74) 78
TABLEAU 8 : ESSAIS CONTROLES RANDOMISES POUR LE TRAITEMENT DE
LISTE DES ABRÉVIATIONS
AGCC : Acides Gras à Chaînes CourtesAIEC : Escherichia Coli adhérent-invasifs ANSM : Agence Nationale de Santé Publique ARN : Acide RiboNucléique
ARS : Agence Régionale de Santé BT : Bactéroides Thetaoimicron
C. difficile : Clostridioides difficile C. scindens : Clostridium scindens
CCFA : Cycloserine Cefoxitine Fructose Agar CDN : C.difficile Négatif
CFU : Colony-Forming Unit
CHU : Centre Hospitalier Universitaire CMI : Concentration Minimale Inhibitrice CNR : Centres Nationaux de Références ECP : Effet CytoPathique
EIA : Enzyme ImmunoAssays EIP : Emerging Infections Program
ELISA : Enzyme-linked Immunosorbent Assay ermB : Erythromycin Ribosome Methylation ERV : Entérocoque Résistant à la Vancomycine
ESCMID : European Society of Microbiology and Infectious Diseases FIAF : Fasting-Induced Adipose Factor
GDH : Glutamate Deshydrogénase
GFTF : Groupe Français de Transplantation Fécale Go : Giga Octets
HAD : Hospitalisation à Domcile
HCUP : Healthcare Cost and Utilization Project ICD : Infection à Clostridioides difficile
IDSA : Infectious Diseases Society of America
INRA : Institut National de la Recherche Agronomique IPP : Inhibiteurs de la Pompe à Protons
MALDI-TOF : Matrix Assisted Laser Desorption Ionization-Time Of Flight MétaHIT : Metagenomics of the Human Intestinal Tract
MICI : Maladies Inflammatoires Chroniques de l’Intestin MLSb : Macrolide-Lincosamide-Streptogramine B NAP1 : North American Pulsed field Type 1 PCR : Polymerase Chain Reaction
PMSI : Programme de médicalisation des systèmes d’information PUI : Pharmacie à Usage Interieur
RCH : RectoColite Hémmoragique
S.boulardii : Saccharomyces boulardii
SARM : Staphylococcus aureus résistant à la méticilline
TMF : Transplantation de Microbiote Fécal VHB : Virus de l’Hépatite B
VHC : Virus de l’Hépatite C
VIH : Virus de l’Immunodéficience Humaine VPN : Valeur Prédictive Négative
INTRODUCTION
Lors de mes études de pharmacie à la Faculté de Clermont-Ferrand, j’ai eu le privilège de suivre les cours de Madame Sylvie Miquel, Docteur en Microbiologie et Maître de conférence à l’université Clermont-Auvergne, sur les probiotiques. Étant tout à fait intéressée par ces compléments alimentaires et cette approche du microbiote nouvelle, je me suis naturellement dirigée vers Madame Miquel pour la rédaction de cette thèse.
D’autre part, lors de ma cinquième année d’étude de pharmacie, j’ai eu la chance d’effectuer un des stages hospitaliers dans un service de médecine interne à Sendai, au Japon. J’ai pu suivre le travail de Madame le Docteur Isabelle Miyazawa dans le service du Professeur Furukawa. C’est grâce à leur grande pédagogie et leur implication dans mon stage, que j’ai pu m’intéresser à Clostridioides difficile. En effet, via les mesures d’isolement et d’hygiène supplémentaires pour les patients atteints d’infection à C. difficile, j’ai été marquée par cette bactérie.
L’infection à la bactérie C. difficile (ICD) représente la première cause de diarrhée nosocomiale chez l’adulte et 15 à 25% des diarrhées post-antibiotiques. L’incidence de cette pathologie n’a cessé d’augmenter ces dernières années et génère un coût important à notre système de santé. En outre, C. difficile est une bactérie résistante à de nombreux antibiotiques, et l’ICD peut être déclenchée par moult xénobiotiques, tels que les antibiotiques à larges spectres, les inhibiteurs de pompes à protons ainsi que les immunosuppresseurs. Ces médicaments peuvent altérer l’équilibre de notre microbiote intestinal, c’est-à-dire l’équilibre des microorganismes vivant dans nos intestins de manière physiologique.
Dans ce travail de thèse, nous développerons le lien entre l’ICD et les perturbations du microbiote intestinal. Nous traiterons dans un premier temps des caractéristiques de la bactérie C. difficile et de ses facteurs de virulence. Nous aborderons plus particulièrement l’infection qu’elle engendre en s’intéressant aux méthodes permettant de diagnostiquer cette pathologie, son épidémiologie ainsi que la transmission de cette bactérie et les facteurs de risques. Dans un deuxième temps, nous parlerons du microbiote intestinal en traitant tout d’abord de l’histoire de sa découverte ainsi que des méthodes qui permettent de l’étudier. Puis, nous étayerons non seulement sa composition, mais également les modifications que notre microbiote intestinal
subit au cours de notre vie, afin de finir par développer les liens entre le déséquilibre du microbiote intestinal et l’infection à C. difficile (ICD). Dans un troisième temps, nous aborderons les différents traitements de l’ICD, c’est-à-dire les différentes antibiothérapies, mais aussi les traitements alternatifs, tels que notamment la transplantation de microbiote fécal.
Enfin, dans un dernier temps, et grâce au Docteur Scanzi, Gastroentérologue au CHU Estaing à Clermont-Ferrand et à l’hôpital de Thiers, nous présenterons une enquête sur 33 patients ayant subi un traitement de l’infection à C. difficile par transplantation de microbiote fécal. Cette étude représente une confrontation clinique de la théorie développée dans cette thèse et permet de valider les traitements incriminés dans le déclenchement de ces infections, mais également d’observer le taux de résolution de l’infection à C. difficile qu’offre la transplantation de microbiote fécal.
PARTIE I :
CLOSTRIDIOIDES
DIFFICILE
I.
CLOSTRIDIOIDES DIFFICILE
A.
PRÉSENTATION DE LA BACTÉRIE
Clostridiodes difficile est un bacille Gram positif, sporulant, mobile et anaérobie (Figure
I). Il s’agit d’un bacille mis en évidence dès 1935 dans la flore intestinale de nouveau-nés en bonne santé par Hall et O’Toole. Cette bactérie tient son nom du fait de la difficulté de sa mise en culture.
.
Figure I: Aspect morphologique de C. difficile au microscope optique après coloration de Gram
C’est en 1980 que Prazmowski décrit le genre Clostridium comprenant un grand nombre d’espèces aux caractéristiques phénotypiques communes : anaérobies, Gram positives et sporulées. Puis, grâce aux avancées scientifiques et notamment du séquençage de l’ARN 16S, Collins et son équipe décident de réviser le groupe Clostridium en fonction des séquences du gène de l’ARN 16S ; ce groupe sera nommé « ARNr Cluster I » (1). Phylogénétiquement parlant, C. difficile s’avère éloigné du Cluster I de par son ARNr, et est alors placé dans le cluster XI. Il est intéressant de noter qu’en 2013 Yutin et Galperin ont émis l’hypothèse d’une reclassification de C. difficile en Peptoclostridium difficile et que le groupe XI prenne le nom de Peptoclostridium, mais que cette requête a été refusée, en raison de la trop grande largeur de ce groupe. En 2016, Lawson et Rainey décident de reclasser Clostridium difficile en
Clostridioides difficile et de réduire le genre Clostridium à la seule espèce Clostridium butyricum et aux espèces apparentées.
C. difficile est responsable de 15 à 25% des diarrhées associées aux antibiotiques et de 95% des colites pseudomembraneuses. C’est la première cause de diarrhée infectieuse nosocomiale chez l’adulte. Il existe différentes souches que l’on peut classer en deux grands groupes : les souches pathogènes ou toxinogènes et les souches non pathogènes ou non-toxinogènes. En effet, cette bactérie peut sous sa forme végétative produire des toxines responsables des symptômes observés lors de l’infection. Ces toxines ne sont pas produites par la forme sporulée mais cette dernière permet une résistance et une survie de la bactérie dans des conditions de stress. Ce sont les spores qui sont souvent source d’infection. La virulence de la bactérie est observée par les toxines.
Il existe trois toxines différentes produites par C. difficile qui sont principalement responsables des symptômes associés à l'ICD :
• La toxine A entérotoxique, codée par le gène tcdA : elle affaiblit la perméabilité de l’épithélium intestinal, en attaquant les monocytes et les neutrophiles.
• La toxine B cytotoxique codée par le gène tcdB cytotoxique : elle attaque directement les cellules épithéliales du colon
• La toxine binaire codée par les deux gènes : tcdA et tcdB. Cette toxine binaire est produite par les souches hypervirulentes. C’est une transférase à activité ADP-ribosylation de l’actine : elle adjoint une ou plusieurs unités ADP-ribose sur l’actine, ce qui perturbe le cytosquelette. La présence de cette toxine binaire augmente le risque de récidives d’ICD.
Les toxines A et B se lient à la surface des cellules et exercent une translocation vers le cytosol des cellules épithéliales. Puis, ces toxines glycosylent puis inactivent des GTPases, ce qui altère le cytosquelette de l’actine, induisant ainsi l’apoptose. Toutes les souches de C. difficile ne présentent pas le même niveau de virulence. En effet, des souches hypervirulentes sont apparues au fil des années (2). Ces souches hypervirulentes sont associées à un taux de sporulation élevé et des niveaux importants de production de toxines. Les souches hypervirulentes les plus décrites dans la littérature sont :
• C. difficile 027 : Il s’agit du ribotype nord-américan nommé 027 par rapport à son profil par PCR-ribotypage, et également appelé NAP1 (North American Pulsed field Type 1 en référence à son profil en électrophorèse en champ pulsé.
Ce ribotype est associé à la prise de Céphalosporines de large spectre et est résistant aux Quinolones. Il est associé aux récidives d’ICD et au taux de guérison le moins élevé par rapport aux autres ribotypes. La propagation initiale s’est faite au Canada, avant de s’étendre à 16 pays Européens. Cette souche a un cycle de croissance plus long : la production de toxines commence plus tôt que pour les autres souches, et les toxines ont tendance à s’accumuler.
• C. difficile 078 : Cette souche est en augmentation aux Pays-Bas. Elle est à la fois retrouvée chez l’Homme et chez les animaux tels que les veaux, les porcs et les chevaux. • C. difficile 017 : Principalement retrouvée en Asie, elle ne libère que la toxine B (A-,
B+).
En plus des toxines, C. difficile présente un pouvoir pathogène augmenté par des facteurs de virulence et des processus de résistance (Tableau 1).
Tableau 1 : Résumé des facteurs de virulence présumés associés aux infections récurrentes à C.
1. FACTEURS DE VIRULENCE
Le Quorum sensing est le mode de communication des bactéries. Il permet de réguler l’expression des gènes via de petites molécules : « les autoinducteurs » qui interagissent avec un régulateur de la transcription. Ainsi, le quorum sensing peut moduler l’expression des gènes (4). Le locus de quorum sensing agr, exprimant le régulateur transcriptionnel AgrA, est impliqué dans le contrôle de l'expression des gènes et l'amélioration de la production de facteurs de colonisation de beaucoup de pathogènes Gram positif (5). Certaines souches de C. difficile possèdent deux loci du gène agr, dénommés agr1 et agr2 (6). Le locus agr1 est présent dans toutes les souches de C. difficile séquencées à ce jour. La production de la toxine A de C. difficile est médiée par un système de signalisation Agr-quorum sensing (5). En effet, l’utilisation d’un mutant invalidé dans le gène agrA (R20291 agrA76a :: CT) a permis de montrer in vitro que ce régulateur induit la synthèse de la toxine A (5) (Figure II).
Figure II : Le locus agrA régule positivement les niveaux de toxine A (4).
C. difficile produit 7,42 ng/mL de toxine TcdA ce qui est significativement supérieur à la production de la souche mutée
Par ailleurs, les protéines exprimées en surface de C. difficile jouent un rôle dans la virulence de cette bactérie. La protéine SlpA (S-Layer protéine A) se situe dans la couche S (S-layer), qui recouvre la surface de toutes les souches de C. difficile, au-dessus du Peptidoglycane. Elle permet une adhésion accrue aux cellules épithéliales de la muqueuse intestinale (3). La protéase Cwp84, fortement conservée chez C. difficile, est associée à une importante activité protéolytique : elle dégrade les protéines de la matrice extracellulaire de l’hôte, entrainant ainsi une perte d’intégrité cellulaire, ce qui facilite la colonisation de C. difficile. Cwp84 est aussi impliquée dans la production de biofilms plus épais (7)(3). Enfin, les
flagelles de C. difficile permettent la propulsion et la mobilité de la bactérie. Le locus agr1 régule positivement la synthèse des flagelles (5). La flagelline (protéine majoritaire structurale du filament flagellaire) peut être modifiée de manière post-transcriptionnelle et induire une augmentation de la formation de biofilm ainsi que de l’adhérence aux cellules épithéliales (3). Ces flagelles auraient également un rôle dans la réponse inflammatoire de l’hôte. Ils activent le récepteur TLR5, qui engendre alors une sécrétion de cytokines pro-inflammatoires (8).
2. PROCESSUS DE RÉSISTANCE ET COLONISATION
Un biofilm est défini comme «une communauté microbienne sessile caractérisée par des cellules adhérant de manière irréversible à un substrat, à une interface biotique ou abiotique, ou les unes aux autres et enchâssées dans une matrice extracellulaire autoproduite» (9). Les biofilms protègent les bactéries face à un environnement hostile et sont associés à une résistance antimicrobienne ainsi qu’a une récurrence des ICD (10). De par leur structure tridimensionnelle, ils constituent une niche de survie pour les bactéries : les bactéries sont protégées des stress multiples tels que les antibiotiques par exemple. En effet, la survie de C. difficile sous forme biofilm versus planctonique après traitement à la Vancomycine 20µg/mL (antibiotique utilisé dans le traitement de l’ICD) a été testée (Figure III) (11). Le taux de survie des bactéries planctoniques, au bout de trois jours de traitement par Vancomycine est bien moins élevé que celui des bactéries du biofilm montrant bien le rôle protecteur du biofilm.
Figure III : Pourcentages de survie des bactéries (sessiles ou planctoniques) après 1 ou 3 jours de traitement antibiotique par vancomycine 20mg/mL (soit 100 fois la CMI de la souche hypervirulente
BI/NAP1/027/R20291).(11)
Une autre étude a souligné le rôle clef des biofilms dans l’ICD, via la production de toxines A et B (12). En effet, lorsqu’on mesure le taux de toxines A et B dans un biofilm de C. difficile à différents temps, une faible quantité de toxines est détectée à 24 heures et ce taux augmente à 3 jours puis reste stable 6 jours après le début de culture. Ainsi, les toxines restent détectables dans un biofilm mature. Le biofilm aurait un rôle clef dans l’ICD comme le lieu d’accumulation des toxines.
Il est intéressant de se questionner sur la faculté de ce biofilm à agir tel un réservoir, qui permettrait le rétablissement de C. difficile après un premier traitement antibiotique. Une étude s’est intéressée au facteur de transcription modulant la formation des spores (spo0A) (11). Lorsque spo0A est invalidé par mutation (afin qu’il soit défectueux dans la sporulation), il est observé une importante diminution de la formation de biofilm par rapport à la souche sauvage de C. difficile. Ainsi, la formation de biofilm est corrélée à la formation de spores. La forme biofilm pourrait faciliter le maintien des spores dans un état de dormance, pouvant causer plus tard une récidive d’ICD.
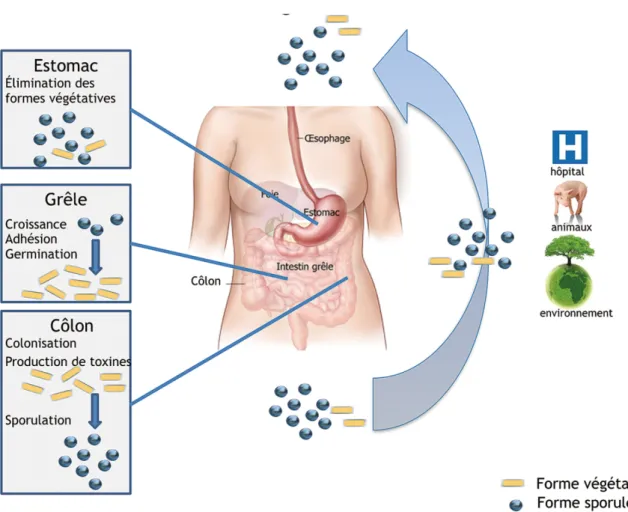
Les spores de C. difficile jouent un rôle prépondérant dans la colonisation du tube digestif par cette bactérie. La contamination se fait principalement par voie oro-fécale. En effet, lorsque la forme végétative et la forme sporulée sont ingérées, seule la forme sporulée résiste à l’acidité gastrique. De plus, si la forme végétative est la forme libérant les toxines, elle n’est pas résistante (aux désinfectants par exemple), contrairement à la forme sporulée (13).
Figure IV : Cycle de colonisation par C. difficile du tube digestif de l’Homme (12)
C’est l’adhésion des spores ingérées, puis leur germination en formes végétatives permise par les acides biliaires qui induit la colonisation de l’intestin grêle et du côlon (Figure
V).
Les souches produisant des toxines stimulent l’inflammation de la muqueuse intestinale. Les toxines inactivent des protéines du cytosquelette, entraînant une destruction des fibres des jonctions serrées et donc une perturbation de la perméabilité intestinale : la barrière épithéliale intestinale est alors rompue. Les toxines peuvent alors traverser l’épithélium et induire une production de cytokines inflammatoires, avec un afflux de neutrophiles et de lymphocytes (Figure V). Ces troubles sont responsables des manifestations cliniques de l’ICD (2). Puis, dans le côlon, ces formes végétatives vont produire les toxines et sporuler à nouveau avant d’être éliminées (13) (Figure IV).
Figure V : Pathogenèse de C. difficile (2)
B.
PATHOLOGIE :
L’INFECTION
À
CLOSTRIDIOIDES
DIFFICILE
1. EPIDEMIOLOGIE
C. difficile est le principal agent entéropathogène responsable de diarrhée infectieuse nosocomiale de l’adulte. Les ICD génèrent un surcoût notoire pour les systèmes de santé. En France, une ICD génère en moyenne 13 jours d’hospitalisation, soit un coût de 9695€ (14). Si on extrapole ces données grâce aux données de The Healthcare Cost and Utilization Project (HCUP), le coût annuel des ICD aux États-Unis est compris entre 1,2 et 5,9 milliards de dollars américains.
Figure VI : Poids des ICD en Europe et aux États-Unis (15)
En Europe, l’incidence est d’environ 124 000 cas par an, versus 453 000 cas par an aux États-Unis (Figure VI). En France, on estime l’incidence des ICD à 2,3 cas pour 10 000 patients par jour. La base nationale de PMSI (Programme de Médicalisation des Systèmes d’Information) permet de fixer des objectifs et de standardiser les données pour le service public hospitalier et les établissements privés de soin. D’après cette base de donnée, entre 2010 et 2015, le nombre de séjours pour ICD a plus que doublé : il est passé de 3300/ an à 6800/ an (13).
Figure VII : Nombre de séjours en établissements de santé pour ICD en France (8)
D’après l’IDSA (Infectious Diseases Society of America), 3 à 26% des patients en unités de soins continus seraient colonisés par C. difficile sans présenter de symptômes et 5 à 7% des patients âgés en HAD (Hospitalisation À Domicile) (15). En parallèle, la prévalence de C. difficile dans les échantillons de selles examinés parmi des adultes asymptomatiques sans exposition récente à des centres de soin est <2% (15).
En 2010 aux États-Unis, parmi 711 hôpitaux de soins intensifs, dans 28 états d’après les mêmes standards de recensement, le taux d’ICD était de 7,4 patients pour 10 000 patients par
jour (15). Toujours d’après cette étude, l’incidence d’ICD est plus élevée chez les personnes âgées de plus de 65 ans, les femmes ainsi que les personnes à la peau blanche. Sur un total de 453 000 cas, 64,7% étaient associés aux soins, 37% se sont déclarés à l’hôpital, 36% sont apparus dans des établissements de soins de longue durée et 28% sont survenus en communauté mais également reliés aux soins (comme par exemple un échantillon prélevé en ambulatoire, une ICD déclenchée moins de 3 jours après une admission à l’hôpital ou encore un séjour avec nuits passées à l’hôpital dans les 12 jours précédents) (15).
Une enquête de prévalence sur les infections nosocomiales, menée par l’EIP (Emerging Infections Program) sur dix états aux États-Unis en 2011, a révélé que C. difficile représente l’agent pathogène le plus courant : 12,1% des infections nosocomiales aux États-Unis (15). En outre, dans un réseau du Sud-Est des États-Unis, l’ICD a dépassé les infections au Staphylococcus aureus résistant à la méthicilline (SARM), et est devenue la cause la plus fréquente d’Infection nosocomiale (15).
En Europe, l’incidence des ICD ne cesse d’augmenter, avec une augmentation de 70% de l’incidence en 6 ans : entre 2008 et 2014 (Figure VIII). Plus précisément, en France, l’incidence a augmenté de 17% par an entre 2009 et 2014 (Figure VIII). Cette augmentation est aussi corrélée à l’amélioration des techniques de diagnostic et à une plus grande sensibilisation des praticiens à l’ICD. En effet, lors de l’émergence des ICD au début des années 2000, des échantillons de selles étaient testés sans fondement, les méthodes diagnostiques n’étaient pas appropriées et les dénominateurs de calcul des ratios d’incidence n’étaient pas standardisés. La standardisation des méthodes de diagnostic et de surveillance des ICD au sein même d’un pays donné et entre les pays est nécessaire afin d’obtenir des données précises et fiables. L’ESCMID (European Society of Clinical Microbiology and Infectious Diseases) a permis de poser une définition de l’Infection à C. difficile et fournit des conseils avisés concernant le diagnostic (16). Elle recommande la standardisation des méthodes de diagnostic et de surveillance, afin de détecter, contrôler et répondre aux changements d’épidémiologie de l’ICD, notamment pour le ribotype 027 (17).
Figure VIII : Incidence des ICD en France et en Europe (14)
2. DIAGNOSTIC
Le diagnostic d’ICD sera posé dès lors que le diagnostic clinique sera accompagné de preuves microbiologiques (recherche de C. difficile et de ses toxines).
a) Diagnostic clinique Lors du diagnostic clinique, on observera :
1/. Des diarrhées simples post-antibiotiques liquides : échelle de Bristol : 5, 6 et 7 (Figure IX)
sans colite avérée, supérieures à 3 fois par jour, légère fièvre possible, avec une amélioration clinique en 2 à 3 jours après l’arrêt des antibiotiques. Il n’y a pas de glaires ni de sang visibles dans les selles, ni d’aggravation de l’état général.
2/. Des colites pseudomembraneuses :
Les diarrhées sont liquides, profuses mais non sanglantes en général avec une fréquence supérieure à 7 par jour. Elles sont accompagnées de fièvre dans 75% des cas et de douleurs abdominales. Une hyperleucocytose est fréquente avec un syndrome inflammatoire (augmentation sérique de la protéine C réactive). On observera également une déshydratation extracellulaire ainsi qu’une entéropathie exsudative. En procédant à une endoscopie, on décèlera des pseudomembranes sur le colon et le rectum, éparses ou confluentes, en fonction de l’avancée de la maladie. (Figure X). Les lésions sont aphtoïdes jaunâtres formées de débris cellulaires, de fibrine et de leucocytes (13).
`
Figure X : Photographie de colite pseudomembraneuse
De nombreuses complications peuvent survenir telles que l’iléus paralytique, le mégacolon toxique et une perforation colique. Elles représentent les critères d’une hospitalisation en Unité de Soins Intensifs (USI).
Tableau 2 : Différents critères de sévérité de l’ICD (10)
La sévérité des ICD a augmenté en parallèle avec l’augmentation de l’incidence des ICD associée au ribotype 027 dans les années 2000. La définition de la sévérité des ICD a varié au cours des années, en fonction des données de laboratoire, des résultats des examens physiques, des séjours en Unités de Soins Intensifs, des colectomies et/ou de la mortalité. Concernant les colectomies, les taux de colectomie signalés chez les patients hospitalisés atteints d'ICD pendant les périodes d'endémie varient de 0,3% à 1,3%, tandis que pendant les périodes d'épidémie, les taux de colectomie varient de 1,8% à 6,2% (15).
b) Diagnostic biologique
Concernant le diagnostic biologique, les tests seront effectués une seule fois sur les patients ayant des selles diarrhéiques après 3 jours d’hospitalisation. Les échantillons biologiques seront prélevés chez :
• les patients de plus de 2 ans avec diarrhées potentiellement infectieuses (40 à 80% des nourrissons de plus de 6 mois sont porteurs asymptomatiques en dépit de la présence de la toxine)
• les patients de plus de 65 ans
• et ceux de moins de 65 ans chez qui le diagnostic clinique justifie le prélèvement. Une seule coproculture sera réalisée avant traitement de la potentielle ICD, il n’y a pas de test de contrôle car la clairance de la toxine est comprise entre 6 à 10 jours. En effet, la culture est positive chez 56% des patients 1 à 4 semaines après le traitement.
Le diagnostic biologique est découpé en 3 méthodes différentes permettant de mettre en évidence la présence de la bactérie ou de ces toxines : Le test immunoenzymatique, le test de cytotoxicité des selles et la culture (Figure XI).
.
Figure XI : Méthodes de détection dans les selles
La GDH et la culture permettent de rechercher la bactérie C. difficile. Les tests de cytotoxicité, les tests ELISA et la PCR mettent en évidence les toxines produites par C. difficile.
• La recherche de C. difficile
§ GDH : Glutamate DesHydrogenase
Ce test recherche l’enzyme métabolique « Glutamate DesHydrogenase » présente chez tous les ribotypes de C. difficile. C’est un test de dépistage qui possède une forte sensibilité et une bonne Valeur Prédictive Négative (VPN) permettant d’exclure l’infection à C. difficile. Ce test indique la présence de souches de C. difficile mais ne permet pas de les différencier ni de détecter la présence de toxines ou non. Il est utilisé en première intention et est à compléter par d’autres analyses. Le test à la GDH offre un résultat rapide, et est peu coûteux (Figure XII).
Figure XII : Exemple de test de dépistage de la GDH (18)
§ Par culture
L’objectif est de sélectionner en culture les souches de C. difficile potentiellement impliquées dans l’infection. Les selles peuvent être prétraitées par un chauffage ou par un choc à l’alcool afin de diminuer la flore fécale naturelle, surtout lorsqu’un milieu de culture non sélectif est utilisé. L’échantillon est mis en culture pendant minimum 48h en anaérobiose sur un milieu chromogène ou sur des géloses enrichies (base cœur-cervelle, sang de mouton, digestion peptidique de tissu animal, sucres …) pour favoriser la croissance de C. difficile qui est une bactérie exigeante .Les milieux doivent être également sélectifs afin d’éliminer la flore fécale abondante Pour cela, les géloses utilisées contiennent des antibiotiques limitant la pousse des autres bactéries de la flore digestive. Ils sont le plus souvent basés sur l’association CCFA cyclosérine-cefoxitine-fructose agar (18). Les colonies de C. difficile ont un aspect très caractéristique en « cire de bougie », avec une odeur de crottin de cheval. Ces colonies suspectes doivent être identifiées pour affirmer la présence de C. difficile.
• La recherche de toxine
§ Par Dosage immuno-enzymatique (EIA) :
Cette technique permet de détecter la présence des toxines A et B de manière simultanée. Parmi les méthodes EIA, la méthode ELISA (Enzyme-linked Immunosorbent Assay) est la plus utilisée. Cette technique est rapide et peu coûteuse. Sa spécificité est élevée mais la sensibilité est faible.
§ Test de cytotoxicité par culture cellulaire
Ce test détecte directement les toxines de C. difficile sur les échantillons de selles fournis. Lors de la culture cellulaire, on observera des modifications biochimiques, métaboliques et morphologiques sur les cellules (appelé effet cytopathique, ECP). On ajoutera par la suite des anticorps anti-toxines afin de neutraliser cet effet, ce qui confirmera ce test (18). Il permet de détecter la présence de toxines libres dans les selles et donc de déceler ou non une ICD. Néanmoins, ce test n’est pas utilisé en routine, mais plutôt au sein des CNR (Centres Nationaux de Références).
§ Par Polymerase Chain Reaction (PCR)
Ce test moléculaire, disponible depuis 2010 est le test de référence (19). L’’amplification cible les gènes codant les toxines A et B (tcdA et tcdB), ainsi que la toxine binaire (cdtA et cdtB). Cette méthode est très rapide et sensible. Il faut cependant faire attention au sur-diagnostic car il ne donne pas d’information concernant la production in vivo de toxines, et également aux mutations des gènes qui pourraient entrainer des faux négatifs (19).
Actuellement, des algorithmes à deux ou trois étapes sont recommandés, mais non standardisés, afin d’optimiser sensibilité, spécificité, délais et coûts. La Figure XIII propose deux algorithmes différents correspondant aux instances européennes et américaines. Ainsi, le test de GDH est le premier test effectué. S’il est négatif, l’ICD est écartée. S’il est positif, d’autres tests sont alors réalisés afin de confirmer ce dépistage. On peut alors effectuer un test immuno-enzymatique afin de rechercher les toxines de C. difficile, ou une PCR afin de détecter les gènes codant pour les toxines A, B, et la toxine binaire, ou encore un test de cytotoxicité (surtout effectué au CNR).
Figure XIII : Algorithmes recommandés pour le diagnostic des ICD en laboratoire (12)
Une ICD se définit par la clinique, ainsi que la mise en évidence microbiologique de C. difficile toxinogène. Il existe également une méthode de coloration au bleu de méthylène sur prélèvement de selles qui mettent en évidence les leucocytes fécaux, ce qui permet de savoir s’il s’agit d’une diarrhée inflammatoire ou non. Cependant, cette technique ne permet pas d’identifier spécifiquement C. difficile car il peut aussi s’agir d’autres bactéries.
3. TRANSMISSION, PREVENTION DE L’INFECTION
C. difficile se transmet de manière oro-fécale, manuportée : les mains se contaminent via les selles ou via l’environnement des patients infectés, les spores sont alors ingérées par le patient et atteignent l’intestin. Si les individus sains présentent une flore intestinale qui permet d’éviter à C. difficile de proliférer, lorsque l’équilibre de la flore est perturbé, C. difficile peut se multiplier et produire des toxines qui provoquent une infection à C. difficile.
C. difficile se transmet principalement lors d’une hospitalisation, ou dans un établissement de soin, en raison de la forte dissémination autour des patients. En effet, un patient peut acquérir une ICD après 4 jours passés dans la même chambre qu’un patient déjà infecté (20). Des mesures d’hygiène sont par conséquent nécessaires dans les établissements de soin afin d’éviter toute propagation de l’infection, de manière directe ou croisée. Ces mesures comprennent entre autres l’isolement en chambre individuelle du patient, avec ses propres sanitaires, sans possibilité de visites de ses proches, afin d’éviter une contamination des autres patients, ou du personnel.
En effet, via sa forme sporulée, C. difficile résiste à l’acide gastrique, mais aussi aux désinfectants classiques, aux solutions hydro-alcooliques, à la chaleur ainsi qu’à la dessiccation. Le personnel médical ainsi que le patient laveront leurs mains à l’aide d’un savon doux liquide afin d’éliminer les spores, puis, après le séchage, ils frictionneront tout de même leurs mains avec une solution hydro-alcoolique afin d’éliminer toute autre bactérie. Sa résistance et sa très forte dissémination peuvent entrainer des épidémies notamment dans des services à risque tels que la réanimation, les maladies infectieuses, la gériatrie ou encore l’hématologie. De ce fait, dès que le diagnostic d’ICD est positif, les professionnels de santé doivent être prévenus, tout comme le patient, sa famille et ses visiteurs. L’ICD du patient est reportée dans son dossier médical mais aussi sur la porte de sa chambre. Afin de se protéger, et de protéger les autres patients, le personnel médical portera des gants de manière obligatoire, ainsi qu’une sur-blouse à manches longues (jetés avant la sortie de la chambre dans un sac DASRI, lui-même vidé plusieurs fois par jour afin d’éviter le stockage des déchets dans la chambre du patient). Le Réseau national de prévention des affections associées aux soins a par ailleurs publié une fiche de conduite à tenir chez les porteurs de C. difficile en période de diarrhées (Figure XIV).
La période de colonisation initiale par C. difficile et l’émergence de l’infection à C. difficile était estimée à 2 à 3 jours. Cependant, d’après les dernières mises à jour de l’IDSA, la période d’incubation serait plus longue et estimée à plus d’une semaine (15). Lorsqu’au moins 2 patients sont diagnostiqués, et pour les cas sévères, un signalement est adressé à l’ARS.
4. FACTEURS DE RISQUE ET DE RECIDIVES
a) Facteurs de risque
En Février 2020, l’IDSA a publié un article concernant les choix d’antibiotiques prescrits ainsi que leurs durées d’utilisation, par rapport au risque d’ICD (15). L’étude a été menée au Canada, entre 2012 et 2017, sur 82592 patients de 66 ans et plus, dans des maisons de retraite. Cette étude montre que l’usage d’antibiotiques est le premier facteur de risque de développement d’ICD dans les 90 jours suivant la prise.
Tableau 3 : Classification des antibiotiques en fonction de leur implication dans les ICD
En effet, certaines classes d’antibiotiques sont plus à risque telles que les céphalosporines de 2ème et 3ème générations, les fluoroquinolones et la clindamycine (15).
Cependant, peu d’études ont examiné précisément quels antibiotiques au sein de ces classes sont les plus impliqués. Comme nous pouvons l’observer via la Figure XV, lors d’un traitement de 7 jours, les antibiotiques à plus hauts risques étaient la céfixime (céphalosporine de 3ème
génération), la clindamycine (lincosamide), la moxifloxacine (fluoroquinolone), ainsi que l’association amoxicilline-acide clavulanique (pénicilline).
Figure XV : Risque relatif d’ICD au 7ème jour d’antibiothérapie en fonction des antibiotiques utilisés (21)
Concernant les fluoroquinolones, lors d’un traitement de 7 jours, la moxifloxacine engendre plus de risque d’ICD que la ciprofloxacine ou la levofloxacine. Toujours lors d’un traitement de sept jours, la ciprofloxacine engendre 89% de risque en plus que la nitrofurantoine, la moxifloxacine 121% de risque en plus que l’amoxicilline et la clindamycine résulte en 112% de risque en plus que la cloxacilline (21).
Figure XVI : Incidence d’ICD pour 1000 résidents en fonction des traitements antibiotiques utilisés. (21)
Le facteur de risque d’ICD est modifiable en fonction de la molécule utilisée mais aussi du temps d’exposition. Un traitement de 14 jours d’antibiotiques (mono-antibiothérapie) dans les 90 jours précédant le déclenchement de l’ICD est associé à une augmentation de risque d’ICD de 27%. Un traitement de 5 jours engendre 9% de risque en moins d’ICD par rapport à un traitement de 7 jours. Ainsi, chaque jour d’exposition supplémentaire à un antibiotique augmente le risque d’ICD. (Figure XVI) Cependant, comme nous pouvons le constater sur la
Figure XVI, les résultats peuvent être hétérogènes en fonction des antibiotiques. En effet, l’emploi de la nitrofurantoine n’accroit pas le risque de déclencher une ICD de manière considérable, contrairement à l’antibiothérapie par moxifloxacine, pour laquelle le risque d’ICD est très élevé lorsque la durée du traitement est importante (21).
En conclusion, afin de minimiser le risque d’ICD, quand les antibiotiques sont nécessaires, il est préférable que le prescripteur évite les antibiotiques les plus à risque (tels que la céfixime, la clindamycine, la moxifloxacine, l’amoxicilline-acide clavulanique) et traite le moins longtemps possible, lorsque cela est envisageable (21).
D’autres facteurs sont en lien avec le risque d’ICD : traitement par IPP (diminuant l’acidité gastrique), les comorbidités, l’âge > 65 ans, l’hospitalisation de longue durée, ainsi que l’hospitalisation en unités de soins intensifs et l’immunodéficience. Ces différents facteurs et leurs rôles dans l’établissement d’une ICD seront repris plus tard dans le manuscrit. A l’échelle collective, les déplacements des patients infectés dans leur environnement, la résistance des spores sur les surfaces inertes et la promiscuité des patients favorisent la transmission d’ICD.
b) Facteurs de récidives
Une récidive d’ICD est définie comme un épisode symptomatique d’ICD, avec test biologique positif apparaissant 2 à 8 semaines après une première ICD (15). Après un premier épisode d’ICD, 25% des patients feront une récidive dans les quatre semaines suivant le premier épisode. Parmi les patients ayant fait un 2ème épisode d’ICD (donc 1ère récidive), 45 à 65% feront
d’autres récidives. Ainsi, le taux de récidive augmente avec le nombre de récidives (Figure
Figure XVII : Pourcentage de risque de récidives d’ICD en fonction du nombre d’épisodes d’ICD ayant déjà eu lieu (21).
Certaines tranches de population sont plus à risque de récidives que d’autres. C’est le cas des personnes âgées de plus de 65 ans (Figure XVIII). A partir du 5ème jour après le dernier
jour de traitement antibiotique pour l’ICD, les courbes divergent : le nombre de patients de plus de 65 ans n’ayant pas de récidive diminue avec le temps plus fortement que les patients plus jeunes. Les récurrences d’ICD sont plus fréquentes chez les patients âgés.
Ainsi, l’âge (> 65 ans), des antécédents d’ICD, l’utilisation d’IPP, l’utilisation d’antibiothérapies, les comorbidités du patient, la sévérité de l’infection initiale, une hyperleucocytose > 15G/L, ainsi que le type de souche (les souches hypervirulentes telles que la souche BI/NAP1/027) sont des facteurs de risque de récidives.
Les récidives d’ICD sont associées à une augmentation de 33% du risque de mortalité à 180 jours, par rapport aux patients sans récidives (15). Selon une étude menée en Europe en 2008, 22% des patients atteints d’une infection à C. difficile décèdent dans les 3 mois suivant le début de l’infection, dont 2% d’une cause directement liée à l’infection. En France, 4% des patients meurent dans le mois suivant l’infection (14).
PARTIE II :
LE MICROBIOTE
INTESTINAL
II. LE MICROBIOTE INTESTINAL
A.
HISTOIRE DU MICROBIOTE
On peut estimer que les prémices de la microbiologie remontent à l’Antiquité. En Égypte ancienne, on décrivait les maladies comme dues à des pathogènes invisibles, que l’on imaginait dans l’air, dans l’eau mais aussi à l’intérieur du corps. Hippocrate, au IVème siècle avant JC, considéré comme le père de la médecine, invente le terme de « miasmes », du grec ancien μίασμα : « pollution » (22). Au IIIème siècle avant JC, on évoque pour la première fois le terme de « contagion » dans un recueil de questions/réponses en partie rédigé par Aristote, en Grèce.
La théorie de la purgation, du latin « purgo, are » nettoyer et du grec « emes » : je vomis est également répandu dès la Grèce Antique. Elle est aussi appelée « catharsis » du grec κάθαρσις « purification, séparation du bon avec le mauvais ». Les Hommes étaient traités par des lavements ou à l’aide de vomitifs. D’abord employée pour des motifs religieux à des fins de purification de l’âme, notamment pour Platon, la purgation permet de séparer l’âme de l’ignorance ; elle est ensuite utilisée par Aristote dans le cadre de la théorie des humeurs.(23) En effet, selon Aristote, Hippocrate et Galien, l’état de santé est dépendant de quatre humeurs (sang, pituite, bile jaune, atrabile), elles-mêmes dérivées des quatre éléments (feu, air, terre, eau). Une bonne santé est synonyme d’équilibre entre ces humeurs. Si un patient est malade, c’est probablement qu’une des humeurs est présente en trop grande et qu’elle doit être évacuée : c’est le principe de la purge. (24) Cette théorie de la purge sera présente jusqu’au XIXème siècle. A partir du XVIème siècle, grâce aux autopsies, on comprend que la présence des vers intestinaux n’est pas une conséquence hasardeuse de la maladie, mais peut plutôt en être la cause. Ainsi, depuis l’Antiquité, les intestins sont au centre des pathologies et de leurs traitements (25).
En 1683, Antoine Van Leeuwenhoeck utilise le microscope, inventé un siècle plus tôt, afin d’observer le monde qui l’entoure. Il découvre alors des microorganismes qu’il nomme « animalicules ». Il faudra cependant attendre le XIXème siècle et notamment 1860 avant de trouver une trace du concept de symbiose dans l’histoire. C’est P.J Van Beneden qui rompt la pensée unique du parasitisme. Il évoque le terme de « commensal » qui signifie littéralement en latin « compagnon de table » et établit qu’une espèce peut être aussi bien commensale qu’en symbiose avec une autre. En 1879, Anton de Bary propose pour la première fois le terme de
« symbiose », en se basant sur le principe du vivre ensemble. On retrouvera les termes « parasitisme », « symbiose, et « commensale » dans les annales de l’institut Pasteur à la fin du XIXème siècle.
Le terme « microbe » est également inventé à cette époque, et désigne les espèces observables grâce au microscope. Puis, on observe pour la première fois les notions de levures et de bactéries. En 1857, Louis Pasteur découvre la fermentation lactique avec le lait aigri, puis Lister isole Bactericum lactis dans le lait fermenté. Les prémices de la microbiologie s’intéressent alors principalement aux processus de fermentation. En 1882, un médecin allemand R.Koch, découvre la bactérie responsable de la tuberculose : Mycobacterium tuberculosis, celle-ci est alors nommée Bacille de Koch. Au XIXème siècle, il s’intéresse à la causalité entre une bactérie et la maladie qu’elle engendre. Selon lui, la présence d’une bactérie chez un Homme ne suffit pas à la rendre responsable d’une pathologie donnée (26). En 1890, il rédige alors les Postulats de Koch, et établit des critères permettant de déterminer si un micro-organisme est ou non responsable d’une maladie :
• Le micro-organisme doit être présent en abondance dans tous les organismes souffrant de la maladie, mais absent des organismes sains.
• Ce micro-organisme doit pouvoir être isolé et croître en milieu de culture pur (ne
contenant que ce seul microbe).
• Le micro-organisme cultivé doit déclencher la même maladie chez un animal de laboratoire sensible.
• Le micro-organisme doit être à nouveau isolé du nouvel organisme hôte rendu malade puis identifié comme étant identique à l'agent infectieux original (27).
Ces derniers ont néanmoins montré certaines limites, comme par exemple le fait que certains microorganismes ne poussent pas en culture, ou encore qu’il n’existe pas de modèle animal.
Le XIXème siècle marque un tournant dans l’histoire, avec l’essor de la flore intestinale aujourd’hui appelé microbiote intestinal. En 1885, T. Escherich décrit Bactericum coli communior qui deviendra Eschericha coli, du nom du scientifique l’ayant mise en exergue, et découvre les effets bénéfiques que cette bactérie peut avoir dans la digestion. Puis H. Tissier, de l’Institut Pasteur, découvre l’omniprésence des Bifidobactéries dans les intestins des enfants allaités, par rapport à ceux nourris via du lait artificiel. Il observe que les enfants ayant beaucoup de Bifidobactéries (ceux allaités au sein maternel) souffrent moins de diarrhées que les autres.
Il en déduit le rôle protecteur des Bifidobactéries dans les diarrhées infantiles. Tissier décrit aussi des différences au niveau de la flore intestinale en fonction des différents régimes alimentaires des individus.
De son côté, E. Metchnikoff, zoologue et prix Nobel de physiologie et de médecine en 1883 reste le précurseur du microbiote. Après des travaux sur le Choléra, il observe que certains patients (dont lui-même) se portent bien après l’inoculation du Vibrio Cholerae et que d’autres non. Il attribue ses différences de réactions aux microbes intestinaux, et introduit la notion de « flore favorisante » et de « flore empêchante ». Dans ses travaux à l’institut Pasteur, on peut constater ses études sur les intestins de scorpions, de lapins, ou encore de roussettes. Il intervient également dans la découverte du Bacille bulgare dans le lait fermenté et l’associe à une bonne santé. Pour lui, les populations consommatrices régulières de ces laits fermentés sont en meilleures santé, et il attribue cet état aux bactéries présentes dans ces laits fermentés.
Ainsi, aujourd’hui, le microbiote, représente l’ensemble des bactéries, virus, et levures vivant dans un milieu déterminé (28). Chaque microbiote diffère en termes de composition avec certaines particularités des microorganismes qui le compose. Il existe différents microbiotes associés à l’Homme : le microbiote intestinal, le microbiote vaginal, le microbiote cutané, le microbiote buccal, le microbiote pulmonaire… Dans ce travail de thèse, nous aborderons principalement le microbiote intestinal, et les bactéries qui le composent.
On estime que le microbiote intestinal est composé de plus de 3 millions de gènes, et de 500 espèces anaérobies différentes (29). Un individu de taille moyenne détiendrait alors 2 kgs de son poids en bactéries intestinales, soit plus que son cerveau (30). En 2008, une étude menée par l’INRA : MétaHit, utilise les méthodes de séquençage de pointe sur les échantillons de selles de 124 personnes, afin de déterminer les liens entre les gènes bactériens et la santé humaine. L’objectif est d’identifier l’ensemble des génomes microbiens intestinaux. Cette étude a permis de mettre en évidence 540 Go de séquence d’ADN microbien, ce qui correspond à 200 génomes humains ; ainsi que 3,3 millions de gènes différents, soit 150 fois plus que notre propre génome. Une personne est donc en moyenne porteuse de plus de 540 000 gènes microbiens et 40% des gènes trouvés dans un individu seront retrouvés dans la moitié de la population (31). MétaHit a permis de révéler pour la première fois la richesse de notre microbiote intestinal, et de comprendre la notion de microbiote altéré, par exemple lors de traitements ou de maladies, grâce à une trame découverte de microbiote sain (30).
B.
MÉTHODES D’ÉTUDE
La culture bactérienne est la méthode la plus ancienne d’analyse du microbiote intestinal. Longtemps désignée comme méthode de référence, la culture bactérienne ne l’est aujourd’hui plus. En effet, 80% des bactéries présentent dans notre tube digestif ne sont pas cultivables in vitro via les méthodes de culture standards. Cette approche a permis de mettre en évidence les espèces dominantes.
La culture est encore utilisée en routine dans les établissements hospitaliers, sur prélèvements de selles non invasifs, pour évaluer l’impact d’antibiothérapies, mais cela reste long et fastidieux. Cependant, depuis quelques années, la culture de microorganismes connait un essor nouveau. En effet, de nouvelles méthodes sont apparues (milieux enrichis, anaérobiose, etc…) permettant la mise en culture de ces bactéries non cultivables, dites exigeantes. De plus, l’avènement d’une méthode de spectrométrie de masse de type MALDI-TOF (Matrix Assisted Laser Desorption Ionisation/Time Of Flight) a permis de simplifier l’identification des espèces en un temps restreint et de manière moins coûteuse (32). C’est ainsi qu’est née la « culturonomics » qui combine la culture microbienne avec utilisation de milieux spécifiques (milieux nutritifs adaptés, antibiotiques ciblés sur les espèces dominantes, afin de sélectionner les minoritaires…), et l’utilisation de MALDI-TOF (29).
Depuis la fin du XXème siècle, de nouvelles techniques sont apparues : ce sont les méthodes d’analyse moléculaire, basées sur le séquençage de l’ARN 16S. Le gène codant pour la petite sous-unité 16 de l’Acide RiboNucléique Ribosomal (ARNr 16S) est utilisé du fait de sa structure, très conservée chez toutes les bactéries. L’ARN ribosomique 16S est constitué d’approximativement 1500 nucléotides, de 9 régions hypervariables selon les différentes espèces bactériennes, séparées par des régions conservées entre les espèces (Figure XIX).
Le principe de la PCR quantitative est d’amplifier le gène de l’ARNr16S in vitro, avec des amorces spécifiques, de façon à ce qu’il soit ensuite révélé, séquencé, quantifié et comparé à des séquences disponibles dans des banques de données, aujourd’hui extrêmement développées (33). C’est notamment le projet MetaHit, qui, en utilisant ces techniques, a permis de constituer une base de données constituées des gènes du métagénome intestinal. Ces techniques permettent une augmentation de la sensibilité et un gain de temps (34).
Ces méthodes présentent cependant des biais et limites à ne pas négliger, comme par exemple le choix des amorces, qui rend les résultats peu reproductibles au sein d’un même laboratoire, ou encore le biais de profondeur. En effet, les espèces présentes à des concentrations inférieures à 10# ou 10$ bactéries/gramme de selles ne sont pas détectées par l’analyse métagénomique. Or, les espèces pathogènes telles que Salmonella typhi ou Yersinia enterocolitica sont présentes en très faibles concentrations (32). De même, les bactéries sont détectées sans que l’on puisse savoir si elles sont viables ou non viables (35). Ainsi, les méthodes moléculaires et la culturonomics sont complémentaires.
C.
COMPOSITION DU MICROBIOTE INTESTINAL
Le microbiote intestinal est principalement composé de 4 phyla (Figure XX): • Firmicutes : Lactobacilles et Entérobactéries productrices de butyrate
• Bactéroidetes : ce phyllum a la capacité de dégrader les glycanes complexes. La majorité des microbiotes intestinaux sont en majorité composés de Bactéroides.
• Actinobacteria : ce phylum comprend les Bifidobactéries.
• Proteobactéria : ce phylum comprend les Escherichia, ainsi que les Akkermansia qui dégradant les mucines
D’autres phyla sont également présents : Cyanobacteria, Eusobacteria, Lentisphaera, Spirochaetes, Euryarchaeota…(34) Les phyla Firmicutes et Bactéroidetes sont les plus présents : les Firmicutes représentes 60 à 75% du microbiote intestinal et les Bactéroidetes 30 à 40% (36).
Figure XX : Les différents phyla du microbiote intestinal chez l’adulte (37)
Le microbiote intestinal est le plus important des microbiotes d’un point de vue quantitatif (environ 10%&bactéries : soit cent mille milliards de bactéries) et est composé majoritairement de bactéries anaérobies présentes dans le colon (Figure XXI). Le gradient d’oxygène présent le long du tractus intestinal s’accompagne d’un gradient de pH. Ainsi, les 10%& bactéries du microbiote intestinal sont réparties comme tel :
• 10+ bactéries/mL entre l’estomac et le duodénum. Avec un pH compris entre 2 et 5, se trouve avec principalement Helicobacter mais aussi Streptococcus, Lactobacillus, Prevotella, Enteroccocus.
• 10&à 10- bactéries/mL entre le jéjunum et l’iléum. Avec un pH compris entre 7 et 9 sont principalement recensés des Streptococcus, Lactobacillus, Prevotella, Enteroccocus au niveau du Jéjunum, ainsi qu’au niveau de l’Ileum mais avec l’apparition des Entérobactéries.
• 10%%à 10%. bactéries/mL dans le colon avec un pH compris entre 5 et 7. Cette zone anaérobie présente une diversité importante de population avec 500 à 1000 espèces différentes dénombrées (35).
Figure XXI : Répartition des bactéries composant le microbiote intestinal (30)
Les études de métagénomiques ont permis de diviser la population en trois principaux groupes en fonction de leurs microbiotes intestinaux, appelés entérotypes (38). (Figure XXII)
Chaque entérotype correspond à un agencement d’espèces dominées par trois différents genres bactériens : Bacteroides, Prevotella, Ruminococcus. Si un microbiote intestinal est dominé par des espèces du genre Bacteroides, alors on qualifiera l’individu qui possède ce microbiote intestinal « entérotype Bacteroides », il en est de même pour Ruminococcus et Prevotella.
• Bactéroides
Le genre Bactéroides est responsable de la synthèse de la biotine ( vitamine B8), elle-même impliquée dans le système nerveux (40).
Les individus possédant majoritairement le genre Bactéroides, ont une alimentation basée sur les Protéines et les graisses d’origine animale, une alimentation carnée. Il s’agit de l’entérotype retrouvé chez les personnes au régime alimentaire occidental, et il est associé une faible richesse du microbiote intestinal.
• Prevotella
Prévotella est associé aux bactéries Désulfovibrionales qui produisent des composés soufrés et de la thiamine (vitamine B1). Les individus à l’entérotype «Prévotella » consomment plus de glucides présents dans les fruits, les légumes et le sucre. Le genre Prévotella est par conséquent le genre le plus fréquemment rencontré chez les individus au régime alimentaire végétarien. Les individus à entérotype Prevotella ont de manière globale une grande richesse dans leur microbiote intestinal (40).
• Ruminococcus
Les individus à entérotype « Ruminococcus » consomment plus d’alcool, et de graisses d’origine végétale (39). Cet entérotype est aussi associé à une grande richesse du microbiote intestinal.
A l’heure actuelle, l’analyse du microbiote intestinal de la population n’est pas permise en routine, mais les liens possibles entre entérotypes et santé sont étudiés en recherche, afin de déterminer si la réponse à certains traitements ne serait pas plus efficace en fonction des entérotypes. Des changements nutritionnels, comme une augmentation de la quantité de fibres ingérées, peuvent modifier l’entérotype d’un individu (38). On ne peut donc pas parler de « microbiote normal », puisqu’il existe plusieurs types de microbiotes différents en fonction