Déterminants génétiques de la variabilité des triglycérides
plasmatiques en réponse à une supplémentation en acides
gras oméga-3 d’origine marine
Mémoire
Bastien Vallée Marcotte
Maîtrise en nutrition
Maître ès sciences (M.Sc.)
Québec, Canada
Déterminants génétiques de la variabilité des triglycérides
plasmatiques en réponse à une supplémentation en acides
gras oméga-3 d’origine marine
Mémoire
Bastien Vallée Marcotte
Sous la direction de
III
RÉSUMÉ
Il est reconnu que la consommation d’acides gras (AG) oméga-3 (n-3) d’origine marine est bénéfique pour la prévention des maladies cardiovasculaires (MCV), notamment en raison de leurs effets hypotriglycéridémiants. Toutefois, il existe une importante hétérogénéité dans la réponse des triglycérides (TG) plasmatiques à une supplémentation en AG n-3 et ce phénomène est en partie attribuable à des facteurs génétiques. Notre groupe de recherche a récemment réalisé une étude d’association à l’échelle du génome (GWAS) sur les participants de l’étude
Fatty Acid Sensor (FAS), qui a permis d’identifier plusieurs loci associés à la réponse des TG
suite à une supplémentation de 3g d’AG n-3 par jour. La plupart de ces loci sont localisés dans les gènes IQCJ, NXPH1, PHF17 et MYB. Des effets du génotype ainsi que des interactions gène-diète ont été observés avec plusieurs polymorphismes nucléotidiques simples (SNPs) des quatre gènes candidats. Ces résultats suggèrent que des variations génétiques à l’intérieur de gènes identifiés par GWAS peuvent expliquer en partie la variabilité de la réponse des TG plasmatiques à une supplémentation en AG n-3 d’origine marine.
IV
ABSTRACT
It is known that omega-3 (n-3) fatty acids (FA) from marine sources are beneficial in cardiovascular disease (CVD) prevention, among others because of their hypotriglyceridemic effect. However, there is an important heterogeneity in the plasma triglyceride (TG) response to an n-3 FA supplementation, which is partly attributable to genetic factors. Our research group recently conducted a genome-wide association study (GWAS) on participants of the Fatty Acid
Sensor (FAS) study and identified several loci associated with the plasma TG response to an
n-3 FA supplementation of n-3g per day. Most of these loci are located in IQCJ, NXPH1, PHF17 and MYB. Genotype effects on TG levels and gene-diet interactions were observed with several single nucleotide polymorphisms (SNPs) within candidate genes. These results suggest that genetic variations within genes previously identified by GWAS may therefore partly explain the large inter-individual variability in the plasma TG response to an n-3 fatty acid supplementation.
V
TABLE DES MATIERES
Résumé ... III Abstract ... IV Table des matières ... V Liste des tableaux ... VII Liste des abbréviations et sigles ... VIII Avant-propos ... X
Introduction ... 1
Chapitre 1 : Problématique ... 3
1. Les maladies cardiovasculaires ... 3
1.1 Les catégories de maladies cardiovasculaires ... 3
1.2 Facteurs de risque ... 3
2. Les triglycérides ... 6
1.1 Digestion et métabolisme des triglycérides ... 6
1.2 Triglycérides et maladies cardiovasculaires ... 7
1.3 Étiologie de l’hypertriglycéridémie ... 8
1.4 Traitement de l’hypertriglycéridémie ... 9
3. Les acides gras oméga-3 ... 11
2.1 Définition et structure des acides gras oméga-3 ... 11
2.2 Sources d’acides gras oméga-3 ... 12
2.3 Recommandations ... 12
2.4 Rôles physiologiques ... 13
2.5 Mécanismes d’action ... 14
4. La génétique ... 17
4.1 Définitions ... 17
4.2 Génétique, triglycérides et acides gras oméga-3 ... 19
5. Objectifs... 23 5.1 Objectif général ... 23 5.2 Objectifs spécifiques ... 23 6. Hypothèses... 24 6.1 Hypothèse générale ... 24 6.2 Hypothèses spécifiques ... 24
VI 7. Méthodologie ... 25 7.1 Population à l’étude ... 25 7.2 Protocole ... 25 7.3 Mesures en laboratoire ... 26 7.4 Analyses statistiques ... 26
Chapitre 2 : Déterminants génétiques de la variabilité des triglycérides plasmatiques en réponse à une supplémentation en acides gras oméga-3 d’origine marine ... 28
Chapitre 3 : Discussion générale et conclusion ... 52
VII
LISTE DES TABLEAUX
C
HAPITRE1
Tableau 1. Définitions de l’hypertriglycéridémie ... 7 Tableau 2. Efficacité des traitements hypotriglycéridémiants ... 11 Tableau 3. Apports nutritionnels de référence relatifs aux AG n-3 (ALA) ... 13
C
HAPITRE2
Table 1. Selected polymorphisms in candidate genes from the GWAS of the FAS study (n = 208 individuals) ... 47 Table 2. Characteristics of the study sample before and after supplementation (n = 208
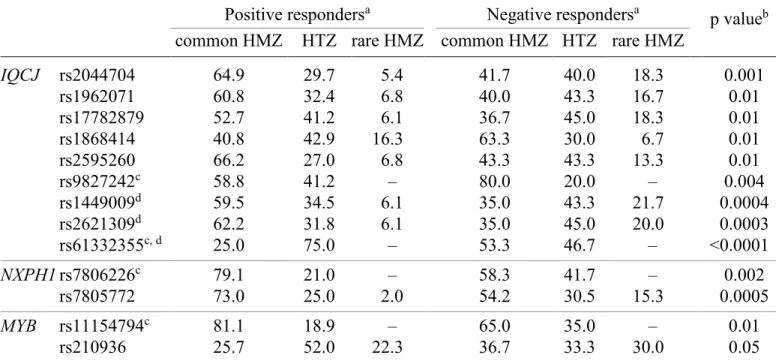
individuals) ... 49 Table 3. Plasma TG levels before and after a 6-week n-3 FA supplementation according to genotype for tagged SNPs with a marginal or significant effect of genotype or gene-diet interaction (n = 208 individuals) ... 50 Table 4. Significant differences in genotype frequency distribution between positive and negative responders to the n-3 FA supplementation according to genotype for tagged SNPs (n = 208 individuals)... 51
VIII
LISTE DES ABBRÉVIATIONS ET SIGLES
AA : Acide arachidonique ADH/DHA : Acide docosahexaénoïque ADN : Acide désoxyribonucléique AEP/EPA : Acide eicosapentaénoïque AG : Acide gras
ALA : Acide α-linolénique
AMT : Apports maximaux tolérables Apo : Apolipoprotéine
ARN : Acide ribonucléique AS : Apports suffisants
AVC : Accident vasculaire cérébral COX : Cyclo-oxygénase
CRP : Protéine C-réactive CVD : Cardiovascular disease
ÉVAM : Étendue des valeurs acceptables pour les macronutriments FA : Fatty acid
FAS : Fatty Acid Sensor
FFA4 : Free fatty acid receptor 4
FINGEN :Fish Oil Intervention and Genotype Study
GOLDN :Genetics of Lipid Lowering Drugs and Diet Network
GPA : Glycérol-3-phosphate acyltransférase
GPR : Récepteurs membranaires couplés aux protéines G GWAS : Étude d’association à l’échelle du génome
HAT : Histone acyltransferase HDL : Lipoprotéine de haute densité IKK-β : IκB kinase β
IL-6 : Interleukine-6
IMC : Indice de masse corporelle
INAF : Institut sur la nutrition et les aliments fonctionnels
IQCJ : IQ motif containing J LD : Déséquilibre de liaison LDL : Lipoprotéine de faible densité
IX
LPL : Lipoprotéine lipase MCV : Maladie cardiovasculaire
MYB : Avian myeloblastosis viral oncogene homolog n-3 : Oméga-3
n-6 : Oméga-6
NFκB : Facteur nucléaire κB
NXPH1 : Neurexophilin-1
PHF17 : Finger protein 17
PPAR : Proliférateurs de peroxysomes
SCHIP1 : Schwannomin interacting protein 1 SNAP : SNP annotation and Proxy Search
SNP : Polymorphisme nucléotidique simple/single nucleotide polymorphism TG : Triglycéride
TiGER : Tissue-specific Gene Expression and Regulation TNF-α : Facteur de nécrose tumorale α
TRAP : Transcription factor Affinity Prediction VLDL : Lipoprotéine de très faible densité
X
AVANT-PROPOS
Dès mon entrée au baccalauréat en nutrition, j’ai su que je voudrais poursuivre à la maitrise. J’ai eu la chance, au cours de mes études de premier cycle, de rencontrer plusieurs grands noms de la recherche en nutrition. Parmi tous les domaines d’étude couverts par l’Institut sur la nutrition et les aliments fonctionnels (INAF), ce sont les travaux de la Dre Marie-Claude Vohl qui m’ont le plus intéressé, ceux-ci portant sur la nutrigénomique.
Dans mon projet de maitrise, je me suis intéressé aux facteurs génétiques responsables de l’hétérogénéité de la réponse des triglycérides plasmatiques suite à une supplémentation en acides gras oméga-3 d’origine marine. Ce projet a mené à la publication d’un article scientifique intitulé Novel Genetic Loci Associated with the Plasma Triglyceride Response to an Omega-3
Fatty Acid Supplementation dans le Journal of Nutrigenetics and Nutrigenomics, en mai 2016.
Tout au long de ma formation, j’ai pu élargir mon champ de connaissances en recherche sur la nutrition et la génétique en contribuant au génotypage en laboratoire, à la réalisation d’analyses statistiques, à la rédaction de manuscrits et à la présentation de travaux de recherche en congrès. J’ai pu bénéficier, au cours de ma maitrise, des appuis financiers de la fondation Initia et de Guelph Food Technology Center. Je tiens d’ailleurs grandement à remercier les donateurs pour m’avoir permis de réaliser ce projet en plus de présenter mes résultats de recherche dans divers congrès scientifiques à travers la province.
Je tiens également à souligner la grande générosité, la présence et le soutien de ma directrice de maitrise, Marie-Claude Vohl, qui m’a accordé sa confiance et m’a accueilli à bras ouverts au sein de son groupe de recherche. Je t’en suis énormément reconnaissant. De plus, pour leur très précieuse aide au cours de la dernière année et demie, je remercie chacun des membres de notre équipe, à commencer par Hubert Cormier, qui a su me guider à travers mon parcours, Bénédicte L Tremblay, Stéphanie Bégin, Bénédicte Allam-Ndoul, Juan de Toro Martin, Catherine Raymond, Alain Houde et Frédéric Guénard, l’homme de la situation dans toutes les situations.
Je dois dire aussi que ces accomplissements n’auraient été possibles sans le soutien de mon entourage. Merci d’abord à mes parents, Gilbert et Louise, à mon frère Jasmin, à ma dulcinée Michèle, à mon cousin Vincent et à mon chien Goethe de m’avoir supporté depuis le début et même avant. Un merci spécial à mes amis pour m’avoir soutenu tout au long de mon parcours, même s’ils m’ont plus souvent empêché d’étudier que l’inverse. Finalement, un gros merci à
XI
tous les étudiants de l’INAF, sans qui mes études aux cycles supérieurs n’auraient jamais été aussi agréables.
1
INTRODUCTION
Les maladies cardiovasculaires (MCV) représentent la deuxième principale cause de mortalité au Canada [1]. Celles-ci sont notamment causées par des facteurs environnementaux et génétiques [2]. Parmi les facteurs environnementaux, on retrouve entre autres l’alimentation. Celle-ci est l’un des facteurs de risque modifiables de MCV les plus importants, c’est pourquoi des organisations de santé ont émis des recommandations nutritionnelles afin de prévenir l’incidence de MCV [3].
En ce sens, plusieurs recommandent la consommation d’acides gras (AG) oméga-3 (n-3) en raison de leurs effets bénéfiques reconnus sur la santé cardiovasculaire [4,5]. Toutefois, les recommandations nutritionnelles actuelles ne tiennent pas compte des différences entre les individus qui affectent leur réponse physiologique aux nutriments, dont aux AG n-3 [6]. Cet effet de variabilité interindividuelle est pourtant bien documenté dans la littérature [6]. Il est admis que la consommation d’AG n-3 permet d’augmenter la réactivité vasculaire, de diminuer l’agrégation plaquettaire, la pression sanguine, l’inflammation et les niveaux de triglycérides (TG) plasmatiques [7]. Cependant, la réponse des TG plasmatiques aux AG n-3 peut considérablement varier d’une personne à l’autre [8,9]. Cela a été observé dans plusieurs études, dont l’étude européenne Fish Oil Intervention and Genotype (FINGEN), où 31% des participants n’ont pas diminué leurs niveaux de TG après avoir reçu une supplémentation de 1,8g d’AG n-3 par jour pendant 8 semaines [8]. Notre groupe de recherche a rapporté des observations semblables avec les participants de l’étude Fatty Acid Sensors (FAS), où 29% des sujets qui avaient reçu un supplément de 3g d’AG n-3 par jour comprenant 1,9-2,2g d’acide eicosapentaénoïque (AEP) et 1,1 g d’acide docosahexaénoïque (ADH) pendant 6 semaines n’ont pas eu de réduction de leurs niveaux de TG [9].
Ce phénomène est en partie causé par des facteurs génétiques [10]. C’est pourquoi plusieurs gènes associés au métabolisme des lipides, tels que l’apolipoprotéine E (APOE) et le
proliférateur de peroxysome α (PPAR-α), et leur relation avec les niveaux de TG en réponse à
une supplémentation en AG n-3 ont été étudiés à travers le monde [10-14]. Cependant, ces deux gènes n’expliquent qu’une faible proportion de la variance et il est probable qu’il existe d’autres variations génétiques en cause.
Notre équipe de recherche a donc conduit une étude d’association à l’échelle du génome (GWAS) sur les participants de l’étude FAS afin d’examiner les différences au niveau des
2
fréquences alléliques entre les répondeurs positifs, soit les participants dont les TG diminuaient avec la supplémentation, et les répondeurs négatifs, soit les participants chez qui la supplémentation n’avait pas d’effets sur les TG ou les faisait augmenter [15]. Le GWAS a permis d’identifier 13 loci associés à la réponse des TG. Un calcul de score de risque génétique à partir de ces loci expliquait 21,53% de la variance des TG [15]. La majorité de ces loci sont situés dans les gènes IQ motif containing J (IQCJ), neurexophilin-1 (NXPH1), PHD finger
protein 17 (PHF17) et V-MYB avian myeloblastosis viral oncogene homolog (MYB) [15]. Le
présent projet porte donc sur l’effet de ces gènes candidats identifiés par GWAS sur les niveaux de TG plasmatiques en réponse à une supplémentation en AG n-3 d’origine marine.
Ce mémoire est séparé en trois chapitres. Le premier aborde la problématique de mon projet de maitrise en passant par les quatre thèmes qui y sont associés, soit les MCV, les TG, les AG n-3 et la génétique. Les objectifs, les hypothèses et la méthodologie du projet sont également détaillés dans ce chapitre. Le second présente l’article scientifique intitulé Novel Genetic Loci
Associated with the Plasma Triglyceride Response to an Omega-3 Fatty Acid Supplementation,
qui a été publié dans le Journal of Nutrigenetics and Nutrigenomics. Le troisième et dernier chapitre consiste en une discussion générale des résultats et une conclusion du projet.
3
CHAPITRE 1 : PROBLÉMATIQUE
1.
L
ES MALADIES CARDIOVASCULAIRES1.1 Les catégories de maladies cardiovasculaires
Les MCV représentent l’ensemble des maladies affectant le cœur ainsi que les vaisseaux sanguins. On peut classer l’ensemble des MCV en six catégories [16]. La première, qui est la plus fréquente, est la cardiopathie ischémique [16]. Celle-ci est caractérisée par un défaut d’irrigation au myocarde, par exemple, en présence d’un thrombus [16]. La cardiopathie ischémique est le type de MCV qui sera principalement discuté dans le cadre de ce mémoire. L’angine de poitrine ou l’infarctus du myocarde sont des exemples de cardiopathie ischémique [17]. La deuxième catégorie est la maladie cérébrovasculaire, qui résulte aussi d’un manque d’irrigation mais, cette fois-ci, au cerveau [16]. Les accidents vasculaires cérébraux (AVC) font partie de cette catégorie [16]. Le troisième type est la maladie vasculaire périphérique, qui représente un manque d’irrigation aux extrémités, particulièrement au niveau des jambes [16]. L’insuffisance cardiaque constitue le quatrième type de MCV [16]. Celui-ci survient lorsque le cœur est incapable de fournir un débit sanguin suffisant pour répondre aux besoins de l’organisme. Cette condition peut découler d’une autre MCV, comme d’un infarctus [16]. Le cinquième type de MCV est le rhumatisme cardiaque [16]. Cette affection, principalement répandue dans les pays en voie de développement, est causée par une infection à la bactérie streptocoque du groupe A et cause des dommages à long terme aux valvules cardiaques [16-18]. La sixième et dernière catégorie est la cardiopathie congénitale, qui se traduit par une dysfonction cardiaque présente à la naissance [16]. Les MCV ne se développent pas toutes sous les mêmes conditions et ont des étiologies multifactorielles [19].
1.2 Facteurs de risque
Les facteurs de risque de MCV peuvent être modifiables ou non. Ils sont dits modifiables s’il est possible d’en exercer un certain contrôle afin de prévenir l’apparition de MCV [3]. Les facteurs de risque modifiables comprennent le tabagisme, l’alimentation, la sédentarité, le stress, certaines conditions métaboliques et autres [3]. Parmi les facteurs de risque non modifiables, on retrouve l’âge, le sexe et les antécédents familiaux de MCV [3,20].
4
Le risque d’évènement cardiovasculaire augmente avec l’âge [3]. Avec le temps, le muscle cardiaque subit divers changements physiologiques et finit par perdre de la puissance [3]. L’âge constitue un facteur de risque indépendant du développement de l’athérosclérose [21]. L’athérosclérose peut mener à plusieurs complications cardiovasculaires sévères, comme l’AVC, l’infarctus du myocarde ou l’insuffisance cardiaque ischémique [21]. De plus, les niveaux d’homocystéine plasmatiques augmentent avec le vieillissement et une homocystéinémie élevée est associée à un risque accru de MCV [22].
Le sexe
Il a été démontré que les femmes en âge de procréer ont un risque cardiovasculaire moindre par rapport aux hommes et que le taux de mortalité associé aux MCV est plus élevé chez ces derniers par rapport aux femmes [3,23]. Cela est en partie attribuable aux différences hormonales [24]. En effet, les hormones féminines offrent une certaine protection cependant, lorsque les femmes atteignent la ménopause, le risque devient similaire entre les deux sexes [3].
Les antécédents familiaux
Les individus qui ont des antécédents familiaux de MCV sont plus susceptibles d’en souffrir au cours de leur vie [25]. Le risque est d’autant plus élevé s’il s’agit de la famille directe qui est touchée [3]. Il est à noter que, bien que les antécédents familiaux reflètent la prédisposition génétique de l’individu, ils peuvent aussi refléter des habitudes de vie qui sont communes aux membres d’une même famille. Les habitudes de vie, quant à elles, font partie des facteurs de risque modifiables.
Le tabagisme
Les impacts négatifs du tabagisme sur la santé cardiovasculaire sont nombreux et bien répertoriés. On note entre autres une diminution de la sensibilité à l’insuline, des dysfonctionnements vasculaires, une exacerbation du bilan lipidique, une augmentation des marqueurs inflammatoires et d’hormones antagonistes à l’insuline, etc. [22,26]
L’alimentation
Il est reconnu qu’une consommation insuffisante ou excessive de certains nutriments peut augmenter le risque de développer des MCV. Par exemple, le fait de consommer trop de sodium, de sucres raffinés, d’alcool ou d’acides gras trans industriels peut accroitre le risque
5
[27,28]. Des apports insuffisants en fibres, vitamines et minéraux peuvent avoir des impacts négatifs sur la santé du cœur [27,29]. De nombreux autres effets de l’alimentation sur le système cardiovasculaire existent et beaucoup d’entre eux sont encore mal compris, c’est pourquoi la nutrition demeure un domaine très étudié de nos jours.
La sédentarité
La pratique régulière d’activité physique est associée à un risque plus faible de mortalité et de morbidité cardiovasculaires [30]. L’activité physique affecte plusieurs facteurs de risque de MCV, comme l’indice de masse corporelle (IMC), la sensibilité à l’insuline, le bilan lipidique, la tension artérielle, etc. [22] L’activité physique permet aussi de réduire le stress, l’anxiété, le risque d’ostéoporose, de cancer et de dépression [31-33].
Le stress
Plusieurs formes de stress peuvent affecter le risque de MCV [34]. Le stress chronique peut engendrer notamment des cardiopathies, augmenter les taux de cholestérol sanguin, la tension artérielle, les niveaux de cortisol et altérer le rythme cardiaque [27,35,36]. Il peut aussi avoir un impact négatif sur le contrôle de la glycémie chez les individus diabétiques [27,35]. En outre, un stress émotionnel à court terme peut déclencher un évènement cardiovasculaire chez une personne atteinte d’athérosclérose avancée [37].
Conditions métaboliques
Certaines conditions de santé augmentent le risque d’évènement cardiovasculaire. Les individus souffrant par exemple de diabète, d’hypertension artérielle, d’obésité, de dyslipidémie ou de syndrome métabolique voient leur risque augmenté [20]. Ces conditions métaboliques sont modulées par les facteurs de risque modifiables et non modifiables de MCV [20].
Les autres facteurs de risque
Bon nombre de groupes de recherche s’intéressent de plus en plus à certains «nouveaux» facteurs de risque autres que les facteurs traditionnels décrits ci-dessus. Ceux-ci sont nombreux et comprennent les niveaux sanguins de protéine C-réactive (CRP), de phospholipase A2 associée aux lipoprotéines, de fibrinogène, d’interleukine-6 (IL-6), d’homocystéine et de plusieurs autres [20,22].
6
2.
L
ES TRIGLYCÉRIDES1.1 Digestion et métabolisme des triglycérides
Les TG sont composés de trois acides gras estérifiés à une molécule de glycérol [38]. Les apports de TG peuvent provenir de sources exogènes, soit de l’alimentation, ou de sources endogènes.
Voie exogène
Les TG composent la majorité des lipides alimentaires, soit de 90 à 95% [39]. Dans le système digestif, les lipides sont d’abord émulsifiés par les acides biliaires [40,41]. Ils sont ensuite hydrolysés sous l’action de diverses enzymes, particulièrement de la lipase pancréatique, qui est relâchée à partir du duodénum sous l’effet de la cholécystokinine [38,40,41]. Les monoacylglycérols et les acides gras libres qui résultent de la lipolyse des TG sont principalement absorbés dans les entérocytes par diffusion passive [39,42]. Les acides gras libres à courte chaine et le glycérol, quant à eux, traversent facilement les entérocytes et se lient par la suite à l’albumine dans la circulation sanguine avant d’être menés vers le foie par la veine porte [42]. Dans l’entérocyte, les monoacylglycérols sont retransformés en TG via l’action d’acyltransférases [42]. Les TG sont transportés hors des cellules et acheminés au sang sous forme de chylomicrons en empruntant les canaux lymphatiques [42]. Les chylomicrons sont captés par la paroi capillaire dans certains tissus spécifiques, comme le tissu adipeux et le muscle squelettique, en se liant à la lipoprotéine lipase, ce qui entraîne leur hydrolyse et la libération d’acides gras libres [40]. Les acides gras passent ensuite à travers les cellules pour être mis en réserve ou oxydés [40,41]. Les résidus de chylomicrons sont captés par le tissu hépatique et catabolisés par les lysosomes [40,41]. Ce processus entraîne la libération de cholestérol, qui est alors intégré aux lipoprotéines de très faible densité (VLDL), converti en acides biliaires ou excrété dans la bile [40].
Voie endogène
Des acides gras en provenance des adipocytes et des réserves de lipides de l’organisme sont constamment relâchés dans la circulation sanguine et ces derniers sont captés par le foie [40,41]. Les hépatocytes produisent des TG à partir de ces acides gras et de glucides [40,41]. Ces TG
7
sont alors intégrés aux VLDL pour être sécrétés dans le système sanguin [40,41]. La sécrétion de VLDL est dépendante de l’accumulation de TG dans le foie [40,41].
1.2 Triglycérides et maladies cardiovasculaires
Tel qu’abordé précédemment, une altération des taux de lipides sanguins, incluant les niveaux de TG plasmatiques, peut influencer grandement le risque d’évènement cardiovasculaire [43-46]. Plusieurs définitions de l’hypertriglycéridémie ont été proposées (tableau 1) [47].
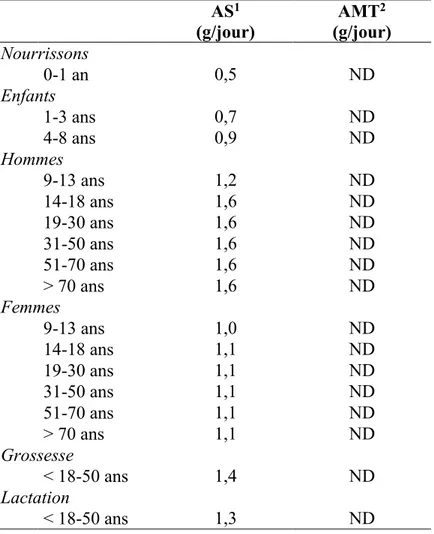
Tableau 1. Définitions de l’hypertriglycéridémie Valeurs normales
(mmol/L) Hypertriglycéridémie (mmol/L)
Légère Modérée Sévère Très sévère
Société Européenne de
Cardiologie (2011) < 1,7 - 1,7 – 9,9 > 10 - National Cholesterol
Education Program Adult Treatment Panel III (2001)
< 1,7 - 1,7 – 2,3 2,3 – 5,6 > 5,6
Endocrine Society guidelines
(2012) < 1,7 1,7 – 2,3 2,3 – 11,2 11,2 – 22,4 > 22,4
Hegele RA et al. Lancet Diabetes Endocrinol. 2014.
Les TG constituent un important biomarqueur du risque cardiovasculaire, principalement en raison de leur forte association avec certaines particules athérogènes, notamment l’Apo C3 [48]. L’Apo C3 est une protéine retrouvée à la surface de toutes les lipoprotéines qui inhibe l’activité de la lipoprotéine lipase (LPL) [49]. Cette dernière, tel que précédemment mentionné, a pour rôle d’hydrolyser les TG contenus dans les lipoprotéines telles que les chylomicrons et les VLDL [48-50]. L’expression génique et la synthèse d’Apo C3 est régulée par divers facteurs, dont le PPARα, le PPARγ, le récepteur farnesoid X, l’insuline et le glucose [51]. Tous ces facteurs ont des effets inhibiteurs, à l’exception du glucose, qui augmente l’expression du gène de l’Apo C3 [51]. Une augmentation de l’expression génique et de la synthèse d’Apo C3 a pour effet de diminuer le catabolisme et la clairance des chylomicrons, des VLDL et des lipoprotéines résiduelles riches en TG [51]. Les lipoprotéines résiduelles, qui sont produites par
8
l’hydrolyse partielle des VLDL et des chylomicrons, sont plus petites, denses et surtout athérogènes par rapport à ces derniers [48,51]. Plus spécifiquement, elles accroissent le recrutement et l’attachement de monocytes via l’action de protéines inflammatoires telles que le facteur de nécrose tumorale α (TNF-α), l’IL-1β, de molécules d’adhésion, diminuent les effets anti-inflammatoires et athéroprotecteurs des lipoprotéines de haute densité (HDL) et favorisent le développement de la résistance à l’insuline dans les cellules endothéliales [51]. Il est donc possible d’observer une augmentation de l’expression d’Apo C3 chez les individus atteints de diabète de type 2 ou résistants à l’insuline [51]. De plus, la diminution de la clairance et de l’hydrolyse des lipoprotéines a pour effet d’augmenter les niveaux d’acides gras libres plasmatiques, ce qui exacerbe la condition [48,51].
Il a été énoncé, dans le passé, que les TG soient possiblement un facteur de risque indépendant de MCV [52-54]. Cependant, cette hypothèse reste controversée, car les résultats d’études cliniques sont contradictoires et les évidences qui la supportent sont modestes [41]. Plusieurs raisons peuvent expliquer les discordances entre ces études. D’abord, les niveaux de TG sont très variables, puisqu’ils reflètent beaucoup les apports alimentaires en lipides [41]. Ensuite, les personnes qui ont des niveaux de TG plasmatiques élevés présentent souvent des facteurs de risque de MCV concomitants, comme de l’insulinorésistance [41]. Finalement, l’hypertriglycéridémie est très associée à de faibles niveaux de cholestérol HDL [41]. Dans l’étude Emerging Risk Factors Collaboration, où les résultats de 68 études prospectives ont été étudiés, les auteurs ont observé que l’impact de niveaux de TG élevés sur le risque cardiovasculaire et d’AVC devenait non significatif dans une régression pas-à-pas lorsque le modèle était ajusté pour les niveaux de cholestérol HDL et de non HDL [48]. Ces résultats suggèrent que les TG ont peut-être un impact moins important sur le risque cardiovasculaire que les faibles niveaux de cholestérol HDL qui y sont souvent associés.
Somme toute, il est tout de même justifié d’affirmer que de hauts niveaux de TG sont associés à une augmentation du risque de MCV. Par contre, les évidences actuelles permettent difficilement de conclure que l’effet des TG sur ce risque est indépendant.
1.3 Étiologie de l’hypertriglycéridémie
L’étiologie de l’hypertriglycéridémie est multifactorielle. L’hypertriglycéridémie peut être d’origine primaire ou secondaire [40]. Parmi les causes primaires prédominantes, on retrouve
9
l’hypertriglycéridémie familiale simple, l’hyperlipidémie familiale mixte, la déficience congénitale en LPL, la déficience en Apo C2 et les dysbêtalipoprotéinémies familiales [40].
Les hypertriglycéridémies primaires peuvent être monogéniques ou, plus fréquemment, multigéniques [47]. Celles qui sont monogéniques se manifestent généralement dès l’enfance ou l’adolescence [47]. Les personnes touchées présentent souvent des mutations génétiques au niveau de gènes impliqués dans le catabolisme des lipoprotéines riches en TG, comme les gènes
LPL, APOC2, APOA5, LMF1, GPIHBP1 ou GPD1 [47]. De ce fait, ces personnes ont des
niveaux de chylomicrons considérablement élevés et donc de TG [47]. Cependant, ils ne développent pas d’athérosclérose prématurée et ce probablement en raison de la grosseur des chylomicrons qui ne leur permet pas de traverser la barrière endothéliale vasculaire [47].
Les affections multigéniques sont plus complexes et résultent de multiples variations génétiques communes ou rares [55]. Les gènes en cause sont impliqués dans l’anabolisme et le catabolisme de lipoprotéines riches en TG, soit APOC2, APOA5, GCKR, LPL, et APOB [47].
Pour ce qui est des hypertriglycéridémies d’origine secondaire, on retrouve, parmi les causes, le syndrome néphrotique, le diabète de type 2, l’obésité, l’hypothyroïdisme, certains médicaments (diurétiques thiazides, bêta-bloquants, corticostéroïdes, contraceptifs oraux, tamoxifène, antirétroviraux, antipsychotiques, isotrétinoïne, immunosuppresseurs et séquestrants de l’acide biliaire), les maladies rénales, la grossesse et l’alcool [40,47,56,57]. Les hypertriglycéridémies secondaires aussi peuvent être influencées par des prédispositions génétiques, même si celles-ci ne les causent pas directement [47]. Par exemple, certains individus sont plus susceptibles que d’autres de développer de l’insulinorésistance et du diabète de type 2 à cause de leur profil génétique [47]. Ces conditions peuvent entraîner une élévation des TG plasmatiques [47]. Dans la plupart des cas, l’hypertriglycéridémie résulte d’une combinaison de ces facteurs [57].
1.4 Traitement de l’hypertriglycéridémie
Les traitements de l’hypertriglycéridémie varient en fonction de la cause et de la gravité de l’affection. Ils visent deux objectifs principaux, soit la prévention de la pancréatite chez les patients aux prises avec une hypertriglycéridémie sévère (> 10 mmol/L) et la réduction du risque cardiovasculaire [47]. Puisque cette affection est associée à une augmentation des taux sanguins de lipoprotéines résiduelles riches en TG, une réduction des concentrations de
10
cholestérol non HDL et d’Apo B est aussi visée, particulièrement lorsque l’hypertriglycéridémie est légère et que la réduction du risque de MCV est l’objectif principal [47].
Cela dit, lorsque l’hypertriglycéridémie est légère (1,7-2,3 mmol/L), le traitement débute avec la modification des habitudes de vie [48]. Il est alors recommandé de faire davantage d’activité physique aérobique [47]. Pour ce qui est de l’alimentation, une diminution de la consommation d’alcool aide à normaliser les TG [58,59]. De plus, il est pertinent de diminuer les apports en sucres simples et en glucides totaux de même que d’augmenter la proportion d’apports énergétiques en lipides, en privilégiant les sources de gras insaturés [58,59]. La consommation d’AG n-3 via l’alimentation (2 portions de poisson gras par semaine) ou sous forme de suppléments peut aussi contribuer à diminuer les niveaux de TG plasmatiques [47,57]. Considérant que de nombreux patients hypertriglycéridémiques sont en surpoids, une perte de poids allant de 5-10% du poids initial peut améliorer considérablement le bilan lipidique [48,56].
Si les changements des habitudes de vies ne suffisent pas à faire diminuer les niveaux de TG, l’ajout d’un traitement pharmacologique est à envisager [60]. Les médicaments qui sont couramment prescrits sont les statines, l’ezetimibe, les fibrates, la niacine et les AG n-3 sous forme de suppléments [48]. Les statines et l’ezetimibe entraînent une réduction des TG sanguins, toutefois ils sont habituellement employés pour réduire le risque d’évènement cardiovasculaire en abaissant les niveaux de cholestérol des lipoprotéines de faible densité (LDL) [58,59,61]. Leur usage est donc surtout pertinent lorsque les taux de TG ne s’élèvent pas au-dessus de 10 mmol/L [47]. À ce niveau, des fibrates, de la niacine et/ou des AG n-3 (2-4g/jour) peuvent également être utilisés [47,62,63]. Les trois autres médicaments sont surtout recommandés si la réduction des TG est l’objectif primaire de l’intervention, particulièrement lorsque la triglycéridémie s’élève à plus de 10 mmol/L [47]. Il est alors impératif de traiter agressivement ces patients du fait qu’ils sont à risque de pancréatite aigüe [47]. Pour la réduction des TG, les fibrates et les AG n-3 sont probablement les agents pharmacologiques les plus efficaces [57-59]. La niacine est associée à de nombreux effets secondaires, incluant des bouffées de chaleur, des inconforts gastro-intestinaux et de l’hyperglycémie [57-59]. L’efficacité des différents traitements hypotriglycéridémiants est présentée dans le tableau 2 [48].
11
Tableau 2. Efficacité des traitements hypotriglycéridémiants
Intervention Réduction des TG (%)
Changements des habitudes de vie
Perte de poids (5-10%) 20 Alimentation 15-20 Exercices aérobiques 15-30 Pharmacothérapie Fibrates 30-50 Niacine 10-30
Acides gras oméga-3
Pour chaque 1g/jour 5-10 Doses élevées (3-4g/jour) 25-30 Statines
Faibles doses 10-15 Doses élevées 15-30
Ezetimibe 5-10
Talayero B. Curr Cardiol Rep. 2011.
3.
L
ES ACIDES GRAS OMÉGA-3
2.1 Définition et structure des acides gras oméga-3
Comme tous les AG, les AG n-3 sont formés de chaînes hydrocarbonées rattachées à un groupe carboxyle à l’une des extrémités et un groupe méthyle à l’autre [64,65]. Le groupe carboxyle des AG est réactif et peut former des liens esters avec un alcool pour former des esters de cholestérol ou des acylglycérols, comme des TG [64,65]. La longueur des chaines d’AG est très variable et peut aller de 2 à 30 atomes de carbones ou plus [64,65]. La particularité des n-3 est qu’ils contiennent plusieurs doubles liaisons carbone-carbone, aussi appelées insaturations [66]. Dans le cas des n-3, la première insaturation se situe sur le troisième carbone à partir de l’extrémité de la chaîne où se trouve le groupe méthyle (n ou oméga), d’où le nom oméga-3/n-3 [64-66]. Il existe trois principaux types d’AG n-oméga-3/n-3 : l’acide α-linolénique (ALA), l’AEP et l’ADH [64,65]. L’ALA est synthétisée dans les plantes à partir d’acide linoléique, un AG oméga-6 (n-6) [64,65]. Les animaux, incluant l’humain, ne possèdent pas l’enzyme nécessaire (delta-15 désaturase) pour en produire [64,65]. Ils possèdent toutefois les enzymes nécessaires pour convertir l’ALA en AEP et en ADH, qui sont plus longs et possèdent respectivement 20 et 22 atomes de carbone [64,65]. Le taux de conversion est cependant très faible, voire insuffisant pour permettre de répondre aux besoins de l’organisme en AEP et en ADH, c’est
12
pourquoi il est recommandé d’avoir des apports en AEP et ADH provenant directement de l’alimentation [64,65,67].
2.2 Sources d’acides gras oméga-3
Les sources alimentaires principales d’ALA sont végétales et comprennent certaines graines, noix et leurs huiles [68,69]. Les huiles qui en contiennent le plus sont l’huile de lin, qui est composée de 45 à 55% d’ALA, l’huile de soya, l’huile de noix de grenoble, l’huile de colza et l’huile de canola [64,65,70]. Les huiles de maïs, de tournesol, d’olive, de carthame contiennent très peu d’ALA [64,65,70]. Pour ce qui est des AG AEP et ADH, ceux-ci se retrouvent plutôt dans les poissons et fruits de mer [64,65,70]. La teneur en AG n-3 peut grandement varier d’un poisson à l’autre. Les poissons gras tels que le maquereau, le hareng, le saumon et le thon, contiennent de 1,5 à 3g d’AG n-3 par portion, alors que les poissons maigres, comme la morue, n’en contiennent qu’environ 0,3g par portion [64,65]. Outre l’alimentation, il existe des suppléments en capsule d’AG n-3 vendus en pharmacie et dans les magasins de produits de santé naturels [64,65]. Les doses d’AG n-3 dans ces suppléments sont variables. Elles vont généralement de 100 à 400 mg d’EPA et de 50 à 200 mg d’ADH. Il existe toutefois des suppléments qui peuvent contenir jusqu’à 2000 mg d’EPA ou 1000 mg d’ADH par capsule.
2.3 Recommandations
Des apports nutritionnels de référence pour les AG n-3 ont été émis par Santé Canada pour l’ALA, mais pas pour les AG AEP et ADH [71,72]. Ces valeurs sont présentées dans le tableau
13
Tableau 3. Apports nutritionnels de référence relatifs aux AG n-3 (ALA) AS1 (g/jour) AMT2 (g/jour) Nourrissons 0-1 an 0,5 ND Enfants 1-3 ans 0,7 ND 4-8 ans 0,9 ND Hommes 9-13 ans 1,2 ND 14-18 ans 1,6 ND 19-30 ans 1,6 ND 31-50 ans 1,6 ND 51-70 ans 1,6 ND > 70 ans 1,6 ND Femmes 9-13 ans 1,0 ND 14-18 ans 1,1 ND 19-30 ans 1,1 ND 31-50 ans 1,1 ND 51-70 ans 1,1 ND > 70 ans 1,1 ND Grossesse < 18-50 ans 1,4 ND Lactation < 18-50 ans 1,3 ND 1 Apports suffisants; 2 Apports maximaux tolérables.
Pour atteindre ces apports, les Diététistes du Canada recommandent de consommer deux portions de 75g de poisson par semaine, ce qui équivaut à des apports d’environ 0,3 à 0,45g d’AEP et d’ADH par jour [71]. Pour tous les groupes d’âge, Santé Canada recommande également de consommer 0,6 à 1,2% des apports énergétiques sous forme d’AG n-3 ALA, selon l’étendue des valeurs acceptables en macronutriments (ÉVAM) [72]. Aucun AMT n’a été établi pour la consommation d’ALA.
2.4 Rôles physiologiques
Les rôles physiologiques des AG n-3 sont multiples. Les AG n-3 sont d’abord reconnus comme ayant des effets positifs sur la santé du cœur [73-75]. Une augmentation des apports en AG
n-14
3 à très longue chaîne est associée à une diminution de la mortalité et de la morbidité cardiovasculaire [64]. Ils ont le potentiel d’influencer plusieurs facteurs de risque, dont la pression artérielle, l’agrégation plaquettaire, les niveaux de TG plasmatiques, la fonction vasculaire et le rythme cardiaque [64,76]. Ils ont également un rôle important à jouer dans la médiation de l’inflammation du fait que l’AEP et l’ADH sont précurseurs d’eicosanoïdes [77]. Ces AG exercent également des effets bénéfiques autres que sur le système cardiovasculaire. Ils se sont avérés efficaces pour soulager l’arthrite rhumatoïde ainsi que certaines maladies inflammatoires du système digestif [64]. Ils ont un rôle structural important dans les membranes cellulaires, particulièrement des cellules de la rétine de l’œil et du cerveau, et permettent d’augmenter leur viscosité [77]. Les AG n-3 ont des effets importants sur le fonctionnement cérébral [78,79]. L’AEP et l’ADH sont importants pour assurer le bon développement neurologique, cognitif et immunitaire du fœtus [77-80]. La consommation d’AG n-3 à longue chaîne durant l’enfance semble être associée à une amélioration de l’apprentissage et du comportement [64]. Chez l’adulte, les AG n-3 pourraient améliorer la condition de personnes atteintes de certains troubles de santé mentale [64]. Ils auraient un léger effet bénéfique potentiel dans le traitement de la dépression [81,82]. Finalement, ils pourraient avoir des effets préventifs dans le développement de maladies neurodégénératives telles que la maladie d’Alzheimer [64,78].
2.5 Mécanismes d’action
Les effets des AG n-3 dans l’organisme passent par divers mécanismes d’actions. Ces derniers incluent la régulation de facteurs de transcription et de récepteurs, l’incorporation des AG n-3 dans les cellules et les métabolites des AG n-3 [64].
Régulation de facteurs de transcription
Les AG n-3 régulent la transcription de gènes en se liant à certains récepteurs nucléaires, comme le récepteur activé par les PPARs, qui sont impliqués dans l’homéostasie énergétique [64,83]. Les PPAR-α et -γ sont les deux isoformes des PPARs qui ont été le plus étudiées dans le passé et qui sont, à ce jour, les mieux comprises [64]. Le PPAR-α est surtout exprimé dans les hépatocytes et est impliqué dans la réponse du foie à la disponibilité de certains AG, des métabolites d’AG et d’autres PPARs [64]. La plupart des gènes régulés par le PPAR-α codent pour des enzymes impliqués dans la β-oxydation des lipides et le métabolisme des lipoprotéines [64]. Le PPAR-γ est exprimé dans le tissu adipeux et les cellules inflammatoires [64]. Il est responsable de la production d’adiponectine et régule la différenciation et la réponse
15
métabolique des adipocytes, incluant leur sensibilité à l’insuline [64,84]. Il exerce des effets anti-inflammatoires en diminuant la production de certains médiateurs de l’inflammation, dont les cytokines inflammatoires TNF et IL-6 en réponse à des endotoxines [64].
L’effet hypotriglycéridémiant des AG n-3 est entre autres attribuable à leur capacité de liaison aux PPARs. L’activation des PPARs par les AG n-3 permet d’augmenter la clairance des TG via l’augmentation de l’activité de la LPL, d’augmenter l’oxydation des lipides dans les tissus hépatique, adipeux, cardiaque et musculaire squelettique, d’augmenter les protéines de transport d’AG et de stimuler la différenciation des adipocytes [83,85]. En outre, les AG n-3 inhibent l’activité d’enzymes responsables de la production de TG dans le foie, dont le diacylglycérol acyltransférase et l’acide phosphatidique phosphohydrolase, ce qui diminue ultimement la synthèse de VLDL [86].
Les AG n-3 se lient également au facteur nucléaire κB (NFκB), un facteur de transcription affectant l’expression de gènes de protéines inflammatoires [64]. Le NFκB est présent dans le cytosol et répond à des stimuli extracellulaires tels que les endotoxines de bactéries, les cytokines inflammatoires, les rayonnements ultraviolets et le stress oxydatif [64]. Les protéines inflammatoires produites par son activation comprennent la cyclo-oxygénase (COX) 2, l’oxyde nitrique synthase inductible, le TNF-α, l’IL-1, l’IL-6, l’IL-8, l’IL-12, les monocytes, les macrophages et les cellules dendritiques [64]. Les AG à longue chaîne AEP et ADH ont pour effet d’inhiber l’activation de NFκB, résultant ainsi en des effets anti-inflammatoires [87,88].
Régulation de récepteurs membranaires
Certains récepteurs membranaires couplés aux protéines G (GPR) ont le potentiel de se lier à certains AG, dont les AG n-3 à longue chaîne [64]. Le GPR120, récemment renommé FFA4, fait partie de ceux-ci [87]. Il est hautement exprimé sur les adipocytes, les macrophages, dans le système digestif, les poumons et le pancréas endocrine et tient un rôle important dans le signalement anti-inflammatoire [64,89,90]. Plus précisément, l’AEP et particulièrement l’ADH augmentent l’activation du FFA4, empêchant ainsi le signalement de l’inflammation via la voie du NFκB et de l’IκB kinase β (IKK-β), ce qui entraine ultimement une diminution de la réponse des macrophages aux stimuli inflammatoires [87,88]. Dans l’intestin, le FFA4 médie la libération de glucagon-like peptide-1 (GLP-1), qui augmente la sécrétion d’insuline stimulée par le glucose, accroit la masse des cellules β et diminue la vidange gastrique en plus de l’appétit [89,91]. Il a été observé que des souris déficientes en FFA4 étaient moins tolérantes au glucose, sécrétaient plus d’insuline et étaient plus résistantes à l’insuline au niveau du tissu musculaire
16
squelettique et hépatique [92]. L’activation du FFA4 aurait aussi des effets sur l’adipogenèse [93].
Incorporation dans les cellules
Les phospholipides composent la majeure partie de la membrane cytoplasmique [64]. Les AG n-3 peuvent s’intégrer à ces phospholipides et affecter le fonctionnement de la cellule [64]. Les apports alimentaires en AG n-3 influencent la proportion de ces AG dans les membranes et cela se fait de manière dose-réponse [64]. L’incorporation d’AG n-3 dans la membrane peut affecter la fonction de la cellule directement en changeant ses propriétés physiques, telles que sa fluidité ainsi que la formation et la structure de radeaux lipidiques [64,65]. Les radeaux lipidiques sont des microdomaines de la membrane cellulaire riches en cholestérol et en sphingolipides qui servent de plates-formes pour faciliter l’adressage apical des signaux, la neurotransmission, l’association de la cellule avec des molécules de signalement et les interactions entre les cellules [64,65]. La modulation des radeaux lipidiques par les AG n-3 aurait un impact sur la fonction immunitaire, la croissance tumorale, la vision, la fonction nerveuse, la fonction endothéliale, la sensibilité à l’insuline, etc [64,65]. L’incorporation des AG n-3 dans la membrane cellulaire modifie aussi l’expression des gènes, la biosynthèse des protéines et l’activité des protéines de la membrane [94]. Ils servent finalement de réservoir pour certaines molécules bioactives [94].
Métabolites
Les AG n-3 à longue chaine peuvent être convertis en divers métabolites ayant des activités biologiques importantes. Les enzymes de la famille du cytochrome P450 synthétisent des eicosanoïdes en utilisant l’acide arachidonique (AA) comme substrat principal [84,95]. Cependant, plusieurs d’entre elles ont la capacité de métaboliser les AG n-3 et n-6 [95]. Les métabolites de l’AEP et de l’ADH produits par ces réactions ont des effets principalement vasodilatateurs, mais aussi bronchodilatateurs, antihyperalgésiques et anti-inflammatoires [84,95]. Ils offriraient donc une certaine protection contre les MCV, la mort cardiaque subite et le développement de tumeurs [84,95].
Par ailleurs, les eicosanoïdes produits à partir de l’AA sont bien reconnus pour leurs effets sur l’inflammation, le système immunitaire, l’agrégation plaquettaire, la contraction du muscle vasculaire lisse et la fonction rénale [64]. Un débalancement de l’équilibre homéostatique de leurs concentrations est associé à certaines pathologies [64]. Cette voie métabolique de l’AA constitue d’ailleurs la cible de bon nombre d’anti-inflammatoires non stéroïdiens [94]. Les AG
17
n-3 à longue chaîne diminuent la disponibilité de l’AA comme substrat, diminuant ainsi ultimement la production d’eicosanoïdes [64].
D’autre part, l’AEP peut être métabolisé par la COX-2 pour produire des thromboxanes et des prostaglandines qui ont pour effet de diminuer l’agrégation plaquettaire et de promouvoir la vasodilatation [84]. La COX-2 aurait aussi le pouvoir de générer des médiateurs anti-inflammatoires à partir d’AG n-3 à longue chaîne [96]. Les AG AEP et ADH peuvent servir à produire des résolvines via la voie de la COX-2 et de la lipoxygénase [64]. Celles-ci ont des actions anti-inflammatoires et immunomodulatrices [97]. Elles préviennent notamment l’infiltration des neutrophiles aux sites inflammatoires et la production de cytokines pro-inflammatoires [64]. La résolvine D1, issue de l’ADH, aiderait aussi à prévenir la neurodégénérescence [64,98].
4.
L
A GÉNÉTIQUE 4.1 DéfinitionsPolymorphismes nucléotidiques simples
Un polymorphisme nucléotidique simple (SNP) est une variation génétique d’une seule paire de bases azotées (A, T, C ou G) à un endroit spécifique dans le génome [99]. Ces variations peuvent entraîner des différences phénotypiques plus ou moins importantes entre les individus en fonction de leur localisation [99,100]. Les SNPs présents dans des régions codantes de l’ADN, soit les exons, sont susceptibles d’influencer directement la transcription des protéines et donc d’avoir un impact important sur le phénotype d’une personne par rapport à un SNP présent dans une région non codante (intron) [101]. Les SNPs représentent une partie importante des variations génétiques de l’ADN [102]. En recherche, ils sont d’un grand intérêt dans le domaine de la médecine et des sciences de la santé, puisqu’ils peuvent avoir une influence sur le risque de maladies, l’efficacité d’un médicament et les effets secondaires ressentis, la réponse à un nutriment, le comportement, etc. [99,102,103]
Déséquilibre de liaison
Le déséquilibre de liaison (LD) représente l’association non aléatoire de plusieurs allèles à des endroits différents dans le génome [104]. Il montre à quelle fréquence les allèles de deux SNPs
18
se retrouvent sur le même chromosome ou haplotype [105]. Un haplotype représente un groupe de SNPs dont les allèles sont habituellement transmis ensemble [106]. On peut dire de deux SNPs qu’ils sont en déséquilibre de liaison lorsque leurs allèles s’associent plus ou moins fréquemment que ce qui serait attendu si elles s’associaient au hasard [104]. Le LD entre les SNPs peut être influencé par plusieurs facteurs, notamment la proximité des SNPs [107]. Ainsi, des SNPs qui sont situés près l’un de l’autre ont moins de chances que leurs allèles soient transmis indépendamment. Un avantage du LD est qu’il permet de prédire le génotype d’un SNP à partir de celui d’autres SNPs. Les études d’association à l’échelle du génome, ou GWAS, se basent justement sur le phénomène de LD [105]. En effet, lorsque la structure d’un bloc d’haplotype est connue, il est possible de sélectionner seulement certains SNPs qui sont représentatifs de ces blocs, ce qui permet de diminuer grandement le nombre de SNPs à analyser dans l’étude [105].
Études d’association à l’échelle du génome
Un GWAS, est une approche qui consiste à sonder rapidement des marqueurs à travers le génome entier de plusieurs personnes afin de vérifier si des variations génétiques peuvent être à l’origine d’un certain phénotype ou d’une maladie [108,109]. Pour réaliser un GWAS, les chercheurs se servent de deux groupes similaires de participants, soit un premier où les participants présentent une condition X et un deuxième où les participants ne présentent pas la condition X [108,109]. Cette condition X peut représenter une variété importante d’atteintes. Il peut s’agir, par exemple, d’une maladie ou de la réponse physiologique à un traitement [108,109]. Après avoir formé les deux groupes, les chercheurs collectent des échantillons d’ADN de chaque sujet et ces derniers sont numérisés et analysés en laboratoire [109]. La procédure sert donc à vérifier s’il existe des différences au niveau des fréquences alléliques entre les deux groupes ou, plus simplement, à comparer le profil génétique entre ceux-ci [108]. Si des variations génétiques sont retrouvées de manière significativement plus fréquente dans le groupe où les participants sont atteints de la condition X, on conclue qu’elles sont associées à cette condition [109]. Il est important de souligner que la présence d’associations n’indique pas nécessairement que les variations identifiées causent la maladie [109]. En raison du LD entre les SNPs, il devient difficile de reconnaître les SNPs en cause simplement par GWAS [109]. Des analyses supplémentaires sont souvent nécessaires pour les identifier [109].
19
La génomique nutritionnelle, ou nutrigénomique, est une science qui étudie l’influence de l’alimentation sur la stabilité du génome, les altérations épigénétiques, l’expression génique, protéique et la production de protéines [110,111]. Elle vise notamment à identifier les variations génétiques qui influencent la réponse des individus à un nutriment ou un traitement nutritionnel [111,112]. La nutrigénétique étudie plutôt comment les gènes modulent l’absorption des nutriments, leur métabolisme ainsi que leurs effets sur la santé [111].
4.2 Génétique, triglycérides et acides gras oméga-3
Il est reconnu que la consommation d’AG n-3 engendre une réduction des taux de TG plasmatiques, toutefois les individus ne répondent pas tous physiologiquement de manière identique à une supplémentation en AG n-3, ce qui est, en partie, causé par des facteurs génétiques. Plusieurs gènes ont été étudiés dans le passé dans le but de mieux comprendre les causes génétiques de ce phénomène, tels que ceux de l’APOE et des PPARs [8,11-14]. Plus récemment, notre groupe de recherche a montré que des gènes des phospholipases A2 (PLA2) expliqueraient en partie la variabilité de la réponse des TG et de la CRP suite à une supplémentation en AG n-3 [113]. Des gènes impliqués dans la voie métabolique de synthèse des TG, soit les gènes des glycérol-3-phosphate acyltransférases mitochondrial, 3 et 4 (GPAM,
GPAT3 et GPAT4) expliqueraient également la variabilité [114]. En outre, notre équipe a
conduit un GWAS sur les participants de l’étude FAS afin de vérifier s’il existe des différences de fréquences alléliques entre les répondeurs positifs et négatifs à une supplémentation en AG n-3 [15]. Le GWAS a notamment permis d’identifier quatre gènes associés aux niveaux de TG :
IQCJ, NXPH1, PHF17 et MYB [15]. Tel que mentionné précédemment, le calcul d’un score de
risque génétique à partir des signaux significatifs du GWAS permettait d’expliquer 21.53% de la variance des niveaux de TG en réponse à une supplémentation en AG n-3 [15].
IQCJ
Le gène IQ motif containing J, ou IQCJ, est un gène situé sur le chromosome 3 (3q25) [115]. C’est un gène qui est hautement exprimé dans le cerveau [115]. Il est adjacent au gène
Schwannomin-interacting protein 1 (SCHIP1) [115]. Les deux gènes codent pour des protéines
différentes, cependant leur liaison forme une autre unité transcriptionnelle, IQCJ-SCHIP1 [115]. Très peu de fonctions propres à IQCJ sont documentées dans la littérature. IQCJ-SCHIP1 joue un rôle dans la fonction des segments initiaux de l’axone et des nœuds de Ranvier dans les systèmes nerveux central et périphérique [116]. Ces deux structures sont essentielles pour la conduction saltatoire de l’influx nerveux [116]. IQCJ-SCHIP1 pourrait participer à la
20
stabilisation de complexes moléculaires associés aux canaux sodiques dans la membrane de l’axone [116]. Il a également été montré qu’IQCJ-SCHIP1 interagit avec la calmoduline en absence de calcium, ce qui suggère que le gène est impliqué dans la signalisation calcique, puisque la calmoduline est une protéine ubiquitaire qui agit comme un capteur de calcium convertissant le signal calcique en un processus cellulaire [116,117]. IQCJ-SCHIP1 pourrait aussi servir de réservoir à la calmoduline dans le segment initial de l’axone et dans les nœuds de Ranvier [116]. D’ailleurs, cette propriété d’interagir avec la calmoduline n’est pas partagée avec le gène SCHIP1 seul, puisque ce dernier ne possède pas de motif IQ qui lui permet de se lier à cette molécule [116]. Une dysfonction du gène IQCJ-SCHIP1 pourrait engendrer des troubles du langage [115].
Le gène IQCJ a très peu été associé au métabolisme des lipides. Selon les résultats d’un GWAS mené sur les participants de l’étude Genetics of Lipid Lowering Drugs and Diet Network (GOLDN), qui avait pour but d’étudier l’effet d’un traitement hypolipidémiant au fénofibrate sur la réponse de différents traits lipidiques, il est possible qu’IQCJ-SCHIP1 soit associé aux niveaux de TG et aux VLDL [118].
NXPH1
Le gène NXPH1, situé sur le chromosome 7, fait partie de la famille des neurexophilines et est particulièrement exprimé dans le cerveau [119]. La protéine qu’il encode est une glycoprotéine neuronale qui se lie à l’α-neurexine [120]. Les neurexines sont des protéines de la membrane neuronale dont le domaine structural est similaire à ceux sur les récepteurs à la surface des cellules [119]. Le complexe formé serait donc impliqué dans la régulation neuronale, la signalisation et les interactions cellulaires [119]. L’α-neurexine est essentielle pour la neurotransmission, particulièrement dans la libération de neurotransmetteurs dans la synapse [121]. Il a été montré que l’α-neurexine régule la fonction des canaux calciques [121]. NXPH1 joue un rôle dans la plasticité des synapses et la configuration des récepteurs GABA [122]. Le gène serait potentiellement impliqué dans le développement de la schizophrénie [123]. Outre les fonctions cérébrales, NXPH1 aurait le potentiel de supprimer la prolifération de cellules progénitrices hématopoïétiques et serait associé à certains désordres immunitaires du système digestif [124,125].
Par ailleurs, NXPH1 a peu été associé au métabolisme des lipides dans le passé. Selon les résultats du GWAS de l’étude GOLDN, NXPH1 serait associé aux LDL, aux HDL, aux niveaux de TG, au diabète de type 2, à la CRP et à la pression artérielle [118]. Dans une autre étude, des
21
chercheurs ont observé une association possible entre NXPH1 et certains traits du diabète de type 2 chez une population d’enfants hispaniques obèses [126].
PHF17
PHF17 code pour la protéine Jade-1. Celle-ci fait partie d’une famille de protéines qui
interagissent avec l’histone acétyltransférase (HAT) HBO1 et qui s’associent avec la chromatine [127,128]. Il favorise l’acétylation de l’histone dans la chromatine. Ce procédé peut réguler la réplication de l’ADN, sa réparation et la transcription des gènes [129]. Diverses fonctions ont été attribuées à PHF17. Le complexe Jade-1 – HBO1 joue un rôle dans la mitose, facilite la prolifération cellulaire et serait potentiellement impliqué dans le processus de régénération des organes [129]. À l’inverse, il a été rapporté que le gène semble aussi promouvoir l’apoptose [130].
De plus, PHF17 est un gène qui est associé au cancer, particulièrement dans le rein [130]. Des chercheurs ont observé que la protéine Jade-1 inhibait la croissance de cellules cancéreuses ainsi que la formation de tumeurs dans le rein chez la souris [130]. Jade-1 agirait conjointement avec la protéinevon Hippel-Lindau, qui est un suppresseur de tumeur [131,132].
Aucune documentation présente dans la littérature scientifique ne semble soulever une quelconque association entre le gène PHF17 et le métabolisme des lipides.
MYB
MYB est un gène qui code le facteur de transcription c-Myb, qui régule l’expression d’une
grande variété de gènes impliqués dans le fonctionnement des cellules [133]. Il est important dans la régulation de l’hématopoïèse chez l’adulte [134]. Il est grandement exprimé dans les cellules souches hématopoïétiques et est impliqué dans la maturation de certaines cellules du sang [134]. Il a été observé que des souris déficientes en MYB subissaient de grandes perturbations de l’hématopoïèse [134]. MYB semble être un déterminant important du développement de tumeurs et de métastases, notamment dans le pancréas, le sang, la peau, le sein et le colon [133]. Une augmentation de l’expression de ce gène a été constatée dans plusieurs cas de cancers chez l’humain [134]. MYB est également connu pour promouvoir la prolifération cellulaire, bloquer la différenciation cellulaire et inhiber l’apoptose [135,136]. Selon certaines recherches, il serait important dans le développement embryonnaire [136].
22
Concernant le métabolisme des lipides, des chercheurs ont suggéré que MYB serait potentiellement associé au développement de MCV et à l’accumulation intracellulaire de lipides [137]. La protéine c-Myb est exprimée dans le muscle vasculaire lisse et elle est induite par l’homocystéine, alors que de hauts niveaux d’homocystéine sont reconnus comme étant un facteur indépendant du risque cardiovasculaire [137,138]. Une étude a rapporté qu’un SNP de
MYB serait probablement associé à certains traits de l’obésité tels que l’indice de masse
corporelle [139]. Quoiqu’une tendance ait été observée, l’association entre les deux variables n’était pas significative [139]. Finalement, des études ont soulevé que MYB serait impliqué dans l’absorption intestinale de nutriments et la différenciation de cellules souches mésenchymateuses du tissu adipeux [140,141].
23
5.
O
BJECTIFS 5.1 Objectif généralL’objectif général de ce projet est de vérifier si les changements au niveau des facteurs de risque des MCV, plus précisément en ce qui concerne la réduction des TG plasmatiques via une supplémentation en AG n-3, sont influencés par des facteurs génétiques.
5.2 Objectifs spécifiques
Objectif spécifique 1 : Étudier l’influence des polymorphismes des gènes IQCJ, NXPH1,
PHF17 et MYB sur la variation des taux de TG plasmatiques suite à une supplémentation en
AG n-3 d’origine marine.
Objectif spécifique 2 : Vérifier s’il existe un effet d’interaction gène-diète entre certains polymorphismes des gènes IQCJ, NXPH1, PHF17 et MYB et la réponse lipidique à la supplémentation en AG n-3.
24
6.
H
YPOTHÈSES 6.1 Hypothèse généraleL’hypothèse générale est que des facteurs génétiques influencent la réponse des TG plasmatiques suite à une supplémentation en AG n-3 d’origine marine.
6.2 Hypothèses spécifiques
Hypothèse spécifique 1 : Les polymorphismes des quatre gènes à l’étude exercent une influence sur la variabilité des niveaux de TG plasmatiques suite à une supplémentation en AG n-3. Hypothèse spécifique 2 : Notre deuxième hypothèse spécifique est qu’un effet d’interaction gène-diète existe et contribue à la variabilité interindividuelle observée dans la réponse au traitement.
25
7.
M
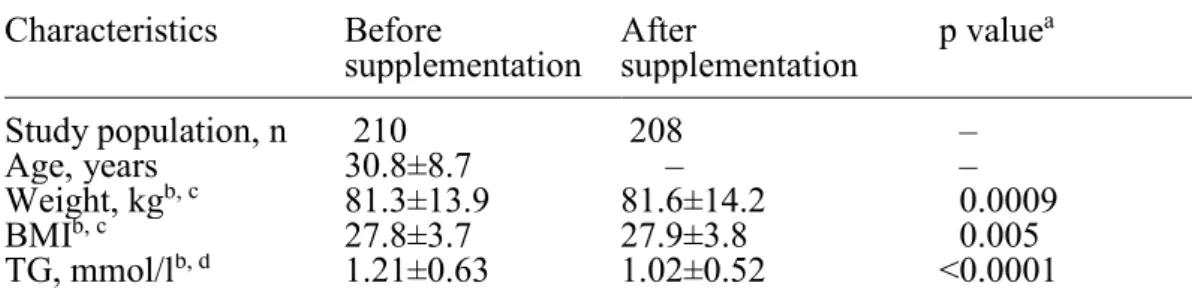
ÉTHODOLOGIE 7.1 Population à l’étudeUn total de 254 sujets de la région métropolitaine de Québec ont été recrutés de septembre 2009 à décembre 2011 pour participer à l’étude FAS. Le recrutement était fait à l’aide d’annonces publiées dans les journaux et de messages électroniques envoyés aux étudiants et au personnel de l’université. Pour être éligibles, les participants devaient être âgés de 18 à 50 ans et avoir un IMC de 25 à 40 kg/m2. Ils devaient également être non-fumeurs et ne pas souffrir de trouble métabolique ou thyroïdien qui requiert un traitement, tel que le diabète, l’hypertension artérielle, la dyslipidémie ou une maladie cardiovasculaire. Les participants étaient exclus de l’étude s’ils avaient consommé des suppléments d’AG n-3 durant les six mois précédant l’étude. Au total, 210 participants ont complété le protocole d’intervention. Deux d’entre eux présentaient des données manquantes en ce qui a trait à leurs niveaux de TG et ces patients ont donc été retirés de l’étude. Les analyses statistiques ont donc été conduites sur 208 personnes. Ces sujets étaient ensuite classés en deux groupes, soit les répondeurs positifs et négatifs à la supplémentation. Tel qu’il a été mentionné plus haut, cette classification était faite selon le changement des niveaux de TG avant vs après l’intervention. Les participants qui avaient un ΔTG ≥ 0 étaient considérés comme étant répondeurs négatifs et ceux dont le ΔTG était < 0 étaient répondeurs positifs.
7.2 Protocole
Les participants respectaient d’abord une période de stabilisation de deux semaines durant lesquelles ils recevaient des instructions d’une nutritionniste pour atteindre les recommandations du Guide alimentaire canadien. Les recommandations étaient émises pour que les participants maintiennent un poids stable et qu’ils aient des apports en AG n-3 constants tout au long du protocole. Après la période de stabilisation, ils recevaient une bouteille contenant les capsules d’AG n-3 (Ocean Nutrition, Dartmouth, N.S., Canada) nécessaires pour compléter l’intervention de six semaines. Chaque capsule contenait 1g de concentré d’huile de poisson. Les sujets devaient prendre cinq capsules par jour, ce qui leur donnait des apports de 3g d’AG n-3 par jour (1,9-2,2g d’AEP et 1,1g d’ADH). Il était demandé aux patients de rapporter toute déviation du protocole, les effets secondaires ressentis s’il y en avait, leur consommation d’alcool et de poisson. Ils recevaient aussi des instructions détaillées orales et écrites sur leur alimentation avant chaque phase.
26 7.3 Mesures en laboratoire
Lipides plasmatiques
Les échantillons de sang étaient collectés le matin. Les participants étaient à jeun depuis 12h et n’avaient pas consommé d’alcool depuis 48h. Les échantillons de sang étaient d’abord pris avant la période de stabilisation dans le but de vérifier si les participants présentaient un désordre métabolique quelconque. Les participants éligibles restants se faisaient prélever un échantillon de sang avant et après l’intervention. Les concentrations plasmatiques de cholestérol et de TG étaient mesurées par dosages enzymatiques.
Sélection des SNPs et génotypage
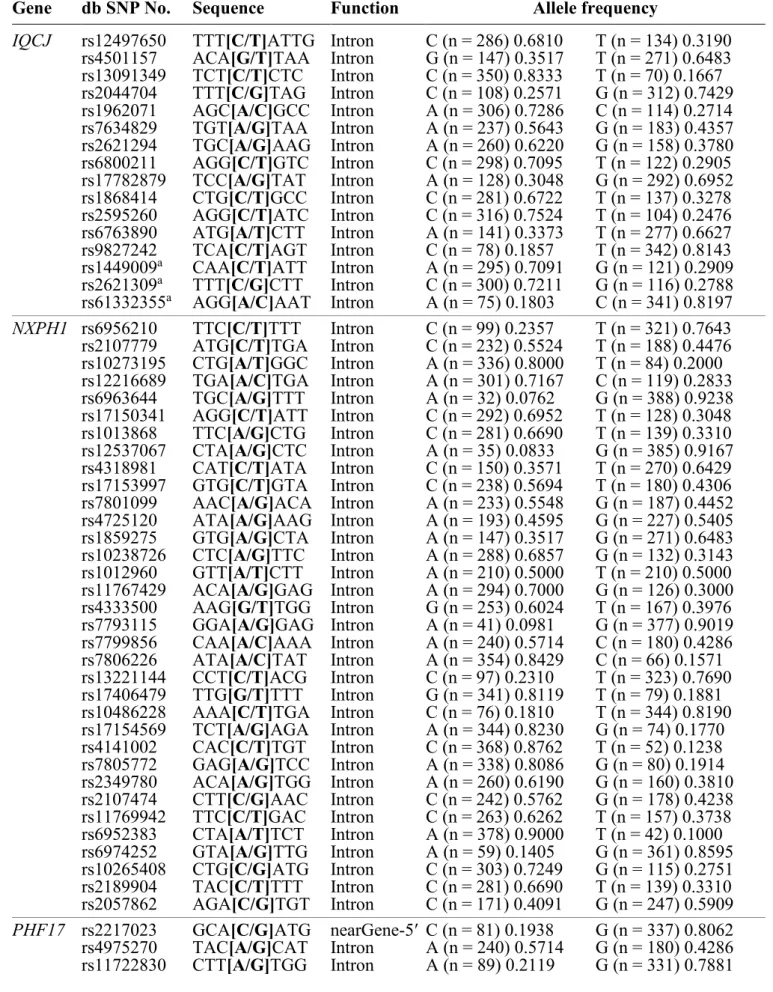
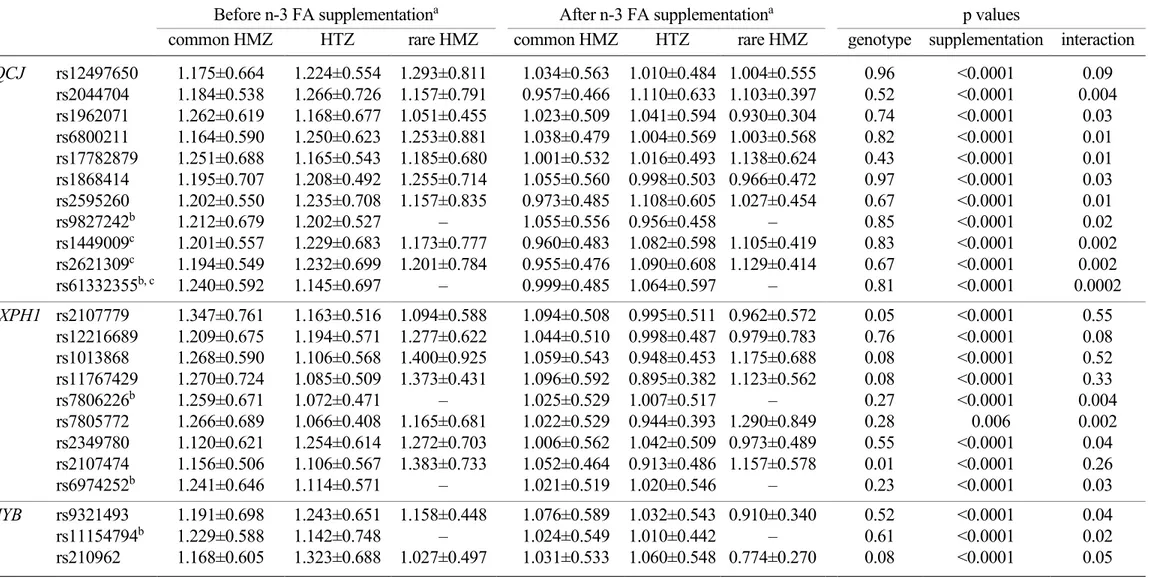
Des SNPs des gènes IQCJ, NXPH1, PHF17 et MYB étaient identifiés via la base de données publique HapMap, basée sur le National Center for Biotechnology Information (NCBI) assemblageB36 Data Rel 28, phase II + III, version 126. Le logiciel Haploview v4,2 (procédure Tagger) était utilisé pour déterminer les SNPs avec une fréquence de l’allèle mineure (MAF) inférieure à 5% et un pairwise tagging (r2) ≥ 0,08. Le r2 moyen était 0,96 pour IQCJ, 0,96 pour
NXPH1, 0,97 pour PHF17 et 0,95 pour MYB. 16 SNPs d’IQCJ, 34 de NXPH1, huit de PHF17
et neuf de MYB ont été sélectionnés de manière à couvrir ≥ 85% de la variabilité génétique. Le matériel GenElute Gel Extraction Kit (Sigma-Aldrich Co., St. Louis, Mo., États-Unis) était utilisé pour extraire l’ADN des prélèvements de sang. Les SNPs sélectionnés étaient génotypés avec la technologie TaqMan. 2,5 µL de chaque échantillon d’ADN (40 ng/µL) et 2,5 µL de OpenArray® Genotyping Master Mix (Life Technologies, Carlsbad, Calif., États-Unis) étaient mélangés avec une amorce dans des plaques de 384 puits et placés sur des plaques de génotypage dans le QuantStudioTM 12K Flex OpenArray® AccuFillTM System (Life Technologies). Le génotypage était réalisé avec le QuantStudioTM 12K Flex Real-Time PCR System (Life Technologies). Ensuite, les résultats étaient analysés avec le TaqMan Genotyper v1.3 (Life Technologies).
7.4 Analyses statistiques
Les analyses statistiques ont été réalisées avec le logiciel statistique SAS v9,2 (SAS Institute, Cary, N.C., États-Unis), à l’exception de la procédure ALLELE, qui a été conduite sur SAS Genetics v9,3. Cette procédure était utilisée pour vérifier les distributions génotypiques, calculer les MAF et vérifier si les SNPs respectaient l’équilibre de Hardy-Weinberg (HWE). La distribution normale était évaluée à l’aide du « skewness » et du « kurtosis ». Les variables