© Mustapha Aissaoui, 2019
Valorisation d'un résidu industriel pour la production
d'hydrogène par un procédé intensifié de
vaporeformage du glycérol
Mémoire
Mustapha Aissaoui
Maîtrise en génie chimique - avec mémoire
Maître ès sciences (M. Sc.)
Valorisation d’un résidu industriel pour la production
d’hydrogène par un procédé intensifié de
vaporeformage du glycérol
Mémoire
Aissaoui Mustapha
Sous la direction de :
ii
Résumé
La capture du CO2 est, de nos jours, une opération très convoitée car elle permet de réduire
les émissions des gaz à effets de serre. Elle peut également être appliquée dans l’intensification des procédés de vaporeformage par l’utilisation des adsorbants chimiques « haute-température » (vaporeformage couplé avec la capture in-situ du CO2
(sorption-enhanced steam reforming, SESR)), afin d’augmenter significativement la pureté de l’hydrogène en une seule étape. Parmi les adsorbants solides utilisés dans ce procédé, ceux qui sont à base de CaO ont montré une certaine efficacité. Toutefois, l’agglomération des particules de CaO au cours de l’opération cyclique carbonatation/régénération rend leur utilisation à échelle industrielle difficile. L’ajout de composants inertes à l’adsorbant est l’une des stratégies utilisées afin d’augmenter sa stabilité.
L’objectif principal de ce travail est la valorisation d’un résidu métallurgique (oxyde d’UGS, UGSO) afin de développer un matériau hybride adsorbant-catalyseur pour application dans la production d’hydrogène de haute pureté par SESR du glycérol. Plusieurs échantillons contenant des proportions différentes UGSO/CaO ont été préparés et testés pour évaluer l'efficacité de l’UGSO dans la stabilisation de l’adsorbant. Les expériences ont été réalisées en utilisant un analyseur gravimétrique intelligent (IGA, Hiden Isochema). Pour tous les échantillons étudiés, une meilleure stabilité a été enregistrée lors de l’ajout de l’UGSO. Les résultats ont montré que l’échantillon contenant 10% en masse UGSO a présenté la meilleure stabilité avec une conversion de CaO de 76% au 18ème cycle carbonatation/régénération, contre une conversion de 55% pour l’échantillon CaO pur testé dans les mêmes conditions. Ce meilleur rapport UGSO/CaO a été ensuite utilisé pour préparer un matériau hybride adsorbant-catalyseur et ses performances ont été testées dans le procédé SESR du glycérol. Les résultats ont montré une production d’hydrogène de pureté élevée avec un rendement de 96 %. Les résultats obtenus dans ce mémoire peuvent contribuer à l’optimisation du procédé de vaporeformage du glycérol couplé à l’adsorption in-situ du CO2.
iii
Abstract
CO2 capture is, nowadays, a widely discussed subject as it helps reducing the greenhouse
gas emissions. It can also intensify steam reforming processes through the use of high-temperature sorbents, in order to produce high purity hydrogen in a single step (sorption-enhanced steam reforming, SESR). Among the solid sorbents used in this process, those based on CaO have shown good results. However, the agglomeration of sorbent particles (sintering) during the cyclic operation carbonation/regeneration makes their use difficult at an industrial scale. The addition of inert compounds to the sorbent is one of the strategies used to increase its stability.
The main objective of this work is the valorization of a metallurgical waste called UGS oxide (UGSO), in order to develop a hybrid sorbent-catalyst material for application in the production of hydrogen with high purity by SESR of glycerol. Several samples with different UGSO/CaO ratios were synthesized and tested to evaluate the efficiency of UGSO in the sorbent stabilization. The experiments were performed using an intelligent gravimetric analyzer (IGA, Hiden Isochema). For all samples, a better stability was obtained in the presence of UGSO. The results showed that the sorbent containing 10 wt.% UGSO achieved the best stability with a CaO conversion of 76% at the 18th carbonation/regeneration cycle compared to 55% for pure CaO (limestone) tested under the same conditions.This optimal UGSO/CaO ratio was then used to prepare a hybrid sorbent-catalyst material and its performance was tested in the SESR of glycerol. The results showed the production of hydrogen with high purity (97%) and yield (96%). The results obtained in this master thesis can contribute to the optimization of the sorption enhanced steam glycerol reforming process.
iv
Table des matières
Résumé………...II Abstract……….III Table des matières……….IV Liste des tableaux………..VI Liste des figures………...VII Liste des notations1... IX
Remerciements ... XI Avant-propos ... XII
Introduction ... 1
1 Chapitre 1 : Revue de la littérature ... 2
1.1 L’hydrogène ... 2
1.2 Le glycérol comme matière première pour produire de l’hydrogène... 2
1.3 Le vaporeformage du glycérol ... 3
1.4 Le vaporeformage du glycérol couplé à l’adsorption du CO2 ... 5
1.5 Les adsorbants du CO2 dans le procédé de SESRG ... 7
1.6 Stratégies de réactivation et de stabilisation des adsorbants ... 9
1.6.1 Hydratation du CaO ... 9
1.6.2 Stabilisation par des matériaux inertes ... 10
1.7 UGSO - résidu métallurgique à valoriser comme stabilisant pour le CaO ... 12
1.8 Conclusion sur la revue de littérature ... 14
1.9 Objectifs ... 15
2 Chapitre 2 : Méthodologie... 16
2.1 Préparation et caractérisation des matériaux ... 16
2.1.1 Adsorbants ... 16
2.1.2 Matériau hybride ... 16
2.1.3 Caractérisation des matériaux ... 16
2.2 Étude de la capacité de capture du CO2 ... 19
2.3 Étude du SESRG ... 21
3 Chapitre 3 : Development of a Fe/Mg-bearing metallurgical waste stabilized-CaO/NiO hybrid sorbent-catalyst for high purity H2 production through sorption-enhanced glycerol steam reforming ... 22
v 3.1 Résumé ... 22 3.2 Abstract ... 24 3.3 Introduction ... 25 3.4 Experimental ... 29 3.4.1 Material preparation ... 29 3.4.2 Material characterization ... 32 3.4.3 CO2 capture... 33
3.5 Sorption enhanced glycerol steam reforming... 34
3.6 Results and discussion ... 36
3.6.1 Effect of UGSO/CaO ratio ... 36
3.6.2 Effect of carbonation temperature ... 45
3.6.3 Steam effect on carbonation ... 46
3.6.4 Sorption enhanced glycerol reforming ... 48
3.7 Conclusion ... 54
3.8 Acknowledgement ... 55
Conclusion générale et recommandations ... 56
Références……….58
*Les adsorbants considérés dans ce mémoire sont des adsorbants chimiques (adsorption chimique). A des fins de simplification, ils seront appelés adsorbants.
vi
Liste des tableaux
Tableau 1.1. Analyse élémentaire de l’UGSO ………...14
Table 3.1. Chemical composition of different sobents………...………...31
Table 3.2. Comparative table of some CaO-based sorbents………....38
vii
Liste des figures
Figure 1.1. Le marché du glycérol en Europe (par application) en kilo tonnes………….3 Figure 1.2 Différentes voies de réactions pour le procédé de vaporeformage du
glycérol………4
Figure 1.3. Phénomène du frittage de CaO……. ………..8 Figure 1.4. Dégradation de la capacité d’adsorption du CO2 sur le CaO au cours des
cycles…… ………..8
Figure 1.5. Représentation schématique des 2 étapes de carbonatation……….9 Figure 1.6. Profil de conversion du CaO avec et sans introduction de vapeur…………. .10 Figure 1.7.Image microscopique du matériau UGSO………13 Figure 1.8. Schéma de l’appareil IGA. 1- Cylindres de gaz 2- Contrôleur de flux
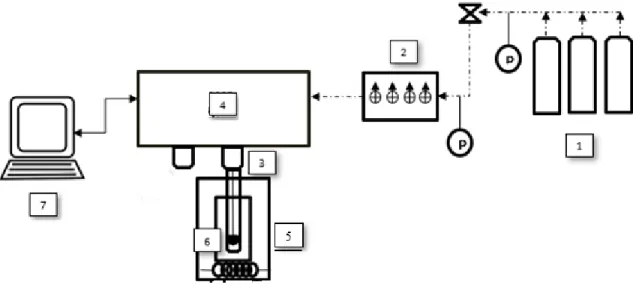
3-Réacteur 4- Microbalance gravimétrique 5- Contrôleur de température 6- Échantillon 7- Ordinateur………..20
Figure 3.1. Flow chart of CaO-UGSO samples preparation ……….31 Figure 3.2. Simple schema of the SESRG setup………35 Figure 3.3. CO2 capture capacity (a) and conversion (b) for the developed sorbents.
Carbonation conditions: 650°C, flow rate: 150 ml/min containing 15 vol.% CO2, 9.5 vol.%
H2O and 75.5 vol.% Ar. Calcination conditions: 750°C, 100 vol.% Ar……….37
Figure 3.4. XRD patterns of pure UGSO, CaO-UGSO10 and CaO-UGSO25 samples …39 Figure 3.5. SEM images of freshly calcined materials ……….41
Figure 3.6. SEM images of samples after 18 carbonation/regeneration cycles………….41
Figure 3.7. UGSO ball milling effect on CaO-UGSO10 and CaO-UGSO10NBM samples
………43
Figure 3.8. SEM-EDX analysis of CaO-UGSO10NBM (a) and CaO-UGSO10 (b) samples
………44
Figure 3.9. CO2 uptake capacity of pure CaO (a) and CaO-UGSO15 (b) samples at various
carbonation temperatures during the 1st and the 18th carbonation cycles under 15% CO2
for 20 min and regeneration at 750°C under Ar for 40 min.………45
Figure 3.10. CO2 capture capacity in the absence and presence of steam for CaO,
viii
Figure 3.11. CO2 sorption result for CaO-UGSO10 and CaO-UGSO10/NiO samples.
Carbonation conditions: 650°C, flow rate = 150 ml/min containing 15 vol.% CO2, 9.5
vol.% H2O and 75.5 vol.% Ar. Calcination conditions: 750°C, 100 vol.%
Ar.……….. 48
Figure 3.12. XRD pattern of CaO-UGSO10/NiO hybrid sorbent-catalyst sample ……..49 Figure 3.13. TPR test result of CaO-UGSO10/NiO hybrid sorbent-catalyst material ….50 Figure 3.14. Typical gaseous product distribution during the 1st cycle of SESRG
conditions (P = 1atm, T = 550°C, S/C = 3)………51
Figure 3.15. Typical H2 and CO2 distribution during two SESRG cycles (P = 1atm, T =
550°C, S/C = 3)………..52
Figure 3.16. Glycerol conversion during two SESRG cycles………52
Figure 3.17. Representative TEM images and Ni particle size distribution of
UGSO-stabilized CaO-UGSO10/NiO hybrid sorbent-catalyst material before (a) and after (b)
ix
Liste des notations
1 AcronymesAl2O3 alumine (aluminium oxide)
Ar Argon
BET théorie Brunauer, Emmett et Teller (Brunauer-Emmett-Teller theory) BJH distribution de la taille des pores (pore size distribution)
Ca12Al14O33 mayenite
CaCO3 le calcaire (limestone)
Ca2Fe2O5 brownmillerite
CaMg(CO3)2 dolomite
CaO oxyde de calcium (calcium oxide)
Ca(OH)2 hydroxyde de calcium (calcium hydroxide)
CaZrO3 zirconate de calcium (calcium zirconate)
CFA cendres de charbon (coal fly ash) CH4 méthane (methane)
C3H8O glycérol
CO monoxide de carbone (carbon monoxide) CoO oxyde de cobalt
CO2 dioxyde de carbone (carbon dioxide)
CTAB Bromure de Cetrimonium
EDX Spectroscopie à rayons X à dispersion d'énergie (Energy-dispersive X-ray spectroscopy)
FeAl2O4 hercynite
GC chromatographie en phase gazeuse (gas chromatography) H2 hydrogène (hydrogen)
HPLC chromatographie liquide haute performance ( high performance liquid chromatography)
IGA analyseur gravimétrique intelligent (intelligent gravimetric analyzer) MgAl2O4 aluminate de magnésium
x
MgFe2O4 ferrite de magnésium (magnesium ferrite)
MgO oxyde de magnésium (magnesium oxide)
n fraction massique du résidu dans l’adsorbant(mass fraction of the residue in the sorbent)
NiO oxyde de nickel (nickel oxide)
SESRG vaporeformage du glycerol avec adsorption in-situ du CO2 (sorption
enhanced steam reforming of glycerol)
SEM microscopie électronique à balayage (scanning electron microscopy) SiO2 dioxyde de silicone
TiO2 dioxyde de titane
UGS upgraded slag UGSO upgraded slag oxide
wi masse initiale de l'échantillon (initial mass of sample)
wt masse de l'échantillon au temps t(mass of the sample at t time)
Xg (%) conversion de glycérol (glycerol conversion)
XRD diffraction aux rayons X (X-ray diffraction) Y2O3 oxyde d’yttrium
ZrO2 dioxyde de zirconium
1 Pour uniformiser l’écriture des notations qui sont également incluses dans l’article en anglais,
xi
Remerciements
Je tiens à remercier, tout d’abord, ma directrice de recherche pour son accueil bienveillant au sein de son laboratoire et pour m’avoir encadré tout au long de cette période. Je la remercie surtout pour son aide précieuse pendant ces deux années, qui a permis de réaliser ce travail, de publier un article dans un grand journal et de rédiger le mémoire de ma maitrise.
Je tiens également à exprimer mes remerciements à mes collègues du groupe de recherche de la professeur Iliuta et spécialement à Alexandre Babin pour son implication très généreuse dans le projet et à Ommolbanin AliZadeh Sahraei, Marziehossadat Shokrollahi Yancheshmeh et Kang GaO qui m’ont fait grandement profiter de leur expérience et leurs précieux conseils.
Nous sommes aussi très reconnaissants au professeur Houshang Darvishi-Alamdari (Université Laval) pour son assistance dans le broyage à boulets du matériau.
Je suis également très reconnaissant pour le soutien financier très généreux de ma directrice de recherche, de l'Université Laval (Bourse d’excellence à la maitrise pour étudiants internationaux), de la Mission universitaire de Tunisie à Montréal (MUTAM) et du Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG), qui m’a permis de réaliser ce projet.
Je remercie aussi mes cousins Slim et Mohamed Betbout pour leur accueil chaleureux et leurs encouragements tout au long de cette période.
Je dédie ce travail à mes très chers parents. Cet accomplissement est le fruit de la confiance que vous avez toujours portée en moi.
xii
Avant-propos
Ce mémoire a été rédigé en trois chapitres. L’introduction permet de mettre en travail le contexte et de présenter la problématique de recherche. La revue de littérature (Chapitre 1) traite l’adsorption du CO2 par l’oxyde de calcium (comme adsorbant chimique*) à haute
température, les différentes techniques de stabilisation de cet adsorbant et le procédé de vaporeformage du glycérol avec adsorption in-situ du CO2. La conclusion de la revue de
littérature est complétée par la présentation des objectifs du projet. La méthodologie (Chapitre 2) porte sur la préparation et la caractérisation des matériaux, l’adsorption du CO2 et la production d’H2 par le procédé de vaporeformage du glycérol couplé à
l’adsorption in-situ du CO2. Le manuscrit de l’article (Chapitre 3) constitue le cœur du
mémoire. Les conclusions générales et les recommandations finissent le document du mémoire.
L’article a été publié dans le journal scientifique International Journal of Hydrogen Energy (doi.org/10.1016/j.ijhydene.2019.08.216) :
Aissaoui, M., Sahraei, O.A, Shokrollahi Yancheshmeh, M., Iliuta, M.C. Development of a Fe/Mg-bearing metallurgical waste stabilized-CaO/NiO hybrid sorbent-catalyst for high purity H2 production through sorption-enhanced glycerol steam reforming.
Les travaux expérimentaux, l’interprétation des données et la rédaction de l’article ont été réalisés sous la supervision directe de ma directrice de recherche, tout en tenant compte des suggestions et des corrections des collaborateurs et des évaluateurs.
*Les adsorbants considérés dans ce mémoire sont des adsorbants chimiques (adsorption chimique). A des fins de simplification, ils seront appelés adsorbants.
1
Introduction
Les gaz à effet de serre (GES) captent la chaleur du soleil par l’entremise du rayonnement infrarouge émis par la surface de la Terre, en contribuant ainsi à l’effet de serre qui est important pour la survie sur notre planète. L’augmentation de la concentration de ces gaz a causé plusieurs perturbations climatiques. Ce phénomène voit son impact s’agrandir tous les jours car l’activité humaine est responsable de ces émissions par le biais d’installations d’unités industrielles devenues, de nos jours, essentielles à notre vie quotidienne, à savoir les stations de production d’électricité par les énergies fossiles, les moyens de transport et l’industrie d’une manière plus générale. Toutes ces activités contribuent aux émissions des gaz à effet de serre avec des proportions différentes [1].
Conscients de notre dépendance aux énergies fossiles et des problèmes qu’ils sont en train de causer, les chercheurs essaient de mettre au point des nouvelles technologies afin de subvenir à nos besoins qui sont en croissance continue sans causer de danger à notre planète pour garantir la survie et l’existence des prochaines générations [1].Ces dernières années, le développement de nouvelles techniques plus efficaces pour la capture et le stockage du dioxyde de carbone (CO2) permet un contrôle plus efficace des émissions de CO2, en
particulier du secteur industriel [1].
Trois catégories principales de méthodes peuvent être appliquées pour la capture du CO2 :
post-combustion, pré-combustions et oxy-combustion [2]. La séparation du CO2 est basée
sur différentes techniques comme l’absorption, l’adsorption, les systèmes membranaires, etc. [3]. Une autre solution envisageable pour contrôler les émissions de GES est la production de nouvelles sources d’énergies renouvelables à partir des ressources non carbonées comme la biomasse. Dans ce contexte, l’hydrogène, le bioéthanol et le biodiesel commencent à gagner plus d’importance dans le domaine industriel et les résultats sont prometteurs pour qu’ils deviennent des alternatives aux énergies fossiles [3].
Lors de ce travail, un résidu métallurgique appelé oxyde d’UGS (UGSO) a été utilisé afin de synthétiser un matériau hybride adsorbant-catalyseur permettant de produire de l’hydrogène d’une haute pureté en une étape par le procédé de vaporeformage du glycérol avec adsorption in-situ de CO2.
2
1 Chapitre 1 : Revue de la littérature
1.1 L’hydrogène
Parmi les différentes solutions proposées pour résoudre la crise mondiale de l’énergie, l’hydrogène est considéré comme une solution très prometteuse pour l’avenir des secteurs de transport et de l’énergie pour réduire la pollution de l’environnement actuellement causée par les carburants issus des énergies fossiles [4, 5]. Dans le but de réduire les émissions de GES, de nombreuses études ont été dirigées vers le développement de nouvelles technologies efficaces de production d'H2 à partir des ressources renouvelables
[4, 5].
Actuellement, la production d’hydrogène peut être effectuée par des technologies thermiques (reformage du gaz naturel, procédés basés sur des biocarburants renouvelables et de la biomasse, gazéification du charbon), électrolytiques (dissociation de l'eau en utilisant diverses sources d'énergie) et photolytiques (dissociation de l'eau en utilisant la lumière solaire) [6]. Pour cela, de nos jours, la consommation globale d’hydrogène dans plusieurs industries ne cesse de croitre rendant ainsi l'épuisement des énergies fossiles plus rapide [6]. Afin de satisfaire cette demande, les industries en collaboration avec les chercheurs sont motivées à trouver une solution en développant de nouveaux procédés de production d'H2 à partir des énergies renouvelables.
Dans le contexte actuel, la production d'hydrogène à partir de ressources renouvelables est considérée comme une voie très prometteuse et respectueuse pour l’environnement [6-9].
1.2 Le glycérol comme matière première pour produire de l’hydrogène
Le glycérol (1,2,3-propanetriol) est un liquide incolore, inodore, visqueux et présentant un goût sucré. C’est un sous-produit du procédé de saponification (production du savon à partir des graisses animales et végétales) et de la transestérification des huiles végétales (production du biodiesel) [10]. Due à une augmentation importante de la production mondiale du biodiesel, le glycérol est actuellement en grand surplus (un exemple est illustré à la Fig. 1.1).
3
Figure 1.1. Le marché du glycérol en Europe (par application) en kilo tonnes [11]
Nous pouvons remarquer une croissance continue qui a comme résultat une baisse de son prix, ce qui permet de le rendre une matière première attrayante pour la fabrication des produits à haute valeur ajoutée, autant liquides que gazeux (hydrogène).
1.3 Le vaporeformage du glycérol
Dans le procédé de vaporeformage du glycérol (1), 7 moles d’hydrogène sont produits théoriquement à partir d’une mole de glycérol [12]:
3 8 3 2 2 2 298
C H O (g) 3H O(g)
+
3CO (g) 7H (g)
+
H
= −
175 kJ/mol
(1)La production d’hydrogène à partir du glycérol est une combinaison de la décomposition du glycérol en gaz de synthèse (2) et la réaction du gaz à l’eau (water-gas shift, WGS) (3) [13]:
3 8 3 2 298
C H O (g)
3CO(g) 4H (g)
+
H
=
251 kJ/mol
(2)2 2 2 298
4
A part ces réactions principales, plusieurs réactions secondaires peuvent avoir lieu pour produire des sous-produits gazeux (réactions 4-10) [12] et liquides (tel que l’acide acétique, acroléine, éthanol, propylène glycol et plusieurs phénols) (Fig. 1.2).
3 8 3 2 4 2
C H O
+
5H (g)
3CH (g) 3H O(g)
+
(4) 2 4 2CO(g) 3H (g)
+
CH (g) 3H O(g)
+
(5) 2 2 4 2CO (g) 4H (g)
+
CH (g) 2H O(g)
+
(6) 2 4 2CO (g) CH (g)
+
2CO(g) 2H (g)
+
(7) 4 2CH (g)
C(s) 2H (g)
+
(8) 2 2C(s) H O(g)
+
CO(g) H (g)
+
(9) 22CO(g)
C(s) CO (g)
+
(10)Figure 1.2. Différentes voies de réactions pour le procédé de vaporeformage du glycérol
5
Les analyses thermodynamiques ont montré que les conditions les plus favorables pour maximiser la conversion du glycérol en hydrogène sont des températures de 527-577°C, pression atmosphérique et un rapport eau/carbone (S/C = 3) [15].
La quantité importante d’eau utilisée est nécessaire non seulement pour la réaction de WGS, mais aussi pour inhiber la formation du coke qui est favorisée à hautes températures. La présence de l’eau permettra également le reformage du coke afin de produire de l’hydrogène selon la réaction (11) [15]:
2 2 2
C(s) 2H O(g)
+
CO (g) 2H (g)
+
(11)Dans le procédé de vaporeformage du glycérol, l’utilisation des catalyseurs spécifiques est primordiale afin d’améliorer le taux d’hydrogène dans le syngas [16]. L’utilisation des catalyseurs permettra d’optimiser les réactions de pyrolyse et WGS mais aussi inhibera des réactions secondaires comme la méthanation L’expérience a montré que le ruthénium, rhodium, platine, nickel, cobalt et le fer sont tous catalytiquement actifs dans le procédé du vaporeformage du glycérol. Le nickel est utilisé avec prédilection grâce à son efficacité et son prix abordable, malgré la possibilité de formation de coke qui se dépose sur le catalyseur.
1.4 Le vaporeformage du glycérol couplé à l’adsorption du CO
2Malgré l’intérêt du procédé du vaporeformage du glycérol, il présente un obstacle majeur. En effet, l’hydrogène produit contient des fractions importantes de CO et de CO2, de 7.5%
et 24.8% (équilibre thermodynamique), respectivement [3]. La présence de ces impuretés limite son utilisation (par exemple, le CO2 nuit aux performances des piles à combustibles
et le CO empoisonne le catalyseur à échange de protons utilisé dans ces piles) [17]. La purification de l’hydrogène est donc nécessaire et implique des coûts supplémentaires importants.
Une option intéressante est l’intégration dans le procédé de reformage de la séparation du CO2 du milieu réactionnel au fur et à mesure qu’il est produit. Conformément au principe
de Le Chatelier, on augmente ainsi la conversion du réactif (glycérol) et la pureté du produit (H2) [12] . Cette technologie est connue sous le nom de vaporeformage du glycérol avec
6
adsorption in-situ du CO2 (sorption enhanced steam reforming of glycerol, SESRG) et
permet d’obtenir, en une étape, de l’hydrogène avec une pureté très élevée [18, 19]. La capture in situ du CO2 permet aussi la diminution du risque de formation du coke [20].
Les réactions qui se déroulent lors du procédé du vaporeformage du glycérol avec adsorption de CO2 in-situ sont les mêmes que celles citées pour le procédé de
vaporeformage du glycérol. Toutefois, l’adsorption de CO2 au début permettra de déplacer
l’équilibre de la réaction globale, selon la loi de Chatelier, dans le sens qui produit l’hydrogène rendant ainsi sa production plus élevée [21] .
L’adsorption de CO2 est souvent réalisée sur l’oxyde de Calcium selon la réaction
suivante :
2 3 298
CaO(s) CO (g)
+
CaCO (s)
H
r= −
175 kJ/mol
(12)Donc, la combinaison dans ce procédé des différentes réactions qui se produisent et qui sont le vaporeformage du glycérol, WGS et la capture de CO2 aboutissent à la réaction
globale suivante :
3 8 3 2 3 2 2 298
C H O
+
3H O(g) CaO
+
→
CaCO (s) 2CO (g)+7H (g)
+
H
r= −
407kJ/mol
(13)Le défi principal dans ce procédé est de trouver l’adsorbant le plus efficace dans les conditions opératoires, en termes de capacité et cinétique de la capture du CO2 et de
stabilité cyclique.
La littérature indique que les conditions suivantes sont les plus favorables pour le procédé de vaporeformage du glycérol avec adsorption in-situ du CO2 [12]
- Température : 527oC - 577oC
- Pression : atmosphérique
7
1.5 Les adsorbants du CO
2dans le procédé de SESRG
Les matériaux capables de capter le CO2à hautes températures et en particulier dans les
procédés de SESR sont les adsorbants La séparation du CO2 du milieu réactionnel a lieu
par la réaction chimique entre le CO2 et l’adsorbant (par exemple, des oxydes métalliques)
pour former des carbonates. Ces matériaux doivent avoir certaines propriétés bien particulières [3, 22] :
- Bonne capacité et cinétique d’adsorption du CO2
- Stabilité à haute température
- Régénération facile
- Coût raisonnable
Les adsorbants les plus prometteurs et les plus utilisés dans le procédé de SESR sont les matériaux à base de CaO et les céramiques [23]. CaO possède une très bonne capacité et cinétique d’adsorption et un prix abordable [3]. Les deux formes de CaO utilisées et qui existent dans la nature sont le calcaire (limestone) (CaCO3) et la dolomite (CaMg(CO3)2).
La réaction entre le CaO et le CO2 (capture du CO2) est la suivante :
2 3 298
CaO(s) CO (g)
+
CaCO (s)
H
r= −
175 kJ/mol
(14)La capacité de capture théorique est égale à 0,786 g CO2 /g adsorbant. Toutefois, la
dolomite possède une capacité plus faible aux alentours de 0,46 g de CO2 /g adsorbant car
MgO n’adsorbe pas le CO2 dans les conditions de reformage [3]. La carbonatation et la
régénération du CaO (décomposition du CaCO3) ont lieu à des températures élevées ( 550
C). Bien que le CaO est un choix approprié pour la capture du CO2, il présente un
inconvénient majeur pour son utilisation industrielle, notamment la perte considérable de son efficacité pendant l’opération cyclique carbonatation/régénération à long terme. Cette diminution de capacité d’adsorption est essentiellement dûe au phénomène de frittage qui consiste dans l’agglomération des particules de CaO, le changement de la forme des pores et/ou le rétrécissement de ces derniers [3] (Fig. 1.3 et 1.4).
8
Figure 1.3. Phénomène du frittage de CaO [3].
Figure 1.4. Dégradation de la capacité d’adsorption du CO2 sur le CaO au cours des
cycles [3].
L’adsorption du CO2 (carbonatation) se déroule en deux étapes (Fig. 1.5) :
1) la première étape de carbonatation (durée 1-3 min) est caractérisée par la réaction avec le CO2 à la surface de la particule de CaO. Cette étape rapide est contrôlée par la réaction
9
2) Après la formation d’une fine couche de CaCO3 à la surface de la particule de CaO, le
CO2 devra diffuser par cette couche pour réagir avec le CaO (non-réagit). Cette étape lente
est donc contrôlée par la diffusion [24].
Figure 1.5. Représentation schématique des deux étapes de carbonatation [24].
Afin de limiter la diminution de la capacité d’adsorption du CO2 par le CaO au cours des
cycles, plusieurs stratégies ont été élaborées, comme la synthèse d’adsorbants synthétiques à base de CaO, la traitement du calcaire naturel et synthétique par hydratation ou la stabilisation des adsorbants par des métaux [25].
1.6 Stratégies de réactivation et de stabilisation des adsorbants
1.6.1 Hydratation du CaO
Une des techniques utilisées afin de réactiver le calcaire naturel est basée sur l’hydratation. Elle consiste à ajouter de l’eau ou de la vapeur aux étapes de carbonatation ou de calcination [26].Il a été constaté que l’introduction d’une étape intermédiaire d’hydratation conduit à la formation de Ca(OH)2, ce qui améliore la capacité d’adsorption du CO2 par
l’augmentation de la surface active. L’hydratation du CaO permet l’augmentation de son volume molaire, causant ainsi un effet de « popcorn » qui rend la surface réactive du matériau plus élevée [25].Ce traitement permet non seulement d’améliorer l’efficacité
10
d’adsorption du CO2 mais aussi de maintenir une capacité de capture élevée pendant
plusieurs cycles.
1.6.1.1 Effet de l’ajout de la vapeur d’eau dans la carbonatation et la calcination
Les données de la littérature montrent une amélioration de la conversion du CaO en présence de la vapeur d’eau à haute température, même à faibles concentrations (5-10%). La présence de la vapeur durant la carbonatation réduit la résistance à la diffusion [25]. Pendant la calcination, le rôle de la vapeur est de maintenir une certaine stabilité de la structure de l’adsorbant. Comme on peut le constater dans la Fig. 1.6, l’introduction de la vapeur permet d’améliorer le taux de conversion en cours d’opération et l’utilisation d’un flux de vapeur de 10 % dès le début du processus permet une amélioration significative de l’efficacité d’adsorption du CO2 [25].
Figure 1.6. Profil de conversion du CaO avec et sans introduction de vapeur [25].
1.6.2 Stabilisation par des matériaux inertes
Une autre méthode d’améliorer la stabilité des adsorbants synthétiques consiste à incorporer des matériaux inertes (stabilisants) ayant des températures de Tammann élevées. Les stabilisants les plus utilisés sont Al2O3, MgO, ZrO2, TiO2, SiO2, Y2O3 et CoO. La
dispersion de ces oxydes dans l’adsorbant pendant sa synthèse contribue à diminuer l’effet de frittage aux cours des cycles de carbonatation/calcination [12].
11
La méthode de synthèse, le type de précurseur du stabilisant et de l’adsorbant, ainsi que le rapport entre le matériau actif (adsorbant) et le matériau inerte jouent un rôle important sur les performances de la capture du CO2. Plusieurs techniques de synthèse tel que le wet
mixing, l’acidification du calcaire avec de l’acide citrique suivie par une calcination sous deux atmosphères, mélange en état solide, ultrason, combinaison de précipitation et hydratation, technique de sol gel et précipitation ont été testées. La littérature a démontré que ces techniques améliorent la stabilité de l’adsorbant en augmentant sa surface spécifique et le volume des pores [12].Par exemple, il a été démontré que la technique de l’acidification du calcaire combinée avec la calcination sous 2 atmosphères ont permis d’augmenter la porosité du CaO pour permettre une distribution adéquate du stabilisant [27]. Le type de précurseur du stabilisant est également un paramètre important qui affecte les propriétés chimiques du matériau adsorbant. En réalité, le stabilisant peut agir comme auto-stabilisant ou bien réagir avec l’adsorbant pour former d’autres composés qui permettent de mieux le stabiliser [12] .
Dépendamment de la méthode de synthèse et des précurseurs utilisés, plusieurs composés d’Al tel que Ca Al O12 14 33, Ca Al O9 6 18 et Ca Al O3 2 18 peuvent être produits et leur
incorporation dans la structure de l’adsorbant permet de limiter le phénomène de frittage et rend le matériau plus stable au cours de la capture en processus cyclique [28].Le rapport entre Al et Ca, la technique de synthèse, ainsi que le type de précurseur utilisé, sont des paramètres clés qui impactent beaucoup sur la capacité d’adsorption et la stabilité aux cours des cycles. Parmi les différents précurseurs d’Al et de CaO, l’oxyde de calcium stabilisé avec du Ca9Al6O18 provenant du nitrate de Ca et de nitrate d’Al représente la meilleure
capacité de capture. Il a été aussi démontré que les adsorbants présentant un rapport Al/Ca élevé possèdent une meilleure stabilité même dans les conditions les plus sévères [29].
Le dioxyde de zirconium (ZrO2) est un autre choix possible pour améliorer la stabilité du
CaO, grâce à la formation du zirconate de calcium (CaZrO3) qui possède une température
de Tammann de 1139oC, ce qui aide à minimiser le phénomène de frittage [12]. La technique de synthèse de l’adsorbant à base de Zr agit beaucoup sur son efficacité. Par exemple, la méthode FSP (Flame spray pyrolysis) a démontré son efficacité dans le développement de nanomatériaux possédant une grande surface spécifique et un volume
12
de pores très large [30]. Le matériau CaO-stabilisé par le Zn a montré une meilleure performance comparée à d’autres stabilisants (Si, Ti, Cr, Co, Zr, Ce). Un travail plus récent de Radfarnia et al. [31] s’est intéressé au développement d’une nouvelle technique ultrason en utilisant un surfactant (CTAB) afin de synthétiser du CaO-stabilisé par le Zn. Cette méthode a permis une meilleure dispersion du CaZrO3 (composant inerte formé pendant la
synthèse), en offrant ainsi au CaO une meilleure stabilité.
Une température de Tammann très élevée du MgO (1276oC) lui permet aussi d’être utilisé comme stabilisant pour améliorer les performances du CaO. Contrairement à Al et Zr, le seul paramètre majeur influençant l’efficacité de l’adsorbant à base de Ca et contenant du Mg comme stabilisant est la méthode de synthèse [32]. Une augmentation du pourcentage de MgO dans l’adsorbant améliore la surface spécifique du matériau et à un effet positif sur la cinétique d’adsorption du CO2 et la stabilité de l’adsorbant.
A part ces stabilisants conventionnels, les spinelles pourraient constituer un choix intéressant, mais à notre connaissance, une seule étude a été trouvée dans la littérature ouverte. Le travail de Li et al. [33] a montré que les performances des adsorbants stabilisés par le spinelle d’aluminate de magnésium (MgAl O2 4) ont été supérieures à ceux stabilisés par des matériaux inertes conventionnels. Le broyage à boulets des particules de MgAl O2 4
et CaO en présence du 2-propanol a permis d’obtenir un matériau doté d’une capacité de capture de CO2 améliorée sur plusieurs cycles. Dans les mêmes conditions, ce matériau a
montré une meilleure stabilité en comparaison avec le CaO stabilisé par MgO. Il a été démontré que l’ajout des spinelles a le pouvoir d’augmenter la stabilité thermique de l’adsorbant et de bien séparer physiquement les particules de CaO, en limitant ainsi le phénomène de frittage.
1.7 UGSO - résidu métallurgique à valoriser comme stabilisant pour le
CaO
La compagnie métallurgique Rio Tinto fer et titane transforme FeTiO -Fe O3 2 3 en produits riches en dioxyde de titane (TiO2). Une partie des scories riches en titane est purifiée pour
13
Afin d’obtenir ce matériau, les scories sont tamisées, oxydées, réduites, traitées à l’acide, lavées, séchées et enfin calcinées. Lors de ce procédé et pendant l’étape de régénération de l’acide, le liquide contenant les résidus des chlorures de métaux est régénéré par pyro-hydrolyse. Les produits de cette étape sont HCl et des cristaux de métaux appelés UGSO Fig. 1.7 [34]. Actuellement, 65000 tonnes par année du résidu UGSO sont produites chaque année et déposées sur un site d’enfouissement. L’analyse ICP de l’UGSO est résumée dans le tableau 1.1.
Figure 1.7. Image microscopique du matériau UGSO [34].
Tableau 1.1. Analyse élémentaire de l’UGSO
Composant Fe2O3 MgO Al2O3 CaO MnO V2O5 TiO2
Wt. % 44.7 29.0 10.1 1.5 1.3 1.6 1.0
Composant Cr2O3 Na2O SiO2 K2O P2O5 ZrO2 ZnO
Wt. % 0.74 0.23 0.18 0.03 0.02 0.02 0.01
L’analyse ICP de l’UGSO (Tableau 1.1) a révélé que ses principales phases sont des spinelles de magnésioferrite (MgFe2O4) et hercynite (FeAl2O4). Ces deux composants
existent sous forme de solution solide (Mg Fe,Al O
(
)
2 4). L’excès de magnésium apparaitsous forme de MgO. Comme mentionné plus haut, cette composition rend donc l’UGSO très intéressant à utiliser comme stabilisant des adsorbants à base de CaO.
14
1.8 Conclusion sur la revue de littérature
Le procédé intensifié de vaporeformage du glycérol avec adsorption in-situ de CO2 est une
alternative très prometteuse au procédé traditionnel de vaporeformage. L’intégration de l’étape de l’élimination in-situ du CO2 dans le réacteur de vaporeformage permet d’obtenir
de l’hydrogène de haute pureté (pouvant dépasser 95%), contenant de très faibles pourcentages de CO et CO2, en éliminant ainsi les coûts supplémentaires de purification
de l’H2 avant son utilisation dans d’autres applications. Plusieurs adsorbants pour le CO2 à
haute température ont été développés pour application dans ce procédé, incluant ceux à base de CaO, hydrotalcites et matériaux céramiques. Parmi ces matériaux, les adsorbants à base de CaO ont attiré beaucoup l’attention grâce à leur capacité de capture élevée, leur cinétique de carbonatation/régénération acceptable et leur prix raisonnable. Toutefois, ces matériaux ont le grand désavantage de la diminution de la capacité de capture lors de l’opération cyclique continue de carbonatation/régénération à haute température, à cause du phénomène de frittage qui consiste en l’agglomération des particules de CaO.
Bien que plusieurs stratégies aient été élaborées et investiguées afin d’optimiser la stabilité des adsorbants à base de CaO, améliorer leur stabilité reste encore un grand défi. Les adsorbants à base de CaO modifiés par ajout des stabilisants à base de métaux tel que Al, Mg ou Zr ont démontré une meilleure stabilité par rapport au CaO pur. L’utilisation des spinelles comme matériaux stabilisants peut également augmenter cette stabilité de façon significative . Toutefois, les composés inertes utilisés comme stabilisants sont synthétiques et leur synthèse est coûteuse. Pour des raisons économiques, l’utilisation de certains résidus industriels pour la stabilisation du CaO semble un choix intéressant . Dans ce contexte, l’UGSO est un résidu métallurgique sans valeur marchande. L’analyse de ce matériau a montré qu’il contient principalement des spinelles de magnésioferrite (MgFe2O4) et
hercynite (FeAl2O4). Il s’avère donc très intéressant de tester l’efficacité de ce résidu pour
15
1.9 Objectifs
L’objectif principal de ce projet consiste à développer un matériau hybride adsorbant/catalyseur, en valorisant l’UGSO (un résidu industriel solide) et le glycérol (un sous-produit de la production du biodiesel ), pour la production d’H2 avec une grande
pureté par un procédé intensifié de vaporeformage.
À notre connaissance, cela n’a jamais fait l’objet des travaux dans la littérature ouverte.
Objectifs spécifiques :
a) Développement et caractérisation d’un adsorbant pour CO2 à base de CaO en
ajoutant différentes proportions d’UGSO ;
b) Étude de l’effet des conditions opératoires sur la capacité cyclique carbonatation/régénération du CO2 des matériaux développés ;
c) Étude de l’ajout du résidu industriel UGSO sur l’efficacité d’un matériau hybride adsorbant/catalyseur dans la capture du CO2;
d) Étude des performances du matériau hybride synthétisé dans le procédé intensifié de vaporeformage du glycérol.
16
2 Chapitre 2 : Méthodologie
2.1 Préparation et caractérisation des matériaux
2.1.1 Adsorbants
Plusieurs échantillons à base de CaO et contenant différents pourcentages massiques d’UGSO ont été préparés en se basant sur une méthode développée dans notre groupe de recherche [27] combinée avec une technologie du broyage à boulets .
La première étape consiste au lavage du calcaire broyé en utilisant de l’eau pendant, ce qui permet d’éliminer les impuretés. Par la suite, une filtration Büchner est effectuée et la poudre récupérée est séchée au four à 75oC pendant la nuit. Pour la préparation du citrate
de calcium, 1.035 g de calcaire lavé est traité avec une solution aqueuse d’acide citrique (pH 2.3) à 75oC pendant 15 minutes. Suite à l’évaporation de l’eau à 75oC, le mélange
visqueux obtenu est séché au four pendant la nuit pour obtenir le citrate de calcium. Par la suite, différentes quantités d’UGSO (5, 10, 15, et 25 wt.%) sont mélangées avec 30 ml d’eau et le citrate de calcium, avant d’appliquer l’ultrason pendant 2h pour une bonne dispersion des particules. Le mélange obtenu est séché au four à 80 oC pendant la nuit et
ensuite calciné à 800°C pendant 2h en appliquant la technique de calcination sous deux atmosphères [27].
2.1.2 Matériau hybride
Un matériau hybride contenant l’adsorbant et le catalyseur a été synthétisé en suivant les mêmes étapes décrites pour la préparation d’adsorbants (§2.1.1), mais en ajoutant une quantité bien déterminée de nickel nitrate hexahydrate
(
Ni NO(
3)
26H O2)
lors de l’étape de mélange par ultrason, de telle sorte que l’échantillon préparé contienne 10 wt. % UGSO, 70 wt.% CaO et 20 wt.% NiO.2.1.3 Caractérisation des matériaux
Afin de comprendre et interpréter le comportement des matériaux synthétisés, plusieurs méthodes d’analyse ont été utilisées : la diffraction aux rayons X (XRD), la microscopie électronique à balayage (SEM), la microscopie électronique en transmission (TEM), la réduction programmée par température (TPR) et l’analyse BET.
17 2.1.3.1 Diffraction aux rayons X (XRD)
La diffraction aux rayons X est une technique d’analyse rapide utilisée pour l’identification des phases d’un matériau cristallin et permet de nous fournir des informations à l’unité de cellule [35]. Le matériau à analyser est finement broyé et homogénéisé avant que la composition moyenne en vrac soit déterminée. Cette technique est basée sur l’interférence constructive entre les rayons monochromatiques X et l’échantillon cristallin [35]. Les rayons X sont générés par une cathode filtrée pour ne produire que des radiations monochromatiques. En effet, l’interaction du rayon incident avec l’échantillon produit une interférence et un rayon diffracte quand les conditions satisfont la loi de Bragg
( )
(
nλ=2dsin θ)
. Cette loi relie la longueur d’onde des radiations électromagnétiques à unangle de diffraction. Ces diffractions sont ensuite détectées, traitées et comptées.
Cette technique nous a permis de déterminer les principales phases qui forment l’UGSO et de distinguer aussi les éléments qui se sont formés lors de la synthèse des différents adsorbants et du matériau bifonctionnel.
2.1.3.2 Microscopie électronique à balayage couplée à la spectroscopie de rayons X (SEM-EDX)
Le microscope électronique à balayage produit des images d’échantillons en scannant la surface avec un flux d’électrons. En effet, les électrons interagissent avec les atomes de l’échantillon en émettant des signaux contenant des informations sur la topologie de la surface et sa composition [36]. Le SEM est souvent couplé à la technique de spectroscopie à rayons X (EDX) qui permet de fournir une analyse élémentaire de l’échantillon sur des surfaces de l’ordre du nanomètre [37]. Cette analyse nous donne une idée sur la composition et la distribution des éléments sur une surface bien déterminée.
La microscopie électronique à balayage nous a permis de voir la morphologie des différents échantillons synthétisés et de surtout les comparer avant et après les dix-huit cycles de carbonatation/calcination afin de voir l’effet du phénomène de frittage sur les différents adsorbants. L’utilisation de l’EDX nous a permis de constater l’impact du broyage de l’UGSO sur son incorporation à l’intérieur du CaO lors du mélange de ces deux éléments.
18 2.1.3.3 Théorie BET (Brunauer, Emett et Teller)
La méthode BET permet d’expliquer l’adsorption des molécules de gaz sur une surface solide et permet la mesure de la surface spécifique. Le concept de la théorie est une extension de la théorie de Langmuir [38]. Cette technique utilise une mesure de la physisorption d’un gaz pour déterminer une valeur de “l’aire surfacique” d’un échantillon. En effet, les molécules du gaz peuvent pénétrer entre les particules et dans tous les pores, fissures et dans la texture de surface, pour obtenir une mesure de la surface microscopique de l’échantillon.
La technique BET nous a permis de mesurer la surface spécifique et la distribution de la taille des pores (BJH) pour des échantillons synthétisés.
2.1.3.4 Microscope électronique en transmission (TEM)
Le microscope électronique en transmission (TEM) est l’une des techniques les plus performantes pour la caractérisation de la morphologie des nanoparticules [39]. L’échantillon à analyser est soumis à un faisceau d’électrons énergétiques. Cette intéraction des électrons avec l’échantillon forme l’image qui est par la suite magnifiée et concentrée sur un dispositif d’imagerie.
L’utilisation du TEM nous a permis de voir la morphologie du matériau bifonctionnel synthétisé et d’estimer la taille des particules du nickel avant et après les cycles de carbonatation/régénération.
2.1.3.5 Réduction programmée en température (TPR)
Cette technique d’analyse est utilisée en catalyse afin d’étudier la surface des métaux et des oxides de métaux sous différentes conditions de températures [40]. Le matériau à analyser est dispersé sur une surface et testé dans un réacteur à lit fixe. Ensuite, un gaz réducteur est utilisé pour passer à travers le catalyseur tout en augmentant la température graduellement à la sortie du réacteur, un détecteur ultra-sensible analyse en continue la différence chimique dans la concentration atmosphérique produisant ainsi une image précise du taux de réduction maximal du catalyseur.
19
Cette méthode de caractérisation nous a permis d’analyser la réduction du matériau bifonctionnel et d’analyser le matériau Ni/Fe qui a été formé.
2.2 Étude de la capacité de capture du CO
2L’étude de l’adsorption du CO2 consiste à mettre en contact l’adsorbant avec un flux
contenant du CO2 à haute température afin d’évaluer la capacité et la cinétique d’adsorption
de chaque matériau. Après l’adsorption, l’adsorbant est régénéré sous un flux d’argon à 750°C.
Le précédé cyclique carbonatation/régénération (dix-huit cycles) a été réalisé en utilisant un analyseur gravimétrique intelligent (IGA, Intelligent Gravimetric Analyser, Hiden Isochema, Royaume-Uni). Cet instrument de très haute précision (Fig. 1.8) permet l’acquisition de la variation de masse de l’échantillon pendant l’adsorption et la désorption (cycle carbonatation/régénération), permettant ainsi la détermination de la capacité de capture de CO2 par un certain matériau, ainsi que l’évaluation de la cinétique d’adsorption.
Les échantillons sont chargés sur la balance dont la température est contrôlée par un four. L’analyseur gravimétrique comprend un dispositif de contrôle de débit et de la composition du flux d’entrée. Les conditions d’adsorption et régénération étaient les suivantes :
- Adsorption: 650°C (15 vol % CO2, 9.5 vol % H2O et 75.5 vol % Ar) 20 min.
20
Figure 1.8. Schéma de l’appareil IGA. 1- Cylindres de gaz; 2- Contrôleur de flux;
3-Réacteur; 4- Microbalance gravimétrique; 5- Contrôleur de température; 6- Échantillon; 7- Ordinateur.
Toutes les expériences ont été réalisées selon la même procédure : avant l’étape d’adsorption de CO2, chaque échantillon (30 mg) a été chauffé à 750°C afin de le régénérer
pour éliminer toute trace d’eau et d’impuretés. Les conditions des 18 cycles carbonatation/régénération ont été réalisés, respectivement, à 650°C (15 vol % CO2, 9.5
vol % H2O et 75.5 vol % Ar) pendant 20 min (flux total de 150 ml/min) et 750°C (100 vol
% Ar) pendant 40 min.
Les données ont été utilisées afin de déterminer la capacité de capture de CO2 et la
conversion de CaO de chaque échantillon:
(
)
2 2 -t i i capacité de capture du CO g CO w w g ads = w (15)( )
% - 1 0.786 t i i w w w n Conversion de CaO = (16)Où wt représente la masse (gramme) de l’échantillon à un temps t, wi la masse initiale
(gramme) de l’échantillon, 0.786 (g de CO2/g de CaO) est la capacité maximale (théorique)
21
2.3 Étude du SESRG
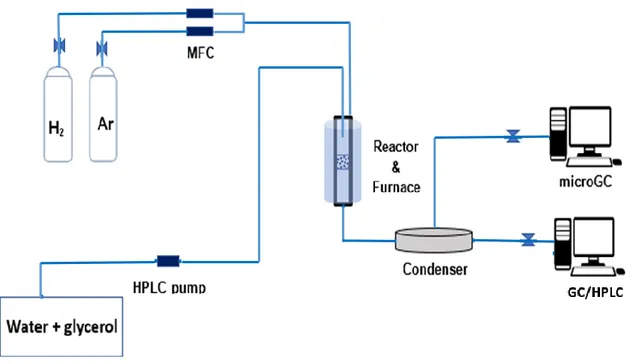
Le réacteur du procédé du vaporeformage du glycérol avec adsorption in-situ de CO2
(SESRG) permet de tester les performances du matériau hybride (adsorbant-catalyseur) synthétisé. L’installation consiste en un réacteur à lit fixe tubulaire en acier inoxydable (diamètre interne de 16 mm, longueur totale de 420 mm) muni d'une plaque perforée installée au milieu du réacteur pour supporter le lit de catalyseur. Des régulateurs de débit massique (Omega, FMA-2620A) ont été utilisés pour contrôler les flux d'H2 (réduction du
catalyseur) et d'Ar. La température était contrôlée par un thermo-contrôleur (Omega CN 7800) connecté à un thermocouple de type k situé à l'intérieur du lit catalytique.
Les gaz à la sortie sont analysés par un microGC (Agilent technologies, 3000A). Les données obtenues ont permis d’obtenir le profil des concentrations de l’H2, CO2, CO et
CH4. Les produits liquides issus du réacteur ont été analysés par chromatographie en phase
gazeuse GC (Agilent technologies, 7820A) et chromatographie liquide haute performance HPLC (Shimadzu, Nexera X2).
Pour chaque test, 1.5 g de matériau hybride contenant 10 wt.% UGSO, 70 wt.% CaO et 20 wt.% NiO a été chargé dans le réacteur à lit fixe (le schéma du réacteur est illustré à la Fig. 3.2). Avant de commencer le premier cycle, l’échantillon a subi un traitement à 800°C pendant 20 min afin de le régénérer. Par la suite, la température a été diminuée à 650°C et gardée à cette température constante pendant 1h afin de réduire le Ni2+ du matériau catalytique, en utilisant un flux de 62.5 ml/min contenant 20 vol.% H2 et 80 vol.% Ar.
Après la réduction, la température a été réglée à 550°C et un flux de 0.04 ml/min (glycérol + eau) est injecté par une pompe HPLC isocratique (BODMAN) pour réaliser la réaction de reformage couplée avec la carbonatation pendant 85 min (étapes de pre-breakthrough + breakthrough +post-breakthrough).
A la fin de la réaction, la température a été augmentée à 800°C pour la régénération de l’adsorbant sous un flux de 150 ml/min d’argon.
22
3 Chapitre 3 : Development of a Fe/Mg-bearing metallurgical
waste stabilized-CaO/NiO hybrid sorbent-catalyst for high
purity H2 production through sorption-enhanced glycerol steam
reforming
Mustapha Aissaoui, Ommolbanin Ali Zadeh Sahraei, Marziehossadat Shokrollahi
Yancheshmeh, Maria C. Iliuta*
Department of Chemical Engineering, Université Laval, Québec, QC G1V 0A6, Canada
3.1 Résumé
Bien que le CaO soit l’un des meilleurs adsorbants de CO2 à haute température, sa capacité
d’adsorption diminue considérablement dans les opérations de carbonatation / régénération cyclique à haute température. Dans ce travail, un déchet métallurgique (oxyde de laitier valorisé, UGSO) a été ajouté à des adsorbants à base de CaO pour améliorer leur stabilité. Le CaO dérivé du citrate de calcium et obtenu à partir d'un calcaire naturel par acidification a été mélangé à l'UGSO sous sonication. La capacité d’adsorption des échantillons contenant différentes charges de déchets (5,10, 15 et 25% en poids) a été étudiée pendant 18 cycles de carbonatation / régénération dans des conditions similaires au processus de vaporeformage du glycérol avec adsorption de CO2 in-situ. Une amélioration significative de la stabilité cyclique
a été observée pour tous les adsorbants dopés; Cependant, l'échantillon contenant 10% en poids d'UGSO a démontré la capacité d’adsorption la plus élevée parmi tous les échantillons testés. Ce meilleur échantillon a ensuite été utilisé pour synthétiser un matériau hybride catalyseur-adsorbant CaO-NiO stabilisé par UGSO (chargé avec 20% de NiO), dont les performances ont été testées dans un réacteur de vaporeformage du glycérol avec adsorption de CO2 in-situ. Un
rendement en H2 de 96% a été obtenu dans la période de pre-breakthrough, qui a duré plus de
23
avec de l’UGSO par rapport au CaO pur et une bonne performance du matériau hybride catalyseur-adsorbant UGSO / CaO-NiO dans le processus de reformage.
Mots-clés: Adsorption de CO2; Oxyde de calcium; matériau hybride; procédé de
24
3.2 Abstract
In this work, a Fe/Mg-bearing metallurgical waste (upgraded slag oxide, UGSO) was, for
the first time, investigated as a stabilizer for increasing the cyclic stability of CaO-based
sorbents. The sorbents were prepared through the wet mixing of the ball-milled UGSO
particles with the limestone-derived calcium citrate under sonication. The sorption capacity
of samples containing different waste loadings (5, 10, 15, and 25 wt.%) was studied for 18
carbonation/regeneration cycles under conditions similar to the sorption-enhanced glycerol
steam reforming process. A significant improvement of the cyclic stability was observed
for all doped sorbents; however, the sample with 10 wt.% UGSO showed the highest
sorption capacity among all tested samples. This optimum sorbent was further used to
synthesize a UGSO stabilized CaO-NiO hybrid sorbent-catalyst material (20 wt.% NiO
loading), whose performance was tested in sorption-enhanced steam reforming of glycerol.
A H2 purity of around 95% was obtained in the pre-breakthrough period that lasted for
about 30 min. In summary, the results showed a better stability of UGSO stabilized
sorbents compared to pure CaO and a good performance of the CaO-UGSO10/NiO
sorbent-catalyst hybrid material in the sorption-enhanced reforming process.
Keywords: CO2 sorption; CaO sorbent; Industrial waste; Hybrid sorbent-catalyst
material; Sorption-enhanced glycerol steam reforming; High-purity hydrogen production.
25
3.3 Introduction
In today's competitive business environment, long-term success is undoubtedly not
possible without considering the concept of sustainability. From the perspective of a
sustainable environmental protection, an extremely important and century scale issue that
needs to be addressed is the global warming and climate change caused by anthropogenic
greenhouse gas emissions. Among the portfolio of options for dealing with this issue, CO2
capture and sequestration hold an important position in mitigating emissions from different
gas streams. Such strategy could provide the opportunity to pass sustainably the lengthy
transition from fossil fuels to renewable energy with low or carbon free emission. On the
other side, steam reforming of different hydrocarbons for the production of hydrogen (a
low emission energy carrier and/or chemical) is one of the processes where large amounts
of CO2 emissions are released [41]. Intensifying this process by simultaneously removing
CO2 in-situ while it is produced, called sorption-enhanced steam reforming (SESR), is a
newly emerged concept whose compelling benefits have been extensively reported in the
literature[12]. Besides CO2 removal, this integrated process has the advantage of the
production of high-purity H2 without any requirement of additional purification systems
[12].
Another tempting opportunity to achieve sustainability in chemical industry is converting
industrial wastes into value-added products. In this regard, using the waste glycerol
produced in the common biodiesel manufacturing process, as a raw material for H2
production by steam reforming, has gained researchers’ attention [5, 42-48]. About 10
wt.% of the vegetable oil processed in the biodiesel production through transesterification
26
approximately 3 Mt/year, while the predictable demand for commercial use is estimated to
be less than 0.5 Mt/year; this confirms the importance of its valorisation [46]. The
sorption-enhanced steam reforming of glycerol (SESRG) process encompasses the concepts of
environmental protection and responsible resource management in the best possible way.
By producing simultaneously high-purity H2 and concentrated CO2 flows from a renewable
and non-fossil fuel source and without any additional purification steps, it can help not only
to surmount one of the most important barriers in biodiesel industrial development, but
also to reduce the CO2 emissions. One of the key parameters of success in the SESRG
process approach is the choice of proper solid CO2 sorbent materials. The main required
characteristics of a suitable sorbent for such process are: high sorption capacity, fast
kinetics, and long-term stability in cyclic operation at high reaction temperatures and in the
presence of steam [12]. Among several developed materials, CaO-based sorbents
(synthetic or derived from natural sources such as limestone and dolomite) can be
mentioned as the most promising ones [3, 38, 49-55]:
( )
2 3 298CaO s +CO (g)CaCO (s) H = −175 kJ/mol (1)
However, to fit the needs of industrial applications, the instability of these kind of sorbents
(due to the sintering phenomena at high temperature, which leads to the loss of CO2 capture
capacity in long cyclic sorption/desorption operation) is still a challenge [56]. Several
approaches such as hydration [57], thermal treatment [58], and chemical pre-treatment [59,
60] have been proposed to deal with this drawback, despite the fact that some cause
secondary pollution and some others are energy-intensive and expensive [56]. Dispersing
an inert material, whose Tammann temperature is sufficiently high (such as Al O2 3, ZrO2
27
For example, Al-Mamoori et al. [61] investigated the effect of doping CaO with iron and
gallium and proved that the metal-stabilized CaO-based sorbents possessed a better sorbent
stability than bare CaO. Besides, Hu et al. [62] studied the stability of CexZr1-XO2 doped
CaO sorbent. Their results showed that CaZrO3 and perovskite structures were formed and
acted as a barrier to CaO agglomeration at high temperature. Dang et al. [63, 64]
investigated CaO stabilized with Ca12Al14O33 as a spacer to prevent CaO sintering. A ratio
of Ca/Al of 2.8 was found to lead to the best CO2 sorption stability. It was revealed that
Ca12Al14O33 was formed during the calcination stage and prevented the sintering process.
A bi-functional Ni-CaO-Ca12Al14O33 material was further successfully applied in the
SESP. In another study, Li et al. [33] applied a wet physical mixing of a CaO precursor
(
)
(
Ca CH COOH3 2)
with magnesium aluminate(
MgAl O spinel nanoparticles followed 2 4)
by calcination at high-temperature to produce a sorbent with better stability;2 4
CaO-MgAl O containing 32 wt.% spinel provided 34 wt.% CO2 capture capacity after 65
carbonation-regeneration cycles, while the capacity of CaO decreased from 68 to 20 wt.%.
It was explained that a physical separation between CaO particles byMgAl O spinel 2 4
prevented the fusion of particles and pore structure failure. Radfarnia et al. [65] have
showed that the formation of some products such as Ca-metal-O mixed oxides (e.g.,
3
CaZrO , Ca Al O ), as a result of the interaction between CaO and metal oxide x y z
precursors, contributed to a significant improvement of the efficiency of metal-stabilized
CaO sorbents. This behaviour was explained by a uniform dispersion of newly formed inert
materials in the CaO framework, which helps prevent the growth of CaO particles and
28
The metal oxides employed in the majority of current studies are synthetic materials, which
are prepared by mixing their precursors with calcium precursors, and there are very little
data available in the open literature on using cheap sources of oxides like mineral residues
as stabilizers for CaO-based sorbents. Considering the current context of low cost and
environmentally friendly carbon capture strategies, few recent works have reported the use
of coal fly ash (CFA) as inert material to improve the stability of CaO-based sorbents for
high temperature CO2 capture [56, 66]. The results by Chen and Khalili [56] who used a
CFA containing 23.78 wt.% alumina and 63.92 wt.% silica, confirmed the formation of a
microstructured Ca Al O12 14 33 and CaSiO3 that resulted in 3.8 times higher CO2 capture
capacity at the end of 30 cycles compared to pure CaO. Besides, Yan et al. [66] used
nanosilica derived from CFA (24.04 wt.% alumina and 53.96 wt.% silica) to enhance both
the cyclic CO2 uptake and sorption kinetics of CaO sorbents and the results showed an
increase in final CO2 uptake capacity by 155% over conventional CaO.
Currently, at Rio Tinto Iron and Titanium (Rio Tinto Fer et Titane, RTFT) company located
in Québec province of Canada, a residue called upgraded slag oxide (UGSO) is produced
and landfilled in a mining waste site [34]. The elemental analysis of as-received UGSO
residue, obtained by ICP-MS, revealed that iron (32 wt.%), magnesium (18 wt.%), and
aluminium (5 wt.%) are the main constitutive elements of the material and other elements
such as Ca, Mn, Ti, and V are present in much lesser amount [67]. The UGSO main
elements are crystalized in the form of magnesioferrite (
MgFe O
2 4) and hercynite (FeAl O
2 429
Considering this specific composition, the objective of this work is to investigate the
efficiency of this metallurgical residue as an inert material for improving the stability of
CaO-based sorbents in long-term carbonation/regeneration cycles. The synthesized sorbent
materials containing different UGSO/CaO ratios were characterized by X-ray diffraction
(XRD), scanning electron microscopy (SEM), energy dispersive X-ray (EDX) and N2
adsorption-desorption isotherms (BET). Thermogravimetric analysis was used to
investigate the sorption capacity and stability of the developed materials under the SESRG
simulated conditions. Finally, the sorbent with the best performance was used to synthesize
a hybrid CaO-Ni-based sorbent-catalyst material for SESRG process. The reducibility of
this hybrid material was determined by temperature-programmed reduction (TPR) analysis
and its morphology before and after SESRG test was characterized using transmission
electron microscopy (TEM).
3.4 Experimental
3.4.1 Material preparation
Canadian Newfoundland limestone was used in this work. The X-Ray fluorescence (XRF)
analysis of this material showed the presence of the following elements: CaO, 52.9%;
MgO, 0.27%; Na2O, 1.55%; SiO2, 0.27%; Al2O3, 0.08%; Fe2O3, 0.13%; K2O, 0.04%; loss
of ignition, 44.8% [27]. In order to remove the salt (NaCl) that may affect the sorption
capacity of the produced CaO sorbent, a pre-wash step of the as received limestone was
therefore essential. Next, a limestone acidification technique, developed by Radfarnia et
al. [27] was used: 1.035g CaO was treated by aqueous citric acid (Fisher, 99.9%) solution (pH ≈ 2.3) at 75 °C for 15 min. This mixture was vigorously stirred until obtaining a viscous
![Figure 1.1. Le marché du glycérol en Europe (par application) en kilo tonnes [11] Nous pouvons remarquer une croissance continue qui a comme résultat une baisse de son prix, ce qui permet de le rendre une matière première attrayante pour la fabrica](https://thumb-eu.123doks.com/thumbv2/123doknet/3188477.91068/16.918.201.716.134.398/glycérol-application-remarquer-croissance-continue-résultat-première-attrayante.webp)
![Figure 1.2. Différentes voies de réactions pour le procédé de vaporeformage du glycérol [14]](https://thumb-eu.123doks.com/thumbv2/123doknet/3188477.91068/17.918.141.778.312.965/figure-voies-réactions-procédé-vaporeformage-glycérol.webp)
![Figure 1.3. Phénomène du frittage de CaO [3].](https://thumb-eu.123doks.com/thumbv2/123doknet/3188477.91068/21.918.206.766.126.726/figure-phénomène-frittage-cao.webp)
![Figure 1.5. Représentation schématique des deux étapes de carbonatation [24]. Afin de limiter la diminution de la capacité d’adsorption du CO 2 par le CaO au cours des cycles, plusieurs stratégies ont été élaborées, comme la synthèse d’adsorbants synthé](https://thumb-eu.123doks.com/thumbv2/123doknet/3188477.91068/22.918.247.660.216.544/représentation-schématique-carbonatation-diminution-adsorption-stratégies-élaborées-adsorbants.webp)
![Figure 1.6. Profil de conversion du CaO avec et sans introduction de vapeur [25].](https://thumb-eu.123doks.com/thumbv2/123doknet/3188477.91068/23.918.235.687.502.764/figure-profil-conversion-cao-introduction-vapeur.webp)
![Figure 1.7. Image microscopique du matériau UGSO [34].](https://thumb-eu.123doks.com/thumbv2/123doknet/3188477.91068/26.918.280.638.336.582/figure-image-microscopique-du-matériau-ugso.webp)