UGT2B17 : marqueur de récidive biochimique du cancer
de la prostate après prostatectomie radicale
Mémoire
Luciana Melo Garcia
Maîtrise en médecine moléculaire - avec mémoire
Maître ès sciences (M. Sc.)
ii
UGT2B17 : marqueur de récidive biochimique du
cancer de la prostate après prostatectomie
radicale.
Mémoire de maitrise
Luciana Melo Garcia
Sous la direction de :
Éric Lévesque, directeur de recherche
Chantal Guillemette, codirectrice de recherche
Résumé
L’enzyme uridine glucuronosyltransférase 2B17 (UGT2B17) participe à l’inactivation des androgènes et régule l’exposition de la prostate à ces hormones. Ainsi, les variabilités génétiques de l’UGT2B17 peuvent modifier son activité, changer l’exposition de la prostate aux hormones et possiblement avoir un impact dans l’évolution du CaP. Nous avons étudié l’association des polymorphismes d’UGT2B17 liés à un gain de fonction (rs59678213C>T et rs6817882T>C) avec les niveaux circulants d’hormones et le risque de récidive biochimique chez 526 patients atteints d’un CaP localisé. L’effet de la surexpression d’UGT2B17 par tissue
microarray (TMA) sur le phénotype du cancer de la prostate a aussi été évalué dans 239
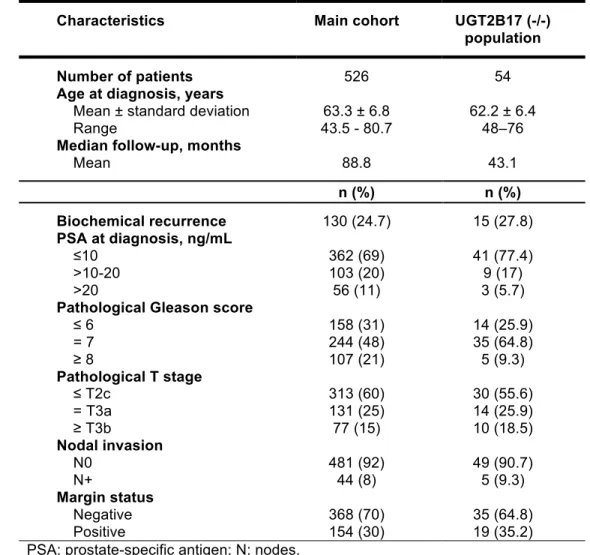
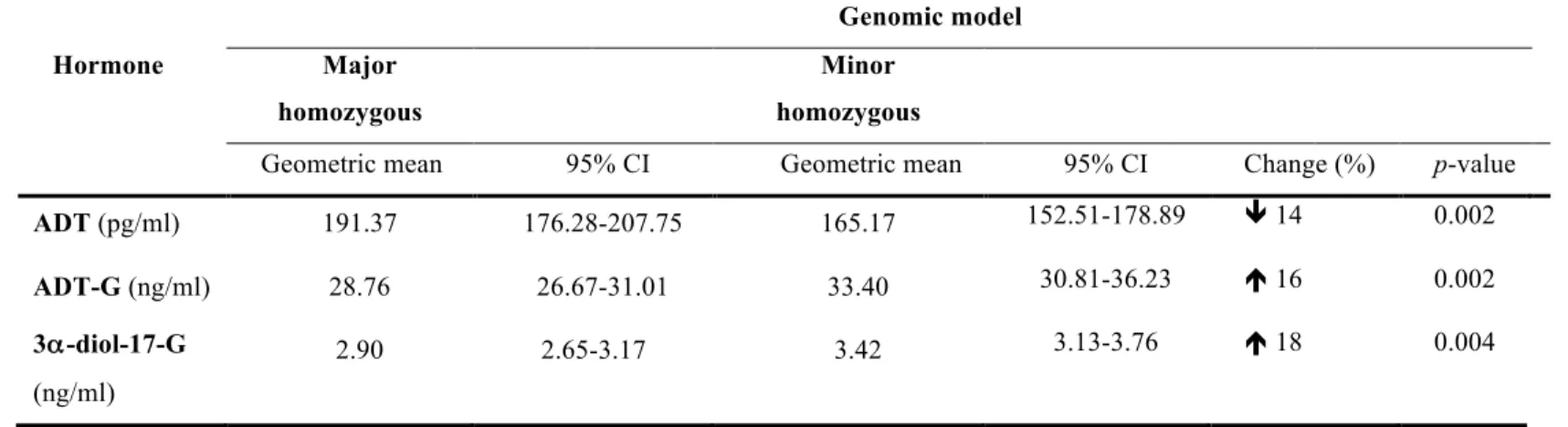
tumeurs primaires. De plus, les profils hormonaux ont été établis chez 48 patients ayant un CaP localisé et présentant une déficience complète du gène UGT2B17. Comparativement aux non-porteurs, les patients avec le génotype rs59678213TT présentent une réduction de 14% (p = 0.002) des niveaux circulants d’androstérone (ADT). En lien avec un gain de fonction de l’enzyme UGT2B17, ces patients présentent des niveaux plus élevés des métabolites d’androgènes glucuronides, l’ADT-G (16%; p = 0.002) et le 3α-diol-17-G (18 %; p = 0.005). Cette variante génétique est également associée à un risque accru de récidive biochimique (HR = 1.80;
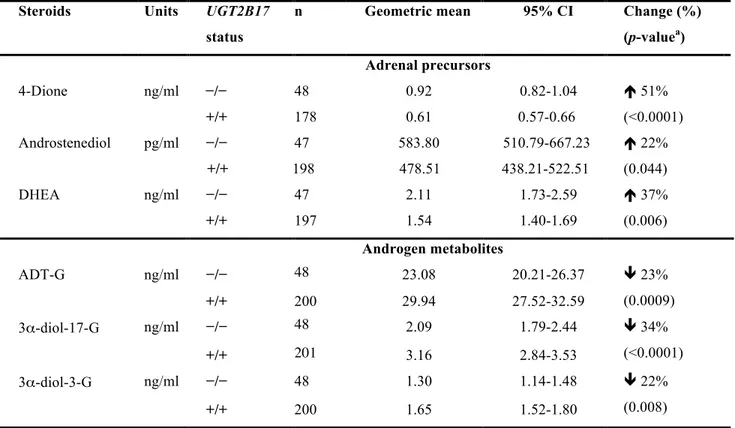
95% IC: 1.23 – 2.64; p = 0.002). Par ailleurs, les patients déficients en UGT2B17 présentent une accumulation des précurseurs surrénaliens (≥ 33 %; p < 0.006). Les patients surexprimant UGT2B17 au niveau tumoral présentent des niveaux abaissés d’antigène prostatique spécifique, des tumeurs plus petites et un taux plus faible de positivité des marges chirurgicales. L’expression des hauts niveaux tumoraux d’UGT2B17 semble être un facteur additionnel de mauvais pronostique (HR = 2.05; 95% IC: 1.04–4.37; p = 0.047). En conclusion, les variations génétiques d’UGT2B17 ainsi que la de surexpression tumorale de la protéine UGT2B17 engendrent des changements significatifs des taux d’hormones androgéniques et semblent avoir un impact sur la progression du CaP.
iv
Abstract
The enzyme uridine glucuronyltransferase 2B17 (UGT2B17) inactivates androgens and influences androgen exposure in the prostate. Thus, UGT2B17 genetic variability can change its activity as well as hormone levels and might have an impact in PCa progression. We have studied the association between UGT2B17 gain-of-function polymorphisms (rs59678213C>T and rs6817882T>C) with hormone levels and the risk of biochemical recurrence in 526 patients who had localized PCa after radical prostatectomy. The effect of UGT2B17 overexpression on PCa phenotype was also analysed in 239 primary tumours by tissue microarray (TMA). Besides, we have determined the hormonal profile of 48 patients with both localized PCa and UGT2B17 complete deletion. When compared to non-carriers, patients having rs59678213TT genotype presented a 14% reduction in androsterone (ADT) levels (p = 0.002). They also had increased levels of glucuronide metabolites such as ADT-G (16% reduction; p = 0.002) and 3α-diol-17-G (18 %; p = 0.005), which is in keeping with greater UGT2B17 activity. Carriers of this genetic variant were also at increased risk of biochemical recurrence (HR = 1.80;
95% CI: 1.23 – 2.64; p = 0.002). Furthermore, patients carrying UGT2B17 complete deletion had increased levels of adrenal precursors (≥ 33 %; p < 0.006). Tumoral overexpression of UGT2B17 was associated with decreased levels of PSA, smaller tumours and lower rates of positive margins. It was also an independent marker for biochemical recurrence (HR = 2.05; 95% CI: 1.04–4.37; p = 0.047). In summary, UGT2B17 genetic variants and tumoral overexpression of UGT2B17 significantly modify androgenic levels and seem to influence PCa progression.
Table de matières
Résumé ... iii
Abstract ... iv
Table de matières ... v
Liste des figures ... vi
Liste des abréviations ... vii
Remerciements ... viii
Avant-propos ... ix
Introduction ... 1
1. Le cancer de la prostate ... 11.1 L’épidémiologie ... 1
1.2 Les facteurs de risque ... 1
1.3 Les outils de dépistage ... 4
1.3.1 L’antigène prostatique spécifique (l’APS) ... 4
1.3.2 Le toucher rectal ... 5
1.3.3. L’antigène-3 du cancer de la prostate ... 6
1.4 La stratification pronostique ... 6
2. Les polymorphismes et le cancer de la prostate ... 9
3. Les androgènes et la prostate ... 11
4. Les UDP-glucuronosyltransférases ... 14
4.1 La famille des UGTs ... 14
4.1.1 La sous-famille UGT2B et la prostate ... 15
5. Les polymorphismes de l’UGT2B17 ... 17
6. Hypothèse ... 19
7. Les objectifs ... 20
Chapitre I. ... 21
Les changements génétiques de l’UGT2B17 et leur influence sur la progression du
cancer de la prostate ... 21
Résumé ... 22Abstract ... 24
Chapitre II. ... 46
L’UGT2B28 : rôle dans le métabolisme androgénique et la progression du cancer de
la prostate ... 46
Résumé ... 47Abstract ... 49
vi
Liste des figures
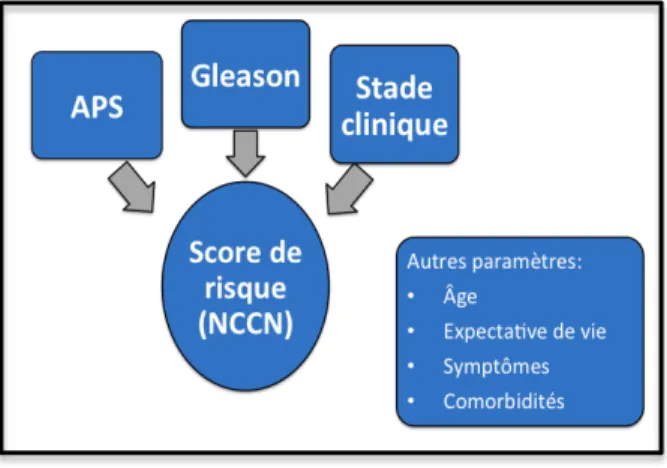
Figure 1. La prise en charge d’un patient présentant un cancer de la prostate doit être basé non seulement sur des critères objectifs comme ceux proposés par le NCCN mais aussi sur l’âge, les symptômes, les comorbidités et les volontés du patient.
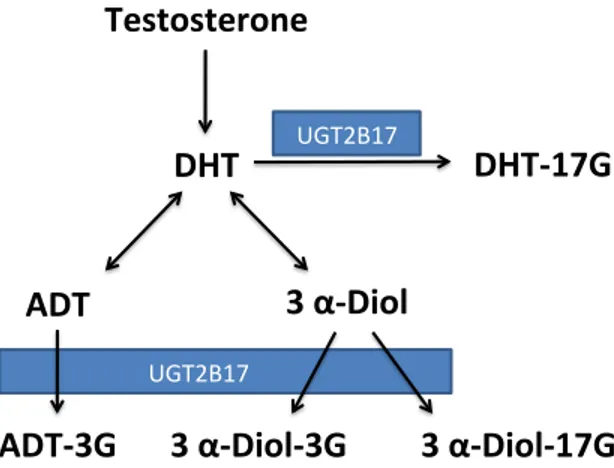
Figure 2. Schéma des voies de synthèse de la testostérone et de la DHT. Figure 3. Métabolisme des androgènes par l’enzyme UGT2B17.
Liste des abréviations
ADN Acide désoxyribonucléique APS Antigène prostatique spécifique ARN Acide ribonucléique
CaP Cancer de la prostate CYP17A1 Cytochrome P450 17A1 DHT Dihydrotestostérone FOX1A Forkhead box A1
HSD17B2 17 β — hydroxystéroïde déshydrogénase type 2 IC Intervalle de confiance
IMC Index de masse corporelle
GnRH Hormone de libération des gonadotrophines hypophysaires GWAS Genome wide association studies
NCCN National Comprehensive Cancer Network
OMS Organisation mondiale de la santé PCA3 Prostate cancer antigen-3
RA Récepteur androgénique
ROC Receiver curve operator
RR Risque relatif
SNP Single nucleotide polymorphism
SRD5A Alpha-réductase
UGT Uridine-diphospho-glucuronosyltranférases
viii
Remerciements
Dans cette session, j’aimerais adresser mes sincères remerciements aux personnes qui m’ont aidé à accomplir les tâches reliées à ma maitrise.
Pour commencer, je souhaite souligner le rôle essentiel de « ma famille canadienne » dans ce processus. Jérôme, Carla et Andrea, merci énormément pour votre disponibilité et votre patience lors de moments difficiles. Jérôme, mon fidèle compagnon, ami et amoureux, je n’ai pas de mots pour exprimer ma gratitude à ton support lorsque des moments de stresse et de fatigue. Sans mentionner le temps que tu as dédié à lire longue et minutieusement non seulement le corps de mon mémoire, mais aussi toutes les applications à mes demandes de bourses. Carla et Andrea, mes formidables amies, vous êtes des exemples de force et d’adaptation à la dure vie d’immigrant. Vos mots d’encouragement et nos belles discussions autour d’une table ont rendu tous les moments difficiles moins pénibles. La vie m’a bénie, tout aurait été plus ardu sans vous.
Je ne pourrais pas m’empêcher de mentionner ma « vraie famille ». Ma mère et mon père, vous êtes mon havre de paix, l’endroit où je me tourne lors des moments de tempête. Par ailleurs, vous m’avez montré que tout est atteignable dans la vie, il faut tout simplement être vaillant et honnête envers soi même ainsi qu’aux gens autour de nous. Merci d’être des parents exemplaires et toujours disponibles. Dan, la vie n’aurait pas pu me consacrer un meilleur frère. Tu es capable de « transformer le citron amer en une limonade sucrée », toujours souriant et d’une humeur impeccable quand la vie t’amène des adversités. Ta présence en soi me réjouit, il n’y a rien de plus satisfaisant que de passer du temps avec toi. Dan, « Pai » et « Mãe », merci de votre fidèle présence dans ma vie.
J’aimerais aussi remercier Chantal et Éric, mes superviseurs de maitrise, pour l’opportunité d’apprendre et de travailler avec eux. La période où je vous ai côtoyés au laboratoire m’a donné l’envie pour poursuivre une carrière en recherche. Votre dévouement et votre passion sont inspirants. Éric, vous avez été non seulement mon superviseur de maitrise, mais vous m’avez guidé dans mes choix de carrière ce qui m’a donné le courage de partir de Québec pour accomplir ma résidence en hématologie à l’Université de Toronto ainsi que ma formation future au MD Anderson Cancer Center. Chantal, comme femme forte, brillante et accomplie, vous êtes un modèle de rôle. Finalement, je vous remercie, Chantal et Éric, de votre patience en ce qui concerne mes tâches cliniques parallèles aux tâches de maitrise ce qui a rendu l’écriture du mémoire plus étendue que d’habitude.
Avant-propos
Ce mémoire de maitrise, présenté à la Faculté de médecine de l’Université Laval et intitulé « UGT2B17 : marqueur de récidive biochimique du cancer de la prostate après prostatectomie radicale » est rédigé sous forme d’insertion d’articles. Je spécifierai dans la présente session la contribution de coauteurs ainsi que ma contribution à chacun des articles intégrés dans ce mémoire.
Le premier article, dont le titre est « Germline and somatic alterations in UGT2B17, hormone levels and prostate cancer biochemical failure », se trouve dans le Chapitre I. Comme l’auteure principale, j’ai participé aux analyses génétiques et statistiques en déterminant de divers modèles génétiques appliqués dans cet article. J’ai aussi travaillé sur l’écriture et la révision du manuscrit. Sylvie Desjardins, Lyne Villeneuve, Éric Allain et Anaïs Belledant ont contribué aux analyses génétiques. La technique de « tissue microarray » (TMA) a été réalisée par Hélène Hovington, Hervé Brisson et Véronique Turcotte. Patrick Caron, Véronique Turcotte et Chantal Guillemette ont été responsables des mesures des hormones. Le recrutement des patients a été effectué par Yves Fradet et Louis Lacombe. Mon directeur et ma codirectrice de maitrise, Chantal Guillemette et Éric Lévesque, ont supervisé et conceptualisé le projet. De plus, ils ont réalisé l’analyse ainsi que l’interprétation des résultats, et ont participé à l’écriture de l’article scientifique. Tous les auteurs ont contribué à la révision de ce manuscrit. Nous travaillons actuellement sur la révision de ce manuscrit ce qui rendra possible sa soumission et publication dans un journal scientifique.
Le Chapitre II de ce mémoire de maitrise est composé de l’article scientifique « The UGT2B28 Sex-Steroid Inactivation Pathway is a Regulator of Steroidogenesis and Modifies Risk of Prostate Cancer Progression ». Cet article est intégré dans ce mémoire de façon identique à la version publiée dans le journal « European Urology » en 2015 et il appartient à la thèse de doctorat de Anaïs Belledant, première auteure. J’ai participé des analyses génétiques et statistiques de ce manuscrit. Tous les auteurs ont contribué à la révision de ce manuscrit. Comme coauteurs de cet article, Hélène Hovington et Hervé Brisson ont effectué la technique de « tissue microarray ». Les mesures hormonales ont été réalisées par Patrick Caron et
1
Introduction
1. Le cancer de la prostate
1.1 L’épidémiologie
Le cancer de la prostate (CaP) est une maladie fréquente dans le monde. En 2012, il a été le deuxième cancer le plus diagnostiqué et la cinquième cause de mortalité par cancer chez les hommes (1). On observe une variabilité de son incidence dans le monde. Notamment, une étude épidémiologique récente a démontré que les pays comme le Canada, les États-Unis, la Nouvelle-Zélande et l’Australie présentent les incidences les plus élevées de cancer de la prostate tandis que les pays asiatiques en ont des incidences beaucoup plus faibles (2). Cette hétérogénéité géographique peut être attribuée aux différences ethniques, à l’exposition aux divers facteurs environnementaux, ainsi qu’aux diverses méthodes de dépistage et de diagnostic utilisées pour le cancer de la prostate à travers le monde. En outre, les données de l’étude CONCORD-2 ressortent la variabilité mondiale de la survie en 5 ans de ce cancer (3). Par exemple, elle peut atteindre au-delà de 90 % dans certains pays comme le Canada, les États-Unis et le Brésil tandis qu’en Libye ou en Mongolie, elle ne s’élève qu’à 40 % (3). Les diverses méthodes de dépistage ainsi que des prises en charge différentiées justifieraient potentiellement cette disparité. Au Canada, le cancer de la prostate est celui le plus souvent diagnostiqué chez les hommes et représente quasi 21 % des nouveaux cas de cancer (4,5). L’homme canadien présente ainsi une probabilité de 14.3 % de développer un cancer de la prostate durant sa vie (4). Cette maladie engendre également 10 % de tous les décès par cancer les hommes au Canada (4,5).
1.2 Les facteurs de risque
Les facteurs de risque du cancer de la prostate peuvent être divisés en deux groupes distincts : les facteurs de risques intrinsèques (non modifiables) et environnementaux (6).
Parmi les facteurs de risque intrinsèques, nous trouvons l’âge, l’ethnie, les facteurs familiaux ou génétiques et l’exposition aux hormones endogènes (6). Il existe une relation étroite entre le développement du cancer de la prostate et l’âge. En effet, moins de 0.1 % des patients atteints de ce cancer sont sous les 50 ans et 85 % ont plus de 65 ans, l’âge moyen au diagnostic étant entre 72 — 74 ans (7, 8). L’ethnie est aussi un facteur qui influence le développement du cancer de la prostate. Aux États-Unis, par exemple, l’incidence du cancer de la prostate est plus
élevée chez les hommes d’origine africaine et plus basse chez hispaniques (9), les Indiens et les Pakistanais (10) lorsqu’ils sont comparés aux individus d’origine caucasienne.
Depuis plusieurs années, des études ont démontré l’importance de la génétique et des facteurs familiaux dans le développement du cancer de la prostate (11). Toutefois, le rôle précis des variations génétiques qui amplifient le risque de cette maladie demeure controversé. Cela survient vraisemblablement puisque le modèle génétique de susceptibilité du cancer de la prostate est complexe et s’appuie sur des mutations fréquentes qui ont une faible pénétrance (11). En outre, il est reconnu que les hommes ayant un parent de premier degré porteur d’un cancer de la prostate ont un risque relatif [RR] = 2.48; IC 95 % : 2.25 — 2.74, lorsqu’ils sont comparés à ceux qui n’ont pas d’histoire de cancer de la prostate dans leurs familles (6). De plus, si le membre de la famille affecté est le frère, le risque relatif est de 3.14 (RR = 3.14; IC 95 % : 2.37 — 4.15) (12). Une étude scandinave a démontré que les facteurs héréditaires pourraient contribuer jusqu’à 42 % au risque de développer un cancer de la prostate et ce taux était le plus élevé parmi tous les cancers étudiés (13). Comme mentionné précédemment, plusieurs polymorphismes ayant une faible pénétrance ainsi qu’une fréquence élevée augmentent le risque de cancer de la prostate (6). Par ailleurs, une étude récente a identifié 97 gènes mutés de façon récurrente chez des patients ayant un cancer de la prostate, incluant des gènes impliqués dans les voies de signalisation de la régulation du cycle cellulaire, de la réparation de l’ADN, des régulateurs épigénétiques et des processus de splicing (14). Nonobstant le fait que leur valeur isolée soit probablement non significative, le risque de développement du cancer de la prostate s’accroit de façon multiplicative lorsque ces polymorphismes sont retrouvés chez un même individu (15). Leur identification pourrait donc avoir une implication clinique et aider dans le dépistage du cancer de la prostate. Par ailleurs, quelques rares mutations dans des gènes précis augmentent de façon importante le risque de ce cancer. Cela est le cas, par exemple, du gène BRCA2. Des études ont démontré que les porteurs de mutations dans ce gène présentent non seulement un risque accru de développer un cancer de la prostate (16, 17), mais ont aussi des maladies plus agressives (18).
Le rôle des androgènes dans le développement du cancer de la prostate a été investigué antérieurement dans plusieurs études observationnelles (19-33). Les résultats trouvés furent
3
proposé un modèle de saturation dans lequel la réponse de la prostate est optimale lorsqu’exposée aux concentrations physiologiques d’androgènes. Ainsi, la prostate serait plus sensible à la stimulation hormonale, lorsqu’exposée aux petites quantités de cette hormone tandis que l’exposition aux concentrations supra-physiologiques n’engendrait pas un surplus de stimulation (35). Cette théorie s’accorde adéquatement avec les trouvailles des études qui n’ont pas démontré une corrélation directe entre le niveau androgénique et le développement du cancer de la prostate (34).
D’autre part, les facteurs environnementaux ayant un impact sur le développement du cancer de la prostate incluent le tabagisme, l’exposition aux rayons ionisants, ainsi que le poids corporel et la pratique d’activité physique. Le tabagisme est un facteur modifiable qui semble être associé non seulement au risque de développement du cancer de la prostate, mais aussi sa mortalité (36). Prueitt et coll. ont démontré récemment que les fumeurs présentent un profil inflammatoire distinct des non-fumeurs qui pourrait être associé à la progression de la maladie et au développement de métastases (37). Ces données concordent avec d’autres études qui montrent que le tabagisme est associé à l’agressivité de la maladie (38) et augmente le risque de récidive (39, 40) ainsi que la mortalité (41-43) reliée au cancer de la prostate.
Contrairement au tabagisme, les données dans la littérature par rapport aux rayons ionisants sont moins consistantes. Dans une étude britannique, les individus exposés aux rayons ionisants lors des procédures diagnostiques avaient un risque accru de développer un cancer de la prostate (44) tandis que, dans une autre étude, les patients soumis à des traitements de radiothérapie pour un carcinome hépatocellulaire ne présentaient pas un risque élevé de cancer de la prostate (45). Dans le cas des rayons ionisants ultraviolets (UV), les données ne sont pas moins équivoques. Des études plus anciennes soulevaient l’hypothèse d’une relation inverse entre l’exposition aux rayons UV et le risque du cancer de la prostate (46-48). Toutefois, une étude australienne récente a évoqué la possibilité de risque accru de cancer de la prostate chez les individus exposés aux rayons UV (49). Ainsi, d’autres études sont nécessaires pour établir le rôle des rayons ionisants dans le développement de ce type de cancer.
L’obésité est un autre facteur de risque modifiable associé au cancer de la prostate. Toutefois, une méta-analyse récente qui incluait 17 études de cohorte pour un total de 3 569 926 individus n’a pas réussi à démontrer une association entre l’obésité et l’incidence du cancer de la prostate (RR = 1.00; IC 95 % : 0.95 — 1.06) (50). Par contre, les individus qui avaient un index de masse corporelle élevée (IMC) présentaient une maladie plus agressive (RR = 1.14; IC 95 % : 1.04 — 1.25) ainsi qu’un plus haut taux de mortalité (RR = 1.24; IC 95 % : 1.15 — 2.33)
(50). Ma et coll. ont démontré que non seulement les hommes obèses présentaient un risque élevé de mortalité lié au cancer (IMC ≥ 30 kg/m2) (HR =2.66; IC 95 % : 1.62 — 4.39), mais aussi
ceux ayant un surplus de poids (IMC entre 25 — 29.9 kg/m2) (HR = 1.47; IC 95 % : 1.16 —
1.88) (51). L’obésité semble également influencer l’agressivité de la maladie puisque les individus obèses présentent un stade pathologique plus avancé et un score de Gleason plus élevé au diagnostic (52). Ce phénomène pourrait être expliqué par des changements endogènes engendrés par l’obésité comme l’inflammation chronique ainsi que les modifications hormonales et métaboliques (53).
D’ailleurs, l’association entre le niveau d’activité physique et l’incidence du cancer de la prostate est un sujet controversé dans la littérature (54-56). Le niveau d’activité physique semble être un facteur protecteur dans la progression du cancer de la prostate. Notamment, Tai et coll. ont démontré une association négative entre la pratique régulière d’activité physique et la mortalité reliée à ce cancer (56). De plus, une étude de cohorte canadienne récente ayant 830 participants a révélé que les patients pratiquant des exercices réguliers présentaient une réduction de la mortalité reliée au cancer (57). L’étude ENGAGE, une étude randomisée australienne, a également démontré l’effet positif de l’activité physique lors du traitement du cancer de la prostate et son impact dans la qualité de vie de ces patients (58).
1.3 Les outils de dépistage
Il n’y a pas de test diagnostique unique pour du cancer de la prostate et l’approche varie selon le contexte clinique de chaque patient. Dans un extrême, ce diagnostic peut être posé chez un individu asymptomatique ayant subi un test de dépistage par le dosage de l’antigène prostatique spécifique (APS) ou par un toucher rectal, tous deux suivis d’une biopsie de la prostate. À l’autre extrême, un patient peut se présenter pour des douleurs osseuses secondaires à un cancer de la prostate métastatique. Chez ce dernier, les niveaux d’APS seront généralement élevés et le diagnostic devra être confirmé par des examens d’imagerie tels que la scintigraphie osseuse suivie d’une biopsie de la prostate ou d’un site métastatique. L’utilisation des outils de dépistage tels que l’APS, le toucher rectal et l’antigène-3 du cancer de la prostate sera abordée dans le présent document.
5
dans le diagnostic précoce de ce cancer a été démontrée depuis les années 1990 (60). Toutefois, des études récentes ont démontré que d’une part, approximativement 20 % des individus ayant des niveaux d’APS considérés comme normaux (< 4 ng/ml) présentent un cancer de la prostate et que d’autre part, quelques-uns ayant des niveaux élevés plasmatiques de ce biomarqueur ne l’ont pas (61, 62). Ainsi, malgré son importance dans le diagnostic précoce et dans la diminution de la mortalité par cancer de la prostate observée depuis les années 90, l’utilisation de l’APS dans le dépistage de ce cancer est actuellement controversée puisqu’entraîne souvent un traitement agressif et superflu des patients présentant une maladie indolente et à bas risque de progression (63). L’étude European Randomised Study of
Screening for Prostate Cancer (ERSPC Trial) a dévoilé, après 13 ans de suivi, une diminution
significative de la mortalité par cancer de la prostate lorsque le dosage d’APS est utilisé dans son dépistage (64). Toutefois, l’étude américaine Prostate Cancer Screening in the Randomized
Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial (PLCO Trial) n’a pas décelé des
résultats similaires et le dépistage par l’APS n’a pas été associé à une diminution de la mortalité par cancer de la prostate (65). Finalement, une méta-analyse sur le dépistage du cancer de la prostate par le dosage d’APS n’a pas démontré de diminution de la mortalité par ce cancer (66). Depuis ces derniers résultats, le débat sur l’utilisation systématique du dosage d’APS dans le dépistage du cancer de la prostate est ouvert. Dans ce contexte, plusieurs entités gouvernementales se sont prononcées contre le dépistage du cancer de la prostate par le dosage d’APS à cause des risques reliés au traitement des patients ayant un bas risque de progression et de décès par ce type de cancer (67, 68). Une récente étude vient de révéler que, depuis les nouvelles recommandations, les médecins de première ligne aux États-Unis prescrivent moins de dosage d’APS à leurs patients (69). Par contre, divers spécialistes croient que cet outil de dépistage ne devrait pas être complètement abandonné (70).
1.3.2 Le toucher rectal
Le toucher rectal est une manœuvre pratiquée lors de l’examen physique qui vise à la détection de nodules et d’indurations dans la prostate. Avant l’utilisation de l’APS comme test de dépistage, le toucher rectal était considéré comme le test d’excellence (« gold standard ») (71) se trouvant le seul outil de détection précoce de ce type de cancer (72). Toutefois, au fil des années, son utilité dans le dépistage et le diagnostic du cancer de la prostate a été contestée. Selon des données de la littérature, il est possible qu’aucune altération ne soit détectée par le toucher rectal même dans des cas de cancer de la prostate avancé et létal (73). Une étude a démontré une grande variabilité inter-observateur lors de la réalisation du toucher rectal visant
la détection du cancer de la prostate même parmi des spécialistes (71). Récemment, on a révélé que les omnipraticiens américains utilisent de moins en moins le toucher rectal comme outil diagnostique du cancer de la prostate (69). Par contre, d’autres études ont démontré que le toucher rectal seul ou en combinaison avec le dosage d’APS peut être utile dans le diagnostic des cancers de la prostate potentiellement agressifs (72, 74).
De nos jours, malgré l’incidence et la mortalité élevées reliées au cancer de la prostate, on méconnait l’utilisation idéale des outils diagnostiques facilement disponibles tels que le dosage de l’APS et le toucher rectal. Dans une cohorte de 1551 patients qui avaient une indication d’avoir une biopsie de la prostate selon les résultats de l’APS ou du toucher rectal, seulement 606 (39.1 %) avaient une biopsie positive (75). Au lieu de proscrire leur utilisation, la solution à cette impasse serait probablement le développement de moyens efficaces de stratification des patients. Dans ce contexte, les nouveaux marqueurs pronostiques tels que les biomarqueurs génétiques s’avèrent une option avantageuse principalement si utilisés en association aux marqueurs cliniques et biologiques disponibles actuellement.
1.3.3. L’antigène-3 du cancer de la prostate
L’antigène-3 du cancer de la prostate (prostate cancer antigen-3 ou PCA3) est un nouveau biomarqueur urinaire du cancer de la prostate (76). En 1999, Bussemakers et coll. ont démontré que le PCA3, un ARN non codant présent dans le chromosome 9q21-22, est surexprimé dans le tissue prostatique cancéreux lorsque comparé aux tissues prostatiques normaux (77). De plus, il n’est pas trouvé dans les tissus non prostatiques ce qui augmente davantage sa spécificité (77). D’autres études ont par la suite confirmé ces trouvailles (78-80). Dans l’étude réalisée par Tinzl et coll., le PCA3 urinaire a eu une performance nettement supérieure à l’APS total sérique en terme de sensibilité, spécificité, valeurs prédictives positive et négative et l’aire sous la courbe ROC (receive operator curve) était 0.87 pour ce test (80). De plus, l’utilisation du PCA3 augmente la performance des modèles de prédiction du cancer de la prostate ce qui peut diminuer jusqu’à 55 % le nombre de biopsies infructueuses (81). Une autre étude a démontré sa valeur dans la surveillance active des patients ayant un cancer de la prostate de bas grade (82). Ainsi, le PCA3 semble être un biomarqueur prometteur dans le dépistage, diagnostic et
7
son pronostic. Pour ce faire, on utilise le système proposé par le National Comprehensive
Cancer Network (NCCN) qui classifie les patients en cinq groupes pronostiques selon la
combinaison de différents critères clinico-pathologiques (83). Par ailleurs, d’autres variables comme l’âge des patients, leurs comorbidités et leur volonté doivent aussi être considérées dans le processus (Figure 1).
Le système Tumor Node Metastasis (TNM) est la classification de l’étendue anatomique de la maladie basée soit sur le toucher rectal lors de l’examen physique (stade clinique) soit sur l’étude pathologique après la prostatectomie (stade pathologique). La lettre « T » se réfère à l’étendue locale de la tumeur dans la prostate tandis que les lettres « N » et « M » font référence à l’atteinte des ganglions régionaux et à la présence de métastases à distance, respectivement (84).
En outre, le niveau plasmatique d’APS au moment de la présentation initiale fournit des informations pronostiques et aide le clinicien dans la stratification des patients. Dans la pratique clinique, le dosage d’APS est un biomarqueur utilisé de façon routinière dans l’évaluation pronostique du cancer de la prostate (85). Des études ont démontré que le niveau d’APS initial présente une bonne corrélation avec l’agressivité, les caractéristiques pathologiques et la progression de la maladie (86). De cette façon, le système de NCCN incorpore le dosage d’APS.
Figure 1. La prise en charge d’un patient présentant un cancer de la prostate doit être basé non seulement sur des critères objectifs comme ceux proposés par le NCCN, mais aussi sur l’âge, les symptômes, les comorbidités et les volontés du patient.
L’autre variable utilisée dans le système NCCN est le score de Gleason, une classification de la gradation pathologique de la tumeur dont l’échantillon provient soit de la biopsie soit de la
prostatectomie. Ce système de gradation relativement simple et reproductible a été déployé par Dr Donald Gleason en 1966 (87) et demeure un élément fondamental dans la prise en charge des patients atteints du cancer de la prostate (88).
Diverses études ont constaté au fil des années la bonne corrélation entre ce score et le pronostic des patients ayant cette maladie. Il se base sur l’architecture histologique du tissu prostatique pouvant varier d’un score de 6 (3+3) à 10 (5+5) d’un échantillon plus différentié jusqu’à un tissu présentant une pauvre différenciation, respectivement (89). Les chiffres entre les parenthèses représentent la combinaison des deux patrons le plus souvent rencontrés lors de l’étude pathologique, le premier étant le plus fréquent et le deuxième étant le second en fréquence (89).
Dans le but de l’adapter aux pratiques cliniques actuelles, ce système a souffert plusieurs modifications depuis sa conception (89). Récemment, l’Organisation mondiale de la santé (OMS) a publié la nouvelle classification pathologique du cancer de la prostate (90). Les experts proposent une manière inédite d’appliquer le score de Gleason par le groupement des chiffres selon leur agressivité, par exemple, le groupe 1 est composé de tous les scores de Gleason plus bas ou égal à 6 et exprime un excellent pronostic (90). Le changement incorpore les récentes trouvailles scientifiques en se servant des associations statistiques entre les différents groupes et leurs pronostics respectifs (90). Cela simplifie l’interprétation du score de Gleason et facilite la prise en charge des patients par les cliniciens.
Le système NCCN dispose d’une bonne corrélation avec le risque de récidive biochimique et la survie sans progression du cancer de la prostate (91). Cependant, il est imparfait et fréquemment des patients ayant une maladie à bas risque de progression sont soumis à des traitements invasifs dont la pertinence est discutable (63). D’un autre côté, il est difficile de prédire l’évolution du cancer de la prostate chez les patients ayant une maladie à risque intermédiaire (92). La difficulté de prédire l’évolution du cancer de la prostate est entre autres engendrée par sa grande hétérogénéité (92). Il est connu que le cancer de la prostate est une maladie multifocale présentant diverses sous populations de cellules ainsi que des anormalités histologiques et moléculaires variées (92). Cette variabilité est retrouvée non seulement d’un
9
cancer de la prostate. Ils ont pour but d’aider les cliniciens et les patients dans la prise de décision quant au traitement selon leur risque de récidive (94). Les nomogrammes présentent des caractéristiques prédictives supérieures en plus d’être plus précis lorsque comparés à d’autres outils de prédiction pronostique (95). Notamment, le University of California, San
Francisco - Cancer os Prostate Risk Assessment (l’UCSF - CAPRA) est un nomogramme utilisé
lors du diagnostic et avant le traitement du cancer de la prostate localisé (96). Pour prédire le risque de récidive, ce score se base sur 5 variables : l’âge du patient, le niveau d’APS, le score de Gleason, le score clinique T et le nombre de biopsies positives. Il a été validé dans différentes cohortes aux États-Unis et en Europe et a démontré une haute précision dans la prédiction de récidive, du développement de métastases et de la mortalité reliée au cancer (96). Un nouveau score, le CAPRA-S, a été développé en utilisant des données post chirurgicales pour les patients ayant subi une prostatectomie (96). Le SelectMDx® est également un outil
prédictif qui joint des facteurs de risques cliniques et des biomarqueurs urinaires, les ARNs messagers DLX1 (un marqueur de progression du cancer de la prostate) et HOXC6 (un marqueur de prolifération cellulaire) (97). Son objectif est d’estimer la probabilité que le patient soit atteint d’un cancer cliniquement significatif (Gleason ≥ 7) à la biopsie. Le SelectMDx® aide les cliniciens à déterminer si les patients ayant un APS élevé et/ou un toucher rectal anormal devraient subir une biopsie de la prostate (97). Son utilisation résulte en une diminution du nombre des biopsies et réduit nombre de diagnostics de cancer de la prostate cliniquement non significatifs (97). ConfirmMDx® est aussi un nouveau outil prédictif récemment introduit en
clinique qui permet une stratification pronostique plus personnalisée des patients atteint d’un cancer de la prostate (98).
Pour toutes les raisons énoncées précédemment, une nouvelle approche de stratification pronostique utilisant des marqueurs qui s’appuient sur la biologie tumorale s’impose pour permettre une prise en charge davantage personnalisée et un traitement individualisé des patients ayant un cancer de la prostate.
2. Les polymorphismes et le cancer de la prostate
Un biomarqueur est une molécule mesurable dans les fluides biologiques ou tissus et qui permet d’identifier un processus normal ou pathologique (61,85). Il doit idéalement être spécifique et avoir une bonne corrélation avec le statut actuel ou futur de la maladie en question (85). Ce type de marqueur, par conséquent, peut être utilisé dans le dépistage ou dans l’évaluation pronostique d’une maladie ainsi que dans la réponse d’un individu à un traitement (85).
Les polymorphismes (single nucleotide polymorphisms ou SNPs) constituent les variations génétiques les plus fréquentes du génome humain et se caractérisent par le changement d’une paire de base dans la séquence de nucléotides. En plus d’être fréquents, ils sont facilement détectables par les techniques de génotypage et sont des variations génétiques stables (99). Il est aussi important de remarquer que les polymorphismes peuvent influencer de diverses façons l’expression génomique. Par exemple, un polymorphisme peut être présent dans l’exon changeant ainsi la séquence d’acides aminés et, par conséquent, la fonction des molécules transcrites. Également, lorsque retrouvé dans une région non-codante, il peut modifier des zones régulatrices comme le promoteur d’un gène, altérer la séquence des microARNs impliqués dans l’expression génomique ou même influencer d’autres mécanismes épigénétiques comme l’acétylation de l’ADN et sa disponibilité à la transcription. Grâce à leur polyvalence et à leur détection facile, les polymorphismes sont de plus en plus explorés non seulement comme biomarqueurs diagnostiques et pronostiques, mais commencent aussi à avoir un rôle dans le domaine de la pharmacogénomique.
Il est connu que le développement du cancer de la prostate est influencé de façon significative par la prédisposition génétique (6,11-13). Comme discuté dans la section Facteurs de risque, le modèle de susceptibilité de ce cancer est complexe et constitué probablement par des variations génétiques fréquentes ayant une faible pénétrance (6). Cependant, ces variations peuvent avoir un impact important dans le développement du cancer de la prostate lorsqu’elles sont héritées conjointement (6). À l’heure actuelle, les données traitant de l’association entre différents polymorphismes et le risque du cancer de la prostate sont de plus en plus nombreuses et quasi 100 différents polymorphismes ont été identifiés comme ayant une association avec le risque de développement du cancer de la prostate (11,100-111). Notamment, Olama et coll. ont réalisé une méta-analyse avec 87 040 individus d’origine caucasienne qui a permis l’identification de 23 nouveaux loci associés au risque de développement du cancer de la prostate (101). Une autre étude réalisée par le même groupe a démontré que les loci associés au risque correspondent approximativement à 39 % du risque relatif relié à l’histoire familiale (112).
11
distinguer les patients à bas et à haut risque (102). Une autre étude réalisée par Szulkin et coll. a également mis en évidence l’applicabilité des polymorphismes dans le dépistage du cancer de la prostate en démontrant que l’addition des loci associés au risque améliore la précision des scores de risque polygénique (109). Les scores de risque polygéniques en combinaison aux critères cliniques permettront ainsi éventuellement aux cliniciens d’effectuer le dépistage de cette maladie selon la prédisposition génétique de chaque individu.
Par ailleurs, les polymorphismes peuvent servir de marqueurs pronostiques et contribuer à la stratification des patients ayant un cancer de la prostate. Cependant, leur capacité de prédire l’évolution de ce cancer est encore un domaine incertain et demeure un champ actif de recherche. Plusieurs études ciblant les polymorphismes des gènes responsables du métabolisme androgénique ont démontré une association avec le risque de progression du cancer de la prostate. Cela est notamment le cas de certaines variations génétiques de l’enzyme cytochrome P450 17A1 (CYP17A1) (113) ainsi que de l’enzyme 17 β — hydroxystéroïde déshydrogénase type 2 (HSD17B2) (114), les deux étant impliquées dans la biosynthèse et la biotransformation des androgènes. Les polymorphismes de l’enzyme alpha-réductase (SRD5A), responsable de la transformation de la testostérone en dihydrotestostérone, peuvent aussi influencer la progression du cancer de la prostate (115). Notamment, Audet-Walsh et coll. ont mis en évidence des associations positives entre l’évolution du cancer de la prostate et certains polymorphismes tant de l’isoforme SRD5A1 que de l’isoforme SRD5A2 (115). Il est intéressant de noter que des changements génétiques des enzymes impliquées dans le métabolisme estrogénique semblent également exercer une influence sur la progression du cancer de la prostate (8). Par ailleurs, le génotypage de larges portions du génome par les Genome Wide Association Studies (GWAS) permet la vérification de l’association entre divers polymorphismes et l’agressivité du cancer de la prostate. Malheureusement, les études du type GWAS jusqu’à présent n’ont pas été capables d’établir les loci reliés à l’agressivité de cette maladie et leurs résultats n’ont pas été reproductibles (103,116-119).
3. Les androgènes et la prostate
Les androgènes, des hormones stéroïdiennes produites à partir du cholestérol par les cellules interstitielles de Leydig dans les testicules et par les glandes surrénales, sont responsables du développement sexuel et de la reproduction (120) (Figure 2). Leurs activités dépendent de leurs interactions avec le récepteur androgénique (RA), membre de la superfamille de récepteur nucléaire, et essentiel dans la régulation de plusieurs gènes androgéno-dépendants (121).
Parmi leurs fonctions, les androgènes participent activement au développement de la prostate, mais semblent aussi essentiels à l’initiation et la progression de certaines conditions pathologiques prostatiques comme l’hyperplasie bénigne et le cancer de la prostate (121). Figure 2. Schéma des voies de synthèse de la testostérone et de la DHT.
Il est connu que les signaux dérivés de l’interaction entre la dihydrotestostérone (DHT) et le RA sont indispensables à la prolifération, à la différenciation, à la morphogénèse et à l’entretien fonctionnel de la prostate (121). Les cellules basales prostatiques sont responsables de la transformation de la testostérone en DHT par l’enzyme 5— alpha-réductase (122). Cette étape est essentielle dans la cascade de production des androgènes puisque la DHT présente jusqu’à 10 fois plus d’affinité pour le récepteur androgénique, lorsque comparée à la testostérone (120) permettant à la prostate de contrôler localement son niveau d’exposition hormonale. On remarque ainsi que la prostate n’est pas seulement un organe cible des androgènes, mais elle exerce aussi un rôle actif dans leur transformation et leur régulation (120,123). Cela est également vrai pour le métabolisme des androgènes puisque la prostate est munie d’un arsenal enzymatique, les UDP-glucuronosyltransférases (les UGTs), capables de modifier et inactiver les androgènes (123).
13
ou élevé de progression consiste à utiliser une mesure locale comme la prostatectomie ou la radiothérapie et parfois associée à une thérapie adjuvante anti-androgénique, la castration chimique (126). Cette dernière, une approche moins invasive et aussi efficace que la castration chirurgicale, comprend l’utilisation des agonistes de l’hormone de libération des gonadotrophines hypophysaires (gonadotropin-releasing hormone, GnRH) en continu dans le but de supprimer l’axe hypothalamo-hypophyso-testiculaire (127). La privation androgénique permet l’expression des gènes proapoptotiques, normalement supprimés par l’activation du récepteur d’androgènes dans les cellules du cancer de la prostate (127). Il est connu d’ailleurs que la suppression androgénique est associée à un risque amoindri de décès par cancer de la prostate chez les patients ayant une maladie hormono-naïve (31). Malheureusement, la privation androgénique n’est pas un traitement curatif et éventuellement la maladie progresse sous traitement et devient ainsi un cancer de la prostate résistant à la castration. Cela s’explique par le développement de divers mécanismes de résistance par les cellules cancéreuses tels que l’amplification ou la surexpression du RA, les mutations du type gain de fonction du RA, la surproduction intracellulaire des androgènes, la surexpression des coactivateurs du RA ou l’activation indirecte du RA par d’autres molécules que les androgènes (128).
Les lignées cellulaires du cancer de la prostate LAPC4 et LNCaP présentent des caractéristiques particulières en ce qui concerne leur récepteur androgénique. Les cellules LNCaP, une lignée cellulaire développée à partir d’un ganglion métastatique du cancer de la prostate dans les années 80, conservent la morphologie ainsi que les fonctions spécifiques du cancer de la prostate. Elles sont ainsi androgéno-dépendantes et capables de produire de l’APS (129). Cependant, ces cellules possèdent une mutation ponctuelle dans leur site de liaison du récepteur androgénique qui diminue la spécificité de liaison des hormones androgènes (130). Par ailleurs, en présence de la DHT, les cellules LNCaP présentent une production diminuée d’UGT2B17 (131). Comme les cellules LNCaP, les cellules LCAP4 ont été développées à partir d’un ganglion métastatique du cancer de la prostate, conservent des caractéristiques morphologiques et fonctionnelles typiques du cancer de la prostate et sont androgèno-dépendantes (132). À l’opposé des cellules LNCaP, la lignée cellulaire LCAP4 détient un récepteur androgénique type sauvage et une mutation type indel (P358fs) dans le site de liaison du facteur de transcription FOXA1 (133).
Dans l’objectif de contrôler les maladies résistantes à la castration, d’autres traitements ciblant les voies de production androgénique ont été développés. L’abiratérone, par exemple, est un
inhibiteur sélectif de l’enzyme CYP17A1 et engendre la diminution de la production d’androgènes par les testicules, par les tissus extragonadiques (comme les surrénales) et même par les cellules du cancer de la prostate (127,128). L’utilisation de l’abiratérone a été associée à un risque moindre de progression et à l’augmentation de la survie chez les patients ayant une maladie métastatique résistante à la castration (134,135). L’enzalutamide est une autre nouvelle molécule utilisée dans le traitement du cancer de la prostate résistant à la castration. Il est un bloqueur puissant de la transmission des signaux du RA agissant sur sa translocation vers le noyau, sur sa liaison à l’ADN et sur le recrutement des co-activateurs (127). Des essais cliniques ont démontré l’efficacité de cette molécule dans le traitement des patients ayant un cancer de la prostate métastatique et résistant à la castration (136,137). Également, l’apalutamide a été développé pour le traitement du cancer de la prostate résistant à la castration. Cette molécule est un antagoniste direct du RA. Comme l’enzalutamide, il possède une haute affinité au site de liaison du RA causant l’inhibition de sa translocation au noyau cellulaire et empêchant sa liaison à l’ADN (138). L’administration de l’apalutamide à des patients ayant un cancer de la prostate non métastatique et résistant à la castration résulte en une diminution significative du temps de développement des métastases ainsi que du temps de progression des symptômes (139).
4. Les UDP-glucuronosyltransférases
4.1 La famille des UGTs
Les UDP-glucuronosyltransférases (les UGTs) font partie d’une famille d’enzymes qui catalysent des réactions de phase II du métabolisme (la glucuronidation), un système essentiel de biotransformation tant de produits exogènes qu’endogènes. Ce processus est important puisqu’il permet la transformation de substances lipophiliques difficilement excrétables en produits plus solubles et plus facilement éliminés par les reins et le foie, les glucuronides (140). La réaction enzymatique catalysée par les UGTs consiste en l’introduction d’un groupe fonctionnel sucré présent dans l’acide uridine 5’ — diphosphoglucuronique dans divers types de groupements comme le carbonyle, le sulfuryle, l’hydroxyle et l’amine (141). Il est reconnu que ces enzymes possèdent la radio — et aussi la stéréospécificité envers leurs substrats. Ces
15
subissent l’action des UGTs, entre autres la bilirubine, les acides biliaires et les hormones stéroïdes incluant les androgènes (140). Il ne faut pas oublier que chez l’humain la glucuronidation est le système le plus important d’inactivation des androgènes, principalement de la DHT qui est l’hormone la plus active. On retrouve ces enzymes dans différents organes comme le foie, les reins, le côlon, l’œsophage ainsi que la prostate (140). Ainsi, les tissus sont capables de contrôler localement leur exposition aux diverses substances ce qui permet par exemple à la prostate de réguler son exposition aux hormones androgéniques (122).
Chez l’humain, quatre sous-familles d’UGTs partagent une séquence similaire d’acides aminés : UGT1A, UGT2, UGT3 et UGT8. De nos jours, les sous-familles UGT3 et UGT8 ont été moins étudiées et ne semblent pas influencer de façon significative le métabolisme de médicaments. La sous-famille d’UGT3 est composée deux membres : UGT3A1 et 3A2. L’activité enzymatique de ces deux isoformes est difficilement détectable dans le foie, les reins et les intestins (142). Ceci suggère qu’elles présentent probablement un rôle alternatif dans la glycosylation de certaines substances seulement dans des contextes précis comme chez les individus utilisant des acides ursodeoxycholiques (142). De son côté, le seul composant de la famille UGT8 ne semble avoir aucun rôle dans le métabolisme des xénobiotiques ni des substances endogènes (142).
Contrairement aux enzymes UGT3 et UGT8, les isoformes qui constituent la sous-famille d’UGT1A jouent un rôle essentiel dans la glucuronidation des médicaments et des produits endogènes comme les stéroïdes, la bilirubine, la sérotonine et les acides biliaires (140). Toutes les isoformes de cette famille sont encodées par un gène unique localisé dans le chromosome 2 et se composent de 9 enzymes actives. Il est intéressant de noter que chaque isoenzyme présente son propre promoteur permettant ainsi le contrôle tissulaire de son expression. De plus, grâce à la présence d’exons distincts au début de la séquence de nucléotides, chaque isoenzyme de la sous-famille UGT1A dispose d’une spécificité envers ses substrats (140).
4.1.1 La sous-famille UGT2B et la prostate
La sous-famille d’UGT2 est composée de deux différentes enzymes : les UGT2A et 2B. Contrairement à la sous-famille UGT1A, les isoformes de la sous-famille UGT2B sont encodées par des gènes distincts contenant six exons canoniques originaires de duplications multiples sur le chromosome 4q13 (140). Les isoenzymes se distinguent principalement par leurs deux premiers exons responsables de la transcription du domaine de liaison aux substrats (140). Les
4 exons suivants composent les séquences des régions transmembranaires et celle reliée à l’acide 5’ — diphosphoglucuronique (140).
Sept enzymes composent la sous-famille UGT2B : UGT2B4, 2B7, 2B10, 2B11, 2B15, 2B17 et 2B28. Parmi les enzymes UGT2Bs considérées comme fonctionnelles, trois jouent un rôle majeur dans le métabolisme des androgènes : l’UGT2B15, 2B17 et 2B28 (122,143,144).
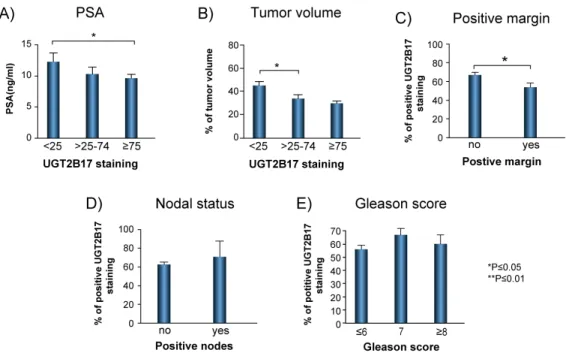
Les isoformes 2B15 et 2B17 participent localement au métabolisme d’androgènes dans la prostate et disposent d’une homologie de 96 % dans leurs séquences d’acides aminés. Tous les deux contribuent à la transformation de l’androstane -3α— DIOL (3α-DIOL) et de la dihydrotestostérone (DHT) en leurs glucuronides respectifs, 3α— DIOL-17G et DHT-17G. Toutefois, malgré leur homologie, ces isoformes présentent un profil d’activité légèrement différent puisque l’UGT2B17, différemment de l’isoforme 2B15, présente de l’activité envers l’androstérone (ADT) et contribue à la formation d’ADT-G (122) (Figure 3). Il est important aussi de remarquer qu’il existe probablement un contrôle local de l’expression des UGT2B15 et 2B17 par les androgènes (145). Dans les cellules prostatiques néoplasiques par exemple, une fois activé par les androgènes, le récepteur androgénique diminue la production d’UGT2B15 et 2B17 (131,146). Cela accorde à ces cellules la capacité de réguler l’action des UGTs et d’avoir une exposition prolongée aux androgènes favorisant leur survie et par conséquent influençant potentiellement la progression du cancer de la prostate. Effectivement, des études ont démontré que les cellules métastatiques du cancer prostate présentent des niveaux variables d’UGT2B15 (147,148). Toutefois, de façon inattendue, ces mêmes cellules disposent de niveaux élevés de l’isoforme 2B17 puisqu’une variante constitutivement activée du récepteur androgénique semble stimuler l’expression de cette isoforme (122,145,147). Li et coll. ont démontré que l’expression accrue d’UGT2B17 semble stimuler davantage la prolifération des cellules métastatiques du cancer de la prostate (149). Ce phénomène serait expliqué par l’intensification de la transcription des gènes mitotiques par le RA de façon indépendante des androgènes causée par l’enzyme UGT2B17(149).
L’UGT2B28 présente également un rôle important dans le métabolisme androgénique en participant de l’inactivation des androgènes telles que la testostérone et l’androstérone (150) et
17
scores de Gleason plus hauts ainsi qu’une fréquence accrue de la positivité ganglionnaire et des marges chirurgicales (144).
Figure 3. Métabolisme des androgènes par l’enzyme UGT2B17.
Ainsi, on observe l’importance du contrôle local de la production et du métabolisme des androgènes par les UGTs (particulièrement les isoformes 2B15, 2B17 et 2B28) dans des contextes tant physiologiques que pathologiques comme le cancer de la prostate.
5. Les polymorphismes de l’UGT2B17
Certaines études ont démontré que des changements génétiques peuvent modifier l’activité enzymatique de l’UGT2B17 et possiblement générer des niveaux anormaux d’androgènes (152-154). En étant un cancer androgéno-dépendant, l’évolution du cancer de la prostate pourrait ainsi être influencée par la modification du niveau d’activité de cette enzyme. Toutefois, peu d’études ont vérifié la relation entre ces variations génétiques et le cancer de la prostate.
Un polymorphisme trouvé dans le promoteur de l’UGT2B17, rs59678213 (C>T), a été décrit par Hu et coll. en 2010 (152). Ce polymorphisme se trouve plus précisément dans le site de liaison du facteur de transcription FOX1A (forkhead box A1), responsable de la disposition de la chromatine lors de la fixation des récepteurs nucléaires à l’ADN (153). Un exemple de récepteur susceptible à l’action de FOX1A est le récepteur androgénique. Hu et coll. ont démontré que, uniquement dans les cellules du cancer de la prostate (in vitro), le promoteur de la variante 155 T de l’UGT2B17 aurait audessus de 10 fois plus d’activité lorsque comparée à la variante -155 C. Cela serait possible, car ce polymorphisme rehausserait l’affinité entre le facteur de transcription et son domaine de liaison (152). Par ailleurs, les auteurs ont aussi démontré que les individus porteurs de la variante la plus active (UGT2B17 -155 T) auraient des niveaux accrus de glucuronides (152). !!!!!!!!!!!!!!!!!!!!!!!UGT2B17!
Testosterone(
DHT(
ADT(
3(α.Diol(
DHT.17G(
ADT.3G(
3(α.Diol.3G(
3(α.Diol.17G(
Un second polymorphisme, rs6817882 (T>C), aussi retrouvé dans le promoteur de l’UGT2B17, a été étudié par Liu et collaborateurs (154). Ils ont démontré que la variante homozygote CC était associée à l’expression accrue d’UGT2B17 dans les cellules hépatiques des individus sains (154). De plus, les cellules ayant cette variante seraient plus efficaces dans le métabolisme de la testostérone. Ce polymorphisme engendrerait probablement l’augmentation d’activité du promoteur de l’UGT2B17 et accentuerait l’expression de cette enzyme (154). De nos jours, le polymorphisme rs6817882 (T>C) n’a jamais été étudié chez les individus ayant le cancer de la prostate.
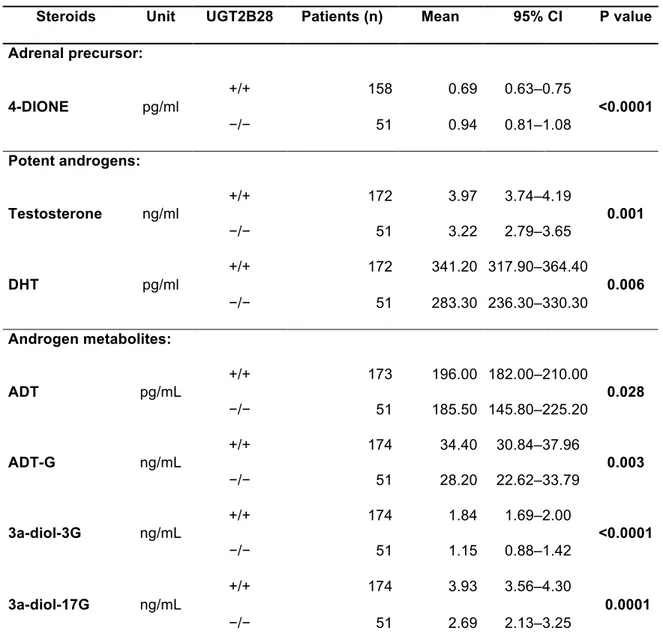
Finalement, la délétion de l’UGT2B17, une des délétions les plus fréquentes du génome humain, trouvée chez jusqu’à 27 % des Caucasiens, aurait un impact considérable sur les niveaux d’androgènes et leurs glucuronides respectifs (151). Swanson et coll. ont observé que la délétion complète de l’UGT2B17 serait associée à la réduction des niveaux plasmatiques de glucuronides, particulièrement le 3 α— diol-17G, chez les individus normaux (155). Chez ceux ayant un cancer de la prostate, Nadeau et coll. ont confirmé que la délétion complète du gène serait associée à des niveaux plasmatiques augmentés d’androstérone ainsi qu’à la diminution significative de 3 α— diol-17G, un des métabolites de la DHT (151). De plus, ces derniers ont mis en évidence que les individus ayant un cancer de la prostate localisé et porteurs d’au moins une délétion de l’UGT2B17 seraient plus à risque de développer une récidive biochimique de ce cancer (151). Ainsi, les porteurs de la délétion du gène UGT2B17 auraient un pronostic défavorable, lorsque comparés aux individus ayant les deux copies du gène.
On constate alors que les polymorphismes du gène UGT2B17 pourraient modifier l’action de l’enzyme sur les androgènes et par conséquent influencer la progression du cancer de la prostate. De cette façon, l’utilisation de ces polymorphismes comme biomarqueurs pronostiques serait une option pour aider les cliniciens dans la stratification des patients ayant une maladie localisée.
19
6. Hypothèse
Le cancer de la prostate est hétérogène et la stratification pronostique peut s’avérer difficile principalement chez les patients ayant une maladie localisée. Malgré sa haute incidence et prévalence, des controverses persistent par rapport à la prise en charge adéquate de cette population. Les outils cliniques tels que le dosage d’APS et le score de Gleason, individuellement ou dans un système combiné comme le score du NCCN, assistent le clinicien dans la prise de décision relative à l’approche thérapeutique la plus appropriée, mais présentent des limitations significatives. Ainsi, la distinction entre les individus qui évolueront vers une maladie métastatique et ceux ayant une maladie lentement évolutive peut se révéler un réel défi pour le clinicien. Dans ce contexte, les nouveaux biomarqueurs tels que les variations génétiques s’avèrent une option pouvant mener à une meilleure stratification pronostique des patients.
Sachant que l’enzyme UGT2B17 est essentielle dans le métabolisme des androgènes et que le cancer de la prostate est une maladie androgéno-dépendante, nous avons émis l’hypothèse que la variabilité génétique du gène UGT2B17 modifie l’exposition aux hormones et influence ainsi la progression du cancer de la prostate.
7. Les objectifs
7.1 En lien avec les variations génétiques associées à un gain de fonction de
l’enzyme UGT2B17
:Évaluer les polymorphismes génétiques d’UGT2B17 menant à un gain d’expression (rs59678213 C>T et rs6817882 T>C), leur lien avec le profil hormonal en circulation des patients ayant un cancer de la prostate localisé et la progression de la maladie.
7.2 En lien avec la délétion germinale complète du gène UGT2B17
:Évaluer le lien entre la délétion complète du gène UGT2B17 et le profil hormonal en circulation des patients ayant un cancer de la prostate localisé
7.3 En lien avec la surexpression tumorale de la protéine UGT2B17
:Évaluer l’association entre la surexpression de la protéine UGT2B17, les facteurs clinico-pathologiques et la progression du cancer de la prostate.
21
Chapitre I.
Les changements génétiques de l’UGT2B17 et leur influence sur la
progression du cancer de la prostate
Résumé
Variations génétiques germinales et somatiques de l’UGT2B17 : leur impact sur
les niveaux hormonaux et la récidive biochimique du cancer de la prostate
Luciana Garcia,Sylvie Desjardins, Hélène Hovington, Hervé Brisson, Anaïs Belledant, Éric P. Allain, Patrick Caron, Lyne Villeneuve, David Simonyan, Véronique Turcotte, Yves Fradet, Louis Lacombe, Chantal Guillemette and Éric LévesqueLes enzymes uridine-diphospho-glucuronosyltransférases (UGTs) sont responsables de l’inactivation des androgènes chez les cellules humaines du cancer de la prostate. Des variations génétiques germinales et somatiques modifient l’activité de l’UGT2B17, une enzyme essentielle au métabolisme stéroïdien, et peuvent altérer la bioactivité androgénique affectant la progression du cancer de la prostate. Ainsi, nous avons caractérisé les effets des changements génétiques germinaux et tumoraux de l’UGT2B17 sur les niveaux hormonaux, le phénotype tumoral et leur impact clinique sur le cancer de la prostate. Les polymorphismes rs59678213 et rs6817882, qui augmentent l’expression de l’UGT2B17, ont été génotypés chez de patients Caucasiens (n=526) ayant un cancer de la prostate localisé. Des modèles de régression de Cox et la technique de spectrométrie de masse ont été utilisés dans l’évaluation de la récidive biochimique après la prostatectomie radicale et dans les mesures des niveaux hormonaux, respectivement. La fonction de chaque polymorphisme a été étudiée dans des modèles cellulaires du cancer de la prostate androgéno-dépendant. Nous avons aussi évalué l’impact de la surexpression de l’UGT2B17 sur le phénotype des tumeurs primaires (n=239). Par la technique de transfection, nous avons démontré que le polymorphisme rs59678213 confère un gain d’expression du gène UGT2B17. Les porteurs du polymorphisme rs59678213T présentaient des niveaux élevés d’androgènes glucuronidés (>16 %; p = 0.004), des niveaux réduits d’androstérone (14 %; p = 0.002) et un risque accru de récidive biochimique (hazard ratio [HR] = 1.80; 95 % CI : 1.23–2.64; p = 0.002). En plus des changements androgéniques, les patients ayant un déficit complet d’UGT2B17 avaient des niveaux plasmatiques élevés de précurseurs surrénaliens (>20 %). La surexpression tumorale d’UGT2B17 a été associée à des changements des niveaux sériques de la testostérone et dihydrotestostérone et à un risque
23
Germline and Somatic Alterations in UGT2B17, Hormone Levels and Prostate
Cancer Biochemical Failure
Luciana Garcia1,Sylvie Desjardins1, Hélène Hovington1, Hervé Brisson1, Anaïs Belledant1, Eric P. Allain1,2, Patrick Caron2, Lyne Villeneuve2, David Simonyan3, Véronique Turcotte2, Yves
Fradet1, Louis Lacombe1, Chantal Guillemette2† and Eric Lévesque1†
1Centre Hospitalier Universitaire de Québec (CHU de Québec) Research Center, Faculty of
Medicine, Laval University, Québec, Canada.
2Pharmacogenomics laboratory, CHU de Québec Research Center and Faculty of Pharmacy,
Laval University, Québec, Canada.
3Statistical and Clinical Research Platform, CHU de Québec Research Center, Québec,
Canada.
†CORRESPONDING AUTHOR:
Eric Lévesque, M.D., Ph.D., FRCPC
CHU de Québec Research Center, R4720, 2705 Boul. Laurier, Québec, Canada, G1V 4G2. Tel. (418) 654-2296
email: eric.levesque@crchuq.ulaval.ca
Abstract
In human prostate cancer cells, the androgen inactivation pathway is mediated by uridine diphospho-glucuronosyltransferases (UGT). Germline and somatic variations modifying the activity of UGT2B17, a major steroid-metabolizing enzyme, may alter androgen bioactivity and affect prostate cancer progression. Thus, we characterized the effect(s) of germline and tumor changes in UGT2B17 on hormone levels, disease phenotype, and clinical outcomes. Caucasian patients (n = 526) with localized prostate cancers were genotyped for SNPs rs59678213 and rs6817882, which increase UGT2B17 expression. Cox proportional hazard analysis and mass spectrometry were used to evaluate biochemical recurrence (post-radical prostatectomy) and circulating androgens, respectively. The function of each SNP was also studied in androgen-dependent prostate cancer cell models. We also assessed the impact of UGT2B17 overexpression on disease phenotype in 239 primary tumors. Transfection experiments revealed that UGT2B17 gain in gene expression is conferred by rs59678213. Patients carrying rs59678213T had higher circulating levels of androgen glucuronides (>16%; p = 0.004), lower levels of androsterone (14%; p = 0.002), and greater risk for recurrence (hazard ratio (HR) = 1.80; 95% CI: 1.23–2.64; p = 0.002). Conversely, UGT2B17-deficient patients had, beyond alterations in androgen glucuronides levels, higher concentrations of adrenal precursors (>20%). UGT2B17 overexpression in tumors is associated with circulating testosterone and dihydrotestosterone levels and was associated with increased risk of recurrence (HR = 2.05; 95% CI: 1.04–4.37; p = 0.047). Our data suggest that an increase in UGT2B17 expression— either germline or somatic—independently affects the risk of disease progression by modifying exposure to androgens.