© Selmene Ouertani, 2019
Effet de l'ajout de biochar sur les microorganismes des
marais filtrants artificiels traitant des effluents de serre
Thèse
Selmene Ouertani
Doctorat en biologie végétale
Philosophiæ doctor (Ph. D.)
Effet de l’ajout de biochar sur les
microorganismes des marais filtrants artificiels
traitant des effluents de serre
Thèse
Selmene Ouertani
Sous la direction de :
Martine Dorais, directrice de recherche
Hani Antoun, codirecteur de recherche
Steeve Pépin, codirecteur de recherche
iii
Résumé
Les marais filtrants artificiels (MFA) forment un système biologique et passif de traitement des eaux usées constituant une alternative durable aux traitements conventionnels des effluents de cultures en serre. La performance des MFAs à réduire la charge polluante des effluents de culture et l’émission de gaz à effet de serre est étroitement liée aux communautés microbiennes. Afin d’optimiser l’activité biologique des MFAs et par conséquent leur performance, l’enrichissement en biochar des substrats filtrants pourrait constituer une avenue prometteuse. Le biochar, produit de la pyrolyse de la biomasse, est utilisé comme amendement pour les sols. Toutefois, les conséquences de son utilisation dans les systèmes d’épuration des eaux usées comme les MFAs sont peu connues jusqu’à nos jours. Les objectifs de cette thèse étaient donc de : (1) évaluer l’effet d’un biochar sur la diversité et l’activité des microorganismes dans les MFAs ; (2) évaluer l’effet du biochar sur l’efficacité des MFAs à réduire la charge en pesticides dans les effluents de cultures ; (3) évaluer l’effet du biochar sur les microorganismes des MFAs en présence de pesticides, et finalement (4) évaluer l’effet de l’utilisation de l’eau traitée par les MFAs comme eau d’irrigation sur la croissance des plantes et la diversité microbienne de la rhizosphère d’une culture de tomate. Les résultats obtenus ont démontré que le biochar n’a pas eu un effet majeur sur la composition des populations bactériennes dans les substrats et les effluents des marais. Toutefois, le biochar a affecté le taux d’expression de plusieurs gènes clés impliqués dans le fonctionnement des MFAs incluant ceux contrôlant le dégagement des gaz à effet de serre. Par ailleurs, l’utilisation des eaux traitées par les MFAs comme eau d’irrigation n’a pas affecté le développement des plantes de tomate. Au contraire, des bactéries connues pour leur stimulation de la croissance des plantes comme
Flavobacterium, Rhizobium, Azospirillum et Pseudomonas ont été détectées en abondance.
Finalement, en présence de pesticides, le biochar a exercé un effet protecteur sur les communautés microbiennes des MFAs permettant ainsi de maintenir leur performance à réduire les charges polluantes dans les effluents de serre. Toutefois, l’effet du biochar sur la capacité des marais à réduire la concentration des pesticides a été spécifique au type de pesticide. Ces travaux suggèrent que l’amendement des MFAs avec du biochar peut être une pratique utile pour améliorer et optimiser le fonctionnement des MFAs en atténuant certains de leurs inconvénients comme le dégagement des gaz à effet de serre. Ils ont démontré également la faisabilité et l’importance de la valorisation des eaux traitées par les MFAs.
iv
Abstract
Recently, the use of constructed wetlands (CWs), which form a biological and passive system of wastewater treatment, has been proposed as an alternative to conventional treatments of greenhouse effluents. The performance of CWs can be improved by the enrichment of their substrates with various products affecting their microbial communities, thus reducing the impact of some related problems such as the release of greenhouse gases. Biochar, which is the product of biomass pyrolysis, is used as an amendment in the soil. However, the consequences of its use with substrates in wastewater treatment systems such as CWs are little known until today. The objectives of this thesis were (1) to evaluate the effect of a biochar on the diversity and activity of microorganisms in CWs, (2) to evaluate the effect of biochar on the efficiency of CWs to reduce pesticides in greenhouse effluents, (3) to evaluate the effect of biochar on microorganisms in CWs in the presence of pesticides, and finally (4) to assess the effect of using water treated in CWs as irrigation water on tomato growth and rhizosphere microbial diversity. The obtained results demonstrated that biochar did not have a major effect on the composition of bacterial populations in CWs substrates and effluents. However, biochar affected the expression rate of several key genes in CWs functioning, including those involved in the release of greenhouse gases. Also, the use of CWs s treated waters to grow tomato plants in hydroponic crops did not present any physiological or microbiological risk to tomato plants. In fact, plant growth-promoting bacteria such as Flavobacterium, Rhizobium,
Azospirillum and Pseudomonas were detected in abundance in the rhizosphere of tomato
plants. Finally, in the presence of pesticides, biochar showed a protective effect on the microbial communities of CWs and thus makes it possible to maintain CWs performance in reducing pollutant loads in greenhouse effluents. However, the effect of biochar on CWs performance in reducing pesticides is specific to the type of pesticide. This work highlights the utility of biochar in improving the functioning of CWs and in circumventing some of their disadvantages such as the release of greenhouse gases. The feasibility and the importance of the valorization of water treated by CWs was also demonstrated.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières... v
Liste des tableaux ... ix
Liste des figures ... xi
Liste des abréviations ... xii
Dédicace ... xiii Remerciements ... xiv Avant-propos... xvi Introduction générale ... 1 Chapitre 1 ... 4 Revue de littérature ... 4
1.1 Les marais filtrants artificiels ... 4
1.1.1 Définition ... 4
1.1.2 Rôle des microorganismes dans les marais filtrants artificiels ... 5
1.1.2.1 Populations microbiennes présentes dans les marais filtrants artificiels ... 6
1.1.2.2 Méthodes utilisées pour l’étude des populations microbiennes présentes dans les marais filtrants artificiels ... 8
1.1.3 Élimination des pesticides par les marais filtrants artificiels ... 9
1.1.4 Réutilisation de l’eau traitée par les marais filtrants artificiels... 13
1.1.4.1 Caractéristiques de l’eau traitée par les marais filtrants ... 13
1.1.4.2 Effet de l’eau traitée par les marais filtrants artificiels sur la croissance des plantes et les agents phytopathogènes ... 15
1.2 Le biochar ... 15
1.2.1 Définition ... 15
1.2.2 Effet du biochar sur les microorganismes du sol ... 16
1.2.2.1 Effet du biochar sur l’abondance des microorganismes du sol ... 17
1.2.2.2 Effet du biochar sur les communautés microbiennes du sol ... 18
1.2.2.3 Effet du biochar sur l’activité des microorganismes du sol ... 19
vi
1.3 Hypothèses et objectifs de recherche ... 23
1.4 Références ... 25
Chapitre 2 ... 44
Microbial community structures and activities in different horizontal subsurface flow constructed wetlands amended with biochar, as revealed by 454-pyrosequencing analysis and qPCR. ... 44
Résumé ... 44
Abstract ... 45
2.1 Introduction ... 47
2.2 Materials and methods ... 49
2.2.1 Constructed wetlands ... 49
2.2.2 Structure of microbial communities... 51
2.2.2.1 Sample collection and DNA extraction ... 51
2.2.2.2 PCR amplification and purification ... 51
2.2.2.3 Pyrosequencing ... 52
2.2.2.4 Sequence analysis ... 52
2.2.3 qPCR Analysis ... 53
2.2.3.1 Sample collection from CW's filter media ... 53
2.2.3.2 Extraction and purification of total RNA from different CWs ... 53
2.2.3.3 Synthesis of complementary DNA (cDNA)... 54
2.2.3.4 Real Time PCR... 54
2.2.4 Statistical analysis ... 55
2.3 Results and discussion ... 56
2.3.1 Structure of microbial communities... 56
2.3.1.1 Structure of microbial communities in different CW filter media ... 56
2.3.1.2 Structure of microbial communities in treated waters ... 67
2.3.1.3 Comparison of CW filter media and treated water bacterial communities 71 2.3.2 qPCR Analysis ... 72
2.4 Conclusion ... 80
2.5 Références ... 82
vii
Effect of use of treated water by constructed wetlands as irrigation water on plant growth and microbial communities in the rhizosphere of tomato plants grown in hydroponic
system ... 92
Résumé ... 93
Abstract ... 94
3.1 Introduction ... 95
3.2 Materials and methods ... 97
3.2.1 Constructed wetlands ... 97
3.2.2 Plant material ... 97
3.2.3 Hydroponic cultivation of tomato plants ... 98
3.2.4 Physiological parameters of tomato plants ... 98
3.2.4.1 Photosynthesis measurement... 98
3.2.4.2 Chlorophyllous fluorescence ... 99
3.2.4.3 Plant growth and fruit yield ... 99
3.2.5 Community-level physiological profiling ... 99
3.2.6 Sample collection and DNA extraction ... 100
3.2.7 PCR amplification and Illumina sequencing analysis ... 101
3.2.8 Seed germination trial ... 102
3.2.9 Statistical analysis ... 102
3.3 Results ... 102
3.3.1 Physiological parameters of tomato plants ... 102
3.3.2 Sequencing reads and overall bacterial diversity ... 104
3.3.3 Taxonomic distribution ... 106
3.4 Discussion ... 110
3.5 Conclusion ... 115
3.6 References ... 117
Chapitre 4 ... 125
Effect of biochar amendment on pesticide removal and microbial community structure in constructed wetlands ... 125
Résumé ... 126
Abstract ... 127
viii
4.2 Materials and methods ... 130
4.2.1 Experimental set-up ... 130
4.2.2 Pesticide application and analysis ... 130
4.2.3 Chemical analysis ... 132
4.2.4 Community-level physiological profiling ... 132
4.2.5 Statistical analysis ... 133
4.3 Results ... 133
4.3.1 Nutrient removal in horizontal subsurface flow constructed wetlands ... 133
4.3.2 Pesticide removal in horizontal subsurface flow constructed wetlands.... 136
4.3.3 Carbon source utilization profiles in constructed wetland effluents ... 137
4.3.4 Carbon source utilization profiles in constructed wetland sediments ... 143
4.4 Discussion ... 148
4.5 Conclusion ... 156
4.6 References ... 157
Chapitre 5 ... 167
Discussion générale ... 167
5.1 Effet d’un biochar sur les populations bactériennes des marais filtrants artificiels 168 5.2 Effet du biochar sur la performance des marais filtrants artificiels à réduire les pesticides dans les effluents de cultures en serre ... 171
5.3 Effet de l’eau traitée par les MFA sur la croissance des plantes et les communautés bactériennes dans les cultures hydroponiques ... 172
5.4 Applications industrielles: ... 174 5.5 References ... 176 Conclusion générale ... 180 Perspectives de recherche ... 182 Bibliographie... 183 Annexe ... 220
7.1 Résultats de Maggie Bolduc: résultats non publiés de la maîtrise de Maggie Bolduc ... 220
7.2 Chapitre 2: Matériel Supplémentaire ... 224
ix
Liste des tableaux
Tableau 1.1 Exemples d’utilisation des marais filtrants artificiels pour l’élimination des
pesticides à partir des effluents de cultures agricoles ... 12
Tableau 1.2 Caractéristiques des eaux traitées par des marais filtrants ... 14
Table 2.1 Properties of biochar of balsam fir and white and black spruce ... 50
Table 2.2 Primers pairs used in this study ... 55
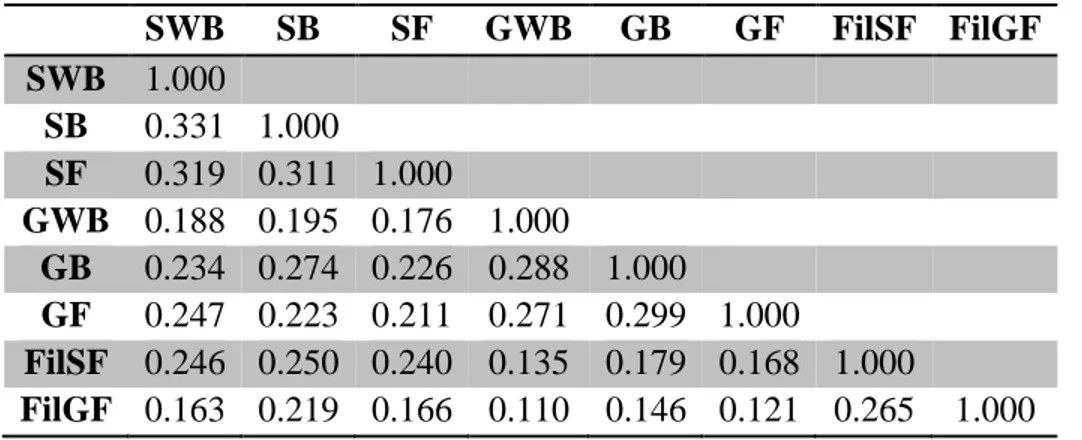
Table 2.3 Number of operational taxonomic units (OTUs), Chao1 estimator, Shannon and Simpson indexes for substrates and treated water samples from the various constructed wetlands. ... 58
Table 2.4 Sørensen Similarity indices of eight samples of constructed wetland substrates. ... 59
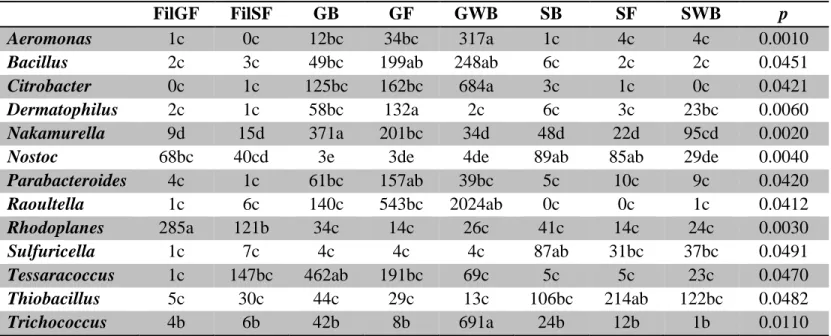
Table 2.5 Number of sequences of each genus representing more than 0.5% of the total relative abundance in constructed wetland substrates and significantly affected by treatments. ... 66
Table 2.6 Number of sequences of each genus representing more than 0.5% of the total relative abundance in constructed wetland effluents and significantly affected by treatments. ... 71
Table 3.1 Growth parameters of tomato plants cultivated in the different types of effluents. ... 105
Table 3.2 Number of operational taxonomic units (OTUs), Chao1 estimator, and Shannon and Simpson indexes for rhizosphere of tomato plants from different treatment. ... 106
Table 3.3 Relative abundance of bacterial classes representing more than 1% of the total relative abundance in rhizosphere of tomato plants from different treatments. ... 108
Table 3.4 Relative abundance of bacterial genera representing more than 0.5% of the total relative abundance in rhizosphere of tomato plants from different treatments. ... 109
x
Table 4.1 Nutrient removal efficiency by constructed wetlands at the different sampling
times (n = 4). ... 135
Table 4.2 Pesticide removal percentages in horizontal subsurface flow constructed
wetlands with different biochar concentrations (0%, 15%, or 30% v/v) (n = 4). ... 137
Table 4.3 Areas under the curve of the different EcoPlate substrates for horizontal
subsurface flow constructed wetland effluents at the different sampling times (day 0, 8, or 16). Data are means of n = 12 (4 constructed wetlands per treatment × 3 replicates) .... 141
Table 4.4 Areas under the curve of the different EcoPlate substrates for horizontal
subsurface flow constructed wetland sediments with different biochar concentrations (0%, 15%, and 30% v/v). Data are means of n = 12. ... 146
xi
Liste des figures
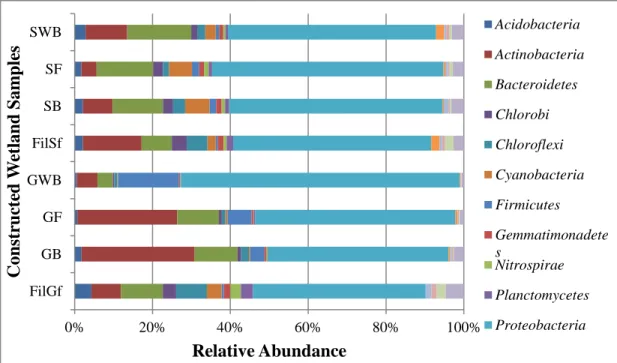
Fig. 1.1 Différentes étapes et gènes impliqués dans le cycle d’azote. ... 8 Fig. 2.1 Bacterial community structures at the phylum level in different constructed
wetland substrates. ... 60
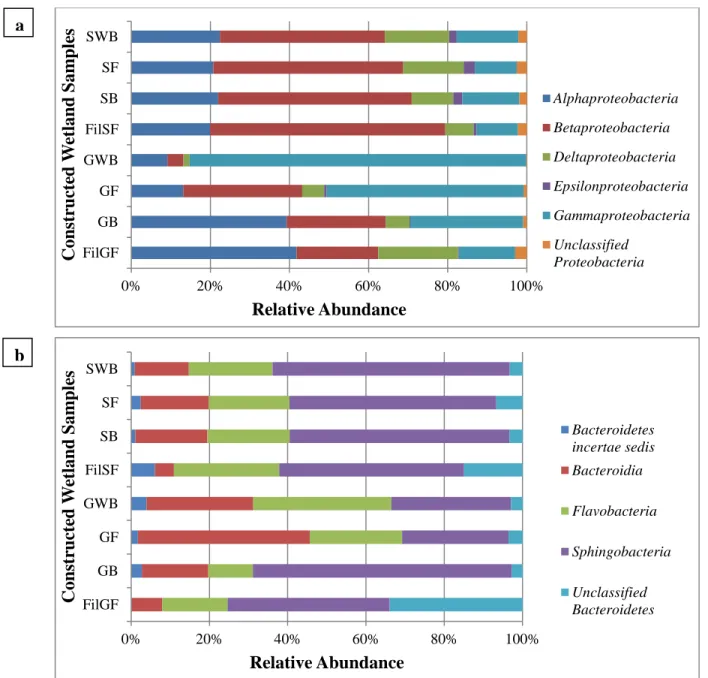
Fig. 2.2 (a) Proteobacteria and (b) Bacteroidetes composition by class in samples of
constructed wetland substrates. ... 63
Fig. 2.3 Bacterial community structures at the phylum level in different constructed
wetland effluents. ... 68
Fig. 2.4 (a) Proteobacteria and (b) Bacteroidetes composition by class in samples of
constructed wetland effluents. ... 70
Fig. 2.5 Number of copies of gene transcripts in the different CW's treatments. ... 74 Fig. 3.1 Bacterial community structures at the phylum level in different tomato rhizosphere
treatments. ... 107
Fig. 4.1 Microbial richness after pesticide application in horizontal subsurface flow
constructed wetland effluents with different biochar concentrations (0%, 15%, or 30% v/v) at the different sampling times (day 0, 8, or 16). ... 138
Fig. 4.2 Average well colour development (AWCD) after pesticide application in
horizontal subsurface flow constructed wetland effluents with different biochar concentrations (0%, 15%, or 30% v/v) at the different sampling times (day 0, 8, or 16). ... 139
Fig. 4.3 Microbial richness in horizontal subsurface flow constructed wetland sediments
(day 16 of the experiment) with different biochar concentrations (0%, 15%, or 30% v/v).. ... 143
Fig. 4.4 Average well colour development (AWCD) showing the averaged substrate
consumption in horizontal subsurface flow constructed wetland sediments (day 16 of the experiment) with different biochar concentrations (0%, 15%, or 30% v/v). ... 144
xii
Liste des abréviations
ADN : Acide désoxyribonucléique ANOVA : Analyse de la variance ARN : Acide ribonucléique
BRS/SRB : Bactéries réductrices de sulfates/Sulfate reducing bacteria CLPP : Community-level physiological profile
DBO5 : demande biologique en oxygène
DCO : demande chimique en oxygène
DMCP/AWCD : Développement moyen de la couleur dans les puits/Average well color development.
FSSH/HSSF : Flux sous-surfacique horizontal/Horizontal subsurface flow MFA/CW : Marais filtrant artificiel/Constructed Wetland
MPN : nombre le plus probable NT : azote total
OTU : Unité taxonomique opérationnelle OD : oxygène dissout
PCR : Réaction de polymérisation en chaîne PT : phosphore total
ssh : marais sous surfacique à flux horizontal ssv : marais sous surfacique à flux vertical sh : marais surfacique à flux horizontal UFC : unité formant colonie
xiii
Dédicace
À la mémoire de ma petite soeur, Emna. À ma famille au Canada et en Tunisie.
xiv
Remerciements
Tout d’abord, j’aimerais remercier ma directrice, la docteure Martine Dorais, de son soutien et de son enthousiasme envers le projet, de m’avoir guidé pendant mon projet de thèse, pour sa collaboration, ses fructueuses discussions ainsi que pour son aide considérable qu’elle m’a apporté tout le long de mon projet et sa disponibilité. Je la remercie pour l’attention avec laquelle elle a suivi ce travail. Qu’elle trouve ici le témoignage de ma profonde reconnaissance.
Je remercie également mon codirecteur le professeur Hani Antoun pour m’avoir transmis ses connaissances scientifiques et pour les conseils qu’il m’a prodigués. Je suis très reconnaissant aussi pour son soutien continu et son encouragement. Qu’il trouve ici l’expression de ma gratitude, de mes vifs remerciements et de mon profond respect.
Également, je tiens à exprimer mes vifs remerciements à mon codirecteur docteur Steeve Pépin pour son soutien continu, son encouragement et son effort, pour sa générosité, sa rigueur et ses nombreux conseils. Qu’il trouve ici le témoignage de ma profonde reconnaissance.
Je tiens par ailleurs à remercier toute l’équipe du laboratoire : Mireille Thériault, Réjean Bacon, Claudine Ménard, Edith Tousignant. De plus, je tiens à remercier l’équipe des serres de l’Envirotron, soit Claudette Roy, Rachel Daigle et Carole Martinez pour leur aide et leur collaboration pour le bon fonctionnement des marais. Merci aux étudiants qui ont participé au projet de recherche.
J’aimerais également remercier Nicolas Gruyer, Patrice Dion et Josée Fortin, qui ont accepté, aux côtés de ma directrice et de mes deux codirecteurs de recherche, d’évaluer cette thèse de doctorat et de faire partie du jury lors de ma soutenance.
Bien entendu, je tiens à remercier ma famille, mes proches et mes ami(e)s pour leur inestimable soutien et leurs encouragements. Je tiens à faire des remerciements à mes parents Kamel et Rachida qui malgré les distances ont su être présents tout au long de mon doctorat. Un grand merci à Manel, ma femme, pour son soutien moral, son temps consacré pour m’aider ainsi que son encouragement continu. Je remercie également mon frère Sofien et ma sœur Asma. Mes pensées sont toujours avec ma sœur Emna qui nous a quittés il y a une année à l’âge de 22 ans. Malgré qu’elle ne soit plus avec nous, je la remercie parce qu’elle était un énorme soutien moral pour moi et elle m’a toujours
xv
encouragé pour avancer. Je remercie également ma belle-mère Hedia pour son soutien et son aide pour finir mon projet de doctorat.
xvi
Avant-propos
Cette thèse a été réalisée dans le cadre d’un projet intitulé « Réduction de l’impact
environnemental des cultures horticoles par l’utilisation de marais filtrants et effet de la recirculation de l’eau traitée sur la productivité et les phytopathogènes » financé par le Programme de soutien à l’innovation en agroalimentaire du ministère de l’Agriculture,
des Pêcheries et de l’Alimentation du Québec (MAPAQ).
Cette thèse est composée de cinq chapitres en plus de la conclusion. Le chapitre 1 comprend une introduction générale et une revue de la littérature. Cette première partie permet d’atteindre des connaissances générales sur le sujet, de dégager les problématiques et d’énoncer les hypothèses et les objectifs de recherche. Les chapitres 2 à 4 sont les principaux chapitres de la thèse et ils sont écrits en anglais. Les articles sont présentement en préparation et seront prochainement publiés dans des journaux scientifiques avec comité de lecture. Le chapitre 2 intitulé « Microbial community structures and activity in different horizontal subsurface flow constructed wetlands amended with biochar, as revealed by 454-pyrosequencing analysis and QPCR » étudie l’effet de l’amendement de biochar sur la composition des populations bactériennes dans les marais filtrants artificiels. De plus, ce chapitre concerne l’effet du biochar sur l’activité des populations microbiennes des marais. Le chapitre 3 traite de l’effet du recyclage des effluents des marais sur les propriétés physiologiques et microbiologiques de plants de tomate. Il est intitulé « Effect of use of treated water by constructed wetlands as irrigation water on plant growth and microbial communities in the rhizosphere of tomato plants grown in hydroponic system ». Le chapitre 4 traite de l’effet du biochar sur la performance des marais filtrants artificiels à éliminer les pesticides dans les effluents de culture ainsi que l’effet du biochar sur les microorganismes des marais en présence de pesticides. Le titre du chapitre est « Effect of biochar amendment on pesticide removal and microbial community structure in constructed wetlands ». Le chapitre 5 est la discussion générale qui présente les apports scientitifques de cette thèse en se basant sur la littérature. La dernière partie de cette thèse est la conclusion générale qui résume les principaux résultats obtenus et expose les
xvii
perspectives de recherche de cette thèse qui permettront de mieux comprendre et exploiter les apports scientitifques de ce projet.
Congrès et colloques
Ouertani, S., S. Pepin, H. Antoun, H. Selmi & M. Dorais (2014) Microbial community structures in different horizontal sub-surface flow constructed wetlands enriched with biochar as revealed by 454-pyrosequencing analysis. Journées du Centre SÈVE, 13–14 November, Orford, QC, Canada. (Oral presentation).
Ouertani, S., S. Pepin, H. Antoun, H. Selmi & M. Dorais (2015) Microbial community structures in different horizontal sub-surface flow constructed wetlands enriched with biochar as revealed by 454-pyrosequencing analysis. Joint meeting of ISMOM–CSSS– AQSSS, 5–10 Juillet 2015, Montreal, QC, Canada. (Poster)
Ouertani, S., S. Pepin, H. Antoun & M. Dorais (2016) Biochar amendment of constructed wetlands treating greenhouse effluents contaminated with pesticides: effects on pesticides removal efficiency and constructed wetland’s microbial communities. 16th International
Symposium on Microbial Ecology (ISME16), 21–26 août 2016, Montreal, QC, Canada. (Poster)
1
Introduction générale
L’industrie serricole canadienne a été marquée par un accroissement continu ces dernières années afin de faire face à la demande croissante des consommateurs exigeant des fruits et légumes frais. Effectivement, au Canada, le volume de l’industrie des cultures en serre a évolué considérablement ces dernières années pour atteindre un chiffre d’affaires de plus de 2,5 milliards de dollars (Agriculture et Agroalimentaire Canada, 2017). Cet accroissement est témoin d’une hausse des quantités d’eau utilisées pour l’irrigation des cultures en serre et conséquemment d’importantes quantités d’eau sont rejetées dans l’environnement. À titre d’exemple, pour le cas de la tomate, on estime que l’eau rejetée représente de 10 à 30 % de l’eau initiale d’irrigation et parfois jusqu’à 50 % pendant la saison de l’été (Dorais et Dubé, 2011). La richesse en engrais de synthèse de cette eau perdue peut mener à un bouleversement de l’équilibre des écosystèmes aquatiques et être à l’origine de graves problèmes environnementaux comme l’eutrophisation des cours d’eau. Pour contourner ce problème, le recyclage de l’eau de drainage est fortement conseillé. Cette pratique peut toutefois être une source importante de propagation de microorganismes pathogènes à travers les systèmes serricoles menant ainsi à de graves infections des cultures par différents agents phytopathogènes comme les espèces de
Pythium et de Ralstonia, Fusarium oxysporum, et Clavibacter michiganensis (Tu et al.,
1999 ; Runia et Amsing, 2001 ; Huang et Tu, 2001 ; Alsanius et Bergstrand, 2007). Partant de ce constat, diverses méthodes de désinfection des eaux de recirculation des effluents de serre ont été mises au point comme l’ozonation, la chloration, l’irradiation aux rayons UV, le traitement thermique et l’utilisation des biofiltres (Ehret et al., 2001 ; Lequillec, 2002 ; Wohanka et Seidel, 2004). Néanmoins, la majorité de ces méthodes sont coûteuses et nécessitent des efforts de maintenance et un suivi strict. De plus, elles ont une efficacité moindre dans certains cas (p. ex. cultures biologiques), ne garantissant pas une minimisation acceptable des agents pathogènes dans les eaux de recirculation riches en matière organique (Lévesque, 2011). L’utilisation des marais filtrants artificiels a été
2
proposée comme une alternative aux traitements conventionnels (Gruyer et al., 2013). Ceux-ci permettent de traiter les effluents de cultures biologiques d’une manière efficace réduisant ainsi les problèmes environnementaux tout en limitant la propagation des agents pathogènes (Kadlec et Wallace, 2009 ; Sleytr et al., 2007 ; Vymazal, 2005). Il s’agit d’un système biologique, passif, naturel, peu coûteux et nécessitant peu d’entretien.
Afin d’accroître la performance des marais artificiels à traiter les effluents de serre riche en nitrate et en sulfate, l’ajout de biochar au substrat pourrait être une avenue prometteuse pour améliorer l’activité biologique du milieu filtrant. Spécifiquement, le biochar résulte de la pyrolyse de la biomasse à des hautes températures et en absence d’oxygène (Laird et al., 2010 b ; Lehmann et al., 2011). Les types de biochar se différencient selon la biomasse utilisée ainsi que la température de pyrolyse ; le contenu en carbone du biochar peut varier de <1 % à >80 % (Laird et al., 2010b). Le biochar est considéré comme un amendement pour les sols agricoles (Lehmann and Joseph, 2009). L’utilité de cette application a été mise en évidence à partir des observations faites par divers chercheurs sur les terres noires en Amazonie. Ils ont constaté que la présence de biochar dans le sol améliore les différentes caractéristiques du sol, par exemple ses propriétés physico-chimiques, sa fertilité et surtout ses propriétés biologiques (O’Neill, 2007 ; O’Neill et al., 2009 ; Kim et al., 2007 ; Grossman et al., 2010 ; Jin, 2010 ; Liang et al., 2010). Le biochar se montre efficace aussi dans la réduction de l’impact de plusieurs problèmes environnementaux comme les émissions de gaz à effet de serre et la contamination des sols avec divers polluants comme les pesticides (Feng et al., 2012 ; Case et al., 2012 ; Lehman et al., 2011 ; Ren et al., 2016 ; Lévesque et al., 2018) ou dans l’amélioration des rendements des cultures agricoles (Zhang et al., 2012 ; Vaccari et al., 2011 ; Cornelissen et al., 2018 ; Raj et al., 2018).
Toutefois, malgré les propriétés très importantes du biochar et ses différents effets bénéfiques observés sur le sol, les conséquences de son utilisation comme substrat ou amendement dans les systèmes d’épuration des eaux usées tels que les marais filtrants artificiels sont peu connues jusqu’à nos jours.
3
Ce travail de recherche a donc pour objectif d’étudier les effets de l’amendement des substrats des marais filtrants artificiels avec le biochar sur les aspects suivants : a) les propriétés biologiques de ces substrats et plus particulièrement la structure de leurs communautés microbiennes ; b) l’efficacité des marais filtrants à éliminer les pathogènes et les pesticides dans les effluents des cultures biologiques ; et c) l’impact de la réutilisation des eaux traitées par les marais filtrants sur les cultures.
4
Chapitre 1
Revue de littérature
1.1 Les marais filtrants artificiels
1.1.1 Définition
Les marais filtrants artificiels (MFA) sont des systèmes naturels de traitement des eaux usées qui, à travers divers mécanismes physiques, chimiques et biologiques, sont capables de diminuer les polluants (métaux lourds, phosphore, azote, etc.) présents dans les eaux usées (Vymazal et al., 2006 ; Scholtz et al., 2007 ; Akratos et al., 2009). Le fonctionnement des MFA, ayant une demande énergétique nettement moindre que les systèmes conventionnels (Shao et al., 2013) avec moins d’influence sur le changement climatique tout au long de leur cycle de vie (Zhao et Liu, 2013), repose sur la composition du substrat, les communautés microbiennes, les écosystèmes végétaux (Wang et al., 2008a, b) et la stratégie opératoire (Zhao et al., 2013 ; Wu et al., 2014).
Il existe trois types de marais filtrants artificiels ayant chacun ses propres caractéristiques : 1) Les marais surfaciques à flux horizontal (sh), où l’eau s’écoule horizontalement
au-dessus de la surface du sol ;
2) Les marais à flux vertical (sv), où l’apport des effluents se fait verticalement par percolation à travers la matrice plantée ;
3) Les marais sous surfaciques à flux horizontal (ssh), où l’eau s’écoule horizontalement au-dessous de la surface du sol.
Les caractéristiques et les processus d’épuration qui se déroulent dans les différents types de MFA diffèrent d’un type de marais à un autre selon la proportion eau/sol et la quantité d’oxygène disponible (Vymazal, 2007 ; Lévesque, 2011). Dans les marais surfaciques à flux horizontal, l’élimination des NO3- est favorisée par l’apport faible en oxygène
(Vymazal, 2007). Cependant, ce type de marais a montré une capacité limitée dans l’élimination de l’azote et du phosphore (Vymazal, 2007 ; Wang et al., 2018). Pour les
5
marais sous-surfaciques (ssh et sv), le système est considéré comme étant un milieu anaérobie avec l’existence de microsites aérobies mais avec une meilleure oxygénation pour les MFA sv parce que l’alimentation intermittente conduit à un meilleur transfert d’oxygène dans le marais (Lévesque, 2011 ; Wang et al., 2018). Dans les MFA sv et les ssh, la nitrification et la dénitrification sont les principaux mécanismes d’épuration de l’azote (Lévesque, 2011 ; Gruyer et al., 2013). Le fait que l’oxygène est un facteur limitant favorise pour les microorganismes l’usage de NO3- comme accepteur final d’électrons
(Vymazal, 2007). Selon Wang et al. (2018), les MFA ssh présentent une efficacité plus élevée à éliminer le N-NH4+ que les MFA sv malgré la meilleure oxygénation de ces
derniers permettant d’avoir un environnement plus favorable à la nitrification. De plus, les MFA ssh sont plus performants que les MFA sv à éliminer les N-NO3- à cause des
conditions plus favorables à la dénitrification (Wang et al., 2018).
Les composantes essentielles des MFA sont le substrat, les plantes et les microorganismes. C’est à travers les interactions et la complémentarité entre ces différentes composantes que les MFA permettent d’épurer avec une grande efficacité les eaux usées. Chacune de ces composantes se distingue par un rôle primordial au sein des processus qui se déroulent dans les marais (Kadlec et Wallace, 2009).
1.1.2 Rôle des microorganismes dans les marais filtrants artificiels
Bien que la performance de purification des MFA soit attribuable à divers mécanismes d’élimination, notamment la sédimentation, la filtration, les précipitations, l’adsorption, la volatilisation et l’absorption végétale, il est reconnu que l’élimination de la plupart des polluants est principalement due à l’activité microbienne (Wu et al., 2014 ; Cui et al., 2010).
Les microorganismes interviennent dans les MFA principalement à travers les mécanismes de biodégradation par les enzymes extracellulaires et la transformation par la respiration et la fermentation (Meng et al., 2014).
6
1.1.2.1 Populations microbiennes présentes dans les marais filtrants artificiels
Les bactéries et les champignons faisant partie des MFA sont impliqués de façon directe dans les différents processus qui ont lieu dans ces marais (Kadlec et Wallace, 2009). Parmi les principaux processus d’épuration des eaux usées dans les marais filtrants, on cite la biodégradation de la matière organique, la réduction des sulfates et la réduction des nitrates (Faulwetter et al., 2009).
En général, la biodégradation de la matière organique dans les MFA est principalement associée aux bactéries hétérotrophes, aux champignons incluant les levures, et les basidiomycètes, et à certains protozoaires spécifiques (Kadlec et Wallace, 2009). Les bactéries hétérotrophes aérobies oxydent les matières organiques en utilisant l’oxygène comme accepteur final d’électrons et libèrent du dioxyde de carbone et d’autres composés chimiques. Les bactéries hétérotrophes anaérobies remplissent la fonction de dégradation dans un processus en deux étapes : la fermentation et la méthanogenèse. Dans ce dernier procédé, les bactéries oxydant le méthane (méthanotrophes) et les archées méthanogènes sont les bactéries fonctionnelles dominantes (Faulwetter et al., 2009 ; Truu et al., 2009).
Les bactéries réductrices de sulfates (BRS) contribuent également à l’élimination des matières organiques dans les MFA. Les BRS sont généralement des anaérobies utilisant le sulfate comme accepteur terminal d’électrons. Cependant, certaines espèces qui persistent dans des conditions oxiques et survivent à de longues périodes d’exposition à l’oxygène ont été découvertes. Selon des études, 25 % de l’enlèvement de carbone de la matière organique est attribué à la communauté BRS (Faulwetter et al., 2009).
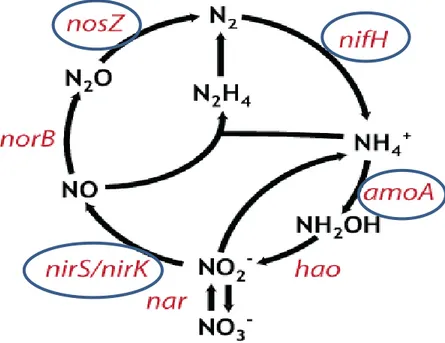
En raison des formes variables d’azote existant dans les MFA et de la complexité du cycle de l’azote (Fig. 1.1), les groupes phylogénétiques impliqués dans l’élimination de l’azote sont divers. En général, les communautés microbiennes dominantes liées à l’élimination de l’azote comprennent des communautés microbiennes oxydant l’ammoniac, des communautés microbiennes dénitrifiantes et des communautés microbiennes anammox.
7
d’ammoniac en nitrates. Les organismes oxydant l’ammoniac comprennent les bactéries oxydant l’ammoniac (BOA) et les archées oxydant l’ammoniac (AOA) alors que les bactéries qui oxydent les NO2 comprennent les Nitrobacter et Nitrospina. Les BOA sont
des microbes chimiolithoautotrophes aérobies, et les marqueurs moléculaires spécifiques pour BOA sont des gènes fonctionnels portant une sous-unité du gène de l’ammoniaque monooxygénase (amoA) (Fig. 1.1) qui catalyse l’oxydation de NH3 en NO2 et de la région
spécifique CTO de l’ADNr 16S (Truu et al., 2009). Basé sur la région CTO, un total d’environ 15 différentes populations BOA peuvent être distinguées. Les BOA appartiennent à deux groupes phylogénétiques : les Bétaprotéobactéries (Nitrosomonas et
Nitrosospira spp.) et les Gammaprotéobactéries (Nitrosococcus oceani et Nitrosococcus halophilus) (Faulwetter et al., 2009).
Les bactéries dénitrifiantes peuvent appartenir à différents genres comme Bacillus,
Micrococcus, Pseudomonas, Aeromonas et Vibrio (Grant et Long, 1981). La plupart des
bactéries dénitrifiantes sont des chimiohétérotrophes anaérobies facultatifs utilisant des composés organiques comme donneurs d’électrons et comme source de carbone et utilisant des nitrates comme accepteurs d’électrons terminaux (Vymazal, 2007). La dénitrification consiste en la transformation des nitrates en azote gazeux. Des amorces de PCR spécifiques pour les gènes nirK, nirS et nosZ (Fig. 1.1), qui codent pour la nitrite réductase et la N2O
réductase, ont été utilisées dans plusieurs études pour explorer la diversité génétique des dénitrificateurs dans les MFA (Faulwetter et al., 2009).
Anammox est une réaction d’oxydation anaérobie de l’ammonium qui est directement converti en azote gazeux par le nitrite (Faulwetter et al., 2009). Cette réaction est principalement faite par des bactéries qui ressemblent aux planctomycètes: Candidatus
8
Fig. 1.1 Différentes étapes et gènes impliqués dans le cycle d’azote.
1.1.2.2 Méthodes utilisées pour l’étude des populations microbiennes présentes dans
les marais filtrants artificiels
Différentes méthodes ont été utilisées pour étudier la composition et l’activité des populations bactériennes et fongiques présentes dans les marais filtrants artificiels (Truu et al., 2009 ; Faulwetter et al., 2009). Ces méthodes varient des méthodes considérées comme classiques, celles qui reposent sur la culture des microorganismes dans des milieux de culture solides ou liquides (Truu et al., 2009; Bahgat et al. 1999; Kern, 2003), aux méthodes moléculaires avancées telles que la réaction de polymérisation en chaîne (PCR) et la technique de polymorphisme de la longueur des fragments de restriction (RFLP) (Truu et al., 2009 ; Faulwetter et al., 2009 ; Calheiros et al., 2010 ; Sleytr et al., 2009). Plusieurs études ont relaté l’utilisation des profils métaboliques (Community-level physiological profile : CLPPs) basés sur l’utilisation des sources de carbone, azote, phosphore et soufre comme un outil accessible et rapide pour étudier la diversité métabolique microbienne des marais filtrants (Gruyer et al., 2014 ; Zhang et al., 2018 ; Zhao et al., 2012 ; Button et al., 2016 ; Lv et al., 2017).
9
Récemment, les approches métagénomiques ont été utilisées comme un outil puissant pour comprendre comment les communautés microbiennes s’adaptent et réagissent aux contaminants environnementaux, et ont permis de mieux comprendre l’impact des contaminants sur l’écologie microbienne. Plus précisément, l’application de techniques de séquençage à haut débit sur les plates-formes 454 pyroséquençage et Illumina a permis d’étudier les communautés bactériennes à une profondeur considérable et à élucider la présence des espèces à faible abondance (Xu et al., 2014 ; Yan et al., 2017 ; Cao et al., 2017 ; Xie et al., 2018).
1.1.3 Élimination des pesticides par les marais filtrants artificiels
L’utilisation des pesticides agricoles est très répandue partout dans le monde pour lutter contre les maladies et améliorer la production agricole afin d’approvisionner la population mondiale (Zhang et al., 2011; Sara and Mohammad, 2013). Au Québec par exemple, les ventes totales de pesticides en 2017 s’élèvent à 10 466 753 kilogrammes de produits commercialisés. Cette quantité brute de pesticides contient 4 114 018 kilogrammes d’ingrédients actifs (gouvernement de Québec, 2017). Cependant, les effets de ces xénobiotiques sont loin d’être souhaitables lorsqu’ils quittent les écosystèmes agricoles, notamment en s’engageant dans les cours d’eau (Olivier et al., 2012).
Les différentes sources d’eau peuvent être contaminées par plusieurs types de pesticides utilisés en agriculture menant à de graves retombées sur les écosystèmes aquatiques, les cultures agricoles et la santé humaine (Reichenberger et al., 2007 ; Dabrowski et al., 2002). Cependant, le risque pour la communauté aquatique ou pour la santé humaine peut souvent être considérablement réduit par des mesures appropriées (Kreuger et Nilsson, 2001). Récemment, l’accent a été mis sur les MFA qui sont très efficaces dans l’élimination des pesticides (Tableau 1.1). Dans ce contexte, diverses études ont relaté l’utilité des marais filtrants dans la réduction ou la minimisation des pesticides dans les effluents des cultures biologiques (Tournebize et al., 2017 ; Locke et al., 2011 ; Agudelo et al., 2012 ; Agudelo et al., 2011 ; Lyu et al., 2018 ; Budd et al., 2009 ; Schulz et Peall, 2001).
10
Les pesticides sont éliminés ou retenus dans les MFA par de nombreux processus, mais les processus les plus importants sont probablement la sédimentation, la photolyse, l’hydrolyse, l’adsorption, la dégradation microbienne et l’absorption végétale (Schulz et al., 2003; Moore et al., 2009; Zhang et al., 2014; Vymazal and Březinová, 2015; Tang et al., 2016; Wu et al., 2017). L’ampleur des processus impliqués dans l’élimination des pesticides dépend de nombreux facteurs tels que la teneur en matière organique, la qualité du matériau de filtration, le pH, les conditions redox, le temps de rétention, la masse des pesticides, la présence et le type de macrophytes (Vymazal and Březinová, 2015; Liu et al., 2019).
Les plantes forment une composante très importante dans le fonctionnement des MFA. Elles permettent non seulement d’absorber directement les contaminants des eaux usées comme les pesticides, mais aussi de supporter la croissance des microorganismes de la rhizosphère, qui jouent un rôle primordial dans la dégradation des pesticides dans les MFA, par différents mécanismes incluant la libération d’oxygène (Dordio and Carvalho, 2013) et la sécrétion de différents types d’exsudats racinaires comme des enzymes extracellulaires (Cheng et al., 2008; Pascal-Lorber and Laurent, 2011; Gao et al., 2014), des sucres (Chen et al., 2015), des acides organiques (Wang et al., 2017) et des facteurs de croissance (Segura and Ramos, 2013). Le processus d’absorption des pesticides par les macrophytes dans les MFA se fait en trois étapes: adsorption, absorption et transformation. L’adsorption se fait par contact direct entre les pesticides et les racines sous la surface de l’eau (Liu et al., 2019). Après l’adsorption des molécules de pesticides sur la surface des racines, le processus de transformation se déclenche via des enzymes extracellulaires sécrétées par la plante (Liu et al., 2019). Les polluants absorbés dans le corps de la plante peuvent être dissipés par extraction, accumulation, phytodégradation, transfert, transport et transpiration (Segura et Ramos, 2013).
La sédimentation et l’adsorption des pesticides aux substrats des MFA constituent un autre mécanisme de réduction de ces polluants au sein des marais. Différents mécanismes peuvent être impliqués dans cette adsorption tels que la partition hydrophobe (Rogers and
11
Stringfellow, 2009), les interactions de van der Waals, les interactions électrostatiques (Dordio and Carvalho, 2013; Li et al., 2014) et l’échange d’ions (Tolls, 2001). La capacité des MFA à retenir les pesticides par adsorption sur la surface des matériaux de substrat dépend des propriétés physicochimiques des pesticides et des substrats (Liu et al., 2019). En effet, selon Vagi et al., (2010), les paramètres les plus importants dans l’absorption des organophosphates au substrat des MFA sont les caractéristiques hydrophobes ou lipophiles des pesticides. De plus, la taille des particules, la porosité, la masse volumique, la surface spécifique, la teneur en minéraux (Gimsing et Borggaard, 2007 ; Maqueda et al., 2017), la capacité d’échange cationique (CEC) (Vagi et al., 2010) la teneur en matière organique (Alfonso et al., 2017 ; Pessagno et al., 2008) et plusieurs autres paramètres de substrat peuvent affecter l’adsorption des pesticides aux substrats des MFA.
Les microorganismes jouent un rôle primordial dans la minéralisation et la transformation des pesticides dans les MFA (Agudelo et al., 2011 ; Moore et al., 2009 ; Rogers et Stringfellow, 2009 ; Wang et al., 2017 ; Wu et al., 2017). Certaines études ont montré que 90 % des pesticides dans les MFA étaient éliminés par biodégradation microbienne (Moore et al., 2009 ; Wu et al., 2017). La biodégradation des pesticides dans les MFA se fait essentiellement par deux voies : une voie enzymatique et une voie non-enzymatique (Liu et al., 2019). La voie enzymatique consiste à la sécrétion des enzymes extracellulaires hydrolytiques comme la phosphatase par les microorganismes dans les MFA afin de couper des liaisons clés dans les molécules de pesticides (Karpouzas and Singh, 2006; Singh and Walker, 2010; Wu et al., 2016). La voie non enzymatique consiste à la sécrétion par les microorganismes de diverses substances comme des acides organiques et des ions hydrogènes qui vont indirectement favoriser la dégradation des pesticides (Zhang et al., 2010).
12
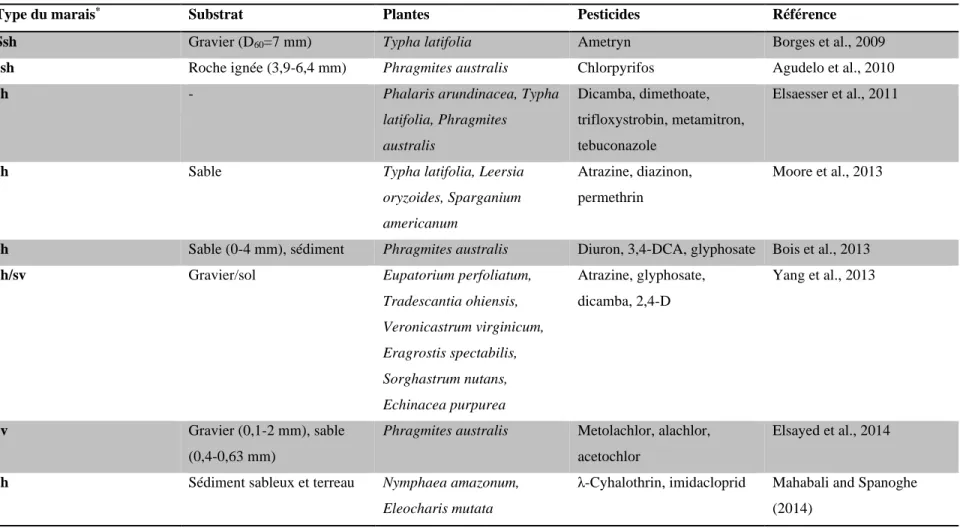
Tableau 1.1 Exemples d’utilisation des marais filtrants artificiels pour l’élimination des pesticides à partir des effluents de cultures
agricoles
*ssh : marais sous surfacique à flux horizontal ; sv : marais surfacique à flux vertical ; sh : marais surfacique à flux horizontal
Type du marais* Substrat Plantes Pesticides Référence
Ssh Gravier (D60=7 mm) Typha latifolia Ametryn Borges et al., 2009
ssh Roche ignée (3,9-6,4 mm) Phragmites australis Chlorpyrifos Agudelo et al., 2010
sh - Phalaris arundinacea, Typha
latifolia, Phragmites australis Dicamba, dimethoate, trifloxystrobin, metamitron, tebuconazole Elsaesser et al., 2011
sh Sable Typha latifolia, Leersia
oryzoides, Sparganium americanum
Atrazine, diazinon, permethrin
Moore et al., 2013
sh Sable (0-4 mm), sédiment Phragmites australis Diuron, 3,4-DCA, glyphosate Bois et al., 2013
sh/sv Gravier/sol Eupatorium perfoliatum,
Tradescantia ohiensis, Veronicastrum virginicum, Eragrostis spectabilis, Sorghastrum nutans, Echinacea purpurea Atrazine, glyphosate, dicamba, 2,4-D Yang et al., 2013 sv Gravier (0,1-2 mm), sable (0,4-0,63 mm)
Phragmites australis Metolachlor, alachlor,
acetochlor
Elsayed et al., 2014
sh Sédiment sableux et terreau Nymphaea amazonum,
Eleocharis mutata
λ-Cyhalothrin, imidacloprid Mahabali and Spanoghe
13
1.1.4 Réutilisation de l’eau traitée par les marais filtrants artificiels
1.1.4.1 Caractéristiques de l’eau traitée par les marais filtrants
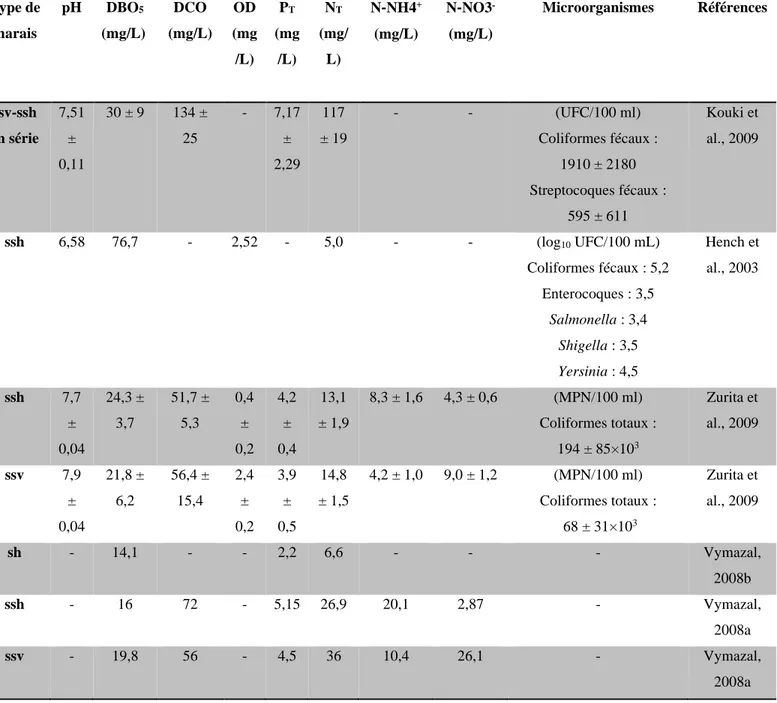
Les propriétés des eaux traitées par les marais filtrants artificiels comme le pH, la teneur en phosphore, la teneur en azote et la teneur en microorganismes varient suivant la qualité d’eau initiale et le type de marais utilisé (Kouki et al., 2009 ; Hench et al., 2003 ; Zurita et al., 2009 ; Vymazal, 2008a ; Vymazal, 2008b). Le Tableau 1.2 montre des exemples de caractéristiques des effluents pris en charge par différents types de marais.
14
Tableau 1.2 Caractéristiques des eaux traitées par des marais filtrants
DBO5 : demande biologique en oxygène ; DCO : demande chimique en oxygène ; OD : oxygène dissout ; PT
: phosphore total ; NT : azote total ; MPN : nombre le plus probable ; ssh : marais sous surfacique à flux
horizontal ; ssv : marais sous surfacique à flux vertical ; sh : marais surfacique à flux horizontal ; UFC : unité formant une colonie.
Type de marais pH DBO5 (mg/L) DCO (mg/L) OD (mg /L) PT (mg /L) NT (mg/ L) N‐NH4+ (mg/L) N‐NO3‐ (mg/L) Microorganismes Références ssv-ssh en série 7,51 ± 0,11 30 ± 9 134 ± 25 - 7,17 ± 2,29 117 ± 19 - - (UFC/100 ml) Coliformes fécaux : 1910 ± 2180 Streptocoques fécaux : 595 ± 611 Kouki et al., 2009 ssh 6,58 76,7 - 2,52 - 5,0 - - (log10 UFC/100 mL) Coliformes fécaux : 5,2 Enterocoques : 3,5 Salmonella : 3,4 Shigella : 3,5 Yersinia : 4,5 Hench et al., 2003 ssh 7,7 ± 0,04 24,3 ± 3,7 51,7 ± 5,3 0,4 ± 0,2 4,2 ± 0,4 13,1 ± 1,9 8,3 ± 1,6 4,3 ± 0,6 (MPN/100 ml) Coliformes totaux : 194 ± 85×103 Zurita et al., 2009 ssv 7,9 ± 0,04 21,8 ± 6,2 56,4 ± 15,4 2,4 ± 0,2 3,9 ± 0,5 14,8 ± 1,5 4,2 ± 1,0 9,0 ± 1,2 (MPN/100 ml) Coliformes totaux : 68 ± 31×103 Zurita et al., 2009 sh - 14,1 - - 2,2 6,6 - - - Vymazal, 2008b ssh - 16 72 - 5,15 26,9 20,1 2,87 - Vymazal, 2008a ssv - 19,8 56 - 4,5 36 10,4 26,1 - Vymazal, 2008a
15
1.1.4.2 Effet de l’eau traitée par les marais filtrants artificiels sur la croissance des
plantes et les agents phytopathogènes
Dans la littérature, on recense très peu de travaux qui ont étudié les conséquences de l’utilisation des eaux traitées par les marais filtrants artificiels comme eau d’irrigation sur la performance agronomique des cultures. Cependant, Gruyer et al. (2011) ont examiné le résultat de l’irrigation des plantes de tomates avec des effluents traités avec plusieurs marais filtrants sous-surfaciques à flux horizontal sur l’élimination de Pythium ultimum et sur le développement racinaire des plants de tomate. Les chercheurs ont constaté que la réduction de la population de Pythium au niveau des racines des plants de tomate inoculés avec cet agent phytopathogène peut atteindre un pourcentage de 100 % dans certains cas. Toutefois, l’utilisation des eaux traitées par les marais comme eau d’irrigation a eu un impact négatif sur le développement racinaire des jeunes plants de tomate non inoculés avec le pathogène. Les auteurs des travaux précités ont expliqué cet effet néfaste par la présence des composés organiques (des composés phénoliques) dans les effluents des marais examinés (Gruyer et al., 2011).
1.2 Le biochar
1.2.1 Définition
Le biochar est un résidu solide riche en carbone obtenu en brûlant de la biomasse dans des conditions privées d’oxygène ou à oxygène limité (Lehmann et al., 2011 ; Tan et al., 2015). Il présente une structure carbonée poreuse, de nombreux groupes fonctionnels et une grande surface spécifique. Récemment, il y a eu un intérêt croissant pour l’application du biochar comme amendement des sols agricoles, une approche d’amélioration des sols et de protection du climat dans de nombreux types d’applications (Weber et Quicker, 2018).
En effet, le biochar, lorsqu’il est appliqué aux sols agricoles, apporte plusieurs effets bénéfiques aux rendements des cultures agricoles (Makoto et al., 2010 ; Vaccari et al., 2011 ; Zhang et al., 2012 ; Cornelissen et al., 2018 ; Raj et al., 2018). Cette substance
16
améliore la qualité et les propriétés des sols agricoles (Laird et al., 2010a ; Laird et al., 2010 b ; Zhang et al., 2012 ; Makoto et al., 2010 ; Jindo et al., 2012 ; Jones et al., 2011 ; Yao et al., 2012 ; Vaccari et al., 2011 ; Graber et al., 2010 ; Mulcahy et al., 2013). Il contribue également à protéger l’environnement via la réduction des émissions des gaz à effet de serre (Lévesque et al., 2018 ; Agyarko-Mintah et al., 2017), la dépollution des sols contaminés par divers xénobiotiques comme les pesticides (Feng et al., 2012 ; Case et al., 2012 ; Stewart et al., 2013 ; Regmi et al., 2012) et la réduction du lessivage des nutriments du sol, dont les nitrates (Gul et al., 2015 ; Lévesque, 2017). Malgré le grand nombre d'études qui ont porté sur les effets de l'amendement des sols agricoles avec du biochar, très peu d'études ont été réalisées sur l'utilisation du biochar dans les systèmes de traiement des eaux usées.
1.2.2 Effet du biochar sur les microorganismes du sol
Les microorganismes telluriques sont parmi les principaux facteurs impliqués dans les caractéristiques et les fonctions du sol. Par conséquent, les différentes propriétés du sol comme la stabilité de sa structure, sa capacité de rétention et de recyclage des nutriments et sa respiration sont directement influencées par les populations microbiennes qui y sont présentes (Brussaard, 1997 ; Kirchman, 2018). À ce propos, les propriétés physico-chimiques du biochar ainsi que les modifications des propriétés physico-physico-chimiques du sol induites par le biochar peuvent altérer les activités des microorganismes du sol (Lehmann et al., 2011 ; Gul et al., 2015). La majorité des études qui ont examiné l’effet du biochar sur les microorganismes du sol, ont prouvé que ce dernier a un impact positif sur les communautés microbiennes du sol en stimulant l’abondance, la diversité et l’activité des microorganismes telluriques (Steiner et al., 2004 ; Makoto et al., 2010 ; Jones et al., 2011 ; Kim et al., 2007 ; O’Neill et al., 2009; Steinbeiss et al., 2009 ; Feng et al., 2012; Bailey et al., 2011 ; Jin et al., 2010; Kolb et al., 2009 ; Quilliam et al., 2013 ; Jaafar et al., 2014: Awad et al., 2018 ; Li et al., 2018 ; Xu et al., 2018). En revanche, son effet est variable selon la biomasse utilisée et les conditions de la pyrolyse lors de la production du biochar (Harter et al., 2016 ; Muhammad et al., 2014 ; Ding et al., 2016 ; Lévesque, 2017).
17
Les effets bénéfiques observés du biochar sur les microorganismes telluriques ont été interprétés par différents mécanismes (Lehmann et al., 2011 ; Niroshika et al., 2019). L’amendement du sol par le biochar améliore simultanément la masse volumique apparente du sol, le pH, le carbone organique dissout, le ratio carbone: azote, la concentration de K+, ainsi que le mouvement de l’air, de l’eau et des nutriments dans la matrice du sol (Steiner et al., 2009; Smith et al., 2010; Jones et al., 2011; Quilliam et al. 2013; Muhammad et al. 2014 ; Choppala et al. 2016 ; Wong et al. 2019). De plus, les pores du biochar servent d’habitat (Zackrisson et al., 1996 ; Pietikainen et al., 2000 ; Warnock et al., 2007 ; Quilliam et al., 2013 ; Jaafar et al., 2014 ; Ye et al., 2017 ; Awad et al., 2018) et de refuge pour les microorganismes du sol. À titre d’exemple, on cite les bactéries (taille variant de 0,3 à 3 µm), les champignons (2-80 mm) et les protozoaires (7-30 mm), qui les protègent des microarthropodes prédateurs du sol (Zackrisson et al., 1996 ; Warnock et al., 2007). De plus, grâce à sa grande capacité d’adsorption, le biochar peut limiter l’effet des substances toxiques et inhibitrices de la croissance bactérienne (Lehmann et al., 2011). La surface spécifique de biochar est une autre propriété qui peut avoir des effets bénéfiques sur les microorganismes telluriques (Jaafar et al., 2015). En effet, L’augmentation de la surface spécifique et de la porosité du biochar sont liées à l’augmentation de la capacité de rétention d’eau dans différents types de sol, ce qui améliore les activités et la croissance microbiennes (Ahmad et al. 2014; Mohamed et al. 2016 ; Wong et al. 2017). En outre, l’augmentation des nutriments observée dans le sol suite à l’amendement par le biochar peut stimuler la croissance et l’activité des microorganismes du sol (Luo et al., 2017).
1.2.2.1 Effet du biochar sur l’abondance des microorganismes du sol
Plusieurs études révèlent l’influence positive du biochar sur la hausse de la biomasse microbienne dans divers types de sols. Hale et al. (2015) ont démontré que le sol amendé avec du biochar de pin produit à 600 ° C et inoculé avec la souche Enterobacter cloacae
UW5 atteignait une densité de population bactérienne 16 % supérieure à celle du témoin
sans biochar. De plus, Ameloot et al. (2013) ont observé une augmentation de 29 % du carbone de la biomasse microbienne (P <0,05) dans un sol sablo-limoneux amendé avec du biochar de bois de saule produit à 700 ° C après 117 jours d’expérience en pots. Dans
18
une autre étude, une augmentation significative de 62 % du carbone de la biomasse microbienne en réponse à l’amendement avec du biochar dérivé de Miscanthus giganteus produit à 700 ° C, après trois mois dans un loam argileux a été rapportée (Luo et al., 2013). Dans une étude menée par Li et al. (2016), l’abondance bactérienne dans le sol a augmenté de 161 % suite à l’ajout de biochars de paille et de bois (Li et al., 2016). Cependant, certaines études ont relaté que l’application à court terme de biochars produits à des températures élevées (≥ 600 ° C) n’avait aucun effet (Luo et al., 2013) ou une influence négative sur la biomasse microbienne (Dempster et al., 2012). Par exemple, Dempster et al. (2012) ont rapporté une réduction de 28 % (P <0,05) du carbone de la biomasse microbienne en réponse à l’amendement du biochar de bois d’Eucalyptus à pyrolyse lente produit à 600 ° C.
1.2.2.2 Effet du biochar sur les communautés microbiennes du sol
Dans la littérature, on rapporte fréquemment que les biochars favorisent la structuration et la diversité des communautés microbiennes des sols (Lehmann et al., 2011 ; Anderson et al., 2011 ; Khodadad et al., 2011 ; Jindo et al., 2012 ; Gul et al., 2015 ; Xu et al., 2018 ; Luo et al., 2017). Les modifications recensées dans les caractéristiques du sol à la suite de l’ajout du biochar entraînent des modifications dans la compétitivité des communautés microbiennes présentes, ce qui favorise l’apparition de nouvelles familles microbiennes et la disparition d’autres. Cette évolution a pour résultat le réarrangement des populations microbiennes telluriques pour la mise en place d’un nouvel équilibre dans le sol (Lehmann et al., 2011 ; Anderson et al., 2011 ; Khodadad et al., 2011 ; Feng et al., 2012 ; Xu et al., 2018 ; Luo et al., 2017). Feng et al. (2012) ont étudié le mécanisme de la minimisation de l’émission du CH4 par des champs de riz après leur amendement avec le biochar à un taux
de 24 t.ha-1. Ils ont trouvé que cette diminution ne résulte pas de l’inhibition par le biochar des archées méthanogènes qui produisent le CH4, mais plutôt de la stimulation des
protéobactéries méthanotrophes qui consomment le CH4 et l’utilisent comme seule source
de carbone et d’énergie (Feng et al., 2012). De plus, Anderson et al. (2011) ont étudié l’effet de l’amendement d’un sol avec du biochar à une concentration de 10 % (v/v) sur les communautés microbiennes présentes à l’aide de la technique de polymorphisme de la
19
longueur des fragments de restriction (RFLP) jumelée au pyroséquençage 454. Ils ont démontré que les familles bactériennes présentes dans le sol étudié sont différemment affectées par le biochar : certaines familles comme les Bradyrhizobiaceae, les
Hyphomicrobiaceae, les Streptosporangineae et les Thermomonosporaceae sont stimulées
par la présence du biochar. De plus, d’autres comme les Streptomycetaceae et les
Micromonosporaceae sont inhibées par le même produit (Anderson et al., 2011). Plusieurs
études ont prouvé une amélioration de la diversité des communautés microbiennes dans le sol à la suite de l’ajout du biochar. Par exemple, les travaux de Kim et al. (2007) et de Grossman et al. (2010) ont montré que la diversité microbienne dans la Terra Preta riche en biochar est améliorée de 25 % et 80 %, respectivement, relativement à celle dans les sols de proximité dépourvus du biochar. Les études menées par Sun et al. (2013) ont trouvé un indice de Shannon presque 3 fois plus élevé à la suite de l’ajout du biochar de granulés de maïs pendant une expérience de 96 jours en pots. Quant à Hu et al. (2014), ils ont observé une diversité bactérienne 12 %, 30 % et 37 % plus élevée pour les indices Shannon, Simpson et Chao, respectivement, en comparant un sol incubé pendant 96 jours avec du biochar produit à partir d’une litière forestière avec le sol témoin. Un sol acide traité au biochar a été évalué pour les communautés microbiennes du sol par PLFA ; où une augmentation de la PLFA a été observée par rapport au sol de contrôle après 431 jours d’incubation (Luo et al., 2018). L’étude par PCR et séquençage des fragments de gène de l’ARN ribosomal 16S dans un sol traité avec un biochar a révélé que la diversité bactérienne augmentait avec l’augmentation du taux d’application du biochar (Xu et al., 2016).
1.2.2.3 Effet du biochar sur l’activité des microorganismes du sol
Les travaux de Bailey et al. (2011), Jin et al. (2010) et Kolb et al. (2009) ont montré que les changements apportés aux différentes caractéristiques du sol par l’amendement avec le biochar ont un impact direct sur l’activité et le métabolisme des communautés microbiennes présentes dans ce sol. Par exemple, diverses études ont validé le fait que la présence du biochar stimule la décomposition de la matière organique du sol (Zimmerman et al., 2011 ; Jones et al., 2011 ; Awad et al., 2012 ; Luo et al., 2011 ; Dias et al., 2010 ;
20
Lehmann et al., 2011). Luo et al. (2011) ont montré que le fait d’ajouter deux types de biochar préparés à deux températures différentes améliore la minéralisation du carbone organique natif de deux sols ayant des pH différents. Les auteurs ont trouvé qu’après 87 jours d’incubation, le biochar produit à 350 °C mène à une augmentation de CO2 respiré
de 250 et de 319 mg CO2-C g-1 sol dans les sols acide et basique, respectivement (Luo et
al., 2011). Selon Zimmerman et al. (2011), la dégradation du carbone organique du sol peut augmenter de 89 % suite à l’amendement de ce sol avec le biochar.
Il est évident que les enzymes extracellulaires du sol sont parmi les facteurs clés de la décomposition de la matière organique et des cycles des éléments nutritifs (Burns et al., 2013 ; Dahlawi et al., 2018). Par conséquent, l’impact du biochar sur l’activité des enzymes extracellulaires du sol est important. Les données disponibles mettent en relief un effet variable des biochars sur les activités enzymatiques extracellulaires (Bailey et al., 2011 ; Awad et al., 2012 ; Daquan et al., 2012 ; Paz-Ferreiro et al., 2012 ; Ameloot et al., 2013 ; Masto et al., 2013). De plus, l’impact du biochar sur l’activité enzymatique du sol dépend de l’interaction du substrat et de l’enzyme avec le biochar (c.-à-d. sorption et désorption des substrats et des enzymes sur la surface du biochar ; Bailey et al., 2011 ; Lammirato et al., 2011). Plusieurs travaux ont rapporté que les activités enzymatiques dans le sol sont stimulées par l’ajout du biochar (Bailey et al., 2011 ; Jin et al., 2010 ; Awad et al., 2012 ; Bhaduri et al. 2016 ; Mierzwa-Hersztek et al. 2016 ; Irfan et al. 2019). À titre d’exemple, les activités de la phosphatase alcaline, de l’aminopeptidase et de la N-acetylglucosaminidase sont nettement améliorées par l’ajout au sol de 2 % (v/v) de biochar (Bailey et al., 2011). Similairement, une augmentation de l’activité de la phosphatase alcaline de 615 % a été observée par Jin (2010) après l’amendement d’un Alfisol avec du biochar. Awad et al. (2012) ont remarqué que l’ajout du biochar stimule la dégradation des résidus de maïs dans le sol ; ils ont attribué cette observation à plusieurs mécanismes parmi lesquels l’augmentation des activités de β-cellobiohydrolase, de β-glucosidase et de chitinase. En outre, une augmentation de l’activité de la déshydrogénase dans des sols amendés en biochar a été observée avec différents types de biochar dans différentes conditions de sol (Bhaduri et al. 2016 ; Mierzwa-Hersztek et al. 2016 ; Irfan et al. 2019). Cependant, selon la littérature, les biochars ayant une plus grande porosité et une plus
21
grande surface spécifique devraient réduire l’activité enzymatique extracellulaire, puisque les groupes fonctionnels de ces biochars ont tendance à se lier aux substrats et aux enzymes extracellulaires, interférant ainsi avec la vitesse de diffusion du substrat vers le site actif de la catalyse enzymatique (Bailey et al., 2011 ; Lammirato et al., 2011 ; Jaiswal et al., 2018). Ce point est soutenu par Ameloot et al. (2013) qui ont observé, lors d’une étude d’incubation de 117 jours, une réduction de 47 % de l’activité de la déshydrogénase avec du biochar produit à 700 ° C et une augmentation de 73 % de cette activité avec du biochar produit à 350 ° C. Ces résultats peuvent être expliqués par l’effet de la température de production de biochar sur ses propriétés physico-chimiques. En effet, l’augmentation de la température de production de biochar induit une augmentation de pH, de la surface spécifique totale, du ratio C:O et du ratio C:N et une diminution de la matière organique dissoute et de contenu en carbone (Crombie et al. 2013; Huff et al. 2014). De plus, Jaiswal et al. (2018) ont révélé que le biochar peut immobiliser et désactiver des enzymes qui dégradent la paroi cellulaire et qui sont produites par Fusarium oxysporum f. sp. radicis
lycopersici.
1.2.3 Décontamination des sols pollués par les pesticides à l’aide du biochar La contamination des sols et des cours d’eau par les pesticides est un problème majeur qui menace l’équilibre et la stabilité de nos écosystèmes. Au cours des dernières années, des recherches de plus en plus poussées ont été effectuées sur les effets bénéfiques du biochar en rapport avec l’atténuation des pesticides (Atkinson et al., 2010 ; Lehmann et al., 2011 ; Wang et al., 2012 ; Tatarkova et al., 2013 ; Jin et al., 2016 ; Deng et al., 2017 ; Liu et al., 2018). Le biochar attire de plus en plus l’attention sur sa capacité à réduire la biodisponibilité des pesticides (Cabrera et al., 2011 ; Barrow, 2012 ; Chen et al., 2012 ; Ahmad et al., 2014). Il a également été reconnu que la présence de biochar dans le sol améliore non seulement la sorption des différents pesticides, mais aussi la nature des mécanismes de sorption et la biodisponibilité des résidus de pesticides pour les organismes vivants (Yang et Sheng, 2003 ; Yu et al., 2006 ; Kookana et al., 2011).