Utilisation de nanoparticules plasmoniques pour la
détection de biomolécules et l’étude des fluctuations
ioniques
Mémoire
Philippe Legros
Maîtrise en chimie
Maître ès sciences (M. Sc.)
Québec, Canada
© Philippe Legros, 2018Résumé
En raison de leur petite taille, les nanomatériaux présentent des propriétés différentes par rapport à leur homologue à l’échelle macroscopique. Une oscillation collective des électrons de conduction, le plasmon, est observée lorsqu’une nanoparticule métallique (par exemple: Ag, Au, In, Cu) est irradiée à une fréquence spécifique. Dans le cadre de ces travaux de maîtrise, la conception de deux types de capteurs utilisant la plasmonique a été accomplie. Le premier capteur aura pour but de détecter des complexes immuns alors que le second aura pour but de détecter de subtiles variations chimiques. Il est possible d’utiliser la plasmonique pour étudier les variations d’indice de réfraction. La reconnaissance spécifique d’un antigène par un anticorps greffé sur une nanoparticule métallique induit un changement d’indice de réfraction local, affectant ainsi la fréquence du plasmon qui peut être mesurée en spectrophotométrie. Au cours de ce projet de maîtrise, un substrat lamellaire supportant des nanocubes d’argent immobilisés par un film de polydopamine a été préparé pour la détection rapide des complexes immuns. La répétabilité, la sélectivité et la sensibilité de ce biocapteur ont été étudiées. En raison de sa sensibilité et rapidité de mesure, ce type de substrat pourrait devenir un outil intéressant pour contrer la fraude alimentaire.
En plus de pouvoir sonder le milieu environnant, les nanoparticules plasmoniques peuvent augmenter la fluorescence intrinsèque de fluorophores positionnés à proximité, ce qui a pour avantages d’augmenter la sensibilité du signal analytique et d’améliorer la photostabilité du fluorophore. La deuxième partie de cette maîtrise porte sur la conception d’une fibre optique supportant des nanoparticules fluorescentes dans le but de détecter de faibles variations chimiques dans un réseau synaptique. Pour ce faire, une nanoarchitecture plasmonique ionosensible a été développée, puis greffée au bout d’une fibre optique. Finalement, une preuve de concept a pu être réalisée afin de montrer l’efficacité et l’applicabilité de ces capteurs fibrés.
Abstract
Due to their relatively small size, nanomaterials display properties different from bulk material. The collective oscillation of conduction electrons, called plasmon, is observed when a metallic nanoparticle (e.g. Ag, Au, In, Cu) is irradiated at a specific wavelength. In this research project, two sensors based on plasmonic properties have been developed and characterized. The first one aims to detect immunocomplexes, while the other one aims at detecting subtle chemical variations.
The first sensor will use plasmonics to detect refractive index variations. Specific recognition of an antigen by its corresponding antibody induces a local refractive index and thus affects the plasmon’s frequency, which is measured using spectrophotometry. Throughout this project, a lamellar substrate supporting silver nanocubes coated with a thin film of polydopamine has been prepared for the rapid detection of immunocomplexes. Properties such as repeatability, selectivity, and sensitivity have also been studied. Due to its sensitivity and speed of measurement, this type of substrate could become an interesting tool to fight meat fraud.
In addition to being able to detect the surrounding environment, plasmonic nanoparticles can increase the intrinsic fluorescence of a fluorophore positioned nearby, which increases the intensity of the analytical signal and improves the fluorophore’s photostability. The second part of the project will focus on the conception of a fiber optic probe supporting fluorescent nanoparticles in order to detect small chemical variations in synaptic networks. For this purpose, an ionosensitive plasmonic nanoarchitecture has been developed and grafted to the end of a fiber optic. Finally, a proof of concept wasdone to show the efficiency and applicability of these fibered sensors.
Table des matières
Résumé ... iii
Abstract... iv
Table des matières ... v
Liste des figures ... vii
Liste des tableaux ... xi
Abréviations et symboles ... xii
Remerciements ... xv Avant-propos ... xvii 1. Introduction ... 1 2. Théorie ... 3 2.1 Fluorescence ... 3 2.1.1 Mécanisme de fluorescence ... 4
2.1.2 Rendement quantique et temps de vie de fluorescence ... 5
2.1.3 Extinction de fluorescence ... 6
2.1.4 Mécanisme de transfert énergétique résonant ... 7
2.2 Sondes fluorescentes ... 8
2.3 Plasmonique ... 10
2.3.1 Modulation de la fréquence plasmon... 11
2.3.2 Détection de l’environnement par LSPR ... 14
2.3.3 Exaltation de la fluorescence par un métal ... 15
2.4 Synthèse et contrôle des systèmes colloïdaux ... 17
2.4.1 Nucléation et croissance ... 17
2.4.2 Contrôle de la géométrie ... 19
2.4.3 Stabilité colloïdale ... 21
2.4.4 Synthèse de nanoparticules métalliques ... 22
2.4.5 Procédé sol-gel de Stöber ... 24
2.5 L’immunologie diagnostique ... 25
2.5.1 Les anticorps et les antigènes ... 25
2.5.2 Interaction anticorps-antigène ... 26
2.5.3 Techniques de détection ... 26
2.5.3.1 Technique immuno-enzymatique... 27
2.5.3.2 Application de la plasmonique à la détection de type ELISA ... 28
3. Méthodes expérimentales... 30
3.1 Méthodes de synthèse ... 30
3.1.1 Réactifs chimiques et matériels spécifiques ... 30
3.1.2 Préparation des capteurs LSPR pour la détection de protéines ... 30
3.1.2.1 Protocole détaillé de la synthèse de nanocubes d’argent ... 31
3.1.2.2 Protocole détaillé de l’assemblage des capteurs LSPR ... 31
3.1.3 Préparation des capteurs à fibre optique ... 32
3.1.3.1 Protocole détaillé de la synthèse de NPs Ag par croissance contrôlée ... 33
3.1.3.2 Protocole détaillé de la croissance de la couche de silice ... 34
3.1.3.3 Préparation des capteurs fibrés ... 35
3.2 Méthodes de caractérisation ... 37
3.2.2 Spectroscopie de fluorescence ... 38
3.2.3 Microscopie électronique ... 38
3.2.4 Spectrométrie photoélectronique X ... 39
3.2.5 NanoSight ... 40
4. Développement d’un capteur LSPR pour la détection d’antigènes ... 42
4.1 Assemblage des nanocubes ... 42
4.2 Polymérisation de la dopamine ... 45
4.3 Évaluation de la sensibilité et de la figure de mérite du capteur ... 47
4.4 Greffage des anticorps ... 48
4.5 Répétabilité du capteur ... 51
4.6 Biodétection sélective ... 52
4.7 Conclusions partielles ... 53
5. Développement d’une fibre optique pour la détection des fluctuations ioniques... 55
5.1 Propriétés optiques des nanoparticules fluorescentes ... 56
5.2 Préparation du capteur fibré ... 60
5.3 Développement d’une plateforme optique ... 62
5.4 Mesure du pH en temps réel ... 63
5.5 Conclusion partielle ... 64
6. Autres manipulations ... 65
6.1 Préparation de fibres creuses... 65
6.2 Greffage par chimie clic photoactivée ... 67
6.3 Conclusion partielle ... 70
7. Conclusion et perspectives ... 71
Liste des figures
Figure 1. A) Exemples de fluorophores commerciaux et B) des exemples de la bande d'absorption et
de la bande d'émission.26... 3
Figure 2. Diagramme de Jablonski. ... 4
Figure 3. Schéma montrant le mécanisme de l'extinction dynamique et statique. ... 7
Figure 4. Condition spectrale pour favoriser le transfert énergétique. La bande d'émission d'un donneur doit recouvrir la bande d'absorption d'un accepteur.26 ... 7
Figure 5. A) Exemples de sondes fluorescentes et B) leurs spectres respectifs.26 ... 9
Figure 6. A) Structure moléculaire de la fluorescéine et B) sa dépendance au pH.28 ... 10
Figure 7. Schéma conceptuel d'un plasmon de surface localisé (LSPR).34 ... 10
Figure 8. A) Exemple de plasmons pour des sphères d'indium, d'argent et d'or. B) facteur de qualité (Q) de différents métaux.33 ... 11
Figure 9. Plasmons de différentes géométries de nanoparticule d’argent. Dans l'ordre: Sphère, cube, triangle plat, tétraèdre, octaèdre et bâtonnet. 35 ... 12
Figure 10. Spectres calculés d'une nanoparticule d’argent de A) 20 et B) 100 nm montrant les différentes contributions d'absorption et de diffusion.33... 13
Figure 11. A) Diffusion élastique de nanoparticules d’argent dans différents milieux diélectriques (air, méthanol, propanol, chloroforme et benzène) et B) la dépendance linéaire du plasmon à l’indice de réfraction.1 ... 13
Figure 12. A) Mesure de l’indice de réfraction environnant (haut) et détection moléculaire (bas). B) déplacement LSPR selon la nanostructure choisie.36,38 ... 14
Figure 13. Diagramme de Jablonski montrant l’influence d’un plasmon sur la fluorescence.34 ... 16
Figure 14. Importance de la distance métal-fluorophore. A) schéma montrant la courbe du MEF en fonction de la distance42 et B) les différentes contributions des effets.47 ... 16
Figure 15. Relation entre l’énergie libre de nucléation, l'énergie libre molaire de cristallisation, l'énergie libre de surface et le rayon critique de nucléation.54 ... 18
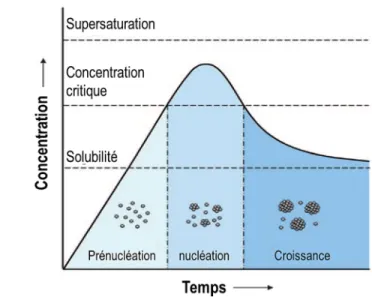
Figure 16. Diagramme de LaMer montrant le mécanisme de nucléation et de croissance.53 ... 19
Figure 17. Schéma montrant deux scénarios possibles des processus cinétiques ou thermodynamiques impliqués. A) des réactions parallèles ou B) une séquence de réactions.57 ... 20
Figure 18. Schéma montrant l'importance de la nature du stabilisant sur la croissance d'un germe.57 ... 21
Figure 19. Interaction entre deux particules en fonction de la distance. La barrière répulsive est la somme des forces de répulsion électrostatique et des forces attractives de Van der Waals.58 ... 21 Figure 20. Schéma montrant la stabilisation électrostatique (A) et par encombrement stérique (B).59 ... 22 Figure 21. Synthèse de nanoparticules par la réduction citrate en une étape. ... 23 Figure 22. Synthèse de nanoparticules par croissance contrôlée : synthèse de germes par
nucléation rapide, puis croissance par étapes pour l'obtention de la taille désirée.25 ... 23 Figure 23. Représentation simplifiée de la réaction de Stöber.118 ... 24 Figure 24. Schéma d'un anticorps. Différentes parties : les chaînes lourdes (bleu), les chaînes légères (vert) et les sites de reconnaissance de l’antigène (cercle pointillé). ... 25 Figure 25. Techniques de détection ELISA. De gauche à droite: méthode directe, indirecte et
sandwich.77 ... 27 Figure 26. Schéma d'un spectrophotomètre UV-visible de marque Cary 50.102 ... 37 Figure 27. Schéma du spectrofluorimètre Fluorolog3 de marque Horiba Jobin-Yvon.103 ... 38 Figure 28. A) Composantes d'un microscope électronique en transmission (TEM) et B) TEM
commercialisé par FEI.104 ... 39 Figure 29. A) L’appareil NanoSight NS300 commercialisé par Malvern et le B) schéma montrant le fonctionnement de l’appareil.107... 41 Figure 30. Caractérisation des nanocubes d'argent. A) Plasmon des nanocubes dans l'eau et B) micrographies TEM. ... 43 Figure 31. Schéma montrant les étapes pour immobiliser les AgNCs sur le substrat de verre. ... 44 Figure 32. Caractérisation du substrat fonctionnalisé de nanocubes d’argent. A) spectre UV-visible des nanoparticules en solution (gris) et immobilisées sur le substrat de verre (noir). B) micrographie SEM du substrat fonctionnalisé. ... 44 Figure 33. Extinction plasmonique avant (gris) et après (noir) le dépôt de polydopamine (temps de réaction de 15 minutes). ... 45 Figure 34. A) Chambre fluidique pour prendre les mesures en spectroscopie UV-visible. B)
Déplacement LSPR dans différents mélanges eau et glycérol. ... 47 Figure 35. Schéma montrant le greffage des anticorps sur la couche mince de polydopamine. ... 49 Figure 36. Influence du tampon PBS sur un capteur avec et sans polydopamine. ... 50
Figure 37. Plasmon du substrat aux différentes étapes d'assemblage: plasmon du substrat couvert de AgNCs (gris pointillé), substrat fonctionnalisé de PDA (gris) et substrat fonctionnalisé avec les anticorps (noir). ... 50 Figure 38. Évaluation de la répétabilité du capteur LSPR aux étapes de fonctionnalisation des AgNCs (bleu), la polydopamine pendant 30 minutes (orange) et des anticorps (gris). ... 51 Figure 39. Schéma montrant la biodétection sélective sur le capteur LSPR. ... 52 Figure 40. Biodétection sélective d'antigènes de porc par rapport à des contrôles négatifs (cheval et bovin) et un blanc (PBS). A) Plasmons correspondants et B) déplacements LSPR induits par les antigènes. ... 53 Figure 41. Caractérisation des nanoparticules de (27 ± 4), (40 ± 5), (60 ± 8) et (74 ± 10) nm. A) imagerie électronique et B) leur plasmon correspondant.25 ... 57 Figure 42. Caractérisation des Ag@SiO2 par A) imagerie électronique et par B) déplacement de la bande LSPR.25 ... 58 Figure 43. A) Facteur d'exaltation (MEF) et B) comparaison des mesures de spectroscopie et de temps de vie de fluorescence de l'échantillon (74 ± 10) nm.25 ... 59 Figure 44. Schéma de la stratégie de greffage des Ag@SiO2-FiTC sur la fibre optique par chimie clic. ... 60 Figure 45. Caractérisation d'une fibre optique fonctionnalisée de Ag@SiO2-FiTC par SEM. Coin supérieur droit: image en microscopie de fluorescence montrant la fluorescence de la fibre optique.61 Figure 46. A) Schéma simplifié et B) photographie de la plateforme optique utilisée pour la
caractérisation des fibres optiques. ... 62 Figure 47. Mesure en alternance en temps réel dans des tampons PBS de pH 5,8 et 7,8 utilisant d'une fibre optique fonctionnalisée de Ag@SiO2-FiTC ... 64 Figure 48. Profil de la fibre optique et le marquage élémentaire du silicium et germanium ... 65 Figure 49. A) Schéma de la préparation de fibres optiques creuses et B) cinétique de dissolution du cœur et de la gaine d’une fibre à indice de réfraction.117 ... 66 Figure 50. Profil des fibres optiques plongées dans le HF à des temps de 2, 3, 5 et 10 minutes. ... 66 Figure 51. Méthodologie de la chimie clic photoactivée.99 ... 67 Figure 52. A) Structure moléculaire du photoinitiateur et B) son spectre d'absorption dans l’éthanol. ... 68
Figure 53. Micrographies SEM d’une fibre fonctionnalisée de Ag@SiO2-FiTC par chimie clic
photoinduite à des temps d’exposition de 10, 30 et 60 minutes. ... 69 Figure 54. Micrographies SEM d’une fibre optique fonctionnalisée de Ag@SiO2-FiTC par chimie clic photoactivée à des concentrations de photoinitiateur de 5, 10, 17 et 30 mM. Le temps d’exposition est de 60 minutes. ... 69
Liste des tableaux
Tableau 1. Volume de TEOS à ajouter pour la croissance d'une couche de silice modulable ... 34 Tableau 2. Performances analytiques du biocapteur LSPR ... 48
Abréviations et symboles
ΔG Énergie libre de Gibbs
Ag@SiO2-Fluorophore Nanoparticule d’argent recouverte d’une couche de silice fluorescente
AgNC Nanocube d’argent
APTES (3-aminopropyl)triéthoxysilane
AUTS 11-azidoundecyltriméthoxysilane
ELISA Enzyme-linked immunosorbent assay
FiTC Fluorescéine isothiocyanate
FOM Figure of merit
FWHM Full width at half maximum
k Constante de Boltzmann
LSPR Localized surface plasmon resonance
MEF Metal-Enhanced Fluorescence
NP Nanoparticule
PBS Tampon phosphate salin
PDA Polydopamine
PI Photoinitiateur
PTSC O-(propargyloxy)-N-(triethoxysilylpropyl)-carbamate
PVP Poly(vinylpyrrolidone)
RET Resonant energy transfer
SEM Scanning Electron microscopy
T Température
TEM Transmission Electron microscopy
TEOS Tétraéthyl orthosilicate
TRIS Trishydroxyméthylaminométane
u.a. Unité arbitraire
UIR Unité d’indice de réfraction
UV Ultraviolet
“The good thing about science is that it's true whether or not you believe in it.”
- Neil deGrasse Tyson “We've always defined ourselves by the ability to overcome the impossible.” - Joseph Cooper “Winter is coming.” - Eddard Stark
À mes parents et mes amis, vous qui avez cru en moi, sans quoi je ne serais pas rendu l’homme que je suis aujourd’hui, merci infiniment…
Remerciements
Pour avoir soutenu mes stages et mes recherches de maîtrise, je tiens à donner mes plus sincères remerciements à mon superviseur de recherche, Prof. Denis Boudreau. Vous avez été un mentor excellent et enrichissant. Vous m’avez pris dans votre équipe et vous avez supporté mes recherches toutes ces années. Vous m’avez permis d’établir mon indépendance intellectuelle et développer mon esprit critique. Votre laboratoire est un endroit agréable pour venir travailler. Je garde en mémoire d’agréables moments et discussions en votre compagnie. Encore une fois : merci pour votre confiance, votre soutien… merci infiniment Denis!
Marie-Pier Lambert. Je tiens à remercier Marie-Pier Lambert, ma collègue et amie avec qui j’ai eu la
chance de partager mes cinq années d’études. Nos samedis passés à travailler sur nos rapports de laboratoire, nos innombrables discussions matinales portant sur la prémisse « qu’est-ce tu as fait hier
soir? » ont toujours été appréciées le matin en dégustant le café. Que ça soit mes pieds puants, notre
projet inachevé sur le FRET, notre acharnement sur Jérémie et son bowling, je garde un très joyeux souvenir de toi et je te souhaite une carrière à la hauteur de ton enthousiasme, ta persévérance et ta bonne humeur éternelle.
Jérémie Asselin. Tu es probablement la personne la plus ostineuse sur la planète, mais je crois que
ma tête de cochon est la raison pour laquelle on s’est bien entendus pendant ces dernières années. Je retiens d’agréables souvenirs : la frustration perpétuelle à chaque partie de tennis ou même les heures à débattre si la rhubarbe fait du bruit, les débats impitoyables sur les séries télévisées ou les films. J’ai apprécié nos longues conversations à caractère scientifique et philosophique. J’ai encore plus apprécié les milliers (et je n’exagère presque pas) de memes que nous avons partagés avec les années. J’attends de toi des parties de tennis à 6h30, des sorties au cinéma pour voir Star Wars sur nos heures de travail et finalement PEUT-ÊTRE un bowling. Plus sérieusement, tu m’as aidé à grandir et développer mon esprit critique et scientifique. Sincèrement, cette maîtrise n’aurait jamais été possible sans ton aide précieuse. Je te souhaite une carrière académique enrichissante, parce oui tu es destiné à ça! Bonne chance!
Samuel Ouellet. Sam, tu es une personne dévouée et persévérante, je sais que tu vas percer, car tu
as une grande gueule! C’est une qualité, ne t’en fais pas! Merci énormément pour ton aide en optique et pour nos discussions pertinentes sur la physique des plasmons (que je ne comprends pas encore…). Je souhaite bon courage dans tes projets futurs!
Alexandre Grégoire. Tu m’as beaucoup aidé pour le côté optique de mon projet, tu es toujours présent
pour nous aider lorsqu’on rencontre des difficultés dans nos projets. Encore plus important, nos discussions politiques, économiques et culturelles du matin sont toujours appréciées en ta compagnie (sauf sur le communisme). Bonne chance futur papa!
Mélina Drouin. Mélina-san! Je retiens le débat éternel Marvel et DC! J’ai apprécié les discussions que
nous avons eues, tu es toujours ouverte pour aider tes collègues et c’est ce que j’apprécie grandement chez toi!
Josée Richard Daniel. Je voulais surtout te remercier pour l’aide que tu as apportée à mon projet. Nos discussions étaient pertinentes et elles ont aidé de façon substantielle mon projet. Bonne chance pour ta thèse Mme Vegan!
Félix-Antoine Lavoie. Félix, source de sagesse… Nos midis enflammés par ta présence me manquent! Je voulais te remercier pour ton aide en salle blanche. Tu m’as introduit et grandement aidé à la conception de montages optiques!
Maxime Rioux. Merci pour l’aide apportée pour la synthèse de cubes et les innombrable discussions de tennis.
Je n’oublie pas les stagiaires du groupe qui m’ont apporté une aide substantielle, spécialement Nicolas Fontaine, Alexe Grenier, Lydia Parent et Xavier Lafleur.
Ce mémoire est le fruit de persévérance et de soutien par ma famille et mes amis. À mes parents, ma sœur et mon petit frère qui m’ont enduré toutes ces années. Alexandre Dallaire-Vallée et Nicolas Pratte, mes plus vieux amis sans qui je n’aurais jamais eu le courage de continuer.
Avant-propos
Une partie de ce travail de maîtrise a mené à la publication de l’article suivant :
« Correlating metal-enhanced fluorescence and structural properties in Ag@SiO2 core-shell
nanoparticles »
Jérémie Asselin, Philippe Legros, Alexandre Grégoire, Denis Boudreau
Département de chimie et Centre d’optique photonique et laser (COPL), Université Laval, Québec, QC G1V 0A6, Canada
Cet article dont je suis co-auteur a été soumis au journal Plasmonics de la maison d’édition Springer le 4 décembre 2015 et accepté le 2 mars 2016. Ce présent mémoire résume les points importants du manuscrit qui ont été utilisés pour la suite du projet présenté au chapitre 5.
Le manuscrit a principalement été rédigé par Jérémie Asselin. Pour ma part, j’ai écrit la section méthodologique et j’ai fait la recherche bibliographique. Les révisions ont été faites par l’ensemble des auteurs. J’ai réalisé la synthèse et l’optimisation des nanoparticules d’argent et leur caractérisation (UV-visible, TEM). Aussi, j’ai participé à la caractérisation par temps de vie de fluorescence des Ag@SiO2-FiTC. Toutes les autres parties de l’article, soit la synthèse de la coquille de silice, la coquille fluorescente, leur caractérisation (spectroscopie de fluorescence, UV-visible, TEM) et le traitement de données ont été faites par Jérémie Asselin. Les réflexions scientifiques constituant la discussion de l’article se basent sur des hypothèses faites par Jérémie Asselin, Alexandre Grégoire et moi-même.
1. Introduction
L’utilisation de nanomatériaux comme outil analytique a été introduite dans les années 1990 et représente aujourd’hui un domaine de recherche en plein essor. Ces dernières années, les chercheurs tentent d’intégrer les nanomatériaux aux capteurs pour atteindre une sensibilité de l’ordre de la molécule unique, pour la livraison ciblée de médicaments ou pour bénéficier de leurs propriétés particulières afin mieux comprendre des mécanismes moléculaires ou biologiques. Pour nommer quelques avantages, ces nano-objets permettent d’augmenter le rapport surface sur volume, d’améliorer la sensibilité de détection1 et d’amplifier un signal analytique.2,3 Les applications visées sont principalement la catalyse,4,5 la livraison ciblée de médicaments6,7 et l’imagerie médicale.8 Le développement de capteurs est aussi un champ d’application important. Les capteurs peuvent être utilisés pour produire un signal optique, électrochimique ou thermique trouvant ainsi des applications dans plusieurs domaines, comme les matériaux, la métallurgie, la médecine, la microbiologie, etc.9 Ils permettent de diagnostiquer et des maladies, de doser des espèces chimiques ou même de comprendre des mécanismes biologiques.
Les nanomatériaux sont des objets d’une taille typiquement inférieure à 100 nm ayant des propriétés différentes de celles à l’échelle macroscopique. Tout dépendant de l’application visée, ils peuvent être utilisés en suspension ou être immobilisés sur un substrat, comme une lame ou lamelle de verre,10,11 un microcircuit,12 des microparticules6 ou une fibre optique.13 Plusieurs types de nanomatériaux ont été élaborés ces dernières années, comme des points quantiques,14 des matériaux poreux,6 des matériaux de carbone (polymère, dendrimère, fullerène, nanotube, nanodiamant, graphène),15,16 des nanoparticules métalliques17 et des nanoparticules de lanthanide.18
Ce projet de maîtrise avait pour but le développement et l’étude de deux types de capteurs optiques supportant des nanoparticules plasmoniques. Le premier est un capteur pour la détection de biomolécules, soit la reconnaissance d’un antigène par son anticorps spécifique pour contrer la fraude alimentaire. Pour ce faire, la plasmonique a été utilisée en quantifiant le déplacement de la fréquence plasmon suite à la capture de ces biomolécules. Le second capteur, quant à lui, utilise également la plasmonique, mais dans le but d’augmenter l’intensité de fluorescence pour détecter des espèces ioniques dans le milieu synaptique.
En 2013, l’Agence Alimentaire de l’Irlande a répertorié plusieurs contaminations de cheval dans la viande de bœuf.19 Afin de lutter contre cette fraude, les scientifiques cherchent de nouvelles méthodes de détection rapides, sensibles et efficaces. Les techniques usuelles, soit l’électrophorèse, ELISA ou la chromatographie, demandent beaucoup de temps d’analyse et de personnel de laboratoire, ce qui peut devenir problématique.20 En collaboration avec le Prof. Luiz Heneine, de l’Université de Minas Gerais au Brésil, un capteur plasmonique a été mis au point pour détecter les protéines animales rapidement et de manière sélective. Pour ce faire, des nanocubes plasmoniques ont été greffés sur une lame de microscope, puis encapsulés dans une matrice de polydopamine. Enfin, les anticorps ont été greffés de façon covalente à ce polymère. La détection sélective de l’antigène par cet anticorps se mesure en spectrophotométrie par un déplacement bathochrome de la bande plasmonique.
La compréhension du système nerveux est d’une importance essentielle pour le diagnostic de maladies neurodégénératives ou dans le but de mieux comprendre comment les neurones décodent et transfèrent l’information dans le réseau synaptique. Pour ce faire, l’étude des fluctuations ioniques (Na+, Ca2+, Cl-, K+) et électriques permet de tirer plus d’information des mécanismes en jeu.21–24 En collaboration avec le Prof. Paul De Koninck, une fibre optique a été développée dans le but de quantifier ces fluctuations. Cette fibre optique a été fonctionnalisée de nanoparticules plasmoniques recouvertes d’une couche de silice fluorescente sensible aux ions.25 Les fluorophores bénéficient de l’exaltation de fluorescence par un métal pour quantifier de très faibles concentrations d’ions. Les avantages d’utiliser ce type de support est d’acheminer et de récolter la lumière d’excitation et de fluorescence à même la fibre optique, puis de sonder localement une région d’intérêt. Une plateforme optique a été mise au point pour caractériser ces nouveaux capteurs et une première preuve de concept a été réalisée à l’aide d’une mesure de pH en temps réel dans des solutions homogènes. Ce mémoire est divisé en plusieurs sections. Tout d’abord, une section théorique traite des principes fondamentaux de la fluorescence et de la plasmonique. Le chapitre suivant, la section expérimentale et méthodologique, se concentre sur les protocoles de synthèse et d’assemblage des capteurs ainsi que les diverses techniques de caractérisation. Finalement, les trois chapitres suivants présentent les résultats obtenus pour ces deux capteurs étudiés, suivis des conclusions et des perspectives de ce projet.
2. Théorie
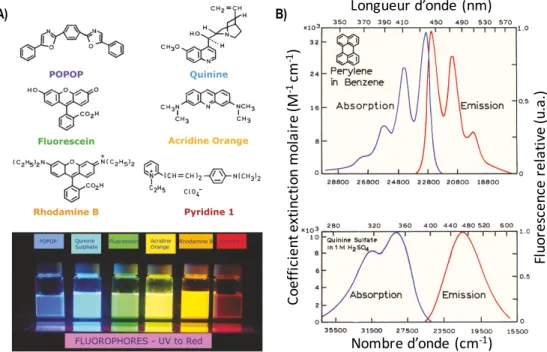
2.1 FluorescenceLa photoluminescence est l’émission de lumière d’une substance impliquant la relaxation d’un état électronique excité atteint suite à l’absorption d’un ou de plusieurs photons.26,27 La photoluminescence se décompose en deux phénomènes, soit la fluorescence et la phosphorescence. La Figure 1A montre des exemples de fluorophores commerciaux, des molécules aromatiques, ayant des spectres de fluorescence allant de la région de l’UV jusqu’au proche infrarouge. Comme il est possible de le voir, les bandes d’absorption et d’émission de ces fluorophores dépendent grandement de leur structure moléculaire (Figure 1B). L’intérêt de la fluorescence réside, entre autres, dans sa sensibilité de détection qui provient du déplacement de Stokes. Ainsi, comme la fluorescence est spectralement distincte de l’absorption, on obtient un rapport signal sur bruit très élevé. Cette technique représente un avantage considérable pour des applications en imagerie et en spectroscopie analytique.
Figure 1. A) Exemples de fluorophores commerciaux et B) des exemples de la bande d'absorption et de la bande
d'émission.26 A) B) Co ef fic ie nt e xt in ct io n m ol ai re (M -1 cm -1) Longueur d’onde (nm) Nombre d’onde (cm-1) Fl uo re sc en ce r el at iv e (u. a.)
2.1.1 Mécanisme de fluorescence
Le diagramme de Jablonski est un excellent outil pour bien comprendre les différents processus électroniques de la fluorescence (Figure 2). Une molécule ayant des propriétés de fluorescence, un fluorophore, peut absorber un photon et amener un électron de l’état fondamental électronique S0 vers un état excité (exemple : S1 ou S2). L’absorption, représentée par hvA à la Figure 2, est un processus rapide de l’ordre de la femtoseconde (10-15 s). Si l’électron est excité dans l’état énergétique S2, il retournera généralement à l’état S1 par un mécanisme non radiatif appelé conversion interne, typiquement de l’ordre de la picoseconde (10-12 s). De plus, en raison des différents niveaux vibrationnels des fluorophores organiques, illustrés par les traits horizontaux fins à la Figure 2, l’électron devra d’abord revenir à l’état vibrationnel le plus bas en énergie, S1, avant de pouvoir retourner à l’état S0. Avec le principe de Frank-Condon, ces pertes non radiatives d’énergie
vibrationnelle sont responsables de la largeur souvent considérable (plusieurs dizaines de nanomètres) des bandes d’absorption et d’émission des fluorophores organiques.
Lorsque l’électron atteint l’état vibrationnel le plus bas en énergie de l’état S1, il peut emprunter quatre chemins pour revenir à l’état électronique S0. Le premier implique un transfert énergétique non radiatif par collision dynamique ou statique, Q, par des composantes du milieu (des molécules de solvant, par exemple). Un autre chemin possible est le transfert de l’état singulet vers l’état triplet, T1, par un croisement intersystème. Le croisement intersystème implique le transfert à un état de multiplicité différente par un couplage spin-orbite; c’est un transfert non favorable. Le couplage spin-orbite est une interaction entre le moment magnétique orbitalaire de l’électron et son moment magnétique de spin. Dans certain cas où le milieu est rigide ou que la température est très basse, il est possible d’observer ce phénomène par l’émission de phosphorescence. Le temps de vie de l’état triplet excité est relativement long, de l’ordre de la milliseconde ou de la seconde. Le troisième chemin est la conversion
interne de l’état S1 à S0, un phénomène non radiatif. Finalement, le dernier chemin de désexcitation est de retourner à l’état fondamental en émettant un photon de fluorescence. Ce dernier est un processus d’une durée de quelques nanosecondes à quelques centaines de nanosecondes (10-9 s), et décrit comme le temps de vie de fluorescence. Le photon de fluorescence est typiquement moins énergétique que le photon absorbé, car il passe par des étapes de conversion interne. Cette perte énergétique se manifeste sur le spectre par l’écart entre la bande d’absorption et d’émission (Figure 1); c’est le déplacement de Stokes.26
2.1.2 Rendement quantique et temps de vie de fluorescence
Le rendement quantique et le temps de vie de fluorescence représentent des paramètres importants pour la caractérisation des fluorophores. Lorsque l’électron excité se trouve à l’état S1, il devient sensible à l’extinction de fluorescence via des transferts non radiatifs affectant ainsi ses propriétés, notamment son rendement quantique et son temps de vie de fluorescence. Le rendement quantique (ɸ) est décrit comme le rapport du nombre de photons émis sur le nombre de photons absorbés. Plus concrètement, c’est le rapport entre le taux d’émission radiative du fluorophore (Γ) et la somme de tous les chemins de désexcitation, radiatifs et non radiatifs (knr) comme la conversion interne (kci) et le croisement intersystème (kc.sys.) (équation 1). Ainsi, lorsque les phénomènes non radiatifs sont importants, le fluorophore n’aura pas une forte intensité de fluorescence.
ɸ = 𝛤
𝛤 + 𝑘&' =
𝛤
𝛤 + 𝑘() + 𝑘(.,-,. [1]
Le temps de vie de fluorescence (τ) est un paramètre décrivant le temps moyen d’un électron à l’état excité précédant son retour à l’état fondamental. La fluorescence étant un phénomène aléatoire indépendante du temps (t), dont le retour à l’état fondamental peut être décrit par l’équation exponentielle suivante : 𝐼(0) = 2 𝐴) ) &45 𝑒(40/8) 𝑜ù 𝜏 = 1 𝛤 + 𝑘&' [2]
Où I(t) est l’intensité en fonction du temps et A représente l’amplitude.
2.1.3 Extinction de fluorescence
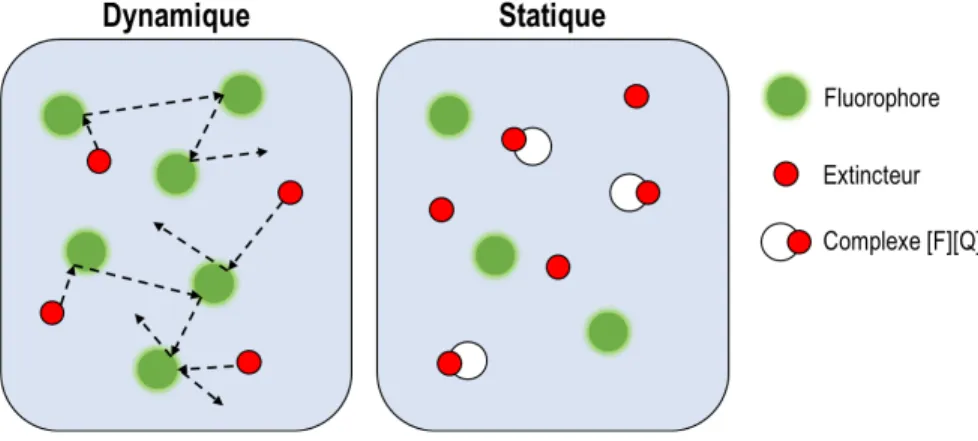
L’extinction de fluorescence représente la perte d’intensité lumineuse suite à des mécanismes de transfert énergétique non radiatifs. Tout d’abord, il y a l’extinction dynamique. Lorsque l’électron se trouve à un état énergétique supérieur, il peut soit émettre un photon de fluorescence ou perdre son énergie par voie collisionnelle au profit d’une autre espèce moléculaire et ainsi relaxer de façon non radiative. L’extinction dynamique survient lorsque le fluorophore transmet son énergie à une autre molécule, un extincteur, par le rapprochement de ces deux espèces, voire un contact entre eux (Figure 3). Le rayon d’action est typiquement 2 Å.26 Ce phénomène produit alors une diminution de l’intensité et du temps de vie de fluorescence. Cette diminution de fluorescence dépend directement de la concentration de l’extincteur, car une augmentation de cette dernière augmente les probabilités de collision. Il est possible de décrire ce mécanisme par l’équation de Stern-Volmer (KSV):26
𝐹>
𝐹 = 1 + 𝐾@A[𝑄] = 1 + 𝑘E𝜏>[𝑄] [3]
Dans cette expression, la constante de Stern-Volmer (KSV) décrit la sensibilité d’un fluorophore face à l’extinction de fluorescence dynamique. Celle-ci dépend de la constante d’extinction bimoléculaire (kq), du temps de vie en absence de l’extincteur (τ0) et de la concentration de l’extincteur ([Q]). Une façon de protéger les fluorophores est de les encapsuler dans une matrice limitant la diffusion des extincteurs, diminuant ainsi la valeur de KSV. Des exemples communs d’extincteurs, pour des fluorophores en milieu aqueux, sont l’oxygène moléculaire et les anions halogénures. Le couplage spin-orbite entre le fluorophore excité et ces extincteurs favorise le croisement intersystème.
D’un autre côté, lorsque l’extinction est due à la formation d’un complexe non fluorescent qui empêche la promotion d’un électron à l’état excité du fluorophore, c’est de l’extinction statique. Contrairement à l’extinction dynamique, celle-ci est gouvernée par les constantes d’association du fluorophore et de l’extincteur. Ainsi, une protéine ou une molécule peut inhiber la fluorescence à l’état fondamental par la formation d’un complexe avec le fluorophore, voir Figure 3. Il est important de noter que ces différents
mécanismes d’extinction ne sont pas en soi des désavantages. En effet, ils peuvent être utilisés pour la détection d’espèces chimiques par extinction de fluorescence.
Figure 3. Schéma montrant le mécanisme de l'extinction dynamique et statique.
2.1.4 Mécanisme de transfert énergétique résonant
Le transfert énergétique résonant (RET) est un autre mécanisme possible impliquant l’état excité d’un fluorophore. Celui-ci implique un couplage dipôle-dipôle entre deux molécules : un donneur (D) et un accepteur (A). Pour que le phénomène se produise, un donneur à l’état excité transfère son énergie à un accepteur. Certaines conditions doivent être respectées pour favoriser ce phénomène. Tout d’abord, il est nécessaire que la bande d’absorption de l’accepteur recouvre la bande d’émission du donneur (Figure 4). Ensuite, l’orientation parallèle des dipôles et une faible distance entre ces deux espèces chimiques sont favorables. Finalement, le rendement quantique du donneur doit être élevé. Il est important de noter qu’il est possible d’utiliser le RET comme une règle moléculaire en raison de sa
𝐸 = 1
1 + G 𝑅𝑅
>I
J [4]
Figure 4. Condition spectrale pour favoriser le transfert énergétique. La bande d'émission d'un donneur doit recouvrir la
bande d'absorption d'un accepteur.26
Absorption de l’accepteur Émission du donneur Fl uor es ce nc e ou abs or pt ion Longueur d’onde
dépendance à la distance. L’équation suivante établie la relation entre la distance (R) entre les deux molécules et le rayon de Förster (R0) pour laquelle l’énergie de RET est de 50% :
La distance à laquelle le RET est égale à 50% s’appelle la distance de Förster, typiquement de 20 à 90 Å.26 Ce type d’interaction est également appelé transfert énergétique résonant de type Förster (FRET). Expérimentalement, on mesure l’efficacité de transfert en comparant l’intensité ou le temps de vie de fluorescence du donneur en absence et en présence d’un accepteur.
Un autre phénomène de type RET est l’échange électronique de type Dexter.26 Celui-ci se produit à très courte distance, typiquement 10 Å, et il est notamment associé au phénomène d’extinction. Il se base sur le transfert d’un électron excité du donneur, vers la LUMO de l’accepteur, alors que ce dernier transfère un électron de sa HOMO au donneur, laissant ainsi l’accepteur avec un électron dans son état excité. Ce phénomène est peu observé, car il est généralement dominé par le RET, qui se manifeste à de plus grandes distances que l’échange de type Dexter.
Finalement, les transferts énergétiques résonants ne sont pas uniquement attribués à des donneurs et accepteurs de nature différente, donc de type hétérotransfert. L’homotransfert est un type de RET impliquant deux molécules identiques. Ce type d’interaction est notable lorsque le déplacement de Stokes est faible, autrement dit, lorsque les bandes d’absorption et d’émission du fluorophore se recouvrent.
2.2 Sondes fluorescentes
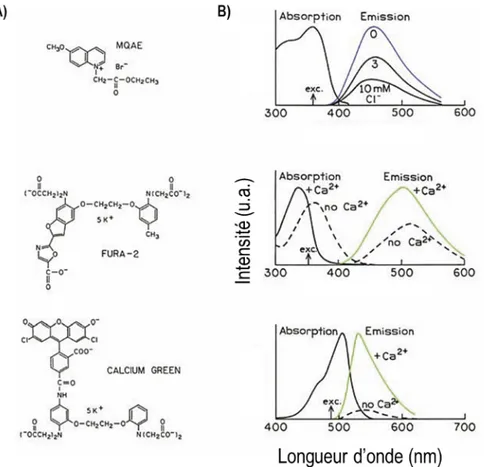
L’intérêt des fluorophores organiques réside dans leur sensibilité à certaines espèces chimiques (Figure 5). Par exemple, la fluorescence du N-(ethoxycarbonylmethyl)-6-methoxyquinolinium bromide (MQAE) est affectée par l’extinction dynamique en présence de chlorure, ce qui en fait une sonde idéale pour mesurer cette espèce chimique. Par ailleurs, certains fluorophores sont fonctionnalisés avec des groupements complexants qui changent de conformation en présence d’un ion ou d’une molécule. Ce changement de conformation implique alors une variation de fluorescence. D’autres techniques utilisant l’extinction dynamique ou statique existent dans le même but. Ainsi, il est possible d’utiliser la fluorescence pour quantifier les espèces chimiques d’un milieu d’intérêt. Le Fura-2 et le Calcium Green sont des fluorophores sensibles au Ca2+, toutefois les deux ont des mécanismes d’action différents. Dans le premier cas, il affecte l’absorption en provoquant un déplacement de son
maximum. Dans l’autre cas, l’intensité de la bande d’émission du Calcium Green est augmentée en présence d’ions calcium.
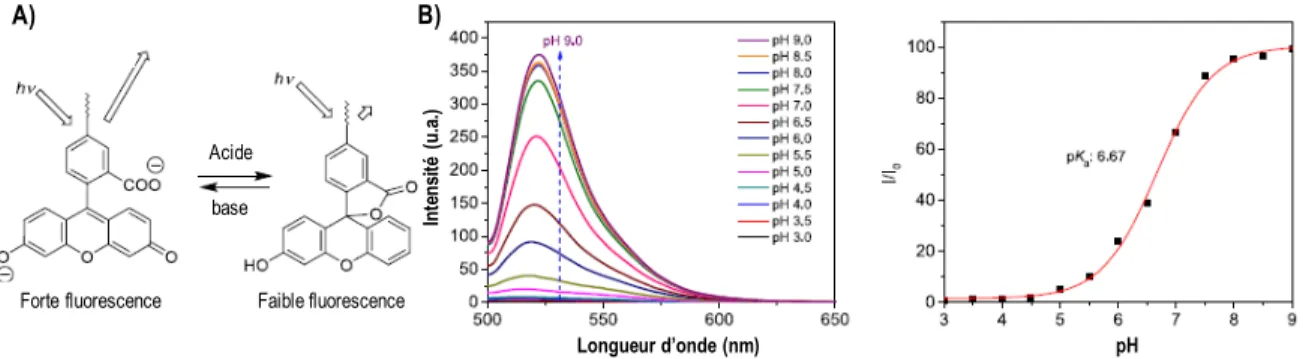
La fluorescéine est un autre exemple intéressant. Ce fluorophore est connu pour son rendement quantique dépendant du pH, ce qui induit une réponse d’émission linéaire dans le domaine physiologique (pH = 5-8).28–30 Ce comportement s’explique par le fait que la forme dianionique de la fluorescéine a un rendement de fluorescence plus élevé que sa forme anionique ou neutre (Figure 6). Donc, cette sonde est un candidat idéal pour la mesure de pH en milieu physiologique.31,32
2.3 Plasmonique
La plasmonique est un phénomène physique impliquant la manipulation des ondes électromagnétiques en dessous de la limite de diffraction. Lorsqu’un mince film ou une nanoparticule (NP) métallique entre en résonance avec la lumière incidente, une oscillation collective des électrons de conduction est observée, ce qui génère un champ électrique, le plasmon.33 Dans le cas des films métalliques, le phénomène est défini comme étant une propagation du plasmon de surface (SP). D’un autre côté, une nanoparticule métallique induit un plasmon de surface localisé (LSPR) confiné dans sa structure en 3
dimensions formant ainsi un dipôle oscillant (Figure 7). Le LSPR comporte deux composantes : la diffusion et l’absorption. La somme de ces composantes est définie comme l’extinction. La fréquence du plasmon dépend principalement de la composition chimique, de la géométrie, de la taille et le diélectrique du milieu environnant.34
Figure 7. Schéma conceptuel d'un plasmon de surface localisé (LSPR).34
Figure 6. A) Structure moléculaire de la fluorescéine et B) sa dépendance au pH.28
Longueur d’onde (nm) pH
Acide base
Forte fluorescence Faible fluorescence
In te ns ité ( u. a.) A) B)
2.3.1 Modulation de la fréquence plasmon
Pour une application visée, le choix de la fréquence plasmon peut être un paramètre important. Par conséquent, il est intéressant de contrôler la fréquence plasmonique de la nanostructure en changeant sa géométrie, sa taille, sa composition chimique et le milieu dans lequel il se trouve.
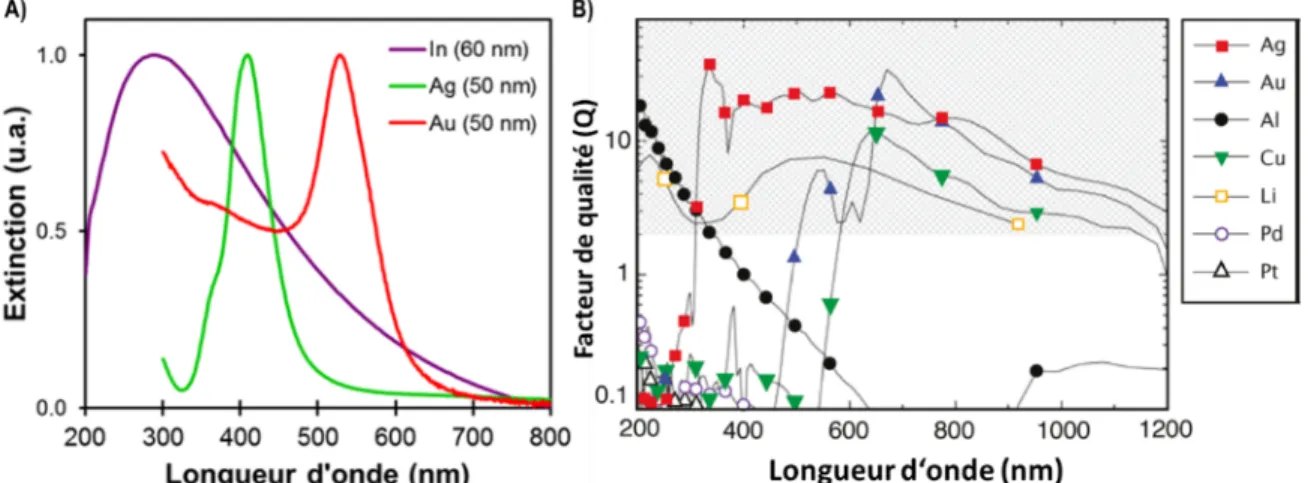
Tout d’abord, la fréquence et l’intensité du plasmon dépendant du métal choisi. La Figure 8A montre le plasmon de nanoparticules sphériques d’indium, d’argent et d’or qui ont des plasmons dans l’UV et dans le visible (300, 400 et 550 nm respectivement). Par ailleurs, ils n’ont pas tous la même intensité. L’intensité d’un plasmon est décrite par son facteur de qualité (Q) et qui représente l’interaction des électrons de conduction avec la lumière. Il est possible de voir à la Figure 8B le facteur de qualité de certains métaux en fonction de la longueur d’onde. On y voit que l’argent est le matériau ayant le meilleur facteur de qualité sur la plage du visible et, par conséquent, son plasmon sera le plus intense. L’or, l’aluminium, le cuivre et le lithium suivent. Toutefois leur haute réactivité, hormis l’or, avec l’environnement fait qu’ils ne sont pas des choix envisageables pour beaucoup d’applications. De plus, malgré son plasmon intéressant, l’utilisation de nanoparticules d’argent soulève beaucoup de questions en lien avec leur cytotoxicité.33
Figure 8. A) Exemple de plasmons pour des sphères d'indium, d'argent et d'or. B) facteur de qualité (Q) de différents
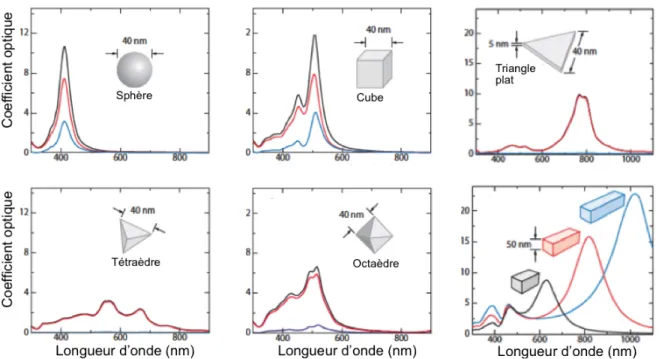
D’un autre côté, la géométrie de la nanostructure va également influencer sa fréquence plasmonique, mais aussi le profil spectral du plasmon observé. Ainsi, une nanoparticule ayant plusieurs axes de symétrie différents (des bâtonnets, des cubes ou des octaèdres) va montrer plusieurs fréquences de résonance plasmonique (Figure 9). Les bâtonnets sont un cas intéressant, car il est possible d’exciter soit l’axe longitudinal à plus basse énergie ou l’axe transversal à plus haute énergie. Parallèlement, dans le cas d’un cube, d’un octaèdre ou d’un tétraèdre, comme le diamètre n’est pas égal en tout point, il y aura plusieurs fréquences de résonance dans un même plasmon.35
La taille joue un rôle important, car les propriétés d’absorption et de diffusion vont changer. Dans le cas d’une sphère, on observe un mode plasmonique dipôle intense à 410 nm où l’absorption et la diffusion sont d’amplitude similaire (Figure 10A). Cependant, lorsqu’on augmente la taille de la nanoparticule, la diffusion devient la contribution principale et fait apparaitre un nouveau mode plasmonique, le quadripôle (Figure 10B). Ce mode provient de la non-uniformité de la lumière incidente à travers la sphère donnant alors deux dipôles distincts dans une même nanoparticule.
Figure 9. Plasmons de différentes géométries de nanoparticule d’argent. Dans l'ordre: Sphère, cube, triangle plat,
Finalement, le plasmon est dépendant de la fonction diélectrique du milieu dans lequel il se trouve. Le modèle de Drude décrit le comportement électronique d’un métal. Après arrangement, il est possible de poser :
𝜆LMN = 𝜆OP𝑛LR + 1 [5]
Où λmax est la fréquence du plasmon, λP la longueur d’onde de la fréquence plasma du métal à l’échelle macroscopique et nm l’indice de réfraction du milieu environnant. De cette équation, on peut déduire que la fréquence du plasmon varie de façon relativement linéaire avec l’indice de réfraction. Concrètement, cela se traduit en un déplacement du plasmon en augmentant l’indice de réfraction du milieu (Figure 11).1,36 Cette propriété est notamment utilisée dans la détection de molécules par LSPR.
Figure 11. A) Diffusion élastique de nanoparticules d’argent dans différents milieux diélectriques (air, méthanol, propanol,
chloroforme et benzène) et B) la dépendance linéaire du plasmon à l’indice de réfraction.1
Figure 10. Spectres calculés d'une nanoparticule d’argent de A) 20 et B) 100 nm montrant les différentes contributions
2.3.2 Détection de l’environnement par LSPR
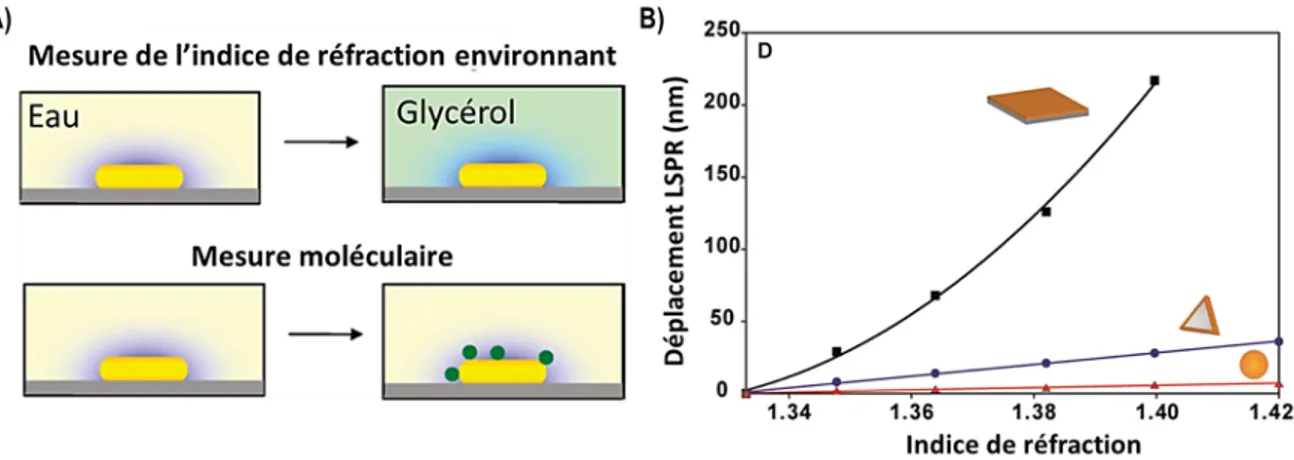
Le déplacement de la bande LSPR peut être utilisé pour détecter la présence de molécules et de changements du milieu environnant. Il y a quelques années, des travaux ont démontré l’efficacité de cette approche et des limites de détection dans l’ordre du zeptomolaire (10-21 M).37 La figure 12A montre ce concept pour la mesure de l’indice de réfraction d’un milieu et la détection de molécule. Une nanoparticule immobilisée sur un substrat dans l’eau (n= 1,33) va avoir une fréquence plasmon définie. Toutefois, cette fréquence sera changée si le milieu environnant est remplacé par le glycérol (n=1,47). Expérimentalement, il sera possible d’observer un déplacement du plasmon à de plus basses énergies. De même manière, une protéine ou une molécule adsorbée à la surface d’une NP va provoquer le même type d’effet. C’est-à-dire qu’il y aura une variation de la fréquence plasmon en raison du changement local de l’indice de réfraction. C’est ainsi qu’il est possible d’observer en temps réel l’attachement d’un antigène à son anticorps sélectif, car il va induire un changement d’indice de réfraction.
La sensibilité de ces mesures par déplacement LSPR dépend de la nanostructure choisie. Il est important que le plasmon soit d’une forte intensité et qu’il y ait la présence de points chauds où le champ électrique local est plus élevé, par exemple près des arêtes des nanostructures ou dans l’interstice d’un dimère plasmonique. De ce fait, il y a un avantage considérable à utiliser des métaux nobles comme l’argent ou l’or et à utiliser des géométries ayant des arêtes (cube, carré plat, etc.).36,38 La Figure 12B met en évidence le déplacement de la bande plasmon en fonction de la nanostructure choisie. Dans cet exemple, les sphères ne sont pas un cas idéal, car le déplacement de la bande est
Figure 12. A) Mesure de l’indice de réfraction environnant (haut) et détection moléculaire (bas). B) déplacement LSPR
très faible. D’un autre côté, le carré plat est une structure intéressante où sa bande plasmon se déplace de plus de 200 nm en changeant l’indice de réfraction de 0,07 unité.
On évalue les performances analytiques d’un capteur LSPR par sa sensibilité au changement d’indice de réfraction et de sa figure de mérite. Tout d’abord, sa sensibilité, S,36 est définie par :
𝑆 =𝑑𝜆𝑑𝑛 [6]
La sensibilité, S, est la variation du déplacement plasmonique par la variation du changement d’indice de réfraction. Expérimentalement, c’est la pente de la droite générée. Néanmoins, la sensibilité ne tient pas compte de la précision sur la mesure de ce déplacement, c’est pourquoi les performances d’un capteur plasmonique sont décrites par sa figure de mérite,36 FOM :
𝐹𝑂𝑀 = 𝑆
𝐹𝑊𝐻𝑀 [7]
Où S est la sensibilité et FWHM est la largeur à mi-hauteur de la bande plasmonique. Cette expression par le fait que plus une bande spectrale est mince, plus il est facile de mesurer précisément son maximum. Ainsi, si les nanoétoiles atteignent de hautes sensibilités en raison de leurs nombreuses pointes plasmoniques, leur figure de mérite est très faible, car la bande plasmonique s’étend typiquement sur 600 nm. Autrement dit, les nanoétoiles sont sensibles, mais elles ne sont pas précises.39 Il y a d’autres variantes à la figure de mérite impliquant une correction supplémentaire par l’intensité relative de la mesure, toutefois cette correction n’a pas été utilisée lors de cette maîtrise.36
2.3.3 Exaltation de la fluorescence par un métal
Le plasmon peut être utilisé pour augmenter l’intensité de fluorescence résultant ainsi en une sensibilité de détection accrue.40,41 Ce phénomène est appelé exaltation de fluorescence par un métal (MEF, « metal-enhanced fluorescence »). Il est possible de mieux comprendre l’effet d’un métal sur la fluorescence par un diagramme de Jablonski modifié (Figure 13).26,34,42
Deux mécanismes entrent en jeu dans ce phénomène. Premièrement, en raison du champ électrique local intense généré par le plasmon, le fluorophore a une meilleure section efficace de capture et son taux d’absorptivité va augmenter. Deuxièmement, le taux d’émission va augmenter en raison de l’interaction du fluorophore à l’état excité et de la nanoparticule plasmonique. Il va y avoir une interaction dipôle-dipôle induit favorisant ainsi le retour du fluorophore à l’état fondamental. Ainsi, il y a une diminution du temps de vie de fluorescence. Une conséquence majeure de cet effet est une meilleure photostabilité, car un fluorophore qui reste moins longtemps à l’état excité est moins vulnérable face aux mécanismes menant à la photodégradation.25,43,44 Finalement, le degré de recouvrement entre le plasmon et les bandes d’absorption et d’émission du fluorophore est un facteur important pour maximiser l’exaltation de fluorescence.45,46
La distance entre le métal et le fluorophore est un paramètre critique pour ce phénomène (Figure 14). D’abord, l’extinction de la fluorescence par transfert énergétique non radiatif vers la nanoparticule
Figure 14. Importance de la distance métal-fluorophore. A) schéma montrant la courbe du MEF en fonction de la
distance42 et B) les différentes contributions des effets.47
prédomine à de courtes distances. Puis, à partir d’une certaine portée, on observe une augmentation des taux d’absorption et d’émission, menant alors au MEF. Finalement, lorsque le champ électrique ne se fait plus sentir par l’émetteur à de longues distances, il y a un retour aux propriétés intrinsèques du fluorophore (I0).47
Un autre facteur important concerne le matériau plasmonique. La distance d’extinction et d’augmentation du MEF est propre à chaque nanostructure. Par exemple, il est connu que l’argent à un facteur d’exaltation maximal sur la plage de 5 – 10 nm à partir de la surface de la nanoparticule, alors que cette même plage d’augmentation se trouve, pour l’or, vers 15 – 20 nm.25,48,49 Une façon de positionner le fluorophore à une distance optimale est d’ajouter une couche formée d’un matériau diélectrique (silice, polymère) ou une chaîne moléculaire (alcane, ADN, biomolécule) à la surface de la nanoparticule et d’y incorporer ou d’y greffer une espèce fluorescente.50,51 L’ajout de la silice sur une nanoparticule sera discuté dans la section sur le procédé sol-gel.
2.4 Synthèse et contrôle des systèmes colloïdaux
La synthèse des nanomatériaux est un domaine en plein essor en raison de la polyvalence et des propriétés uniques de ces matériaux. Or, pour les raisons détaillées précédemment, il est important dans ce projet de contrôler leur taille, leur géométrie, leur stabilité colloïdale, leur concentration et leur composition chimique.17,52,53 Cette section portera donc sur les différents paramètres cinétiques et thermodynamiques qui peuvent être modulés lors de la préparation de nanomatériaux. D’autres aspect, tels que la stabilisation de ces systèmes, les protocoles de synthèse et la fonctionnalisation des nanoparticules seront également abordées.
2.4.1 Nucléation et croissance
La nucléation est un processus par lequel un germe est utilisé comme support pour permettre la cristallisation d’une espèce chimique. La nucléation peut être expliquée de façon thermodynamique.54 L’énergie libre de la nucléation (ΔGn) est la somme de l’énergie libre de surface (ΔGs) et l’énergie libre molaire de cristallisation (nΔGcristal).
Le processus de nucléation ne peut se produire que si le coût énergétique de cristallisation équivaut au cout de création de nouvelle surface. L’interdépendance de ces deux facteurs résulte en un rayon critique (Figure 15). Un cristal de taille inférieure à ce rayon va spontanément se dissoudre, alors qu’un germe ayant un rayon supérieur va croître. Afin d’augmenter la probabilité de nucléation, la valeur de ΔGcristal doit être négative. Donc, il suffit d’augmenter la concentration de monomère à un niveau critique de nucléation.
Ces considérations thermodynamiques peuvent être expliquées par le diagramme de LaMer (Figure 16).55 Ce schéma divise le processus de nucléation et de croissance en trois phases : la prénucléation, la nucléation et la croissance. Tout d’abord, dès l’initiation de la réaction chimique, la concentration des espèces est bien en dessous de la solubilité, ce qui rend la réaction thermodynamiquement non favorable. Après un certain temps, la concentration augmente et atteint une concentration critique ou de saturation. À ce stade, la nucléation n’a pas encore lieu, car le coût de création de surface est encore supérieur à la formation de germes stables. Il y a nucléation lorsque la concentration atteint le seuil de la concentration critique. D’un point de vue énergétique, la nucléation est favorable, car l’énergie de cristallisation couvre le coût énergétique de création de surface (équation 8). Pendant la nucléation, les précurseurs sont consommés, ce qui aura pour effet de diminuer la concentration de réactifs disponibles. Enfin, à l’étape de croissance, les réactifs restants sont utilisés pour la croissance des germes permettant d’augmenter la taille des nanoparticules.
Figure 15. Relation entre l’énergie libre de nucléation, l'énergie libre molaire de cristallisation, l'énergie libre de surface
et le rayon critique de nucléation.54
Én er gi e lib re , Δ Gn ΔGn ΔGs ΔGcristal
La nucléation est l’étape critique pour obtenir une population uniforme de nanoparticules. Par conséquent, une nucléation rapide favorise la formation instantanée de germes de tailles similaires. Pour ce faire, il suffit d’utiliser un réducteur fort et l’injecter rapidement au milieu. À l’opposé, l’utilisation d’un réducteur faible favorise une nucléation sur un plus long intervalle de temps et la formation de nanoparticules de haute polydispersité.
Pour terminer, un autre mécanisme qui peut influencer la polydispersité de la population de NPs est le mûrissement d’Ostwald. C’est un processus impliquant le réarrangement des nanoparticules en solution. De ce fait, dans le cas où les nanoparticules ont des tailles différentes, les plus petites d’entre elles sont plus susceptibles de se dissoudre au profit des plus grosses NPs dans le but de diminuer l’énergie de surface.56 Le mûrissement d’Ostwald est principalement dépendant du temps et de la concentration d’ions métallique à l’étape de croissance.
2.4.2 Contrôle de la géométrie
La synthèse de nanoparticules métalliques ne se limite pas uniquement à la préparation de nanoparticules ayant la forme d’une sphère. Il est possible de former différentes géométries de nanoparticules métalliques à l’aide du contrôle des paramètres thermodynamiques ou cinétiques.57 En effet, une réaction chimique peut mener à la transformation d’un réactif (le précurseur métallique) en des produits I ou II en fonction de la compétition entre des procédés thermodynamique et cinétique (Figure 17). Autrement dit, des barrières d’activation d’énergies différentes peuvent séparer le réactif
des produits cinétique et thermodynamique. Par exemple, alors que la réaction cinétique peut se faire à plus basse température, il faut nécessairement une plus haute température pour obtenir le produit thermodynamique majoritaire (Figure 17A). En réalité, le processus est plus complexe et c’est pourquoi les synthèses de nanoparticules vont mener, dans certains cas, à une grande variété de géométries. Cette variété dépend de plusieurs facteurs, notamment l’activité réductrice, la viscosité, la nature des précurseurs et des solvants, etc. La figure 17B illustre les nombreux minima présents lors d’une synthèse piégeant le produit à des états cinétiques stables. Par conséquent, il peut être difficile d’obtenir le produit cinétique désiré.
L’ajout d’un agent stabilisant de facettes cristallines est un élément de contrôle à considérer pour l’obtention de géométries particulières. Ainsi, lorsqu’un agent stabilisant est ajouté dans le milieu réactionnel, il vient stabiliser une des facettes cristallines en rendant son énergie de surface plus faible. Ainsi, la facette cristalline couverte sera moins prompte à la croissance, maximisant ainsi son expression dans la structure finale. La figure 18 montre l’exemple d’un germe métallique pouvant suivre deux chemins réactionnels possibles. Dans un premier cas, l’utilisation d’un agent stabilisant pour les facettes [100], le stabilisant illustré par les points rouges, montre l’expression grandissante de ces facettes. La formation d’un cube est alors possible. D’un autre côté, l’utilisation d’un agent stabilisant de nature différente, ayant plus d’affinité pour la facette [111], montre la croissance dans un autre axe favorisant ainsi la formation de bipyramides. Le citrate de sodium et la poly(vinylpyrrolidone) (PVP) sont des exemples d’agents stabilisants couramment utilisés en synthèse pour la stabilisation des facettes [111] et [100], respectivement. Finalement, il est important de mentionner que la concentration du stabilisant aura un impact significatif sur le taux de recouvrement et donc sur la structure finale.
Figure 17. Schéma montrant deux scénarios possibles des processus cinétiques ou thermodynamiques impliqués. A)
Figure 18. Schéma montrant l'importance de la nature du stabilisant sur la croissance d'un germe.57
2.4.3 Stabilité colloïdale
L’énergie libre d’interface entre les nanoparticules est toujours de valeur positive, sinon le contraire impliquerait qu’il y a miscibilité entre les phases. Par conséquent, les colloïdes sont thermodynamiquement instables et il devient nécessaire de stabiliser ces systèmes de façon cinétique en ajoutant suffisamment de répulsion interparticulaire. La théorie de Derjaguin, Verwey, Laudau et Overbeek (DVLO) décrit l’interaction entre les énergies d’attraction et de répulsion électrostatique de Van der Waals et la barrière à franchir pour que le système colloïdal soit stable (Figure 19). Une solution est stable lorsque les forces répulsives dominent les forces attractives avec une énergie supérieure à 10 kT.58 Donc, si deux nanoparticules entrent en collision avec assez d’énergie pour
Figure 19. Interaction entre deux particules en fonction de la distance. La barrière répulsive est la somme des forces de
répulsion électrostatique et des forces attractives de Van der Waals.58
Distance interparticule Én er gi e Barrière répulsive Forces attractives de Van der Waals Répulsion électrostatique
franchir cette barrière répulsive, les forces d’attraction seront dominantes et il y aura agrégation colloïdale. Il y a deux façons de stabiliser une suspension de nanoparticules: la méthode électrostatique et la méthode stérique.
La stabilisation électrostatique implique l’utilisation de charges afin de créer suffisamment de répulsions électrostatiques pour empêcher l’adhérence des NPs (Figure 20A). Dans ce cas, la force ionique du système joue un rôle essentiel à la stabilité colloïdale. De son côté, la stabilisation stérique consiste à ajouter des molécules encombrantes pour défavoriser le rapprochement des NPs (Figure 20A). Les polymères sont des excellents exemples de la méthode d’encombrement stérique.52,59
2.4.4 Synthèse de nanoparticules métalliques
L’optimisation des synthèses de nanoparticules continue à faire l’objet d’études intensives dans le but de créer une librairie de géométries et de tailles différentes. Parmi les méthodes de synthèses ascendantes, la réduction par le citrate, la croissance contrôlée et le procédé polyol sont les plus utilisées.
La réduction d’un sel AgNO3 par le citrate est une synthèse simple et encore très utilisée aujourd’hui pour la génération rapide et à rendement élevé de NPs d’argent en milieu aqueux.33,60 Brièvement, elle implique l’ajout du précurseur métallique dans de l’eau à ébullition contenant le citrate, qui sert de réducteur et de stabilisant, et à laisser la réaction procéder sous ébullition pendant une heure (Figure 21). Malgré son efficacité, cette méthode de synthèse offre peu de contrôle sur la polydispersité, la géométrie et la taille des colloïdes.
La réduction par le citrate présente plusieurs lacunes qu’une méthode de croissance contrôlée peut régler. Le principe de la croissance contrôlée est d’enchaîner plusieurs étapes successives de synthèse pour avoir un meilleur contrôle de la forme. De cette façon, les étapes de nucléation et de croissance sont indépendantes, ce qui donne des populations de faible polydispersité. Typiquement, la nucléation se fait à l’aide d’un réducteur fort pour obtenir des germes uniformes. Puis, ces germes
sont utilisés pour poursuivre la croissance jusqu’à la taille désirée par l’ajout d’un stabilisant, d’un réducteur faible et du précurseur métallique. Cette dernière étape est similaire à la réduction par le citrate détaillée précédemment. Par contre, la croissance contrôlée permet la modulation de la géométrie et de la taille jusqu’à 200 nm, comme il a été démontré dans la littérature.61–65
Finalement, la synthèse polyol est connue pour sa polyvalence, sa robustesse et sa reproductibilité de synthèse. De plus, il est possible d’avoir un contrôle fin de la taille et de la géométrie en modifiant la température, la concentration des réactifs et la présence d’ions à l’état de trace.66–69 Le principe repose sur la réduction d’un sel métallique par un polyol (par exemple, l’éthylène glycol) à de hautes températures. Étant donné que les propriétés réductrices des polyols sont dépendantes de la température, ils deviennent intéressants pour obtenir le produit cinétique désiré. De plus, comme ils
Figure 22. Synthèse de nanoparticules par croissance contrôlée : synthèse de germes par nucléation rapide, puis
croissance par étapes pour l'obtention de la taille désirée.25
ont une température d’ébullition très élevée, la synthèse de nanoparticules plus réactives (Co, Ni, Cd, Bi, Pb et In) par décomposition thermique est possible.68
2.4.5 Procédé sol-gel de Stöber
La solution-gélification (sol-gel) permet la production d’un matériau vitreux et poreux par polymérisation (Figure 23). La méthode de Stöber est une méthode utilisée pour la préparation de nanoparticules de silice de faible polydispersité et pour le recouvrement de nanoparticules métalliques.25,43,51,70,71 Il s’agit d’une approche intéressante pour la fabrication de matériaux hybrides pouvant incorporer des molécules organiques ou afin de protéger des nanoparticules métalliques.
Le procédé sol-gel de Stöber consiste en l’hydrolyse du précurseur silane (TEOS) sous catalyse basique (NH4OH). L’hydrolyse des groupements alkoxy libère un alcool (ROH) pour former le silanol corresponsant, (RO)3Si(OH). La condensation du silanol permet la polymérisation d’un réseau de silice par le relargage d’une molécule d’eau qui peut soit former des nanoparticules de silice, soit se greffer en surface d’un oxyde métallique.
Le réseau de silice ouvre la porte à une variété de voies synthétiques pour la fonctionnalisation de surface et l’incorporation de molécules. Tout d’abord, en raison de la polyvalence des silanes disponibles, il est possible de condenser en surface de NPs ou de lamelles de verre (par la formation
d’une monocouche autoassemblée) des fonctions spécifiques comme des amines (-NH2), des thiols (-SH), des acides carboxyliques (-COOH) ou des agents de couplage comme le N-hydroxysuccinimide (NHS) pour le greffage de protéines ou de fluorophores.72,73 D’un autre côté, il est possible de condenser un fluorophore à l’intérieur d’un réseau de silice dans le but de créer des nanoparticules luminescentes en ajoutant un précurseur fluorescent pendant la synthèse de Stöber pour que celui-ci s’incorpore dans la couche de silice.40
2.5 L’immunologie diagnostique
2.5.1 Les anticorps et les antigènes
Le corps humain a plusieurs mécanismes de défense contre l’attaque d’agents pathogènes. Parmi ceux-ci, les anticorps sont des protéines sécrétées par les plasmocytes, un type de globule blanc. Un anticorps est généralement schématisé par la forme Y (Figure 24). Il est constitué de deux chaînes lourdes (région bleue) et deux chaînes légères (région verte) liées par des ponts disulfure (lignes noires). Aux extrémités se trouvent les paratopes (cercle pointillé), les sites de reconnaissance des
antigènes. De son côté, l’antigène est une protéine reconnue par l’anticorps générant ainsi une réponse immunitaire. La structure moléculaire de l’antigène contient plusieurs épitopes, des sites de reconnaissance par les anticorps. Il est à noter que les anticorps monoclonaux ont la caractéristique d’être spécifiques à un épitope de l’antigène. Cette spécificité particulière fait de ce complexe biologique un outil de détection de maladies important dans le domaine médical.
Figure 24. Schéma d'un anticorps. Différentes parties : les chaînes lourdes (bleu), les chaînes