Caractérisation des interactions phage-minerai et
développement de bio-réactifs potentiels pour les
procédés de flottation
Mémoire
Karl Tremblay-Bouliane
Maîtrise en génie chimique
Maître ès sciences (M.Sc.)
Québec, Canada
iii RÉSUMÉ
La flottation est un procédé de séparation important dans l’industrie minière. Un in-térêt particulier est porté aux réactifs employés dans ce procédé en raison de leur impact sur les performances économiques des mines. Avec pour objectif de développer des réactifs efficaces d’origine biologique et moins nocifs pour l’environnement, une librairie d’expression phagique a été criblée afin d’identifier des ligands pour différents minerais d’intérêt industriel, notamment l'or, la chalcopyrite, la sphalérite, la pyrite et la silice. Après plusieurs rondes de sélection et d'enrichissement, des séquences peptidiques ont été isolées pour chacun de ces minerais. Toutefois, la détermination des isothermes d'adsorption pour chacune de ces interactions a révélé une faible spécificité. L’effet de l’adsorption de bacté-riophages, arborant certaines séquences, à la surface de ces minerais a été étudié afin d’évaluer leur potentiel en tant que bio-réactifs de flottation. Ceci a permis de confirmer une diminution de l’hydrophobicité, c’est-à-dire un effet déprimant. Les bactériophages seraient donc des candidats potentiels pour certains types d'application en flottation, cepen-dant leur coût de production devrait être significativement réduit afin d'en faire une alterna-tive viable.
v SUMMARY
Flotation is an important separation process in mining industry. Because of their impact on mines economic performances, special attention is directed to flotation reagents. In order to develop efficient bio-based reagents with a lower environmental footprint, a phage display library was screened as a mean to identify peptides able to bind to ores of economical interest, including gold, chalcopyrite, pyrite, sphalerite and silica. After many biopanning rounds, peptide sequences were successfully isolated for each of these ores. However, adsorption isotherm determination for these interactions revealed a low specifici-ty of the obtained sequences. The possibilispecifici-ty to use bacteriophages as flotation bio-reagents was assessed by studying effect produced by adsorption of phages displaying selected pep-tide sequences on surface properties of some of the ores. A decrease in hydrophobicity was confirmed, suggesting a depressing effect on ores. Thus, bacteriophages might be potential candidates for some types of flotation applications but their production cost will have to be brought down significantly in order to be considered a viable alternative.
vii TABLE DES MATIÈRES
Résumé ... iii
Summary ... v
Liste des tableaux ... ix
Liste des figures ... xi
Remerciements ... xiii
Avant-propos ... xv
Chapitre 1 : Introduction et objectifs ... 1
1.1. Mise en contexte et problématique ... 3
1.2. Procédés de flottation ... 5
1.2.1. Concept général... 5
1.2.2. Réactifs de flottation ... 6
1.2.3. Flottation des sulfures ... 8
1.3. Revue de littérature : Interactions peptides/minerais et bio-réactifs de flottation 9 1.3.1. Bactéries ... 9
1.3.2. Polymères d’origine naturelle ... 10
1.3.3. Peptides ... 12
1.4. Objectifs ... 19
Chapitre 2 : Matériel et méthodes ... 21
2.1. Caractéristiques et traitement des phases minérales ... 23
2.1.1. Caractéristiques des minerais ... 23
2.1.2. Traitement à l’EDTA ... 23
2.2. Criblage de la librairie de phages ... 24
2.2.1. Choix de la librairie... 24
2.2.2. Procédures générales reliées au bio-criblage ... 26
2.3. Caractérisation de l’adsorption ... 32
2.3.1. Modèle d’interaction récepteur/ligand ... 33
2.3.2. Génération des isothermes et calcul des paramètres ... 33
2.4. Mesure de temps d’induction ... 34
2.4.1. Concept de temps d’induction... 34
viii
Chapitre 3: Résultats présentés sous forme d'article ... 37
3.1. Résumé en français ... 39
3.2. Abstract ... 40
3.3. Introduction ... 41
3.4. Materials and Methods ... 42
3.4.1. Phage library and biopanning ... 42
3.4.2. Adsorption isotherms... 43
3.4.3. Induction time measurements ... 44
3.5. Results and discussion ... 45
3.5.1. Biopanning ... 45
3.5.2. Adsorption isotherms... 47
3.5.3. Induction time measurements ... 51
3.6. Conclusion ... 54
Chapitre 4: Résultats et éléments de discussion supplémentaires ... 55
4.1. Expériences de bio-criblage supplémentaires ... 57
4.2. Efficacité de la titration des phages ... 61
4.3. Calcul du coût potentiel de l'utilisation de phages comme réactif de flottation .. 63
Chapitre 5 : Conclusion et recommandations ... 65
Références ... 69
ANNEXES ... 75
Annexe 1 : Milieux et solutions ... 77
Annexe 2 : Protocoles détaillés ... 79
Annexe 3 : Résultats détaillés du bio-criblage ... 83
ix LISTE DES TABLEAUX
Tableau 1: Types de minerai traités par flottation et concentrés produits aux États-Unis, en
millions de tonnes métriques ... 4
Tableau 2: Adhésion d'acides aminés sur différentes surfaces inorganiques avec de l'eau comme solvant ... 13
Table 3: Biopanning results ... 46
Table 4: Results found in literature for biopanning on ores ... 47
Tableau 5: Séquences obtenues lors du bio-criblage avec pré-incubation ... 58
Tableau 6: Efficacité de sélection de différents groupes de clones ... 59
Tableau 7: Concentrations types récupérées lors de l'élution et de l'amplification ... 60
Tableau 8: Coût du milieu de culture pour la production de bactériophages ... 64
Tableau 9: Détails à propos de la préparation des milieux et des solutions ... 77
Tableau 10: Acides aminés et abréviations ... 89
xi LISTE DES FIGURES
Figure 1: Croissance économique de l'industrie minière canadienne de 1983 à 2014,
excluant les combustibles ... 3
Figure 2: Schéma conceptuel d’une cellule mécanique majoritairement employée pour les procédés de flottation ... 6
Figure 3: Représentation du xanthate d'éthyle de potassium, largement utilisé pour la flottation des sulfures ... 7
Figure 4: Adhésion de R. opacus sur l'hématite et le quartz en fonction du pH ... 10
Figure 5: Flottation de mélanges de chalcopyrite et de galène selon le pH, avec ajout de chitosane ... 11
Figure 6: Récupération de la sphalérite et de la galène par flottation en fonction de différentes concentrations d'ADN ... 12
Figure 7: Structure du bactériophage M13 ... 15
Figure 8: Isothermes d'adsorption démontrant l'affinité des peptides obtenus suite au criblage d'une librairie de phages sur du carbone de type diamant ... 16
Figure 9: Représentation de l'adsorption de bactériophages sur la silice et la sphalérite par l'entremise de mesure de fluorescence ... 16
Figure 10: Comparaison de l'adsorption de bactériophages décorés de séquences octapeptidiques différentes sur la chalcopyrite, la sphalérite, la silice et la pyrite ... 17
Figure 11: Temps d'induction pour la chalcopyrite en présence et en absence de phages adsorbés ... 18
Figure 12: Agrégation de fines particules de chalcopyrite induite par l'addition de bactériophages ... 18
Figure 13: Séquences insérées pour la fabrication de librairies peptidiques (Ph.DMD, NEB) sur le bactériophage M13 ... 25
Figure 14: Représentation des différentes étapes du bio-criblage ... 28
Figure 15: Exemple d'essai sur plaque ... 29
Figure 16: Appareil de mesure de temps d’induction (induction timer) ... 35
Figure 17: Isotherms comparing adsorption of different phage clones on chalcopyrite and sphalerite. ... 48
Figure 18: Estimated parameters for receptor-ligand interaction model. ... 50
Figure 19: Induction time measurements of chalcopyrite, sphalerite and pyrite with and without (control) addition of phages at different concentrations. ... 53
Figure 20: Calcul de la représentation des différents groupes et de chacun des différents clones présents dans chaque groupe suite aux différentes rondes du bio-criblage. ... 60
xii
Figure 21: Vérification de l'efficacité de mise en culture. Comparaison du titre de différents stocks de phages par la méthode d’essai sur plaque et la méthode spectrophotométrique. ... 62 Figure 22: Production de bactériophages en bioréacteur de 20 L. ... 63
xiii REMERCIEMENTS
Pour son aide dans la réalisation de ce travail et dans cette introduction au monde de la recherche, je voudrais remercier mon directeur de recherche au département de génie chimique de l’Université Laval, M. Alain Garnier. J’aimerais également mentionner l’aide apportée par M. Bruno Gaillet, co-directeur, ainsi que celle apportée par les membres des équipes de recherche que j’ai côtoyés, qui ont contribué à une ambiance de travail enrichis-sante et constructive.
Je tiens également à souligner la contribution très importante de Caroline Olsen, superviseure du projet dans le milieu industriel d’accueil (COREM). Son expérience en recherche et ses connaissances en traitement du minerai ont été d’une grande aide dans ce projet et pour la rédaction de ce mémoire. Merci également à tout le personnel de recherche et le personnel technique de COREM avec qui j’ai eu l’occasion de travailler et sans qui la réalisation de ce travail aurait été impossible.
Enfin, j’aimerais remercier M. Sylvain Moineau, Mme Denise Tremblay et leur équipe au département de biochimie, microbiologie et bio-informatique de l’Université Laval pour leur aide et générosité, particulièrement en ce qui a trait à mon initiation à la culture et la caractérisation des bactériophages.
xv AVANT-PROPOS
Dans le cadre des travaux reliés à ce programme de maîtrise, un article a été rédigé et inséré dans le présent mémoire. Cet article n’a toutefois pas encore été soumis ni publié. Au moment de la rédaction de ce mémoire, des démarches de révision sont entamées et certains périodiques scientifiques sont considérés pour la publication. D’autre part, des pré-sentations ont été faites lors de diverses conférences scientifiques
1. Insertion d’article Titre de l’article:
Screening a Phage Library Looking for Peptide-Ore Interactions for Bio-Flotation Applica-tion
Auteurs:
Karl Tremblay-Bouliane1, Caroline Olsen3, Denise Tremblay2, Sylvain Moineau2 et Alain Garnier1,*
1Université Laval, Department of Chemical Engineering, Québec, QC, Canada
2Université Laval, Department of Microbiology and Bio-informatic, Québec, QC, Canada 3COREM, Research Group in Flotation and Extractive Metallurgy, Québec, QC, Canada
*Auteur de correspondance: Alain.Garnier@gch.ulaval.ca
Auteur principal: Karl Tremblay-Bouliane Co-auteurs:
Caroline Olsen, Denise Tremblay, Sylvain Moineau, Bruno Gaillet et Alain Garnier Périodique scientifique considéré :
CIM magazine (Canadian Institute of Mining, Metallurgy and Petroleum) Rôle de l’auteur principal:
- Réalisation des expériences - Analyse des résultats
- Rédaction de la première version de l’article (révision et contribution par les co-auteurs)
xvi
2. Présentations lors de conférences
15e Rencontre Québec-Ontario en biotechnologie Date : 28/05/2013
Type de présentation : Présentation par affiche
Titre : Screening a Phage Library Looking for Peptide-Ore Interactions
Auteurs : Karl Tremblay-Bouliane1, Caroline Olsen3, Denise Tremblay2, Sylvain Moineau2 et Alain Garnier1,*
63e Congrès canadien de génie chimique Date : 22/10/2013
Type de présentation : Présentation orale
Titre : Peptide-Ore Interaction Screening by use of Phage Display Combinatorial Library Auteurs : Karl Tremblay-Bouliane1, Caroline Olsen3, Denise Tremblay2, Sylvain Moineau2 et Alain Garnier1,*
14e Symposium annuel de PROTEO Date : 09/05/2014
Type de présentation : Présentation par affiche
Titre : Recherche et caractérisation d’interactions peptide-minerai par l’entremise du cri-blage d’une librairie de phages dans une optique de bio-flottation
Auteurs : Karl Tremblay-Bouliane1, Caroline Olsen3, Denise Tremblay2, Sylvain Moineau2 et Alain Garnier1,*
1Université Laval, Département de génie chimique, Québec, QC, Canada
2Université Laval, Département de microbiologie et bio-informatique, Québec, QC, Canada 3COREM, Groupe de recherché en flottation et métallurgie extractive, Québec, QC, Canada
1 CHAPITRE 1 : INTRODUCTION ET OBJECTIFS
3 1.1. Mise en contexte et problématique
Les matériaux issus des mines sont, à toute fin pratique, indispensables pour le dé-veloppement de nouvelles technologies et la conception de la plupart des biens usuels. Tel qu’illustré à la Figure 1, l’industrie minière a une grande importance dans l’économie cana-dienne, et représente une industrie croissante dont les problématiques sont toujours d’actualité.
Figure 1: Croissance économique de l'industrie minière canadienne de 1983 à 2014, ex-cluant les combustibles [1].
De nombreuses étapes séparent le minerai brut, directement tiré d’une mine, du produit final désiré, qui lui, requiert un matériau d’une pureté suffisante pour être employé. Les métaux extraits des mines sont originalement emprisonnés dans une matrice complexe, composée de plusieurs espèces minérales différentes. Les éléments indésirables (la gangue) doivent donc être séparés du minerai d’intérêt. Les procédés de flottation représentent un exemple de procédé de séparation bien connu et largement utilisé dans l’industrie minière.
La flottation par écumage permet de récupérer et concentrer différents minerais en misant sur les différences entre les propriétés de surface de ces derniers. La première appli-cation concrète de ce procédé date du début du 20e siècle en Australie. Il avait alors été possible de récupérer le zinc présent dans les résidus miniers issus de la séparation gravi-taire d’un composé plomb-argent [2]. Puisque la sphalérite, minerai contenant le zinc,
pos-44,7 12,1 0 10 20 30 40 50 60 1980 1985 1990 1995 2000 2005 2010 2015 Production (G $)
4
sédait une densité semblable aux résidus, la séparation gravitaire ne permettait pas de sépa-rer ce minerai de valeur économique importante. Cependant, en tentant de dissoudre le zinc des résidus en faisant bouillir ces derniers en présence de sels, il a été constaté que les sul-fures, tels la sphalérite, pouvaient flotter, contrairement au reste de la gangue. Depuis, la flottation a été employée pour la récupération de particules fines de tous genres : charbon, potasse, oxydes et sulfures métalliques, etc, tel que présenté au Tableau 1. Les sulfures (as-sociés entre autres au cuivre, au plomb et à l’or) occupent d’ailleurs une très grande part de l’ensemble des minerais traités par flottation.
Tableau 1 : Types de minerai traités par flottation et concentrés produits aux États-Unis, en millions de tonnes métriques [3]
1926 1960 1980
Type de minerai Traité Concentré Traité Concentré Traité Concentré
Cuivre 39,89 2,17 133,38 4,82 211,61 4,67 Plomb-zinc 5,57 0,84 7,43 0,49 11,39 0,84 Or-argent 0,48 0,03 0,12 0,003 0,10 0,005 Fer 1,39 0,54 37,88 21,48 Phosphate 19,03 6,37 108,70 26,63 Potasse 10,87 2,83 12,93 2,99 Charbon 3,73 2,54 11,70 6,86 Feldspath-mica 1,67 1,06 11,58 8,51 Minerais industriels divers 0,23 0,02 2,23 0,83 0,58 0,37
Plusieurs réactifs sont employés pour améliorer les rendements de flottation. Comme ils possèdent un grand impact sur la qualité de la récupération et purification des métaux, ces réactifs représentent un élément important dans l’optimisation des perfor-mances des procédés minéralurgiques. D’ailleurs, des milliers de tonnes de matériel sont traitées chaque jour, et les minerais d’intérêt possèdent une grande valeur économique. Même de faibles gains sur le plan de la performance peuvent mener à des avantages éco-nomiques substantiels.
L’industrie est donc en constante recherche de réactifs de flottation plus efficaces et l’instauration de normes environnementales toujours plus sévères stimule le développement
5 de réactifs plus verts. En plus de l’aspect environnemental, les réactifs traditionnels peuvent représenter un souci important sur le plan de la santé et de la sécurité. Les xanthates, par exemple, largement employés en flottation des sulfures, sont toxiques pour le milieu récep-teur. Ce type de réactifs induit également la formation de sous-produits (disulfure de car-bone) pouvant porter atteinte à la santé humaine en cas de trop grande exposition (limite à 1 ppm pour le CS2 en Ontario [4]).
Bien que le domaine ait été bien peu exploré comparativement aux technologies tra-ditionnelles, quelques produits d’origine biologique ont fait l’objet d’études cherchant à développer des réactifs capables de remplacer les réactifs traditionnels [5-9]. Cette nouvelle avenue est une option intéressante puisque les bio-réactifs peuvent permettre un impact réduit sur l’environnement et un traitement plus facile dans l’effluant des usines. C’est donc dans ce contexte de développement de bio-réactifs de flottation qu’est situé le présent tra-vail.
1.2. Procédés de flottation
1.2.1. Concept général
Une fois extrait de la mine, le minerai est broyé afin de libérer le plus possible les différentes espèces minérales présentes dans la matrice rocheuse [3, 10]. Ceci implique un broyage considérablement fin, habituellement de l’ordre de 100 μm et moins. Le matériel fraîchement broyé est classifié par des tamis ou des hydrocyclones. Avant d’effectuer la flottation, différents réactifs chimiques sont ajoutés pour contrôler le pH et l’hydrophobicité des particules d’intérêt. Ces réactifs sont ajoutés au broyage ou encore lors d’une étape de conditionnement préalable à la flottation. Le matériel est ensuite transféré dans des équipements de flottation, dans lesquels de l’eau est ajoutée au minerai pour obte-nir une pulpe de 30 à 35% solide. Par la suite, de l’air est injecté et dispersé de sorte à for-mer de fines bulles. Il existe différents types d’appareils de flottation tels que les cellules de flottation mécaniques (Figure 2), les cellules contact, les colonnes de flottation, les cellules Jameson, qui impliquent chacun des méthodes différentes permettant de maximiser le con-tact entre les bulles et les particules minérales. Les particules les plus hydrophobes s’accrochent donc préférentiellement aux bulles, ce qui leur permet de flotter jusqu’à la
6
surface pour être récupérées dans l’écume qui s’y forme. Il est également commun de pla-cer plusieurs appareils de flottation en série afin d’augmenter le temps de résidence des particules et maximiser le contact avec les bulles d’air (et donc augmenter les performances du procédé). Généralement, les rejets d’une première cellule servent d’apport à une seconde afin de répartir et de maximiser la récupération en fonction du tonnage et du temps de ré-tention. En ce qui concerne le concentré, c’est-à-dire la portion flottée riche en minerai, il peu subir une étape de nettoyage lorsque nécessaire. Il est alors acheminé à une autre cel-lule ou colonne afin d’en augmenter la teneur (pourcentage de minerai d’intérêt).
Figure 2: Schéma conceptuel d’une cellule mécanique majoritairement employée pour les procédés de flottation [11].
1.2.2. Réactifs de flottation
Collecteurs et déprimants
Plusieurs minerais possèdent un certain degré de flottabilité naturelle. Toutefois des produits chimiques sont ajoutés afin d’altérer sélectivement les propriétés de surface des espèces minérales en question, leur conférant un caractère plus ou moins hydrophobe, selon
7 le cas [3, 12]. Ainsi, les collecteurs sont ajoutés dans le but d’augmenter l’hydrophobicité des particules sur lesquelles ils s’adsorbent. Les molécules employées contiennent généra-lement un groupement polaire responsable de la liaison sur le minerai (principagénéra-lement une liaison ionique ou covalente) et un résidu non-polaire hydrophobe conférant le caractère désiré à la surface (Figure 3). Contrairement aux collecteurs, les déprimants ont pour rôle de diminuer la flottabilité des particules qu’on souhaite éliminer du concentré de minerai à récupérer [3, 12].
Figure 3: Représentation du xanthate d'éthyle de potassium, largement utilisé pour la flot-tation des sulfures. À gauche, on retrouve le résidu hydrocarboné (non-polaire); à droite on retrouve le groupement polaire responsable de l'adsorption sur le minerai [13].
Moussants
D’autres produits peuvent être ajoutés afin d’optimiser les conditions de flottation [10, 12]. L’ajout de collecteur au procédé permet d’augmenter l’hydrophobicité des espèces minérales ciblées, mais n’implique pas nécessairement la formation d’une écume stable, qui facilite la récupération du concentré. Dans ces conditions, des moussants sont employés pour diminuer la taille des bulles et stabiliser l’écume; les molécules employées sont des tensio-actifs qui possèdent un groupement polaire (hydrophile) et un groupement alipha-tique (hydrophobe) qui, en s’arrangeant à l’interface air-liquide, induisent la formation de mousse. Ils permettent de diminuer la tension de surface de l’eau.
Agents modifiants
Les agents modifiants sont quant à eux employés pour améliorer les performances de flottation en modulant les interactions entre collecteurs, déprimants et minerais, de sorte à augmenter la sélectivité et la performance du procédé [12]. Parmi ces agents on compte, par exemple, les agents activants, qui permettent de faciliter l’adhésion des collecteurs sur
8
le minerai, des agents floculants et dispersants, utiles pour contrôler la récupération de par-ticules fines, ainsi que des acides et des bases, servant à réguler le pH (paramètre important qui influence grandement les propriétés de surface du minerai).
1.2.3. Flottation des sulfures
La flottation des sulfures est l’une des applications les plus répandues de ce type de procédé dans l’industrie minière [3, 12]. La chalcopyrite (CuFeS2), la chalcocite (Cu2S), la bornite (Cu5FeS4) et la covellite (CuS) sont parmi les sulfures de cuivres les plus répandus, avec la chalcopyrite qui vient en tête. La chalcopyrite possède d’ailleurs un degré appré-ciable de flottabilité naturelle. De plus, il est assez fréquent de retrouver de l’or parmi le minerai de cuivre, ce qui augmente la valeur d’un gisement. Les xanthates sont les collec-teurs les plus couramment utilisés pour les sulfures de cuivre.
La sphalérite (ZnS), un minerai de zinc, est également un sulfure de valeur écono-mique considérable fréquemment traité dans l’industrie minière, tout comme la galène (PbS) fréquemment associée à l’argent [3].
Toutefois, les minerais de valeur décrit ci-haut sont souvent retrouvés en compagnie de sulfures de fer comme la pyrite (FeS2), la pyrrhotite (Fe(1-x)S, où x = 0 à 0,2) et
l’arsénopyrite (FeAsS), qui possèdent une bien moindre valeur et doivent donc être séparés du cuivre et de l’or [3, 12, 14]. De plus, comme ils ont aussi la capacité de flotter en pré-sence de xanthates, des procédures particulières doivent être mises en œuvre pour éviter la récupération de sulfure de fer dans le concentré. Dans certains cas, il est favorable de dé-primer ces sulfures de fer. Parmi les déprimants conventionnels de la pyrite, on retrouve d’abord la chaux et l’air. Une augmentation de pH provoque en surface des sulfures ferreux une formation d’oxyhydroxides de fer (FeOOH). Ces dépôts hydrophiles limitent l’attachement des sulfures de fer aux bulles d’air lors de la flottation. Par exemple, en pré-sence de xanthate à pH alcalin, la pyrite ne flotte pas très bien alors qu’un pH neutre ou acide lui permet de flotter [12]. Tout comme l’ajout de chaux, une pré-aération de la pulpe avec de l’air ou de l’oxygène provoque la même formation d’espèces hydrophiles de type FeOOH en surface des sulfures de fer. D’autres déprimants comme le cyanure de sodium (plus connu pour la séparation Cu-Pb), l’hydrogénosulfure de sodium, de l’amidon oxydé et des dextrines dans certains cas, peuvent être employés. Le choix des déprimants varie d’un
9 procédé à l’autre, selon la composition du minerai, la taille des particules ou encore l’étape de séparation (séparation grossière, concentrateur). La silice est un autre élément de la gangue qui est largement répandu dans les gisements miniers et qu’on cherche habituelle-ment à éliminer du concentré par l’emploi de déprimants. Toutefois, il est généralehabituelle-ment possible de séparer cette espèce minérale ainsi que d’autres éléments non sulfurés de la gangue par l’emploi de xanthates uniquement [12], à condition que les sulfures d’intérêt soient bien libérés au broyage (absence d’associations minéralogique avec la gangue). Il est donc possible de moduler les conditions d’opération du procédé (variation du pH, ajout d’agents modifiants) pour limiter l’activation de la gangue et diminuer sa flottabilité.
1.3. Revue de littérature : Interactions peptides/minerais et bio-réactifs de flottation Plusieurs travaux ont permis d’évaluer le potentiel de différents produits d’origine biologique en tant qu’agents de bio-flottation ou encore comme agent de chélation pour divers matériaux. Des bactéries ont d’ailleurs fait l’objet de plusieurs études, de même que certains polymères d’origine naturelle. L’interaction entre peptides et matériaux inorga-niques a également été étudiée par l’entremise de différents acides aminés ainsi que par l’emploi de bactériophages comme véhicule d’expression peptidique.
1.3.1. Bactéries
Les bactéries ont d’abord été considérées dans l’industrie minière pour des applica-tions en biolixiviation. Ce concept est utilisé afin de récupérer des métaux à partir de rési-dus miniers qu’il était difficile de récupérer par des méthodes conventionnelles[15].
La capacité des micro-organismes à utiliser de tels substrats implique en premier lieu la capacité à se lier à la surface du minerai, par l’entremise de la paroi cellulaire char-gée et la présence de polysaccharides et de protéines imbriquées dans cette même paroi [7]. Ceci est intéressant pour les procédés de flottation également puisqu’il y a démonstration du potentiel des micro-organismes en tant que ligands efficaces. Plusieurs travaux de re-cherche ont été publiés par rapport à l
’
utilisation de bactéries en tant que bio-réactifs de flottation [7, 16-19].
10
Acidithiobacillus ferrooxidans (A. ferrooxidans) a été testée sur différents sulfures
,
par exemple,
en tant qu’
alternative au cyanure pour la dépression de la pyrite [16, 17].
La séparation de la silice de la chalcopyrite et de la pyrite a été démontrée,
avec A.
ferrooxidans ainsi qu’
avec A. thiooxidans (connue pour sa capacité à fixer les sulfures) [20].
Cette dernière espèce a également permis d’
observer une dépression sélective de la galène par rapport à la sphalérite à pH 9-9,
5 [18].
Mycobacteria phlei et Rhodococcus opa-cus,
deux bactéries hydrophobes,
ont été testées en tant que collecteurs pour la flottation sélective de l’
hématite (FeO2) en présence de quartz, démontrant du même coup une sélec-tivité des micro-organismes vis-à-vis l’hématite (Figure 4) [17, 19].
Figure 4: Adhésion de R. opacus sur l'hématite et le quartz en fonction du pH [19].
Bien que ces travaux démontrent la capacité d’éléments de source biologique à se lier au minerai, très peu d’information est disponible par rapport à l’identification et l’optimisation de ligands issus des composants cellulaires des micro-organismes.
1.3.2. Polymères d’origine naturelle
D’autres travaux ont plutôt testé des polymères d’origine biologique en tant que bio-réactifs de flottation. Le chitosane [5] et l’ADN [6] représentent des exemples intéressants de polymères naturels ayant fait l’objet de publications récentes.
11 Chitosane
La Chalcopyrite et la galène sont généralement séparées par flottation. Des dépri-mants inorganiques sont souvent utilisés, toutefois ces derniers sont toxiques, dangereux et ne parviennent pas à diminuer l’entraînement des minéraux déprimés, surtout lorsque ceux-ci sont présents en particules ultra fines. Une étude a exploré le potentiel du chitosane, un polymère naturel non toxique issu de la chitine (élément retrouvé entre autres comme cons-tituant de la carapace des invertébrés [21]), en tant que déprimant pouvant floculer sélecti-vement les minéraux à être déprimés, aidant ainsi à contrer le phénomène d’entraînement [5].
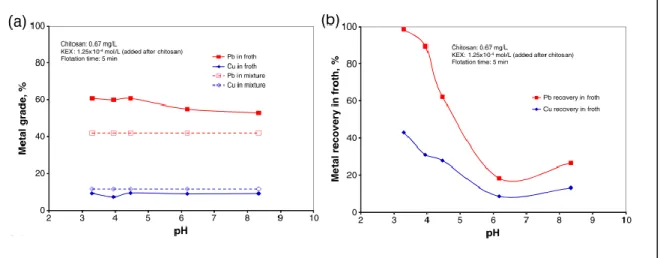
Suite aux tests de flottation individuels, il est apparu que la présence de chitosane diminuait considérablement la récupération par flottation, passant de plus de 90% à envi-ron 60% en présence de chitosane, tant pour la chalcopyrite que pour la galène. Cependant, en présence d’un mélange galène et chalcopyrite, une flottation plus importante de la galène a été observée, ce qui expose la possibilité d’utiliser le chitosane comme déprimant sélectif, surtout à bas pH (Figure 5). Il y aurait donc présence d’une adsorption préférentielle du chitosane sur la chalcopyrite, permettant d’expliquer que cette dernière soit plus faiblement récupérée que la galène lors de tests de flottation.
Figure 5: Flottation de mélanges de chalcopyrite et de galène selon le pH, avec ajout de chitosane. (a) Teneur des métaux dans l’écume; (b) Récupération des métaux dans l’écume [5].
12 ADN
De nombreuses études ont mis de l’avant l’utilisation de bactéries à des fins de flot-tation sans toutefois identifier clairement les composants cellulaires responsables des effets observés [7, 16-19]. Afin d’explorer davantage cette question, l’effet de différents compo-sants cellulaires a été vérifié en les éliminant un à la fois par l’ajout de différentes enzymes à une suspension bactérienne [6]. Il en est découlé que dans un mélange sphalérite/galène, l’ADN simple brin pouvait agir comme bio-collecteur favorisant la flottation de la sphalé-rite (Figure 6) alors que les autres composants cellulaires engendraient un effet déprimant pour la galène. Toutefois, il y aurait adsorption préférentielle d’ADN sur la galène, donc l’ajout d’une mixture de composants cellulaires adhérant aussi préférentiellement à la ga-lène permettrait à l’ADN de se fixer sur la sphalérite et permettre sa flottation. Le caractère amphiphile de l’ADN (présence de groupements hydrophiles et hydrophobes) serait à l’origine de sa capacité à agir comme collecteur pour la flottation.
Figure 6: Récupération de la sphalérite et de la galène par flottation en fonction de diffé-rentes concentrations d'ADN [6].
1.3.3. Peptides
Tel que décrit précédemment, l’application des biotechnologies dans le domaine minier a déjà fait l’objet d’études permettant d’évaluer le potentiel de l’utilisation de bacté-ries pour la récupération ou le traitement de divers minerais. Il en ressort d’ailleurs que cer-taines séquences protéiques à la surface de bactéries peuvent présenter des affinités suffi-santes avec des métaux pour permettre la chélation et la formation de complexes utiles pour
13 la séquestration ou la récupération de métaux. Il apparait donc pertinent d’étudier les inte-ractions entre peptides et minerais.
Différents acides aminés testés séparément
Quelques publications [22, 23] traitent de l’étude des interactions entre des compo-sants de base des structures biologiques (peptides) et des surfaces inorganiques. Dans l’une de ces publications [23], différentes surfaces inorganiques ont été exposées à des solutions de peptides, chacune impliquant des polypeptides composés d’un acide aminé spécifique, avec marqueurs fluorescents. La fluorescence a été mesurée pour quantifier la densité de peptides adsorbés sur ces surfaces. Les matériaux inorganiques testés incluent des métaux (Au, Pd, Pt, Ti et Al), des semi-conducteurs (GaAs, AlGaAs) et des isolants (Si3N4, SiO2). Les tests ont permis d’observer une adhésion significative d’acides aminés chargés (chaînes latérales acides et basiques) principalement sur les isolants (la silice et le nitrure de sili-cium), tel que présenté au Tableau 2.
Tableau 2: Adhésion d'acides aminés sur différentes surfaces inorganiques avec de l'eau comme solvant [23]
14
Protéines et peptides naturels se liant aux métaux
Les interactions avec les métaux sont courantes dans différents processus biolo-giques. Par exemple, le fer est un élément essentiel de l’hémoglobine qui sert au transport d’oxygène dans le sang. La fixation du fer est un phénomène important et résulte d’interactions avec des composants de l’organisme. À cet effet, des travaux ont permis d’isoler un polypeptide (NLGEQYFKG) pouvant se lier au fer. Ce nonapeptide a été obte-nu par hydrolyse d’une protéine de plasma porcin [24]. Des peptides pouvant se lier au fer ont également été isolés à partir de l’hydrolysat de sous-produits provenant du traitement de crevettes [25]. Ces études évoquaient toutefois l’utilité de tels peptides en tant qu’additif alimentaire.
Dans d’autres cas, il est question du rôle des peptides et protéines dans la fixation des métaux dans une optique de bioremédiation [26, 27]. La capacité de protéines et pep-tides à se lier aux métaux lourds tels que le cadmium et le mercure a été rapportée, souli-gnant le potentiel de l’utilisation de plantes et micro-organismes exprimant ces protéines en tant qu’agents de phytoremédiation et bioremédiation.
Polypeptides exprimés sur des bactériophages
L
’
identification de polypeptides affinitaires à divers matériaux inorganiques a fait l’
objet de quelques publications.
En fusionnant une multitude de séquences peptidiques aléatoires différentes sur l’une des protéines présentes à la surface de bactériophages fila-menteux (de type M13 ou fd), une librairie d’expression phagique (ou encore « phage di-play libraries ») peut être générée [28].Ces phages filamenteux, de la famille des Inoviridae, dont la structure est illustrée à la Figure 7) sont des phages à ADN simple brin spécifiques à E. coli [29]. L’infection des bactéries par ces virus ne provoque pas la lyse des cellules mais provoque un ralentisse-ment de rythme de reproduction. Le cycle de réplication de ce type de phages est bien do-cumenté [29-32] et les étapes principales sont résumées ci-après. Le cycle débute par l’adsorption de la protéine PIII sur le pilus F d’E. coli. L’infection se poursuit avec le dé-sassemblage des protéines structurales principales PVIII (qui s’insèrent dans la membrane cellulaire), et l’intrusion de l’ADN viral dans la cellule hôte. Les enzymes de l’hôte
conver-15 tissent ensuite cet ADN en ADN double brin qui permet d’abord la production des pro-téines du phage, et ensuite à la duplication du matériel génétique effectuée par un méca-nisme de réplication circulaire. Il y a alors formation d’un complexe nucléoprotéique avec la protéine d’assemblage-réplication PV, qui protège l’ADN jusqu’à l’étape d’extrusion de la particule virale, au cours de laquelle la protéine PV est remplacée par les protéines struc-turales entreposées dans la membrane cellulaire. Le particule virale mature est finalement relâchée dans le milieu et peut infecter d’autres cellules.
Figure 7: Structure du bactériophage M13. L’ADN du virus est enveloppé de 5 protéines structurales différentes (PIII, PVI, PVIII, PVII et PIX).
Une librairie d’expression phagique mise en contact avec une cible définie permet de tester des millions de candidats potentiels (tout dépendant du degré de complexité de la librairie) au cours d’une même expérience et de sélectionner les meilleurs ligands de cette très grande réserve de peptides. Des séquences peptidiques affinitaires
,
découlant d’
un pro-cessus de criblage d’
une librairie de phages,
ont été obtenues,
entre autres,
pour l’
or [33],
des oxydes de silice et de titane [34], des oxydes de zinc [35], ainsi que pour du carbone de type diamant [36]. Dans le dernier cas, il a d’ailleurs été démontré par une méthode d’isothermes d’adsorption que l’affinité des peptides obtenus était de beaucoup supérieure à celle des contrôles (Figure 8). Cependant, les matériaux mentionnés précédemment ont surtout un intérêt lié à des applications nano technologiques.16
Figure 8: Isothermes d'adsorption démontrant l'affinité des peptides obtenus suite au cri-blage d'une librairie de phages sur du carbone de type diamant [36].
D’autres chercheurs ont plutôt ciblé des minerais intéressants pour l’industrie mi-nière (chalcopyrite
,
pyrite,
sphalérite et silice) lors d’
expériences de bio-criblage (biopan-ning) à partir de différents types de librairie (heptapeptides cycliques sur protéine PIII [8],
pour un total de 5 copies par phage
,
et octapeptide linéaire sur protéine d’
enveloppe PVIII [9],
à plusieurs milliers de copies par phage).
En premier lieu, des séquences ont été obte-nues d’une librairie d’expression sur PIII et testées pour leur sélectivité vis-à-vis différents minerais; il a été démontré que certaines séquences adhéraient spécifiquement à la sphalé-rite pour un mélange silice/sphalésphalé-rite (Figure 9).Figure 9: Représentation de l'adsorption de bactériophages sur la silice (particules blanches) et la sphalérite par l'entremise de mesure de fluorescence (taches rouges) [8].
17 L
’
expression d’un peptide en plus grande quantité sur PVIII a résulté en une adsorp-tion beaucoup plus spécifique de bactériophages (Figure 10) [9].
Ainsi, des clones sélectifs à la chalcopyrite et la pyrite ont pu être isolés. La sélectivité respective des différents clones vis-à-vis les différents minerais a été vérifiée en comparant l’adsorption par méthode im-muno-enzymatique (ELISA).Figure 10: Comparaison de l'adsorption de bactériophages décorés de séquences octapep-tidiques différentes sur la chalcopyrite, la sphalérite, la silice et la pyrite [9].
De plus, l’effet de l’adsorption de bactériophages sur le caractère hydrophobe ou hydrophile de la surface du minerai a été testé [9]. Des mesures de temps d’induction ont permis de constater une diminution de l’hydrophobicité des minerais en présence de bacté-riophages (augmentation du temps d’induction, Figure 11). Le temps d’induction représente le temps requis pour observer l’attachement de particules de minerai suite au contact avec une bulle d’air, simulant le comportement d’attachement dynamique tel que retrouvé en condition de flottation.
18
Figure 11: Temps d'induction pour la chalcopyrite en présence et en absence de phages adsorbés [9].
L’ajout de bactériophages à des suspensions de minerais a également permis de fa-voriser l’agrégation des particules fines (Figure 12) [9]. Suivant cette observation, des tra-vaux ont été effectués afin d’étudier le potentiel des bactériophages en tant que bio-réactif permettant l’agrégation de résidus présents dans l’eau de rejet du traitement des sables bi-tumineux [37].
Figure 12: Agrégation de fines particules de chalcopyrite induite par l'addition de bacté-riophages [9].
La publication de ces travaux démontre le potentiel de l’emploi de librairies pepti-diques exposées par des bactériophages en tant qu’outil d’exploration pour l’étude de li-gands d’origine biologique. De plus, ceci ouvre la porte à des applications intéressantes des bactériophages du côté industriel [9, 37].
19 1.4. Objectifs
En tenant compte des préoccupations environnementales reliées aux réactifs de flot-tation traditionnels, l’exploration de nouvelles options axées sur les biotechnologies s’avère pertinente. D’ailleurs, comme il s’agit d’un procédé de séparation, la sélectivité des réactifs employés est cruciale. Dans une optique de développement de bio-réactifs, l’un des aspects les plus importants est donc d’identifier des ligands sélectifs par rapport aux différentes cibles. À cet effet, l’emploi d’outils permettant d’étudier une grande variété de ligands (tel qu’une librairie d’expression phagique) est approprié, tout comme l’application d’une dé-marche permettant de vérifier la sélectivité des ligands à l’étude. En dernier lieu, afin d’examiner le potentiel des ligands sélectionnés pour la flottation, une méthode permettant de vérifier l’effet procuré à la surface du minerai est nécessaire.
La flottation est employée pour le traitement d’une multitude de minerais, mais la séparation des sulfures représente l’une des applications les plus répandues. D’autre part, l’importance économique des métaux précieux justifie l’intérêt qui leur est porté au niveau industriel. Combinant ces considérations avec les besoins du partenaire industriel (CO-REM), les minerais ciblés dans ce travail sont la chalcopyrite, la sphalérite et l’or, pour leur valeur économique. En contrepartie, la silice et la pyrite sont des composantes importantes de la gangue associée aux minerais mentionnés précédemment et doivent généralement être éliminés des concentrés, ce pourquoi ils sont également considérés dans cet ouvrage.
Les objectifs de ce mémoire peuvent donc être résumés en trois étapes principales :
1. Identifier, par l’entremise du criblage d’une librairie de bactériophages, des sé-quences peptidiques ayant la capacité de se lier à différents minerais d’intérêt indus-triel, tels que la chalcopyrite, la sphalérite, l'or, la pyrite et la silice.
2. Vérifier la sélectivité des séquences obtenues en comparant l’adsorption des clones arborant ces séquences sur les différents minerais.
3. Examiner l’effet de l’adsorption de bactériophages sur la surface des minerais dans une optique d’application à un procédé de flottation.
21 CHAPITRE 2 : MATÉRIEL ET MÉTHODES
23 2.1. Caractéristiques et traitement des phases minérales
2.1.1. Caractéristiques des minerais
Les échantillons de chalcopyrite, de pyrite et de sphalérite ont été obtenus de Ward’s Science et proviennent respectivement de Zacatecas au Mexique (chalcopyrite et pyrite), et des mines Piedras Verdes (état de Chihuahua, Mexique). La silice a quant à elle été obtenue de Sigma Aldrich (produit # 274739, lot # MKBG7577V) alors que la poudre d’or a été obtenue d’Alfa Aesar (lot # B27Y009). La taille de particules était inférieure à 38 μm pour les tests de bio-criblage et les phases minérales ont été conservées à -20°C pour limiter l’oxydation des sulfures exposés à la surface du minerai. La surface spécifique de chacun des minerais a été obtenue par analyse BET, effectuées au laboratoire du professeur Serge Kaliaguine du département de génie chimique de l’Université Laval. Un prétraite-ment à 150°C d’une durée de deux heures a été effectué (pour retirer toute trace d’eau) et l’expérience BET a été accomplie par adsorption d’azote à -196°C (refroidissement à l’azote liquide). Pour les tests de temps d’induction, la tranche granulométrique de 45 à 90 μm a été employée afin de permettre la visualisation des particules (détails à la section 2.4.).
2.1.2. Traitement à l’EDTA
Afin d’obtenir une qualité de surface se rapprochant le plus possible de celle retrou-vée immédiatement après le broyage, les sulfures ont été soumis à un traitement à l’EDTA avant chacune des expériences impliquant l’adsorption de bactériophages. Cette étape per-met d’extraire sélectivement les oxydes métalliques, les hydroxydes, les carbonates et les sulfates formés à la surface des sulfures, sans altérer ces derniers.[38]
Le traitement a été effectué avec une solution 3% (m/m) d’EDTA ajustée à pH 7,5 (NaOH). La solution a été désoxygénée au métabisulfite de sodium afin d’éviter la forma-tion de nouveaux oxydes suite à la dissoluforma-tion de la couche initiale. Cette soluforma-tion a ensuite été ajoutée aux échantillons à traiter de manière à former une pulpe de 25% massique de minerai et les contenants (tubes, erlenmeyer, etc.) ont alors été scellés et incubés avec agita-tion pour environ une heure. Le surnageant contenant les oxydes dissouts a été jeté et le minerai rincé à l’eau distillée désoxygénée ou à l’aide de la solution tampon utilisée pour
24
les expériences prévues. En cas d’utilisation ultérieure, le matériel préparé a été conservé dans l’éthanol à -20°C, puis rincé au moment de l’emploi.
2.2. Criblage de la librairie de phages
Afin de développer des réactifs de flottation efficaces, il est essentiel d’identifier des ligands sélectifs par rapport aux différents minerais. Bien que quelques travaux aient été publiés sur le sujet [5, 6, 8, 9], davantage de connaissances par rapport aux interactions peptides/minerais sont requises. D’autre part l’identification de la nature de telles interac-tions ou la simulation numérique basée sur des modèles fondamentaux d’interacinterac-tions molé-culaires représente un travail extensif et difficile à réaliser. L’absence de données expéri-mentales exhaustives fait en sorte qu’il serait ardu d’obtenir par simulation des séquences polypeptidiques typiques ayant un bon potentiel en tant que ligand pour les minerais. Dans cette optique, le criblage d’une librairie de peptides présentée par des phages permet de mettre en contact de nombreuses séquences d’acides aminés avec les minerais à tester, et ce au cours d'une même expérience. Il est alors possible d’identifier des ligands sans avoir à étudier fondamentalement la nature des interactions entre la cible et les polypeptides, ce qui simplifie grandement le processus. D’ailleurs, comme les séquences d’acides aminées fu-sionnées font partie du génome des phages, elles sont identifiables par séquençage de l’ADN des virus. De plus, les bactériophages peuvent être produits rapidement et en grande quantité par l’entremise d’un hôte bactérien, ce qui facilite la transition vers des étapes liées à la caractérisation de l’adsorption des phages.
2.2.1. Choix de la librairie
Les travaux ont été effectués avec la librairie d’expression Ph.D.MD C7C (New En-gland Biolabs). Cette librairie est construite de sorte à inclure toutes les combinaisons pos-sibles d’heptapeptides, exprimés à la surface de différents bactériophages M13. Le proces-sus de génération de la librairie implique l’insertion de séquences d’ADN randomisées (correspondant à différents heptapeptides) au gène codant pour la production de la protéine PIII du bactériophage (responsable de l’adhésion au pilus F d’E. coli lors de l’infection), située à l’extrémité de la particule virale (Figure 7). Ces phages génétiquement altérés
ex-25 priment donc une protéine PIII naturelle, mais à laquelle est fusionnée une séquence de 13 acides aminés supplémentaires incluant l’heptapeptide variable (Figure 13).
Figure 13: Séquences insérées pour la fabrication de librairies peptidiques (Ph.DMD, NEB) sur le bactériophage M13 [39].
En considérant un total de 20 acides aminés, une librairie d’heptapeptides comporte virtuellement 207 combinaisons différentes, soit 1,28 milliards de types de clones distincts (un clone représente une population de phages possédant la même altération génétique). Ces séquences peptidiques sont fusionnées à chacune des cinq copies de la protéine PIII. De plus, contrairement aux autres librairies disponibles, la séquence variable d’acides ami-nés est intercalée entre une paire de cystéines (librairie Ph.D.-C7C, Figure 13) qui, par la
26
formation d’un pont disulfure entre ces deux résidus, impose une contrainte conformation-nelle au peptide. Cette contrainte engendre la présentation du peptide sous forme d’une boucle. Cette particularité, combinée au fait que les peptides soient présents en seulement cinq exemplaires sur les phages, devrait favoriser l’obtention de séquences plus sélectives [39, 40]. Un autre type de librairie intéressante aurait été celle développée par Petrenko et al [28] et testée avec succès[9], où l'heptapeptide était exprimé sur toutes les protéines d'en-veloppe (PVIII) du phage filamenteux de type fd. Cependant, cette librairie n’est pas dispo-nible commercialement et la construction complète d’une libraire d’expression phagique à partir du phage original n'était pas réalisable dans le cadre de ce projet.
2.2.2. Procédures générales reliées au bio-criblage
Le bio-criblage ("biopanning"), qui représente le processus requis pour la sélection et l’enrichissement de séquences peptidiques affinitaires, a été réalisé en suivant le proto-cole fourni avec la librairie de phages de New England Biolabs [39]. Quelques modifica-tions ont été apportées afin d’adapter certaines secmodifica-tions de ce protocole au criblage de la librairie sur une cible composée de fines particules de minerai. Le protocole complet, de même que les détails concernant la préparation des tampons et des solutions, sont dispo-nibles en annexe.
Préparation du minerai (cible)
Le minerai a été nettoyé à l’EDTA (tel que décrit à la section précédente) pour éli-miner les oxy-hydroxydes sans altérer les sulfures. Un échantillon de éli-minerai de 75 mg [34] a ensuite été suspendu dans du tampon TBS (tampon salin Tris 50 mM, NaCl 150 mM, pH 7,5) additionné de polysorbate 20 (TweenMD 20) (croissant d’une ronde à l’autre: 0,1% v/v pour la première ronde, 0,5% pour la deuxième ronde et 0,75% pour les suivantes). La masse de minerai a été abaissée à 25 mg à partir de la deuxième ronde. L’augmentation de la concentration de polysorbate et la diminution de la quantité de minerai avait pour but d’augmenter la rigueur des conditions de sélection lors des rondes pour lesquelles le ren-dement était moins important. Lors des rondes initiales, moins de copies des clones étaient présentes; il était donc souhaitable de permettre une sélection moins sévère afin d’éviter de perdre des candidats potentiels [39, 41].
27 Culture bactérienne en vue du titrage ou de l’amplification
La souche E. coli ER2738, recommandée pour le bio-criblage, a été obtenue de New England Biolabs et les méthodes de culture sont tirées des recommandations du fournisseur [39]. La souche a d’abord été cultivée sur boîte de Petri composée de milieu LB avec anti-biotique (tétracycline) à 37°C pour une nuit. Cette souche possède un gène de résistance à la tétracycline lié à la production du pilus F, qui sert de site d’adsorption des bactério-phages. L’utilisation de l’antibiotique lors des pré-cultures assure donc le maintien de cette caractéristique des cellules, essentielle à la réplication des phages. L’inoculum utilisé lors du titrage ou de l’amplification provient de pré-cultures préparées dans du milieu LB+Tet20 (20 mg/L de tétracycline), inoculées à partir d’une colonie de la boîte de Petri puis incubées à 37°C avec forte agitation (200-250 rpm). La culture sur boîte de Petri a été conservée pour un maximum d’un mois à 4°C alors que les pré-cultures liquides ont été conservées pour 4-5 jours seulement, également à 4°C.
Bio-criblage
Une portion de la librairie a été ajoutée aux échantillons de minerais de sorte à obte-nir une représentation équivalente à 100 copies de chaque clone, chacun représentant une séquence distincte de 7 acides aminés (heptapeptide). Après une incubation d’une heure sous légère agitation à la température de la pièce, les échantillons ont été brièvement centri-fugés afin d’en récupérer le surnageant contenant les phages non liés. Le culot a été rincé une dizaine de fois avec du TBST (concentration croissante de polysorbate, comme pour la préparation des échantillons). L’élution des phages liés aux minerais a été effectuée avec une solution de glycine-HCl (pH 2,2). L’éluat récupéré a été neutralisé avec une solution Tris-HCl pH 9,1 afin d’éviter la dégradation des phages, puis une titration virale a été effec-tuée afin de vérifier le rendement de l’expérience. Le rendement devrait augmenter d’une ronde à l’autre puisque les meilleurs candidats devraient être enrichis au cours du processus. Le reste de l’éluat a été amplifié en milieu LB inoculé à 1% avec E. coli ER2738. Les phages contenus dans le surnageant de l’amplification ont été purifiés par une double préci-pitation au PEG, puis resuspendus dans du TBS. L’éluat amplifié et purifié a été titré afin d’en connaître la concentration et d’évaluer le volume à ajouter lors de la ronde suivante, pour obtenir un apport de phages comparable à la première ronde. Le tout a été répété pour
28
3-4 rondes (en ajustant les quantités de minerais et de polysorbate), selon le cas, après quoi l’éluat a été titré afin d’échantillonner la population obtenue en vue du séquençage menant à l’identification des séquences peptidiques sélectionnées. La Figure 14 illustre l’ensemble des étapes suivies lors du processus de bio-criblage.
1. Ajout initial de phages à l’échantillon de minerai (à partir de la
librairie) Minerai en
suspension 2. Incubation :
ad-sorption des phages affinitaires
3. Lavages : élimination des phages non liés 4. Élution : récupération des phages liés
5. Amplification, purification et titration : production de l’apport de la ronde suivante
Figure 14: Représentation des différentes étapes du bio-criblage. Ces étapes sont répétées pour un minimum de trois rondes, jusqu’à ce que le groupe de clones sélectionnés pré-sente un consensus au séquençage.
Surface du minerai Surface du minerai Surface du minerai
29 Titration des bactériophages
Essais sur plaque
La titration a été effectuée en employant la méthode de plages d'infection [39, 42]. L’échantillon à quantifier est dilué plusieurs fois (facteur 10 pour chaque dilution) dans du milieu LB, puis mélangé à un petit volume de « top agar » inoculé avec E. coli. L’échantillon est ensuite versé sur une boîte de Petri composée de milieu de culture auquel a été ajouté de l’IPTG et du X-gal. Comme le bactériophage M13 ne forme pas de plages de lyse mais plutôt des zones de croissance bactérienne plus faible, les clones de la librairie sont conçus de manière à inclure dans leur génome le gène lacZα (lié à la production de β-galactosidase). L’expression de ce gène par les bactéries suite à l’infection par les phages leur confère la capacité de dégrader le X-Gal (un galactoside, hétéroside du galactose); son hydrolysation produit un substrat bleu, facilement identifiable lors d’essais sur plaque (Fi-gure 15). Il faut donc ajouter de l’IPTG et du X-Gal à la composition du milieu de culture des boîtes de Petri utilisés pour ces essais. Après incubation, la quantité de phages de l’échantillon peut être déterminée en dénombrant les plages bleues formées sur le tapis bac-térien (unités formatrices de plages ou « plaque forming unit », pfu/mL), en appliquant le facteur de dilution utilisé.
Figure 15: Exemple d'essai sur plaque. Chaque bactériophage actif présent dans l'échantil-lon initial produit une zone de croissance bleutée.
30
Méthode par absorbance UV
Pour des mesures rapides d’échantillons purifiés, resuspendus dans du TBS, (pour évaluer le résultat d’une amplification par exemple) une méthode spectrophotométrique a été employée [43]. En raison de la contribution importante des protéines (pic d'absorbance à 280 nm) par rapport à l’ADN (pic d'absorbance à 260 nm) dans le spectre d’absorbance des bactériophages, une absorbance dans cette plage, avec un maximum à 269 nm peut être mesurée. La valeur de cette absorbance maximale est proportionnelle à la concentration de phages de l’échantillon (moyennant la soustraction de l’absorbance mesurée à 320 nm per-mettant de compenser pour l’absorbance des chromophores de phage). Un blanc est égale-ment requis pour soustraire l’absorbance du tampon. Finaleégale-ment, la formule employée (équation 1) tient compte de la taille du génome du phage, proportionnelle à la taille du phage et donc de la quantité de protéines.
𝑇𝑖𝑡𝑟𝑒 (𝑝ℎ𝑎𝑔𝑒𝑠 𝑚𝐿⁄ ) = (𝐴269− 𝐴320) ∙ 6 ∙ 10 16
𝑡𝑎𝑖𝑙𝑙𝑒 𝑑𝑢 𝑔é𝑛𝑜𝑚𝑒 𝑑𝑢 𝑝ℎ𝑎𝑔𝑒 (𝑛𝑏 𝑑𝑒 𝑏𝑎𝑠𝑒)∙ 𝑓𝑎𝑐𝑡𝑒𝑢𝑟 𝑑𝑒 𝑑𝑖𝑙𝑢𝑡𝑖𝑜𝑛 Équation 1: Évaluation du titre phagique par spectrophotométrie
Cette méthode a l’avantage de pouvoir être réalisée en une quinzaine de minutes comparativement aux essais sur plaque qui requièrent au moins 10 heures d’incubation. En contrepartie, l’échantillon doit être suffisamment pur (suspendu dans du TBS) afin d’éviter d’affecter le spectre d’absorption. La valeur obtenue ne tient également pas compte de l’activité des phages, mais plutôt d’un nombre total de particules virales, impliquant un ratio phage infectieux/phage totale pouvant être variable (sujet traité plus en détail à la sec-tion 4.2). D’autre part, le seuil de détecsec-tion de cette méthode est assez élevé: une concentra-tion minimale d’environ 1011 phages/mL est requise. La spectrophotométrie n’a donc pas été employée pour des mesures précises à basses concentrations.
31 Amplification de clones individuels
Petite échelle
Suite à la titration de la dernière ronde de bio-criblage, des plages infectieuse sont sélectionnées et amplifiées afin d’obtenir suffisamment de matériel pour procéder au sé-quençage d’une partie dy génome des phages [39]. Chaque plage a été piquée à l’aide d’un embout de micropipette et employée pour infecter 1 mL de milieu LB préalablement inocu-lé avec E. coli. Après une incubation à 37°C pendant 4-5 heures, les échantillons ont été centrifugés pour en séparer les bactéries et les surnageants transférés dans des tubes stériles. Une méthode d’extraction et purification d’ADN a ensuite été effectuée pour procéder au séquençage. Pour conservation à long terme, un volume de culture d’un clone amplifié peut être entreposé à -20°C, dilué dans un volume égal de glycérol.
Afin de produire davantage de matériel biologique pour des tests subséquents, les clones individuels préalablement préparés sont employés pour infecter 20 mL de milieu LB inoculé à 1% (v/v) d’une culture E. coli (cultivée pendant une nuit). Cette pré-culture, in-cubée pour 2-3 heures à 37°C, sert ensuite d’inoculum pour une culture d’un litre, qui est incubée pour 4 heures supplémentaires à 37°C [44].
Fermentation en bioréacteur de 20 litres
À un certain point lors des travaux, une quantité importante de bactériophages était requise pour la réalisation de diverses expériences autant à l’université que chez le parte-naire industriel. D’autre part, il est pertinent d’avoir une idée du potentiel de production de bactériophages afin de vérifier comment la technologie pourrait être transposée à l’échelle industrielle advenant l’emploi de bactériophages comme bio-réactifs de flottation.
À cet effet, des travaux d’optimisation des conditions de fermentation pour la pro-duction de phages filamenteux fd sont déjà rapportés dans la littérature [45, 46]. Par la réa-lisation d’un plan d’expérience et d’une analyse par surface des réponses, il a été démontré qu’une température de 28°C et un pH de 7 représentaient des conditions optimales; ces conditions ont d’ailleurs permis d’obtenir une production finale de l’ordre de 3,5E11 pfu/mL [46]. Ces conditions, en plus d’une quantité d’oxygène dissous fixée à 100% ont été employées pour effectuer une production de 20 L en bioréacteur. Une pré-culture
équi-32
valant à 2% du volume du réacteur, préparée tel que décrit pour l’amplification à petite échelle, a servi d’inoculum pour cette expérience. La croissance bactérienne en cours de production a été mesurée par densité optique à 600 nm (OD600) alors que la concentration de bactériophages a été mesurée par essai sur plaque.
Purification d’échantillons d’ADN et séquençage
Une fois amplifiés, les échantillons de clones sélectionnés (obtenus à partir d’une plage de lyse) ont été purifiés par une courte précipitation au PEG/NaCl (PEG 20% / NaCl 2,5 M), puis centrifugés. L’ADN a été extrait par suspension du culot dans du tampon io-dure et précipité par l’ajout d’éthanol. Le culot d’ADN obtenu a été resuspendu dans du tampon EB et quantifié par spectrophotométrie à 260 nm avec un NanoDrop 2000c (Ther-mo Scientific). Les échantillons d’ADN ont été séquencés par la Plate-forme d’Analyses Génomiques de l’Université Laval. Un total de 16 clones issus de la dernière ronde ont été sélectionnés pour le séquençage afin d’assurer une représentation suffisante pour l’identification de séquences consensus.
2.3. Caractérisation de l’adsorption
Le processus de bio-criblage permet d’isoler des séquences peptidiques qui de-vraient a priori avoir une affinité pour la cible à laquelle elles auront été exposées. Toute-fois, il incombe de vérifier cette hypothèse en caractérisant plus précisément l’adsorption des différents clones identifiés sur les minerais à l’étude. Dans cette optique, la détermina-tion d’isothermes d’adsorpdétermina-tion est un choix adéquat puisque ces derniers fournissent de l’information quantitative sur le degré d’affinité et la spécificité des phages pour leurs cibles et la capacité d’adsorption maximale des matériaux. De plus, cette méthode est assez simple à réaliser comparativement à d’autres méthodes (telles que l’ELISA [9]). D’autre part, cette méthode a l’avantage de représenter le phénomène dans des conditions d’équilibre, ce qui se rapproche davantage de la sorption de réactifs de flottation en milieu industriel que des méthodes impliquant le rinçage des échantillons, éliminant les ligands non fortement liés.
33 2.3.1. Modèle d’interaction récepteur/ligand
L’application d’un modèle d’interactions récepteur/ligand (équation 2) sur les don-nées expérimentales mènera à l'obtention des paramètres qui permettront la comparaison quantitative des différentes expériences [47].
𝜑𝑙𝑖é =
𝐵𝑚𝑎𝑥∙ 𝜑𝑙𝑖𝑏𝑟𝑒
𝐾𝑑+ 𝜑𝑙𝑖𝑏𝑟𝑒 + 𝑁𝑆∙ 𝜑𝑙𝑖𝑏𝑟𝑒
Équation 2: Modèle d'interaction récepteur/ligand [47]
Dans cette équation, 𝜑𝑙𝑖é représente la quantité de phages liés à la cible et 𝜑𝑙𝑖𝑏𝑟𝑒 correspond à la quantité de phages libres. D'autre part, la constante de dissociation (Kd) est indicatrice du degré d’affinité du ligand par rapport au récepteur. Plus Kd est faible, plus l'affinité du ligand (le phage) pour le récepteur (le minerai) est grande. Le paramètre Bmax représente quant à lui la capacité d’adsorption maximale de phage par le minerai, alors que l’importance de l’adsorption non spécifique sera proportionnelle au paramètre NS.
2.3.2. Génération des isothermes et calcul des paramètres
Les clones à tester ont été amplifiés et purifiés afin d’obtenir des quantités suffi-santes pour effectuer les expériences d’adsorption. Pour chaque point expérimental, un échantillon de 125 mg de minerai a été préparé et nettoyé à l’EDTA (dans le cas des sul-fures). Des concentrations variables de phages, préparées dans du tampon TBST (0,25% Tween 20) ont été ajoutées aux minerais et incubés pendent une heure à la température de la pièce, permettant ainsi d’atteindre l’équilibre. Après centrifugation, le surnageant (conte-nant les phages non liés) a été récupéré et titré; par bilan de masse (équation 3), il a alors été possible de déterminer la quantité de phages adsorbés et d’obtenir les points de l’isotherme.
𝜑𝑙𝑖é = 𝑉𝜑∙ (𝜑𝑙𝑖𝑏𝑟𝑒,0− 𝜑𝑙𝑖𝑏𝑟𝑒,é𝑞)
𝑚𝑚 ∙ 𝑎𝑚
34
Où la quantité de phages liés (𝜑𝑙𝑖é) est en pfu/cm2, le volume de la solution de phages exposée au minerai (𝑉𝜑) est en mL, la quantité de phages libres initiale et à l’équilibre (𝜑𝑙𝑖𝑏𝑟𝑒,0 𝑒𝑡 𝜑𝑙𝑖𝑏𝑟𝑒,𝑒𝑞) sont en pfu/mL, la masse de minerai (𝑚𝑚) en grammes (g) et la surface spécifique du minerai (𝑎𝑚) en cm2/g.
Ainsi, pour satisfaire l’équation 2, la constante de dissociation (Kd), la capacité maximale d’adsorption (Bmax) et la constante d’adsorption non-spécifique (Ns) doivent res-pectivement être rapportées en pfu/mL, pfu/cm2 et mL/cm2. La valeur de ces paramètres a été calculée par régression non-linéaire. Des valeurs de paramètres sont d’abord fixées, permettant de calculer des concentrations de phages liés (𝜑𝑙𝑖é) en fonction de la quantité de
phages libres (𝜑𝑙𝑖𝑏𝑟𝑒) expérimentale. À l’aide d’un logiciel (tel que l’outil Solveur d’ExcelTM), la valeur des paramètres a été optimisée de sorte à minimiser l’erreur entre le calcul issu de l’équation 2 et celui provenant de l’équation 3.
2.4. Mesure de temps d’induction
Une fois des séquences polypeptidiques identifiées et l’affinité vérifiée, il importe de vérifier l’effet de l’adsorption des bactériophages sur les propriétés de surface du mine-rai, dans une optique d’application aux procédés de flottation. Pour ce faire, un appareil permettant de mesurer ce qui est appelé le temps d'induction a été utilisé chez le partenaire industriel (COREM).
2.4.1. Concept de temps d’induction
Le temps d’induction est une mesure permettant de comparer le niveau d’hydrophobicité de différents échantillons [3]. Cette méthode a été préférée à d’autres mé-thodes, telles que la mesure d’angle de contact, puisqu’elle permet de prendre des mesures qui se rapprochent davantage du modèle dynamique qui représente l’attachement d'une par-ticule de minerai à une bulle dans les procédés de flottation (c'est-à-dire l'effet net d'une compétition entre des phénomènes d’attachement et de détachement).
Une bulle est mise en contact avec un lit de particules pour un temps donné et l'atta-chement ou non de particules à sa surface est détecté. L’expérience est répétée plusieurs fois, de sorte que la proportion des essais qui résultent en l’attachement de particule(s)
![Figure 1: Croissance économique de l'industrie minière canadienne de 1983 à 2014, ex- ex-cluant les combustibles [1]](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/19.918.241.702.343.635/figure-croissance-économique-industrie-minière-canadienne-cluant-combustibles.webp)
![Tableau 1 : Types de minerai traités par flottation et concentrés produits aux États-Unis, en millions de tonnes métriques [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/20.918.129.758.421.760/tableau-minerai-traités-flottation-concentrés-produits-états-métriques.webp)
![Figure 2: Schéma conceptuel d’une cellule mécanique majoritairement employée pour les procédés de flottation [11]](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/22.918.231.640.378.803/figure-schéma-conceptuel-mécanique-majoritairement-employée-procédés-flottation.webp)
![Figure 4: Adhésion de R. opacus sur l'hématite et le quartz en fonction du pH [19].](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/26.918.224.644.451.701/figure-adhésion-opacus-hématite-quartz-fonction-ph.webp)
![Figure 6: Récupération de la sphalérite et de la galène par flottation en fonction de diffé- diffé-rentes concentrations d'ADN [6]](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/28.918.286.584.541.787/figure-récupération-sphalérite-galène-flottation-fonction-diffé-concentrations.webp)
![Tableau 2: Adhésion d'acides aminés sur différentes surfaces inorganiques avec de l'eau comme solvant [23]](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/29.918.155.814.617.963/tableau-adhésion-acides-aminés-surfaces-inorganiques-eau-solvant.webp)

![Figure 9: Représentation de l'adsorption de bactériophages sur la silice (particules blanches) et la sphalérite par l'entremise de mesure de fluorescence (taches rouges) [8]](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/32.918.113.767.712.998/représentation-adsorption-bactériophages-particules-blanches-sphalérite-entremise-fluorescence.webp)
![Figure 10: Comparaison de l'adsorption de bactériophages décorés de séquences octapep- octapep-tidiques différentes sur la chalcopyrite, la sphalérite, la silice et la pyrite [9]](https://thumb-eu.123doks.com/thumbv2/123doknet/6623234.180423/33.918.283.678.298.563/comparaison-adsorption-bactériophages-décorés-séquences-tidiques-chalcopyrite-sphalérite.webp)