Fonctions et régulations des protéines Crumbs
dans la morphogenèse des tissus épithéliaux
Thèse
Kévin Sollier
Doctorat en biologie cellulaire et moléculaire
Philosophiae doctor (Ph.D.)
Québec, Canada
© Kévin Sollier, 2016
Fonctions et régulations des protéines Crumbs
dans la morphogenèse des tissus épithéliaux
Thèse
Kévin Sollier
Résumé
Les tissus épithéliaux recouvrent les surfaces et les cavités du corps et fonctionnent comme des barrières sélectives capables d’échanges entre les différents compartiments de l’organisme. La fonctionnalité de ces tissus repose notamment sur la mise en place et le maintien d’une asymétrie structurale des cellules épithéliales, aussi appelée « polarité épithéliale ». La modulation des mécanismes orchestrant l’asymétrie membranaire est centrale dans la formation et le maintien de l’architecture des tissus épithéliaux. Ainsi, des défauts de polarité épithéliale provoquent des anomalies morphologiques et fonctionnelles des tissus épithéliaux, qui peuvent contribuer au cancer chez l’Homme. C’est pourquoi, la compréhension des processus liés à la polarité épithéliale constitue des objectifs cruciaux dans la biologie des épithéliums et dans la santé humaine, pour assurer le développement de nouvelles thérapies liées au rétablissement des fonctions soutenues par une asymétrie membranaire. Les mécanismes de polarité épithéliale et leurs fonctions signalétiques dans la morphogenèse des tissus épithéliaux jouent un rôle central dans ma thèse et font l’objet de mon introduction.
Mon projet de doctorat a consisté à caractériser la fonction et la régulation de Crumbs, un acteur clé dans la mise en place du domaine apical, dans le contrôle de la morphologie cellulaire et dans la morphogenèse des tissus épithéliaux. C’est pourquoi, l’étude de la régulation de la fonction de Crb au sein de la cellule épithéliale revêt un rôle capital dans la compréhension de la biologie des épithéliums. Dans ce cadre, nous avons d’abord permis d’approfondir les modalités d’une éventuelle fonction du domaine extracellulaire de CRB3A. De plus, nous montrons que la GTPase Rac1 permet de contrôler Crumbs dans un contexte tridimensionnel. Ainsi, nous proposons un modèle fonctionnel de Crumbs, soutenu par des approches in vitro et in vivo, dans le contrôle de la morphologie cellulaire et la morphogenèse des tissus tridimensionnels.
Table des matières
RÉSUMÉ ... III TABLE DES MATIÈRES ... IV LISTE DES FIGURES ... VI LISTE DES ABRÉVIATIONS ... VII REMERCIEMENTS ... X
CHAPITRE 1 : INTRODUCTION ... 1
1.1 ORGANISATION ET FONCTIONS DES ÉPITHÉLIUMS ... 2
1.2 ORGANISATION CELLULAIRE DES ÉPITHÉLIUMS. ... 5
1.2.1 Les jonctions cellulaires ... 5
1.2.2 Le cytosquelette et le trafic vésiculaire ... 8
1.3 ORGANISATION MOLÉCULAIRE DE LA CELLULE ÉPITHÉLIALE ... 15
1.3.1 Le module Crumbs ... 15
1.3.2 Régulation du module Crumbs dans la polarité épithéliale ... 19
1.4 FONCTION ET RÉGULATION DE CRB DANS LA MORPHOLOGIE CELLULAIRE ET TISSULAIRE. 29 1.4.1 Fonction de Crb dans la morphologie cellulaire et tissulaire. ... 29
1.4.2 Régulation de Crb dans la morphologie cellulaire et tissulaire. ... 30
1.4.3 Modulation de la fonction de Crb dans la morphogenèse des tissus épithéliaux. ... 31
1.5 UN MODÈLE DE MORPHOGENÈSE DES TUBULES ÉPITHÉLIAUX, LE DÉVELOPPEMENT DE LA TRACHÉE EMBRYONNAIRE DE DROSOPHILE ... 35
1.5.1 Généralités sur le modèle de la drosophile ... 35
1.5.2 Anatomie de la trachée embryonnaire de drosophile ... 37
1.5.3 Morphogénèse initiale de la trachée de drosophile ... 38
1.5.4 Contrôle du diamètre de la trachée embryonnaire ... 40
1.5.5 Contrôle de la longueur de la trachée embryonnaire... 40
OBJECTIFS ... 42 CHAPITRE 2 : ... 44 2.1AVANT-PROPOS ... 45 2.2RÉSUMÉ ... 45 2.3ABSTRACT ... 46 2.4INTRODUCTION ... 46
2.5RESULTS AND DISCUSSION ... 47
2.5.1 Rac1 limits Crb activity to define dorsal trunk length ... 47
2.5.2 Rac1 promotes Crb endocytosis, which prevents over-elongation of dorsal trunks ... 50
2.5.3 Rac1 is required for SJ functions as well as for Verm and Serp secretion ... 54
2.5.4 Rac1 and Cora are involved in a positive feedback loop ... 56
2.6MATERIALS AND METHODS... 60
CHAPITRE 3 : ... 62
3.1AVANT-PROPOS ... 63
3.2CONTRÔLE DE LA TUBULOGENÈSE PAR LES PARTENAIRES FONCTIONNELS DE CRB . 63 3.3ÉTUDE DE L’INTERACTION HOMOTYPIQUE CRB3A/CRB3A DANS LES CELLULES DE MAMMIFÈRES ... 67
3.3.1 Étude structure-fonction des domaines intracytoplasmique et extracellulaire de la protéine CRB3A dans la compaction cellulaire ... 67
3.3.2 Étude du domaine extracellulaire de CRB3A dans la promotion des forces adhésives intercellulaires ... 69
3.3.3 Étude de l’interaction homotypique entre les protéines CRB3A par une approche
biochimique ... 70
3.3.4 Étude de l’interaction homotypique entre les protéines CRB3A par une approche chimique ... 72
3.4MATÉRIELS ET MÉTHODES : ... 75
3.4.1 Contrôle de la tubulogenèse par les partenaires fonctionnels de Crb. ... 75
3.4.2 Étude de l’interaction homotypique CRB3A/CRB3A dans les cellules de mammifères 76 CHAPITRE 4 : DISCUSSION ... 82
4.1 ÉTUDE DE L’INTERACTION HOMOTYPIQUE CRB3A/CRB3A DANS LES CELLULES DE MAMMIFÈRES ... 83
4.2 FONCTIONS DE CRB3A DANS LE CONTRÔLE DE LA MORPHOLOGIE CELLULAIRE ET DE LA RÉPRESSION TUMORALE. ... 87
4.2.1 CRB3A contrôle un module contractile via l’activité RhoA ... 87
4.2.2 Crumbs, un chef d’orchestre de la morphologie apicale ? ... 88
4.2.3 CRB3A réprime l’agressivité des cellules tumorales en modifiant la morphologie cellulaire ? ... 91
4.3 RÉGULATION DE CRUMBS DANS LE CONTRÔLE DE LA TUBULOGENÈSE. ... 93
4.3.1 Rac1, un régulateur négatif des fonctions apicales de Crb ... 93
4.3.2 Rac1, un chef d’orchestre du trafic vésiculaire dans la signalisation liée aux jonctions septées ? ... 95
4.3.3 Rac1 et Cora coopèrent dans l’inhibition des fonctions de Crb ... 97
4.4 FONCTIONS DE CRB DANS LE CONTRÔLE DE LA TUBULOGENÈSE. ... 98
4.5CONCLUSIONS ... 104
BIBLIOGRAPHIE ... 105
ANNEXES ... 126
ANNEXE 1 :CRB3ACONTROLS THE MORPHOLOGY AND COHESION OF CANCER CELLS THROUGH EHM2/P114RHOGEF-DEPENDENT SIGNALING. ... 127
ANNEXE 2 :RAC1 CONTROLS EPITHELIAL TUBE LENGTH THROUGH THE APICAL SECRETION AND POLARITY PATHWAYS. ... 141
Liste des figures
Figure 1.1. Diversité morphologique et fonctionnelle des épithéliums. ... 4
Figure 1.2. Organisation spatiale de la cellule épithéliale ... 7
Figure 1.3. Schéma des modes de régulation d’une GTPase ... 9
Figure 1.4. Schéma de l’intégration des GTPases, Rac1 et Rab5 dans le maintien de l’architecture polarisée ... 14
Figure 1.5. Schéma de la structure du module Crumbs. ... 19
Figure 1.6. Schéma de la structure du module Par-6/aPKC/Cdc42. ... 20
Figure 1.7. Coopération et antagonisme des modules de polarité dans la mise en place de la polarité épithéliale ... 23
Figure 1.8. Régulation des fonctions de Crb par les protéines Yrt et Cora ... 26
Figure 1.9. Régulation réciproque du module de Crumbs par le métabolisme des phosphoinositides ... 28
Figure 1.10. Le programme de polarité épithéliale limite les propriétés invasives des cellules épithéliales ... 31
Figure 1.11. Régulation de la fonction des protéines Crb par interaction homotypique ... 34
Figure 1.12. Schéma du système UAS-GAL4 ... 37
Figure 1.13. Anatomie et morphogenèse de la trachée de drosophile. ... 39
Figure 1.14. Schéma de description du projet. ... 42
Figure 2.1. Rac1 promotes Rab5-dependent endocytosis of Crb ... 53
Figure 2.2. Rac1 promotes Rab5-dependent endocytosis of Crb ... 54
Figure 2.3. Rac1 controls SJ permeability and luminal accumulation of chitin-modifying enzymes. ... 55
Figure 2.4. Rac1 and Cora act in a positive feedback loop ... 57
Figure 2.5. Model of Rac1 activation and function in the control of tracheal tube length ... 59
Figure 3.1 : L’activité Rac1 est nécessaire à l’intégrité physique de la taenidia ... 65
Figure 3.2 : L’activation de la Moésine promeut l’allongement de la trachée ... 66
Figure 3.3 :Expression et localisation des constructions de CRB3A utilisées ... 68
Figure 3.4 : La surexpression de CRB3A ne modifie pas l’agrégation cellulaire. ... 69
Figure 3.5. Co-immunoprécipitation ectopique de CRB3A. ... 71
Figure 3.6. Absence d’interaction homotypique par l’utilisation de peptide synthétique. ... 74
Figure 4.1. Modèle des fonctions bimodales de Crb dans le maintien de la morphologie cellulaire ... 91
Liste des abréviations
α-cat : α-caténine β-cat : β-caténine
AJ : Jonction adhérente (Adherens junctions) aPKC : atypical Protein Kinase C
Arm : Armadillo
Arp2/3 : Actin-related proteins 2/3 Baz : Bazooka
BCA : Bicinchoninic acid Assay Bd : Branche dorsale
Bl : Branche latérale
BSA : Bovin serum albumin Btl (promoteur) : Breathless
C. elegans : Caenorhabditis elegans
Cdc42 : Cell division control protein 42 homolog Cora : Coracle
Crb : Crumbs
Da (promoteur) : Daughterless D. rerio : Danio rerio
DAPI : 4',6'-diamidino-2-phénylindole Dlg : Discs large
Ehm2 : Expressed in high metastatic cells 2 ERM : Ezrin, Radixin, Moesin
FA : FERM-Adjacent
FERM : band 4.1, Ezrin, Radixin, Moesin
FITC : Isothiocyanate de fluorescéine (Fluorescein isothiocyanate) GAP : GTPase-activating protein
GDP : Guanosine biphosphate
GEF : Guanine nucleotide exchange factor GTP : Guanosine triphosphate
Lgl : Lethal giant larvae
MAGUK : Membrane-associated guanylate kinase MDCK : Madin-Darby canine kidney
NGS : Normal Goat Serum Nrx-IV : Neurexine-IV Pak : p21 activated kinases
PALS1 : Protein associated with Lin-7 PAR3 : Partition defective 3
Par-6 : Partition defective 6
PATJ : Pals1-associated tight junction protein PBM : PDZ-Binging Motif
PBS : Phosphate buffered saline PDZ : PSD95, Dlg1, ZO-1 PI3K : Phosphoinositide 3-kinase
PIP2 : Phosphatidylinositol-4,5-diphosphate PIP3 : Phosphatidylinositol (3,4,5)-trisphosphate PTEN : Phosphatase and Tensin homolog
Pyd : Polychaetoid
Rac1 : Ras-related C3 botulinum toxin substrate 1 RIPA : Radioimmunoprecipitation assay
ROCK : Rho-associated protein kinase Scrib : Scribble
Sdt : Stardust Sp : spiracle
SJ : Jonctions septées (Septate junctions) Tc : Tronc connectif
Td : Tronc dorsal
TJ : Jonctions serrées (Tight junctions) TP : Tracheal Pit
UAS (promoteur) : Upstream Activator Sequence Yrt : Yurt
ZA : Zonula adherens ZO : Zonula occludens
Remerciements
Je tiens d’abord à remercier mon directeur de recherche Patrick Laprise, d’abord pour m’avoir fait confiance et confié un projet de recherche dans son laboratoire, ensuite pour m’avoir permis d’acquérir toutes mes connaissances dans le domaine de la polarité épithéliale et, enfin, de m’avoir conseillé et guidé tout au long de cette thèse.
Je remercie également tous les anciens membres du laboratoire, notamment François Chartier et Emilie Hardy, pour toutes les discussions scientifiques (ou plus légères !) dans la fly room, ainsi que pour l’aide technique apportée qui m’a été très précieuse pour certaines expériences. Je remercie également les autres membres du laboratoire, Clémence Gamblin, Elise Houssin, Lucie Charrier, Elise Loie et Hélori Gaudé, pour leur soutien et leur bonne humeur tout au long de cette thèse.
Enfin, je tiens à remercier ma famille et mes amis pour leur patience témoignée pendant cette thèse, et plus spécialement Amélie, dont le soutien inconditionnel a été déterminant pendant le déroulement de cette thèse.
1.1 Organisation et fonctions des épithéliums
Le maintien de l’homéostasie d’un organisme pluricellulaire requiert une compartimentation du milieu intérieur du milieu extérieur. Chez les métazoaires, cette fonction est remplie par les tissus épithéliaux. Ces tissus sont constitués de cellules épithéliales qui tapissent l’ensemble du corps et des cavités de l’organisme. De plus, ces cellules s’agencent histologiquement de manière compacte et reposent sur une lame basale (Eroschenko, 2008). Néanmoins, la dénomination d’épithélium regroupe des tissus aux formes et aux fonctions très différentes au sein d’un même organisme. Ainsi, les différents épithéliums peuvent d’abord être classés empiriquement selon la morphologie globale de leurs cellules (morphologie squameuse, cubique ou cylindrique). On peut également distinguer les épithéliums selon le nombre de strates du tissu. On peut alors observer des épithéliums stratifiés (ex : épiderme), constitués de plusieurs couches cellulaires empilées, des épithéliums pseudo-stratifiés (ex : épithélium de la trachée) et des épithéliums simples, constitués d’une couche unique de cellules épithéliales faisant face à la lumière (ex : épithélium du jéjunum). Dans ce manuscrit, je ne traiterai que des épithéliums simples.
En plus de leurs rôles de revêtement, les épithéliums assurent des échanges sélectifs et dirigés entre différents compartiments de l’organisme (ex : l’absorption de nutriments par les entérocytes, la réabsorption tubulaire du sodium et du glucose dans les tubes proximaux du rein, la sécrétion d’acide chlorhydrique par les cellules pariétales de l’estomac). Dans ce cadre fonctionnel, les cellules épithéliales peuvent mettre en place des structures spécifiques additionnelles, comme des microvillosités (ex : épithélium intestinal), des cils vibratiles (ex : épithélium bronchique) ou des stéréocils (ex : cellules de l’oreille interne).
Toutefois, malgré cette diversité morphologique et fonctionnelle des épithéliums simples, toutes les cellules épithéliales ont pour point commun une distribution spatiale asymétrique de leurs composants physico-chimiques (Figure 1.1). Cette organisation polarisée de la cellule permet de distinguer histologiquement un pôle apical, faisant face à la lumière, et un pôle basolateral. Cette «polarité épithéliale» est
centrale dans la biologie des épithéliums. En effet, sa mise en place précède et est requise à la morphogenèse (des mots grecs : « Morphê» –forme- et «Génésis» – origine-) des tissus épithéliaux et au maintien de leur homéostasie.
Cependant, les processus orchestrant la formation de tissus aux fonctions polarisées à partir de la mise en place d’une asymétrie cellulaire sont encore largement inconnus. C’est pourquoi, la compréhension de la morphologie et des propriétés fonctionnelles des épithéliums nécessitent l’étude des mécanismes cellulaires assurant une polarisation des fonctions de la cellule épithéliale dans l’espace.
Figure 1.1 : Diversité morphologique et fonctionnelle des épithéliums. Les cellules des tissus épithéliaux forment des tissus aux formes et aux fonctions très variées au sein d’un même organisme. Néanmoins, celles-ci nécessitent que les cellules épithéliales se polarisent au préalable dans un axe apicobasal.
1.2 Organisation cellulaire des épithéliums.
La topologie compacte et la fonctionnalité d’un épithélium requièrent un contrôle de la morphologie des cellules épithéliales pour assurer leurs cohésions au sein du tissu. Dans ce cadre, les cellules épithéliales mettent en place des structures mécaniques sur la membrane latérale (Lecuit and Yap, 2015). Ainsi, à l’interface du domaine apical et basolatéral des cellules épithéliales, on retrouve notamment les jonctions adhérentes et les jonctions étanches. De manière intrigante, ces jonctions cellulaires permettent également d’assurer la morphogenèse tridimensionnelle des tissus épithéliaux en coordonnant les forces mécaniques générées par les cellules épithéliales au niveau du tissu (Hannezo et al., 2014).
1.2.1 Les jonctions cellulaires
1.2.1.1 Les jonctions adhérentes
L’observation en microscopie électronique des épithéliums permet de distinguer une zonula adherens (ZA), une structure dense aux électrons qui ceinture la membrane latérale de chaque cellule épithéliale (Kanno et al., 2000). Ainsi, au niveau moléculaire, la ZA est une plate-forme moléculaire complexe, enrichie en protéines transmembranaires (ex : E-cadhérine), pouvant établir des interactions homotypiques à l’interface de deux cellules adjacentes (Chappuis-Flament et al., 2001). Du côté cytoplasmique, ces protéines s’associent directement et indirectement à des adaptateurs (ex : β- et α-caténine) qui se connectent mécaniquement au cytosquelette d’actine (Buckley et al., 2014). Ainsi, ces complexes moléculaires participent localement à la formation des jonctions adhérentes (Adherens Junction, AJ) sur la membrane latérale, qui permettent de lier mécaniquement le cytosquelette des cellules épithéliales entre-elles et de générer les forces nécessaires au maintien de l’intégrité physique du tissu épithélial.
De manière intéressante, les cellules épithéliales isolées en culture ne possèdent pas de ZA. La formation de la ZA et le maintien de son intégrité sont dynamiques et dépendent de la densité cellulaire. En effet, le contact physique entre deux cellules
épithéliales promeut la stabilisation membranaire des complexes jonctionnels de la ZA. Dans un environnement cellulaire dense, ces derniers coalescent en une structure circulaire unique d’où émerge les propriétés adhésives de la ZA (Andersen et al., 1996, Adams et al., 1998). Les jonctions adhérentes sont des structures évolutives anciennes partagées chez tous les métazoaires, suggérant que les machineries mécaniques permettant de maintenir l’intégrité physique du tissu épithélial sont conservées à travers les espèces (Harris and Tepass, 2010). En effet, la drosophile possède notamment un complexe DE-cadhérine/Armadillo/α-caténine, orthologue au complexe E-cadhérine/β-caténine/α-caténine des mammifères (Oda et al., 1994, Cox et al., 1996, Desai et al., 2013) (Figure 1.2).
1.2.1.2 Les jonctions étanches
Les épithéliums bâtissent également une zonula occludens (ZO). Cette architecture protéique forme une barrière physique au passage des ions et des fluides, qui permet de cloisonner l’organisme en compartiments étanches. Chez les vertébrés, cette fonction d’étanchéité est remplie par les jonctions serrées (Tight Junction, TJ). À l’image des jonctions adhérentes, cette structure se compose de protéines transmembranaires (ex : Claudine), associées à des adaptateurs cytoplasmiques (ex : ZO-1) reliés au cytosquelette d’actine de la cellule. Chez les vertébrés, ces jonctions se forment du côté apical des jonctions adhérentes (Figure 1.2).
Les invertébrés ne possèdent pas de jonctions serrées. En effet, la fonction d’étanchéité de leurs tissus épithéliaux est réalisée par des jonctions septées (Septate Junction, SJ) qui sont considérées comme les structures analogues aux jonctions serrées. Néanmoins, les mécanismes cellulaires en amont et en aval de ces jonctions ont divergé durant l’évolution (Matter and Balda, 2003) (Figure 1.2). En effet, la localisation et la composition chimique des jonctions septées diffèrent des jonctions serrées (Tepass and Hartenstein, 1994, Wood, 1990, Fehon et al., 1994). De plus, les jonctions septées sont localisées du côté basal des jonctions adhérentes. Enfin, certaines protéines, associées uniquement aux TJs chez les mammifères, présentent des localisations jonctionnelles différentes chez la drosophile (ex : Polychaetoid, l’orthologue drosophile de ZO-1, s’associe à la fois aux SJs et aux AJs (Takahisa et
al., 1996)). Les jonctions septées sont néanmoins constituées de protéines transmembranaires conservées à travers les espèces (ex : Neurexine-IV; Kune-Kune, un orthologue des claudines vertébrées), qui s’associent à des adaptateurs cytoplasmiques (ex : Coracle).
Figure 1.2 : Organisation spatiale de la cellule épithéliale. Les cellules épithéliales vertébrées et invertébrées forment des structures fonctionnelles latérales homologues (Jonction adhérente) et analogues (Jonction serrée/septée) entre-elles. Ces jonctions cellulaires sont formées de protéines transmembranaires qui s’associent à des adaptateurs cytoplasmiques connectés mécaniquement au cytosquelette d’actine. Les protéines et les fonctions associées aux jonctions septées se sont arrangées de manière différentielle dans l’évolution. Légende : α-cat:α-caténine ; β-cat :β-caténine ; ZO-1 :Zonula Occludens-ZO-1 ; Arm:Armadillo ; Pyd: Polychaetoid; Cora:Coracle; Nrx-IV:Neurexine-IV.
1.2.2 Le cytosquelette et le trafic vésiculaire
La mise en place d’une asymétrie apicobasale et la formation des structures jonctionnelles sont progressives et s’accompagnent d’un ajustement morphologique des cellules épithéliales (Hannezo et al., 2014). En effet, la mise en place de la polarité épithéliale et la formation des jonctions sont étroitement couplées au contrôle de la morphologie cellulaire. Ainsi, les cellules épithéliales, isolées en culture ou pendant le processus de cicatrisation chez l’animal, forment de nombreuses extensions membranaires, qui disparaissent concomitamment à la mise en place de la polarité épithéliale et la formation des jonctions cellulaires. Dans ce cadre, la compaction de la morphologie cellulaire est notamment soutenue par une réorganisation dynamique du cytosquelette qui charpente la cellule (Georgiou and Baum, 2010), et par la mise en place d’un trafic vésiculaire polarisé au sein de la cellule épithéliale (van Ijzendoorn et al., 2003). Ainsi, l’étude de leurs mécanismes est important dans la compréhension du contrôle de la morphologie cellulaire.
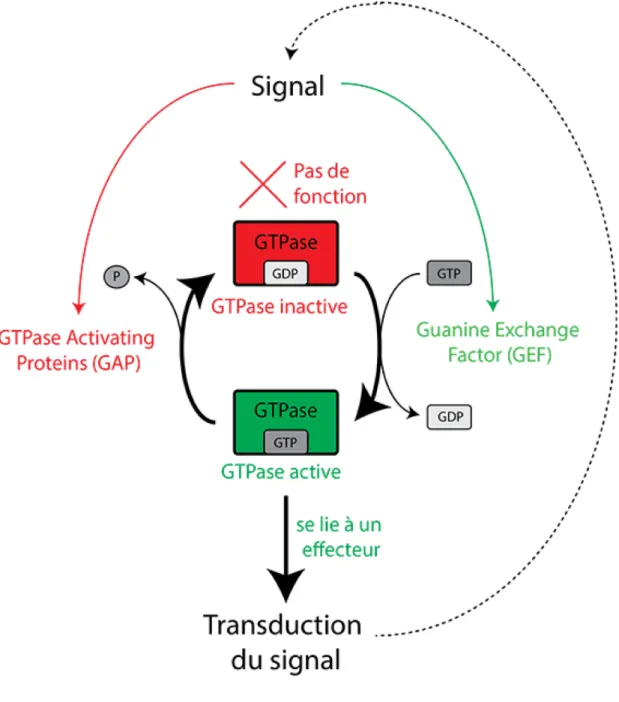
Le remodelage du cytosquelette et le trafic vésiculaire sont contrôlés par des petites GTPases, qui agissent comme des interrupteurs moléculaires au sein de la cellule (Sit and Manser, 2011, Fromme and Segev, 2014). En effet, les GTPases peuvent adopter une conformation active (liée au GTP) ou inactive (liée au GDP), permettant de contrôler l’activation de manière spécifique d’un vaste panel d’effecteurs en aval (Figure 1.3) (Etienne-Manneville and Hall, 2002).
Dans cette section, je décrirais essentiellement le rôle des GTPases Rac1, RhoA et Rab5 dans les processus de polarité épithéliale, qui tiennent un rôle central dans les projets présentés dans les chapitres 2 et 4.
Figure 1.3 : Schéma des modes de régulation d’une GTPase. La structure tridimensionnelle d’une GTPase cycle entre une conformation inactive (liée au GDP) et une conformation active (liée au GTP). Les changements de conformation sont contrôlés par des GTPase Activating Proteins (GAP), qui stimulent l’hydrolyse du GTP par la GTPase et favorisent la conformation inactive, et des Guanine Exchange Factor (GEF), qui échangent le GDP lié par un GTP. Ainsi, l’activité et la localisation des GAP et des GEF jouent un rôle central dans la fonction de la GTPase. En effet, seule la GTPase dans sa conformation active (liée au GTP) est capable de se lier à ses effecteurs et d’assurer ainsi la transduction d’un signal en aval.
1.2.2.1 La GTPase Rac1
Plusieurs mécanismes de remodelage du cytosquelette sont intimement liés à la morphologie cellulaire et font intervenir la famille des GTPases Rho (Hall, 1998). Dans cette famille, on peut distinguer la sous-famille Rac (Ras-related C3 botulinum toxin substrate) qui comporte chez les mammifères 3 membres partageant plus de 90% d’identité : Rac1, Rac2 et Rac3 (Malosio et al., 1997). La GTPase Rac1 est l’isoforme majeure et ubiquitaire des GTPases Rac dans les tissus de mammifères (Didsbury et al., 1989). En effet, Rac2 est exprimée spécifiquement dans les cellules hématopoïétiques (Shirsat et al., 1990) et l’expression de Rac3 est restreinte au système nerveux embryonnaire et adulte (Haataja et al., 1997). Le génome de la drosophile contient trois gènes rac (rac1, rac2 et mtl) dont les fonctions sont partiellement redondantes (Ng et al., 2002, Hakeda-Suzuki et al., 2002). Il est à noter que l’expression d’un dominant négatif de Rac1 (Rac1N17) suffit à récapituler plusieurs défauts morphogénétiques liés à la perte des gènes rac chez la drosophile (Harden et al., 1995, Luo et al., 1994, Fanto et al., 2000, Hakeda-Suzuki et al., 2002). Dans les cellules épithéliales de mammifères et de drosophile, l’activité de la GTPase Rac1 est régulée de manière asymétrique le long de l’axe apicobasal, en étant enrichie au domaine basolatéral et désactivée au domaine apical (Mack et al., 2012, O'Brien et al., 2001, Chartier et al., 2011). Plus de 70 effecteurs fonctionnels de Rac1 ont été identifiés (Bustelo et al., 2007). Parmi eux, Rac1 peut notamment activer localement le complexe nucléateur d’actine Arp2/3 (Actin-Related Proteins 2/3). Ainsi, l’activité Rac1 stimule la formation de protrusions membranaires (Yamazaki et al., 2007, Galbraith et al., 2007) qui favorisent les étapes précoces de formation des jonctions adhérentes (DeMali and Burridge, 2003). En retour, ces jonctions cellulaires activent localement l’activité Rac1 (Nakagawa et al., 2001, Noritake et al., 2004), créant ainsi une boucle de rétroaction positive au domaine latéral entre l’activation de Rac1 et la promotion de l’adhésion cellulaire. Cependant, Rac1 peut, de manière concomitante, stimuler l’endocytose de la E-cadhérine (Akhtar and Hotchin, 2001), induisant ainsi le désassemblage des jonctions adhérentes (Braga et al., 2000). De plus, l’expression d’un dominant actif de Rac1 (Rac1V12) mène au désassemblage des jonctions
cellulaires (Braga et al., 2000). Ainsi, il a été suggéré que Rac1 puisse jouer un rôle de tenseur membranaire, pouvant moduler l’adhésion cellulaire en contrôlant la quantité jonctionnelle des cadhérines (Daneshjou et al., 2015). L’enrichissement basolatéral de l’activité Rac1 est également essentiel pour la fonction des jonctions serrées chez les mammifères (Mack et al., 2012, Chen and Macara, 2005).
L’activité Rac joue un rôle crucial dans la morphogenèse des tissus épithéliaux in vivo. Son rôle a surtout été étudié chez la drosophile puisque les embryons de souris knock-out pour Rac1 montrent des défauts dès la gastrulation, avec une absence de mise en place des trois feuillets embryonnaires (Sugihara et al., 1998), qui pourrait être expliquée par un défaut de mouvements collectifs des cellules de l’épiblaste (Migeotte et al., 2010). Les embryons de drosophiles déficients pour l’activité Rac1 montrent également des défauts de migration collective des cellules épithéliales, qui ont été reliés à des défauts d’organisation du cytosquelette ou de la plasticité des jonctions cellulaires. En effet, ces embryons montrent d’abord une absence de fermeture dorsale (Harden et al., 1995), un évènement développemental impliquant la migration et la fusion coordonnées de deux feuillets d’ectoderme sur la partie dorsale de l’embryon. Ainsi, l’activité Rac1 est nécessaire à la migration des cellules des deux feuillets ectodermiques en assurant le remodelage de leur cytosquelette (Woolner et al., 2005). Ensuite, les défauts de l’activité Rac1 entraînent des anomalies de tubulogenèse chez la drosophile. La tubulogenèse est un processus developpemental complexe, orchestrant la formation d’un tube à partir d’un tissu bidimensionnel (ex : tube neural chez les mammifères, trachée et glandes salivaires embryonnaires chez la drosophile) (Hogan and Kolodziej, 2002). Dans ce cadre, l’activité Rac1 module l’adhésion entre les cellules épithéliales pour assurer la morphogenèse de la trachée embryonnaire (Chihara et al., 2003) et des glandes salivaires de drosophile (Pirraglia et al., 2006).
1.2.2.2 La GTPase RhoA
La GTPase RhoA (Ras homolog gene family, member A) joue également un rôle capital dans le maintien de la morphologie épithéliale. En effet, l’activité RhoA est nécessaire à la maintenance des jonctions adhérentes (Ratheesh et al., 2012), des
jonctions serrées (Terry et al., 2011) et de l’intégrité physique des structures apicales (Pan et al., 2007). Dans ce contexte, RhoA peut s’associer à plusieurs machineries impliquées dans le remodelage du cytosquelette (Sahai and Marshall, 2002). Parmi elles, l’activité RhoA stimule la fonction des ROCK (Rho-associated protein kinase), des sérines/thréonines kinases qui assurent la phosphorylation de la chaîne légère régulatrice de la myosine-II (Watanabe et al., 2007). La myosine-II est un moteur moléculaire capable de s’associer au cytosquelette d’actine et de générer des tensions corticales, qui assurent la contractilité et la stabilisation du cytosquelette apical des cellules épithéliales (Terry et al., 2011, Nakajima and Tanoue, 2010). Néanmoins, les mécanismes moléculaires permettant de contrôler en amont l’activité RhoA au domaine apical d’une cellule épithéliale restent largement méconnus.
Le contrôle de l’activité RhoA joue également un rôle crucial pendant la morphogenèse tridimensionnelle des tissus épithéliaux. En effet, la modulation de son activité permet d’assurer une constriction corticale des cellules épithéliales, une modification morphologique cellulaire qui peut promouvoir, selon le contexte, l’élongation (Schock and Perrimon, 2002) ou l’invagination d’un tissu épithélial (He et al., 2014, Martin et al., 2009).
Le contrôle des machineries cytosquelettiques par les GTPases au niveau de la cellule est essentiel pour le maintien de l’homéostasie des épithéliums. Ainsi, les fonctions de RhoA et de Rac1 s’inscrivent dans un réseau signalétique cellulaire polarisé, permettant de contrôler la morphologie cellulaire et la morphogenèse des tissus épithéliaux (Chauhan et al., 2011). En effet, les fonctions de Rac1 et de RhoA s’antagonisent réciproquement (Moorman et al., 1999, Chauhan et al., 2011, Lee and Thomas, 2011, Jou and Nelson, 1998) par des mécanismes qui restent à définir. Ces GTPases semblent établir des gradients d’activation mutuellement exclusifs le long de la membrane apicobasale et participent à la fonctionnalité de machineries de remodelage du cytosquelette distinctes (Figure 1.4), de manière analogue à la polarisation avant-arrière des cellules en migration (Rottner et al., 1999).
1.2.2.3 La GTPase Rab5
La formation des jonctions cellulaires est concomitante à la mise en place d’un trafic vésiculaire polarisé au sein de la cellule épithéliale, qui permet d’assurer un contrôle quantitatif des composants délivrés dans les différents compartiments membranaires (Rodriguez-Boulan et al., 2005, Rodriguez-Boulan and Macara, 2014). Le trafic vésiculaire joue un rôle crucial dans la morphogenèse des épithéliums puisque son altération entraîne des défauts de polarité épithéliale chez la drosophile et les mammifères (Lu and Bilder, 2005, Shaye et al., 2008, Zeigerer et al., 2012). Le contrôle du trafic vésiculaire s’articule autour de la famille des GTPases Rab (Ras-related in brain), qui assure l’acheminement et le recyclage des composants apicaux et basolatéraux (Zerial and McBride, 2001). Dans cette famille, la GTPase Rab5 est impliquée dans les étapes précoces de l’endocytose de protéines transmembranaires (Stenmark et al., 1994) en stimulant la fusion des vésicules décorées de clathrine avec les endosomes précoces (Bucci et al., 1994). De manière intéressante, Rab5 exerce un contrôle sur l’état d’activation et la localisation de la GTPase Rac1, qui démontre l’existence d’un système intégré entre les mécanismes de remodelage du cytosquelette et du trafic vésiculaire (Ramel et al., 2013, Palamidessi et al., 2008)(Figure 1.4).
L’étude des mécanismes d’activation de ces GTPases est ainsi déterminante dans la compréhension de la mise en place et le maintien de la polarité épithéliale, des jonctions cellulaires, de la morphologie cellulaire et du contrôle de la morphogenèse des tissus.
Figure 1.4 : Schéma de l’intégration des GTPases, Rac1 et Rab5 dans le maintien de l’architecture polarisée. Les machineries de remodelage du cytosquelette liées aux GTPases Rac1 (jaune) et RhoA (bleu) ont des fonctions mutuellement exclusives pour maintenir l’intégrité des jonctions cellulaires (bleu), du domaine apical (vert) et du domaine basolatéral (noir). Les mécanismes de contrôle du trafic vésiculaire, notamment par la GTPase Rab5, permettent d’assurer un contrôle quantitatif des composants membranaires le long de l’axe apicobasal et s’inscrivent dans la polarisation des fonctions des GTPases le long de l’axe apicobasal.
1.3 Organisation moléculaire de la cellule épithéliale
L’état d’activation et la fonction des différentes GTPases sont intrinsèquement couplés au recrutement local de leurs GEFs, GAPs et de leurs effecteurs (Pertz, 2010) (Figure 1.3). Il est important de noter que la localisation de ces acteurs est spatialement restreinte à un domaine membranaire par un programme de polarité épithéliale (Georgiou and Baum, 2010). Ce programme de polarité épithéliale permet de créer une asymétrie cellulaire qui permet de localiser correctement les machineries de remodelage du cytosquelette et les composants des structures jonctionnelles à la membrane. Ce mécanisme s’articule autour de plusieurs modules moléculaires, qui font l’objet de régulations réciproques (Fletcher et al., 2012). Ainsi, l’analyse structurale et fonctionnelle de ces modules revêt une importance capitale dans la compréhension de la mise en place d’une asymétrie membranaire, de la morphologie cellulaire et de la morphogenèse des épithéliums.
La localisation et la fonction des modules du programme de polarité épithéliale sont dynamiques pendant l’établissement de la polarité épithéliale et l’embryogenèse. Pour simplifier la nomenclature, ces modules sont classés selon leur localisation subcellulaire finale. Ainsi, on distingue des modules dits « apicaux », qui participent à la formation du pôle apical, et des modules « basolatéraux » qui assurent la formation du pôle basolatéral. Dans cette section, je décrirais les mécanismes communs de mise en place de polarité épithéliale chez la drosophile et les mammifères qui seront particulièrement importantes pour la compréhension des chapitres 2 et 4.
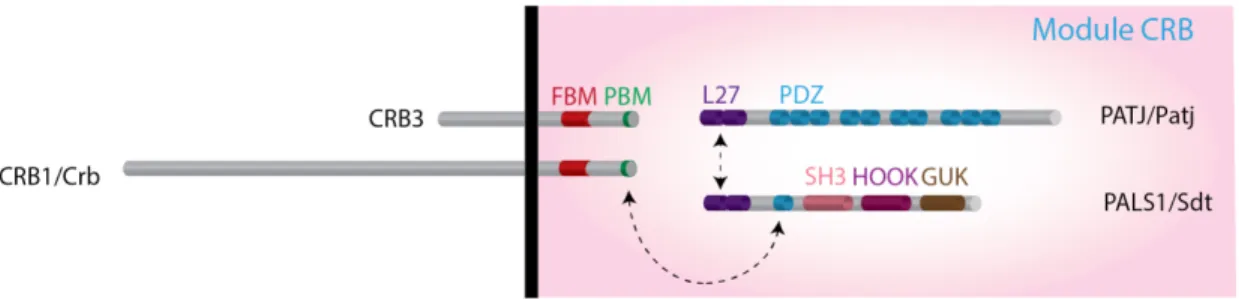
1.3.1 Le module Crumbs
Chez la drosophile, les protéines Crumbs (Crb), Stardust (Sdt) et Patj forment le module Crumbs, qui joue un rôle fondamental dans la mise en place du pôle apical de la cellule épithéliale.
1.3.1.1 Crumbs/CRB3A
Le gène crb a d’abord été caractérisé chez l’embryon de drosophile pour son rôle essentiel dans le maintien de l’intégrité des tissus épithéliaux. En effet, la perte de crb s’associe à une désorganisation majeure de la structure de l’ectoderme de l’embryon de drosophile , associée à de larges plages d’apoptose des cellules épithéliales, ne laissant que des « miettes de cuticule » visibles en microscopie optique (Jürgens et al., 1984).
Au niveau moléculaire, la protéine Crb est une protéine transmembranaire d’environ 230 kDa, qui possède un très court domaine intracellulaire de 37 acides aminés. Crb se localise exclusivement dans la portion membranaire apicale à la ZA (également appelée « zone marginale ») des cellules de la plupart des tissus dérivés de l’ectoderme (Tepass et al., 1990). Le contrôle quantitatif de Crb à la membrane est crucial pour l’intégrité physique des épithéliums. En effet, la surexpression de Crb suffit à entraîner une expansion du domaine apical au dépend du domaine basolatéral dans la plupart des tissus ectodermiques (Wodarz et al., 1995), alors que la perte de Crb empêche la formation de la ZA (Tepass, 1996) et s’associe à une perte de l’organisation en monocouche des tissus embryonnaires.
De manière intrigante, les fonctions de Crb semblent intégralement encodées dans son court domaine intracellulaire. En effet, l’expression d’une version de Crb tronquée de son domaine extracellulaire mime la surexpression de la protéine Crb pleine longueur et suffit à restaurer la plupart des défauts physiques des tissus épithéliaux observés chez les embryons mutant pour crb (Wodarz et al., 1995). De plus, la surexpression de la portion extracellulaire de la protéine n’induit pas de phénotype apparent dans la plupart des tissus embryonnaires et adultes (Tepass et al., 1990).
La protéine Crb est conservée à travers les espèces. En effet, trois homologues ont été caractérisés chez Caenorhabditis elegans (C. elegans), dénotés CeCrb1 -aussi appelé CRB-1 (Segbert et al., 2004)-, CeCrb2 -aussi appelé EAT-20 (Shibata et al., 2000)- (Klebes and Knust, 2000) et CRB-3 (Waaijers et al., 2015). Chez les vertébrés, cinq
homologues ont été identifiés chez Danio rerio (D. rerio), dénotés crb1, crb2a, crb2b, crb3a et crb3b (Omori and Malicki, 2006) et trois homologues ont été caractérisés chez les mammifères, dénotés CRB1 (den Hollander et al., 1999), CRB2 (van den Hurk et al., 2005, Lemmers et al., 2002) et CRB3 (Makarova et al., 2003).
L’analyse des séquences des protéines CRB a permis d’identifier deux motifs dans la portion cytoplasmique remarquablement conservés à travers les espèces. Le premier domaine est constitué des quatre résidus d’acides aminés C-teminaux de Crb (E-R-L-I), qui forment un motif « PBM » (PDZ-Binding Motif), impliqué dans l’interaction avec des protéines à domaine PDZ (PSD-95, Discs Large, ZO-1). Le second domaine conservé forme un motif « FBM » (FERM-Binding Motif) qui permet le recrutement à la membrane de protéines à domaine FERM (band 4.1 Ezrin Radixin Moesin) (Figure 1.5). Ces deux motifs d’interaction protéine-protéine sont essentiels aux fonctions de Crb chez la drosophile (Klebes and Knust, 2000, Medina et al., 2002) et chez les mammifères (Fogg et al., 2005). Néanmoins, le domaine extracellulaire de Crb (Crbextra) peut coopérer en partie avec le domaine intracellulaire dans le maintien de la polarité apicobasale dans l’ectoderme dorsal et les placodes trachéales (Letizia et al., 2013). De plus, Crbextra est nécessaire à la stabilisation membranaire de Crb durant la morphogenèse de plusieurs structures embryonnaires et adultes chez la drosophile (Roper, 2012, Letizia et al., 2011, Pellikka et al., 2002). Chez le poisson zèbre, la morphogenèse de la rétine nécessite une interaction homotypique des orthologues crb2 et crb3 (Zou et al., 2012), qui semble conservée chez la drosophile puisque la surexpression de Crbextra suffit à promouvoir l’agrégation de cellules in vitro (Letizia et al., 2013).
L’humain possède trois orthologues de Crb, nommés CRB1, CRB2 et CRB3 (Bazellieres et al., 2009). La protéine CRB3 est exprimée dans la plupart des tissus épithéliaux, contrairement à CRB1 et CRB2 (van den Hurk et al., 2005, den Hollander et al., 1999) et semble fonctionner comme l’orthologue de Crb dans le maintien de la polarité épithéliale (Fogg et al., 2005). CRB3 possède deux variants d’épissage aux fonctions différentes. CRB3A se localise aux jonctions serrées et soutient leurs formations (Makarova et al., 2003, Lemmers et al., 2004) alors que
CRB3B soutient la cytokinèse et la ciliogenèse en se localisant respectivement aux pôles du fuseau mitotique et à la membrane du cil. Au niveau moléculaire, la séquence de CRB3B diverge de celle de CRB3A dans la portion C-terminale et n’encode notamment pas de motif PBM (Fan et al., 2007). Ainsi, ces données ont suggéré le rôle prédominant de l’isoforme CRB3A dans le maintien de la polarité épithéliale chez les mammifères (Fogg et al., 2005).
1.3.1.2 Stardust/PALS1
Les embryons de drosophile portant une mutation dans le gène stardust (sdt) montrent une perte d’intégrité de la ZA associée à une mauvaise distribution d’Armadillo et de la DE-cadhérine, un phénotype similaire aux embryons mutants pour crb (Bachmann et al., 2001). Chez les mammifères, cette fonction est remplie par PALS1 (Protein Associated with Lin Seven)(Kamberov et al., 2000, Roh et al., 2003) qui est l’orthologue de Sdt. Sdt/PALS1 sont des protéines cytoplasmiques de la famille MAGUK (Membrane-Associated GUanylate Kinase). Les protéines de la famille MAGUK comportent de nombreux motifs d’interactions et fonctionnent comme des structures d’échaffaudage cytoplasmique permettant notamment le recrutement de protéines à la membrane apicale (Straight et al., 2001).
Dans ce cadre, Sdt/PALS1 contient un domaine PDZ qui peut interagir au domaine PBM des protéines Crumbs (Bachmann et al., 2001, Hong et al., 2001)(Figure 1.5). Sdt/PALS1 fonctionne au sein d’un module moléculaire avec Crumbs. En effet, chez la drosophile, bien que des spécificités tissulaires existent dans la coopération fonctionnelle entre ces deux protéines (Kumichel and Knust, 2014), les localisations au pôle apical de Crb et de Sdt sont interdépendantes et essentielles au maintien de la polarité épithéliale dans la plupart des épithéliums (Tepass and Knust, 1993, Hong et al., 2001).
1.3.1.3 Patj/PATJ
Chez les mammifères, PATJ (Protein Associated with Tight Junctions) est une protéine d’échaffaudage contenant un domaine L27 qui s’hétéro-oligomérise avec
celui de PALS1 (Lemmers et al., 2002). La protéine PATJ possède également 10 domaines PDZ qui permettent de lier directement certaines protéines des jonctions serrées (Roh et al., 2002a)(Figure 1.5). PALS1 permet le recrutement apical de PATJ (Roh et al., 2002b), qui promeut en retour la maturation des jonctions serrées (Shin et al., 2005, Michel et al., 2005). Il est à noter que Patj (l’orthologue drosophile de PATJ (Pielage et al., 2003)) est classée dans le module Crumbs, bien que ses fonctions soient tissus-spécifiques dans les mécanismes de polarité épithéliale. En effet, chez la drosophile, Patj n’est pas nécessaire à la mise en place de la polarité épithéliale de l’ectoderme. De plus, les individus mutants pour Patj dépassent le stade embryonnaire et se developpent jusqu’au stade de pupe. Néanmoins, chez l’adulte, Patj est nécessaire à la mise en place et au maintien de la ZA dans les rétines de drosophile, en régulant la localisation de Crb et de Sdt (Nam and Choi, 2006). Enfin, dans l’épithélium foliculaire, la perte de Patj limite la croissance du domaine apical induite par Crb (Penalva and Mirouse, 2012).
Figure 1.5 : Schéma de la structure du module Crumbs.
1.3.2 Régulation du module Crumbs dans la polarité épithéliale
L’activité du module Crumbs est régulée spatialement par plusieurs modules moléculaires permettant de confiner son activité au domaine apical. Ainsi, le module Crumbs est au cœur d’une connexion signalétique avec d’autres modules de polarité épithéliale (le module apical Par-6/aPKC/Cdc42 et le module basolatéral Scribble), avec des protéines à domaine FERM-FA (Yurt et Coracle) et avec le métabolisme des phosphoinositides. Ensemble, ces différentes régulations spatiales permettent, au niveau cellulaire, de maintenir la polarité épithéliale (Fletcher et al., 2012).
1.3.2.1 Le module apical Par-6/aPKC/Cdc42
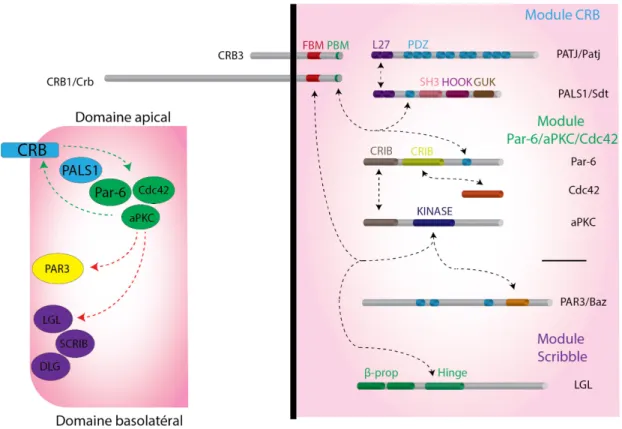
Le module apical Par-6/aPKC/Cdc42 coopère avec le module Crumbs dans l’établissement et le maintien de la polarité épithéliale (Nam and Choi, 2003).
Par-6 (Partitioning defective-6) est au cœur du module Par-6/aPKC/Cdc42. En effet, Par-6 est une protéine d’échafaudage interagissant au domaine apical avec la GTPase Cdc42 (Hung and Kemphues, 1999, Hutterer et al., 2004) et s’hétéro-oligomérise par son domaine PB1 avec aPKC (atypical Protein Kinase C)(Hirano et al., 2005). Cette interaction permet de contrôler les fonctions de la kinase aPKC (Graybill et al., 2012, Yamanaka et al., 2001)(Figure 1.6).
Figure 1.6 : Schéma de la structure du module Par-6/aPKC/Cdc42.
aPKC est une sérine/thréonine kinase conservée parmi les espèces (Tabuse et al., 1998, Wodarz et al., 2000, Joberty et al., 2000). Le contrôle spatiotemporel de l’activité aPKC par la cellule épithéliale est crucial puisqu’il permet de réguler un programme séquentiel dans la création de l’asymétrie membranaire (Hutterer et al., 2004, Betschinger et al., 2003). Ainsi, aPKC possède de nombreux substrats au sein de la cellule et participe à maintenir la localisation des modules de polarité épithéliale à un domaine membranaire, en modifiant leurs affinités d’interactions par phosphorylation (Horikoshi et al., 2009, Morais-de-Sa et al., 2010, Zhu et al., 2014, Hurov et al., 2004, Gamblin et al., 2014).
Le module Crumbs permet de localiser et de restreindre l’activité aPKC au domaine apical. En effet, chez la drosophile, les étapes précoces de la mise en place de la polarité épithéliale nécessite d’abord le recrutement membranaire de Bazooka (Baz, l’orthologue drosophile de PAR3 mammifère) au niveau des régions
pré-jonctionnelles lors de l’établissement de la formation des jonctions adhérentes (Muller and Wieschaus, 1996, Harris and Peifer, 2004). Baz recrute en retour le complexe Par-6/aPKC pour former le complexe jonctionnel transitoire Baz/Par-6/aPKC, nécessaire à la maturation épithéliale. Cette association est ensuite déstabilisée par Crb, qui entre en compétition avec la liaison Baz/Par-6 qui favorise la phosphorylation de Baz par aPKC. Cette phosphorylation entraîne la dissociation du complexe Baz/Par-6/aPKC (Morais-de-Sa et al., 2010) et l’exclusion de Baz du domaine apical (Walther and Pichaud, 2010, Gula et al., 2010), favorisant ainsi le recrutement et la restriction du complexe Par-6/aPKC au domaine apical par Crb (Figure 1.7). Des processus similaires sont retrouvés chez C. elegans (Aceto et al., 2006) et les mammifères, avec l’exclusion apicale de PAR-3 par CRB3 et le complexe Par-6/aPKC (Lin et al., 2000, Joberty et al., 2000, Suzuki et al., 2001, Horikoshi et al., 2009, Hurd et al., 2003, Izumi et al., 1998). Il est à noter que ce processus d’exclusion de Baz/PAR3 nécessite le recrutement concomitant et l’activation de la GTPase Cdc42 dans le complexe Par-6/aPKC, chez la drosophile (Hutterer et al., 2004) et les mammifères (Martin-Belmonte et al., 2007, Wu et al., 2007b, Lin et al., 2000).
La coopération entre le module Par-6/aPKC et le module Crumbs joue ultérieurement un rôle fondamental dans la croissance du domaine apical et la morphogenèse des tissus épithéliaux. En effet, aPKC est capable de phosphoryler Crb, permettant ainsi en retour de stabiliser le module Crumbs au domaine apical (Sotillos et al., 2004). Cette coopération modulaire entre aPKC et Crumbs est également essentielle dans la morphogenèse des cellules photoréceptrices (Nam and Choi, 2003) et celle de la trachée de drosophile (Letizia et al., 2011).
1.3.2.2 Le module basolatéral Scribble
Le module Scribble (Scrib) constitue un régulateur central de l’identité du domaine basolatéral. Chez la drosophile, ce complexe comporte les protéines latérales Scrib, Discs-large (Dlg) et Lethal giant larvae (Lgl). Ces trois composants agissent de manière concertée puisqu’ils montrent une forte interaction génétique et que leurs localisations subcellulaires sont mutuellement dépendantes (Bilder and Perrimon,
2000). Le module Scrib est conservé à travers les espèces puisqu’il a été identifié chez l’humain un homologue de Scrib (hSCRIB1), 4 homologues de Dlg (hDlg, SAP97; Dlg2, Chapsyn-110, PSD-93 ; Dlg3, NE-Dlg, SAP102 ; Dlg4, PSD-95, SAP90) et 2 homologues de Lgl (Hugl1; Hugl2) (Assemat et al., 2008). Fonctionnellement, la perte de scrib suffit à entraîner une délocalisation des protéines apicales à la membrane basolatérale et une fragmentation des jonctions adhérentes, empêchant la mise en place des jonctions septées. Ces trois protéines contiennent de nombreux domaines d’interactions protéine-protéine qui permettent de restreindre la localisation de Crb à la membrane apicale par un mécanisme encore incompris (Bilder and Perrimon, 2000, Tanentzapf and Tepass, 2003, Bilder et al., 2003).
Bien qu’il n’existe pas d’interactions physiques caractérisées chez la drosophile entre les trois membres du module, la localisation et la fonctionnalité de la protéine Lgl dépendent de sa phosphorylation par aPKC et requiert l’exclusion de Par-6 du domaine basolatéral (Betschinger et al., 2003, Hutterer et al., 2004, Betschinger et al., 2005)(Figure 1.7). La phosphorylation de Lgl par aPKC permettrait son interaction avec Dlg chez les mammifères (Zhu et al., 2014) ce qui suggère que les mécanismes fonctionnels du module Scrib sont conservés à travers les espèces.
Figure 1.7 Coopération et antagonisme des modules de polarité dans la mise en place de la polarité épithéliale. Inspiré de (Rodriguez-Boulan and Macara, 2014). Gauche : Les protéines d’un même module se stabilisent mutuellement. De plus, le module Crumbs (bleu) permet de stabiliser le module Par-6/aPKC/Cdc42 (vert) au domaine apical et réciproquement (flèches vertes). En revanche, le module Par-6/aPKC/Cdc42 exclut du domaine apical (flèches rouges) PAR3 (jaune) et le module Scribble (violet). Droite : Résumé des structures et des interactions des différents modules de polarité épithéliale chez la drosophile et les mammifères.
1.3.2.3 Les protéines à domaine FERM
Le module Crumbs interagit également fonctionnellement avec des protéines à domaine FERM. Les protéines à domaine FERM sont des adaptateurs cytoplasmiques de protéines transmembranaires et constituent une famille aux fonctions hétérogènes, et sont notamment impliquées dans la régulation de la polarité épithéliale (Tepass, 2009).
1.3.2.3.1 La protéine Yurt
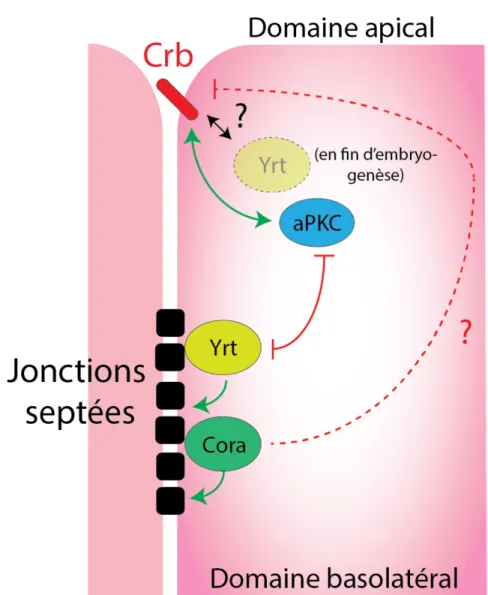
Yurt (Yrt) est une protéine cytoplasmique à domaine FERM impliquée dans la mise en place et le maintien de la polarité épithéliale (Laprise et al., 2006). En effet, Yrt s’associe à la membrane latérale et participe au maintien de l’identité basolatérale en inhibant localement l’activité de la kinase aPKC (Gamblin et al., 2014). Ainsi, les embryons mutants pour yrt montrent en milieu d’embryogenèse un phénotype similaire obtenu par une surexpression de Crb, dû à une perte d’inhibition de l’activité aPKC au domaine latéral, avec une délocalisation des protéines apicales à la membrane latérale (Laprise et al., 2006). Néanmoins, les fonctions de Yrt sur Crb en fin d’embryogenèse restent incertaines dans le contrôle de la taille du domaine apical. En effet, les embryos mutants pour yrt parviennent ensuite à ségréger à nouveau les marqueurs apicaux à la membrane apicale (Laprise et al., 2009). Dans ce cadre, Yrt s’enrichie aux jonctions septées et participe à leurs fonctionnalités mais colocalise également avec Crb dans la zone marginale au domaine apical (Figure 1.8). Chez les mammifères, les orthologues humains de Yrt, notamment Ehm2 (Expressed in high metastatic cells 2), interagissent in vitro via leurs domaines FERM avec les protéines CRB (Laprise et al., 2006) mais le rôle fonctionnel de cette interaction dans le maintien de la polarité épithéliale n’est pas déterminé.
1.3.2.3.2 La protéine Coracle
Coracle (Cora) est une protéine cytoplasmique à domaine FERM enrichie au domaine basolatéral (Fehon et al., 1994) et joue le rôle de protéine adaptatrice cytoplasmique de la Neurexine-IV (Nrx-IV) (Ward et al., 1998), une protéine
transmembranaire impliquée dans la morphogénèse des jonctions septées (Baumgartner et al., 1996). Dans ce cadre, la localisation de la Nrx-IV et de Cora sont interdépendantes et permettent d’orchestrer la formation des jonctions septées (Genova and Fehon, 2003). En plus de ses fonctions structurales, Cora est impliqué dans l’inhibition de la machinerie apicale de manière redondante avec Yrt en milieu d’embryogenèse (Laprise et al., 2009). La compréhension des fonctions de Cora en relation avec sa structure est limitée. En effet, Cora fait partie de la famille des protéines à domaine FERM, caractérisée par un domaine FERM dans sa partie N-terminale et un domaine de liaison à l’actine dans sa partie C-N-terminale. Cependant, Cora ne possède pas de domaine de liaison à l’actine, suggérant que cette protéine ne peut pas interagir avec le cytosquelette d’actine (Fehon et al., 1994). Ainsi, les mécanismes en aval de Cora permettant de soutenir l’inhibition de Crb et la formation des jonctions septées, ainsi que ses fonctions dans la morphogenèse des tissus épithéliaux ne sont pas identifiés (Figure 1.8).
Figure 1.8 : Régulation des fonctions de Crb par les protéines Yrt et Cora. Yrt et Cora participent à la fonctionnalité des jonctions septées et participent au maintien de la polarité épithéliale en inhibant de manière redondante les fonctions de Crb au domaine apical en milieu d’embryogenèse. En fin d’embryogenèse, Yrt colocalise avec Crb, mais le rôle de cette interaction sur les fonctions de Crb n’est pas déterminé. La protéine Cora se localise exclusivement aux jonctions septées et inhibe les fonctions de Crb par un mécanisme inconnu.
1.3.2.4 Le métabolisme des phosphoinositides
Le module Crumbs contrôle également le métabolisme des phosphoinositides. Les phosphoinositides sont des phospholipides impliqués dans le contrôle de nombreux processus cellulaires, notamment le trafic vésiculaire et le remodelage du cytosquelette, en participant à définir une identité membranaire (Di Paolo and De Camilli, 2006). La cellule épithéliale présente une composition lipidique membranaire asymétrique, avec notamment un domaine apical enrichi en phosphatidylinositol-4,5-bisphosphate (PIP2) et un domaine basolatéral enrichi en phosphatidylinositol-3,4,5-trisphosphate (PIP3) (Shewan et al., 2011). Fonctionnellement, la phosphorylation des phosphoinositides crée des motifs d’interactions lipide-protéine capables de recruter des protéines cytoplasmiques à la membrane. Ainsi, le maintien de l’asymétrie lipidique joue un rôle crucial dans l’identité membranaire, puisque l’introduction exogène de PIP3 à la membrane apicale suffit à initier la relocalisation de protéines basolatérales au pôle apical (Gassama-Diagne et al., 2006).
De manière intéressante, la phosphatase PTEN (Phosphatase and TENsin homolog), catalysant la formation de PIP2 à partir de PIP3, est recrutée à la membrane par Baz dans les étapes précoces de la mise en place de la polarité épithéliale et permet de limiter la quantité de PIP3 au pôle apical (von Stein et al., 2005). Ce processus est essentiel à la mise en place de l’asymétrie cellulaire puisqu’il permet d’activer en aval la GTPase Cdc42 et de stimuler l’activation du complexe Par-6/aPKC (Martin-Belmonte et al., 2007). D’autre part, la formation de PIP3 est catalysée par la phosphoinositide 3-kinase (PI3K), dont les fonctions sont promues au domaine basolatéral par l’activité de la GTPase Rac1 et Akt (Watton and Downward, 1999). Il est important de noter que l’activité Rac1 est inhibée au domaine apical par le module Crb dans l’ectoderme de drosophile, limitant ainsi la formation de PIP3 au domaine apical et permettant de ce fait d’affiner l’identité membranaire de la cellule épithéliale (Figure 1.9)(Chartier et al., 2011). Néanmoins, les mécanismes moléculaires permettant l’inhibition réciproque spatiale de Crb sur Rac1 n’ont pas été identifiés.
Figure 1.9 : Régulation réciproque du module de Crumbs par le métabolisme des phosphoinositides. Le module PI3K/Rac1 permet l’enrichissement en PIP3 (violet) de la membrane basolatérale, qui participe à raffiner l’identité du domaine basolatéral. La fonction de ce module est inhibée au domaine apical par le module Crumbs, qui participe à l’identité du domaine apical, enrichi en PIP2 (bleu).
1.4 Fonction et régulation de Crb dans la morphologie
cellulaire et tissulaire.
Nous avons vu que Crb est un acteur central dans la mise en place d’une asymétrie cellulaire, soutenue essentiellement par son domaine PBM (Wodarz et al., 1995). De plus, Crb possède un domaine FBM qui permet ensuite de garantir la formation et le maintien architectural des épithéliums. Ainsi, la modulation des fonctions de Crb devient cruciale pour la morphogenèse des tissus épithéliaux.
1.4.1 Fonction de Crb dans la morphologie cellulaire et tissulaire.
Crb permet de contrôler directement la morphologie des cellules et des tissus par l’intermédiaire de son domaine FBM. En effet, ce domaine est capable de recruter au domaine apical plusieurs régulateurs de la morphologie cellulaire, notamment des protéines à domaine FERM (Laprise et al., 2006, Medina et al., 2002, Robinson et al., 2010). Parmi elles, on retrouve d’abord les protéines de la famille ERM (Ezrin, Radizin, Moesin). Ces protéines sont des adaptateurs cytoplasmiques qui permettent de lier mécaniquement des protéines transmembranaires au cytosquelette sous-jacent. Néanmoins, les mécanismes leur permettant de modifier la morphologie épithéliale ne sont pas définis. Cependant, il a été suggéré que ces protéines permettraient de réorganiser localement le cytosquelette en modulant l’activité de GTPases (Fehon et al., 2010). Parmi les protéines de la famille ERM, la drosophile encode uniquement la Moésine (Tepass, 2009), qui coopère avec Crb dans l’organisation du cytosquelette apical (Medina et al., 2002, Letizia et al., 2011).
La coopération des protéines Crb et des protéines ERM est essentielle pour la morphogenèse des tissus épithéliaux. En effet, la perte de la Moésine chez la drosophile désorganise l’architecture des cellules photoreceptrices sans affecter de manière drastique la polarité épithéliale de ces cellules (Pellikka et al., 2002, Karagiosis and Ready, 2004) et entraîne des défauts de formation de la trachée (Letizia et al., 2011) et des glandes salivaires embryonnaires (Kerman et al., 2008). Il est intrigant de noter que la coopération fonctionnelle entre Crb et les protéines ERM
est retrouvée chez les mammifères, puisque les défauts tissulaires observés chez les souris knock-out pour Crb3 phénocopient en partie ceux de la perte de l’Ezrine (Whiteman et al., 2014). Néanmoins, la fonction exacte de la Moésine sur le cytosquelette reste énigmatique puisque la régulation de ses fonctions sur les GTPases est contextuelle. En effet, chez la drosophile, l’activité de la Moésine et celle de la GTPase RhoA sont impliquées dans une inhibition fonctionnelle réciproque (Speck et al., 2003) alors que chez les mammifères, l’activité de la GTPase RhoA promeut l’activation des protéines ERM (Matsui et al., 1999).
1.4.2 Régulation de Crb dans la morphologie cellulaire et tissulaire.
Les régulateurs moléculaires des fonctions de Crb dans la polarité épithéliale ont également des fonctions dans le maintien de la morphologie cellulaire et tissulaire.
La perte de la protéine Cora suffit à provoquer des anomalies de fermeture dorsale, de maturation des glandes salivaires et de la trachée (Lamb et al., 1998, Ward et al., 2001). Similairement, la perte de Yrt chez la drosophile produit des défauts de morphogenèse des tissus épithéliaux (Hoover and Bryant, 2002) qui peuvent être corrigés en partie dans l’ectoderme en diminuant les fonctions de Crb (Laprise et al., 2006). Chez les mammifères, la surexpression d’Ehm2, un des deux orthologues de Yrt, suffit à promouvoir l’activation de la p114RhoGEF, une GEF de RhoA recrutée aux jonctions serrées par PATJ, et à induire une constriction apicale des cellules épithéliales (Nakajima and Tanoue, 2012). De manière intéressante, CRB3 interagit avec Ehm2 (Laprise et al., 2006). Cependant, le rôle de cette interaction dans le contrôle de la morphologie cellulaire n’a pas été établi.
On retrouve également l’implication du dialogue réciproque entre le module Crumbs et l’activité Rac1 dans le contrôle de la morphogenèse des tissus épithéliaux. En effet, celui-ci permet de garantir l’intégrité structurale des cellules photoréceptrices (Chartier et al., 2012, Pinal et al., 2006) et la morphogenèse de l’amnioserosa chez la drosophile (Harden et al., 2002).
1.4.3 Modulation de la fonction de Crb dans la morphogenèse des tissus épithéliaux.
Les protéines de polarité épithéliale assurent la fonction et le maintien de l’architecture du tissu épithélial. Néanmoins, dans certaines étapes du développement, comme pendant la gastrulation, ou la réparation des tissus adultes, les cellules épithéliales doivent perdre de manière transitoire leurs caractéristiques épithéliales, pour assurer leurs migrations dans un autre compartiment anatomique de l’organisme. Dans ce cadre, la cellule épithéliale polarisée peut physiologiquement réprimer l’activité de ses modules de polarité épithéliale en réponse à l’activation de programmes développementaux (Figure 1.10). Ainsi, des défauts de contrôle de ce processus sont à l’origine de pathologies chez l’Homme, notamment le cancer.
Figure 1.10 : Le programme de polarité épithéliale limite les propriétés invasives des cellules épithéliales. La polarité épithéliale assure le maintien de l’architecture cellulaire et inhibe la migration et la prolifération des cellules épithéliales. La perte des caractéristiques épithéliales s’accompagne d’une augmentation des capacités invasives des cellules épithéliales. Dans certains cancers, ce processus est détourné par les cellules tumorales pour promouvoir leurs agressivités.
1.4.3.1 Modulation transcriptionnelle des fonctions de Crb
Il existe un lien étroit entre la régulation transcriptionnelle des modules de polarité épithéliale et la morphogenèse des tissus épithéliaux. En effet, de la drosophile à l’humain, pendant la gastrulation, un programme développemental déclenche une transition épithélio-mésenchymateuse (EMT) des cellules épithéliales
dans une région contrôlée de l’embryon. Ce processus modifie la morphologie et le « comportement épithélial » de ces cellules et permet d’aboutir à l’établissement des trois feuillets embryonnaires (El-Mallawany et al., 2012). Ce mécanisme repose sur un ensemble de facteurs de transcription conservés à travers les espèces, notamment Snail (Alberga et al., 1991, Carver et al., 2001). Chez les mammifères, Snail réprime notamment la transcription du gène CRB3, qui engendre en retour une perte de la morphologie épithéliale (Whiteman et al., 2008).
L’étude de la modulation transcriptionnelle des protéines de polarité est particulièrement importante pour la santé humaine. En effet, l’expression des protéines de polarité est souvent dérégulée dans les cancers, un phénomène qui peut être attribué à une activation ectopique de l’EMT (Moreno-Bueno et al., 2008). De plus, la progression tumorale s’associe à une perte des caractéristiques épithéliales et à une augmentation des propriétés invasives et métastatiques des cellules (Wodarz and Komarova, 2007). Ainsi, certaines cellules tumorales régulent négativement l’activité des promoteurs de gènes de la E-cadhérine, CRB3 et PATJ (Aigner et al., 2007) et la réintroduction de l’expression de ces acteurs clé de la polarité épithéliale, notamment CRB3 (Karp et al., 2008), est capable de limiter les propriétés mésenchymateuses acquises par les cellules tumorales (Whiteman et al., 2008). Ainsi, le module Crb joue un rôle décisif dans le maintien de l’homéostasie des épithéliaux en limitant l’EMT. C’est pourquoi, la caractérisation des sentiers signalétiques en aval du module Crb dans le contrôle de la morphogenèse des tissus est cruciale dans la compréhension des processus cellulaires épithéliaux dérégulés dans les carcinomes.
1.4.3.2 Modulation contextuelle des fonctions de Crb
Plusieurs régulateurs de la polarité épithéliale sont des suppresseurs de tumeurs et sont étroitement liés à la régulation de voies contrôlant la prolifération et la croissance cellulaire, telles que JNK ou Hippo (Bunker et al., 2015). Ainsi, des défauts de la polarisation apicobasale peuvent s’associer à une modulation des sentiers de différenciation ou d’apoptose (Andersen et al., 2015). Les protéines Crumbs sont directement en amont de plusieurs voies de signalisation impliquées dans le développement et le renouvèlement des tissus adultes, notamment Notch et
Hippo (Herranz et al., 2006, Chen et al., 2010, Ling et al., 2010, Robinson et al., 2010, Richardson and Pichaud, 2010). De manière surprenante, bien que le domaine extracellulaire de Crb ne semble pas avoir de fonction dans le maintien de la polarité épithéliale, il pourrait jouer un rôle décisif dans la morphogenèse des tissus épithéliaux. En effet, chez la drosophile, le contrôle de la voie Notch nécessite le domaine extracellulaire de Crb pour réguler la croissance et l’organisation des tissus épithéliaux en prolifération (Herranz et al., 2006), une fonction qui semble conservée pour l’orthologue humain CRB2 (Mitsuishi et al., 2010). D’autre part, Crb est également en amont de la voie Hippo (Grzeschik et al., 2010), une voie de signalisation anti-proliférative régulée par la densité cellulaire (Gumbiner and Kim, 2014), une fonction qui semble remplie par CRB3A chez les mammifères (Varelas et al., 2010).
Ces observations ont proposé l’existence d’un mécanisme sensitif membranaire permettant de limiter la prolifération des cellules épithéliales polarisées. Il a notamment été suggéré que la protéine Crb, correctement localisée au domaine apical par le programme de polarité épithéliale, pourrait transduire un signal de densité cellulaire par l’intermédiaire de son domaine extracellulaire. En effet, chez la drosophile, Crb est capable de s’enrichir sur les bordures membranaires riches en Crb (Hafezi et al., 2012, Roper, 2012). Cette localisation hétérogène requiert le domaine extracellulaire de Crb (Letizia et al., 2013) et semble jouer un rôle crucial dans la morphologie des cellules photoréceptrices de la drosophile (Pellikka et al., 2002) et pourrait prévenir leurs dégénérescences (Johnson et al., 2002). Ainsi, Crb pourrait être impliquée dans une interaction homotypique contrôlant la morphogenèse des tissus épithéliaux (Figure 1.11).
Chez les vertébrés, le domaine extracellulaire des protéines CRB pourrait également jouer un rôle fondamental dans le contrôle de leurs fonctions. En effet, les isoformes crb2 et crb3 sont impliqués dans une interaction homotypique chez le poisson-zèbre (Zou et al., 2012). Néanmoins, aucune interaction homotypique des protéines CRB n’a encore été mis en évidence chez les mammifères. En effet, le domaine extracellulaire de CRB3A est très court et n’est pas conservé à travers les espèces
(Makarova et al., 2003). Ainsi, aucun domaine fonctionnel n’a pu être caractérisé sur la portion extracellulaire de CRB3A sauf un site de N-glycosylation dont la fonction reste encore indéterminée (Makarova et al., 2003).
Figure 1.11 : Régulation de la fonction des protéines Crb par interaction homotypique. Les domaines extracellulaires des protéines Crb pourraient interagir de manière homotypique au domaine apical pour réguler la prolifération cellulaire et participer à la morphogenèse des tissus épithéliaux.
1.5 Un modèle de morphogenèse des tubules
épithéliaux, le développement de la trachée
embryonnaire de drosophile
L’intrication des signalisations des modules de polarité épithéliale permet une régulation fine de leurs activités respectives et permet de moduler la morphologie épithéliale pendant le développement. Les tissus épithéliaux sont capables de bâtir des structures tridimensionnelles en forme de tubes (ex : tubules rénaux, bronchioles pulmonaires, duodénum) dont les paramètres morphométriques (ex : longueur, diamètre) doivent être contrôlés pour assurer leurs fonctions. Cependant, la compréhension des mécanismes cellulaires permettant de définir ces paramètres tissulaires reste peu étendue.
Chez les vertébrés, l’analyse de ces phénomènes tissulaires est complexe. En effet, leurs génomes comportent de nombreuses duplications de gènes, nécessitant d’évaluer la contribution de chaque paralogue dans la morphogenèse d’un tissu. C’est pourquoi, l’utilisation d’un modèle génétique simple comme la drosophile est justifiée. En effet, nous avons vu que la structure et la fonction de ces acteurs sont conservées à travers les espèces, et que le développement des épithéliums de la drosophile et de l’humain partage de nombreux processus communs. Parmi eux, l’embryon de drosophile forme des architectures épithéliales complexes, notamment des tubes épithéliaux, dont les paramètres morphologiques doivent être contrôlés pour assurer leurs fonctionnalités. Dans cette section, je présenterais le modèle de la trachée embryonnaire de la drosophile et les mécanismes liés à sa morphogenèse, dont la compréhension est importante pour le projet présenté dans les chapitres 2 et 3 de ce manuscrit.
1.5.1 Généralités sur le modèle de la drosophile
La drosophile est un diptère à métamorphose complète qui se distingue par un stade larvaire et un stade pupe. Le cycle de vie de la drosophile est dépendant de la température et dure environ 3 semaines à 18˚C et 10 jours à 25˚C. La drosophile