© Myriam Ladrie, 2021
Étude de la diversité des levures du genre
Brettanomyces et de leur potentiel en fermentation
brassicole
Mémoire
Myriam Ladrie
Maîtrise en sciences des aliments - avec mémoire
Maître ès sciences (M. Sc.)
ii
Résumé
Les levures du genre Brettanomyces sont considérées depuis longtemps comme des contaminants par les industries vinicoles et brassicoles dû aux composés phénoliques indésirables qu’elles produisent. Cependant, l’utilisation des espèces B. bruxellensis et B. anomalus en brasserie est maintenant plus répandue grâce à leur capacité à diversifier les composés aromatiques produits par la traditionnelle levure Saccharomyces cerevisiae. Malgré cette émergence dans le domaine brassicole, peu d’informations sont disponibles en ce qui concerne la diversité génétique des souches et leur potentiel en fermentation. À notre connaissance, aucune méthode permettant de caractériser, d’identifier rapidement les souches de Brettanomyces spp. et pouvant facilement être mise en place dans un contexte industriel est présentement disponible.
L’objectif de l’étude était donc de développer une nouvelle méthode rapide et fiable pour le typage moléculaire des levures Brettanomyces spp. dans l’optique de différencier les espèces et les souches, ainsi que de prédire leur potentiel brassicole. À cet effet, la méthode de typage génétique Random Amplification of Microsatellites (RAM)-PCR utilisant l’amorce (CGA)5
a été développée et validée avec la méthode Restriction Endonuclease Analysis-Pulsed-Field Gel Electrophoresis (REA-PFGE) sur vingt-deux (22) souches de Brettanomyces spp., une (1) souche de Pichia kluyveri, une (1) souche de Candida parapsilosis, une (1) souche de Schizosaccharomyces pombe et une (1) souche de Saccharomyces cerevisiae, toutes isolées de bières, ferments commerciaux, vin rouge, levain et kombucha. Des essais de fermentation primaire ont révélé que les souches ayant un bon potentiel brassicole se trouvent dans les mêmes groupes phylogénétiques générés avec la méthode RAM-PCR et l’amorce (CGA)5. Le projet a donc permis de fournir un outil efficace pour les brasseurs et les
fournisseurs de levures pour l’identification rapide des espèces, des souches et du potentiel brassicole de levures Brettanomyces spp. provenant de différents substrats, sans avoir à faire appel aux techniques de séquençage et d’essais de fermentation qui sont plus coûteux ou qui demandent plus de temps à réaliser.
iii
Abstract
The yeasts of the genus Brettanomyces are often considered as a major contaminant in the wine and beer industries because of their production of phenolic off-flavors. Recently, few species of this genus, especially B. bruxellensis and B. anomalus, have been used in beers to enlarge the pool of aromatic compounds produced by the traditional Saccharomyces cerevisiae starter used for decades in breweries. The characterization of Brettanomyces species is therefore crucial to identify the strains showing interesting technological traits. However, to our knowledge, no fast method is currently available to evaluate the genetic diversity of the genus Brettanomyces which can be easily adapted in an industrial context. The aim of this study was to develop and optimize a new, fast and reliable typing method used for the species and strains differentiation of Brettanomyces spp. isolates and for the prediction of their brewing potential. Twenty-two (22) strains of Brettanomyces, one (1) Pichia kluyveri, one (1) Candida parapsilosis, one (1) Schizosaccharomyces pombe and one (1) Saccharomyces cerevisiae were isolated from beer, red wine, kombucha, sourdough, chicha and commercial starters and used for the development of a method based on the Random Amplification of Microsatellites (RAM)-PCR technique with (CGA)5 primer. This
method was validated with the already existent and reliable Restriction Endonuclease Analysis coupled with Pulsed-Field Gel Electrophoresis (REA-PFGE) method. Further fermentation assays revealed that potential brewing isolates were clustered in the same phylogenetic group generated with RAM-PCR electrophoretic profiles. The study allowed the development of a useful tool for brewers and yeast suppliers for the identification at the species and strains levels and the brewing potential of various Brettanomyces spp. isolates, without the need for sequencing and laborious fermentation assays.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vii
Liste des tableaux ... viii
Liste des abréviations ... ix
Remerciements ... x
Avant-propos ... xi
Introduction ... 1
Chapitre 1 : Revue de littérature ... 4
1.1 La bière ... 4
1.1.1 L’industrie brassicole ... 4
1.1.2 Les matières premières ... 4
1.1.2.1 L’eau et son contenu en minéraux ... 4
1.1.2.2 Le malt ... 5
1.1.2.3 Le houblon... 8
1.1.2.4 Les levures... 12
1.1.3 Le procédé de fabrication de la bière ... 14
1.1.3.1 Les méthodes de fabrication ancestrales ... 14
1.1.3.2 Les méthodes modernes ... 15
1.1.3.2.1 L’empâtage ... 15
1.1.3.2.2 L’ébullition ... 17
1.1.4 La fermentation alcoolique ... 17
1.1.4.1 La fermentation pure ... 18
1.1.4.2 Les fermentations mixtes ... 19
1.1.4.2.1 Les fermentations mixtes inoculées ... 19
1.1.4.2.2 Les fermentations mixtes non-inoculées ... 20
1.2 Les levures du genre Brettanomyces. ... 21
1.2.1 La taxinomie des levures du genre Brettanomyces. ... 22
v
1.2.3 Les caractéristiques de la levure Brettanomyces spp. en fermentation brassicole 25
1.2.3.1 La production de composés aromatiques ... 25
1.2.3.2 Les conditions optimales de croissance de la levure Brettanomyces spp. ... 27
1.2.4 La diversité génétique chez les levures Brettanomyces spp. ... 28
1.3 Méthodes de caractérisation génétique des levures ... 31
1.3.1 Les méthodes basées sur le séquençage d’ADN ... 31
1.3.1.1 Le séquençage de la région ITS de l’ADNr ... 32
1.3.1.2 Le séquençage du génome complet ... 33
1.3.2 Les méthodes de typage moléculaire ... 33
1.3.2.1 Les méthodes basées sur l’amplification PCR ... 34
1.3.2.2 L’analyse de restriction par endonucléase couplée à une électrophorèse en champs pulsés 36 Chapitre 2 : Problématique, hypothèse de recherche et objectifs ... 39
2.1. Problématique ... 39
2.2. Hypothèse de recherche ... 40
2.3. Objectifs ... 40
Chapitre 3 : Caractérisation génétique et phénotypique de souches de levures du genre Brettanomyces sp. ... 41
3.1 Résumé ... 41
3.2 Abstract ... 43
3.3 Introduction ... 44
3.4 Material and methods ... 46
3.4.1 Molecular typing analysis ... 46
3.4.1.1 Isolation of strains and culture conditions ... 46
3.4.1.2 DNA isolation and molecular identification ... 47
3.4.1.3 Restriction Endonuclease Analysis with Pulse Field Gel Electrophoresis (REA-PFGE) ... 48
3.4.1.4 RAM and RAPD-PCR amplification ... 48
3.4.1.5 Image analysis and reproducibility... 49
3.4.2 Pilot-scale beer production ... 50
3.4.2.1 Yeast propagation ... 50
3.4.2.2 Brettanomyces sp. pure culture fermentations screening ... 50
3.4.2.3 Brettanomyces sp. pure culture fermentations ... 51
3.5 Results and discussion ... 52
vi
3.5.2 REA-PFGE assay ... 55
3.5.3 RAM- and RAPD-PCR assays ... 57
3.5.4 Screening of the strains for their brewing potential ... 60
3.5.5 Pilot-scale fermentation ... 62
3.6 Conclusion ... 65
Chapitre 4 : Discussion générale ... 66
4.1 Méthode de caractérisation génétique ... 67
4.2 Méthode de caractérisation phénotypique ... 69
Conclusion et perspectives ... 72
vii
Liste des figures
Figure 1. Représentation d’épillet d’orge à (a) six rangs et (b) deux rangs. ... 6
Figure 2. Structure d’un grain d’orge.. ... 7
Figure 3. Réaction d’isomérisation des acides alphas. ... 10
Figure 4. Représentation des trois groupes formant les huiles essentielles présentes dans le houblon. ... 11
Figure 5. Représentation simplifiée de la structure d’une cellule de levure de bière. ... 12
Figure 6. Représentation des reproductions sexuée et asexuée chez les ascomycètes. ... 13
Figure 7. Métabolisme énergétique des levures. ... 14
Figure 8. Intervalles de température et pH favorisant l’action de différentes enzymes durant l’étape d’empâtage pour la fabrication de bière. ... 16
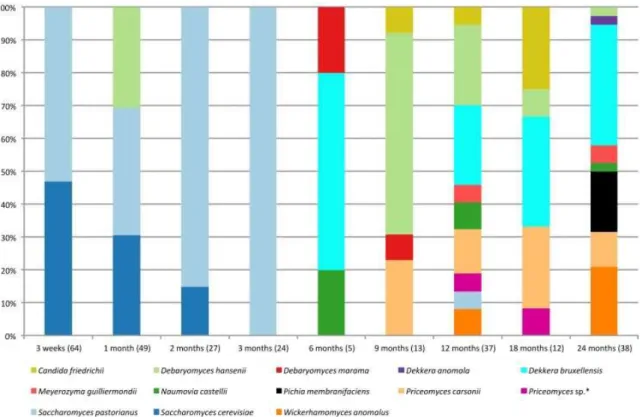
Figure 9. Identification des levures isolées de brassins aléatoires de bières issues de fermentations spontanées traditionnelles. ... 21
Figure 10. L’effet Custers chez Brettanomyces bruxellensis.. ... 24
Figure 11. Représentation de la diversité génétique au sein de l’espèce Brettanomyces bruxellensis provenant de différentes niches écologiques. ... 29
Figure 12. Dendrogramme généré avec 1488 isolats de Brettanomyces bruxellensis provenant de différentes niches écologiques et leur différent niveau de ploïdie... 30
Figure 13. Gène de l’ADNr chez les organismes eucaryotes. ... 32
Figure 14. Profils génétiques de 18 souches de Geotrichum candidum générés par RAM-PCR utilisant l’amorce (GATA)4. ... 36
Figure 15. Schématisation des principales étapes des méthodes fréquemment utilisées pour le typage d’isolats de mycètes. ... 37
Figure 16. Dendrogram showing cluster analysis on profiles of the isolates generated by REA-PFGE with NotI endonuclease. ... 56
Figure 17. Dendrogram showing cluster analysis on profiles of the isolates generated by RAM-PCR with (CGA)5 primer. ... 59
Figure 18. Fermentation curves of small-scale industrial fermentation at 22 °C for LMA-1467, LMA-1470, LMA-1476 and LMA-1477 isolates... 64
viii
Liste des tableaux
Table 1. Yeast isolates from different ecological niche isolated in the study... 53
Table 2. Comparison of ITS region sequences of Brettanomyces anomalus and Brettanomyces bruxellensis groups formed by isolates presenting identical ITS sequences. ... 54
Table 3. Yeast isolates used in the screening fermentation test, their group affiliation for the REA-PFGE, (CGA)5-RAM-PCR and ITS sequence methods and their apparent attenuation
ix
Liste des abréviations
ADN Acide désoxyribonucléique
ADNr Acide désoxyribonucléique ribosomique APY 2-acétylpyrroline
ARN Acide ribonucléique ATHP 2-acétyltétrahydropyridine ATP Adénosine triphosphate
CNV Variations du nombre de copies (Copy Number Variations) DMS Sulfure de diméthyle (Dimethyl sulfide)
ETHP 2-éthyltétrahydropyridine
ITS Espaceurs internes transcrits (Internal transcribed spacers) LMA Laboratoire de mycologie alimentaire
MLST Typage de séquence multilocus (Multilocus sequence typing) PCR Réaction en chaîne de la polymérase (Polymerase chain reaction) PFGE Électrophorèse en champs électrique pulsé (Pulsed-field gel
electrophoresis) pH Potentiel hydrogène PIB Produit intérieur brut ppm Partie par million
RAM Amplification aléatoire des microsatellites (Random amplification of microsatellites)
REA Analyse de restriction par endonucléase (Restriction endonuclease analysis)
SNP Polymorphisme nucléotidique (Single nucleotide polymorphism) VNC Viable, mais non cultivable (viable but nonculturable)
x
Remerciements
Avant d’aller plus loin, je dois dédier mes premiers remerciements à mon directeur de maîtrise, Monsieur Steve Labrie. Merci d’avoir été si enthousiaste envers le projet dès le début et de m’avoir accueillie et guidée dans un monde qui m’a sortie de mes bottines. Tes précieux conseils teintés d’expérience et de compréhension, tes encouragements et ton approche calme et humaine ont su m’apaiser et me motiver à maintes reprises.
Je tiens également à adresser ma reconnaissance et mes sincères remerciements au Labo – Solutions Brassicoles, partenaire industriel, sans qui le projet n’aurait tout simplement pas vu le jour. Merci Louis-Philippe Simard pour ta détermination, ta passion contagieuse, tes encouragements et pour toutes les connaissances que tu m’as transmises. Merci également à Gérald Bourdaudhui, tes réflexions, ta patience et ton expérience m’ont beaucoup aiguillée tout au long du projet. Par la même occasion, je souhaite remercier toute l’équipe du Labo pour votre aide dans les manipulations et de former, tout simplement, une équipe de feu. Merci Séraphine, Maxime, Émilie, Ari, Rémi et Samuel.
Je ne pourrais oublier de remercier Marie-Hélène Lessard, professionnelle de recherche du Laboratoire de Mycologie Alimentaire, pour ta rigueur, ta bonne humeur, tes corrections et, évidemment, ton aide si précieuse. Un gros merci à la charmante équipe du LMA; Vincent, Gabrielle, Annick, Vincent, Antony et Thomas pour tous les moments bien agréables. Je tiens également à remercier le Centre de développement bioalimentaire du Québec (CDBQ) pour les équipements, les locaux et le support technique. Je dois également souligner la contribution des organismes subventionnaires tels que le CRSNG et Mitacs sans lesquels le projet de maitrise industrielle n’aurait pas pu être possible.
Il m’est impératif de finalement remercier ma famille. Merci à mes parents, Annie et Jacques, et mon frère, Martin, d’avoir toujours été les parents et le frère que vous êtes et de m’appuyer comme vous le faites si bien.
Un dernier merci tout spécial à mon amoureux, Anthony, pour avoir mis la main à la pâte, quelques fois par de beaux samedis après-midi, pour ton accompagnement dans mes nombreux allers-retours à La Pocatière et, par-dessus tout, pour ton support et ta relativité.
xi
Avant-propos
Ce mémoire présente les résultats d’un projet de maitrise industriel et se décline en cinq principaux chapitres. Suite à l’introduction qui met en lumière le contexte menant à la problématique se trouve le Chapitre 1 qui se veut une revue de la littérature en lien avec le projet. La fabrication brassicole y est traitée ainsi que les connaissances actuelles sur les levures du genre Brettanomyces et leur place au sein de l’industrie brassicole. Une partie de cette revue de littérature est dédiée à la diversité génétique des levures Brettanomyces spp. et aux méthodes de caractérisation génétique permettant de typer ces dernières. Ensuite, le Chapitre 2 exprime la problématique à laquelle le projet veut répondre ainsi que l’hypothèse et les objectifs qui, quant à eux, permettront d’y répondre.
Le Chapitre 3 est présenté sous forme d’article scientifique qui sera soumis pour une publication dans la revue de la MBAA (Master Brewers Association of Americas). Conformément aux règles de la revue, l’article est rédigé en anglais. Cet article représente le corps des résultats obtenus dans le cadre de la maitrise. À titre d’auteure principale de l’article j’ai élaboré les protocoles expérimentaux, réalisé l’ensemble de ces derniers et rédigé la majorité de l’article et du mémoire. Dr Steve Labrie est un coauteur dont la contribution a été au niveau des démarches pour l’obtention des subventions pour la recherche ainsi qu’à la participation à l’écriture de l’article et du mémoire et de la supervision des travaux. Dre Marie-Hélène Lessard a aussi encadré les travaux expérimentaux et aidé à la rédaction au niveau universitaire.
Du côté industriel, Louis-Philippe Simard a contribué au projet en supervisant les travaux effectués dans les murs de l’industrie et Gérald Bourdaudhui était présent à titre de référence dans le domaine scientifique brassicole. Tous deux ont également participé à la révision des textes. Louis-Philippe et Gérald sont parmi les propriétaires du Labo – Solutions Brassicoles, partenaire industriel du projet.
Le Dr Charles Lavigne, directeur du Centre de développement bioalimentaire du Québec (CDBQ), a permis l’accès aux locaux et au personnel qualifié pour le bon déroulement des brassins expérimentaux.
xii
Le Chapitre 4 du mémoire est une discussion générale dans laquelle y sont abordés les avantages et les limites des méthodes utilisées et développées ainsi que l’apport de ce projet dans le monde brassicole. Finalement, le Chapitre 5 se veut une conclusion du projet et soulève les perspectives que ce dernier a engendrées.
Une partie des résultats du projet a été présentée sous forme d’affiche scientifique dont le titre était «Molecular typing of Brettanomyces brewing yeasts using RAM-PCR and REA-PFGE» dans le cadre du congrès de la MBAA qui a eu lieu à Calgary du 31 octobre au 2 novembre 2019.
1
Introduction
Monopolisant le tiers des parts de marché de la bière au Canada, l’industrie brassicole québécoise génère au niveau provincial 14 % du PIB de la fabrication des aliments, et ce, de 2007 à 2012. Il va sans dire que le secteur de la transformation et de la commercialisation brassicole est un pilier économique très important au Québec, autant au niveau local, provincial que fédéral. Dénombrant à ce jour près de 260 microbrasseries au Québec, dont 30 % d’entre elles s’étant établies dans des villes de moins de 10 000 habitants, cette industrie permet de faire revivre les régions [8]. De plus, elle a trois fois plus d’incidence sur l’économie que les industries du vin et des spiritueux confondues [39]. À cet effet, la bière se classe au premier rang des boissons alcoolisées les plus consommées [39].
Considérant l’importance à la fois quantitative et qualitative de ce secteur encore en expansion, il devient de plus en plus difficile pour les producteurs de bière, les brasseurs, de se démarquer face à l’éventail de choix qui s’offrent aux consommateurs, d’autant plus que ces derniers sont de plus en plus connaisseurs. Afin de produire des bières de qualité, les brasseurs doivent d’abord maîtriser leurs procédés de production et s’approvisionner en matières premières de qualité (l’eau, le malt, le houblon et les levures). Toutefois, pour faire sa place parmi les microbrasseries de renom, il importe d’être innovateur, voire avant-gardiste. Plusieurs approches sont envisageables afin d’obtenir une bière dont les caractéristiques organoleptiques se démarquent. Les brasseurs peuvent modifier le procédé de fabrication, ajouter ou changer divers ingrédients au mélange, comme des levures. Les levures sont responsables de la production de nombreux composés conférant à la bière son caractère unique [75, 164]. Elles permettent la transformation des sucres contenus dans le mout en alcool et en gaz carbonique pendant la fermentation [4]. Elles sont donc nécessaires à la transformation du mout en bière, mais sont aussi importantes dans le développement des saveurs dans la bière [167].
Traditionnellement, les levures du genre Saccharomyces sp. sont les plus couramment utilisées en fermentation brassicole, étant donné leur métabolisme permettant la production d’éthanol et de composés aromatiques désirables, ainsi que leur tolérance au stress et à l’éthanol [50]. L’utilisation de ferments sauvages, c’est-à-dire de ferments qui n’ont pas été
2
domestiqués, telles que les levures du genre Brettanomyces sp., afin de produire des bières dites de spécialité, est alors une opportunité de créer des produits distinctifs [1]. Cette levure est considérée comme nuisible en production vinicole, car elle produit des composés aromatiques tels que le 4-éthylphénol, le 4-éthyl-gaïacol et de l’acide isovalérique, qui sont caractérisés par des arômes phénoliques, de basse-cour et de cheval [156]. Dans le monde brassicole, ces composés s’avèrent parfois désirables, spécialement dans le cas des bières Lambic, où les fermentations spontanées sont favorisées. Ces bières, étant traditionnellement refroidies dans un bac large et peu profond, sont inoculées naturellement par les microorganismes de l’environnement [121], puis sont transférées en barriques de chênes pour la fermentation [83]. Une succession d’espèces microbiennes s’établit, où les Brettanomyces sp. deviennent majoritairement dominantes après le sixième mois de fermentation [83].
La méthode moderne d’utilisation des Brettanomyces sp. en brasserie consiste à inoculer le mout avec une culture pure de cette levure afin d’en faire une fermentation 100 % Brettanomyces sp. (fermentation primaire) ou à ensemencer avec une culture de Brettanomyces sp. un mout préalablement fermenté par d’autres microorganismes, notamment par Saccharomyces cerevisiae (affinage) [164]. Les bières résultantes des deux types de procédés présentent de caractéristiques sensorielles différentes. La fermentation primaire amène des arômes fruités d’esters, alors que l’affinage favorise davantage la production d’arômes médicinaux, chevalins, de ferme, de clou de girofle [179]. Donc, dans le monde des bières de spécialités, les Brettanomyces sp. peuvent être désirables dans certains cas dû à leur fort potentiel brassicole.
Malgré l’émergence de l’utilisation des levures Brettanomyces sp. dans le domaine brassicole, peu d’informations sont disponibles quant à la diversité des souches et au potentiel des différentes espèces en fermentation primaire. En fait, les connaissances sur la fermentation de ces levures en culture pure sont majoritairement anecdotiques bien que ce soit la méthode de fermentation la plus utilisée pour produire de la bière avec les levures du genre Saccharomyces [153]. Les caractéristiques organoleptiques obtenues lors de la fermentation étant l’élément qui définit la qualité du produit fini, il est essentiel de distinguer
3
les différentes caractéristiques biochimiques des souches et des espèces de levures en fermentation primaire 100 % Brettanomyces sp.
Ce projet propose donc d’étudier la diversité des levures du genre Brettanomyces sp. isolées de différentes niches écologiques (bière, levain, kombucha, vin) par typage génétique et par leur classification phylogénétique. Ces techniques d’analyse génétique, réalisées parallèlement à des essais de fermentation, permettront de classifier les isolats de Brettanomyces sp. selon leur potentiel brassicole en plus de permettre d’associer des caractéristiques sensorielles spécifiques à chaque groupe de souches identifié. Ces résultats permettront de développer des outils génétiques pour la sélection et la classification des isolats de Brettanomyces sp. et ainsi d’optimiser leur utilisation dans l’industrie brassicole.
4
Chapitre 1 : Revue de littérature
1.1 La bière
1.1.1 L’industrie brassicole
Depuis la période Néolithique, la production brassicole fait partie des traditions chez l’humain. Au niveau de la santé publique, la bière fut longtemps un breuvage nécessaire au peuple canadien dû à sa faible concentration en microorganismes pathogènes en comparaison à ce que pouvaient contenir l’eau et le lait de l’époque coloniale [79]. La bière s’est ancrée dans les coutumes de la majorité des peuples et s’inscrit dans les dimensions sociale, culinaire, scientifique, mais aussi économique, politique et historique de ces peuples. Le Québec actuel, où la bière est un pilier économique très important, ne fait pas exception à ce constat. En fait, l’industrie brassicole québécoise est une industrie florissante en pleine expansion. En 2020, le nombre de brasseries québécoises est au nombre de 272, ce qui est près de huit fois plus élevé que le nombre de brasseries recensées en 2002 [8]. L’industrie brassicole québécoise représente plus du tiers de l’industrie brassicole canadienne et il y a encore de la place sur le marché pour les microbrasseries. Depuis 2000, les parts de marché des microbrasseries, c’est-à-dire les ventes sur tablettes, dans les bars et dans les restaurants, sont passées de 1 % à 11 %. On suppose que ces données sont encore sujettes à augmenter à 20-30 %, si on se fie à ce qui se passe ailleurs [94].
1.1.2 Les matières premières
1.1.2.1 L’eau et son contenu en minérauxLa matière première retrouvée en plus grande quantité dans le processus de production de la bière est l’eau. Représentant entre 90 et 94 % du contenu d’une bière [46], l’eau a une incidence directe sur les qualités organoleptiques finales de celle-ci. La présence d’ions dans l’eau a une influence sur le pH qui régit en grande partie les réactions enzymatiques durant l’empâtage et qui affecte les composés responsables des flaveurs ainsi que la perception des
5
flaveurs elles-mêmes [171]. En fait, les ions particulièrement d’intérêt sont le calcium (Ca2+),
le magnésium (Mg2+), le sodium (Na+), le bicarbonate (HCO
3–), le sulfate (SO42–) et le
chlorure (Cl–) [171].
D’une part, la dureté de l’eau, principalement attribuable à l’ion calcium et, en moindre mesure, l’ion magnésium, permet la dégradation des glucides en abaissant le pH lors de l’empâtage dans le but de le rendre favorable à l’activité des enzymes d’intérêt [171]. De son côté, le calcium favorise la floculation des levures et, ainsi, la clarification de la bière durant la maturation [46]. Ces ions sont également d’importants nutriments pour les levures, étant essentiels à leur métabolisme, ce qui contribue à une fermentation viable [170]. Cependant, la présence de l’ion calcium en concentration trop importante peut empêcher l’assimilation du magnésium par les levures nuisant ainsi à leur métabolisme [170, 171]. Généralement, il n’est pas recommandé d’ajouter des sels de magnésium à l’eau puisqu’en trop grande concentration, l’ion magnésium confère une amertume indésirable [95].
Du côté des anions, les ions carbonates et bicarbonates sont directement responsables de l’alcalinité de l’eau et de l’empâtage [68]. Sachant que l’ion calcium est responsable de l’acidification de l’eau par la réaction illustrée en 1.1, il importe donc de doser les ions calcium, carbonate et bicarbonate afin d’atteindre le pH cible (entre 5,1 et 5,5) pour l’empâtage. Pour ce faire, l’ajout de sels tels que le chlorure de calcium (CaCl2) et le
carbonate de calcium (CaCO3) doivent être ajoutés de manière calculée en fonction de leur
masse molaire et de la quantité finale désirée [68].
3Ca
2++ 2HPO
42-
2H
++ Ca
3(PO
4)
2(1.1)
1.1.2.2 Le malt
Le second ingrédient en termes de quantité dans la fabrication de la bière est le malt. En fait, le malt est obtenu par la transformation de grain d’orge durant un procédé se nommant le maltage. Il est important de mentionner qu’il est possible de malter d’autres céréales telles que le blé, l’avoine, le millet, le seigle, le sorgho et le triticale, mais il n’en demeure pas
6
moins que la céréale la plus utilisée au niveau du maltage est l’orge [45, 76, 129]. Afin de simplifier le texte, les mentions ultérieures de malt désigneront le malt d’orge.
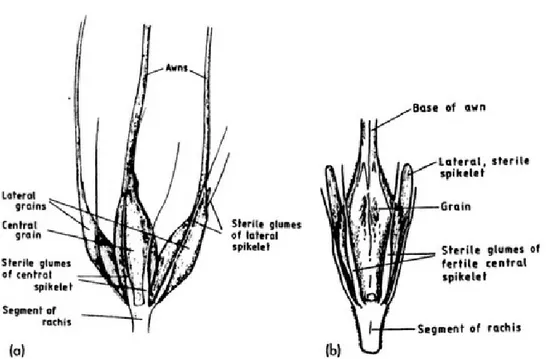
Il existe deux types d’orge utilisés en brasserie, soient l’orge à deux rangs et l’orge à six rangs. À première vue, l’orge à deux rangs se distingue par la présence de deux rangées de grains sur la longueur de l’épi, alors que l’orge à six rangs en compte plutôt six qui sont divisés en deux groupes (Fig. 1). Bien que cette différence soit la plus évidente, ces deux types d’orge diffèrent en beaucoup d’autres points qui sont d’autant plus importants au niveau brassicole. À cet effet, l’orge à deux rangs offre aux producteurs des grains dont la taille est plus uniforme et généralement plus grosse [76]. Il en résulte des grains contenant davantage de carbohydrates, essentiellement de l’amidon, une molécule primordiale pour la fabrication de bière [23]. Néanmoins, l’orge à six rangs (aussi nommé escourgeon), quant à lui, contient davantage de protéines et d’enzymes, ce qui le rend intéressant dans le cas de brassins contenant des céréales non-maltées. Ces dernières sont pauvres en enzymes nécessaires à la production de bière, puisque l’étape de maltage permet de libérer les enzymes des céréales crues [76].
Figure 1. Représentation d’épillet d’orge à (a) six rangs et (b) deux rangs. Figure tirée intégralement de Briggs (1998) [23].
7
Le maltage en soi consiste en une germination contrôlée et limitée de l’orge. Le but est d’induire la germination de l’embryon afin de rendre l’amidon et les nutriments contenus dans l’endosperme plus accessibles, de même que les enzymes contenues dans la couche d’aleurone [23, 47]. En fait, l’endosperme constitue la réserve de nutriments et d’hydrates de carbone du grain, le tout sous forme de grains d’amidon séparés dans un ciment protéique (Fig. 2). Afin de permettre à l’embryon de se développer en utilisant les réserves du grain, la couche d’aleurone sert à la synthèse des enzymes permettant l’assimilation des réserves par l’embryon [47]. Ceci étant dit, le processus de maltage consiste donc à induire la germination par le contrôle de la température et de l’humidité à 45 % suite au trempage des grains afin de provoquer une partie de la dégradation de l’amidon en sucres plus simples et des protéines en acides aminés par l’action des enzymes [23]. Lorsque l’amidon est suffisamment désagrégé, les grains sont alors séchés en dessous de 5 % d’humidité en faisant passer de l’air chaud et sec au travers les grains, une étape nommée fanage [23]. Cette étape permet d’arrêter les réactions enzymatiques qui provoqueraient une dégradation trop importante de l’amidon et des protéines [76].
8
Finalement, la dernière étape de transformation des grains d’orge en malt est le touraillage. C’est à cette étape que les grains subissent un traitement de chaleur d’intensité et de durée variables qui déterminera alors la couleur et le type de malt. Pour un malt foncé, voire torréfié, il s’agit d’un traitement de chaleur court à haute température, ce qui aura comme effet de dénaturer les enzymes et de donner des arômes de café et de chocolat au malt. Au contraire, un traitement long à plus basse température favorisera les enzymes utiles dans le processus de fabrication de la bière et confèrera au grain une couleur plus pâle [23, 76]. Plusieurs régimes sont possibles tout dépendant de la vocation des grains. Les malts de spécialité sont utilisés davantage pour conférer les arômes, couleurs et saveurs à la bière, tandis que les malts de base ont la vocation de fournir les enzymes et les sucres essentiels à la transformation de la bière. Le pouvoir diastasique d’un malt réfère à sa teneur en enzyme, plus précisément une glycoside hydrolase (β-amylase) qui permet l’hydrolyse des chaines d’amidon en sucres plus simples [23, 56]. Il est alors du devoir du brasseur de sélectionner et de combiner les malts selon leurs différentes propriétés et selon le style de bière qu’il désire produire.
1.1.2.3 Le houblon
Connu comme étant l’épice de la bière, le houblon est probablement la matière première la moins primordiale pour le procédé de fabrication de la bière, mais qui demeure toutefois nécessaire pour les qualités organoleptiques du produit fini. En fait, il est fréquent que les brasseurs réduisent les fonctions du houblon à son apport en amertume et ses propriétés aromatiques. Bien qu’ils soient effectivement utilisés à cet effet, les houblons exercent également d’autres rôles tels que stabiliser les arômes, limiter la croissance de bactéries et améliorer la tenue de mousse [159].
Le houblon est en fait une plante dont seule l’espèce Humulus lupulus (houblon commun) est utilisée en brasserie [35]. Avec 350 cultivars existants pour cette espèce, 97 % de la production mondiale d’houblon commun est dédié à l’industrie de la bière [141]. Le houblon est une plante grimpante qui se cultive facilement, mais qu’il faut récolter et travailler avec soin afin de préserver les composés importants qui peuvent facilement se dégrader à la
9
chaleur, à l’humidité ou à la lumière. Brièvement, le houblon est récolté, puis séché afin de diminuer son taux d’humidité entre 8 % et 9 %, ce qui veillera à conserver la qualité des huiles essentielles [70]. Ensuite, il est compressé en granules, forme normalisée sous laquelle le houblon est généralement vendu.
Trois composés du houblon sont indicateurs de la valeur brassicole de ce dernier, soient les acides alphas, les acides betas et les huiles essentielles contribuant à l’amertume, la conservation et aux arômes de la bière [88, 141]. D’une part, les acides alphas contribuent majoritairement à l’amertume dans la bière. Telle qu’illustrée à la figure 3, la transformation des acides alphas en acides iso-alphas est nécessaire afin de rendre les molécules plus solubles dans l’eau et d’ainsi obtenir l’amertume désirée dans le produit fini. Cette isomérisation est possible par un traitement de chaleur qui correspond à une ébullition dans le cas de la bière [82]. Bien qu’il existe plus de 22 composés pouvant être responsables de l’amertume, c’est principalement l’humulone qui se retrouve dans la bière puisqu’elle est dérivée d’un constituant majeur du houblon : la lupuline [141]. Les autres molécules peuvent contribuer à l’amertume, mais elles sont généralement trouvées en plus faible concentration et leur seuil de perception est plus élevé [141]. Du côté des acides betas, c’est plutôt l’oxydation durant la fermentation et l’entreposage qui permet d’activer leurs pouvoirs amérisant et bactériostatique [88].
10
Figure 3.Réaction d’isomérisation des acides alphas. Tirée intégralement de Caballero et al. (2012) [24].
Du côté aromatique, les molécules responsables des différents arômes sont beaucoup plus nombreuses. Ce sont en majeure partie des huiles essentielles, dont plusieurs centaines de composés ont été analysés, qui occupent entre 0,03 % et 3 % des constituants du houblon [141]. Ces huiles se divisent en trois catégories comme illustré à la Figure 4. De manière générale, bien que les mécanismes exacts menant aux arômes ne soient pas encore entièrement compris, les huiles essentielles contenues dans le houblon ajouté pour ses vertus aromatiques ne doivent pas subir le même traitement de chaleur que les acides alphas. En majeure partie, les terpènes et les sesquiterpènes risqueraient de s’oxyder au contact avec l’air en fraction soluble dans l’eau [64]. En effet, les composés résultants peuvent s’évaporer lors d’une ébullition soutenue. Il est donc d’usage d’intégrer les houblons en fin d’ébullition ou à la fin de la fermentation afin de favoriser la conservation de leurs arômes.
11
Figure 4.Représentation des trois groupes formant les huiles essentielles présentes dans le houblon. Tirée intégralement de Schönberger et Kostelecky (2011) [141].
Il n’est pas encore possible de définir exactement l’apport de chaque molécule sur le profil aromatique final des bières puisque bon nombre d’entre elles agissent en synergie, ne sont pas en concentration assez importante pour dépasser le seuil de perception ou dépendent même du métabolisme des levures pour être exprimées [80]. Cependant, il est établi que le linalool, souvent en synergie avec le géraniol et le citronellol, est une molécule qui contribue grandement aux arômes de houblon. Cette molécule est reconnue pour ses arômes floraux, fruités et de citron [80, 141].
Les producteurs de bière peuvent donc développer leurs bières avec un éventail de près de 350 différents cultivars existants, ayant chacun leur particularité au niveau des flaveurs qu’ils ont à offrir. Cependant, en plus de noter un effet de terroir sur les propriétés organoleptiques du houblon, la possibilité de cultiver différentes variétés est dépendante du climat. De ce fait, pour les brasseurs québécois désirant produire de la bière en utilisant strictement des ingrédients du terroir, le choix est alors plus restreint. Cascade, Nugget, Willamette, Brewer’s Gold et Centennial sont tous des cultivars qui peuvent être produits au Québec [35, 166].
12 1.1.2.4 Les levures
L’ingrédient sans doute le plus sous-estimé par une multitude de brasseurs est toutefois un ingrédient dont l’importance est indéniable. En effet, les levures sont responsables de la transformation du mout en bière par le processus métabolique de la fermentation.
Figure 5. Représentation simplifiée de la structure d’une cellule de levure de bière. Tirée intégralement de White et Zainasheff (2010) [172].
Ces microorganismes font partie du règne des Mycètes où l’on retrouve les champignons, les moisissures et les levures [132]. Tel qu’illustré à la figure 5, ils possèdent un noyau dans la cellule où se retrouve le matériel génétique, tout comme chez les autres organismes eucaryotes. Cependant, à défaut d’être multicellulaire comme les champignons filamenteux, les levures sont des microorganismes unicellulaires [132]. Étant hétérotrophes, ces microorganismes doivent se nourrir de sources de carbone provenant de leur environnement en sécrétant des enzymes permettant leur assimilation. Cette caractéristique, en plus de la présence de chitine dans leur paroi cellulaire et de leur capacité à stocker le glycogène en période de stress, leur vaut leur place au sein de ce règne.
13
Elles se trouvent également au sein de l’embranchement des ascomycètes, caractérisé par la présence d’asques, qui sont des structures en forme de sacs où se trouvent les spores intervenant dans la reproduction sexuée des organismes [14, 106].
Figure 6. Représentation des reproductions sexuée et asexuée chez les ascomycètes. Tirée intégralement de Bennett et Turgeon (2017) [14].
Chez les levures, deux types de reproduction sont possibles, soient les reproductions sexuée et asexuée. Bien que la reproduction asexuée soit plus fréquente, les levures ont la capacité d’alterner entre ces deux modes de reproduction en fonction de leur milieu et des conditions de croissance [84, 138]. Généralement, elles se reproduisent par bourgeonnement. Cependant, lorsque les conditions environnementales sont plus difficiles, les cellules optent plutôt vers la reproduction sexuée (Fig. 6).
Peu importe le mode de reproduction, les cellules ont besoin d’énergie afin d’assurer leur croissance et leur survie. Tel que mentionné antérieurement, les levures, étant hétérotrophes, doivent se nourrir de source de carbone provenant de leur environnement [138]. Leur métabolisme énergétique peut varier entre la respiration et la fermentation, selon les conditions de leur milieu (Fig. 7) [167, 172]. Elles peuvent générer de l’énergie par la voie métabolique de la respiration, en présence d’oxygène, ou de la fermentation, et ce, en
14
anaérobie [138]. Généralement, la respiration est favorisée puisqu’elle génère davantage de molécules d’ATP par molécule de glucose métabolisée. Le ratio se situe à 18 molécules d’ATP pour la respiration contre seulement deux molécules pour la fermentation. Cependant, dans le cadre de la production de la bière, les brasseurs créent un milieu favorable à la fermentation, puisque cette voie métabolique génèrera un produit contenant de l’alcool, du gaz carbonique et des composés aromatiques, même si le rendement énergétique est plus pauvre pour les levures [136]. C’est pourquoi la fermentation sera plus approfondie que la respiration dans ce mémoire.
Figure 7. Métabolisme énergétique des levures. Tirée intégralement de Pfeiffer et Morley (2014) [128].
1.1.3 Le procédé de fabrication de la bière
1.1.3.1 Les méthodes de fabrication ancestralesDepuis la préhistoire, la bière est ancrée dans les coutumes des peuples grâce, entre autres, à ses propriétés nutritives et euphorisantes [50]. Évidemment, le procédé de fabrication de la bière n’était pas standardisé d’autant plus que les réactions biochimiques qui menaient à la création de ce breuvage tant apprécié n’étaient pas étudiées comme maintenant. En fait, la bière a été découverte, par hasard, suite à une averse de pluie qui avait humidifié les récoltes de céréales se trouvant dans des récipients. Les céréales, ayant germé suite à ce trempage, ont donc pu libérer leurs sucres et enzymes et se solubiliser dans l’eau de pluie [98]. Conséquemment, bien que l’existence des microorganismes n’était pas encore connue à cette
15
époque, les levures et bactéries présentes à la surface des grains ont pu coloniser le mout et fermenter le sucre en alcool et en gaz carbonique. Les gens, ayant grandement apprécié le résultat, ont donc continué à reproduire ce procédé de façon empirique durant des milliers d’années. C’est à l’époque de Louis Pasteur que le lien entre la présence de microorganismes et le procédé de fermentation a été établi [50, 98].
1.1.3.2 Les méthodes modernes
Suite à une succession de recherches et de découvertes par différents pionniers tels que Pasteur et Hansen, le procédé est dorénavant bien connu, malgré qu’il reste encore beaucoup de phénomènes à étudier [31, 55]. À partir des connaissances actuelles, la fabrication de la bière se décline en trois étapes majeures, soient l’empâtage, l’ébullition et la fermentation.
1.1.3.2.1 L’empâtage
La première étape consiste à mélanger les céréales avec de l’eau pour en faire du mout cru. Les céréales sont généralement de l’orge malté, mais une multitude de combinaisons sont possibles avec du blé, de l’avoine, du seigle, du riz, entre autres, tout dépendant de la volonté du brasseur et du style de bière qu’il désire obtenir. Le malt doit préalablement avoir été concassé afin d’exposer à l’eau d’empâtage les sucres et enzymes contenus à l’intérieur de l’enveloppe ce qui en favorisera leur extraction. Lors de l’étape d’empâtage, les paramètres tels que la température et le pH sont ajustés en fonction des enzymes favorables à la saccharification. L’enzyme α-amylase catalyse l’hydrolyse des liens glycosidiques de type α-1,4 retrouvés dans l’amidon [148]. De son côté, la β-amylase hydrolyse le même type de lien, mais seulement par les extrémités des molécules d’amidon. Ce faisant, la β-amylase génère davantage de sucres simples, fermentescibles alors que l’α-amylase produit plus de dextrines, sucres plus complexes [15]. La figure 8 illustre les paramètres optimaux pour favoriser les enzymes α-amylase et β-amylase. Le pH désiré se situe entre 5,1 et 5,5 alors que la température varie entre 65 et 70 °C. Typiquement, il existe deux types d’empâtage, soient l’empâtage mono-palier ou l’empâtage enzymatique (multi-palier). Alors que le premier type
16
vise un empâtage d’une durée d’une à deux heures à une température stable de 67 °C afin que les enzymes travaillent conjointement, l’empâtage avec des paliers enzymatiques permet de favoriser consécutivement chaque enzyme. En fait, le premier palier consiste à stabiliser la température entre 60 et 65 °C afin de permettre à la β-amylase de générer des sucres fermentescibles, principalement du maltose, en action complémentaire avec l’α-amylase qui est minimalement active à ces températures [107]. Le palier suivant, situé entre 68 et 75 °C, dénature complètement la β-amylase, laissant donc libre cours à l’α-amylase qui hydrolyse des sucres plus complexes [107]. Ces sucres non-fermentescibles octroient donc du corps à la bière. Le dernier palier, pouvant être optionnel, consiste à monter la température autour de 78 °C dans le but de dénaturer toutes les enzymes et de s’assurer de l’arrêt de la saccharification durant le transfert du mout vers la cuve d’ébullition. Il n’est toutefois pas recommandé d’atteindre 80 °C lorsque le mout est encore en contact avec les céréales afin de ne pas solubiliser l’amidon restant et les tanins contenus dans les grains, ce qui aurait comme conséquence de générer respectivement des sucres non fermentescibles et de l’astringence non désirée dans la bière [32].
Figure 8. Intervalles de température et pH favorisant l’action de différentes enzymes durant l’étape d’empâtage pour la fabrication de bière. Tirée intégralement de Palmer (2017) [124].
17 1.1.3.2.2 L’ébullition
Alors que le mout cru est dans la cuve d’ébullition, après avoir été transféré et filtré par l’enveloppe des grains, il est prêt à être bouilli durant 60 à 90 minutes, dépendamment de la densité désirée du mout (exprimée en degrés Plato). Cette étape, pourtant très simple en apparence, est cruciale quant aux propriétés aromatiques finales de la bière ainsi que pour la stabilité des protéines et la concentration du mout [77]. De plus, le traitement de chaleur permet d’inactiver les enzymes et d’inhiber les microorganismes [176]. En effet, c’est durant l’ébullition que certains composés précurseurs d’arômes indésirables peuvent être évaporés. Le malt pâle contient des composés soufrés tels que le S-méthylméthionine susceptible d’être transformé en sulfure de diméthyle (DMS) durant la fermentation, un composé caractérisé par des arômes indésirables de végétaux ou de maïs en conserve. L’ébullition permet donc de catalyser cette transformation et d’évaporer le DMS puisqu’il est un composé très volatil [176].
Le houblonnage, soit le fait d’ajouter les houblons au mout, s’effectue principalement durant l’étape d’ébullition. De ce fait, tel que mentionné antérieurement, ce traitement de chaleur permet de transformer les acides alphas en molécules amères et solubles par isomérisation [141]. Il est donc d’usage d’ajouter les houblons voués au développement de l’amertume au début de l’ébullition. Du côté des houblons ajoutés pour leurs vertus aromatiques sans développement d’amertume, il est préférable de les ajouter en fin d’ébullition puisque les molécules aromatiques risqueraient de se dénaturer et de s’évaporer, si elles sont soumises à un tel traitement de chaleur [80].
1.1.4 La fermentation alcoolique
Le processus métabolique à la base de la transformation des sucres contenus dans le mout en éthanol et en gaz carbonique est la fermentation alcoolique qui est assurée par les levures. Dans le cas de la production de bière, les levures, suite à l’oxygénation du mout durant le transfert et à l’inoculation subséquente, sont en aérobie. Conséquemment, elles utilisent la respiration, ce qui permet la reproduction cellulaire par bourgeonnement durant les premières
18
heures suivant l’inoculation. Ensuite, l’oxygène est consommé et diminue en concentration dans le mélange, ce qui coïncide avec une concentration maximale des levures. Elles prennent alors la voie métabolique de la fermentation alcoolique afin de produire de l’éthanol et du gaz carbonique [167].
Cependant, un fait plutôt étonnant chez les levures brassicoles est leur tendance à opter pour la voie métabolique de la fermentation, même en présence d’oxygène, malgré que la cellule produise environ neuf fois moins de molécules d’ATP par molécule de glucose consommée. Ce phénomène est nommé l’effet Crabtree et est observé lorsque la concentration en sucres est suffisamment élevée [172]. En présence d’une concentration en sucres supérieure à ce que les levures peuvent métaboliser via la respiration, ces sucres sont alors fermentés [128]. Une concentration minimale de 3 g/L de glucose représente une condition favorable pour permettre la fermentation du mout par les levures même en présence d’oxygène [38].
1.1.4.1 La fermentation pure
En brasserie, deux grands types de fermentations alcooliques sont possibles selon l’espèce de microorganisme à l’origine de la fermentation. Historiquement, Louis Pasteur découvrit la présence de levures au bas des fermenteurs et d’autres dans le haut des fermenteurs. C’est donc grâce à cette observation qu’il constata une différence entre les levures [55].
Dès lors, la levure Saccharomyces cerevisiae qui se retrouvait dans le haut des fermenteurs fut associée aux bières issues de fermentation haute, appelées Ales. Ces fermentations sont conduites à plus hautes températures, c’est-à-dire de 18 à 24 °C [98]. Depuis sa découverte, cette levure est considérée comme la levure de bière par excellence puisqu’elle est tolérante au stress occasionné par les hautes concentrations en sucres et en éthanol. En réutilisant cette levure lors des fermentations subséquentes, procédé nommé « backslopping », Saccharomyces cerevisiae est devenu un microorganisme modèle et parfaitement adapté pour la fermentation de la bière, si bien que les autres levures étaient éliminées du procédé. Anecdotiquement, S. cerevisiae fut le premier microorganisme à voir son génome complet être séquencé [103]. La domestication et la diversité génétique au sein de cette espèce font
19
en sorte que quelques centaines de souches de cette levure sont disponibles pour la fermentation brassicole [50].
Récemment, beaucoup d’intérêt a été porté vers les Kveik, levures norvégiennes, ayant la capacité de fermenter à des températures très élevées, soient au-delà de 28 °C, tout en développant des arômes très agréables. Ces levures permettent donc des fermentations plus rapides sans la production de composés aromatiques désagréables, ce qui n’est pas le cas avec les autres Saccharomyces cerevisiae. Ces souches de S. cerevisiae proviennent de régions où les traditions brassicoles ont permis la domestication des levures de manière à ce qu’elles s’adaptent à ces paramètres environnementaux [131].
D’un autre côté, il existe aussi des fermentations dites basses qui se produisent à des températures moins élevées, soient de 5 à 15 °C. Les levures associées à cette fermentation menant à la production de bière de type Lager sont de l’espèce Saccharomyces pastorianus [55]. Cette espèce de levure est en fait un hybride entre Saccharomyces cerevisiae et Saccharomyces bayanus [43]. L’évènement menant à la formation de cet hybride est connu comme étant une spéciation spontanée due aux conditions environnementales auxquelles les levures étaient exposées [43]. L’espèce S. bayanus est plus tolérante au froid que S. cerevisiae, ce qui fait en sorte que l’hybride S. pastorianus est caractérisé par sa capacité à fermenter à des températures moins élevées [55].
1.1.4.2 Les fermentations mixtes
Bien que les procédés de fermentation impliquant un seul microorganisme soient largement utilisés, il est également possible de faire des fermentations mixtes où plusieurs microorganismes interviennent dans la fermentation.
1.1.4.2.1 Les fermentations mixtes inoculées
D’une part, il est possible de faire une fermentation mixte qui soit contrôlée. Dans ce cas, différents ferments préalablement sélectionnés sont inoculés à des moments définis, selon les
20
caractéristiques finales désirées de la bière [164]. Les fermentations mixtes peuvent faire intervenir des bactéries lactiques, lesquelles fermentent les sucres pour en produire de l’acide lactique. À elles seules, les bactéries ne peuvent fermenter du mout pour en faire une bière puisque leurs voies métaboliques de fermentation génèrent de l’acide lactique plutôt que de l’éthanol [160]. Cependant, leur présence est complémentaire à celle des levures puisque ces dernières ne sont généralement pas capables de produire de l’acide lactique en fermentation. Par conséquent, dans les dernières années, quelques espèces de levures, telles que Lachancea thermotolerans, Lachancea fermentati, Hanseniaspora vineae, Wickerhamomyces anomalus et Schizosaccharomyces japonicus, ont été étudiées pour leur capacité à fermenter une bière en produisant à la fois de l’éthanol et de l’acide lactique [41, 123]. Néanmoins, en fermentation avec des levures du genre Saccharomyces sp., il est très commun d’ajouter des lactobacilles afin de générer de l’acide lactique et, ainsi, d’acidifier la bière [160].
1.1.4.2.2 Les fermentations mixtes non-inoculées
D’une autre part, il existe les fermentations mixtes dont l’inoculation n’est pas contrôlée par l’ajout de souches sélectionnées, il s’agit de la fermentation spontanée. Bien que peu de brasseries utilisent ce procédé, ce type de fermentation occupe une place de niche au sein de la sphère brassicole. La colonisation du mout par les microorganismes ambiants, suivie par une fermentation qui peut durer de quelques mois à quelques années où se succèdent plusieurs microorganismes, produit des bières aux profils aromatiques distinctifs [120, 152]. Les flaveurs produites sont notamment attribuables à la présence systématique des levures Brettanomyces spp. après six mois de fermentation (Fig. 9) [83]. Cette présence peut être un des indicateurs d’un potentiel brassicole, puisqu’elles sont en mesure de métaboliser les sucres contenus dans le mout.
21
Figure 9. Identification des levures isolées de brassins aléatoires de bières issues de fermentations spontanées traditionnelles. Les levures du genre Brettanomyces (téléomorphe; Dekkera spp.) sont présentes à partir du 6e mois de fermentation. Tirée intégralement de
Spitaels et al. (2014) [152].
1.2 Les levures du genre Brettanomyces.
Les levures du genre Brettanomyces ont été mentionnées pour la première fois dans un article écrit en Grande-Bretagne par Claussen en 1904 prétendant que ces levures étaient responsables des fermentations secondaires et du développement de composés aromatiques atypiques dans les bières ales anglaises [31]. L’étymologie du terme Brettanomyces vient donc du grec, signifiant «champignon britannique» [119]. Ce n’est que quelques années plus tard, soit en 1940, qu’une recherche plus poussée sur le genre Brettanomyces fut dirigée par Custers sur 17 souches de Brettanomyces spp. [4]. Cette étude a mis de l’avant que ces levures sont nuisibles dans le vin, dû aux arômes indésirables qu’elles produisent. Presque cent ans plus tard, l’utilisation des Brettanomyces spp. est dépendante du produit fabriqué [99]. Étant considérées indésirables dans le vin, leur présence reste essentielle dans le cas de la
22
production de bières spontanées, ainsi que dans certaines bières de spécialité [85]. À cet effet, depuis les dernières décennies, l’utilisation des levures Brettanomyces spp. dans le monde des microbrasseries a augmenté considérablement [179].
1.2.1 La taxinomie des levures du genre Brettanomyces.
Depuis la découverte du genre Brettanomyces sp., des levures ascomycètes appartenant à la famille des Pichiaceae, leur classification a fait l’objet de beaucoup de débats [1]. À l’origine, seules les levures anamorphes étaient classées, c’est-à-dire les espèces de ces levures se reproduisant par bourgeonnement. Pourtant, en 1960, Van der Walt observa la présence d’ascospores chez quelques souches [149, 163]. Cette découverte a permis d’introduire la forme homologue sexuée de Brettanomyces dans la classification. Ce stade téléomorphe est donc nommé Dekkera [25, 149]. Bien que la présence de stades anamorphe et téléomorphe ait été prouvée, les techniques moléculaires de détection de l’ADN ne sont pas, à ce jour, en mesure de révéler des différences moléculaires entre les deux stades [119]. Après quelques reclassifications taxinomiques, cinq espèces de Brettanomyces sont reconnues présentement, soient B. bruxellensis, B. anomalus, B. custersianus, B. naardenensis et B. nanus. Des téléomorphes existent pour les deux premières espèces, soit D. bruxellensis et D. anomala [153]. Malgré l’existence de cinq espèces de levures du genre Brettanomyces, les levures B. bruxellensis et B. anomalus sont les plus communes, surtout en industrie brassicole[153].
1.2.2 La fermentation par les levures Brettanomyces spp.
Considérant l’importance des levures du genre Brettanomyces dans la production de bières issues de fermentations spontanées, de même que dans les bières de spécialité, il importe d’étudier le comportement de ces levures en fermentation [85, 153]. Une tendance observée chez ces levures est la super-atténuation des bières issues de leur fermentation. En effet, les Brettanomyces spp., grâce à l’enzyme β-glucosidase qui est produite par la plupart des
23
souches, mais en quantité variable, sont capables de fermenter des sucres tels que les dextrines, sucres à longues chaines glucosidiques et le cellobiose, un sucre complexe retrouvé dans le bois[145, 179]. D’ailleurs, c’est pourquoi les Brettanomyces spp. sont associées aux fermentations dans des barriques de chêne, où elles peuvent y survivre longtemps et libérer des composés d’arômes qui sont liés par des liens glucosidiques [145]. Il n’est donc pas rare de procéder à la maturation de bières dans des barriques de chêne afin de développer de nouvelles saveurs. De la même manière, les Brettanomyces spp. sont aussi responsables de certains arômes typiques retrouvés dans la traditionnelle bière Kriekpar l’hydrolyse de liens glucosidiques contenus dans les cerises [153].
Une caractéristique phénotypique digne d’intérêt chez Brettanomyces spp. réside dans sa tendance à fermenter les sucres en éthanol et ce, même en présence d’oxygène. Alors que la voie métabolique de la respiration est possible et génère neuf fois plus d’ATP que celle de la fermentation, Brettanomyces spp. produit de l’éthanol par la voie de la fermentation afin d’être compétitive face aux autres microorganismes [126, 128]. Ce caractère présent chez cette levure est nommé l’effet Crabtree et est possible seulement qu’en présence d’une concentration en sucres supérieure à 3 g/L [38]. Il est à noter que Brettanomyces sp. partage cette caractéristique avec S. cerevisiae[153].
Un autre phénomène originalement décrit en 1940 se nomme l’effet Custers ou l’anti effet Pasteur. Lorsque les concentrations en sucres sont faibles, le métabolisme de ces levures admet un arrêt complet de fermentation en anaérobie alors que la fermentation est plutôt stimulée en présence d’oxygène [122]. Les raisons de cet effet observé ne sont pas encore claires, mais une des causes probables est sans doute l’incapacité des Brettanomyces spp. à rétablir et maintenir leur équilibre d’oxydoréduction en conditions d’anaérobie [145]. D’autres levures, telles que S. cerevisiae rétablissent leur équilibre redox en activant la production de glycérol, nécessitant l’enzyme phosphatase glycérol 3-phosphate [52, 113]. Étant dépourvues de cette enzyme (Fig. 10), les Brettanomyces spp. ne sont pas capables de rétablir leur équilibre redox, ce qui explique les longues phases de latence lorsque les cellules sont transférées d’un environnement aérobie à un environnement anaérobie ainsi que la lenteur de leur croissance [153].
24
Figure 10. L’effet Custers chez Brettanomyces bruxellensis. (A) Représentation simplifiée des facteurs pouvant influencer l’équilibre redox. L’incapacité de B. bruxellensis à convertir le glucose-3-phosphate (G3P) en glycérol est due à l’activité limitée, voire absente, de l’enzyme 3-phosphate phosphatase (indiquée par un X). Cette incapacité se traduit par une fermentation plus rapide du glucose en éthanol en condition aérobie qu’en anaérobie. (B) Le changement de condition aérobie en condition anaérobie cause une phase de latence dans la cinétique de croissance chez B. bruxellensis. Cette phase de latence est causée par un manque de NAD+ bloquant la glycolyse. Tirée intégralement de Steensels et al. (2015) [153].
Une caractéristique reliée à l’effet Custers est la production d’acide acétique qui a comme conséquence d’avantager ces levures par rapport aux autres microorganismes [3, 28]. En effet, les levures du genre Brettanomyces sp. produisent et accumulent l’acide acétique pour
25
la métaboliser plus tard, et ce, en phase aérobie. En présence de nitrate comme seule source d’azote, l’acide acétique devient le métabolite de fermentation le plus important au niveau quantitatif. De plus, une production d’acide acétique en condition anaérobie et en présence de nitrate peut aussi être observée, mais demeure un phénomène assez inhabituel [153].
1.2.3 Les caractéristiques de la levure Brettanomyces spp. en
fermentation brassicole
Considérant le rôle de Brettanomyces spp. en fermentation et sa présence pratiquement systématique lors de fermentations spontanées, notamment pour la production de bière Lambic, quelques recherches scientifiques se sont intéressées à l’étude de leurs caractéristiques phénotypiques. Les résultats de ces recherches ont donc permis de déterminer certaines particularités des levures Brettanomyces spp. qui sont pertinentes dans une perspective brassicole [153].
1.2.3.1 La production de composés aromatiques
De toutes les caractéristiques distinctives des levures Brettanomyces spp., la production de composés aromatiques atypiques dans le domaine de la brasserie est sans doute la plus évidente. Contrairement à la levure S. cerevisiae, plus traditionnellement utilisée en brasserie, Brettanomyces spp. est associée à un large spectre d’arômes différents variant entre fruits tropicaux, cuir humide, phénolique, pansement, agrumes, médical, clou de girofle, plastique, fumé, floral et épicé, entre autres [164, 167, 179].
Du côté des esters volatils, caractérisés par des arômes fruités et floraux, les Brettanomyces spp. sont reconnues pour produire un profil bien distinct. Elles produisent une quantité de caprate d’éthyle significativement plus élevée que les autres ferments plus traditionnels, de même que des quantités plus élevées de caprylate d’éthyle et de lactate d’éthyle [145, 151]. Concernant l’acétate d’isoamyle, un ester couramment retrouvé dans les produits brassicoles étant associé à l’arôme de banane, Brettanomyces spp. n’en produit que
26
de très petites quantités [145]. De toute évidence, la présence d’estérases dans ces levures est à l’origine de ce profil type de production d’esters par la formation d’éthyles et par l’hydrolyse de l’acétate d’isoamyle [151, 153, 179]. Il est à noter que ces caractéristiques organoleptiques sont plus accentuées dans le cas de fermentations mixtes alors que des quantités plus appréciables d’acides lactique et acétique sont présentes [121].
Les arômes typiques de clou de girofle, d’épices, de fumée, d’écurie et de basse-cour sont directement attribuables à la présence de composés phénoliques volatils. Les six plus dominants dans le cas des fermentations avec Brettanomyces spp. sont les 4-éthylguaïacol, 4-éthylphénol, 4-éthylcatécol ainsi que leurs précurseurs, soient les 4-vinylguaïacol, 4-vinylphénol et 4-vinylcatécol [72, 153]. Il est admis que la présence d’acides hydroxycinnamiques, d’acide p-coumarique et d’acide férulique dans le milieu permet à ces levures de produire les composés aromatiques phénoliques grâce à deux enzymes : la décarboxylase d’acide phénolique et la réductase de vinylphénol [60, 67].
Les levures du genre Brettanomyces sp. peuvent également produire des arômes rappelant l’écurie ou des biscuits de type craquelins par la présence de composés tels que le 2-éthyltétrahydropyridine (ETHP), le 2-acétyltétrahydropyridine (ATHP) et le 2-acétylpyrroline (APY) [63]. Les voies métaboliques impliquées dans la formation de ces composés par les Brettanomyces spp. ne sont toujours pas connues [72]. Cependant, dans le cas des bactéries lactiques, il est admis que la synthèse d’ATHP et d’APY nécessite la présence d’éthanol, de sucres fermentescibles et d’un acide aminé, soit la L-lysine pour
l’ATHP et la L-ornithine pour l’APY [33]. Il est également connu que la production de
l’ETHP est attribuable à la réduction de l’ATHP [33].
Par ailleurs, bien que très peu aromatique, le glycérol est un composé généralement retrouvé dans les bières. Il est reconnu pour donner du corps à la bière, une grande amplitude en bouche, ainsi que pour conférer un goût sucré. Cependant, puisque les Brettanomyces spp. ne possèdent pas la glycérol 3-phosphase, elles ne sont pas en mesure de produire du glycérol [174].
L’acide acétique est un coproduit de fermentation couramment retrouvé dans les fermentations par Brettanomyces spp. en présence d’oxygène, de glucose et
27
d’éthanol [30, 48]. Par contre, cette caractéristique est variable tant au niveau interspécifique qu’intraspécifique [28]. En fermentation brassicole, la concentration maximale d’acide acétique produite qui est considérée agréable au goût est de 1,2 g/L [28].
Finalement, les Brettanomyces spp. sont réputées pour produire des acides gras volatils qui sont des composés jugés indésirables. Entre autres, l’acide isovalérique est associée aux arômes de rancis et de fromage [97, 153]. Les voies métaboliques responsables de la production de ces composés ne sont pas encore connues bien que la présence d’acides aminés tels que la L-leucine, la L-isoleucine et la L-valine soit directement liée avec la présence des
composés aromatiques indésirables [153].
1.2.3.2 Les conditions optimales de croissance de la levure Brettanomyces spp.
Afin d’être en mesure de cultiver les Brettanomyces spp., il importe de connaître leurs conditions optimales de croissance. Toutefois, il est admis qu’il existe chez les levures Brettanomyces spp., comme chez plusieurs autres espèces fongiques et microbiennes, un état physiologique pendant lequel les levures sont viables, mais non cultivables (VNC) [27]. Par exemple, en présence d’un stress tel que l’addition de sulfites, les cellules ont la capacité de demeurer viables, sans toutefois être cultivables sur milieu de culture. Cet état est réversible dans le sens où, lorsque la source de stress est éliminée, les cellules redeviennent cultivables après un temps de récupération [144].
Malgré l’existence de l’état VNC, les levures Brettanomyces spp. sont généralement faciles à faire croître, bien qu’elles soient lentes. Elles montrent une grande résistance face au stress osmotique et au stress causé par la présence d’éthanol en plus d’être en mesure de croître dans des milieux présentant un faible pH [153]. Néanmoins, elles nécessitent un environnement contenant des concentrations en oxygène modérées à faibles afin d’optimiser leur croissance. Le taux de transfert d’oxygène requis pour une croissance optimale est de 43 mg d’O2/L/h. Au-delà de ce seuil, les concentrations cellulaires obtenues sont plus faibles [3].
D’ailleurs, le niveau d’oxygène influence la production d’éthanol et d’acide acétique [3, 48]. De plus, la production d’acide acétique est très variable d’une souche à l’autre, considérant
![Figure 2. Structure d’un grain d’orge. Tirée intégralement de Fox (2010) [47].](https://thumb-eu.123doks.com/thumbv2/123doknet/2755184.65591/19.918.150.773.633.956/figure-structure-grain-orge-tirée-intégralement-fox.webp)


![Figure 5. Représentation simplifiée de la structure d’une cellule de levure de bière. Tirée intégralement de White et Zainasheff (2010) [172]](https://thumb-eu.123doks.com/thumbv2/123doknet/2755184.65591/24.918.234.687.360.658/figure-représentation-simplifiée-structure-cellule-tirée-intégralement-zainasheff.webp)
![Figure 6. Représentation des reproductions sexuée et asexuée chez les ascomycètes. Tirée intégralement de Bennett et Turgeon (2017) [14]](https://thumb-eu.123doks.com/thumbv2/123doknet/2755184.65591/25.918.277.647.226.575/figure-représentation-reproductions-asexuée-ascomycètes-intégralement-bennett-turgeon.webp)
![Figure 7. Métabolisme énergétique des levures. Tirée intégralement de Pfeiffer et Morley (2014) [128]](https://thumb-eu.123doks.com/thumbv2/123doknet/2755184.65591/26.918.229.698.366.581/figure-métabolisme-énergétique-levures-tirée-intégralement-pfeiffer-morley.webp)