HAL Id: dumas-02104311
https://dumas.ccsd.cnrs.fr/dumas-02104311
Submitted on 19 Apr 2019
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Identification et caractérisation de composantes
génétiques liées à la résistance aux maladies chez
l’abricot
Margaux Jammes
To cite this version:
Margaux Jammes. Identification et caractérisation de composantes génétiques liées à la résistance aux maladies chez l’abricot. Sciences du Vivant [q-bio]. 2018. �dumas-02104311�
Identification et caractérisation de
composantes génétiques liées à la résistance
aux maladies chez l’abricot
Par : Margaux JAMMES
Soutenu à Rennes le 13 Septembre 2018
Devant le jury composé de :
Président : Anne Laperche
Maître de stage : Jean-Marc AUDERGON
Enseignant référent : Maria MANZANARES-DAULEUX
Autres membres du jury Rapporteur : Alain BARANGER
Les analyses et les conclusions de ce travail d'étudiant n'engagent que la responsabilité de son auteur et non celle d’AGROCAMPUS OUEST
AGROCAMPUS OUEST CFR Angers CFR Rennes Année universitaire : 2017-2018 Spécialité :
Sciences et ingénierie du végétal (SIV) Spécialisation (et option éventuelle) : Génétique et amélioration des plantes (GAP)
Mémoire de Fin d'Études
d’Ingénieur de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
de Master de l’Institut Supérieur des Sciences agronomiques, agroalimentaires, horticoles et du paysage
Remerciements
En premier lieu je souhaiterais remercier de tout cœur Jean-Marc Audergon pour le temps
qu’il a su me consacrer malgré son emploi du temps extrêmement chargé mais aussi pour sa
bienveillance, sa gentillesse et sa pédagogie qui a fait de ce stage une réelle expérience
professionnelle et scientifique.
Je voudrai également exprimé des remerciements particuliers à Guillaume Roch qui a bien
voulu m’accueillir et me faire une place dans son bureau déjà bien occupé et qui m’a
conseillée et a répondu à mes nombreuses questions tout au long de ce stage. Merci
également pour toutes ces discussions pleines d’humour et de sarcasmes grâce auxquelles j’ai
passé de très bons moments.
Un grand merci à Jean pour m’avoir accompagnée dans le début de mon stage sur
l’expérimentation monilia et avoir fait de ce premier mois un moment d’apprentissage et de
découverte très agréable.
Un remerciement tout particulier à Joël qui a su m’accompagner et m’aider dans les analyses
statistiques avec toute la pédagogie qui lui est propre et sa manière un peu décalée et originale
d’expliquer les choses.
Je remercie aussi Mariem Omrani qui a su m’accorder de son temps bien occupé par la fin de
sa thèse pour m’aider sur les analyses génétiques et répondre à mes diverses interrogations.
Tout ce travail n’aurait pu être possible sans Alain Blanc et Laurent Brun, hommes de terrain
de grande expérience, qui ont réalisé toutes les notations nécessaires pour mon étude.
Enfin, merci à tout le reste de l’équipe et de l’unité (Eric, Sabrina, Véronique…) pour
l’accueil chaleureux qu’ils m’ont réservé et l’aide qu’ils ont pu m’apporter tout au long du
stage, merci aux autres stagiaires et doctorants pour ces moments de discussions et de
distractions, tout particulièrement Estelle, Lisandra, Mathilde et Stéphanie.
Sommaire
Introduction ... 1
I. Contexte et connaissance de l’étude ... 2
1. L’espèce Prunus armeniaca, l’abricotier ... 2
a. Origine et histoire de l’espèce ... 2
b. Contexte économique, la culture de l’abricot en France et dans le monde ... 2
c. Biologie et génétique de l’abricotier ... 3
2. Le monilia, une maladie de grande importance économique ... 4
a. Les dégâts économiques causés par la maladie ... 4
b. Symptômes de la maladie ... 4
c. Les agents pathogènes responsables ... 4
d. Les méthodes de lutte ... 6
3. Des maladies secondaires mais non négligeables ... 6
a. La rouille ... 6
b. La tavelure ... 7
c. L’oïdium ... 8
d. Intérêt de l’étude de ces maladies secondaires ... 9
II. Matériel et méthodes ... 9
1. Matériel végétal ... 9
2. Dispositif expérimental ... 9
3. Notations ... 10
4. Génotypage ... 12
5. Traitement statistique des données ... 12
III. Résultats ... 13
1. Analyse des données phénotypiques ... 13
2. Analyse de liaison mise en œuvre sur la population biparentale Berba ... 15
3. Analyse de liaison sur les populations interconnectées ... 17
IV. Discussion ... 18
1. Réponse aux objectifs de travail et perspective d’évolution ... 18
2. Stratégie de lutte contre les maladies pour l’amélioration variétale ... 20
3. Analyse critique des dispositifs expérimentaux ... 21
Conclusion ... 22
Introduction
L’abricot est une culture d’intérêt économique et nutritionnel, c’est le troisième fruit à noyau le plus cultivé dans le monde (Missang et al, 2011). La France est le deuxième pays producteur d’abricot européen et la culture est en plein essor du fait de l’élargissement de la période de production et des perspectives de diversification notamment avec les abricots rouges et blancs.
Or, les productions fruitières sont fortement impactées par la présence de nombreux bio-agresseurs. Chez l’abricot, les maladies comme la sharka, le chancre bactérien ou encore le monilia peuvent entrainer une altération de la production en quantité et en qualité voire même provoquer la mort de l’arbre. Les traitements phytosanitaires ne sont pas toujours efficaces pour enrayer les maladies, ils sont de surcroit polluants et d’autres moyens de lutte méritent d’être mobilisés comme les résistances génétiques afin de protéger durablement les vergers de ces bio-agresseurs d’importance majeure.
De manière complémentaire, dans un contexte de développement durable et de culture sous faibles niveaux d’intrants (plan Ecophyto), le développement de variétés fruitières productives, régulières en production, qualitatives pour le consommateur et résistantes aux principaux bio-agresseurs cités précédemment mais aussi aux bio-agresseurs secondaires tels que la tavelure, la rouille et l’oïdium représente un enjeu majeur. Cette approche intégrée requiert le passage d’une sélection ciblée mono-caractère à une approche intégrée multi-caractère.
L’objectif de mon projet est d’évaluer la pertinence d’une telle approche dans un contexte où la SAM est déjà engagée pour les caractères résistance à la sharka et auto-fertilité en y intégrant d’autres caractères d’intérêt dont la résistance au monilia, à la tavelure, à la rouille et à l’oïdium et en sachant que le travail sur le chancre est déjà bien engagé en parallèle.
Ce stage consiste donc en la recherche de régions génomiques impliquées dans la résistance à ces maladies par la détection de QTL en analyse de liaison sur des descendances biparentales dérivées de « Bakour » et en analyse d’association par une Gwas mise en œuvre sur une partie de la core-collection. Les QTL détectés seront validés sur d’autres fonds génétiques et les marqueurs identifiés seront utilisés dans la sélection assistée par marqueurs. Puis des géniteurs cumulant des caractères d’intérêts agronomiques pour la création de variétés adaptées à une production sous bas intrants phytosanitaires seront recherchés.
Figure 1 : Dissémination de l’abricot depuis l’Asie Centrale (Janick, 1998)
Figure 2 : Origine de onze groupes d’abricots issus de trois régions différentes et leur proximité spatiale et génétique (Bourguiba et al, 2012)
I. Contexte et connaissance de l’étude
1. L’espèce Prunus armeniaca, l’abricotier
a. Origine et histoire de l’espèce
Le genre Prunus appartient à la famille des Rosacées et est caractérisé par des espèces fruitières de type drupe (fruit à noyau). Il se divise en trois sous-genres : Amygdalus comme les pêches,
Prunophora contenant les abricots et Cerasus dont les cerises font partie. (Dirlewanger et al, 2012). Il
comprend de nombreuses espèces cultivées partout dans le monde, certaines ayant une grande importance économique comme les pêches (P. persica L. Batsch var. persica), les nectarines (P.
persica var. nucipersica (Suckow) C.Schneider), les abricots (P. armeniaca L.), les prunes (P. domestica
L.) et les cerises (P. avium L.) (Rungjindamai et al, 2014 ; Lino et al, 2016).
L’abricot a été initialement cultivé en Chine, région où des espèces sauvages ont été trouvées. Les premières formes de domestication ont ensuite été disséminées en Asie centrale et dans la région Irano-caucasienne. Le groupe européen le plus commun originaire d’Asie centrale a atteint l’Europe par la région du Caucase et s’est largement répandu dans le Bassin Méditerranéen en suivant deux voies de dissémination : les pays au nord du bassin et les pays Nord-Africain (Bourguiba et al, 2013) (figure 1). L’abricotier aurait été introduit en France au XVe siècle mais la culture de cet arbre ne s’est développée qu’au XVIIIe siècle. (Doré et Varoquaux, 2006)
Quatre groupes éco-géographique majeurs ont été identifiés sur la base de caractères morphologiques : le groupe d’Asie centrale qui est le plus vieux et le plus diversifié dont les cultivars sont auto-incompatibles et possèdent de forts besoins en froid, le groupe Dzhungar-Zailij dont les accessions sont auto-incompatibles et présentent de petits fruits, le groupe Irano-Caucasien (auto- incompatibles et besoins en froid modérés) et le groupe Européen, le plus récent et le moins diversifié, comprenant des cultivars possiblement auto-compatibles (Bourguiba et al, 2012).
Depuis le centre d’origine en Asie centrale, un gradient décroissant Est-Ouest de diversité génétique est clairement établi et correspond à la domestication et à la diffusion de l’abricot à travers la région méditerranéenne (Bourguiba et al, 2012). Ce gradient de diversité a aussi été observé par Pedryc et
al (2009) et dans la même étude les auteurs observent de plus que les abricots de Chine et d’Europe
sont très éloignés génétiquement.
Dans le bassin méditerranéen l’abricot est structuré par trois pools de gènes principaux correspondant à la région Irano-caucasienne, la région nord méditerranéenne et la région sud méditerranéenne (Bourguiba et al, 2013) (figure 2).
Enfin, les cultivars américains, résultent de l’exploitation d’une diversité plus large en provenance des régions euro-méditerranéennes, d’Asie centrale et orientale (Hagen et al, 2002).
b. Contexte économique, la culture de l’abricot en France et dans le monde
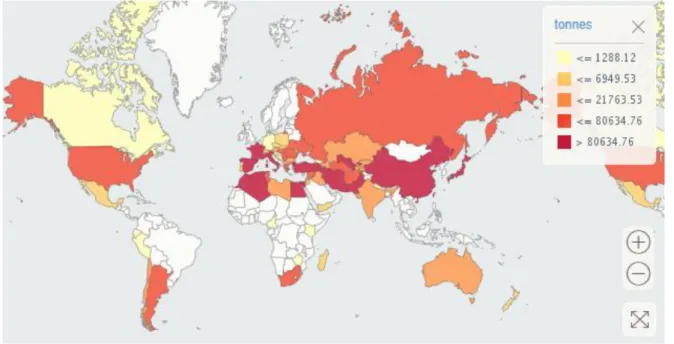
L’abricot, septième production mondiale chez les fruits tempérés, a connu une progression de près de 60% en vingt ans (Lichou et Jay, 2012). En 2016, la production mondiale était de 3,8 millions de tonnes ce qui représentait une surface cultivée de 568 000 hectares (FAOstat).
Figure 3 : Production d’abricots dans le monde (FAOSTAT)
Figure 4 : Répartition de la production mondiale d’abricots (FAOSTAT)
L’abricot est une culture fruitière typiquement méditerranéenne (plus de 50% de la production mondiale) (Bourguiba et al, 2013) (figure 3). La Turquie est le premier producteur mondial avec environ 17% de la production, suivie par l’Iran (12% de la production mondiale) et le Pakistan (Lichou et Jay, 2012). La production européenne représente près de 22% de la production mondiale (FAOstat). En Europe les quatre principaux producteurs sont l’Italie, la France, l’Espagne et la Grèce. L’Italie est le cinquième producteur mondial avec une production d’environ 220 000 tonnes (Lichou et Jay, 2012) (Figure 4 et 5).
En France, la production annuelle a augmenté de 30% en vingt ans et la production en 2016 était de 110 850 tonnes. Le pays semble avoir une avance sur les autres pays européens en termes de renouvellement et de modernisation du verger (Lichou et Jay, 2012).
Le calendrier de production français est plus tardif que celui des autres pays donnant à la France un quasi-monopole sur la période juillet-août avec principalement la variété Bergeron.
La production française est irrégulière du fait de la forte sensibilité de l’abricot aux aléas climatiques. Il s’agit de la troisième production fruitière en France après la pomme et les pêches-nectarines. La production se concentre très principalement dans le sud-est du pays dont les régions Rhône-Alpes (nouvellement Auvergne-Rhône-Alpes), Languedoc-Roussillon (nouvelle Occitanie) et Provence-Alpes-Côte d’Azur qui produisent la quasi-totalité des volumes (Lichou et Jay, 2012).
c. Biologie et génétique de l’abricotier
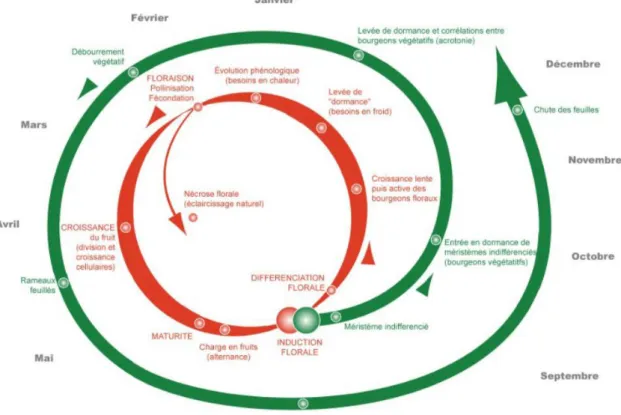
L’abricot est un fruit charnu qu’on appelle une drupe indéhiscente (Doré et Varoquaux, 2006). Les feuilles de l’abricotier ont des nervations pennées dont les bords sont finement dentelés. Son pétiole est rouge et portes des glandes nectarifères. A sa base se trouve un bourgeon axillaire. La croissance des axes de l’abricotier est rythmique et définie. A la fin de chaque unité de croissance, le méristème terminal meurt et les méristèmes les plus jeunes, situés juste en dessous peuvent entrer en fonctionnement. La phyllotaxie d’une unité de croissance est alterne spiralée et les organes foliaires évoluent qualitativement de la base vers le sommet. La pousse annuelle de l’abricotier est polycyclique et contient une à quatre unités de croissance. Au cours du repos hivernal, une réorganisation de l’aptitude à la ramification se produit : les bourgeons des parties néoformées n’ayant pas fonctionné l’année d’avant reprennent tous leur croissance au cours de la première unité de croissance de l’année suivante, au printemps. La différenciation florale se fait entre août et novembre puis a lieu la microsporogénèse jusqu’au printemps. Les fleurs se répartissent sur l’ensemble de la pousse annuelle. L’abricotier a une ramification sympodiale. L’ensemble de la tige a une croissance à direction verticale dans sa partie basale puis oblique à horizontale dans sa partie distale. Les rameaux sont disposés selon un gradient acrotone (Costes, 2013). Le cycle annuel de l’abricotier est représenté figure 6.
L’abricotier est une espèce pérenne ligneuse propagée à des fins de production commerciale par multiplication végétative (greffage) (Miller et Gross, 2011). Il peut être greffé sur des semis d’abricotier, de pêcher ou de prunier mais aussi sur des boutures de prunier ou d’hybrides interspécifiques entre ces espèces (Doré et Varoquaux, 2006).
Les espèces du genre Prunus se développent sous des climats avec des saisons bien différenciées, elles sont adaptées à des basses températures en hiver et des étés secs (Dirlewanger et al, 2012). L’abricot est cultivé dans les régions tempérées (Bourguiba et al, 2012) et parmi les arbres fruitiers,
Figure 6 : Cycle annuel de l’abricotier (Lichou et Jay, 2012)
Figure 7 : Symptômes causés par le monilia. A gauche : sur fruit (Guy Clauzel). Au milieu : sur fleur (photo personnelle). A droite : Sur fleur (Guy Clauzel)
les variétés d’abricot possèdent une plasticité de culture très limitée en lien avec ses contraintes climatiques élevées (Andreini et al, 2014).
L’abricotier aime des sols profonds, riches et bien drainés mais il est sensible à des pH élevés, à la salinité et aux excès d’eau qui peuvent provoquer la mort des arbres.
C’est une plante bisexuelle, certaines variétés sont auto-incompatibles (auto-incompatibilité gamétophytique) et d’autres auto-compatibles (Miller et Gross, 2011). L’ovaire contient deux ovules infères dont l’un des deux est atrophié et avorte dans la plupart des cas (Lichou et Jay, 2012).
L’abricotier est une espèce diploïde à huit paires de chromosomes (2n=16) (Miller et Gross, 2011). Son génome est de petite taille et mesure 294 mégabases (Mb) (Arumuganathan, Earle 1991). C’est l’espèce la moins caractérisée génétiquement chez les Prunus. Cependant, plusieurs cartes génétiques ont été construites chez l’abricotier. (Lambert et al, 2004). De plus, il est synténique avec les autres Prunus et peut s’ancrer sur la carte de référence des Prunus issue du croisement interspécifique entre la variété d’amande ‘Texas’ et la variété de pêche ‘Earlygold’ (Kole et Abbott, 2012 ; Joobeur et al, 1998).
2. Le monilia, une maladie de grande importance économique
a. Les dégâts économiques causés par la maladie
Le monilia est considéré comme l’une des maladies sur fruits à noyau les plus communes et importantes économiquement (Papavasileiou et al, 2015) et il est présent dans toutes les aires de production d’arbres fruitiers dans le monde. Cette maladie cause des pertes mondiales conséquentes sur les cultures fruitières (Poniatowska et al, 2013) avant et après récolte qui sont estimées à 1,7 millions d’euros chaque année (Martini et Mari, 2014). Tous les arbres fruitiers appartenant à la famille des Rosacées sont touchés par la maladie, principalement les Prunus, en particulier les pêchers sur fruits, et l’abricotier sur fleurs et dans une moindre mesure les pommiers et les poiriers (Lichou et Jay, 2012, Riccioni et Valente, 2015).
b. Symptômes de la maladie
Les symptômes de cette maladie se caractérisent par des nécroses des rameaux et des fleurs, des chancres et une pourriture des fruits (Poniatowska et al, 2013). Sur les fleurs, on observe un brunissement des pétales puis elles se dessèchent et restent sur les rameaux après la chute des pétales, et de petits coussinets gris apparaissent (Lichou et Jay, 2012). La maladie apparait initialement sur les fleurs et se déploie ensuite vers les rameaux et les feuilles en causant des nécroses. Les fruits sont aussi affectés à tous les stades de leur développement, les stades les plus sensibles étant l’approche de la maturité des fruits et les premiers stades post-récoltes (Papavasileiou et al, 2016). Sur les fruits, on observe d’abord une tache brune suivie de l’apparition de coussinets concentriques gris ou beige (Lichou et Jay, 2012). (Figure 7)
c. Les agents pathogènes responsables
La maladie est causée par des champignons pathogènes appartenant au genre Monilinia Honey. Ce sont des ascomycètes de la famille des Sclerotiniaceae (EFSA panel on plant health). Trente espèces
Figure 8 : Distribution de monilia laxa dans le monde (CABI)
Figure 9 : Distribution de monilia fructigena dans le monde (CABI)
existent à l’intérieur du genre Monilinia mais trois sont considérées comme ayant une forte importance au niveau économique en production fruitière, ce sont M.laxa, M.fructigena,
M.fructicola (Poniatowska et al, 2013).
Certaines caractéristiques permettent de distinguer les trois espèces M.laxa, M.fructicola et
M.fructigena. Tout d’abord, on peut les distinguer par la partie infectée de la plante ; M.laxa attaque
préférentiellement les fleurs et les rameaux, M.fructigena est principalement un pathogène des fruits et M.fructicola attaque à la fois les fleurs, les rameaux et les fruits. La couleur des pustules peut aussi permettre d’identifier l’espèce du champignon, M.laxa et M.fructicola provoquent des pustules grisatre tandis qu’elles sont plutôt beiges chez M.fructigena (Van Leeuwen et Van Kesteren, 1998). De plus, M.fructicola attaque le plus fréquemment les pêches et les nectarines, on retrouve
M.fructigena principalement sur les fruits à pépins tels que les pommes et les poires et les pertes
qu’il cause sur les fruits à noyau sont considérées comme moins importantes, enfin, M.laxa est plus communément trouvé sur les abricots et les amandes (Lane, 2002 ; Papavasileiou et al, 2015).
Monilia laxa est très répandu à travers le monde et est considéré comme le pathogène du monilia le
plus commun en Europe (Papavasileiou et al, 2015) (figure 8). Monilia fructigena est lui aussi très commun en Europe (figure 9), tandis que M.fructicola est très répandu en Asie (Chine, Japon…), sur tout le continent américain, en Australie et en Nouvelle-Zélande (figure 10) (Poniatowska et al, 2013). Cependant, M.Fructicola a tout de même été signalé pour la première fois en Europe en 2001, dans le sud de la France dans des vergers de pêche du département du Gard (Riccioni et Valente, 2015) et il est récemment apparu dans les pays du centre et du sud de l’Europe : il a été observé une augmentation de ce pathogène dans des vergers d’abricots en Suisse, de pêche en Espagne et une forte présence en Grèce (Papavasileiou et al, 2016).
Contrairement à M.laxa et M.fructigena dont le développement est principalement clonal,
M.fructicola peut se reproduire par voie sexuée dans certaines régions comme en Californie ce qui lui
permet de se multiplier plus rapidement, de sporuler plus abondamment, d’avoir une meilleure capacité de dissémination et de développer plus facilement des résistances aux fongicides. Il est donc nécessaire d’augmenter et d’améliorer la surveillance de cette maladie (Papavasileiou et al, 2016 ; Jänsch et al, 2012).
Récemment, quatre nouvelles espèces de Monilia spp. ont été signalées comme agents causant la moniliose mais ont une importance moindre et une distribution géographique limitée. M.polystroma est une espèce asexuée recensée au Japon, en Hongrie, en Pologne et en Chine, M.mumecola au Japon et en Chine (pêche), M.yunnanensis sur les pêches en Chine et M.linhartania sur coing en Espagne (Papavasileiou et al, 2016).
La maladie a une longue période d’incidence allant de la floraison à la consommation des fruits, de nombreux facteurs climatiques et agronomiques favorisent l’expansion de la maladie, certains pathogènes possèdent des résistances aux fongicides et il y a peu de résistance existante chez les plantes hôtes (Lino et al, 2016). Des pluies importantes lors de la floraison, des températures comprises entre 20 et 25°C le jour et des nuits fraiches sont les conditions idéales pour le développement rapide du pathogène (Hrustić et al, 2012).
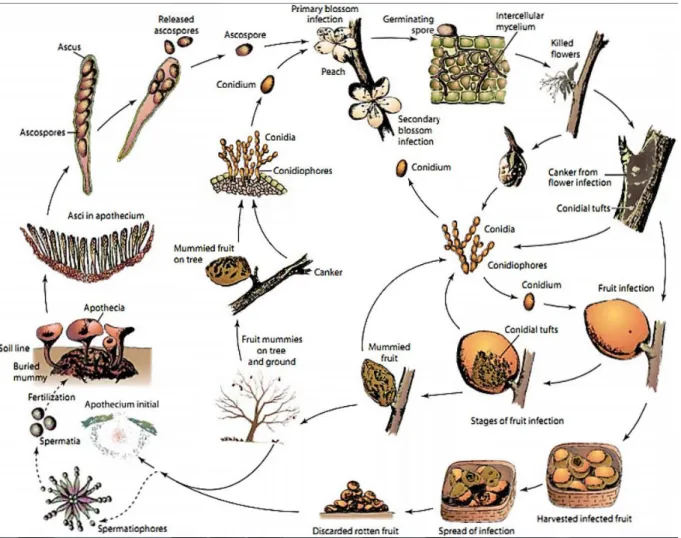
Il y a deux phases d’infection, la phase d’infection des fleurs et la phase de pourriture des fruits (Villarino et al, 2012). Au printemps, les premières sources d’inoculum sont les momies de fruit ayant
hiverné sur l’arbre et produisant les structures asexuées (sporodochies) contenant les conidies, ou bien les momies tombées au sol qui produisent, elles, les structures sexuées (apothécies) à l’origine d’autres spores, les ascospores. Les spores sont transportées par le vent et la pluie jusqu’à de nouveaux hôtes sensibles et vont ensuite germer sous des conditions favorables. Les fleurs infectées ne tombent pas et l’infection se propage à travers le pédoncule et continue jusqu’au rameau. Cette infection provoque l’apparition de chancre sur les rameaux. C’est dans les tissus infectés que se forment les conidies qui serviront d’inoculum secondaire pour l’infection des fruits. L’infection sur des fruits immatures peut aussi engendrer la formation de conidies et donc créer un inoculum supplémentaire (figure 11) (Lino et al, 2016). L’infection peut démarrer seulement en présence d’eau ce qui provoque la germination des conidies. La pénétration du mycélium se fait grâce à une blessure du fruit ou au contact d’un organe attaqué (Lichou et Jay, 2012).
d. Les méthodes de lutte
Le contrôle des monilias peut être envisagé par le contrôle chimique, les pratiques culturales et la création de variétés résistantes. Les pratiques culturales peuvent être menées de manière à créer des conditions favorables pour la plante et défavorable pour le pathogène (Hrustić et al, 2012). De plus, afin d’éviter les dommages sur les cultures, la maladie est contrôlée par méthode chimique, l’application de fongicide est nécessaire afin de limiter les dégâts en saison humide (Lino et al, 2016). Plusieurs fongicides sont disponibles permettant de prévenir ou de réduire l’impact de la maladie (Guinet et al, 2016). Mais dans le but d’atteindre une durabilité des cultures fruitières et comme certaines souches du champignon sont résistantes aux fongicides (en effet, des résistances à certaines molécules de ces produits ont été observées chez M.fructicola ce qui rend le contrôle chimique pour cette maladie plus difficile), la recherche de stratégies alternatives incluant l’épidémiologie et la lutte intégrée devient pertinente (Guinet et al, 2016). A plus long terme, des efforts importants ont été investis dans la caractérisation et l’amélioration de la résistance au monilia par la création de nouvelles variétés (Lino et al, 2016).
Aujourd’hui, les variétés cultivées sont plus ou moins sensibles au monilia. Il existe peu de source de résistance chez les fruits à noyau. C’est pourquoi ce caractère est devenu l’un des objectifs majeurs dans les programmes d’amélioration pour les cerises, abricots, prunes et pêches dans différents pays (Lino et al, 2016). Des études montrent une grande variation dans la résistance au monilia, ce qui suggère que de nombreux gènes sont impliqués et donc que la résistance au monilia peut être considérée comme un caractère quantitatif, polygénique (Martinez-Garcia et al, 2013). Plusieurs QTLs ont été identifiés comme pouvant être associés à la résistance au monilia chez la pêche par Martinez-Garcia et al (2013). Deux de ces QTLs pourraient être impliqués dans la reconnaissance de M.fructicola chez la pêche et activant à la fois une réponse immunitaire declenchée par PAMPs et par des effecteurs (Rungjindamai et al, 2014).
3. Des maladies secondaires mais non négligeables
a. La rouille
La rouille est une maladie d’importance économique secondaire mais dans certaines conditions elle peut entrainer une défoliation grave des arbres qui est préjudiciable a minima pour l’induction florale
Figure 12 : Symptômes de rouille sur feuilles (Guy Clauzel)
de l’année suivante et, elle peut provoquer une baisse de la qualité des fruits bien qu’elle ne s’y attaque pas directement (Lichou et Jay, 2012).
Les symptômes de cette maladie (figure 12) se caractérisent par l’apparition de pustules brunes sur la face inférieure des feuilles et de décoloration jaunes ou orangées sur la face supérieure. Ces symptômes se manifestent généralement à partir de fin Juin. La rouille entraine une chute précoce des feuilles commençant par le sommet de l’arbre ce qui gêne la bonne reconstitution des réserves de la plante et engendre donc des baisses de rendements l’année suivante. Enfin, en cas de forte attaque, cela peut entrainer une perturbation de l’aoutement du bois et de la qualité des bourgeons (Lichou et Jay, 2012).
La rouille est une maladie cryptogamique provoquée par deux champignons basidiomycètes appartenant au genre tranzschelia, T. discolor et T. pruni-spinosae (Brun et al, 2011).
Tranzschelia discolor est un pathogène fongique attaquant les plantes du genre Prunus (amande,
abricot, cerise, pêche, prune …) et plus particulièrement les amandes, pêches et prunes (Adaskaveg
et al, 2000). Tranzschelia pruni-spinosae est présent dans de nombreux pays dans le monde comme
les Etats-Unis, l’Angleterre, la France, l’Italie, l’Espagne, l’Afrique du Sud, la Chine, le Japon ou encore l’Australie (Jafar, 1958).
Ces champignons sont des champignons hétéroïques, ils complètent leur cycle de vie dans deux hôtes différents, l’anémone et l’arbre (figure 13). La conservation du pathogène sur l’hôte écidien (l’anémone) se fait par le mycélium dans les bourgeons du rhizome de l’anémone. Au début du printemps, le mycélium s’étend dans le limbe et produit des spermogonies qui, après diploïdisation formeront des écidies. Les écidies, qui se développent sur la face inférieure des feuilles, forment ensuite les écidiospores. Ces nouvelles spores ne sont pas capables de germer sur les anémones et vont alors infecter les arbres du genre Prunus en étant disséminées par le vent. La période critique de contamination est comprise entre mai et juin et l’infection est favorisée par les pluies. Les écidiospores sont ensuite à l’origine de la formation de nouvelles spores, les urédospores, qui propagent la maladie par générations successives, et les téleutospores qui vont hiverner et germeront au printemps suivant pour former les basidiospores. Ces basidiospores ne sont plus capables de germer sur les Prunus et vont donc infecter les anémones sur lesquelles elles provoquent la formation de nouvelles écidiospores pour un nouveau cycle d’infection (Lichou et Jay, 2012 ; Jafar, 1958 ; Ephytia).
Si l’attaque de Tranzschelia se produit plusieurs années de suite sur le même arbre, cela l’affaiblit et celui-ci devient plus sensible aux pourridiés.
b. La tavelure
La tavelure noire du pêcher est une maladie secondaire chez l’abricot mais elle peut être considérée comme une maladie majeure sous certaines conditions climatiques humides au printemps (Lichou et Jay, 2012).
Figure 14 : Symptômes de tavelure sur abricot (Guy Clauzel)
Les symptômes de la maladie (figure 14) sont des taches grisâtres ou noires arrondies sur les deux faces des feuilles. Sur les rameaux de l’année des taches superficielles rougeâtres apparaissent puis deviennent noires pendant l’hiver. Il peut aussi y avoir un dessèchement des jeunes rameaux. De petites taches circulaires rouges ou noires apparaissent aussi sur les fruits pouvant conduire au craquellement de l’épiderme. Le fruit murit mal et présente des galles pouvant être colonisées par des champignons secondaires (Lichou et Jay, 2012).
Le champignon à l’origine de la maladie peut être trouvé sous deux formes : une forme conidienne connue sous le nom de Fusicladium carpophilum oudemans et une forme sexuée, plutôt rare, Venturia carpophila E.E Fisher (Lichou et Jay, 2012).
La maladie causée par la forme sexuée Venturia carpophila a eu une importance économique considérable dans une partie de l’Australie et en Afrique du sud dans les régions avec des pluies estivales importantes (Fisher, 1961).
Pendant l’hiver, le champignon reste à l’état de mycélium dans les chancres des rameaux de l’année puis, au printemps, il y a formation de conidies hyalines dès le début de la végétation propageant la maladie sur fruits. Les taches sur fruits produisent à leur tour des spores qui vont aller contaminer d’autres fruits et rameaux (Lichou et Jay, 2012 ).
c. L’oïdium
L’oïdium provoque sur les fruits, un mois après la floraison, l’apparition de taches blanchâtres pouvant être auréolées de rouge (figure 15). Ces taches sont légèrement en relief et se trouvent principalement sur la face ensoleillée du fruit. Si le fruit est attaqué tôt, il peut se déformer, se craqueler et chuter.
Sur feuilles, les attaques sont plus tardives et moins fréquentes. Elles provoquent une ondulation du limbe et l’apparition de taches blanchâtres arrondies, sur la face supérieure au début, puis elles s’étendent rapidement sur tout le limbe. La feuille devient sèche, cassante et tombe prématurément (Lichou et Jay, 2012).
La maladie peut être provoquée par deux champignons : Podosphaera tridactyla et Sphaerotheca pannosa (Lichou et Jay, 2012).
Le genre Podosphaera appartient à la famille des Cystoyheceae et est séparé en deux sections, Podosphaera et Sphaerotheca contenant respectivement Podosphaera tridactyla et Sphaerotheca pannosa. Ces deux clades attaquent principalement des plantes ligneuses appartenant à la famille des rosacées (Takamatsu et al, 2010).
Podosphaera tridactyla est un champignon ascomycètes attaquant les Prunus dans une majeure partie de la planète (Cunnington et al, 2005).
La contamination des abricotiers par l’oïdium du pêcher Sphaerotheca pannosa se fait au printemps, soit à partir de pêcher malade, soit à partir d’abricotiers atteints d’enroulement chlorotique de l’abricotier (ECA) présentant un dérèglement végétatif.
Les attaques sur feuilles se produisant en été sont dues à Podosphaera tridactyla. En hiver il reste sous forme de périthèces apparaissant sur les feuilles avant la chute, c’est la forme sexuée du
Figure 16 : Parent de la population BerBa. A gauche : variété Bergeron, A droite : variété Bakour
champignon, ou sous forme de filaments mycéliens (très fréquent pour les arbres atteints d’ECA). Les conidies perdent leur faculté germinative en milieu liquide (pluies) (Lichou et Jay, 2012 ).
d. Intérêt de l’étude de ces maladies secondaires
Ces trois maladies sont des maladies secondaires de l’abricotier, cependant elles peuvent avoir des conséquences graves sur la production dans certaines conditions climatiques favorables au développement de la maladie. De plus, les seuls moyens de lutte connue contre ces maladies sont la lutte chimique par fongicide et les mesures prophylactiques et aucune étude sur la résistance génétique de ces maladies chez l’abricotier n’a pour le moment été conduite. Enfin, dans un objectif de réduction de l’utilisation des produits phytosanitaires, il a été observé que ces maladies apparaissent de nouveau lorsque la protection par fongicide est allégée ; il est donc nécessaire de trouver des résistances génétiques au sein de l’espèce pour éviter un développement important de ces maladies en culture sous faibles niveaux d’intrants. Matériel et méthodes
II. Matériel et méthodes
1. Matériel végétal
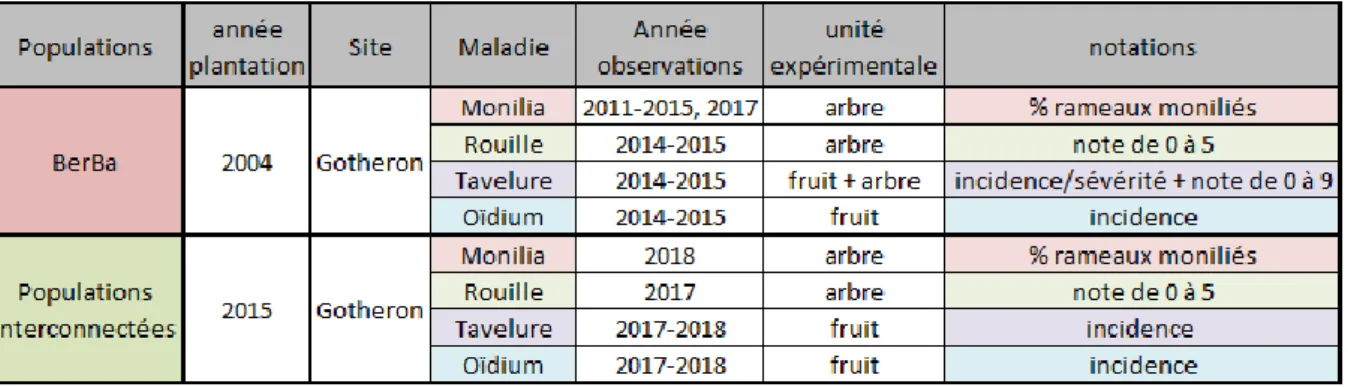
Quatre populations biparentales ont été mobilisées dans le cadre de notre étude.
Population BerBa
La population Berba est une population biparentale issue du croisement entre la variété Bergeron et la variété Bakour (figure 16). Initialement créée pour l’étude de la résistance au chancre bactérien, Bergeron étant sensible à la maladie mais avec de bonnes qualités agronomiques, et Bakour présentant une résistance en verger et un niveau agronomiques très faible. La population initiale était constituée de 336 hybrides plantés en 2004. Son observation a permis de mettre en évidence d’autres caractères en ségrégation comme la sensibilité au monilia, à la rouille, à l’oïdium et à la tavelure.
Population interconnectée
Les trois populations dites « interconnectées » résultent du croisement de 3 présélections issues de la population BerBa (hybrides C092, C109 et D099), choisies pour leur tolérance au chancre bactérien, et au monilia avec un hybride d’intérêt (figure 17) apportant la résistance à la sharka et l’autofertilité (A4049). Elles ont été mise en place en 2015 dans les mêmes conditions que la population initiale. Elles sont composées respectivement de 111, 119 et 77 individus.
2. Dispositif expérimental
Les populations biparentales mobilisées dans notre étude sont implantées sur le site de l’UERI INRA de Gotheron situé à Saint-Marcel-Lès-Valence dans la Drôme. Les arbres sont regroupés par croisement à des écartements de 5 x 1 m et plantés sur leurs propres racines.
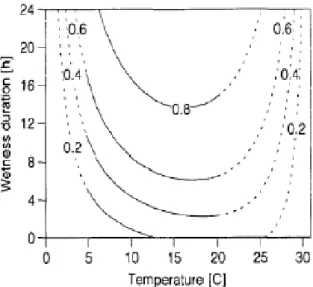
Figure 18 : Courbes de risque du Monilia sur fleur de cerisier en fonction de la durée d’humectation et de la température (Tamm et al, 1995)
Les suivis individualisés des arbres en verger ont porté
- sur la sensibilité en verger en conditions naturelles d’infection au monilia, à la rouille, à la tavelure et à l’oïdium
- ainsi que sur la phénologie des matériels et plus particulièrement les périodes de floraison, et de maturité.
Ils ont été réalisés sur plusieurs années en respectant le protocole d’observation établi ci-après.
Dans le cas de la sensibilité au monilia sur fleurs, les données ont été complétées cette année par une expérimentation conduite en conditions contrôlées dans le cadre d’un projet conduit en partenariat avec l’Agroscope à Conthey en Suisse (protocole en Annexe).
3. Notations
Monilia sur fleursPour chaque arbre, la maladie est évaluée en relevant le pourcentage de rameaux à fleurs desséchés par le monilia par rapport à l’ensemble des rameaux à fleurs de l’arbre. Les observations sont effectuées un mois après la floraison afin que tous les symptômes de monilioses sur rameaux se soient développés. Ces observations ont été réalisées en 2011, 2012, 2013, 2014, 2015 et 2017 pour la BerBa et en 2018, première année de floraison, pour les populations interconnectées.
La floribondité a été estimée sur une échelle allant de 0 à 4 ; la note 0 correspond à un faible nombre de fleurs (10 fleurs par mètre linéaire de rameau) et la note 4 à un nombre très important de fleurs (50 fleurs par mètre linéaire de rameau).
Les données de température et d’humectation ont été relevées du fait de la forte influence des conditions climatiques sur l’infection au monilia sur fleurs. Elles sont issues de la station météorologique du domaine située à moins de 500 mètres de la parcelle d’étude. Elles ont permis de calculer des risques de contamination sur fleurs pour les individus de la population BerBa selon la formule établie par Tamm et al (1995) sur Cerisier et ajustée à l’abricotier par D. Dam (2017). La notion de risque traduit le pourcentage de fleurs maximal pouvant être atteint par les monilioses dans des conditions d’humidité et température données.
=
Avec T la température moyenne en période humectée et DH la durée d’humectation (h).
Le risque affecté à chaque arbre est égal à la somme des risques cumulés sur la période de floraison (stade F à G (stade phénologique en annexe)). Si les périodes d’humectation sont séparées par moins de 4h non humectées, un seul risque est considéré, sinon les risques sont estimés puis additionnés. Ce risque calculé grâce à la formule de Tamm est noté Rcalc. Du fait de la sous-estimation de la durée d’humectation, décrite dans la publication (Tamm et al, 1995), une deuxième estimation des risques a été réalisée de manière graphique à l’aide des courbes (figure 18) rehaussées de 4h. Ce nouveau risque estimé graphiquement est noté Rest.
Ces risques de contamination ont été utilisés dans l’élaboration d’un modèle d’infection de la maladie permettant de prendre en compte l’influence des conditions climatiques sur l’expression de la maladie. Ce modèle sera présenté ultérieurement.
Rouille
Les notations de sensibilité à la rouille se font en fonction du développement de la maladie. Si l’attaque est précoce et forte, les notations sont réalisées dès le mois de juillet en estimant la densité de pustules de rouille sous les limbes (échelle de notation 1). Sinon elles ont lieu à l’automne (septembre, octobre) en comptabilisant la densité de pustules et/ou le pourcentage de feuilles chutées (échelle de notation 2) selon la gravité de l’attaque. Ces notations visuelles ont été réalisées arbre par arbre.
Echelle de notation 1 :
Note Pourcentage de feuilles présentant des pustules de rouille
0 Aucun symptôme de rouille observé
1 ≤ à 10% 2 >10% et ≤30% 3 >30% et ≤60% 4 >60% et ≤80% 5 >80% Echelle de notation 2 :
Note Pourcentage de feuilles chutées à cause de la rouille
0 Aucune chute 1 ≤ à 10% de chute 2 >10% et ≤30% 3 >30% et ≤60% 4 >60% et ≤80% 5 >80% de chute
Les observations ont été réalisées en 2014 et en 2015 pour la population BerBa et en 2017 pour les populations interconnectées.
Tavelure
Pour la tavelure, cinquante fruits proches de la maturité ont été prélevés sur chaque arbre. Le pourcentage de fruits atteints pour chaque arbre est calculé et la sévérité de la maladie sur chaque fruit est estimée par une note allant de 0 à 3 (voir échelle de sévérité en annexe). Une moyenne de ces notes de sévérité (sevtot = Σsévérité /nb de fruits) et une intensité (sevtav = Σsévérité /nb de fruits tavelés) de la maladie sont calculées pour chaque génotype. Ces observations ont été réalisées en 2014 et 2015 pour la BerBa et en 2017 et 2018 pour les populations interconnectées.
De plus en 2010, 2014 et 2015, sur la BerBa, une deuxième notation a été effectuée sur arbre directement en verger en estimant la part de fruits contaminé sur une échelle de 1 à 9 (1=pas de tavelure et 9=presque tous les fruits tavelés) selon l’échelle du tableau 1.
Oïdium
La notation de sensibilité à l’oïdium se fait sur les mêmes fruits que ceux prélevés pour les notations tavelure. La notation consiste à calculer le pourcentage de fruits atteints par la maladie.
Ces observations ont été réalisées en 2014 et 2015 pour la BerBa et en 2017 et 2018 pour les populations interconnectées.
Tableau 2 : résumé des notations effectuées pour les différentes maladies étudiées
4. Génotypage
Population BerBa218 individus génotypés ont contribué à la construction d’une carte de type père-mère à l’aide de 149 SNP développés sur la carte génétique de Bakour et 139 SNP sur la carte génétique de Bergeron. Les deux cartes génétiques ne couvrent pas les 8 groupes de liaison attendus et comportent respectivement 10 et 11 groupes de liaisons chez Bakour et Bergeron. La difficulté d’identification de SNP polymorphes au sein de la population notamment liée à la forte homozygotie des deux parents sur certaines portions du génome, conduit à la séparation de chromosomes en plusieurs groupes de liaison.
Les deux cartes génétiques ont été établies avec JoinMap 4.0 en considérant une répartition en différents groupes de liaison selon un critère de LOD d’indépendance>3. L’agencement des marqueurs sur chaque groupe de liaison s’est fait à l’aide d’une régression en considérant une fréquence de recombinaison maximale à 0.40 et un LOD supérieur à 1. Les distances génétiques ont été calculées en Kosambi.
Populations interconnectées
Pour les populations interconnectées de 2ème génération, les cartes individuelles ont été réalisées de la même manière. Une carte consensus a ensuite été élaborée à l’aide de Joinmap en connectant les cartes entre elles, à l’aide des marqueurs ponts (marqueurs recombinants sur au moins deux des trois populations). Cette carte comporte à l’état actuel 162 marqueurs répartis sur les 8 chromosomes.
5. Traitement statistique des données
Toutes les données sont traitées grâce au logiciel R.Pour la population BerBa, l’analyse de liaison a été réalisée grâce au package « qtl » du logiciel R. Trois méthodes différentes ont été testées : la méthode « mr », la méthode « em » et la méthode
Figure 19 : Répartition moyenne des hybrides de la population BerBa selon la sensibilité observée pour les quatre maladies étudiées : monilia (a), oïdium (b), rouille (c), tavelure sur fruit (d), tavelure sur arbre (e). (Moyennes sur les
différentes années de mesures, les variables ont été transformées de manière à normaliser les résidus)
Figure 20 : étendue de la variabilité interannuelle de la sensibilité au monilia (a) et du risque estimé Rest (b) au sein de la population BerBa.
« imp » qui ont permis de réaliser la cartographie d’intervalles des QTLs par les méthodes simple (SIM) et composite (CIM). Les LOD seuils ont été estimés par permutations (500 simulations).
Dans le cas des données de sensibilité au monilia, l’analyse de liaison a été réalisée sur les données brutes et sur les données modélisées, à la fois sur les données annualisées, sur les données moyennes et sur l’ensemble des années significatives étudiées. Pour toutes les autres variables étudiées (rouille, tavelure et oïdium), nous étudierons les données brutes annualisées, sur les moyennes des années et sur l’ensemble des années significatives étudiées.
Pour les populations interconnectées, l’utilisation de R/qtl est à éviter car trop limitante. En effet, au vu de la structuration de cette population multi-parentale très apparentée, cette méthode de cartographie ne permet pas de prendre en compte le fait que ces populations peuvent être connectées. Le logiciel MCQTL a donc été mobilisé en collaboration avec l’Unité MIA de Toulouse, un script R a été développé dans le cadre de la Thèse de Mariem Omrani au laboratoire et mobilisé pour d’autres variables sur les mêmes populations dans le cadre de ce travail. Il a permis de tester les deux hypothèses « populations connectées » ou « populations déconnectées », selon que l’apparentement est pris en compte ou non. Pour chacune de ces deux hypothèses, quatre modèles ont été testés :
- Modèle additif (A4049 avec même allèle ou 2 allèles différents mais même effet) - Modèle additif (A4049 avec 2 allèles différents influants)
- Modèle additif + dominance (A4049 avec même allèle ou 2 allèles différents mais même effet)
- Modèle additif + dominance (A4049 avec 2 allèles différents influants) Les LOD seuils ont été estimés par permutations suite à 1000 simulations.
III. Résultats
1. Analyse des données phénotypiques
Population biparentale BerBaLes données de sensibilité aux maladies observées sur la population BerBa sont quantitatives. Leurs distributions, dans la plupart des cas éloignées de distributions normales, ont exigé des transformations de type racine carrée ou logarithmiques afin de se rapprocher des hypothèses de normalité des résidus attendues tant pour les analyses de variances que pour les analyses de liaison (Figure 19).
- Monilia
La Figure 20 traduit une forte variabilité de sensibilité au monilia en fonction des hybrides constituant la population « BerBa » et des années d’observation sur les mêmes individus. Cette variabilité rend compte d’un effet génétique et d’un effet année qui est lié aux conditions climatiques (humidité notamment) au moment de la floraison de chacun des clones. On peut ainsi observer la fluctuation de la contamination par le monilia en fonction des années. Une analyse de variance en
Figure 21 : Relation entre la notation de sensibilité au monilia sur les hybrides de la population BerBa et les valeurs de risque estimés pour chacun des clones établis annuellement sur la base de leur date de floraison
Figure 22 : Etendue de la diversité observée au sein de la population Biparentale BerBa pour la sensibilité à la rouille (a), la Tavelure (b) et à l’oïdium (c) pour les années 2014 et 2015.
fonction de l'année montre que l’effet année est significatif (p-value=10-16) même si la part de la variance expliquée par l’année reste faible (R2=0.08). On peut donc penser qu’une grande partie de la variabilité correspond à l’effet génétique et/ou à l’effet d’interaction génotype x année qui est notamment lié au fait que tous les clones de la population ne fleurissent pas au même moment et donc ne sont pas confrontés au même niveau de risque.
Pour intégrer cette notion de risque individualisé nous avons représenté en figure 20 la variabilité des jeux de données brutes et des risques associés issus du modèle de Tamm (1995) présenté précédemment (partie II.3).
Les deux types de risques (Rcalc et Rest) étant corrélés (r2 = 0.74), nous avons choisi de travailler avec le risque estimé qui permet de maximiser l’effet génétique pour la sensibilité au monilia. La Figure 21 rend compte de la relation entre sensibilité au monilia et niveau de risque estimé), on remarque qu’un risque élevé permet de bien séparer les individus sensibles des individus résistants ce qui est moins évident lorsque le risque est faible car la plupart des individus sont peu infectés par la maladie qu’ils soient résistants ou sensibles.
Du fait de la relation entre la sensibilité observée au monilia et le risque estimé (figure 21), un ajustement à une courbe de type exponentielle négative a été privilégié : l’équation résultant de cet ajustement s’écrit comme suit : M(Rest) = α(1-exp(-βRest)), avec M (note de sensibilité au monilia) et Rest (risque estimé).
Si nous posons α=100, faisant ainsi l’hypothèse que pour un inoculum saturant, il n’existe pas de résistance totale à la maladie (ce que nous avons pu vérifier avec le géniteur de résistance Bakour). On obtient alors la formule M(Rest)=100*(1exp(βRest)) ce qui nous conduit à l’équation suivante : -log((100-M(Rest))/100)=βRest. Cette équation correspond à l’équation d’une régression passant par 0. Si nous régressons les données observées selon cette transformation en fonction du risque estimé, nous allons alors gommer le risque climatique, et les résidus vont porter le facteur génétique que nous désirons estimer et sur lesquels nous mettrons en œuvre l’analyse de liaison. Selon cette régression, le modèle mis en œuvre explique environ 14% de la variabilité observée sur la variable monilia. Il reste donc une part importante de cette variabilité qui devrait être expliquée par l’effet génétique que nous allons caractériser dans l’analyse de liaison.
- Rouille, tavelure, oïdium
Sur la figure 22 sont représentés les boxplots des autres maladies en fonction des années d’observation (2014 et 2015). La variabilité des caractères est plutôt bien représentée en ce qui concerne la rouille et la tavelure, pour l’oïdium, la variabilité est moins bien représentée du fait de valeur de contamination observée faible notamment en 2015. On observe que pour la rouille et l’oïdium, l’attaque a été beaucoup plus forte en 2014 contrairement à la tavelure pour laquelle les arbres ont été plus touchés en moyenne sur l’année 2015. Cet effet « année » est significatif pour chacune des maladies. Pour l’oïdium, la part de variance expliquée par l’effet année est relativement forte (33%). Elle reste faible pour les autres maladies (rouille : 3%, tavelure sur fruit : 12,5%, tavelure sur arbre : 6%). L’effet génétique est également significatif pour chacune de ces maladies, il explique une grande part de la variabilité observée, une diversité génétique intéressante est donc disponible pour étudier ces effets et potentiellement exploitable en sélection.
Figure 23 : Etendue des distributions observées au sein des 3 populations bi-parentales interconnectées regroupées pour les variables de sensibilité au monilia (a), à la rouille (b), à la chute des feuilles due à la rouille (c), à la tavelure (d) et à
l’oïdium (e). (Données issues de moyennes des années 2017 et 2018)
Figure 24 : Etendue de la variabilité phénotypique observée au sein des 3 populations biparentales interconnectées étudiées conjointement pour la sensibilité au monilia observée en 2018 (a), à la rouille et chute de feuille due à la rouille
Populations interconnectées
Sur la figure 23, on peut voir les distributions des variables dans le cas des populations interconnectées. Ces distributions s’éloignent de distributions normales attendues du fait principalement de nombreuses données ayant des valeurs nulles. Des transformations de ces variables ont été appliquées lorsqu’elles étaient utiles mais on garde toujours des distributions très éloignées de la normalité.
Figure 24 nous observons une moindre variabilité phénotypique notamment pour le monilia et la tavelure pour lesquels la grande majorité des individus ont des valeurs de contamination nulle. Ceci est dû au fait que pour les années 2017 et 2018, la pression de ces maladies a été moins importante. On peut aussi prendre en compte le fait que ces populations ont été plantées récemment ce qui fait que la présence d’inoculum permettant le développement des maladies est aussi moins importante dans le verger. On observe tout de même une certaine variabilité sur les variables oïdium et rouille avec un effet année significatif pour l’oïdium expliquant 33% de la variabilité.
2. Analyses de liaison mise en œuvre sur la population biparentale Berba
Monilia (Figure 25)Sur la carte génétique de Bakour, plusieurs QTLs ont été mis en évidence sur les données traitées année par année.
- En 2011, un QTL ressort sur le groupe de liaison 3 à la position 59,7, avec un LOD score de 4,77 pour les données brutes. Ce QTL est présent également pour les données modélisées à une position proche de ce dernier.
- En 2012 (données brutes et modélisées), un QTL est présent sur le groupe de liaison 7 (il apparait aussi en 2013 et 2014 sur le jeu des données brutes). Mais les positions de ce QTL ne sont pas stables et varient entre les positions 6 et 86,9.
- En 2012, sur les données brutes, un QTL mis en évidence sur le groupe de liaison 6 est à la position 125,3 avec un LOD de 2,73.
- Enfin, sur les données moyennes sur les années 2011-2017, aucun QTL ne ressort. Cependant, on observe qu’en regroupant toutes les années, une grande partie des arbres n’ont pas été confronté au risque, l’effet environnemental de chaque arbre devient prépondérant et ne permet pas d’estimer l’effet génétique. En effet, il est difficile de séparer les individus sensibles des individus résistants car ils ont peu de chance d’être contaminés. De plus ces données ont un poids important dans l’analyse car très représentées et biaisent les résultats de l’analyse. Une deuxième analyse a donc été réalisée en supprimant les données de monilia dont la note est nulle ou très faible pour des risques de contamination nul ou très faible également. Après cette deuxième analyse, le même QTL que pour 2012 sur le groupe de liaison 6 ressort à la même position.
Les effets observés sur le groupe de liaison 7 ne sont pas stables selon les années ce qui explique que l’on ne retrouve pas ce QTL lorsqu’on analyse les données moyennes entre 2011 et 2017.
Figure 25 : Représentation graphique des QTLs observés pour la sensibilité au monilia sur les deux cartes génétiques des parents Bakour (a et b) et Bergeron (c et d) en utilisant les méthodes SIM et CIM
Figure 26 : Représentation graphique des QTLs observés pour la sensibilité à la rouille sur les deux cartes génétiques des parents Bakour (a) et Bergeron (b) en utilisant les méthodes SIM et CIM
- Un QTL ressort particulièrement sur plusieurs années. Il est localisé sur le GL1 à la position 41 à la fois en 2011 (données brutes), en 2012 (données brutes et modélisées) et pour les données brutes moyennes de 2011 à 2017.
- En 2012, deux QTLs ressortent aussi sur le GL2 et le GL3.
- Un second QTL est présent sur le GL6 pour 2011-2017 à la position 56,3 avec un LOD de 2,49. Rouille (Figure 26)
Sur la carte de Bakour, un QTL a été mis en évidence sur le GL 4 en 2015 et sur la moyenne 2014-2015 aux positions 129 et 127 respectivement. En 2014-2015, deux autres QTL ont été identifiés sur les GL 6 et 3.
Sur la carte de Bergeron, un QTL ressort également sur le GL4 pour 2015 et 2014-2015 à la position 49. Pour l’année 2015, trois autres QTLs sont présents sur les groupes de liaison 5, 6 et 7.
Oïdium (Figure 27)
Sur la carte de Bakour, un QTL sur le GL7 est présent à la fois en 2014, 2015 et 2014-2015 mais les positions respectives varient. Pour 2014 et 2014-2015, un deuxième QTL a été identifié sur le GL 6 aux positions 82 et 81 respectivement.
Sur la carte de Bergeron, un seul QTL a été identifié pour 2014 et 2014-2015 sur le groupe de liaison 1 à la position 0. Cette position en bordure de chromosome par une méthode de cartographie par intervalle est assez discutable et devra être regardé plus finement. Si on réalise l’analyse en régression marqueur par marqueur, ce QTL est présent en 2014.
Tavelure (Figure 28)
Sur la carte de Bakour, aucun QTL n’a été identifié en lien avec la résistance à la tavelure. Mais une tendance semble apparaitre à la fois sur les données de tavelure sur fruits (Tav2014-2015) et de tavelure sur arbre (TavArbre2010-2015) sur le GL2 qui demanderait à être confirmée.
Sur la carte de Bergeron, un QTL ressort pour les données de tavelure sur arbre en 2014 situé sur le GL 5 à la position 49,9 avec un LOD de 3,10. Puis on retrouve une tendance pour le GL 2 à plusieurs reprises.
Figure 27 : Représentation graphique des QTLs observés pour la sensibilité à l’oïdium sur les deux cartes génétiques des parents Bakour (a) et Bergeron (b) en utilisant les méthodes SIM et CIM
Figure 28 : Représentation graphique des QTLs observés pour la sensibilité à la tavelure (notation sur arbre) sur la carte génétique du parent Bergeron.
Tableau 3 : Synthèse des résultats obtenus dans le cadre des analyses de liaison sur la population biparentale BerBa pour les sensibilités au monilia, à la rouille, à l’oïdium et à la tavelure observées en verger. Les parents Bakour et Bergeron étant des clones hétérozygotes les QTLs sont positionnés sur les cartes génétiques établies pour chacun des parents
3. Analyse de liaison sur les populations interconnectées
Concernant les populations interconnectées, trois QTLs ont été identifiés.Un premier QTL est présent sur le GL4 pour la sensibilité au monilia. Ce QTL existe à la fois dans l’hypothèse de populations déconnectées ou connectées pour des positions proches (55,3 et 58,45 respectivement).
En ce qui concerne l’oïdium, on détecte un QTL sur le GL7 pour l’année 2017. Ce QTL est situé à la position 127,1. Il est significatif sous l’hypothèse considérant que les 3 populations sont connectées
Figure 29 : Représentation graphique des QTLs observés pour la sensibilité au monilia chez les populations interconnectées
Figure 30 : Représentation graphique des QTLs observés pour la sensibilité à l’oïdium chez les populations interconnectées
Figure 31 : Représsentation graphique des QTLs observés pour la sensibilité à la tavelure chez les populations interconnectées
ce qui signifie que ces populations sont liées et quelles peuvent être considérée comme une seule et même population.
Le troisième QTL concerne la notation pour la tavelure de l’année 2018. Il est situé sur le GL1 à la position 0, ce QTL étant positionné en bout de chromosome, son existence réelle n’est pas sûre et devra être vérifiée. C’est à nouveau l’hypothèse d’une population connectée qui est significative pour cette analyse.
Tableau 4 : Représentation synthétique des QTLs observés dans le cadre des populations biparentales interconnectées
Pour chacun des QTLs identifiés, le meilleur modèle se révèle être le premier modèle qui correspond au modèle additif sans dominance avec même allèle ou deux allèles à même effet pour le parent A4049.
Aucun QTL n’a été identifié pour la rouille.
Le QTL identifié pour le monilia n’était pas présent lors de l’analyse de liaison de la population biparentale BerBa tout comme celui identifié pour la tavelure. Par contre le QTL identifié ici pour l’oïdium est sur le même groupe de liaison que l’un des QTL précédemment mis en évidence pour cette même maladie.
Cependant on observe pour cette analyse que les pourcentages de variances expliquées par les QTLs identifiés sont relativement faibles (2,23%, 3,62%, 3.51% et 2,34%).
IV. Discussion
1. Réponse aux objectifs de travail et perspective d’évolution
L’analyse phénotypique nous a permis de vérifier qu’une variabilité génétique est présente dans nos populations pour chacune des variables étudiées. Il est donc potentiellement envisageable de contrôler cette diversité et d’étudier les composantes génétiques de la résistance aux différentes maladies. Cette variabilité est particulièrement importante dans la population BerBa pour laquelle les niveaux de sensibilité diffèrent selon les individus ; on a pu observer des individus ayant une bonne résistance aux maladies contrairement à d’autres très sensibles. La variabilité présente chez les populations interconnectées est moins importante. Cela s’explique en grande partie par le fait que ces populations dérivent de présélections issues de la population BerBa présentant des tolérances particulières aux différentes maladies étudiées. Cependant, ces populations, complémentaires de la BerBa, permettent de faire ressortir des caractères récessifs masqués dans la population BerBa issue
d’individus de phylum différents et présentant une forte homozygotie donc proches d’une population F1.
L’analyse de liaison sur les deux types de populations nous a permis d’identifier différentes zones du génome impliquées dans la résistance aux différentes maladies étudiées. Certains des QTLs ressortant de ces analyses sont stables sur plusieurs années avec des pourcentages de variance expliquée assez importants comme notamment ceux des GL 6 et 7 pour le monilia et pour l’oïdium, et ceux des GL 4 et 7 pour la rouille. Ces QTLs « généralistes » pourraient servir de point d’appui pour des travaux destinés à identifier les gènes candidats sous-jacents et à engager des approches de sélection assistées par marqueurs.
Le GL1 ressort également régulièrement pour la résistance au monilia mais avec des parts de variance expliquée relativement faible dans la population BerBa et dans les populations interconnectées.
Les autres QTLs ressortant seulement sur une année tels que le GL3 et le GL4 pour le monilia, le GL6 pour la rouille ou encore le GL5 pour la tavelure témoignent peut-être de mécanismes différents dont les composantes génétiques s’exprimeraient sous certaines conditions « climatiques » notamment ; ce qui expliquerait que les QTLs n’apparaissent pas chaque année. Etant donné que nous sommes, pour chacune de ces maladies, dans des cas de résistance partielle et non de résistance totale, il est important de prendre en compte ces composantes génétiques également pour pouvoir cumuler le maximum de facteurs de résistance.
L’analyse des populations interconnectées a permis de mettre en évidence des QTLs nouveaux par rapport à l’analyse de liaison sur la population BerBa tel que le GL4 pour le monilia. On peut penser que le caractère sous-jacent à ce QTL est un caractère de type récessif et n’était donc pas visible dans la population BerBa. Le QTL sur le GL7 pour l’oïdium sur la population BerBa a, au contraire, été confirmé par l’analyse sur les populations interconnectées.
Aucune analyse n’avait jusqu’alors été réalisée pour étudier la résistance au monilia sur fleurs, ni sur abricotier, ni sur pêcher (génome de référence pour les prunus), le pêcher n’étant pas sensible au monilia sur fleurs mais plus particulièrement sensible au monilia sur fruits. Des analyses ont cependant été réalisées pour étudier la résistance au monilia sur fruits chez la pêche et ont conduit à la mise en évidence d’un QTL positionné sur le GL1 associé à un gène d’intérêt induisant la reconnaissance de monilia fructicola en activant à la fois une réponse immunitaire par PAMPs et par des effecteurs (Martinez-Garcia et al, 2013).
En ce qui concerne l’oïdium, des QTLs de résistance ont été trouvé sur pêcher où une résistance monogénique avait été identifiée(GL8) mais ils ne correspondent pas aux régions identifiées dans notre étude. Par contre sur l’espèce Prunus davidiana (espèce botanique proche du pêcher) une région sur le GL6 a été identifiée comme portant une résistance partielle à cette maladie.
Chez les Prunus, aucune étude de recherche QTL n’a été conduite sur la rouille et la tavelure. Cependant des études existent pour la tavelure chez le pommier. Des gènes majeurs de résistance monogénique ont été identifiés dont le gène Vf. Il existe également des résistances polygéniques au sein de l’espèce dont l’un des QTLs co-localise avec le gène Vf (Durel et al, 2007)
Nos analyses QTLs nous ayant permis d’identifier des régions génomiques impliquées dans la résistance, il est donc possible d’identifier dans nos populations d’études des individus cumulant des caractères d’intérêts identifiés. Dans la population BerBa, trois individus possèdent un bon nombre des caractères d’intérêts identifiés précédemment en cumulant des marqueurs pour chacune des
Tableau 5 : Récapitulatif des marqueurs présents chez les individus sélectionnés de la population BerBa et des populations interconnectées. En vert : présence de la bonne version du marqueur, en rouge : absence de la bonne version du marqueur, en gris : données manquantes. En bleu : les QTLs identifiés dans les populations interconnectées.