MOREAU Laura
Année 2007-2008 Rapport de stage Master GESMARE 2ème année
Evolution du phytoplancton de la
retenue d’eau potable La Bultière
(85) : 1996-2007
Réalisé du 7 janvier au 4 juillet 2008
à la Station d’Hydrobiologie Lacustre INRA de Thonon-les-Bains sous la direction de :
a) M. DRUART Jean-Claude, INRA b) M. RIMET Frédéric, INRA
c) Mme PELTRE Marie-Christine, UFR SciFa d) M. LEGLIZE Lionel, UFR SciFa
Mémoire soutenu le 15 septembre 2008 devant le jury composé de : M. IZART Alain
M. MASSON Gérard
Mme PELTRE Marie-Christine M. LEGLIZE Lionel
M. DRUART Jean-Claude M. RIMET Frédéric
Institut National de la Recherche Agronomique Stati on d’hy drobi ologi e lacus tre de Thon on- les-Bains
Remerciements
Je tiens tout d’abord à remercier tous les membres de la station INRA pour leur accueil, leur aide et l’intérêt qu’ils ont porté à mon travail.
Plus particulièrement, je tiens à remercier mon maître de stage Jean-Claude Druart pour son aide apportée à la détermination des algues et à la rédaction du présent rapport. Je remercie également Frédéric Rimet, Ingénieur d’étude à l’INRA, pour ses explications et sa rigueur exprimée lors de nombreuses discussions, notamment pour l’exploitation des résultats.
Je souhaite remercier également Eric Magaud et Anne Leauté, de l’usine d’eau potable de La Bultière, pour leur accueil et leur patience devant mes nombreuses questions.
D’autre part, j’aimerai remercier mes tuteurs pédagogiques Marie-Christine Peltre et Lionel Léglize pour leurs nombreux conseils liés à la rédaction de ce rapport. De même, je remercie Delphine Latour, de l’université de Clermont, pour les nombreuses informations partagées sur l’écologie des cyanobactéries.
Pour finir, je tiens à remercier les « châtelains » de l’INRA pour leur bonne humeur, leur soutien et leur aide pendant ces six mois, tout particulièrement ma petite Fatma, Audoceros
didymus, Rozennella thromoidea, Mikabaena solitaria. Je remercie aussi Anne, Lyria et Thomas,
Sommaire
INTRODUCTION...1
CHAPITRE I : L’ÉCHANTILLONNAGE DU PHYTOPLANCTON...2
I.1) LEPHYTOPLANCTON...2
I.1.1) Quelques définitions...2
I.1.2) Distribution spatiale du phytoplancton...2
I.2) L’ÉCHANTILLONNAGEDESPLANSD’EAU...2
I.2.1) Site d’échantillonnage...3
I.2.2) Fréquence et périodes d’échantillonnage...3
I.2.3) Echantillonnage qualitatif...4
I.2.4) Echantillonnage quantitatif...4
I.2.5) Utilisation d’une sonde fluorimétrique...5
I.2.6) Les paramètres physico-chimiques associés...6
I.3) L’ÉCHANTILLONNAGEDESRIVIÈRES...6
I.4) CONSERVATIONDESÉCHANTILLONS...7
CHAPITRE II : LA RETENUE DE LA BULTIÈRE...8
II.1) CONTEXTEHISTORIQUE...8
II.2) LEBASSINVERSANT...8
II.3) GÉOLOGIE...9
II.4) HYDROBIOLOGIE...9
II.5) DESCRIPTIONTECHNIQUEDUBARRAGEDELA BULTIÈRE...9
II.6) VOCATIONDELARETENUEDELA BULTIÈRE...9
II.7) PRÉ-BARRAGEDE PREUILLY...10
II.7.1) Description technique du pré-barrage de Preuilly...10
II.7.2) Vocation du pré-barrage de Preuilly...10
II.8) FONCTIONNEMENTDUPLAND’EAULA BULTIÈRE...10
II.8.1) Le marnage...10
II.8.2) Les temps de résidence...11
II.8.3) Affluents...11
II.9) QUALITÉGLOBALEDELA BULTIÈRE...11
II.10) USINEDETRAITEMENTDELA BULTIÈRE...12
II.11) CONTEXTERÉGLEMENTAIREETOUTILSDEGESTION...13
II.12) PERSPECTIVES...15
CHAPITRE III: MATÉRIELS ET MÉTHODES...16
III.1) ORGANISATIONDUTRAVAIL...16
III.2) PHYTOPLANCTON...16
III.2.1) Prélèvements...16
III.2.2) Traitement des échantillons...17
III.2.3) Préparation des échantillons...17
III.2.4) Identification et dénombrement...18
III.2.5) Présentation des résultats...19
III.2.6) Précision des résultats...19
III.3) PARAMÈTRESPHYSICO-CHIMIQUES...20
III.3.1) Prélèvements...20
III.3.2) Analyses...20
III.4) EXPLOITATIONDESRÉSULTATS...21
III.4.1) L’indice de diversité de Shannon...21
III.4.2) Les groupes fonctionnels de Reynolds...21
III.4.3) Analyses statistiques...21
III.4.3.1) Méthodes d’ordination...21
III.4.3.2) Analyse de groupement : K-Means...22
III.4.3.3) Boîtes à moustaches...22
III.4.3.4) Multi Response Permutation Procedures...22
CHAPITRE IV : RÉSULTATS...24
IV.1) PHYSICO-CHIMIE...24
IV.1.1) Phosphore...24
IV.1.1.2) Station A...24
IV.1.2) Azote Kjeldahl...24
IV.1.3) Chlorophylle a...24
IV.1.4) Analyse en Composante Principale pour la station A...25
IV.2) PHYTOPLANCTON...25
IV.2.1) Diversité-Richesse...25
IV.2.2) Evolution de la biomasse...26
IV.2.2.1) Station D...26
IV.2.2.2) Station A...26
IV.2.3) Evolution des groupes fonctionnels de Reynolds...26
IV.2.3.1) Station D...27
IV.2.3.2) Station A...27
IV.2.4) Les groupements K-Means...27
IV.2.4.1) Station D...28
IV.2.4.2) Station A...28
IV.2.5) Pertinence des différentes classifications par « année », « saison », « méthode », « station »...29
CHAPITRE V : DISCUSSION...30
V.1) PRÉSENTATIONDESRÉSULTATS...30
V.2) PLAND’ÉCHANTILLONNAGE...30
V.2.1) Différentes méthodes...30
V.2.2) Variabilité des fréquences d’échantillonnage...30
V.2.3) Deux stations ?...31
V.2.4) A l’avenir...31
V.3) EVOLUTIONDUPLAND’EAU...32
V.3.1) Evolution générale...32
V.3.2) Diminution des apports externes...32
V.3.3) Impact du changement climatique...33
CONCLUSION...34
Liste des tableaux
Liste des annexes
Annexe 1 : Matériel de prélèvement du phytoplancton a) Le filet à plancton
b) La bouteille de prélèvement à intégration (Shearer et al., 1985) c) La bouteille à prélèvement intégré (Pelletier & Orand, 1978a) d) La bouteille Van Dorn
e) Le prélèvement intégré au tuyau
Annexe 2 : Synthèse graphique de l’évolution du volume transité, des concentrations en phosphore total et en azote au Plessis-des-Landes
Annexe 3 : Comptages du phytoplancton de la Bultière pour l’année 2007 a) Station D
b) Station A
Annexe 4 : Liste des biovolumes calculés pour les taxons manquants Annexe 5 : Présentation orale du 3 juillet 2008
Annexe 6 : Détails d’une chambre à plaque Wild (Rimet, 1998)
Annexe 7 : Valeurs des seuils du système fixe de classification de l’état trophique établi par l’OCDE (d’après OCDE, 1982)
Liste des abréviations
cf. : confer
chl a : chlorophylle a et al. : et les autres Gp : groupe p. : page
p. ex. : par exemple N.B. : Nota Bene ? Zeup : zone euphotique
Présentation de la structure d’accueil
L’Institut National de la Recherche Agronomique
L’Institut National de la Recherche Agronomique (INRA), créé par la loi du 18 mai 1946, est un Etablissement Public à caractère Scientifique et Technologique, placé sous la tutelle des ministères chargés de la Recherche et de l’Agriculture. Il comprend 8 576 agents, dont 4 222 chercheurs et ingénieurs, en décembre 2006. L’INRA disposait de 678 millions d’euros de ressources en 2006. Il existe actuellement 20 centres de recherche et 14 départements scientifiques dans le domaine de l’agriculture, de l’alimentation et de l’environnement, représentant un large spectre de disciplines.
La Station d’Hydrobiologie Lacustre INRA de
Thonon-les-Bains
Depuis 1999, la station est une Unité Mixte de Recherche (UMR CARRTEL) (Centre Alpin de Recherche sur les Réseaux Trophiques des Ecosystèmes Limniques) par association avec un laboratoire de microbiologie aquatique et un laboratoire de Sciences du Sol de l’Université de Savoie. Depuis 2002, la direction de l’UMR a été confiée à Jean Marcel Dorioz, directeur de l’unité de Thonon-les-Bains.
Aujourd’hui, le laboratoire et ses partenaires universitaires représentent 45 personnes permanentes et une quinzaine de personnes en doctorat, séjours post-doctoraux, stages de recherche, formation permanente,… Le budget de la station est de 600 k€ pour le fonctionnement et 28 k€ pour les travaux.
Les projets de recherche développés au sein du CARRTEL s’intéressent au fonctionnement écologique des lacs subalpins et de leurs bassins versants. L’acquisition des connaissances porte sur les caractéristiques écologiques des organismes aquatiques, l’impact des activités humaines, en particulier agricoles, les communautés biologiques, les facteurs de production, la dynamique des stocks et le fonctionnement des populations d’espèces de poissons d’intérêt halieutique ou patrimonial. « Les recherches sur le fonctionnement des systèmes lacustres sont conduites dans une perspective d’aide à la décision en matière de qualité des eaux et de gestion de la ressource naturelle grands Lacs » (Dorioz, 2004).
Organigramme de l’UMR CARRTEL
Responsables : BOUCHEZ A. (CR), RIMET F. (IE)Membres techniques : DRUART JC. (IE), LE BERRE -TREVISAN B. (AI), LAINE L. (TR), MENTHON E. (TR)
Introduction
Le plan d’eau de la Bultière, situé au nord-est de la Vendée est une retenue pour l’alimentation en eau potable. Le bassin versant étant fortement agricole, la qualité de l’eau est particulièrement préoccupante notamment au regard des pollutions azotées. Sur ce bassin versant, il existe déjà un contentieux européen sur la qualité de l’eau distribuée et un autre contentieux sur la qualité de l’eau brute est à craindre à court terme. Etant donné ce contexte particulier, un suivi du phytoplancton du plan d’eau s’est mis en place à partir de 1995, soit un an après sa mise en eau.
Après onze années d’étude, il apparaissait intéressant de valoriser ces données afin de mettre en évidence une évolution probable du phytoplancton. Plusieurs questions peuvent être énoncées à ce propos :
- Existe-t-il des cortèges floristiques différents en fonction du temps ?
- La vidange décennale du barrage de 2004 a-t-elle eu un impact sur le phytoplancton ? - Les actions menées sur le bassin versant pour diminuer les apports au plan d’eau sont-elles traduites par des modifications de biomasse et de composition du phytoplancton ?
Un second aspect est à envisager par rapport au plan d’échantillonnage du phytoplancton, puisque 8 méthodes différentes ont été mise en œuvre à des fréquences d’échantillonnage variables selon les années. Les questions suivantes ont donc été posées :
- Ces différentes méthodes d’échantillonnage (techniques utilisées et fréquences des échantillons) ont-elles un impact sur la composition des listes floristiques ?
- Quelle méthode serait là plus adaptée pour La Bultière ?
Le premier objectif est donc de synthétiser toutes les données floristiques existantes sur La Bultière afin de dresser un bilan de l’évolution du plan d’eau d’un point de vue biologie. Le second objectif est de proposer des améliorations au plan d’échantillonnage existant.
Ce rapport se divise en cinq parties. La première partie s’intéresse aux différentes méthodes d’échantillonnage du phytoplancton. La seconde s’attache à la présentation du site d’étude. La troisième constitue un ensemble méthodologique pour suivre l’évolution de ce plan d’eau. La quatrième est consacrée à l’exploitation des résultats obtenus à partir des listes floristiques. Enfin, la dernière partie est dédiée à l’interprétation des données, aux hypothèses explicatives, aux perspectives et aux conclusions des problématiques posées.
Chapitre I : L’échantillonnage du phytoplancton
I.1) Le phytoplancton
I.1.1) Quelques définitions
Le plancton correspond à l’ensemble des organismes flottants en pleine eau dont les mouvements sont incapables de surmonter les courants. Il est composé d’algues microscopiques (phytoplancton) et d’animaux en général de plus grande taille (zooplancton).
Le phytoplancton est principalement composé d’algues chlorophylliennes puisant dans le milieu les divers éléments nécessaires à leur croissance grâce à la photosynthèse et produisant de l’oxygène, ce qui enrichit les couches supérieures. Il englobe plusieurs groupes taxonomiques déterminés selon leur morphologie et leur physiologie. Leurs différents besoins font varier leur abondance en réponse aux variations des facteurs environnementaux physiques et chimiques (lumière, température, nutriments) (Wetzel, 2001). Les espèces phytoplanctoniques peuvent vivre de façon isolée, coloniale, ou filamenteuse. La taille des algues phytoplanctoniques unicellulaires varie de 1µm (Chlorella) à 700µm (Closterium ehrenbergii) et peut atteindre ou dépasser quelques millimètres chez certaines espèces coenobiales (Volvox) ou filamenteuses (Tribonema).
I.1.2) Distribution spatiale du phytoplancton
Le phytoplancton se répartit de façon plus ou moins homogène dans la colonne d’eau, bien que sa distribution horizontale soit discontinue, sous forme de nuages. Dépendant de la lumière et des substances nutritives, ces organismes microscopiques vivent principalement dans la zone euphotique, c’est-à-dire dans la strate supérieure des plans d’eau recevant plus de 1% d’énergie lumineuse (Findlay et al., 1996).
Ces algues optimisent leurs conditions de vie dans la zone euphotique en recourant à plusieurs mécanismes : contrôle de flottabilité à l'aide de vacuoles gazeuses, migration grâce à un flagelle, augmentation de la surface par rapport au volume comme moyen de résistance et divers autres processus métaboliques (Findlay et al., 1996).
Le phytoplancton se renouvelle très rapidement (de l’ordre de plusieurs heures à quelques jours), et il est affecté par des facteurs physiques, chimiques et biologiques, ce qui le rend précieux pour des programmes de surveillance (Findlay et al., 1996). Cet élément biologique est d’ailleurs mesuré dans le cadre des suivis la Directive cadre sur l’Eau (European commission (2000)).
I.2.1) Site d’échantillonnage
La station de prélèvement doit être à une distance suffisante de la berge pour éliminer les contaminations par les algues périphytiques (Findlay et al., 1996 ; Laplace et al., 2008) et par les efflorescences accumulées sur les berges par le vent (Laplace et al., 2008).
Une seule station de mesure est requise pour un suivi phytoplanctonique, localisée à la verticale du point de plus grande profondeur (Laplace et al., 2008 ; CEN/TC, 2008), car les profils des autres paramètres (température, oxygène, phosphore), doivent être réalisés à la profondeur maximale. Pendant l’échantillonnage à bord du bateau, il est important de ne pas dériver de ce point (Rimet & Druart, 2008a, CEN/TC, 2008). Il faut citer aussi : CIPEL (1975); CIPEL (1984) pour les propositions d’emplacement de site d’ech.
I.2.2) Fréquence et périodes d’échantillonnage
La fréquence d’échantillonnage du phytoplancton et le nombre d’échantillons dépendent des objectifs de l’étude à mener et de ses applications spécifiques (CEN/TC, 2008). Par exemple, un échantillonnage bimensuel est nécessaire pour comprendre la dynamique saisonnière du phytoplancton. Il peut être nécessaire d'accroître la fréquence d'échantillonnage pendant les périodes de prolifération algale (Findlay et al., 1996). Ainsi, concernant le suivi des lacs alpins, la fréquence d’échantillonnage est bi-mensuelle durant la phase de plus grande activité biologique (p. ex. de mars à novembre pour le Léman et le Bourget) et mensuelle le reste de l’année (Rimet & Druart, 2008a ; CIPEL, 1975).
Dans le cadre d’un suivi allégé de plan d’eau en rapport avec la Directive Cadre européenne sur l’Eau (DCE), 4 campagnes sont préconisées en fonction des différentes phases de croissance du phytoplancton et du fonctionnement du lac :
- la première phase de croissance du phytoplancton correspondant au brassage du plan d’eau (mi-février à fin mars),
- la phase printanière de croissance durant la mise en place de la thermocline (si une thermocline est présente sur le plan d’eau considéré) (mi-mai à fin juin),
- la deuxième phase de croissance du phytoplancton (juillet à août),
- et en fin de stratification estivale, lorsque l’épilimnion a une épaisseur maximale (septembre à mi-octobre) (Laplace et al., 2008 ).
Dans le cas où seulement deux prélèvements sont à réaliser, il est préférable d’échantillonner à la fois la phase de brassage et la phase de stratification estivale (CEN/TC, 2008). La date exacte d’échantillonnage est liée à la météorologie, la journée pour effectuer le prélèvement doit être calme, avec peu de vent, et peux de vagues (Rimet & Druart, 2008a).
I.2.3) Echantillonnage qualitatif
L’échantillonnage au filet à plancton (cf. Annexe 1a) renseigne sur la présence ou l'absence d'espèces et peut aider à repérer des espèces rares. Il permet donc une analyse qualitative du phytoplancton. De nombreuses espèces ou individus peuvent échapper aux filets les plus fins, des colonies peuvent être perturbées par le filet et certaines espèces fragiles pourront éclater suite à une pression excessive. Cette technique trop imprécise a d’ailleurs été abandonnée pour le suivi des grand lacs alpins en France au profit d’échantillonneurs intégrés dans les années 70 (CIPEL, 1975).
D’autre part, concernant l’étude spécifique des toxines de cyanobactéries, une étude a montré que les échantillons d’eau brute fournissent des estimations plus précises des densités de population et des concentrations plus élevées de microcystines que les échantillons au filet (63µm de maille) (Rogalus et al., 2008).
Toutefois, les échantillons qualitatifs sont excellents aux fins d'études taxinomiques, à cause du grand nombre de spécimens (de grande taille) recueillis (Findlay et al., 1996). Dans la mesure où ils sont équipés de débitmètres, les filets constituent alors des dispositifs semi-quantitatifs (OSPAR, 1995).
Un filet de maille de filtration de 10µm dont l’ouverture est d’environ 30 ou 40cm est préconisé pour l’échantillonnage lors de la diagnose rapide d’un plan d’eau (Cemagref, 2003). De plus, deux prélèvements sont à réaliser par campagne : un verticale partant de la zone profonde jusqu’à la surface, et un horizontal tiré sur une centaine de mètres (moins si le colmatage est rapide), de telle manière que le filet reste à 1 ou 2m sous la surface de l’eau (Cemagref, 2003).
Dans le cadre du suivi DCE des lacs, il est conseillé d’effectuer, en complément d’un échantillon brut, un prélèvement au filet de 30µm de vide de maille sur un trait vertical de la zone euphotique afin de disposer de suffisamment de matériel pour certaines identifications (Laplace et al., 2008).
I.2.4) Echantillonnage quantitatif
Il existe plusieurs méthodes éprouvées pour prélever des échantillons quantitatifs de phytoplancton, lesquels sont des échantillons non concentrés tirés d’un volume d’eau connu (Findlay et al., 1996). Il est préférable d’échantillonner la zone euphotique (Zeup) correspondant à la
tranche d’eau comprise entre la surface et 2,5 fois la profondeur de disparition du disque de Secchi (CEN/TC, 2008). Il est alors pris sous la forme d’un prélèvement intégré sur cette profondeur. Lorsque la Zeup est supérieure à la profondeur, le prélèvement intégré est réalisé de la surface
jusqu’à 1m au-dessus du fond (Laplace et al., 2008). Des profils mensuels réalisés avec une sonde fluorimétrique (sonde BBE), des profils de production primaire peuvent être utilisés pour
déterminer la zone euphotique ou l’essentiel de la production primaire se passe et donc la couche à prélever (Rimet & Druart, 2008a).
Un échantillonneur intégrateur permet de prélever un échantillon dans un intervalle pré-établi de profondeur. Cette méthode d’échantillonnage est idéale car elle a l’avantage de donner un échantillon d’un volume conséquent homogène représentatif de l’ensemble de la Zeup échantillonnée
(CEN/TC, 2008). Il existe différents modèles de préleveurs-intégrateurs (cf. Annexe 1b et c) tels que la bouteille de prélèvement à intégration (Shearer et al., 1985), utilisée par les canadiens (Findlay et al., 1996), et la bouteille à prélèvement intégré (Pelletier & Orand, 1978a) utilisée par l’INRA dans le cadre du suivi des lacs alpins par l’INRA (Rimet & Druart, 2008a).
L’utilisation d’une bouteille fermante est couramment utilisée (p. ex. la bouteille de Van Dorn) : elle recueille des volumes d’eau constants à une profondeur précise (cf. Annexe 1d).
En eau peu profonde, il est possible de collecter un échantillon à l’aide d’un tuyau de plastique (cf. Annexe 1e). L’expérience montre toutefois qu’il est difficile de nettoyer suffisamment le tuyau pour éviter la contamination des échantillons par la croissance algale au sein de celui-ci. De plus, la contamination des échantillons par les champignons, les bactéries ou les diatomées benthiques par exemple, est un problème commun associé à l’utilisation de cette méthode (CEN/TC, 2008).
La bouteille Van Dorn peut être utilisée pour un échantillonnage intégré. Dans ce cas, un volume donné est prélevé au maximum tous les mètres pour un lac peu profond et tous les 2m pour un lac profond pour être mélangé dans un plus grand récipient type seau dans lequel le prélèvement de phytoplancton sera réalisé. De plus, il est important de ne pas conserver ce seau sous une insolation ou une pluie directe qui pourrait entraîner une modification de l’échantillon. Il convient également de bien homogénéiser le contenu du seau immédiatement avant le prélèvement du sous-échantillon (Laplace et al., 2008).
Dans tous les cas, il est important que le moyen de prélèvement soit associé à un système fiable et précis de la mesure de la profondeur d’échantillonnage (p. ex. corde graduée, treuil avec compteur décimétrique) (Laplace et al., 2008).
I.2.5) Utilisation d’une sonde fluorimétrique
Le principe de mesure repose sur les capacités de fluorescence des algues phytoplanctoniques (Jacquet, 2008). La sonde est en effet capable de différencier les principaux groupes phytoplanctoniques sur la base de leurs caractéristiques pigmentaires propres (Moldaenke, 2007). Les algues d’un même groupe phytoplanctonique contiennent une qualité et une quantité de pigments phytosynthétiques similaires. Ainsi, leur spectre d’excitation est significatif pour chaque classe algale (Moldaenke, 2007). Il est donc possible de différencier les différents groupes d’algues
par leur fluorescence respective et d’obtenir leur concentration, en µg équivalent de chlorophylle a par litre, en continu le long de la colonne d’eau (Jacquet, 2008).
La sonde fluorimétrique permet donc d’obtenir un profil vertical de la répartition des différents groupes algaux (Cyanobactéries, Diatomées, Chlorophycées, Cryptophycées, Dinophycées), impossible à obtenir avec les analyses classiques de taxonomie sauf au prix de dizaines de comptages très coûteux en temps. Cependant, elle représente un investissement important à l’achat, et de plus, elle consomme un temps précieux pour le personnel de part son calibrage délicat.
I.2.6) Les paramètres physico-chimiques associés
Certains paramètres physico-chimiques sont importants à connaître pour l’étude du phytoplancton. Par exemple, les concentrations de nutriments et leurs proportions constituent des indicateurs fondamentaux de prolifération planctonique (Findlay et al., 1996 ; CIPEL, 1984).
Il est nécessaire de mesurer la transparence, à l’aide du disque de Secchi, permettant de calculer la profondeur de la zone euphotique et dans le cadre de suivi de lacs, la profondeur du prélèvement intégré (Laplace et al., 2008).
Des profils verticaux, de la surface jusqu’à 1m au-dessus du fond pour le pH, la conductivité et l’oxygène dissous, mesurés tous les mètres sont intéressants à réaliser. Le profil de la température permet d’identifier la présence d’une thermocline. Un profil vertical de la chlorophylle a apporte également de précieux compléments d’information. De même, des profils verticaux des formes de l’azote et du phosphore peuvent aider à l’interprétation des résultats de phytoplancton (CIPEL, 1975).
Dans tous les cas, un sous-échantillon, issu du prélèvement intégré pour analyse des pigments chlorophylliens au laboratoire est requis. Un litre d’eau est en général suffisant (Laplace et al., 2008).
Comme il est préconisé par ailleurs dans la circulaire « surveillance » DCE 2006/16 un échantillon d’eau issu du prélèvement intégré doit être fait pour réaliser des analyses chimiques en laboratoire. Ces analyses comportent entres autres les formes de l’azote et du phosphore contribuant à l’interprétation des données phytoplanctoniques (Laplace et al., 2008). Un volume de 1 à 2 litres d’eau est nécessaire. Leur conservation doit se faire à l’obscurité et à 4°C. L’analyse au laboratoire doit débuter le plus tôt possible après le prélèvement.
I.3) L’échantillonnage des rivières
La Bultière étant une retenue d’eau sur le cours principal de la Grande Maine, il semble intéressant de comparer la technique d’échantillonnage utilisée sur ce plan d’eau à la méthode
indiquée pour les rivières. Ainsi, la DCE préconise le suivi du phytoplancton pour certains très grands cours d’eau comme la Loire par exemple (Circulaire “surveillance” DCE 2006/16). Pour ce suivi, la méthode d’échantillonnage retenue est un prélèvement d’eau brute. Concernant la station d’échantillonnage, la section de rivière ne doit pas être deux fois plus large ni un tiers plus profond que la zone où l’écoulement n’est pas contraint (CEN/TC, janvier 2008). L’échantillonnage s’effectue dans la ligne de courant, à l’aide d’un échantillonneur adéquat permettant de prélever à 0,5m de profondeur. Si des algues flottant à la surface de l’eau (p. ex. Microcystis) sont détectées ou que la profondeur du Secchi est inférieure à 1m, un second échantillon est réalisé directement avec de l’eau de surface et mélangé avec le prélèvement à 0,5m 1:1 (CEN/TC, janvier 2008).
D’après la norme européenne, les infrastructures portuaires et les barrages doivent être échantillonnés de la même manière que les lacs (CEN/TC, janvier 2008).
I.4) Conservation des échantillons
Un aliquote de l’échantillon est prélevé et conservé dans un flacon à large col en verre ou en polypropylène transparent et propre. Pour les lacs eutrophes, des bouteilles de 100ml sont suffisantes, pour les lacs dont le statut trophique est compris entre oligo- et eutrophe des bouteilles de 250ml sont à utiliser, pour les lacs dont la profondeur de disparition du Secchi est supérieure à 10m il faut prendre un flaconnage de 500ml (CEN/TC, janvier 2008). Le polyéthylène est déconseillé car il absorbe l’iode contenu dans le fixatif employé (Lugol). Les flacons colorés sont à éviter car ils masquent la couleur de la fixation au Lugol. Le remplissage du flacon ne doit pas se faire jusqu’en haut pour permettre une bonne homogénéisation de l’échantillon avant la prise du sous-échantillon pour comptage (Laplace et al., 2008).
Les échantillons fixés au Lugol (concentration finale de 0,5% dans l’échantillon, soit une coloration orangée obtenue avec 8 gouttes de lugol pour 100ml d’échantillon) doivent être stockés préférablement dans le noir, à des températures se situant entre 4 et 10°C (CEN/TC, janvier 2008 ; Rimet & Druart, 2008a).
L’étiquetage des flacons est une étape indispensable auquel il faut apporter beaucoup de soin afin de pouvoir interpréter les résultats. Il est possible de noter sur le flaconnage le lieu, la date, la profondeur, l’engin d’échantillonnage utilisé, le nom du collecteur.
Etant donné l’hétérogénéité spatiale et temporelle de la distribution du phytoplancton, toute méthode de prélèvement comporte des biais. L’important le plus souvent est de suivre une cinétique temporelle avec une même méthode (Communication Personnelle D. Latour).
Chapitre II : La retenue de la Bultière
II.1) Contexte historique
La Vendée est parcourue par un réseau dense de rivières avec des débits d’étiage pratiquement nuls, interdisant tout prélèvement «au fil de l’eau» au moment où les besoins sont les plus importants. C’est ainsi que dans les années 1948-50 a été conçu un plan d’ensemble prévoyant la desserte totale du territoire à partir d’usines de traitement peu nombreuses, de forte capacité, annexées à des barrages construits sur les rivières et alimentant des réseaux collectifs interconnectés les uns avec les autres (cf. figure 1) [1]. 10 usines de traitement d’eau associées à 12 barrages produisent 95% des consommations. Par ailleurs, 19 captages de moindre importance existent en Vendée.
Actuellement, les réseaux des Syndicats Intercommunaux sont tous reliés les uns aux autres. Le diamètre des canalisations de liaison varie de 100mm à 600mm en fonction de l’étendue des territoires desservis et de l’objectif recherché: transit ou distribution [1].
Parmi les retenues d’eau utiles à l’alimentation en eau potable de la Vendée, se trouve celle de la Bultière, située entre les communes de Montaigu et des Herbiers. Le Syndicat Intercommunal d’Alimentation en Eau Potable (SIAEP) des Vals de Sèvre, représentant 21 communes, a réalisé la maîtrise d’ouvrage de l’opération, à savoir la création du plan d’eau. Le chantier s’est déroulé de 1992 à 1995 et la retenue a été mise en eau en mars 1994 [2].
II.2) Le bassin versant
Le bassin versant de la Bultière a une superficie de 154km2. Il est situé dans un secteur de
fortes activités d’élevage intensif (bovins, porcins et volailles). Il est traversé par un cours d’eau principal : la Grande Maine, affluent rive gauche de la Sèvre Nantaise. Il comprend 11 communes (concernées toutes ou en partie), représentant 18 000 habitants en 2004. 13 000 habitants sont raccordés à 7 stations d’épurations communales [3]. Le pôle industriel du bassin versant est concentré sur la commune des Herbiers. On dénombre 236 exploitations agricoles représentant une surface agricole utile de 10 975ha [4].
Autour du plan d’eau, un sentier piétonnier de 17km ainsi qu’une zone verte de protection d’une surface de 110ha ont été aménagés [2]. L’accès au lac est autorisé pour les pêcheurs en bordure, sur toute la périphérie sauf une bande de 50m à partir du barrage, et par des bateaux non équipés de moteurs thermiques.
Cinq retenues collinaires ont été créées sur les petits affluents de la retenue aux Grassières, aux Permouillères, à Preuilly, à la Maurosière et à l’Ortay, afin de mieux maîtriser les ruissellements directs dans le lac [2].
II.3) Géologie
La Vendée réunit dans son sous-sol des caractères géologiques variés : - schistes argileux au centre et au nord-est,
- formations calcaires au sud, marais conquis sur la mer.
La Vendée présente une prépondérance des terrains primaires donnant naissance à de nombreuses sources qui, en dépit de leur pérennité, n’offrent que des débits dérisoires face aux besoins collectifs (cf. figure 2). Les réserves des granits ou des schistes du socle hercynien sont très localisées et par conséquent très modestes [1].
II.4) Hydrobiologie
Le Plan Départemental de Protection des milieux aquatiques et la Gestion des ressources piscicoles (PDPG) classe la retenue de la Bultière en domaine cyprinicole dégradé, ainsi l’espèce repère est le Brochet (SAGE, 2005). L’Association Agrée pour la Pêche et la Protection des Milieux Aquatique (AAPPMA) L’Union des Ecluses, à Chavagnes en Paillers, gère le cheptel piscicole. Il semble que le projet de mettre en place une passe à anguilles pour la montaison et l’avalaison ait été envisagé par cette association à la fin de l’année 2007 (Web 1).
II.5) Description technique du barrage de la Bultière
C’est un barrage poids béton comprenant 17 plots, 15 de 11m et 2 plots d’extrémités [1]. Il est muni de deux vidanges de fond destinées à maintenir un niveau de plan d’eau à peu près constant et capables d’un débit de deux fois 39m3.s-1. Huit siphons de 24m3.s-1 ont été prévus pour
évacuer les crues exceptionnelles. La hauteur de l’ouvrage est de 26,5m pour une longueur de 187m et une largeur de 4,5m en crête. Le barrage retient un volume d’eau de 5 200 000m3 sur une surface
totale de 72ha (Pelte et al., 1996). Le déversoir se trouve à la cote 60m NGF soit 2m au-dessus de la digue de Preuilly (Restituito, 2000). Une canalisation spécifique de 300mm de diamètre traverse le barrage et envoie à l’aval le débit réservé. Une dérivation sur la canalisation d’exhaure se substituera à la canalisation spécifique en cas de dégradation de la qualité de l’eau de fond.
II.6) Vocation de la retenue de la Bultière
La retenue de la Bultière permet de constituer une réserve d’eau pour renforcer l’alimentation en eau potable du Nord Est vendéen. De plus, elle contribue également [2] :
- au soutien des étiages de la Maine jusqu’à la Loire-Atlantique, - à l’écrêtage des crues,
- à la création d’un espace vert à la périphérie du lac.
II.7) Pré-barrage de Preuilly
II.7.1) Description technique du pré-barrage de Preuilly
C’est un barrage poids en béton à déversoir, constitué de 7 plots et surmonté d’un pont routier de 7,5km de largeur. Cet ouvrage mesure 112m de longueur en crête, 7,50m de largeur en crête et 13,54m de hauteur totale. Le déversoir, de 100m en crête, permet d’évacuer une crue de 270m3.s-1.
Ce barrage comprend deux conduits de vidange de 1m2 de section utile chacun. Ces conduits
permettent de baisser le niveau de l’eau en amont du pré-barrage. Ils sont ouverts une fois par mois afin de vérifier leur bon fonctionnement (Pelte et al., 1996). Des sauts de ski permettent de diriger le jet de la lame déversante vers des fosses d’érosion à l’aval [2]. La profondeur au pied du barrage, côté amont, est de 6,5m. Le haut de la digue est situé à la cote 58m NGF et le niveau de remplissage ne descend pas en dessous de cette cote (Restituito, 2000).
II.7.2) Vocation du pré-barrage de Preuilly
D’après le SIAEP des Vals de Sèvre, le rôle du pré-barrage est de protéger la retenue principale notamment en provoquant la sédimentation dans les eaux de la Grande Maine. En effet, les eaux de la Grande Maine sont fortement chargées en phosphore et peuvent l’être en diverses matières en suspension. Le pré-barrage retiendrait la masse d’eau qui arrive durant quelques jours, permettant au phytoplancton de proliférer en utilisant les nutriments. Ceci a donc l’intérêt de limiter la prolifération algale provoquée par un excès de phosphore à une zone réduite du plan d’eau et, par la même occasion, de fixer le phosphore en excès de façon plus efficace et durable par cette assimilation par le phytoplancton (Pelte et al., 1996).
De plus, il a aussi comme but de réduire les variations de niveau de la queue de la retenue à 1,25m afin d’éviter la mise à l’air libre des sédiments qui pourrait gêner la faune ou simplement nuire à l’esthétique [2].
II.8) Fonctionnement du plan d’eau la Bultière
Ce paragraphe a été rédigé à partir de la synthèse des campagnes de mesures de 1995 à 1999 (Restuito, 2000).
II.8.1) Le marnage
L’importance des marnages estivaux est conditionnée par les besoins en eau d’alimentation et l’importance de l’étiage. Le pré-barrage de Preuilly est un « plan d’eau » à « niveau constant ». Le haut de la digue étant situé à 58m NGF, le niveau de remplissage ne descend pas en dessous de cette côte. Ainsi, en période hivernale, la digue est noyée et il y a communication directe par
surverse avec la retenue principale. Concernant la retenue principale, le niveau de remplissage s’abaisse fortement l’été étant donné la diminution des débits d’alimentation par la Grande Maine et l’augmentation des pompages pour la potabilisation de l’eau. La restitution à l’aval du barrage est de 100 à 180 l.s-1. Ainsi, le niveau du plan d’eau diminue en fonction des besoins en eau, à l’inverse
du pré-barrage. Entre le début de l’été et la fin du mois de décembre, le niveau de la retenue est inférieur au pré-barrage. Le remplissage de la retenue s’effectue grâce à la reprise des écoulements amont, soit à partir de l’automne.
II.8.2) Les temps de résidence
Le volume entier du plan d’eau est renouvelé plusieurs fois pendant l’hiver (cf. tableau 1). Seule la quantité d’éléments dissous entrant au printemps a un impact sur la qualité estivale de la retenue. En été, les apports ont une faible influence sur la qualité de l’eau.
Tableau 1 - Temps de remplissage moyen (en jours) de la retenue principale de 1995 à 1998
1995 1996 1997 1998
Annuel 32 86 80 40
Basses eaux 671 4050 712 774
Hautes eaux 22 34 36 23
II.8.3) Affluents
La Grande Maine est le principal affluent du plan d’eau. Cependant quelques petits ruisseaux peuvent alimenter la retenue. Ils sont en majorité barrés par des digues, formant des petits réservoirs pour l’irrigation des terrains environnants, et se retrouvent asséchés en été.
II.9) Qualité globale de la Bultière
L’étude du plan d’eau de 1995 à 1999 a montré que :
- La transparence est faible (0,84m) en toute saison, particulièrement l’été.
- La durée de la stratification thermique et le niveau de la thermocline dépendent à la fois des conditions météorologiques et de l’importance des pompages.
- Les eaux profondes sont très fortement désoxygénées en été. En effet, la limite supérieure des masses d’eau dont la concentration en oxygène dissous est inférieure à 1mg.l-1 se situe
en moyenne à 6m en dessous de la surface, en période estivale.
- Les nitrates, l’azote ammoniacal, les orthophosphates et le phosphore total ont des concentrations maximales en hiver, quand le débit de la Grande Maine est important et que le temps de résidence est faible. Les concentrations minimales en nitrates se situent en fin de période estivale lorsque les apports externes sont réduits et que le phytoplancton consomme les nutriments. Les teneurs en orthophosphates et azote ammoniacal en été dépendent du
stock printanier, et de l’abondance des apports par les sols en place ou les sédiments accumulés depuis la mise en eau.
- La qualité de la retenue est principalement conditionnée par la qualité printanière de la Grande Maine, étant donné les forts débits de crue en hiver et au début du printemps.
- Le caractère eutrophe de la retenue est déterminé par : le stock d’éléments nutritifs accumulé au printemps
la qualité des eaux de sortie du pré-barrage de Preuilly en été
la diffusion / le relargage des éléments nutritifs à partir des sédiments (Restuito, 2000).
Les principales caractéristiques physico-chimiques du plan d’eau, mesurées à la station A sont synthétisées dans le tableau 2.
Tableau 2 - Principales caractéristiques physico-chimiques de la Bultière
L’absence de donnée est signalée par « - ». Concernant l’année 1999, les données s’échelonnent de février à juin et pour l’année 2004 de septembre à décembre.
Des mesures physico-chimiques ont également été effectuées en amont du plan d’eau, à la station Plessis-des-Landes, afin de caractériser l’apport principal de la Bultière (cf. Annexe 2). Ainsi, le volume d’eau transité au Plessis-des-Landes est très variable selon les années. Les concentrations moyennes annuelles en phosphore total diminuent de 1993 à 2005, et ont tendance à stagner voire à augmenter depuis 2005. Quant aux concentrations moyennes annuelles d’azote, la tendance globale est à la diminution malgré des hausses ponctuelles.
II.10) Usine de traitement de la Bultière
L’usine de production, localisée au niveau du barrage, produit 3 000 000m3.an-1 d’eau
potable. Elle est gérée par la Compagnie des Eaux et de l’Ozone (C.E.O.). Deux châteaux d’eau sont positionnés en tête d’usine pour la mise en pression de l’eau.
L’usine de traitement prélève 40 000 m3.j-1. La prise d’eau est constituée de 2 bras
orientables de diamètre 500mm pour un prélèvement en surface généralement. La profondeur de la prise d’eau oscille sur 5m environ, à une côte supérieure à 51,50m NGF (Communication personnelle E. MAGAUD, Responsable Usine de la Bultière). Une canalisation de prise d’eau _
chambre d’exhaure (où le pompage s’effectue à 1 000m3.h-1 en première tranche) expédie l’eau
brute vers l’usine [2].
Différents procédés de traitement sont utilisés (cf. figure 3) : - Pré-traitement par oxydation des matières organiques, - Floculation-décantation au sulfate d’alumine,
- Filtration sur sable,
- Stérilisation à l’ozone avec un complément de chlore afin de prolonger l’effet de cette stérilisation pendant le transport de l’eau,
- Distribution de silice afin de pallier au ralentissement de la réaction de floculation à partir du sulfate d’alumine par les températures hivernales,
- Reminéralisation,
- Utilisation du charbon actif pour éliminer les pesticides [1].
II.11) Contexte réglementaire et outils de gestion
Le Schéma Directeur d’Aménagement et de Gestion des Eaux (SDAGE) Loire Bretagne, adopté le 4 juillet 1996, a défini le bassin de la Sèvre nantaise comme unité hydrographique cohérente et l’a reconnu comme un Schéma d’Aménagement et de Gestion des Eaux (SAGE) prioritaire.
Le SAGE de la Sèvre Nantaise élaboré en mars 2005 a pour objectifs principaux de :
o Reconquérir la qualité de l’eau brute par la maîtrise des rejets ponctuels et des pollutions diffuses ;
o Maintenir, préserver, développer la diversité de la ressource en eau (qualité, quantité, continuité hydraulique) ;
o Sensibiliser, informer, former et responsabiliser ;
o Maintenir, préserver, développer la diversité des milieux aquatiques, du patrimoine biologique et du patrimoine bâti et historique lié à l’eau ;
o Prévenir et gérer les risques d’inondations ;
o Favoriser la concertation autour des sites touristiques (équilibre entre les différents usages).
De plus, des objectifs de qualité d’eau potable ont été retenus :
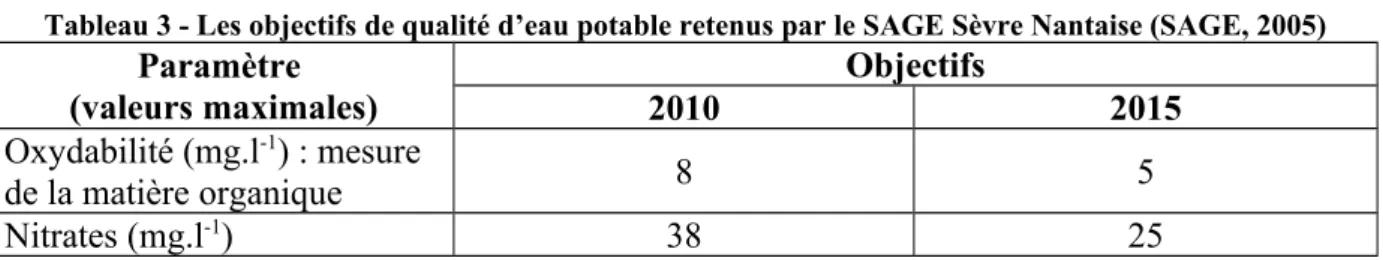
Tableau 3 - Les objectifs de qualité d’eau potable retenus par le SAGE Sèvre Nantaise (SAGE, 2005)
Paramètre (valeurs maximales) Objectifs 2010 2015 Oxydabilité (mg.l-1) : mesure de la matière organique 8 5 Nitrates (mg.l-1) 38 25
Pesticides (µg.l-1)
Somme des matières actives 1 0,5
Le Contrat de bassin versant de la Bultière 2004-2008 «Eau Vendée Environnement (EVE) Bultière» est une démarche volontaire et participative qui s’adresse à tous les utilisateurs de l’eau (agriculteurs, industriels, particuliers, collectivités, …).
o Il propose des actions concrètes :
Lutte contre les pollutions non agricoles Lutte contre les pollutions agricoles
Aménagement de l’espace pour limiter les transferts au cours d’eau Communication et information
Suivi-évaluation
o Ses objectifs à 5 ans sont les suivants:
Tableau 4 - Les objectifs concernant la qualité de l’eau du contrat EVE, d’après [3]
Paramètres Prélèvements Concentrations En amont immédiat de la
retenue
Nitrates 90 % < 35 mg.lmaximum: 50 mg.l-1 -1
Phosphore 90 %50 % < 1 mg.l< 0,3 mg.l-1-1
A la prise d’eau brute
Pesticides 90 %90 % < 0,3 µg.l
-1 pour une molécule
< 2 µg.l-1 pour l’ensemble des
molécules Matière
organique 90 % < 8 mg.l
-1
maximum: 10 mg.l-1
Le PDPG préconise certaines mesures pour le secteur des rivières Maines telles que (SAGE, 2005) :
o Respect des normes de rejets domestiques et agricoles o Mesures agri-environnementales sur le bassin versant o Suppression des pompages directs
o Restauration de la ripisylve et des berges
o Non restauration systématique / aménagement des barrages o Aménagement de 5 frayères
L’arrêté préfectoral du 16 juillet 1992 réglemente et protège le plan d’eau [2] : o la baignade est non autorisée
o l’usage d’une embarcation à moteur à explosion est interdit o deux périmètres de protection sont définis:
à 50m de la retenue: toute construction, tout camping et tout stationnement automobile est interdit
à 300m de la retenue: les projets susceptibles de nuire à la qualité des eaux sont interdits, les pratiques agricoles pour l’amendement et le traitement des sols obéissent à des dispositions contractuelles destinées à éviter les rejets d’azote et de phosphore.
La Directive Nitrates (Directive européenne du 12 décembre 1991 concernant la protection des eaux contre la pollution par les nitrates à partir de sources agricoles) situe le bassin versant de la Sèvre Nantaise en zone vulnérable, c’est-à-dire où le risque de pollution des eaux par les nitrates issus des effluents d’élevage est avéré. Ainsi un Programme de Maîtrise des Pollutions d’Origine Agricole doit être mis en place.
Il existe un plan de gestion des ressources en eau afin de permettre le traitement et le mélange des eaux pour la production d’eau potable.
II.12) Perspectives
Les barrages de la Bultière et de Preuilly ont été vidangés en septembre 2004. Au cours de cette vidange décennale, l’entretien des vannes et l’amélioration des installations ont pu être réalisés. A cette époque, le curage du pré-barrage a été envisagé, le volume des sédiments à évacuer était estimé à 15 000 m3. En effet, la sédimentation rapide des particules induit une diminution du
volume d’eau et diminue ainsi le rôle du pré-barrage. Cependant, il n’a pas été réalisé étant donné le problème que pose le stockage et l’élimination des sédiments potentiellement toxiques (Com. Pers. E. MAGAUD, Responsable Usine de la Bultière).
Depuis 2007, les dépassements répétés de la norme nitrates (50mg.l-1) provoquent le
classement du barrage en contentieux européen. En 2006, le taux légal de nitrates dans l’eau du robinet a été dépassé pendant 4 à 5 mois (D.D.A.S.S. de la Vendée, mars 2007). En 2007, par contre, l’eau est restée de qualité tous les jours. Une solution envisagée est la pose d’une canalisation « eau traitée de la Loire », de capacité de 15 000m3, entre le château d’eau de la
Bruffière, commune déjà régulièrement alimentée par la Loire-Atlantique, et l’usine de la Bultière à Chavagnes-en-Paillers. Les travaux débuteront cet été, représentant un coût de 3,3 millions d’euros [5].
Chapitre III: Matériels et méthodes
III.1) Organisation du travail
Janvier + Février + Mars : dénombrement phytoplanctonique des échantillons de l’année 2007
(cf. Annexe 3)
Avril : saisie des données sous informatique (base de données), rédaction du rapport pour l’usine de
la Bultière, et calcul des biovolumes (cf. Annexe 4)
Mai + Juin : analyse des résultats, préparation de la présentation orale pour l’usine de la Bultière et
rédaction du rapport universitaire
3 juillet 2008 : présentation orale de l’évolution du phytoplancton de la Bultière devant les
principaux gestionnaires et acteurs du site d’étude (cf. Annexe 5)
La taxinomie des algues phytoplanctoniques représente la majeure partie de ce travail. En effet, trois mois ont été nécessaires à la détermination des échantillons d’algues de 2007. Puis, une étude des synonymies possible a été menée afin d’éviter que des espèces compter sous deux noms différents apportent des biais aux résultats finaux. Pour finir, la recherche des dimensions des algues pour le calcul des biovolumes cellulaires a été particulièrement importante, tout comme l’exploitation des résultats au travers de l’essai de nombreux tests statistiques.
III.2) Phytoplancton
III.2.1) Prélèvements
Deux stations ont été échantillonnées (cf. figure 4) :
- la station D est située à l’amont du pré-barrage de Preuilly, elle est appelée station E à partir de l’année 2004. Pour des raisons de cohérence, cette station sera appelée station D au cours de ce rapport,
- la station A est située à l’amont immédiat du barrage de la Bultière.
Depuis 1995, différentes méthodes de prélèvement du phytoplancton ont été utilisées. Le plan d'échantillonnage initial a été défini par l'Agence de l'Eau Loire-Bretagne (AELB). Depuis 2005, le printemps, l’été et l’automne ont un effort d’échantillonnage plus important (deux fois par mois) par rapport à l’hiver (une fois par mois). Les prélèvements à des profondeurs précises sont réalisés avec un préleveur en profondeur tandis que ceux de surface sont effectués avec un seau de 10 litres (volume prélevé de 5 litres). Le plan d’échantillonnage est résumé dans les tableaux 5 et 6. Trois méthodes d’échantillonnage ont été utilisées sur ce plan d’eau :
- prélèvement intégré :
o sur 0-5m ou 0-10m en fonction de la profondeur de la station,
o sur la zone euphotique (de la surface à la profondeur équivalent à 2,5 fois la transparence),
o de la surface à la profondeur de la thermocline (uniquement en 1996), - prélèvement à une profondeur donnée :
o à la profondeur de la thermocline,
o à 4m au dessus du fond pour la station A.
La catégorie « non renseignée » correspond aux échantillons reçus au laboratoire pour lesquels la notation de la méthode sur le flaconnage était absente ou effacée.
Tous les prélèvements ont été effectués par l’usine de la Bultière, principalement par Anne LEAUTE.
Tableau 5 - Récapitulatif du plan d’échantillonnage de la Bultière de 1996 à 2007 pour la station D
Tableau 6 - Récapitulatif du plan d’échantillonnage de la Bultière de 1996 à 2007 pour la station A
III.2.2) Traitement des échantillons
Après la récolte, les échantillons sont immédiatement fixés au lugol, réactif iodo-ioduré (cf. figure 5). Ce réactif assure la fixation et la conservation des organismes tout en les alourdissant, ce qui favorise leur sédimentation (Druart, 1981). Il permet également la coloration de l’amidon des cellules, ce qui facilite l’identification. La quantité de lugol ajoutée à l’échantillon dépend de l’âge de la solution et du pH du milieu. Plus un milieu est acide de même que plus la solution a été préparée il y a longtemps, plus la quantité de lugol ajoutée sera importante. Au minimum 8 gouttes de lugol sont ajoutées pour 100 ml d’eau prélevée afin d’obtenir une coloration orangée (Rimet & Druart, 2008a).
III.2.3) Préparation des échantillons
La préparation des échantillons s’effectue selon la technique d’Utermöhl (1958) maintenant normalisée (Afnor (2006) :
Afin de permettre une distribution aléatoire du plancton dans la chambre de sédimentation, l’échantillon et tout le matériel utilisé doivent être à des températures similaires. Ainsi, l’échantillon traité et le matériel sont entreposés dans la salle dans laquelle se fera le comptage environ 12h00 avant le début du comptage (Rimet & Druart, 2008b).
Après agitation de l’échantillon, destinée à remettre en suspension le phytoplancton, 10 ml d’eau sont versés doucement et en une seule fois dans le cylindre surmontant une chambre à plaque Wild (cf. figure 5). La description détaillée d’une chambre à plaque de Wild se situe en annexe 6. Compte tenu de l’abondance du phytoplancton et de la matière organique détritique contenus dans certains échantillons, rendant très difficile le dénombrement des organismes, des dilutions ont été réalisées, les résultats pouvant être de ce fait sous-évalués. Le tout est déposé avec précaution sur un support horizontal, à l’abri de la lumière ou d’une trop forte source de chaleur. Le temps minimal de sédimentation pour un volume de 10 ml est de 8 heures (Rimet & Druart, 2008b) afin que les algues les plus légères, surtout les cyanobactéries, se déposent sur le fond de la chambre à plaque.
Puis, on fait glisser la partie tubulaire supérieure de l’appareil sur la chambre à plaque en faisant suivre immédiatement la lamelle de couverture en verre (cf. figure 5).
La chambre est déposée sur un microscope inversé, en évitant les mouvements rapides et surtout les rotations qui remettraient en suspension les algues, afin de procéder à l’examen qualitatif et quantitatif du phytoplancton (cf. figure 5). La faible épaisseur de la chambre, libérée de la partie tubulaire permet de bonnes conditions d’examen, notamment au contraste de phase.
III.2.4) Identification et dénombrement
L’identification du phytoplancton se fait par rapport à des critères de taille, de présence/absence de flagelles et leur nombre, d’organisation cellulaire (individu ou colonie), et de types de membrane externe.
On utilise un microscope inversé pour dénombrer le phytoplancton, Zeiss Axiovert 135. Ainsi, la source de lumière et le condensateur illuminent la chambre par dessus. Les objectifs sont en dessous, ce qui permet d’observer des spécimens à travers la très fine plaque de verre (0,2 µm) au fond de la chambre et sur laquelle les organismes ont sédimenté. Ce système permet de sédimenter de grandes quantités d’eau, c’est-à-dire concentrer le phytoplancton même s’il est très pauvre. Il permet des observations en contraste de phase. Il est relié à un écran vidéo et à une caméra numérique (Axiocam) permettant de prendre des microphotographies d’organismes.
De façon générale, on utilise les objectifs x20 et x40, ainsi qu’un facteur de multiplication (x 1,6) pour l’identification des algues. En effet, le dénombrement complet des individus d’espèces à densité élevée représente un travail énorme, disproportionné par rapport à la précision qu’il peut fournir. Nous utilisons donc un système d’échantillonnage d’aires à dénombrer. Ce système consiste à dénombrer les organismes se trouvant sur deux bandes disposées selon deux diamètres perpendiculaires (cf. figure 6). La largeur de la bande d’observation est délimitée en utilisant un oculaire de cadrage photo dont la petite dimension correspond à 215 µm, lorsqu’elle est utilisée avec un objectif x20. Ainsi, des deux oculaires (x10) du microscope seulement un seul est muni d’un cadre de comptage délimitant la surface à dénombrer le long de la bande. Au laboratoire INRA, un comptage de 400 objets algaux est requis au minimum, ce qui correspond à une fidélité de 5%, un objet algal étant défini comme une cellule ou un groupe de cellules indépendantes des autres particules de l’échantillon (Rimet & Druart, 2008c). On réalise également un balayage complet de la chambre afin de recenser les autres organismes pouvant être présents en dehors des champs de dénombrement, auxquels on affecte l’effectif 0,2 (Rimet & Druart, 2008c).
III.2.5) Présentation des résultats
Les abondances sont exprimées en nombre de cellules algales, de colonies ou de filaments par litre ou ml d’eau brute. Elles sont obtenues par ajout d’un facteur de multiplication au dénombrement brut, le dénombrement brut étant le comptage des algues au microscope. Ce facteur varie en fonction du volume sédimenté, de la surface de comptage et du grossissement utilisé (cf. tableau 7). S n s N v
avec N: Nombre d’organismes par millilitre
n: nombre d’organismes comptés au microscope S: surface totale de la chambre (en mm²)
s: surface de comptage (en mm²) v: volume sédimenté (en ml)
Le biovolume cellulaire est calculé par rapport aux dimensions moyennes et à la forme géométrique de l’espèce considérée. Pour le calcul de la dimension moyenne d’une espèce, la membrane cellulaire est incluse tandis que la gaine mucilagineuse enveloppant certaines algues est exclue. La détermination du volume cellulaire brut moyen pour chaque espèce permet d’obtenir la biomasse en considérant que la densité des cellules est égale à 1. De nombreux biovolumes cellulaires ont été calculés, essentiellement à partir des dimensions moyennes décrites dans la bibliographie (Rimet & Druart, 2008d), et ajoutés à la base de données INRA (cf. Annexe 4).
La biomasse est calculée par addition des différentes biomasses cellulaires. Elle est exprimée en poids de matières fraîches en mg/m3 ou µg/l d’eau (Rimet & Druart, 2008d). La
biomasse algale représente le stock de phytoplancton présent à un instant.
III.2.6) Précision des résultats
L’échantillon d’eau prélevé subit plusieurs manipulations jusqu’au moment du comptage. Chacune de celles-ci apporte une source de variabilité (Druart, 1981):
- L’erreur d’échantillonnage est très variable selon la répartition du phytoplancton dans la colonne d’eau du lac.
- Si le brassage de la bouteille n’est pas bien réalisé, il y aura une mauvaise répartition des algues et donc une sous-estimation. En effet, on dénombre uniquement les unités cellulaires, qu’elles soient individualisées ou sous forme de colonies.
- La concentration de l’échantillon dans la chambre peut être incomplète à cause de la vitesse de sédimentation très lente de certains groupes (les cyanobactéries par exemple).
- Les échanges thermiques entre les parois du cylindre de la chambre et le laboratoire induisent des courants à l’intérieur de la chambre, ce qui conduit à une distribution hétérogène des organismes. Ainsi, on a parfois un grand nombre d’unités cellulaires en périphérie de la chambre. L’étude des erreurs liées au dénombrement cellulaire aboutit à un calcul de l’erreur possible (E): E=± 2 x 100/(N) % (Nauwerck, 1963) avec N le nombre d’organismes comptés de chaque espèce. Ainsi, lorsqu’on dénombre 400 individus, la précision du résultat est de l’ordre de 10%.
III.3) Paramètres physico-chimiques
III.3.1) Prélèvements
Tous les prélèvements ont été réalisés par Anne LEAUTE, Usine de la Bultière. De 1995 à 2004, un suivi hebdomadaire des flux entrée-sortie a été effectué à partir de trois stations:
- une station amont au niveau de Plessis des Landes,
- une station intermédiaire au niveau du pré-barrage de Preuilly, - et une station en aval du barrage de la Bultière (cf. figure 7).
Différents paramètres ont été analysés selon les années, principalement l’azote Kjeldhal (avant et après filtration), le phosphore total (avant et après filtration), et les orthophosphates.
A partir de 2003, un suivi physico-chimique hebdomadaire de trois colonnes d’eaux sur plusieurs profondeurs a été mis en place:
- la colonne A située à l’amont immédiat du barrage de la Bultière,
- la colonne D située à l’amont du pré-barrage de Preuilly (elle est abandonnée à partir de 2005),
- et la colonne E située au Plessis des Landes (cf. figure 8).
En plus des paramètres cités précédemment, le pH, la température, la chlorophylle a, les phéopigments, les nitrites et les nitrates sont mesurés.
III.3.2) Analyses
Les analyses du phosphore total et de l’azote Kjeldhal sont réalisées par le laboratoire départemental d'analyses vétérinaires de Vendée. Toutes les autres analyses sont réalisées à l’usine de la Bultière par Anne LEAUTE. Ainsi, la méthode Hach-Lange est utilisée pour les orthophosphates entre autres, la méthode Merck pour le fer et le manganèse, et les ultra-violets pour les nitrates.
III.4) Exploitation des résultats
III.4.1) L’indice de diversité de Shannon
L’indice de diversité de Shannon H’ (Shannon & Weaver, 1949) a été calculé afin de représenter la diversité des communautés par la formule :
1
'
ln(
)
S i iq
H
qi Q
Q
avec S : la richesse taxonomique soit le nombre de taxons différents qi : le nombre d’individus observés
Q : le nombre d’individus total
Cet indice a été calculé à l’aide du logiciel Past (Hammer, 2001).
III.4.2) Les groupes fonctionnels de Reynolds
Afin de traduire les caractéristiques écologiques des différentes espèces présentes dans le plan d’eau, les groupes fonctionnels de Reynolds ont été utilisés (Reynolds et al., 2002). En effet, à partir de la structure des assemblages de phytoplancton d’eau douce, Reynolds a regroupé les différentes espèces selon leurs caractéristiques écologiques propres. Ainsi, un groupe correspond à un ensemble d’espèces ayant la même écologie.
III.4.3) Analyses statistiques
III.4.3.1) Méthodes d’ordination
Il est difficile de représenter graphiquement des matrices de données lorsque le nombre d’objets et de descripteurs est élevé. C’est dans ce but que les analyses multivariées ont été développées. Les méthodes d’ordination construisent des vecteurs dans l’espace en relation avec les variables
originales. L’objectif usuel est d’accumuler la variabilité des données dans la première dimension de l’espace, dans le but de maximiser la quantité d’information affichée dans l’espace à deux dimensions. Pour les analyses non-canoniques (une matrice uniquement), l’interprétation des résultats est possible par l’interprétation de la contribution des variables originales tandis que pour les analyses canoniques (deux matrices minimum), il faut considérer la contribution des variables explicatives aux axes canoniques. Le pourcentage de variance expliquée est très important à noter puisqu’il représente le degré de d’explication de l’analyse. Les méthodes d’ordination ont été effectuées avec le logiciel Gingko (De Caceres, 2005).
Paramètres physico-chimiques :
Une Analyse en Composantes Principales (ACP) a été réalisée afin de comprendre l’organisation spatiale des échantillons en fonction des variables physico-chimiques et également de mettre en évidence les relations entre ces variables. Ainsi, l’ACP permet de comparer les caractéristiques physico-chimiques des différentes stations.
Listes floristiques :
Une Analyse Factorielle des Correspondances (AFC) a été utilisée, au premier abord, pour permettre la représentation graphique des échantillons en fonction de leurs listes floristiques. En effet, l’AFC permet d’analyser la structure spatio-temporelle d’un peuplement floristique. Seulement, l’AFC a tendance à maximiser les différences entre échantillons. Ainsi, dans notre cas, il est préférable d’utiliser une analyse Metric Multidimensional Scaling (MDS) à partir d’une matrice des distances. La distance utilisée est celle de Bray-Curtis, majoritairement utilisée lorsque les données sont sous forme d’abondance d’espèces. A la différence de l’ACP, l’analyse MDS ne produit pas de relations entre les descripteurs originaux et les coordonnées principales. Il est possible de combiner l’analyse MDS avec une analyse de groupement, ce qui permet de représenter graphiquement les groupes.
III.4.3.2) Analyse de groupement : K-Means
La méthode de groupement K-Means est une classification algorithmique. Elle compare les échantillons selon la distance de Bray-Curtis. Elle calcule un relevé floristique moyen pour chaque groupe (centroïde) et par itération, cherche à regrouper les échantillons avec les relevés floristiques les plus proches. Cette analyse a été réalisée sous le logiciel Gingko (De Caceres, 2005).
III.4.3.3) Boîtes à moustaches
Le logiciel Past (Hammer, 2001) a été utilisé afin de générer des boîtes à moustaches à partir des valeurs physico-chimiques. Le niveau inférieur de la boîte correspond au premier quartile et le niveau supérieur au troisième quartile. Le trait à l’intérieur de la boîte se traduit par la médiane. Les
moustaches sont dessinées du sommet de la boîte jusqu’au point de donnée inférieur à 1,5 fois la hauteur de la boîte, et de façon similaire pour le bas de la boîte. Les valeurs hors de limites internes sont présentées comme des cercles et les valeurs les plus éloignées que 3 fois la hauteur de la boîte sont présentées par des *.
De plus, ce logiciel a permis le calcul de l’indice de diversité Shannon-Weaver (Shannon & Weaver, 1949) pour les listes phytoplanctoniques.
III.4.3.4) Multi Response Permutation Procedures
Le logiciel PC-ORD (McCune and Mefford, 1999) Afin de savoir quel paramètre exprimé sous forme de classe (année, saison, méthode d’échantillonnage) est le plus pertinent pour regrouper les échantillons, des analyses MRPP (Multi-Response Permutation Procedures) ont été réalisées. C’est un test non paramétrique sur l’absence de différence entre deux ou plusieurs groupes d’entités. L’avantage de ce test est que la normalité et l’homogénéité des variances ne sont pas nécessaires. Lorsque la valeur calculée, A, est positive, cela signifie que l’hétérogénéité des groupes est plus importante que la variabilité due au hasard. Ainsi, plus A est grand, et plus la significativité des groupes est grande. Cette valeur varie entre -1 (groupes rigoureusement identiques) et 1 (groupes complètement différents).
Chapitre IV : Résultats
IV.1) Physico-chimie
IV.1.1) Phosphore
IV.1.1.1) Station D
D’après la figure 9, on constate que l’évolution des teneurs en phosphore total et en orthophosphates est stable de 1995 à 2004. Les concentrations en phosphore total évoluent entre 0,09 et 24,6 mgP.l-1 et celles des orthophosphates entre 0 et 1,63 mg.l-1.
Majoritairement, on constate une augmentation de la concentration en orthophosphates en hiver tandis qu’elle diminue en été. Cela peut s’interprété par une consommation plus importante des algues, car elles sont plus nombreuses à se développer l’été.
IV.1.1.2) Station A
Globalement, les concentrations en phosphore total et orthophosphates sont stables. En effet, le phosphore total varie entre 0,05 et 0,55 mgP.l-1 et les orthophosphates oscillent entre 0,007 et
0,45 mgP.l-1 entre 2003 et 2007 (cf. figure 10). D’après la classification OCDE du statut trophique
des lacs (Annexe 7), la Bultière est considérée comme un lac hyper-eutrophe avec des concentrations en phosphore totale supérieures à 100µg.l-1.
De 2003 à 2005, les teneurs en orthophosphates évoluent de la même façon que celles en phosphore total. A partir de 2006, des écarts se creusent entre ces deux paramètres, notamment pour les mois d’hiver et de printemps. L’année 2007 se distingue des précédentes de avec des teneurs en orthophosphates qui oscillent beaucoup.
Il est étonnant d’avoir des concentrations en orthophosphates supérieures à celles du phosphore total. Cela pourrait s’expliquer par le fait que les deux paramètres ne sont pas analysés par le même laboratoire ni par la même méthode. Ainsi, il y a eu des problèmes lors des dosages des valeurs fortes qui ont été sous-estimées ou sur-estimées par l’une des deux méthodes (Communication personnelle J. Lazzarotto).
IV.1.2) Azote Kjeldahl
Concernant la station D et sur la période 1995-2004, les teneurs d’azote Kjeldahl sont stables, oscillant entre 0,28 et 8,7mgN.l-1. Il en est de même pour la station A et pour la période
2003-2007 où les concentrations évoluent entre 0,4 et 5,6mgN.l-1.
IV.1.3) Chlorophylle a
Les données sont disponibles uniquement pour la station A de 2003 à 2007. Les concentrations en chl a restent importantes malgré une variation en fonction des années. En effet, la
![Tableau 4 - Les objectifs concernant la qualité de l’eau du contrat EVE, d’après [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/11371688.286078/26.892.88.812.196.721/tableau-objectifs-concernant-qualité-l-eau-contrat-eve.webp)