HAL Id: dumas-01735378
https://dumas.ccsd.cnrs.fr/dumas-01735378
Submitted on 15 Mar 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Diagnostic précoce des troubles du spectre autistique
chez l’enfant d’âge préscolaire : étude rétrospective de
cohorte
Lucile Huard
To cite this version:
Lucile Huard. Diagnostic précoce des troubles du spectre autistique chez l’enfant d’âge préscolaire : étude rétrospective de cohorte . Sciences du Vivant [q-bio]. 2017. �dumas-01735378�
AVERTISSEMENT
Cette thèse d’exercice est le fruit d’un travail approuvé par le jury de soutenance et réalisé dans le but d’obtenir le diplôme d’Etat de docteur en médecine. Ce document est mis à disposition de l’ensemble de la communauté universitaire élargie.
Il est soumis à la propriété intellectuelle de l’auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite encourt toute poursuite pénale.
Code de la Propriété Intellectuelle. Articles L 122.4
UNIVERSITÉ PARIS DESCARTES
Faculté de Médecine PARIS DESCARTES
Année 2017
N° 271
THÈSE
POUR LE DIPLÔME D’ÉTAT
DE
DOCTEUR EN MÉDECINE
Diagnostic précoce des troubles du spectre autistique chez l’enfant
d’âge préscolaire : étude rétrospective de cohorte
Présentée et soutenue publiquement
le 23 octobre 2017
Par
Lucile HUARD
Née le 20 avril 1988 à Courcouronnes (91)
Dirigée par Mme Le Docteur Anita Beggiato, PH
Jury :
M. Le Professeur Richard Delorme, PU-PH ……….. Président Mme Le Professeur Caroline Dubertret, PU-PH
M. Le Professeur Bruno Étain, PU-PH
Remerciements
Je remercie Monsieur le Professeur Richard Delorme, Madame le Professeur Caroline Dubertret, Monsieur le Professeur Bruno Etain et Madame le Docteur Florence Vorspan de l’honneur qu’ils me font en acceptant d’être membre de ce jury de thèse.
Je remercie chaleureusement toutes les personnes qui m’ont aidée à l’élaboration de ma thèse et notamment ma directrice, Madame le Docteur Anita Beggiato, pour son intérêt, sa motivation, sa grande disponibilité et ses nombreux conseils pour la rédaction de ma thèse. Je remercie également Myriam Zarzour pour son aide dans le recueil des données cliniques.
À Monsieur le Docteur Christophe Bouché, avec qui j’ai expérimenté l’autonomie grâce à la confiance qu’il a placée en moi. L’intérêt qu’il a eu pour mes travaux, ses questions et nombreux conseils ont permis d’améliorer le propos de cette thèse.
Je tiens également à remercier toute l’équipe du service de l’intersecteur 6 du Docteur Pérouse de Montclos. Merci à Sandrine Deloche, Marie Terral-Vidal et Mathias Gorog pour leur finesse clinique, leur invitation à me questionner sur mon statut, mon rôle et ma fonction mais également sur la position de savoir.
Je souhaite exprimer ma gratitude à Monsieur le Docteur Jérôme Pellerin qui par un merveilleux don d’observation, d’écoute et d’apaisement a contribué à façonner mon regard sur la psychiatrie, m’invitant toujours à de nouvelles réflexions.
À Monsieur le Docteur Philippe Delmaire avec qui j’ai eu beaucoup de plaisir à plaisanter et à qui je souhaite sincèrement un joyeux anniversaire.
Le Docteur Armelle Cadoret fut une rencontre exceptionnelle. Ses enseignements et son dynamisme ont largement participé à mes choix professionnels.
Mille mercis à Mme Bisson, professeur de Français et Latin, pour qui les corrections grammaticales et orthographiques de cette thèse n’ont pas dû être une sinécure.
Une pensée tendre pour mes amis, en particulier pour Cora, Virginie, Marie, Axelle et ma famille. À ceux qui ont compris et supporté mon emploi du temps surchargé. Leurs présences et leurs encouragements m’ont accompagnée tout au long de ses dix années d’étude.
À la mémoire de mon grand-père, René Garnier.
Merci tout particulièrement à Lionel, de m’avoir soutenue et encouragée durant toutes ces années. Merci de m’avoir supportée dans les moments difficiles de mon cursus et surtout d’être aussi « sympas ». Merci de m’apporter Amour, Attention et Tendresse.
Table des matières
REMERCIEMENTS ... 2
INTRODUCTION ... 5
CHAPITRE 1 :DESCRIPTION CLINIQUE ... 5
1.1 : Critères diagnostiques ... 5
1.2 : Signes précoces des TSA ... 6
CHAPITRE 2 :ÉPIDEMIOLOGIE ET COMORBIDITES ... 7
2.1 : Épidémiologie et sex-ratio ... 7
2.2 : Comorbidités ... 7
CHAPITRE 3 :ÉTIOLOGIES ET FACTEURS DE RISQUE ... 8
3.1 : Facteurs génétiques ... 8
3.2 : Facteurs de risque environnementaux ... 9
3.3 : Hypothèses neurodéveloppementales précoces ... 11
CHAPITRE 4 :DEPISTAGE ET DIAGNOSTIC ... 11
4.1 : Outils d’aide au dépistage ... 11
4.2 : Outils d’aide au diagnostic : ... 12
CHAPITRE 5 :PRISE EN CHARGE ... 13
5.1 : Traitements comportementaux ... 13
5.2 : Action auprès des parents ... 14
5.3 : Traitements éducatifs et rééducatifs ... 14
5.4 : Pédagogie ... 14
5.5 : Traitements médicamenteux ... 15
CHAPITRE 6 :PROBLEMATIQUE ET OBJECTIF ET L’ETUDE ... 15
PREMIERE PARTIE : SUJETS ET METHODE ... 16
CHAPITRE 1 :METHODES DE SELECTION DES SUJETS ... 16
1.1 : Critères d’inclusion ... 16
1.2 : Critère de non inclusion ... 16
CHAPITRE 2 :METHODES D’EVALUATION CLINIQUE ... 16
2.1 : Équipe multidisciplinaire ... 16
2.2 : Entretien médical, anamnèse ... 16
2.3 : Évaluation du développement cognitif ... 17
2.4 : Bilan orthophonique ... 18
2.5 : Bilan psychomoteur ... 18
2.6 : Évaluation des symptômes autistiques ... 19
CHAPITRE 3 :METHODES D’EVALUATIONS STATISTIQUES ... 20
3.1 : Description de la cohorte ... 20
3.2 : Comparaison entre les groupes TSA et NonTSA ... 22
3.3 : ADOS et développement cognitif ... 22
3.4 : Influence des facteurs de risque sur le diagnostic et sur la sévérité de l’autisme ... 23
CHAPITRE 4 :ÉTHIQUE ... 23
PARTIE 2 : RESULTATS ... 24
CHAPITRE 1 :DESCRIPTION DE LA COHORTE ... 24
1.1 : Caractéristiques démographiques et signes d’alerte ... 24
1.2 : Facteurs de risque de TSA ... 25
1.3 : Caractéristiques cliniques ... 26
CHAPITRE 2 :COMPARAISON ENTRE LES GROUPES TSA ET NON TSA ... 28
2.1 : Caractéristiques démographiques et cliniques ... 28
2.2 : Facteurs de risque de TSA ... 29
2.3 : Caractéristiques cliniques évaluées par des outils standardisés ... 30
CHAPITRE 3 :ADOS ET DEVELOPPEMENT ... 32
CHAPITRE 4 :INFLUENCE DES FACTEURS DE RISQUE SUR LE DIAGNOSTIC ET SUR LA SEVERITE DE
L’AUTISME ... 33
4.1 : Influence des facteurs de risque et de leur accumulation sur le diagnostic provisoire de TSA ... 33
4.2 : Moyenne de l’ADOS en fonction des facteurs de risque ... 34
PARTIE 3 : DISCUSSION ... 37
CHAPITRE 1 :RESULTATS PRINCIPAUX, IMPLICATION MAJEURE ET HYPOTHESES ... 37
1.1 : Description de la cohorte ... 37
1.2 : Comparaison entre les groupes TSA et NonTSA ... 38
1.3 : ADOS et développement cognitif ... 38
1.4 : ADOS et facteurs de risque ... 38
CHAPITRE 2 :COMPARAISON AVEC LA LITTERATURE ... 38
2.1 : Comparaison entre les groupes TSA et NonTSA ... 38
2.2 : TSA et développement cognitif ... 39
2.3 : ADOS et facteurs de risque ... 40
CHAPITRE 3 :LIMITES DU TRAVAIL ... 41
3.1 : Limites liées au type d’étude ... 41
3.2 : Limites liées aux méthodes d’évaluation clinique ... 41
3.3 : Limites liées aux méthodes d’évaluation statistiques ... 41
CHAPITRE 4 :PERSPECTIVES ... 42
CONCLUSION ... 43
BIBLIOGRAPHIE ... 45
INTRODUCTION
Chapitre 1 : Description clinique
Dans la cinquième édition du Manuel Diagnostique et Statistique des troubles mentaux (DSM-5) (1), les diagnostics de trouble autistique, de syndrome d’Asperger ou de trouble envahissant du développement non spécifié, décrits de façon catégorielle dans la précédente version du DSM, sont regroupés au sein d’une même entité diagnostique : les troubles du spectre de l’autisme (TSA) (2).
Les TSA sont des troubles neurodéveloppementaux précoces, définis par des déficits persistants de la communication et des interactions sociales associés à un caractère restreint et répétitif des comportements, des intérêts ou des activités. Lorsque le diagnostic est posé, il doit être spécifié s’il est associé ou non à un déficit intellectuel, à une altération du langage, à une pathologie médicale ou génétique connue ou à un facteur environnemental.
La nouvelle classification permet de mieux prendre en compte l’importante hétérogénéité clinique, neurobiologique et étiologique de ces troubles, outre à mettre en évidence le caractère dimensionnel des symptômes.
1.1 : Critères diagnostiques
Les critères diagnostiques des TSA, selon le DSM 5 peuvent être ainsi résumés :
A. Déficits persistants de la communication sociale et des interactions sociales dans différents contextes, non expliqués par le retard global et manifeste dans les 3 cas suivants :
1. Manque de réciprocité sociale et émotionnelle; allant de l'approche sociale anormale et du défaut d’alternance dans la prise de la parole, avec un partage d'intérêts, d’émotions, et d’affects, ainsi qu’une réponse, réduits, jusqu’à à l'absence totale d’initiation de l'interaction sociale,
2. Défauts d’utilisation des comportements communicatifs non verbaux utilisés pour l'interaction sociale; allant d’une intégration pauvre de la communication verbale et non verbale jusqu’à l’absence totale d’expression faciale et de gestes, en passant, par le biais des anomalies dans le contact visuel et le langage du corps, ou des déficits dans la compréhension et l'utilisation de la communication non verbale, pour un total manque d'expression faciale ou des gestes.
3. Défaut de développement et de maintien de relations sociales correspondant au niveau de développement en dehors des relations avec les aidants, allant de difficultés à ajuster son comportement pour s'adapter à différents contextes sociaux jusqu’à une absence apparente d'intérêt pour les gens, en passant par des difficultés à partager des jeux imaginatifs et à se faire des amis.
B. Aspect restreint, répétitif des comportements, des intérêts, ou des activités qui se manifeste par au moins deux des éléments suivants:
1. Caractère stéréotypé ou répétitif du langage, des mouvements moteurs, ou de l'utilisation des objets; (comme des stéréotypies motrices simples, une écholalie, une utilisation répétitive des objets, ou utilisation idiosyncrasique de phrases) 2. Adhésion excessive à des routines, des modèles de comportement verbal ou non verbal ritualisés, ou une résistance excessive au changement; (comme des rituels moteurs, une insistance à prendre le même chemin ou consommer la même nourriture, des questions répétitives ou une détresse extrême lors de petits changements).
3. Intérêts très restreints, fixes avec un caractère anormal dans leur intensité ou leur contenu; (comme un attachement fort ou des préoccupations concernant des objets inhabituels, intérêts excessivement circonscrits ou persévérants).
4. Hyper ou hypo-réactivité à des stimuli sensoriels ou intérêt inhabituel pour des caractéristiques sensorielles de l'environnement; (comme une indifférence apparente à la douleur, à la chaleur ou au froid, réponse négative à des sons ou des textures spécifiques, flairage ou toucher excessif des objets, fascination pour les lumières ou les objets tournants).
C. Les symptômes doivent être présents dans la petite enfance mais peuvent ne devenir manifestes que lorsque les exigences sociales dépassent les capacités limitées
1.2 : Signes précoces des TSA
Certains critères du DSM-5 ne sont pas appropriés pour les nourrissons et les jeunes enfants, qui peuvent présenter des signes aspécifiques et évolutifs selon différentes trajectoires développementales (3)(4); ainsi, un diagnostic définitif ne peut donc pas être posé avant l’âge de 3 ans.
Plusieurs études, en particulier rétrospectives, ont mis en évidence des signes repérables avant les 12 mois (5)(6)(7)(8) (9)(10):
Cependant, cette description a été mise en évidence chez des enfants présentant des troubles autistiques sévères. Elle n’est ni spécifique ni majoritaire (5).
De 0 à 6 mois : Le bébé peut être décrit comme sage, qui ne pleure pas et ne réclame pas. Sur le plan moteur, il peut présenter une hypotonie ou une hypertonie avec des gesticulations incessantes. Son visage peut être figé. Il peut y avoir un décrochage du regard et une absence de sourire réponse à partir du 3e mois. Des troubles du sommeil (insomnies calmes) et des troubles alimentaires (trouble de la succion ou anorexie) peuvent être associés.
De 6 à 12 mois : L’enfant peut sembler hypotonique ou hypertonique. Il peut refuser le contact et ne pas tendre les bras. On peut observer un évitement du regard avec une amimie. Sur le plan du langage, Il est possible que l’enfant ne babille pas et ne vocalise pas. Il peut y avoir une absence de réaction face à l’étranger ainsi qu’une indifférence aux séparations et aux retrouvailles. Enfin, il peut émerger des activités stéréotypées.
De 12 à 30 mois : Il est possible que le langage ne se développe pas. L’enfant peut refuser l’attention conjointe et ne pas utiliser le pointage. Les stéréotypies, les maniérismes et les intérêts pour des objets inhabituels peuvent être de plus en plus marqués. Les troubles du sommeil et alimentaires peuvent également s’accentuer (insomnie, trouble de l’endormissement, refus des morceaux, sélectivités).
À partir d’études prospectives plus récentes effectuées sur des fratries à risque de TSA (fratries d’enfants ayant déjà reçu un diagnostic de TSA) depuis leur naissance (11), les chercheurs tentent actuellement de retrouver des marqueurs comportementaux, biologiques ou neurophysiologiques précoces de façon plus solide.
Ces études de fratries ne retrouvent pas de précurseur comportemental spécifique durant la première année de vie chez les enfants diagnostiqués TSA à 36 mois (12)(13)(14). Notamment, les mécanismes impliqués dans les interactions sociales semblaient préservés lors du développement très précoce (15).
Les symptômes cliniques propres de TSA semblent émerger seulement après la première année puis s’accumulant au cours de la deuxième année de vie (11)(15)(16).
D’après une révision qualitative de la littérature de Zwaingenbaum et al, les signes de TSA les plus fréquemment présents entre 12 et 24 mois sont (9):
Ø Attention et communication sociales : Il peut s’agir d’une réduction, d’un développement atypique, d’une régression ou d’une perte des compétences d’interaction et de la communication sociale (verbale et non verbale). La réponse à l’appel du prénom peut donc être inconstante ou absente. De même, le contact visuel peut être fluctuant, fuyant ou inexistant. L’attention conjointe, le partage des émotions et les gestes de communication pourront être moins fréquents et moins bien coordonnés (sourire social ou réciproque, regard, expressions faciales adaptées, pointage en coordonnant le regard, vocalisations). L’attention conjointe étant associée à l’acquisition du langage il peut également y avoir un retard ou un développement atypique du langage. Les enfants peuvent par exemple, éprouver des difficultés de
18 mois ou l’utilisation écholalique de certains mots ou morceaux de phrase. L’intonation de leur voix peut paraître inhabituelle.
Ø Utilisation atypique et répétitive des objets : Il peut être observé des manipulations, des explorations, des actions ou des utilisations inhabituelles et répétitives de jouets ou d’autres objets de manière excessive, comme des rotations, des alignements ou des tris par catégorie.
Ø Mouvements atypiques/répétitifs et développement moteur atypique : L’enfant peut également manifester des mouvements répétitifs et emprunter des postures inhabituelles des bras ou des doigts (flapping). Ces actions peuvent être présentes de manière transitoire dans certaines phases du développement typique de l’enfant, mais de façon moins fréquente et moins intense. Il peut s’agir également d’un contrôle moteur atypique (hypotonie musculaire ou instabilité motrice, contrôle postural réduit pour l’âge, régulation motrice inhabituelle) ou d’un retard dans la motricité fine et/ou globale.
Ø Particularités sensorielles: Il peut être observé une hypo ou une hyper réactivité aux stimuli sensoriels avec soit une recherche de tels stimuli, soit une réaction semblant exagérée lorsqu’ils y sont confrontés. Cette particularité peut s’exprimer dans tous les champs sensoriels : visuel (rotation d’objets, fixation des lumières, regards périphériques), auditif (chantonner, se boucher les oreilles), gustatif (mise en bouche d’objet, refus des morceaux), tactile (recherche de textures douces ou rugueuses, refus de porter certains vêtements) ou vestibulaire (marche sur la pointe des pieds).
Ø Dysrégulation des fonctions primaires : Comme déjà citées plus haut, des perturbations du sommeil, de l’alimentation et des émotions peuvent se manifester dès les premiers mois de la vie.
Chapitre 2 : Épidémiologie et comorbidités
2.1 : Épidémiologie et sex-ratio
En 2017, l’OMS estime qu’un enfant sur 160 présente un TSA tandis que Brugha et al (2012) estime la prévalence des TSA à 1% (17)(18). Cette prévalence semble avoir augmenté au cours des cinquante dernières années (19)(20). Nous pouvons en partie expliquer cette augmentation par l’élargissement des critères de diagnostic, une meilleure connaissance du trouble, une plus grande sensibilisation au TSA, le développement d’outils diagnostiques plus performants permettant un repérage plus précoce, mais aussi l’augmentation de certains facteurs de risque (comme l’âge parental) (21)(22). Cependant, cette augmentation interroge également sur l’existence de nouveaux facteurs de risque non encore identifiés.
Le sex-ratio moyen de 4 garçons pour 1 fille a tendance à s’équilibrer en cas de déficience intellectuelle associée ou chez les patients présentant des caractéristiques de dysmorphie (23)(22).
2.2 : Comorbidités
Les principales pathologies identifiées et fréquemment associées aux TSA d’après Levy et al. (2010) sont répertoriées dans la Table a (26).
Table a : Principales pathologies fréquemment associées aux TSA d’après Levy et al (2010)
Pathologies associées au TSA Fréquence estimée (%) dans les TSA
- Déficience intellectuelle 40 - 80 %
- Trouble du langage 50 - 63%
- Retard psychomoteur 9 - 19 %
- Épilepsie 5 - 49 %
- Tics 8 - 10 %
- Trouble obsessionnel compulsif 37 %
- TDAH 40 - 60 %
- Dépression 2 - 50 %
- Trouble anxieux 43 - 84 %
- Sélectivité alimentaire 30 - 90 %
- Reflux gastro-oesophagien, constipation 8 - 59 %
- Trouble du sommeil 40 - 86%
TDAH : trouble déficitaire de l’attention avec hyperactivité
Chapitre 3 : Étiologies et facteurs de risque
3.1 : Facteurs génétiques
L’implication des facteurs génétiques dans les TSA est aujourd’hui bien établie.
Actuellement, plus de 250 gènes impliqués ont été identifiés. Pour la plupart, il s’agit de gènes communs aux déficiences intellectuelles et souvent ces anomalies génétiques donnent un tableau d’autisme qui présente plusieurs comorbidités (TSA, dysmorphie, déficit cognitif et anomalie du développement) (22)(27)(28)(29). Une liste non exhaustive des principales anomalies génétiques d’après Tordjaman et al. (2014) figure dans la Table b (30)(31).
Ce modèle donne une explication à l’hétérogénéité étiologique et phénotypique (32)(33) des TSA en les considérant comme un catalogue de nombreuses formes génétiques, allant des modèles monogéniques aux modèles polygéniques. En effet, la susceptibilité génétique pourrait être différente d’un individu à l’autre avec une combinaison de variantes à risque rares et d’une multitude d’allèles à faible risque. Quand une seule mutation de novo peut être suffisante pour causer un TSA chez certains, l’accumulation d’allèles à faible risque augmentera le risque de manière additive chez d’autres. Pour certains, un fonds génétique
pourrait tamponner l’impact des variations génétiques rares, tandis que pour d’autres cette capacité tampon ne sera pas suffisante (34)(23).
3.1.1 : Héritabilité
Bien que les causes restent méconnues, les études portant sur jumeaux, publiées entre 1977 et 2015, ont permis de montrer une contribution de la génétique à l’étiologie des TSA. Pour
Tordjman et al (2014), le risque pour les fratries d’autistes est estimé à 3 % (30). Pour Ozonoff et al (2011), des estimations catégoriques du risque de récurrence intrafamiliale ont indiqué que les frères et sœurs d’enfants atteints de TSA ont un risque relatif de 10 à 20 fois plus élevé de développer le trouble lors de leur troisième année (35). L’héritabilité des TSA a pu être imputée à 50 % (23)(36)(16).
Les premières études ont associé des variants génétiques au TSA. Les grandes anomalies chromosomiques ont une prévalence estimée à moins de 2 % dans la population générale. Chez les patients atteints de TSA, on retrouve ces anomalies dans 4 à 7 % des cas (37). En moyenne, dans la population générale, un individu a 3 millions de variants génétiques par rapport à la séquence de référence du génome humain. La majorité des variants (95 %) sont qualifiés de « communs » quand ils sont partagés avec plus de 5 % de la population humaine. On estime que certains variants communs contribuent à l’apparition des TSA dans 40 % des familles simples (un cas de TSA dans la famille) et dans 60 % des familles multiplex (au moins deux cas de TSA dans la famille) (23). De leur côté, Gaugler et al. (2014) fournissent une estimation de l’héritabilité à 52,4 % qui serait exclusivement due à des variants communs, laissant seulement 2,6 % de la responsabilité aux variants rares (38).
3.1.2 : Mutation de novo
Une méta-analyse a révélé que des mutations de novo étaient plus fréquentes chez les patients atteints de TSA que chez les frères et sœurs non affectés. Ces mutations de novo ont été le plus souvent associées à un faible quotient intellectuel non verbal (39). Les études ont également indiqué que ces mutations de novo sont probablement des gènes impliqués dans les fonctions synaptiques tels que NLGN3, NLGN4X et SHANK3 (34)(23)(40)(39)(41). Cela a contribué à l’élaboration de l’hypothèse qu’une plasticité synaptique anormale et qu’un défaut de l’homéostasie neuronale/synaptique peuvent augmenter le risque de TSA (34)(23).
Table b: Quelques maladies génétiques associées au TSA d’après Tordjman et al. (2014) et Leblond et al. (2014)
Maladie génétique Fréquence estimée (%) dans les TSA Déficit intellectuel Symptômes associés aux symptômes de TSA
Anomalies chromosomiques
Syndrome d’Angelman (del
15q11-q13*) 1 Sévère
Dysmorphie faciale, microcéphalie, épilepsie, ataxie, TDAH
Duplication 15q11-q13* ? Sévère Épilepsie, hypotonie
Trisomie 21 2,5 Variable Dysmorphie faciale, malformations cardiaques et intestinales Délétion 22q13
(impliquant SHANK 3) 0,69 Sévère Hypotonie, tolérance à la douleur
Mutation d’un gène isolé
X fragile 2,5 - 5 Variable Dysmorphie faciale, macro-orchidie TDAH, hyper réactivité sensorielle Sclérose tubéreuse 1 – 4 Variable Anomalie de l’ectoderme, lésions rénales, épilepsie,
trouble des apprentissages Syndrome de Rett (mutation
MECP2) < 5 Sévère
Microcéphalie acquise, apraxie, ataxie, tremblement
Stagnation développementale (6-18 mois) puis régression (12-36 mois)
Phénylcétonurie ? sévère Eczéma, hypertonie, épilepsie, hypo pigmentation. Accès de colère, TDAH
3.2 : Facteurs de risque environnementaux
Outre les causes et facteurs de risque génétique, il existe de nombreux facteurs environnementaux. À l’heure actuelle, il est difficile de déterminer le réel impact de ces facteurs de risque et certains d’entre eux restent controversés (la migration (42)(43), la pauvreté (44) ou encore la dépression maternelle (45)). Nous avons repris dans la table c les principaux facteurs environnementaux décrits dans la littérature d’après Guinchat et al. 2012
Table c : Principaux facteurs de risque environnementaux de TSA d’après Guinchat (2012)
Facteurs de risques Auteurs Définition risque associé Facteurs épidémiologiques et socioéconomiques
- Âge maternel avancé Blider (2009), Buchmayer (2009), Burstyn (2010)
Âge au moment de la procréation > 30 ans
1,6
- Âge paternel avancé Zhang (2010), Hultman (2011),
Grether (2009) Âge au moment de la procréation > 30 ans 2,1 ; 1,34 ; 3,10
- Dépression maternelle Rai (2012)
EDM chez la mère avant ou pendant la grossesse 1,49 3,34 (si antidépresseur )) Facteurs maternels
- Diabète gestationnel Dodds (2011), Burstyn (2010), Buchmayer (2009)
GAJ > 7mmol/L pendant la grossesse. 2,07 - Menace d’accouchement prématuré Langridge (2013) Contraction régulière et prolongée + modification du col avant 37 SA ?
- Pré-éclampsie Buchmayer (2009), Dodds (2011), Burstyn (2010) HTA gravidique Protéinurie 1,64 ; 1,49 ; 1,69 - Psychotropes, drogues Dodds (2011) Prise de toxique pendant la grossesse 1,46 Facteurs périnataux
- Césarienne Burstyn (2010), Haglund (2011),
Maimburg (2006) Naissance par césarienne 1,83 1,23 - Retard de croissance in utero Burstyn (2010), Hultman (2011), Haglund (2011) PDN, TDN et PCN < 2DS 1,3 ; 3 ; 7,1
- Infection néonatale Buchmayer (2009), Atladottir (2010)
Hypo ou hyper thermie + hypotension ± trouble respiratoire ± splénomégalie chez la mère ou l’enfant pendant ou après accouchement 1,5
- Souffrance néonatale Buchmayer (2009), Burstyn (2010),
Maimburg (2006)
Hypoxie Apgar 5min < 6
1,97 3,2
Facteurs liés aux paramètres de naissance
- Prématurité o < 37 SA Buchmayer (2009), Dodds (2011), Durkin (2008) Naissance avant le terme de 37 SA 1,44 ; 1,4 ; 2,2 o < 35 SA Larsson (2005), Zhang (2010) 2,57 o < 33 SA Schendel (2008), Eaton (2001) 5,4 o < 28 SA Durkin (2008), Johnson (2010) 2,8 - Petit poids de naissance Mann (2010), Kamel (2010), Wilkerson (2002) PDN < 2 DS ? - Petite taille de naissance Hultman (2011), Buchmayer (2009), Eaton (2011) TDN < 2 DS 1,86 ; 2,1 ; 1,32
- Microcéphalie Courchesne (2003), Karmel (2010) PCN < 2 ou 3DS ?
EDM : épisode dépressif majeur ; GAJ : glycémie à jeun ; HTA : hypertension artérielle ; SA : semaine d’aménorrhée; PDN : poids de naissance ; TDN : taille de naissance ; PCN : périmètre crânien de naissance ; DS : déviation standard ; (45)(47)(48)(49)(50)(51) (52)(53)(54) (55)(56)(57)(58)(59)(60) (61)(62)
3.3 : Hypothèses neurodéveloppementales précoces
Bien que de nombreuses causes (génétiques et environnementales) aient pu être mises en évidence, l’étiopathogénie des TSA reste encore à explorer. Quels sont les mécanismes neurodéveloppementaux responsables de ces manifestations cliniques hétérogènes ?
Grâce à la neuro-imagerie, des atypicités des réseaux spécialisés dans le traitement de l’information sociale (le cortex orbitofrontal, l’amygdale et le sillon temporal supérieur) ont pu être mises en évidence chez les patients diagnostiqués TSA (63)(64)(65). Ces atypicités pourraient être à l’origine d’un dysfonctionnement très précoce impactant le développement des compétences sociales (66). Des études d’imagerie spectroscopique proche infrarouge fonctionnelle ont également mis en évidence un défaut de spécialisation de ces régions chez des enfants à risque de TSA âgés de 6 mois (67).
Nous pouvons donc supposer que, quelle que soit la cause, elle semble impacter le développement précoce du cerveau, ce qui engendre des dysfonctionnements en cascade à l’origine des manifestations physiologiques patentes (34)(68)(69)(22).
Cependant, on observe une asynchronie entre l’apparition des premières anomalies physiologiques et l’émergence des premiers symptômes autistiques. En effet, plusieurs études ont décrit des symptômes de TSA émergeant seulement après la première année de vie avec notamment une capacité de reconnaissance émotionnelle et sociale complexe préservée (11)(15)(16). Pour expliquer cette asynchronie, Jones & Klin ont accrédité l’hypothèse que les dysfonctionnements neurodéveloppementaux surviendraient lors de la maturation de ces réseaux impliqués dans la reconnaissance sociale au cours de la première année de vie (6).
Chapitre 4 : Dépistage et diagnostic
Le diagnostic et la prise en charge précoces ont démontré avoir un impact positif significatif sur le pronostic d’évolution des enfants atteints de TSA (70)(71)(72)(73).
L’Académie Américaine de Pédiatrie recommande un dépistage des enfants entre 18 et 24
mois(74)(75), et, en France, les recommandations de bonne pratique de la HAS préconisent,
pour les enfants dépistés, une confirmation diagnostique à partir de l’âge de 2 ans (76)(77). Pourtant, les études épidémiologiques à grande échelle suggèrent que l’âge moyen du diagnostic est situé entre 4 et 5 ans (78)(79)(80).
L’absence de marqueurs diagnostiques biologiques et l’hétérogénéité étiologique rendent le dépistage et le diagnostic de TSA difficile. Cependant, nous disposons d’outils cliniques permettant de les identifier avec une certaine solidité entre 18 et 24 mois de l’enfant et un diagnostic définitif, selon le DSM-5, peut être posé à l’âge de 36 mois (81)(82)(9).
4.1 : Outils d’aide au dépistage
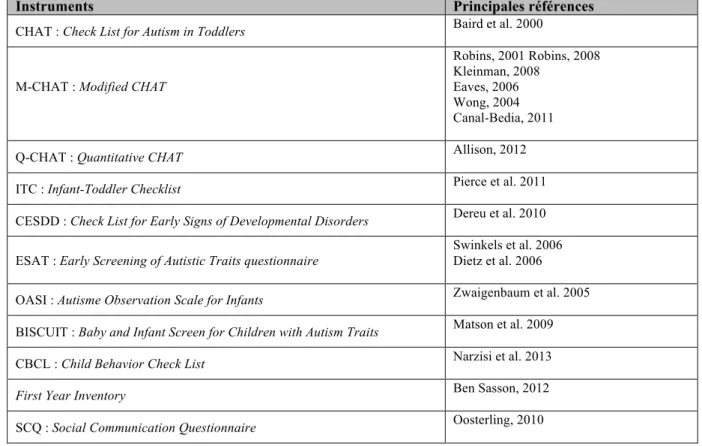
Des outils de dépistage, listés dans la Table d, ont été développés pour accompagner les pédiatres et les médecins généralistes lors du repérage des signes précoces de TSA afin de les orienter vers des équipes expérimentées dans le diagnostic des TSA (22). Il s’agit pour certains (CHAT, M-CHAT) de questionnaires parentaux accessibles en ligne et ne nécessitant aucune formation particulière.
Table d : Principaux instruments de dépistage précoce des TSA d’après Cohen et Marcelli (2015) et Zwaigenbaum et al. (2015)
Instruments Principales références
CHAT : Check List for Autism in Toddlers Baird et al. 2000
M-CHAT : Modified CHAT
Robins, 2001 Robins, 2008 Kleinman, 2008
Eaves, 2006 Wong, 2004 Canal-Bedia, 2011
Q-CHAT : Quantitative CHAT Allison, 2012
ITC : Infant-Toddler Checklist Pierce et al. 2011 CESDD : Check List for Early Signs of Developmental Disorders Dereu et al. 2010 ESAT : Early Screening of Autistic Traits questionnaire
Swinkels et al. 2006 Dietz et al. 2006 OASI : Autisme Observation Scale for Infants Zwaigenbaum et al. 2005 BISCUIT : Baby and Infant Screen for Children with Autism Traits Matson et al. 2009 CBCL : Child Behavior Check List Narzisi et al. 2013
First Year Inventory Ben Sasson, 2012
SCQ : Social Communication Questionnaire Oosterling, 2010 (83)(84)(85) (86)(87)(88) (89)(90)(91) (92) (93)(94) (95)(96)(97)(98)
4.2 : Outils d’aide au diagnostic :
À ce jour, nous ne disposons d’aucun examen complémentaire ou clinique permettant de poser avec certitude un diagnostic de TSA, qui reste essentiellement clinique. C’est pourquoi des échelles ont été développées pour orienter le diagnostic et évaluer la sévérité. La Table e cite les principaux instruments d’évaluation diagnostique et de sévérité des symptômes (22).
Table e : Principaux instruments d’évaluation des symptômes TSA
Instruments
Âge Principales références
ADOS-2 : Autism Diagnostic Observation
Schedule-2
Tout âge (5 modules en fonction de l’âge et du niveau
de langage) Lord et al. 2000 ADI-R : Autism Diagnostic Interview-Revised Vers 5 ans ou actuel Lord et Rutter. 1994 Vineland Adaptative Behavior Scales II Tout âge Sparrow et al. 1984 CARS : Childhood Autism Rating Scale Tout âge Schopler et al. 1980 BECS : Batterie d’Évaluation Cognitive et
Socioémotionnelle < 24 mois d’âge de développement Jl Adrien. 2008 ECA-R : Échelle d’évaluation des Comportements
Autistique-Révisée Tout âge Lelord et al. 1989 (99)(100)(101)(102)(103)(104)
La HAS recommande que chaque évaluation des TSA soit accompagnée de bilans complémentaires (105) (106). Par exemple :
Ø Une évaluation des fonctions cognitives.
Ø Un bilan orthophonique afin d’évaluer les compétences de communication verbale et non verbale.
Ø Un bilan psychomoteur et sensorimoteur afin d’évaluer un éventuel retard psychomoteur et élaborer un profil sensoriel.
Ø Un bilan neuropédiatrique (associé à EEG et IRM cérébrale) afin d’exclure des syndromes neurologiques comme les syndromes épileptiques associés au TSA, les encéphalopathies déficitaires et les syndromes génétiques associés à un déficit intellectuel (syndrome de l’X fragile, de Williams etc.).
Ø Un bilan génétique à la recherche d’un X fragile et de nouvelles copies de variants par la méthode CGH-array.
Ø La recherche de certaines maladies métaboliques rares comme un déficit en créatine.
Chapitre 5 : Prise en charge
La méconnaissance des origines étiologiques fait que l’approche thérapeutique dépend des conceptions théoriques du clinicien. Le traitement des TSA est donc sujet à des enjeux dogmatiques. Cependant, la majorité des cliniciens s’accordent à l’heure actuelle sur la nécessité d’une approche pluri focale s’adaptant aux situations individuelles. En 2012, la HAS rédige des recommandations visant à optimiser les prises en charge précoces basées sur des interventions scientifiquement validées. Le 3e plan autisme, établi en 2013, a été élaboré à partir de ces recommandations (107).
Actuellement, les programmes thérapeutiques cités s’adressent à des enfants présentant déjà des symptômes de TSA marqués (71). Il n’existe pas à ce jour de modèle thérapeutique efficient pour prévenir l’apparition des TSA chez les enfants encore asymptomatiques (69). Narziris et al. 2012 rappellent les grands principes généraux qui devraient guider tout programme de soins pour les enfants atteints de TSA (108):
1. Débuter le traitement le plus tôt possible.
2. Diminuer les délais entre diagnostic de TSA et début de prise en charge. 3. Proposer un traitement intensif (au moins 3 à 4 h de traitement par jour). 4. Favoriser l’implication familiale dans les soins.
5. Proposer des évaluations régulières (1x 6 mois) pour suivre l’évolution de l’enfant et adapter les soins.
6. Choisir un programme global comportemental ou développemental en fonction de la réponse de l’enfant.
7. Encourager la réponse spontanée.
8. Promouvoir les habiletés sociales à travers les jeux avec les pairs.
9. Garder en perspective l’acquisition de nouveaux apprentissages, leur maintien et leur généralisation en contexte naturel.
10. Promouvoir les comportements adaptés plutôt qu’interdire les comportements inadaptés.
5.1 : Traitements comportementaux
L’Applied Behavior Analys (ABA) basée sur les principes du conditionnement est un traitement développé dans les pays anglo-saxons visant au renforcement des comportements
positifs et à l’extinction des comportements négatifs. Il s’agit d’un programme nécessitant une importante intensité des prises en charge dans un rapport de 1 pour 1 (109).
Le programme de Denver ou Early Start Denver Model (EDSM) est, quant à lui, un programme nord-américain plus développemental, respectant certaines étapes et lignes de développement de l’enfant (110)(111). Le travail est ciblé sur la zone proximale de ses difficultés. Il a été spécialement développé pour les enfants atteints de TSA âgés de 12 à 48 mois.
5.2 : Action auprès des parents
L’implication des parents est un critère d’évolution favorable. Il peut alors leur être proposé outre de la guidance parentale, la participation à des groupes de formation de parents(112). Le Pre-scool Autism Communication Trial (PACT) est un modèle d’intervention précoce ( dès l’âge de 2 ans) développé par Jonathan Green qui a pour but d’aider les parents à communiquer avec leur enfant atteint de TSA. Il a été démontré que ce modèle permet de diminuer les symptômes de l’autisme sur le long terme (jusqu'à 6 ans après l’intervention) (113).
5.3 : Traitements éducatifs et rééducatifs
Le but étant d’acquérir les principales conduites sociales menant à l’autonomie, des programmes d’intervention précoce et comportementale à domicile en collaboration avec les familles peuvent notamment être proposés. Par exemple, la méthode TEACCH est un ensemble de pratiques éducatives et pédagogiques, reposant sur la notion d’émergence qui visent à repérer, stimuler et gratifier des comportements et des savoirs dans l’imitation, la perception, la motricité fine et générale, la coordination oculo-manuelle, la performance cognitive, la cognition verbale et le langage. Cependant, cette méthode nécessite une active collaboration entre parents, enseignants et soignants.
La mise en place au long cours d’une rééducation orthophonique intensive avec un professionnel formé au TSA a également montré un impact positif dans l’évolution des interactions sociales et de la communication verbale et non verbale. Notamment des outils de communication alternative et augmentée, comme le système de communication d’échange d’image (PECS) et le MAKATON, ont démontré leur efficacité dans l’augmentation et l’amélioration des comportements sociaux-communicatifs ainsi que dans la diminution des troubles du comportement (114)(115).
Une prise en charge en psychomotricité peut également être proposée.
5.4 : Pédagogie
Le maintien dans une scolarité ordinaire est souhaitable et doit être priorisé si l’enfant en retire des bénéfices cognitifs et relationnels. Actuellement, la mise en place d’une aide en classe (aide de vie scolaire: AVS) peut être proposée afin de favoriser le maintien en milieu ordinaire. Il peut également être proposé de privilégier les classes à petits effectifs ou des sections aménagées (Unités Localisées pour l’Inclusion Scolaire ou ULIS).
Cependant, si le maintien en milieu ordinaire est délétère pour l’enfant, un apport pédagogique peut être proposé dans des structures d’accueil spécialisées (Institut Médico-Educatif ou IME).
5.5 : Traitements médicamenteux
Actuellement, il n’existe pas de traitement médicamenteux spécifique pour traiter les TSA. L’utilisation symptomatique et ponctuelle d’antipsychotiques peut être utile dans les situations d’angoisses majeures, d’hyper agitation motrice avec désorganisation et lors des comportements d’automutilation.
Chapitre 6 : Problématique et objectif et l’étude
Au total, il a été démontré qu’un diagnostic et une prise en charge précoces ont un impact positif sur l’évolution des enfants atteints de TSA. Cependant, l’hétérogénéité étiologique et phénotypique des TSA (116)[109](33) rend difficiles le dépistage et le diagnostic, ce qui retarde la mise en place d’une prise en charge individualisée (117).
Cette constatation suggère le besoin de mettre en évidence des marqueurs comportementaux, environnementaux, biologiques ou neurophysiologiques précoces afin de repérer précocement les enfants à risque.
Les objectifs de cette étude sont, à travers la description d’une cohorte française d’enfants d’âge préscolaire, de repérer les manifestations précoces des TSA, de relever la présence de facteurs de risque environnementaux ou génétiques, d’établir quel est l’effet des symptômes autistiques mesurés avec l’ADOS sur le niveau de développement des enfants, et enfin, d’observer le lien entre les différents facteurs de risque, la probabilité de diagnostic de TSA et la sévérité des symptômes autistiques.
PREMIÈRE PARTIE : SUJETS ET MÉTHODE
Chapitre 1 : Méthodes de sélection des sujets
1.1 : Critères d’inclusion
Nous avons recueilli de façon rétrospective, les données anamnestiques, démographiques et cliniques de tous les enfants, âgés de moins de 36 mois, évalués entre avril 2015 et avril 2017, au Centre de Diagnostic et d’Évaluation précoces de l’autisme dans le service de psychiatrie de l’enfant et de l’adolescent de l’Hôpital Universitaire Robert Debré (Paris). Chaque enfant était évalué en raison d’une préoccupation au niveau de la communication, de l’interaction sociale ou bien de façon systématique, si un membre de la fratrie avait reçu un diagnostic de TSA.
1.2 : Critère de non inclusion
Le seul critère d’exclusion était l’indisponibilité des données concernant l’évaluation clinique structurée (ADOS, MSEL).
Chapitre 2 : Méthodes d’évaluation clinique
2.1 : Équipe multidisciplinaire
Chaque enfant a été évalué par une équipe multidisciplinaire spécialisée. Cette équipe était composée d’un psychologue, un orthophoniste, un psychomotricien, un éducateur spécialisé et un pédopsychiatre. Toute l’équipe était formée aux outils diagnostiques des TSA.
L’évaluation se déroulait sur cinq demi-journées. Pour chaque enfant, une synthèse était organisée en fin d’évaluation avec l’ensemble de l’équipe afin de poser un diagnostic consensuel provisoire de TSA, de retard de développement, de retard de langage, de retard psychomoteur ou autre. Chaque enfant pouvait recevoir un ou plusieurs diagnostics cités précédemment.
Tous les enfants ont eu un bilan génétique et métabolique, un électroencéphalogramme et une IRM cérébrale. Les résultats de ces examens ne seront pas analysés dans cette étude, vu qu’ils n’étaient pas tous disponibles au moment du recueil des données.
Comme décrit dans l’introduction, les critères du DSM-5 ne sont pas appropriés pour les nourrissons et les jeunes enfants qui peuvent également évoluer vers différentes trajectoires. Un diagnostic définitif ne peut donc pas être posé avant l’âge de 3 ans. C’est pourquoi nous utiliserons le terme de diagnostic provisoire de TSA.
Chaque enfant ayant reçu un diagnostic provisoire de TSA devra donc être réévalué à distance afin de confirmer ou non le diagnostic.
2.2 : Entretien médical, anamnèse
En début d’évaluation, les patients étaient reçus avec leurs parents par un pédopsychiatre ou un interne en psychiatrie. Cet entretien permettait de réaliser l’examen clinique et de recueillir les antécédents médicaux personnels et familiaux, l’histoire du développement et les données sociodémographiques à travers l’anamnèse et l’examen du carnet de santé.
Plus particulièrement, l’anamnèse a permis de recueillir la notion de consanguinité dans la famille, les antécédents familiaux psychiatriques et les complications pendant la grossesse. À l’aide de l’examen du carnet de santé, il était relevé les complications lors de l’accouchement, les paramètres de naissance, les courbes de croissance, les données relatives au développement psychomoteur (notamment la notion de régression) mais également les signes d’alertes de TSA.
2.3 : Évaluation du développement cognitif
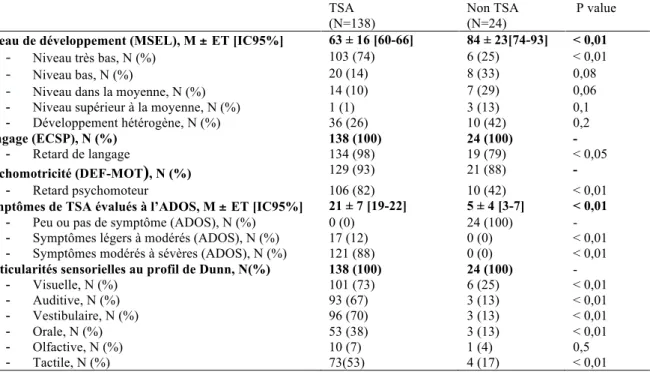
Les compétences de développement cognitif étaient évaluées par un psychologue ou un éducateur spécialisé, à partir de la Mullen Scale of Early Learning (MSEL) (118)(119)(120)(121)(122), test standardisé de référence pour les TSA.
Ce test permet de mesurer le développement moteur et cognitif du jeune enfant.
La base théorique de cet outil repose sur les théories neuro-développementales de l’auteur quant au traitement de l’information, qui conceptualise l’intelligence comme un réseau d’habiletés cognitives inter reliées mais fonctionnellement distinctes.
La passation se compose d’une entrevue avec les parents puis d’une observation des habiletés par l’examinateur (124 items) où chaque item se voit attribuer un score de 0 ou 1 en fonction de la performance de l’enfant.
Les items sont regroupés en 5 échelles : Ø La motricité globale
Ø La perception visuelle Ø La motricité fine Ø Le langage expressif Ø Le langage réceptif
Un score T est ensuite calculé pour chacune des échelles.
Les quatre dernières échelles, appelées « échelles cognitives » sont combinées pour produire un quotient global « Indice Composite d’Apprentissage » (ICA) qui représente l’intelligence générale dans cet outil.
D’après l’ICA, différents niveaux de développement cognitif peuvent être définis: Ø Niveau très bas : ICA inférieur à 70 ; percentiles 1-2
Ø Niveau bas : ICA compris entre 84 et 70 ; percentiles 3-15
Ø Niveau dans la moyenne : ICA compris entre 115 et 85 ; percentiles 16-84 Ø Niveau supérieur à la moyenne : ICA supérieur à 115 ; percentiles 85-99
Un développement est dit hétérogène lorsque, parmi les différentes échelles (motricité globale, perception visuelle, motricité fine, langage expressif et langage réceptif), la différence entre le plus grand score T et le plus petit score T est supérieure à 20.
2.4 : Bilan orthophonique
La communication verbale et non verbale était explorée par un orthophoniste formé aux TSA, à partir de l’échelle d’Évaluation de la Communication Sociale Précoce (ECSP) (123)(124)(125)(126).
L’ECSP évalue les compétences communicatives. Elle permet d’évaluer des enfants présentant un retard ou des dysfonctionnements communicatifs. Elle permet également de rechercher des émergences du langage.
L’ECSP est l’adaptation française de Guidetti et Tourrett d’une échelle américaine (Early
Social Communication Scales ou ECS, J. Seibert et A. Hogan 1982 ) (125) (127) qui a été
construite à partir des théories sur la genèse des comportements communicatifs de Bruner et de Bates à partir de la théorie néopiagétienne de Fisher (123).
Cet outil évalue 3 fonctions de la communication : Ø Les interactions sociales
Ø L’attention conjointe
Ø La régulation des comportements.
Dans les 2 premières fonctions, on évalue l’initiation, la réponse et le maintien. Dans la troisième, on n’évalue que l’initiation et la réponse.
Une passation en observation directe est composée de 108 items cotés sur les trois fonctions (les interactions sociales, l’attention conjointe et la régulation des comportements) simultanément au cours de 23 situations initialement structurées. La cotation des items permet ensuite de calculer un âge de développement en termes de communication sociale.
On distingue 4 niveaux de développement :
Ø Niveau simple : 0-6 mois, action simple et début des actions intentionnelles. Ø Niveau complexe : 0-6 mois, actions complexes et différenciées
Ø Niveau conventionnel gestuel : 7-16 mois, début des gestes sociaux de communication Ø Niveau conventionnel verbal : 7-24 mois, utilisation de mots simples accompagnés ou
non de gestes sociaux de communication, mais uniquement avec des objets.
Ø Niveau symbolique : 24-30 mois, initiation de comportements sociaux de communication et d’anticipation sociale
2.5 : Bilan psychomoteur
2.5.1 : Le développement psychomoteur
Le développement moteur de l’enfant a été évalué par un psychomotricien à partir de l’échelle
DEF-MOT (128)(129).
Cette échelle met l’accent sur l’aspect statique et dynamique de la coordination motrice. Elle explore les capacités d’adaptation et de régulation de la fonction motrice de la naissance à 48 mois. Il s’agit d’une échelle standardisée qui respecte la chronologie des acquisitions transitoires (retournements, pivotement, quatre-pattes) par rapport aux grandes étapes du développement (maintien de la tête, station assise, marche, etc.).
Elle évalue :
Ø Le niveau de coordination global, posturo-moteur et locomoteur (PML) Ø Le niveau de coordination visuo-manuelle (PCVM) fine.
Les items proposés sont sensibles aux déviations du comportement par rapport à la normale. Chaque item fait l’objet d’une démonstration préalable. Leur notation systématique permet de révéler des atypicités caractéristiques de profils de développement qui peuvent servir au diagnostic. Un niveau moteur fonctionnel moyen est établi pour chaque développement (PML et PCVM). Par ailleurs, il est possible de préciser la déviation standard pour chaque item, ce qui permet de relever des profils atypiques.
L’ouvrage Précis théorique et pratique du développement moteur du jeune enfant sert de manuel et donne des illustrations de tous les items (130).
2.5.2 : Le profil sensoriel
Au cours du bilan psychomoteur, les particularités sensorielles sont également explorées à partir du Profil Sensoriel de Dunn — version abrégée (131).
Le Profil Sensoriel de Dunn repose sur la théorie de l’intégration sensorielle qui explique les comportements de l’enfant par l’interprétation de sa capacité d’intégration des stimuli sensoriels. L’outil fournit des informations sur les tendances de l’enfant à réagir aux stimuli et sur les systèmes sensoriels susceptibles de contribuer ou de faire obstacle à une performance fonctionnelle.
Dans la version originale, le profil sensoriel de l’enfant est établi à partir d’un questionnaire de 125 questions décrivant ses comportements face à diverses expériences sensorielles de la vie quotidienne. Il est rempli par la personne qui s’occupe habituellement de l’enfant.
Les résultats permettent d’évaluer l’impact du traitement sensoriel sur la performance de l’enfant. Un éclairage peut ainsi être apporté à la famille et aux autres intervenants (enseignant, rééducateur, auxiliaire de vie scolaire, etc.) pour comprendre les réactions de l’enfant à des expériences qui sont habituellement bien tolérées par ses pairs. Il peut être utile pour guider dans le choix des activités ou la mise en place d’un programme d’intervention adapté aux besoins spécifiques de l’enfant (132).
La version abrégée, plus adaptée au dépistage, comprend 38 items issus de la version longue.
Les items du questionnaire sont regroupés en 7 sections : Ø Sensibilité tactile
Ø Sensibilité au goût/odorat Ø Sensibilité vestibulaire
Ø S’exprime peu/cherche la sensation Ø Filtrage auditif
Ø Manque d’énergie/faible Ø Sensibilité visuelle/auditive.
2.6 : Évaluation des symptômes autistiques
Dans cette étude, le psychologue ou l’éducateur spécialisé a utilisé l’Échelle d’Observation
Autism Diagnostic Observation Schedule-deuxième version (ADOS-2) pour déterminer la
Cet outil permet d’observer, de manière standardisée, la communication, les interactions sociales, les habiletés de jeu et les comportements restreints et répétitifs de l’enfant à travers 14 items. Il oriente le diagnostic, qui se repose cependant sur le consensus clinique de l’équipe pluridisciplinaire.
Il existe cinq modules. Chaque enfant passe un seul module, choisi en fonction du niveau de langage. Compte tenu de l’âge et du niveau de langage des enfants évalués dans cette étude, seulement deux modules ont été utilisés:
Ø ADOS-2 toddler : pour les enfants âgés de 12 à 30 mois dont le niveau de langage ne dépasse pas quelques mots (133)(134)(100).
Ø ADOS-2 module 1 : pour les enfants de 31 mois et plus dont le niveau de langage ne dépasse pas quelques phrases simples (135)(136).
Pour chaque module, les items de l’ADOS-2 sont regroupés en 2 domaines :
Ø L’affection sociale (AS) : regroupant la communication et les interactions sociales réciproques.
Ø Les comportements restreints et répétitifs (CRR).
Après la passation du module, une cotation est effectuée en fonction de la présence d’un pattern et du degré de déviance par rapport au développement normal sur une échelle à 4 niveaux (« 0 » indiquant l’absence d’un comportement anormal et « 3 » indiquant la présence d’un comportement anormal).
La somme des items de chaque domaine (affection sociale et comportements restreints et répétitifs) permet de calculer un score global. Basés à la fois sur les critères de la CIM-10 et du DSM-5, les modules de l’ADOS-2 proposent des seuils définis par des algorithmes, pour orienter le diagnostic et préciser soit le degré de sévérité des symptômes (module 1) soit le degré de risque de développer un TSA (module Toddler):
Module 1 :
Ø Hors spectre, peu ou pas de symptômes.
Ø Spectre autistique, symptômes légers à modérés. Ø Autisme, symptômes modérés à sévères.
Module Toddler : Ø Aucun risque
Ø Risque léger à modéré Ø Risque modéré à sévère
Chapitre 3 : Méthodes d’évaluations statistiques
3.1 : Description de la cohorte
3.1.1 : Caractéristiques démographiques et anamnèse
Nous avons calculé les fréquences des données catégorielles, les moyennes (M) et les écarts types (ET) de toutes les variables continues disponibles (par exemple : âge, scores de la MSEL et de l’ADOS-2, etc.).
Après l’analyse rétrospective des dossiers, nous avons choisi de porter notre attention plus particulièrement sur la présence de facteurs identifiés dans la littérature comme à risque de TSA.
Nous avons classé ses facteurs en 4 catégories :
Ø Les facteurs maternels : regroupant la menace d’accouchement prématuré, l’hypertension durant la grossesse et le diabète gestationnel.
Ø Les facteurs périnataux : l’hypoxie et les infections materno-fœtales à la naissance. Ø Les facteurs familiaux : pour les antécédents psychiatriques dans la famille et plus
précisément la présence d’une fratrie ou d’un autre membre de la famille ayant reçu un diagnostic de TSA. Nous avons décidé de nommer cette catégorie « facteurs de risque familiaux » et non « facteurs de risque génétiques », car l’héritabilité est estimée à 50%, tout comme la part environnementale. De plus, des antécédents psychiatriques familiaux comme la dépression maternelle sont également considérés par certains auteurs comme des facteurs de risque environnementaux.
Ø Les facteurs liés aux paramètres de naissance : dont la prématurité, un petit poids de naissance pour l’âge gestationnel, une petite taille de naissance pour l’âge gestationnel et la microcéphalie.
Pour définir les facteurs liés aux paramètres de naissance, nous nous sommes basés sur les définitions de l’OMS (137).
La prématurité est définie par une naissance avant 37 semaines d’aménorrhée (SA) et cette notion recouvre 3 catégories :
Ø Une prématurité extrême : définie par une naissance avant 28 semaines. Ø Une grande prématurité : définie par une naissance entre 28 et 32 semaines. Ø Une prématurité moyenne : définie par une naissance entre 32 et 37 semaines.
L’OMS définit un faible poids de naissance par un poids de naissance inférieur à 2 500g (138). Cependant, cette définition ne permet pas de différencier le faible poids de naissance des enfants nés à terme de celui des enfants nés prématurément. Nous avons donc considéré comme définition, un petit poids de naissance pour l’âge gestationnel. Cette réflexion s’applique également pour la taille et le périmètre crânien à la naissance (139)(140)(141).
Le poids, la taille et le périmètre crânien de naissance ont donc été convertis en percentile par rapport à l’âge gestationnel à la naissance et au sexe de l’enfant. Pour ce faire, nous avons utilisé un logiciel de calcul disponible en ligne sur Audipog* (142).
Dans cette étude, un petit poids ou une petite taille de naissance pour l’âge gestationnel sont définis par une taille ou un poids de naissance inférieur à 2 déviations standard (DS), soit au 10e percentile.
Dans la littérature, la microcéphalie et la macrocéphalie sont définies par un périmètre crânien à la naissance, inférieur ou supérieur à 2 ou 3 DS.
Pour cette étude, nous avons choisi de les définir par un périmètre crânien inférieur ou supérieur à 3DS. La microcéphalie est donc définie ici, comme un périmètre crânien inférieur au 3e percentile.
*
Les variables moyennes et leurs écart-types sont calculés puis modélisé par régression polynomiale et pondérée afin de
3.1.3 : Caractéristiques cliniques
Nous avons classé les quotients de développement en fonction des niveaux de développement cognitif (niveau très bas, niveau bas, niveau dans la moyenne, niveau supérieur à la moyenne) afin d’y observer la répartition de notre cohorte. Nous avons procédé de la même manière pour les développements homogènes et hétérogènes.
À partir de l’ECSP et du DEF-MOT nous avons calculé les fréquences des diagnostics de retard de langage, de retard psychomoteur.
À partir de l’ADOS-2 et du profil de Dunn, nous avons regardé combien d’enfants avaient peu ou pas de symptôme de TSA, des symptômes légers à modérés et des symptômes modérés à sévères ainsi que les fréquences des particularités visuelles, auditives, vestibulaires, orales, olfactives, et tactiles.
Enfin, nous avons calculé la fréquence du diagnostic provisoire de TSA d’après les conclusions pluridisciplinaires de chaque évaluation.
3.2 : Comparaison entre les groupes TSA et NonTSA
Dans cette partie de l’étude, nous avons réparti la cohorte en deux groupes. Les enfants ayant reçu un diagnostic provisoire de TSA au décours de l’évaluation ont été inclus dans le groupe « TSA ». Les enfants n’ayant pas reçu de diagnostic provisoire de TSA ont été inclus dans le groupe « NonTSA ».
Nous avons comparé dans les deux groupes, toutes les données démographiques, anamnestiques, la présence de facteurs de risque et les résultats des évaluations cliniques. La réalisation au préalable d’une droite de Henry nous a permis de vérifier que la distribution de notre critère de jugement principal (score global de l’ADOS) suivait une loi normale (R2 > 0,98). Nous pouvions donc utiliser des tests statistiques paramétriques. La différence entre les groupes a été calculée en utilisant un test t pour les variables continues et un test exact de Fisher pour les variables binaires. Le niveau de significativité statistique considéré était
p<0.05.
3.3 : ADOS et développement cognitif
Pour les analyses statistiques concernant l’ADOS-2 et le développement cognitif, seuls les enfants avec un diagnostic provisoire de TSA ont été étudiés.
L’effet du score global de l’ADOS-2 sur l’indice composite total de la MSEL a été étudié en utilisant un modèle de régression linéaire.
La différence des scores globaux moyens de l’ADOS-2 entre les profils hétérogènes et les profils homogènes a été calculée en utilisant un test t.
3.4 : Influence des facteurs de risque sur le diagnostic et sur
la sévérité de l’autisme
3.4.1 : Influence des facteurs de risque et de leur
accumulation sur le diagnostic provisoire de TSA
Nous avons utilisé un modèle de régression logistique pour estimer l'influence de l’accumulation des facteurs de risque sur le diagnostic.
3.4.2 : Moyenne de l’ADOS en fonction des facteurs de
risque
Pour les analyses statistiques concernant l’observation de l’influence des facteurs de risque sur la sévérité des symptômes autistiques, seuls les enfants avec un diagnostic provisoire de TSA ont été étudiés.
L’échantillon étant plus petit, la réalisation d’une nouvelle droite de Henry, nous a permis de vérifier que la distribution de notre critère de jugement principal (score global de l’ADOS) suivait toujours une loi normale (R2 > 0,94). Nous pouvions donc utiliser également des tests statistiques paramétriques.
La différence des scores globaux moyens de l’ADOS-2 en fonction de la présence de chacun des différents facteurs de risque (maternels, périnataux, liés aux paramètres de la naissance, génétiques) a été calculée en utilisant un test t.
Le niveau de significativité statistique considéré était p < 0.05.
Chapitre 4 : Éthique
Un consentement écrit des parents ou tuteurs des patients a été recueilli pour l’utilisation rétrospective des données cliniques. Cette étude a reçu l’avis favorable du Comité d’Éthique Locale.
PARTIE 2 : RÉSULTATS
Chapitre 1 : Description de la cohorte
1.1 : Caractéristiques démographiques et signes d’alerte
Parmi les 168 enfants évalués entre avril 2015 et avril 2017, 3 enfants avaient plus de 36 mois et n’ont donc pas été inclus. De même, 3 autres enfants n’ont pas été inclus du fait que l’évaluation de la sévérité des symptômes autistiques n’était pas disponible dans le dossier. Au total, 162 enfants âgés de 9 à 36 mois ont été inclus dans l’étude. Nous avons observé une prédominance masculine (133 garçons et 29 filles ; sex ratio de 4,6 :1). Dans la cohorte, 25 enfants (15 %) ont été évalués, après avoir eu un suivi systématique en consultation du fait d’avoir membre de la fratrie diagnostiqué TSA.
L’âge des premières inquiétudes des parents, recueilli à l’anamnèse, se trouvait en moyenne
aux alentours du 15e mois (M ± ET [IC95%] = 15 ± 6 [14-16]). L’âge moyen des enfants au
moment de l’évaluation était de 27 mois (M ± ET = 27 ± 6 [26-28]). Il s’écoulait en moyenne 12 mois (M ± ET = 12 ± 8 [11-13])entre les premières inquiétudes des parents et l’évaluation
et 2 mois (M ± ET = 2 ± 2 [1,5-2])entre la première consultation avec un pédopsychiatre à
Robert Debré et l’évaluation. Après un ajustement sur les fratries, l’âge des premières inquiétudes reste aux alentours du 15e mois (M ± ET = 15 ± 8 [14-18]), le temps moyen entre les premières inquiétudes et l’évaluation était alors augmenté à 14 mois (M ± ET = 14 ± 8 [12-15]) et l’âge moyen des enfants lors de l’évaluation était augmenté à 28 mois (M ± ET = 28 ± 5 [27-30]).
LaTable 1 décrit les caractéristiques démographiques de la cohorte.
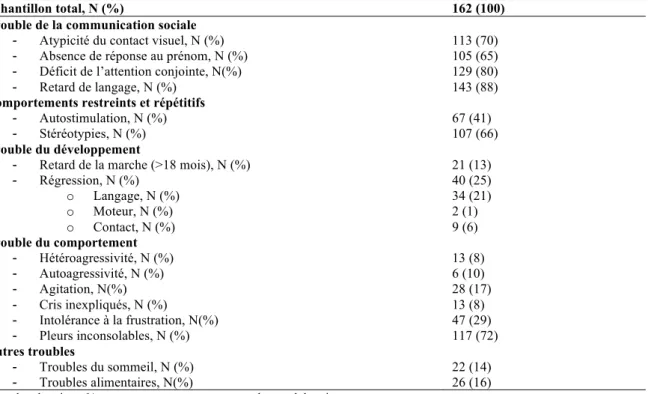
À l’anamnèse, il a été recueilli qu’au cours des deux premières années de vie, 113 enfants (70%) présentaient des atypicités du contact visuel, 105 (65%) ne répondaient pas à leur prénom, 129 (80%) avaient des difficultés à établir l’attention conjointe, 143 (88%) avaient un retard de langage, 67 (41%) présentaient des autostimulations, 107 (66%) présentaient des stéréotypies vocales ou comportementales et 21 (13%) avaient un retard de la marche.
Pour 40 enfants (25%), les parents avaient constaté une régression au cours du développement psychomoteur en moyenne (±ET) vers l’âge de 17±8 mois . Pour 34 (21 %) d’entre eux, la régression touchait la sphère du langage. Pour seulement 2 d’entre eux (1 %), les parents rapportaient une régression motrice et pour 9 d’entre eux (6 %) la régression concernait la qualité de l’interaction.
Les parents rapportaient également des troubles du comportement. En effet, 13 enfants (8%) avaient des comportements hétéroagressifs, 6 enfants (10%) avaient des comportements autoagressifs, 28 enfants (17%) présentaient une agitation motrice, 47 enfants (29%) avaient une intolérance à la frustration, pour 13 enfants (8%) les parents rapportaient des cris inexpliqués et enfin, 117 enfants (72%) présentaient des pleurs inconsolables.
Les caractéristiques, qui ont alerté les parents et qui les ont amenés à consulter, sont résumées dans la table 2.
Nous avons retrouvé que 5 enfants (3 %) étaient issus d’une procréation médicalement assistée, 6 (4 %) étaient issus d’une grossesse gémellaire et 39 (24 %) étaient nés par césarienne.
Toujours à l’anamnèse, nous retrouvions que 25 % des enfants avaient des antécédents connus comme comorbidités au TSA. Soit, 4 enfants (2 %) avaient reçu un diagnostic d’épilepsie, 30 (19 %) avaient des otites à répétition et 11 (7 %) un reflux gastro-œsophagien, 22 enfants (14%) avaient des troubles du sommeil et 26 enfants (16%) avaient des troubles alimentaires. Au moment de cette étude, les analyses génétiques† retrouvaient 2 enfants avec un syndrome du X fragile (1%), 1 enfant avec un syndrome de Rett (1%) et 3 enfants avec des délétions à la CGH-array (2%).
Table 1 : Caractéristiques démographiques de la cohorte
Échantillon, N (%) Total : 162 (100)
Sexe, N masculin/N féminin 133/29
Âge d’inquiétude (mois), M ± ET [IC95%] 15 ± 6 [14 – 16] Âge à l’évaluation (mois), M ± ET [IC95%] 27 ± 6 [26-28] Enfant évalué dans le cadre de fratrie TSA, N (%) 25 (15) Temps entre 1ere inquiétudes et évaluation (mois), M ± ET [IC95%] 12 ± 8 [11-13] Temps entre 1ere consultation et évaluation (mois), M ± ET [IC95%] 2 ± 2 [1,5-2]
M : moyenne ; ET : écart type ; N : nombre de sujets ; % : pourcentage par rapport au nombre total de sujets Table 2 : Signes d’alertes à l’origine des premières inquiétudes
Échantillon total, N (%) 162 (100)
Trouble de la communication sociale
- Atypicité du contact visuel, N (%) 113 (70) - Absence de réponse au prénom, N (%) 105 (65) - Déficit de l’attention conjointe, N(%) 129 (80)
- Retard de langage, N (%) 143 (88)
Comportements restreints et répétitifs
- Autostimulation, N (%) 67 (41)
- Stéréotypies, N (%) 107 (66)
Trouble du développement
- Retard de la marche (>18 mois), N (%) 21 (13)
- Régression, N (%) 40 (25) o Langage, N (%) 34 (21) o Moteur, N (%) 2 (1) o Contact, N (%) 9 (6) Trouble du comportement - Hétéroagressivité, N (%) 13 (8) - Autoagressivité, N (%) 6 (10) - Agitation, N(%) 28 (17) - Cris inexpliqués, N (%) 13 (8) - Intolérance à la frustration, N(%) 47 (29) - Pleurs inconsolables, N (%) 117 (72) Autres troubles - Troubles du sommeil, N (%) 22 (14) - Troubles alimentaires, N(%) 26 (16)
N : nombre de sujets ; % : pourcentage par rapport au nombre total de sujets
1.2 : Facteurs de risque de TSA
À l’anamnèse, nous avons relevé que pour 3 enfants (2 %), il y avait une notion de consanguinité entre les parents.
Nous avons retrouvé que 52 enfants (32 %) ont été exposés à des complications obstétricales durant la grossesse. Parmi elles, il a été recueilli 8 cas de menace d’accouchement prématuré (5%), 12 cas d’hypertension (7%) et 13 cas de diabète gestationnel (8%).