HAL Id: dumas-01346680
https://dumas.ccsd.cnrs.fr/dumas-01346680
Submitted on 19 Jul 2016
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Sécurité et tolérance des anticoagulants oraux directs
dans une population de fibrillation auriculaire : étude
prospective monocentrique
Florent Cazaux-Lerou
To cite this version:
Florent Cazaux-Lerou. Sécurité et tolérance des anticoagulants oraux directs dans une population de fibrillation auriculaire : étude prospective monocentrique . Médecine humaine et pathologie. 2016. �dumas-01346680�
1
Université de Bordeaux U.F.R. DES SCIENCES MEDICALES Année 2016 N° 89
Thèse pour l’obtention du
DIPLOME d’ETAT de DOCTEUR EN MEDECINE SPECIALITE MEDECINE GENERALE
Présentée et soutenue publiquement Par Florent CAZAUX-LEROU
Né le 23 avril 1985 à Pau Le lundi 20 juin 2016
SECURITE ET TOLERANCE DES ANTICOAGULANTS ORAUX DIRECTS DANS UNE
POPULATION DE FIBRILLATION AURICULAIRE : ETUDE PROSPECTIVE
MONOCENTRIQUE
Directeur de thèse : Dr Maxime DE GUILLEBON
Jury
Monsieur le Professeur Raymond ROUDAUT Président
Monsieur le Professeur Hervé DOUARD Juge et Rapporteur Monsieur le Docteur Laurent MAGOT Juge
Monsieur le Docteur Emmanuel PROTHON Juge
2
REMERCIEMENTS
A mon Président du jury :
Monsieur le Professeur Raymond ROUDAUT ;
Vous me faites le grand honneur de présider cette thèse. Veuillez trouver ici le témoignage de ma profonde admiration et de ma gratitude.
A mes juges :
Monsieur le Professeur Hervé DOUARD ;
Monsieur le Docteur Laurent MAGOT ;
Monsieur le Docteur Emmanuel PROTHON ;
Monsieur le Docteur Maxime DE GUILLEBON ;
L’honneur que vous me faites en acceptant de juger cette thèse est pour moi l’occasion de vous témoigner ma reconnaissance et mon sincère respect.
3 A ma famille :
Ma Maman, pour m’avoir accompagné au cours de ces longues années d’études. Je n’y serais pas arrivé sans toi. Merci pour tout du fond du cœur.
Mon Papa, à qui je dédie ce travail de thèse et qui me manque énormément. Je t’aime Papa.
Mon frère Romain, pour ton immense affection et ton soutien durant toutes ces années, je ne te remercierai jamais assez.
Lorène, pour la réalisation esthétique du power point et m’avoir fait découvrir l’existence du cidre poire.
Mamie et Papi, mes grands-parents adorés.
Mes oncles Michel et Alain, Sylvie, pour votre présence.
Fred alias Greg « le millionnaire », Julie : une soirée film Les Visiteurs tous ensemble ?
A ma belle-famille, pour cette très jolie rencontre et les bons moments à venir :
Mes beaux-parents Laurence et François.
Ma belle-sœur Fanny, Julien, Gaspard et Auguste.
Bernadette et Jean-Pierre.
A mes amis :
Patrice : « Entrez messieurs, entrez… dans l’antre de l’escroquerie ! »
Zozo : comment gagner un troisième set en une leçon ? Je t’expliquerai…
Todd : « Rendez la prose de Monsieur Martine ! »
Clément « Brigand » et le poil toujours soyeux, comme en terminale.
Jeff : ce revers une main long de ligne, c’est pour quand ?
Tala : mais Tala quoi ?
Rémi : merci pour ces grandes luttes tennistiques sur les différents centre courts béarnais, à quand la prochaine ?
MP : Federer ? Nadal ? Roger bien évidemment !
4 Billy : une démonstration de cross fit ?
Elodie Tahiti : la plus brillante des pédiatres
Elodie Perdreau : God save the Queen !
Lise : on staffe ?
Nadège : Un apéro à Ponson-Dessus ?
Violaine : « Dr Cazaux ! » « Superbe ! »
Sandrine : pas d’ordonnance sauvage sans examiner un bébé de 21 ans.
A tout le personnel médical et paramédical rencontré tout au long de mes études et de mes différents stages et qui m’ont fait grandir en tant qu’homme et en tant que médecin.
A Maxime, merci pour ta disponibilité et ton écoute, je n’aurais pu avoir meilleur directeur de thèse que toi.
A Pau, ma ville natale.
5 A Anaïs, ma femme et mon amour, pour me supporter au quotidien, pour tous les instants déjà partagés et les projets à venir, personnalité unique et délicieuse, je t’aime éperdument.
6
Table des matières
I. INTRODUCTION ... 8
II. PROBLEMATIQUE ... 10
1. Etat des lieux ... 10
a. L’anticoagulation dans la FANV : pourquoi ? ... 10
b. Les antivitamines K : preuve d’efficacité et effets indésirables ... 16
c. Rationnel de développement d’un nouveau traitement ... 22
d. Etudes princeps -> AMM ... 27
e. Particularités sujets âgés / insuffisance rénale ... 31
2. Problèmes du quotidien ... 35
a. Risque hémorragique ... 35
b. Efficacité du traitement ... 48
c. Bénéfice global ... 50
III. OBJECTIFS ... 52
IV. MATERIELS ET METHODES ... 53
V. RESULTATS ... 55
1. Population de base ... 55
2. Décès et mortalité toutes causes confondues ... 58
3. Observance et tolérance du traitement ... 58
4. Efficacité du traitement : survenue d’évènements thrombo-emboliques ... 59
5. Sécurité d’emploi : survenue d’effets indésirables ... 59
a. Evènements hémorragiques ... 59
b. Effets indésirables autres qu’hémorragiques ... 61
6. Evaluation de la fonction rénale : surveillance et adaptation éventuelle au cours du suivi .. 62
7. Arrêt du traitement ... 62
a. Détail des arrêts justifiés ... 63
b. Détail des arrêts non justifiés ... 64
c. Autres arrêts : arrêts temporaires ... 67
8. Comparaisons des évènements hémorragiques avec ceux des études princeps et post-AMM 68 9. Efficacité et tolérance des AOD chez les patients âgés de 75 ans et plus ... 73
7
VI. DISCUSSION ... 75
VII. CONCLUSION ... 84
VIII. ANNEXES ... 86
8
I. INTRODUCTION
En 1997, dans une lecture demeurée célèbre, Eugène Braunwald, cardiologue américain né le 15 août 1929 et père de la cardiologie moderne, prophétisait l’émergence de 2 nouvelles épidémies : l’insuffisance cardiaque et la fibrillation atriale, responsables l’une et l’autre d’une croissance exponentielle de la morbi-mortalité cardiovasculaire. En effet, avec une incidence et une gravité qui augmentent parallèlement au vieillissement de la population et de lourds enjeux médico-économiques, la fibrillation auriculaire se présente comme un véritable problème de santé publique et à l’évidence comme un des défis majeurs de la médecine cardiovasculaire et générale du XXIème siècle.
La prise en charge de cette pathologie comporte plusieurs volets, en particulier celui de l’anticoagulation pour en prévenir le risque thrombo-embolique. Dans cette indication, les
antivitamines K (AVK) constituent le traitement anticoagulant par voie orale de référence, prescrit depuis plusieurs décennies déjà. De nombreuses études et essais cliniques apportent des preuves robustes et valides en faveur de l’efficacité de ces médicaments.
Ces dernières années ont vu l’émergence de nouvelles molécules présentées comme une
alternative thérapeutique aux AVK. Il s’agit des nouveaux anticoagulants oraux (NACO) ou encore dénommés anticoagulants oraux directs (AOD) et prescrits dans des indications précises, dont la « prévention des accidents vasculaires cérébraux (AVC) et des embolies systémiques (ES) chez les patients adultes atteints de fibrillation atriale non valvulaire (FANV) et présentant un ou plusieurs facteur(s) de risque, tels que l’insuffisance cardiaque congestive, l’hypertension artérielle, l’âge, le diabète, un antécédent d’AVC ou d’accident ischémique transitoire (AIT) » [1]
Dans une période où les craintes vis-à-vis de l’industrie pharmaceutique et les inquiétudes liées à l’apparition de nouveaux traitements se veulent de plus en plus importantes, la mise sur le marché des AOD n’a pas fait exception à la règle. Elle a été accompagnée de nombreuses réticences et réserves qui persistent encore à ce jour, conduisant les instances nationales et internationales à publier régulièrement des notes de pharmacovigilance quant à l’utilisation de ces molécules.
9 Nous avons donc décidé de sélectionner une population de patients chez qui un traitement par AOD a été instauré entre septembre 2013 et septembre 2014 à l’hôpital de Pau, et de les suivre pour réaliser un état des lieux de leur utilisation à l’échelle locale, en situation de vie réelle.
10
II. PROBLEMATIQUE
1. Etat des lieux
a. L’anticoagulation dans la FANV : pourquoi ?
La fibrillation auriculaire (FA) est une arythmie caractérisée par une activation auriculaire totalement désorganisée avec pour conséquence une altération de la fonction mécanique des oreillettes. [2] Elle est suspectée à l’examen clinique sur le caractère irrégulier du pouls et
diagnostiquée sur l’électrocardiogramme (ECG) par l’absence d’onde P, une trémulation de la ligne de base et une irrégularité de la réponse ventriculaire lorsque la conduction auriculo-ventriculaire est normale. Le mécanisme sous-jacent correspond habituellement à de multiples circuits de micro réentrées. Dans certains cas il s’agit de foyers anormaux dans les veines pulmonaires. [3] D’autres arythmies auriculaires peuvent survenir chez les patients en FA comme une tachycardie atriale ou un flutter atrial.
Plusieurs classifications de la FA ont été proposées. Elles sont basées sur la présentation électrocardiographique (FA à petites mailles, grosses mailles) ou sur la présentation clinique. L’utilisation des « 3 P » est consensuelle : paroxystique, persistante ou permanente :
- Une FA est paroxystique si elle survient par crises qui cèdent spontanément en moins de 7 jours ;
- Une FA est persistante si elle dure depuis plus de 7 jours et ne se réduit pas spontanément ;
- Une FA est permanente si tous les ECG enregistrés sont en fibrillation sur une période prolongée (en général plus d’un an) ;
- Une FA persistante devient permanente à partir du moment où une cardioversion n’a pas été proposée ou a échoué.
Lorsqu’un patient est vu pour la première fois et que la FA n’était pas connue, il s’agit d’une fibrillation de détection récente. Il est alors impossible de savoir si par la suite celle-ci sera paroxystique, persistante ou deviendra permanente. La FA paroxystique ou persistante est souvent récidivante.
11
Figure 1 : Classification de la fibrillation auriculaire
Sur le plan fonctionnel, l’évaluation de la sévérité des symptômes liés à la FA est réalisée au moyen du score EHRA qui regroupe 4 stades :
- Stade I : absence de symptômes
- Stade II : symptômes modérés sans retentissement sur l’activité quotidienne normale - Stade III : symptômes sévères retentissant sur l’activité quotidienne normale
- Stade IV : symptômes invalidants empêchant l’activité quotidienne normale.
La FA constitue le trouble du rythme cardiaque le plus fréquent dont la prévalence est estimée entre 1 et 2% de la population générale. [4] [5] Plus de 6 millions d’Européens sont concernés. Sa prévalence augmente avec l’âge : inférieure à 0,5% avant 50 ans, elle peut atteindre 5 à 15% après 80 ans. [4] [5] [6] [7] L’incidence et la gravité de ce trouble du rythme cardiaque augmentant avec le vieillissement de la population, les estimations prévoient une prévalence multipliée au
minimum par 2 dans les 50 ans à venir.
La FA majore le risque de mortalité. Plusieurs études observationnelles indiquent une
augmentation du risque de décès de 50 à 90% en cas de FA en comparaison aux sujets du même âge en rythme sinusal. [8] [9] L’augmentation du risque de mortalité est plus nette chez les femmes et d’autant plus marquée qu’il existe une cardiopathie ou une insuffisance cardiaque associée. Néanmoins, l’augmentation de la mortalité directement liée à la FA semble s’atténuer au-delà de 75 ans du fait de la surmortalité liée à d’autres causes. [10]
12 Sa gravité vient de ses complications potentielles, au premier rang desquelles les AVC (85% des complications emboliques de la FA) : le risque d’AVC est multiplié par 5 en présence d’une FA et 1 AVC sur 5 est secondaire à une FA. [11] [12] De plus, les AVC ischémiques associés ou secondaires à une FA sont souvent plus graves, les séquelles plus sévères et le risque de récidive plus fréquent que ceux d’étiologies différentes. Leur risque de décès est doublé et leur coût en terme de soins multiplié par 1,5. [13] [14]
Le risque d’AVC est similaire en cas de FA paroxystique, persistante ou permanente. [15]
Ce risque cardio-embolique diffère d’un patient à un autre en fonction de ses antécédents et autres comorbidités. Les principaux facteurs de risque de survenue d’AVC en cas de FA sont intégrés dans le score CHADS2. Les maladies vasculaires (antécédent d’infarctus du myocarde,
artériopathie oblitérante des membres inférieurs, plaque aortique) ; l’âge de 65 à 74 ans, le sexe féminin ont été ajoutés dans les recommandations de la Société Européenne de Cardiologie de 2010 [18] pour établir le score CHA2DS2-VASc [17] (cf tableau 1). Il s’agit donc d’une variante plus
sensible dont le score individuel varie de 0 à 9 :
- 0 indique un risque quasi-nul, 9 un risque maximal.
- 2 facteurs de risque majeur sont identifiés : l’antécédent d’AIT ou d’AVC et l’âge supérieur à 75 ans chez l’homme et 65 ans chez la femme.
- Le risque devient significatif (1-2%/an) dès les scores 1-2.
Tableau 1 : score CHADS2 et CHA2DS2-VASc
items CHADS2 (points) CHA2DS2-VASc (points)
Age > ou égal à 75 ans 1 2
Age de 65 à 74 ans 1
Hypertension artérielle 1 1
Diabète 1 1
Insuffisance cardiaque ou dysfonction VG 1 1
Antécédent d’AVC ou d’AIT 2 2
Sexe féminin (si > 65ans) 1
Maladie vasculaire (antécédent d’IDM, AOMI, plaque aortique)
13 Les objectifs du traitement de la FA comportent plusieurs volets :
- Prévention des complications de la FA, en particulier de l’AVC ; - Réduction de la mortalité ;
- Réduction du nombre d’hospitalisations ; - Réduction des symptômes ;
- Amélioration de la qualité de vie.
La prévention des complications cardio-emboliques repose sur le traitement anticoagulant, partie essentielle de la prise en charge. Une prévention correctement réalisée a une influence directe sur l’évolution des autres objectifs du traitement précédemment cités. La prise en charge comprend aussi le traitement de la cardiopathie sous-jacente et la gestion du rythme cardiaque, cette partie ne sera cependant pas développée dans ce travail car ne correspondant pas au sujet de l’étude.
La décision d’instaurer un traitement anticoagulant dépend du risque cardio-embolique propre à chaque patient.
En 2006, les recommandations posaient l’indication d’une anticoagulation pour un score CHADS2
supérieur ou égal à 2. [2]
Depuis 2010 puis 2012 et les dernières recommandations émises par la Société Européenne de Cardiologie, c’est le score CHA2DS2-VASc qui doit être utilisé pour guider le praticien dans ses
choix. Un traitement anticoagulant est toujours indiqué pour un score supérieur ou égal à 2, mais également pour un score égal à 1. [16] [18] En effet, parmi les critères supplémentaires, les
maladies vasculaires constituent un facteur de risque indépendant d’évènement embolique en cas de FA et augmentent la sensibilité du score CHADS2, [19] [20] tout comme l’âge à partir de 65 ans.
[19] [21] [22]
A noter cependant une exception concernant le genre : le critère « sexe féminin » augmente aussi le risque embolique [23] [24] [25] sauf si la patiente a moins de 65 ans et aucun autre facteur de risque associé. [24] [26] En d’autres termes, le traitement anticoagulant pour un score CHA2DS2
-VASc égal à 1 correspondant uniquement à ce critère n’est pas indiqué, comme le confirment des études récentes. [24] [26]
14 Enfin, pour un score CHA2DS2-VASc égal à 0, le taux d’AVC ou d’autre épisode embolique est si
faible qu’aucune anticoagulation n’est requise, que le patient soit un homme ou une femme.
La place des anti-agrégants plaquettaires est également précisée dans ces recommandations. [16] L’effet de l’aspirine sur la réduction du risque d’AVC chez les patients en FA est modeste selon les études : environ 20% contre 64% pour la warfarine versus placebo, avec un surcroît de risque hémorragique. [27]-[29] Le risque d’hémorragies graves ou d’hémorragies intracrâniennes avec l’aspirine n’est pas significativement différent de celui avec un traitement anticoagulant,
notamment dans la population âgée [30]-[33] Donc leur utilisation est limitée aux patients ayant un score CHA2DS2-VASc supérieur ou égal à 1, qui refusent tout traitement anticoagulant ou s’il
existe une contre-indication à ce dernier.
Parmi les anti-agrégants plaquettaires, l’association aspirine-clopidogrel a une efficacité
supérieure comparée à l’aspirine seule mais avec une augmentation du risque hémorragique. [34] L’aspirine sera utilisée en monothérapie chez la catégorie de patients précédemment citée qui ne peuvent pas tolérer l’association aspirine-clopidogrel, en raison par exemple d’un risque excessif de saignement. Il n’existe pas de preuve montrant une diminution de la mortalité cardiovasculaire ou totale avec ce type de traitement (aspirine ou aspirine + clopidogrel).
L’évaluation du risque cardio-embolique n’est pas la seule à prendre en compte lorsque se pose la question de débuter une anticoagulation orale, celle du risque hémorragique, principal effet secondaire d’un tel traitement, est également nécessaire. Là encore, le choix standardisé d’un score permet plus de précision et d’uniformité entre les praticiens. Parmi les différents scores existants, le score HAS-BLED (cf tableau 2) est recommandé pour apprécier le risque hémorragique par l’European Society of Cardiology (ESC) [35], la Canadian Cardiovascular Society [36], [37], l’European Heart Rhythm Association (EHRA) et l’ESC working group on thrombosis [38].
15
Tableau 2 : score HAS BLED
items Points
H : HTA (PAS non contrôlée supérieure ou égale à 160 mmHg)
1
A : Anomalie de la fonction rénale
(créatininémie supérieure ou égale à 200 µmol/l) ou hépatique (maladies hépatiques chroniques ou anomalies biologiques (bilirubine x 2N, ASAT ALAT x 3N…))
1 ou 2
S : Stroke (antécédent d’AVC, en particulier lacune)
1
B : Bleeding (antécédent de saignement ou risque de saignement)
1
L : Labile (INR variable) 1
E : Ederly (âge supérieur à 65 ans) 1
D : Drogues (médicaments avec risque hémorragique (antiagrégants plaquettaires, AINS)) ou alcool
1 ou 2
Il varie donc de 0 à 9 points.
La prescription d’une anticoagulation orale, après évaluation rigoureuse du rapport
bénéfices/risques, est donc basée sur le score CHA2DS2-VASc pour le risque thrombo-embolique et
sur le score HAS-BLED pour le risque hémorragique qui, s’il est élevé, ne constitue pas une contre-indication mais incite à la prudence et à un suivi ultérieur très attentif. [39]
La population traitée étant volontiers âgée avec de fréquentes comorbidités, il est conseillé de réévaluer périodiquement ce rapport pour tenir compte de l’apparition de facteurs de risque ou à l’inverse pour ne pas maintenir une prescription devenue plus dangereuse qu’utile.
16 Le choix d’instaurer un traitement anticoagulant peut se résumer dans le schéma ci-dessous :
Figure 2 : Choix du traitement anticoagulant (ESC 2012)
b. Les antivitamines K : preuve d’efficacité et effets indésirables
Ce premier paragraphe souligne la place essentielle qu’occupe l’anticoagulation dans la prise en charge de la FA non valvulaire chez les sujets à risque, pathologie responsable d’une importante morbi-mortalité dont l’incidence et la prévalence ne cessent d’augmenter, notamment avec le vieillissement de la population.
Pour assurer ce rôle, les antivitamines K (AVK) ont longtemps constitué le seul traitement anticoagulant oral disponible. Ils sont le traitement de référence pour la prévention de la fibrillation atriale. De nombreux essais publiés entre 1989 et 1992, dont les essais AFASAK, BAATAF, SPAF, CAFA, SPINAF et EAFT, ont montré que les AVK ont fait la preuve de leur efficacité
17 dans la diminution de la morbi-mortalité liée à la FA, mais également dans la réduction
significative du risque d’AVC.
Ils ont montré une réduction relative du risque d’AVC de 64% par rapport au placebo, ce qui équivaut à une réduction absolue annuelle du risque d’AVC de 2,7%, et de 39% par rapport à l’aspirine, alors que l’aspirine, comme vu au paragraphe précédent, ne réduit le risque que d’environ 20% par rapport au placebo. [40] Ces bénéfices ont aussi été confirmés dans l’étude observationnelle ATRIA. [5]
Les premières utilisations thérapeutiques des anticoagulants oraux représentés par les AVK remontent aux années 1940.
En France, les AVK commercialisés sous forme orale sont les coumariniques et les dérivés de l’indanedione.
Les coumariniques regroupent l’acénocoumarol commercialisé sous le nom de SINTROM et MINISINTROM et la warfarine commercialisée sous le nom de COUMADINE. Dans la prévention des complications thrombo-emboliques des cardiopathies emboligènes, au niveau national, le SINTROM a obtenu l’AMM le 06 décembre 1990, le MINISINTROM le 04 octobre 1993 et la
warfarine le 08 mars 1993 pour les comprimés de 2 mg et le 02 mai 2001 pour les comprimés de 5 mg. [41]
Parmi les dérivés de l’indanedione, la fluindione est commercialisée sous le nom de PREVISCAN et a obtenu l’AMM le 12/10/1998. [41]
En France, cette dernière est le principal AVK utilisé (80 % des utilisateurs d’AVK en 2013), suivie respectivement de la warfarine et de l’acénocoumarol. [42]
La surveillance de l’activité anticoagulante des AVK est réalisée à partir d’un test biologique, l’INR (International Normalized Ratio).
En dehors de tout traitement par AVK, l’INR d’un sujet normal est inférieur ou égal à 1,2.
Dans la prévention des complications thrombo-emboliques liées à la FANV, un INR compris entre 2 et 3 avec une valeur cible de 2,5 est recherché, ce qui signifie que :
18 - Un INR inférieur à 2 reflète une anticoagulation insuffisante et donc un risque
cardio-embolique augmenté,
- Un INR supérieur à 3 traduit un excès d’anticoagulation et donc un risque hémorragique augmenté (majoration significative en cas d’INR supérieur à 5).
L’objectif est donc que le patient passe un maximum de temps avec un INR compris dans cette fenêtre thérapeutique. On parle de temps passé dans la fenêtre d’efficacité de l’INR (Time in Therapeutic Range TTR). Les différents essais cliniques s’intéressant à ce paramètre estiment un TTR moyen à 60-65 %, tandis que de nombreuses études menées « en vie réelle » l’estiment inférieur à 50 %. Ce niveau insuffisant est associé à une augmentation du risque hémorragique (cf score HAS-BLED). La difficulté à obtenir un TTR correct s’explique par l’existence d’une grande variabilité intra et interindividuelle, mais également par les nombreuses interactions
médicamenteuses et non médicamenteuses des AVK. Or, de nombreuses études démontrent qu’un niveau de prévention satisfaisant est associé à un TTR supérieur à 70 %. [18], [43] – [47].
Le rythme des contrôles biologiques est bien codifié :
- Avant l’initiation du traitement, il est recommandé de faire un bilan d’hémostase (TP, TCA) afin de détecter d’éventuels troubles de l’hémostase et de pouvoir ainsi adapter au mieux la posologie initiale.
- Le premier contrôle s’effectue après la 3ème prise d’AVK (c’est-à-dire le matin du 4ème jour), afin de dépister une hypersensibilité individuelle : un INR supérieur à 2 annonce un
surdosage avant l’obtention de l’équilibre et doit faire réduire la posologie.
- Le deuxième contrôle est réalisé en fonction des résultats du 1er INR, afin d’apprécier l’efficacité anticoagulante (selon les cas entre 3 et 6 jours après le 1er contrôle).
- Les contrôles ultérieurs sont pratiqués 1 à 2 fois par semaine jusqu’à stabilisation de l’INR, puis avec un espacement progressif jusqu’à un intervalle maximal de 1 mois. L’équilibre du traitement n’est parfois obtenu qu’après plusieurs semaines.
- Un contrôle doit être fait 3 jours après toute modification posologique, puis répété jusqu’à stabilisation.
- Un contrôle doit être envisagé 2 à 3 jours après toute situation susceptible de perturber l’INR (fièvre, déshydratation, décompensation cardiaque, ajout ou retrait d’un autre médicament, infections, etc.) afin d’adapter la posologie de l’AVK si besoin.
19 Les tableaux 3 et 4 rappellent les différents AVK en France et leurs indications, ainsi que leurs principales caractéristiques pharmacocinétiques et pharmacodynamiques. [42]
Tableau 3 : AVK commercialisés en France et leurs indications
Famille
pharmacologique
Dénomination commune internationale
Nom commercial Indications
coumarinique Acénocoumarol warfarine SINTROM 4 mg, comprimé quadrisécable MINISINTROM 1 mg, comprimé sécable COUMADINE 2 mg, comprimé sécable COUMADINE 5 mg, comprimé sécable -cardiopathies emboligènes : prévention des complications thrombo-emboliques en rapport avec certains troubles du rythme auriculaire (FA, flutter,
tachycardie atriale), certaines valvulopathies mitrales, les prothèses valvulaires
-prévention des complications thrombo-emboliques des infarctus du myocarde
compliqués : thrombus mural, dysfonction ventriculaire gauche sévère, dyskinésie emboligène…, en relais de l’héparine.
-traitement des thromboses veineuses profondes et de l’embolie pulmonaire ainsi que la prévention de leurs récidives, en relais de l’héparine.
Dérivés de l’indanedione
fluindione PREVISCAN 20 mg,
20
Tableau 4 : Principales caractéristiques pharmacocinétiques (PK) et pharmacodynamiques (PD) des AVK disponibles en France
fluindione warfarine Acénocoumarol
Paramètres PK
Absorption
Biodisponibilité T max
rapide rapide Rapide
Importante (60%) 2-3h
Variabilité
Intra/interindividuelle importante importante Importante
Distribution Volume distribution (Vd) Liaison protéines plasmatiques Passage placenta/lait maternel Forte (97 %)
Formes liées inactives oui
Forte (97 %)
Formes liées inactives oui
Vd = 0,16 à 0,22 L/kg
oui
métabolisme Forme libre
uniquement
Forme libre uniquement Principales voies Induction
enzymatique Induction enzymatique CYP450 2C9 CYP1A2 CYP2C19
Métabolites Inactifs Inactifs Inactifs
Interactions médicamenteuses d’origine métabolique
Nombreuses Nombreuses Nombreuses
Elimination Rénale Directe ou après métabolisation Rénale Directe ou après métabolisation 60 % rénale 29 % fécale Surtout après métabolisation T ½ vie 31h 35-45h 8-11h
21 Principaux facteurs d’augmentation de l’exposition Sujets âgés Insuffisance rénale Sujets âgés Insuffisance rénale Sujets âgés Insuffisance rénale Paramètres PD Activité anticoagulante Indirecte
Action sur la synthèse hépatique des
facteurs de la
coagulation (facteurs II, VII, IX, X, protéines C et S)
Délai d’action 36-72h
Durée d’action 3-4 jours 4 jours 2-4 jours
Surveillance biologique INR Principaux facteurs perturbant l’équilibre de l’INR Sujet âgé Insuffisance rénale Insuffisance hépatique Poids < 50 kg Evènement pathologique intercurrent, épisode infectieux aigu Hypoprotidémie Polypathologie Alimentation riche en vitamine K Médicaments/plantes agissant sur le métabolisme hépatique
22 Comme tout médicament, il existe des effets indésirables, au premier rang desquels les
complications hémorragiques. Toutes les études épidémiologiques ont montré que les AVK arrivent en France au premier rang des accidents iatrogènes entraînant une hospitalisation.
Les manifestations hémorragiques peuvent concerner différents organes, par exemple : hémorragie ou hématome intracérébral, hématome du psoas, hémorragie intra-abdominale, hémorragie intra-articulaire ou encore urologique. Il peut également s’agir d’hémorragies non graves : ecchymoses, hématomes, épistaxis, gingivorragies.
L’étude EMIR [48] en 2007 a montré que les AVK correspondaient toujours à la plus forte incidence d’hospitalisation pour effets indésirables (12,3 %).
L’étude ENEIS 1 et 2 [49] a mis en évidence que les anticoagulants dont les AVK arrivent en France au premier rang des médicaments responsables d’accidents iatrogènes graves (37 % en 2004 et 31 % en 2009 des évènements indésirables graves rapportés liés au médicament).
On estime à environ 5 000 le nombre d’accidents mortels liés aux hémorragies sous AVK par an.
Le rapport bénéfices/risques positif des AVK dans la prévention thrombotique et thrombo-embolique liée à la FANV est conditionné par leur bon usage, nécessitant une très bonne connaissance et un respect rigoureux des conditions d’utilisation de ces médicaments par les prescripteurs. Ces derniers doivent s’adapter à chaque patient et sa situation personnelle, et s’assurer de la bonne adhésion, compréhension et observance au traitement de ce dernier.
c. Rationnel de développement d’un nouveau traitement
L’utilisation des AVK s’avère complexe pour plusieurs raisons :
- Elle nécessite une surveillance biologique régulière ; - La variabilité intra et interindivuelle est importante ;
- Les difficultés d’équilibration sont réelles, avec très peu de patients dont le TTR est satisfaisant ;
- Les interactions alimentaires et médicamenteuses sont nombreuses (cf annexe 1) - Leur demi-vie est longue.
23 Devant ces difficultés de maniabilité, de nouvelles molécules ont été développées ces dernières années, les AOD, présentés comme des alternatives aux AVK. Ils se veulent plus faciles
d’utilisation, à la fois pour les prescripteurs mais également pour les patients.
Ils regroupent :
- Le dabigatran, commercialisé sous le nom de PRADAXA, inhibiteur direct de la thrombine. Il a obtenu l’AMM européenne en 2008 et française en 2009.
- Le rivaroxaban, commercialisé sous le nom de XARELTO, inhibiteur direct du facteur Xa. AMM européenne en 2008 puis française en 2009.
- L’apixaban, commercialisé sous le nom d’ELIQUIS, inhibiteur direct du facteur Xa également. AMM européenne en 2011 puis française en 2012.
L’edoxaban, qui sera commercialisé sous le nom de LIXIANA, est un inhibiteur direct du facteur Xa. L’Agence Européenne des médicaments a rendu un avis favorable pour une AMM en 2015.
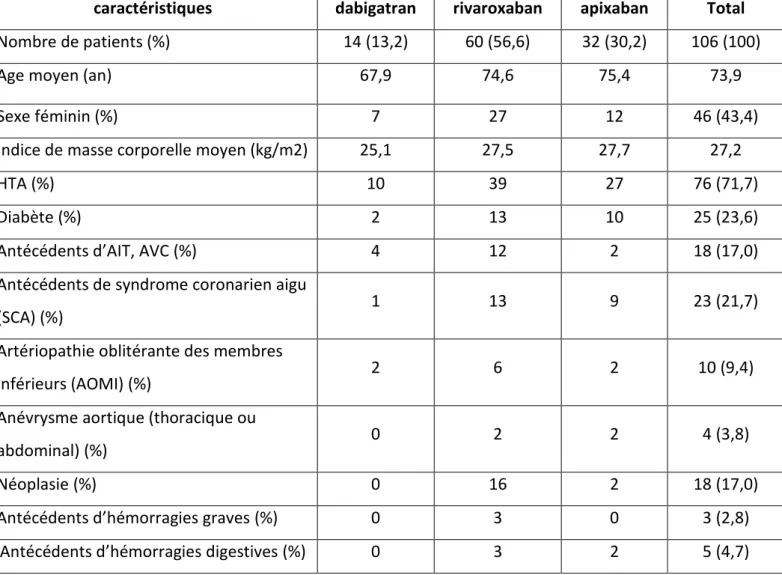
N’ayant pas encore obtenu l’AMM française (attendue à l’automne 2016), notre étude inclue donc uniquement des patients traités par dabigatran, rivaroxaban ou apixaban. Notre analyse sera par conséquent structurée autour de ces trois molécules. Nous indiquerons néanmoins les posologies auxquelles est utilisé l’edoxaban dans la prévention du risque thrombo-embolique lié à la FA, ainsi que les principaux résultats de l’étude princeps l’ayant comparé à la warfarine, dans les tableaux 5 et 7 de notre travail.
Les AOD présentent des caractéristiques pharmacologiques différentes des AVK, rendant leur maniement plus aisé :
- La variabilité intra et interindividuelle est faible ;
- La réponse prévisible permet des doses fixes et ne nécessite donc pas de surveillance biologique en routine ;
- Il n’y a pas d’interactions alimentaires et les interactions médicamenteuses sont moins nombreuses (cf annexe 2) ;
- Le délai d’action est plus rapide et la demi-vie plus courte.
Les tableaux 5 et 6 regroupent les différents AOD actuellement commercialisés accompagnés de leurs posologies auxquelles ils sont utilisés dans la prévention thrombo-embolique de la FANV ainsi que leurs principales caractéristiques pharmacocinétiques et pharmacodynamiques. [42]
24
Tableau 5 : AOD utilisés et leurs posologies respectives
DCI Nom commercial et
présentation
Posologies
dabigatran PRADAXA gélule à 110 et 150
mg
110 mg 2 fois par jour (1)
150 mg 2 fois par jour
rivaroxaban XARELTO comprimé à 15 et 20
mg
15 mg par jour (2)
20 mg par jour
apixaban ELIQUIS comprimé à 2,5 et 5
mg
2,5 mg 2 fois par jour (3)
5 mg 2 fois par jour
edoxaban LIXIANA comprimé à 30 et 60 mg
30 mg 1 fois par jour (4) 60 mg 1 fois par jour
(1) si âge supérieur ou égal à 80 ans, en cas de co-traitement par vérapamil, ou d’après l’évaluation individuelle du risque thrombo-embolique et du risque de saignements
(2) en cas d’insuffisance rénale modérée à sévère
(3) en cas d’insuffisance rénale sévère (clairance de la créatinine < 30 ml/min), ou d’association d’au moins deux des caractéristiques suivantes : poids inférieur ou égal à 60 kg, âge supérieur ou égal à 80 ans, insuffisance rénale légère ou modérée [50]
(4) si un ou plusieurs facteurs cliniques suivants : insuffisance rénale modérée ou sévère (clairance de la créatinine de 15 à 50
ml/min) ; poids inférieur ou égal à 60 kg ; traitement concomitant par les inhibiteurs de la glycoprotéine P (P-gp) suivants : ciclosporine, dronédarone, érythromycine ou kétoconazole
25
Tableau 6 : Principales caractéristiques pharmacologiques des AOD.
Dabigatran Rivaroxaban Apixaban
Prodrogue Oui Dabigatran etexilate Non Non Absorption Biodisponibilité Faible 6,5% Importante Alimentation/dose dépendante < 15 mg : 80-100% >- 15 mg : 66 % à jeûn 100 % avec nourriture Modérée 50 % Influence de la nourriture
Pas d’effet sur biodisponibilité T max retardé de 2 heures
Prise possible au cours ou en dehors des repas
>-15 mg : biodisponibilité + 39 %
Prise au cours des repas uniquement
<15 mg : Prise possible au
cours ou en dehors des repas
Pas d’effet sur biodisponibilité
Prise possible au cours ou en dehors des repas
Influence de l’intégrité de la gélule ou du comprimé
Si ouverture de la gélule : biodisponibilité + 75 %
Ne pas ouvrir/ croquer les gélules
Pas d’influence
Peut être écrasé/mélangé à repas liquide (compote, eau) et administré par sonde gastrique Variabilité
intraindividuelle
20 %
interindividuelle 30-40 %
70 % après une prise post-opératoire
30 %
Distribution
Volume Distribution 60-70 litres 50 litres 21 litres
Liaison protéines plasmatiques
34-35 % 92-95 % 87 %
Métabolisme Très faible Important Important
26
Métabolites Actifs Inactifs Inactifs
Principales voies Conjugaison Substrat de la P-gp CYP3A4 Substrat de la P-gp CYP3A4/5 Substrat de la P-gp Principales interactions médicamenteuses d’origine métabolique Inhibiteurs/inducteurs/substrats P-gp Inhibiteurs/inducteurs CYP3A4 et P-gp Inhibiteurs/inducteurs CYP3A4 et P-gp
Elimination 85 % rénale directe
(sous forme inchangée)
2/3 après métabolisation 1/3 rénale directe Surtout fécale Après métabolisation Elimination rénale +++ 85 % de la dose absorbée ++
33 % sous forme inchangée 33 % sous forme de métabolites + 27 % de la dose absorbée Elimination fécale - 6 % de la dose absorbée + 33 % sous forme de métabolites ++ 50 % de la dose absorbée Principaux paramètres PK T ½ vie 12-14h
Prolongée si insuffisance rénale
5-9h chez sujets jeunes 11-13h chez sujets âgés
12h
T max 0,5-2h après la prise
6h après une prise post-opératoire
2-4h après la prise 3-4h après la prise
T min 12-24h après la prise 16-24h après la prise 12-24h après la prise
Principaux facteurs d’augmentation de l’ASC Insuffisance rénale Age Petit poids Femmes Insuffisance rénale Age Insuffisance hépatique Insuffisance rénale Age Petit poids Hémodialyse Possible Diminution de l’ASC de 50-60 %
Non dialysable Peu efficace
Diminution de l’ASC de 50-60 %
27
d. Etudes princeps -> AMM
Le dabigatran, le rivaroxaban et l’apixaban ont chacun été comparés à la warfarine dans trois larges essais randomisés multicentriques, dans la prévention des évènements thrombo-emboliques de la FA, chez des patients à risque.
Il s’agit d’études de non-infériorité ayant abouti à leur autorisation de mise sur le marché respective.
Le dabigatran fut comparé à la warfarine dans l’étude RE-LY [51] (Randomized Evaluation of Long term Anticoagulant Therapy). Cette dernière fut publiée dans le New England Journal of Medicine le 17 septembre 2009. 18 113 patients de 44 pays issus de 951 centres furent inclus dans l’étude. Le suivi minimum était d’un an, maximum de 3 ans avec une médiane de 2 ans. Chez les patients prenant le dabigatran, deux dosages ont été étudiés : 110 mg 2 fois par jour et 150 mg 2 fois par jour. L’âge moyen était de 71,5 ans et le score CHADS2 moyen à 2,1. Le critère de jugement
principal était la survenue d’un AVC (ischémique, hémorragique ou inclassé) ou d’un évènement embolique, ainsi que la survenue d’hémorragies majeures, dans chacun des trois groupes étudiés.
Les principaux résultats à retenir sont :
- la survenue d’un AVC ou d’un évènement embolique était similaire chez les patients traités par le dabigatran à la dose de 110 mg 2 fois par jour et chez les patients traités par de la warfarine (RR 0,91 ; IC 95% 0,74-1,11), alors qu’elle était moindre dans le groupe prenant le dabigatran à la dose de 150 mg 2 fois par jour (RR 0,66 ; IC 95% 0,53-0,82);
- le taux d’hémorragies majeures était moindre chez les patients prenant le dabigatran à la dose de 110 mg 2 fois par jour (RR 0,80 ; IC 95% 0,69-0,93) alors qu’il était similaire chez les patients traités par du dabigatran 150 mg 2 fois par jour (RR 0,93 ; IC 95% 0,81-1,07), en comparaison avec le groupe warfarine ;
- le taux d’hémorragies intracrâniennes était inférieur dans les 2 groupes traités par le dabigatran par rapport au groupe warfarine (pour le dosage 110 mg 2 fois par jour : RR 0,31 ; IC 95% 0,20-0,47 ; pour le dosage 150 mg 2 fois par jour : RR 0,40 ; IC 95% 0,27-0,60) ;
28 - le taux d’infarctus du myocarde était supérieur dans les 2 groupes traités par dabigatran
(pour le dosage 110 mg 2 fois par jour : RR 1,35 IC 95% 0,98-1,87 ; pour le dosage 150 mg 2 fois par jour : RR 1,38 IC 95% 1,00-1,91) ;
- le taux d’hémorragies digestives graves était plus élevé dans le groupe traité par le dabigatran 150 mg 2 fois par jour (RR 1,50 ; IC 95% 1,19-1,89) ;
- le taux de mortalité toutes causes confondues était diminué dans les deux groupes dabigatran mais de manière non significative (pour le dosage 110 mg 2 fois par jour : RR 0,91 ; IC 95% 0,80-1,03 ; pour le dosage 150 mg 2 fois par jour : RR 0,88 ; IC 95% 0,77-1,00); - en dehors des effets secondaires hémorragiques, le principal effet indésirable relevé dans
les groupes traités par le dabigatran était la dyspepsie.
Le rivaroxaban fut comparé à la warfarine dans l’étude ROCKET-AF [52] (Rivaroxaban Once daily oral direct Factor Xa inhibition Compared with vitamine K antagonism for prevention of stroke and embolism Trial in Atrial Fibrillation) présentée lors du congrès de l’AHA 2010 et publiée dans le New England Journal of Medicine le 08 septembre 2011. 14 264 patients en FANV de 45 pays issus de 1 178 centres furent compris dans cette étude. Le suivi médian était de 1,9 an. La posologie du rivaroxaban était de 20 mg par jour sauf chez les patients insuffisants rénaux avec une clairance de la créatinine entre 30 et 49 ml/min où elle était réduite à 15 mg/j. L’âge moyen était de 73 ans et le score CHADS2 moyen à 3,5. Le critère de jugement principal était la survenue d’un AVC
(ischémique, hémorragique) ou d’un évènement embolique, ainsi que la survenue d’hémorragies majeures ou non majeures ayant un impact clinique, dans chacun des groupes étudiés.
Les principaux résultats à retenir sont :
- la survenue d’un AVC ou d’un évènement embolique était similaire dans le groupe traité par le rivaroxaban et dans le groupe traité par la warfarine (RR 0,88 ; IC 95% 0,75-1,03); - il n’y avait pas de différence significative concernant la survenue d’hémorragies majeures
ou non majeures entre les groupes (RR 1,03 ; IC 95% 0,96-1,11);
- le taux d’hémorragies intracrâniennes et d’hémorragies fatales était moindre dans le groupe traité par le rivaroxaban (RR 0,67 ; IC 95% 0,47-0,93 ; RR 0,50 ; IC 95% 0,31-0,79, respectivement) ;
- le taux d’hémorragies digestives graves est plus élevé dans le groupe rivaroxaban (224 évènements hémorragiques soit 3,15% contre 154 soit 2,16% dans le groupe warfarine).
29 - Le taux de mortalité toutes causes confondues était diminué dans le groupe rivaroxaban
mais la différence n’était pas significative (RR 0,85 ; IC 95% 0,70-1,02).
L’apixaban fut comparé à la warfarine dans l’étude ARISTOTLE [53] présentée au congrès de l’European Society of Cardiology 2011, et publiée simultanément dans le New England Journal of Medicine le 15 septembre 2011. Elle comprenait 18 201 patients de 39 pays issus de 1 034
centres. Le suivi médian était de 1,8 an. 2 dosages d’apixaban ont été étudiés : 5 mg 2 fois par jour et 2,5 mg 2 fois par jour chez les patients présentant au moins deux des critères suivants : âge supérieur ou égal à 80 ans, poids inférieur ou égal à 60 kg, créatinine sérique supérieur ou égal à 1,5 mg /dl (133 µmol/l). Les patients atteints d’une insuffisance rénale sévère étaient exclus de l’étude. L’âge moyen était de 70 ans et le score CHADS2 moyen à 2,1. Le critère de jugement
principal était la survenue d’un AVC (ischémique, hémorragique ou inclassé) ou d’un évènement embolique, ainsi que la survenue d’hémorragies majeures, dans chacun des groupes.
Les principaux résultats à retenir sont :
- le taux de survenue d’un AVC ou d’un évènement embolique était inférieur chez les patients traités par apixaban par rapport aux patients traités par warfarine (RR 0,79 ; IC 95% 0,66-0,95);
- le taux de survenue d’hémorragies majeures était moindre dans le groupe traité par apixaban (RR 0,69 ; IC 95% 0,60-0,80);
- le taux de survenue d’hémorragies intracrâniennes était également inférieur dans le groupe traité par apixaban (RR 0,42 ; IC 95% 0,30-0,58);
- le taux de survenue d’hémorragies digestives graves était inférieur chez les patients traités par apixaban mais la différence n’était pas significative (RR 0,89 ; IC 95% 0,70-1,15).
- Le taux de mortalité toutes causes confondues était diminué de manière significative dans le groupe apixaban (RR 0,89 ; IC 95% 0,80-0,99).
Enfin, l’edoxaban fut également comparé à la warfarine avec des résultats comparables et résumés dans le tableau suivant.
30
Tableau 7 : Récapitulatif des études de non-infériorité AOD versus warfarine, en prévention des emboles artériels systémiques, chez les patients atteints de fibrillation atriale non valvulaire.
RE-LY ROCKET-AF ARISTOTLE ENGAGE-AF
AOD dabigatran rivaroxaban apixaban edoxaban
Nombre de patients 18 113 14 264 18 201 21 105 Suivi médian (années) 2 1,9 1,8 2,8 Age moyen (ans) 71,5 73 70 72 CHADS2 moyen 2,1 3,5 2,1 2,8 Dose 110 mg 2/j 150 mg 2/j 20 mg 1/j 5 mg 2/j 60 mg 1/j 30 mg 1/j Risque relatif AOD contre warfarine (intervalle de confiance 95%)
AVC 0,91 (0,74-1,11) 0,66 (0,53-0,82) 0,88 (0,75-1,03) 0,79 (0,66-0,95) 0,79 (0,63-0,99) 1,07 (0,87-1,31) HIC 0,31 (0,20-0,47) 0,40 (0,27-0,60) 0,67 (0,47-0,93) 0,42 (0,30-0,58) 0,54 (0,38-0,77) 0,33 (0,22-0,50) Saignement majeur 0,80 (0,69-0,93) 0,93 (0,81-1,07) 1,04 (0,90-1,20) 0,69 (0,60-0,80) 0,80 (0,71-0,91) 0,47 (0,41-0,55) Décès 0,91 (0,80-1,03) 0,88 (0,77-1,00) 0,85 (0,70-1,02) 0,89 (0,80-0,99) 0,92 (0,83-1,01) 0,87 (0,79-0,96)
31
e. Particularités sujets âgés / insuffisance rénale Age du patient
L’incidence de la fibrillation atriale étant plus fréquente chez les personnes âgées, l’âge du patient est un élément essentiel à prendre en compte lorsque se pose la question d’instaurer une
anticoagulation orale, notamment si le choix se porte sur un AOD.
Dans l’essai RE-LY, rappelons que l’âge moyen des patients était de 71,5 ans. Dans le sous-groupe des sujets de plus de 75 ans (7 258 patients), la réduction du risque thromboembolique reste similaire à celle observée avant 75 ans. En revanche, l’âge a influencé de manière statistiquement significative le risque de saignement. En effet, le risque d’hémorragie majeure augmente avec l’âge : après 75 ans, il est similaire à celui de la warfarine avec la posologie de 110 mg 2 fois par jour de dabigatran, mais il est supérieur avec le dabigatran dosé à 150 mg. La réduction du risque d’hémorragie cérébrale persiste sous dabigatran après l’âge de 75 ans. [54] [55]
En conclusion, la posologie la plus faible de dabigatran est à privilégier après 80 ans ou après 75 ans en cas de risque hémorragique élevé (exemples : clairance de la créatinine entre 30 et 50 ml/min, poids < 50 kg, score HAS-BLED supérieur ou égal à 3). Ceci est validé par les
recommandations émises par le consensus d’experts de la Société Française de Gériatrie et Gérontologie et de la Société Française de Cardiologie [56], sur la prise en charge de la fibrillation atriale du sujet âgé, ainsi que par la Haute Autorité de Santé concernant le bon usage du
médicament lors de sa mise à jour de septembre 2015. [50]
Dans l’essai ROCKET-AF, l’âge moyen était de 73 ans. Dans les sous-groupes des sujets de plus de 75 ans (6 164 patients), les résultats sont similaires à ceux observés dans la population générale, caractérisés par une non-infériorité du rivaroxaban en comparaison à la warfarine pour la prévention des évènements thromboemboliques et des accidents hémorragiques.
Donc, aucun ajustement posologique n’est nécessaire en fonction de l’âge et la dose de 20 mg une fois par jour de rivaroxaban doit être utilisée, sous réserve d’une fonction rénale normale. [50] [56]
Dans l’essai ARISTOTLE, l’âge médian était de 70 ans. Rappelons que l’âge des patients (supérieur ou égal à 80 ans) (avec le poids et la créatininémie) était l’un des critères choisis pour sélectionner
32 les patients du groupe à posologie faible, c’est-à-dire 2,5 mg 2 fois par jour, au lieu de 5 mg 2 fois par jour. Dans les sous-groupes des plus de 75 ans (5 678 patients), les résultats retrouvent également un bénéfice significatif de l’apixaban sur la réduction des évènements
thromboemboliques et des hémorragies majeures.
La plus faible posologie de l’apixaban est alors indiquée en cas d’âge supérieur ou égal à 80 ans associé à une des caractéristiques suivantes : poids inférieur ou égal à 60 kg, insuffisance rénale légère ou modérée. [50] [56]
Insuffisance rénale
Un autre paramètre important à prendre en compte lors de l’initiation et du suivi d’un traitement par AOD est la fonction rénale.
Nous avons vu que les AOD sont tous éliminés, dans des proportions variables mais significatives, par les reins, exposant le patient à une accumulation de principe actif et donc à une hémorragie, potentiellement grave, en cas d’altération de la fonction rénale. On peut prédire que l’insuffisance rénale sera la cause d’accident hémorragique évitable sous AOD la plus importante, et la plus regrettable, car facilement identifiable. L’attention que portait le prescripteur sur l’INR lorsqu’un AVK était administré doit dorénavant se porter sur la clairance de la créatinine.
Les 3 essais précédemment cités prévoyaient des précautions particulières selon la fonction rénale dans leur protocole. Les patients atteints d’insuffisance rénale sévère n’ont pas été inclus dans ces études :
- dans l’étude RE-LY, une clairance de la créatinine inférieure à 30 ml/min constituait un critère d’exclusion ;
- dans l’étude ROCKET-AF, les patients étaient exclus si la clairance de la créatinine était inférieure à 25 ml/min, et une dose faible (15 mg une fois par jour au lieu de 20 mg) était employée si elle était entre 30 et 49 ml/min ;
- dans l’étude ARISTOTLE, une créatininémie supérieure à 221 µmol/l ou une clairance de la créatinine inférieure à 25 ml/min correspondait à un critère d’exclusion, et la posologie basse d’apixaban (2,5 mg deux fois par jour au lieu de 5 mg deux fois par jour) était utilisée
33 en cas de créatininémie supérieure à 133 µmol/l en présence d’au moins un des critères suivants : âge supérieur à 80 ans, poids inférieur à 60 kg.
Dans ces essais, indépendamment de la posologie attribuée et du type de traitement, il y avait un nombre plus élevé de complications hémorragiques chez les patients atteints d’insuffisance rénale, par rapport à ceux ayant une fonction rénale préservée. [18] [54] [57] [58]
Les AOD doivent donc être utilisés avec précaution en cas d’insuffisance rénale, affection dont la fréquence est loin d’être négligeable dans la population concernée. Suivant les recommandations de septembre 2015 émises par la Haute Autorité de Santé [50], les grandes lignes posologiques à retenir sont les suivantes :
- le dabigatran doit être utilisé à la posologie la plus basse en cas d’insuffisance rénale modérée (clairance de la créatinine entre 30 et 60 ml/min) ; il est contre-indiqué en cas d’insuffisance rénale sévère (clairance de la créatinine inférieure à 30 ml/min) ;
- le rivaroxaban doit être utilisé à la posologie la plus basse et avec prudence en cas de clairance de la créatinine comprise entre 15 et 29 ml/min ; son utilisation n’est pas recommandée si la clairance est inférieure à 15 ml/min ;
- l’apixaban doit être utilisé à la posologie la plus basse et avec prudence en cas
d’insuffisance rénale sévère ou d’au moins deux des caractéristiques suivantes : poids inférieur ou égal à 60 kg, âge supérieur ou égal à 80 ans, insuffisance rénale légère ou modérée ; son utilisation n’est pas recommandée en cas de clairance inférieure à 15 ml/min.
La surveillance de la fonction rénale est essentielle et fait l’objet également de recommandations précises [50] :
- elle doit être évaluée avant l’instauration du traitement, tout comme la fonction hépatique et le taux d’hémoglobine ;
- la surveillance s’effectue ensuite au minimum une fois par an, et si besoin en cas d’évènement intercurrent ;
- elle doit être réalisée tous les 6 mois chez les patients de plus de 75 ans ou pesant moins de 60 kg ou si la clairance de la créatinine de départ était comprise entre 30 et 60 ml/min ;
34 - elle doit être réalisée tous les 3 mois si la clairance de la créatinine de départ était
inférieure à 30 ml/min (en cas de traitement par rivaroxaban ou apixaban).
A noter que l’évaluation de la fonction rénale doit se faire au moyen de la formule de Cockroft, car c’est elle qui a été utilisée dans tous les essais ayant évalué les AOD.
Rappel de la formule de Cockroft :
Clairance de la créatinine (ml/min)= (140-âge) x poids x constante / créatinine (µmol/l)
Constante = 1,23 chez l’homme et 1,04 chez la femme
Le tableau 8 rappelle les différents stades d’évolution de la maladie rénale chronique selon le débit de filtration glomérulaire.
Tableau 8 : Classification des stades d’évolution de la maladie rénale chronique (MRC) selon le débit de filtration glomérulaire. [59]
Stade DFG (ml/min/1,73 m2) Définition
1 >= 90 MRC* avec DFG normal ou augmenté
2 Entre 60 et 89 MRC* avec DFG légèrement diminué 3 Stade 3A : entre 45 et 59
Stade 3B : entre 30 et 44
Insuffisance rénale chronique modérée
4 Entre 15 et 29 Insuffisance rénale chronique sévère 5 < 15 Insuffisance rénale chronique terminale
*avec marqueurs d’atteinte rénale : albuminurie, hématurie, leucocyturie, ou anomalies morphologiques ou histologiques, ou marqueurs de dysfonction tubulaire, persistant plus de 3 mois (deux ou trois examens consécutifs)
35 2. Problèmes du quotidien
a. Risque hémorragique
Toutes les études distinguent 2 types d’hémorragies : les hémorragies majeures et mineures. Quatre échelles sont couramment utilisées pour classer les syndromes hémorragiques :
- Le Bleeding Severity Index (Landefeld 1987, Landefeld, 1989); - La classification de Fihn (1993);
- La Classification de la Fédération Italienne des Cliniques des Anticoagulants (Palareti, 2000, Pengo, 2001) ;
- La Classification du sous-comité « Contrôle de l’anticoagulation » de la Société internationale de thrombose et d’hémostase (ISTH) (Schulman, 2005). [60]
La classification de la ISTH est celle la plus communément retrouvée, notamment au cours des études princeps des AOD. C’est celle que nous utiliserons au cours de notre étude pour distinguer les hémorragies majeures et mineures qui sont définies de la façon suivante :
- Hémorragie majeure : - hémorragie fatale ;
- hémorragie symptomatique dans une zone ou un organe critique, telle que : intracrânienne, intraspinale, intraoculaire, rétropéritonéale, intra-articulaire, péricardique, ou intramusculaire avec syndrome de compartiment ;
- hémorragie entrainant une chute de l’hémoglobine supérieure ou égale à 2 g/dl ou conduisant à transfuser 2 unités ou plus de sang total ou de concentrés
érythrocytaires.
- Hémorragie mineure : toutes les hémorragies non majeures.
D’autres publications (Makris, 2001, van Latum 1995, van der Meer 1993, van der Meer 1996, Schulman 2003, Beyth 1998, Kuijer 1999, Copland 2001, Prandoni 2002) ont cherché à préciser ces notions de gravité des hémorragies :
36 - Les hémorragies majeures y sont caractérisées par leur localisation, leurs conséquences,
leur volume.
- La notion d’hémorragies intermédiaires a été utilisée pour des hémorragies notifiées séparément des questionnaires de routine, car plus manifestes que les épisodes mineurs, sans pour autant correspondre à des hémorragies majeures : hématurie macroscopique, hématomes importants, saignements de nez prolongés.
- Les hémorragies mineures sont le plus souvent définies par défaut par rapport aux hémorragies majeures. Une étude les caractérise un peu plus précisément : hématomes, épistaxis, rectorragies, urines hématiques. Une revue les décrit comme les épisodes hémorragiques sans coût ou conséquence (Schulman, 2003).
La HAS qualifie quant à elle une hémorragie grave, ou potentiellement grave, (dans le cadre d’un traitement par AVK) par la présence d’au moins un des critères suivants : [61]
- Hémorragie extériorisée non contrôlable par les moyens usuels ;
- Instabilité hémodynamique : PAS < 90 mmHg ou diminution de 40 mmHg par rapport à la PAS habituelle, ou PAM < 65 mmHg, ou tout signe de choc ;
- Nécessité d’un geste hémostatique urgent : chirurgie, radiologie interventionnelle, endoscopie ;
- Nécessité de transfusion de culots globulaires ;
- Localisation menaçant le pronostic vital ou fonctionnel, par exemple : hémorragie intracrânienne et intraspinale, hémorragie intraoculaire et rétro-orbitaire, hémothorax, hémo et rétropéritoine, hémopéricarde, hématome musculaire profond et/ou syndrome de loge, hémorragie digestive aiguë, hémarthrose.
S’il n’existe aucun de ces critères, l’hémorragie est qualifiée de non grave.
Le risque hémorragique constitue l’effet indésirable le plus redouté d’un traitement anticoagulant. Il est commun à toutes les molécules appartenant à cette classe médicamenteuse, sans exception. On ne le répètera jamais assez, chaque prescription doit reposer sur une analyse rigoureuse de la balance bénéfices / risques, une évaluation du risque thrombo-embolique et du risque
hémorragique par des scores validés, et s’assurer de l’adhésion, de la compréhension et de l’observance du patient par rapport à ce traitement. Surtout, cette évaluation doit être répétée
37 avec le temps, à chaque consultation, étant donné que le profil du patient peut évoluer en
fonction de la modification des comorbidités associées.
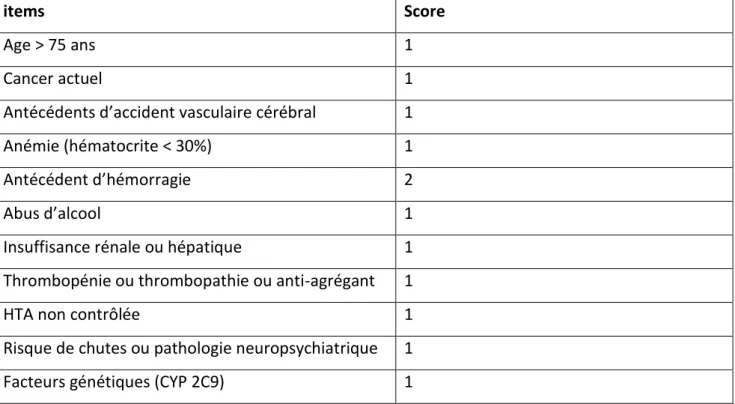
Pour évaluer le risque hémorragique, nous avons vu que le score HAS-BLED est celui utilisé dans toutes les grandes études. Un autre score qui doit être connu des prescripteurs est le score HEMORR2HAGES [62] (cf tableau 9), qui a été étudié chez des personnes âgées en moyenne de 80
ans et qui comporte plus d’items relatifs aux comorbidités du sujet âgé comme les chutes ou les troubles cognitifs, que le score HAS-BLED. Il sera à privilégier chez cette catégorie de personnes, comme le recommande la Société Française de Gériatrie et Gérontologie. [56]
Tableau 9 : Score HEMORR2HAGES
items Score
Age > 75 ans 1
Cancer actuel 1
Antécédents d’accident vasculaire cérébral 1
Anémie (hématocrite < 30%) 1
Antécédent d’hémorragie 2
Abus d’alcool 1
Insuffisance rénale ou hépatique 1
Thrombopénie ou thrombopathie ou anti-agrégant 1
HTA non contrôlée 1
Risque de chutes ou pathologie neuropsychiatrique 1
Facteurs génétiques (CYP 2C9) 1
Score HEMORR2HAGES total Nombre d’hémorragie (/100 pts-années)
0 1,9 1 2,5 2 5,3 3 8,4 4 10,4 >=5 12,5
38 Concernant les AOD, le paragraphe précédent met l’accent sur l’importance de la surveillance de la fonction rénale, cette dernière constituant un facteur indépendant d’augmentation du risque hémorragique en cas d’altération.
Le poids et l’âge du patient sont également des éléments à garder en mémoire, ce d’autant plus qu’une fonction rénale perturbée se retrouve plus fréquemment chez les personnes âgées.
La commercialisation et les premières années d’utilisation des AOD ont été accompagnées de nombreux débats, craintes et réserves de la part de différents acteurs du monde de la santé, qui persistent à l’heure actuelle. Une des voix les plus bruyantes fut celle élevée par le Syndicat des Jeunes Biologistes Médicaux (SJBM) qui fit part de son inquiétude vis-à-vis de ces nouvelles molécules et donna lieu à un communiqué de presse et une lettre ouverte au ministre de la Santé le 19 septembre 2013, au titre volontairement provocateur « Les NACO : le nouveau Mediator ? » [63]
Qualifiant ces nouveaux médicaments de « bombe à retardement » ou encore de « nouveau scandale en puissance », leurs craintes se portent entre autre sur l’absence d’antidote disponible, de test biologique permettant une surveillance de l’activité anticoagulante, ou encore de
protocoles validés auxquels se référer en cas de survenue d’accidents hémorragiques nécessitant des mesures thérapeutiques d’urgence. Le SJBM termine son exposé en se posant la question de l’intérêt d’inscrire les AOD sur la liste des médicaments d’exception afin d’avoir un meilleur contrôle sur leur prescription qui va croissante. Demande réitérée quelques jours plus tard dans l’article « NACO : leur place demande bien à être réévaluée ». [64]
La prescription des anticoagulants oraux n’a cessé d’augmenter au cours des 15 dernières années : quelques chiffres issus du rapport de l’ANSM d’avril 2014 intitulé « Les anticoagulants en France en 2014 : état des lieux, synthèse et surveillance » sont là pour l’illustrer : [42]
- Les ventes d’anticoagulants oraux ont doublé entre 2000 et 2012 (195 millions de doses définies journalières DDJ* en 2000 et 394 millions de DDJ en 2012), avec une croissance nettement plus marquée depuis 2011 ;
- Les ventes des AVK ont pratiquement doublé entre 2000 et 2012 (195 millions de DDJ en 2000 et 361 millions de DDJ en 2012), puis ont commencé à décroître (environ 313 millions de DDJ en 2013) ;
39 - Les ventes des AOD ont progressé très rapidement depuis leur introduction sur le marché
français en 2009 (1 million de DDJ en 2009 et 117 millions en 2013).
*Etablie sous l’égide de l’OMS, la DDJ constitue une posologie de référence pour un adulte de 70 kg dans l’indication principale de chaque molécule. Cette dose moyenne constitue un étalon de mesure qui, en éliminant les problèmes liés aux tailles de conditionnement et aux dosages différents d’une même substance active, permet de comparer les niveaux de consommation des médicaments.
C’est dans ce contexte que les AOD font l’objet d’une surveillance très étroite tant au niveau national qu’aux niveaux européen et mondial depuis leur mise sur le marché, notamment en ce qui concerne le risque hémorragique.
Au niveau européen, le comité de pharmacovigilance et d’évaluation des risques (PRAC) évalue les données de sécurité disponibles dans les rapports périodiques actualisés de pharmacovigilance (PSUR) de façon semestrielle. Au niveau national, le profil de sécurité de ces molécules est également suivi et un bilan est présenté au comité technique de pharmacovigilance tous les 6 mois.
Rappelons que concernant le risque hémorragique, les études princeps du dabigatran, du rivaroxaban et de l’apixaban (respectivement RE-LY, ROCKET-AF et ARISTOTLE) ont montré par rapport à la warfarine :
- Un taux de survenue d’hémorragies majeures moindre pour le dabigatran à la posologie de 110 mg 2 fois par jour et pour l’apixaban, similaire pour le dabigatran à la posologie de 150 mg 2 fois par jour et le rivaroxaban ;
- Un taux de survenue d’hémorragies intracrâniennes moindre pour chacun des AOD ; - Un taux de survenue d’hémorragies digestives graves supérieur pour le dabigatran dosé à
150 mg 2 fois par jour et le rivaroxaban, inférieur pour l’apixaban (différence non significative).
Les données publiées régulièrement depuis leur mise sur le marché en matière de
pharmacovigilance, ainsi que les études post-AMM actuellement disponibles vont dans le sens des études princeps et se veulent plutôt rassurantes :
40 - En octobre et en décembre 2013, après examen des données des derniers PSUR du
dabigatran, du rivaroxaban et de l’apixaban, le PRAC a conclu à l’absence de nouveaux signaux de sécurité remettant en question la balance bénéfice/risque de ces molécules ou nécessitant la mise à jour des informations produit.
- Au niveau national, le dernier bilan de suivi de pharmacovigilance, portant sur tous les effets indésirables graves rapportés depuis le début de la commercialisation du dabigatran et du rivaroxaban, a été présenté au comité technique de pharmacovigilance du 12 novembre 2013. Ce bilan a montré que les effets hémorragiques sont les effets
indésirables les plus fréquents et en rapport avec la pharmacodynamie de ces produits. Cependant, leur taux de notification apparait stable dans le temps. Certains facteurs de risque fréquemment associés à ces effets hémorragiques ont pu être mis en évidence : insuffisance rénale, sujets âgés, interactions médicamenteuses, posologies excessives,…
- Le dernier bilan de suivi de pharmacovigilance n’a pas mis en évidence de mésusage important, et les indications rapportées sont majoritairement conformes à l’AMM.
- Concernant l’apixaban, le dernier bilan de suivi national de pharmacovigilance, portant sur tous les effets indésirables rapportés en France depuis sa commercialisation jusqu’au 31 décembre 2013, présenté au Comité Technique de Pharmacovigilance le 18 février 2014, ne met en évidence aucun signal particulier. Les effets indésirables rapportés sont principalement attendus et conformes à ce qui est décrit dans l’information produit. Peu de mésusage a été mis en évidence, avec des indications majoritairement conformes à l’AMM.
- En décembre 2012, l’EMA a décidé de contre-indiquer l’utilisation du dabigatran chez les patients porteurs de prothèses valvulaires cardiaques mécaniques nécessitant un
traitement anticoagulant. Cette décision fait suite à la mise en évidence, dans une étude clinique (RE-ALIGN), d’un risque plus important de manque d’efficacité (de type
thromboses de valve ou AVC) et d’évènements hémorragiques chez les patients ayant bénéficié d’une chirurgie pour prothèse valvulaire cardiaque mécanique et traités par dabigatran par rapport aux patients traités par warfarine. [65]
41 - La méta-analyse parue en ligne dans le Lancet en 2013 [66], la première à analyser les
résultats des quatre études RELY, ROCKET-AF, ARISTOTLE et ENGAGE AF-TIMI 48 (cette dernière comparant un quatrième AOD nommé edoxaban, pas encore commercialisé, à la warfarine), souligne le bénéfice des AOD en terme de risque d’AVC (en particulier
hémorragiques) et d’évènements emboliques avec, sur le plan de la tolérance, une diminution de 52% des hémorragies intracérébrales mais une augmentation de 25% des hémorragies digestives par rapport à la warfarine.
- La méta-analyse des études RELY, ROCKET-AF, ARISTOTLE menée chez 44 563 patients indique un moindre risque d’hémorragie cérébrale avec les AOD en comparaison à la warfarine (RR 0,49, IC 95% = 0,36-0,66). [67]
- Une étude nommée Epan (Enquête de prévalence des accidents hémorragiques liés aux NACOS) a été réalisée chez 575 MG provenant de 12 régions françaises. Il s’agissait d’une étude rétrospective, déclarative visant à estimer la prévalence des accidents
hémorragiques survenant chez des patients traités par dabigatran ou rivaroxaban. Sur 2 365 patients traités et sélectionnés en 2013, 149 accidents hémorragiques ont été relevés (6,3%), ayant entrainé 7 décès (0,30%). [68]
- Une étude « en vie réelle » du bénéfice/risque à court terme des nouveaux anticoagulants oraux (dabigatran, rivaroxaban) chez les patients débutant un traitement et non
précédemment traités par des AVK, nommée étude NACORA (nouveaux anticoagulants oraux et risques associés), a été réalisée par la Caisse Nationale de l’Assurance Maladie des Travailleurs Salariés (CNAMTS) dont le rapport a été rendu le 23 juin 2014 et publié le 02 juillet 2014. [69] Au total, entre juillet et novembre 2012, 71 589 patients ont été inclus dans l’étude et suivis durant les 90 premiers jours suite à l’instauration du traitement : 12 403, 10 436 et 48 750 patients dans les cohortes dabigatran, rivaroxaban et AVK, respectivement. Les résultats de cette étude observationnelle à partir des bases de données médico-administratives françaises sont rassurants quant au bénéfice/risque des AOD à court terme et cohérents avec les résultats des autres études observationnelles publiées à ce jour. Ils ne montrent pas d’excès de risque hémorragique chez les patients