Effets des coupes de récupération sur les
successions naturelles de coléoptères saproxyliques
le long d’une chronoséquence de 15 ans après feu
en forêt boréale commerciale
Mémoire
Olivier Jeffrey
Maîtrise en sciences forestières avec mémoire
Résumé
Cette étude vise à décrire l’état naturel des communautés de huit familles de coléoptères saproxyliques, reconnues pour être associées aux brûlis, à partir d’un échantillonnage fait au niveau des souches et à l’intérieur de peuplements commerciaux d’épinettes noires (Picea mariana (Mill)) résiduels à la coupe de récupération (état naturel) provenant de brûlis de 1995, 2003, 2005, 2007, 2009 et 2010. L’étude vise également à comparer ces communautés à celles retrouvées dans des peuplements d’épinettes noires récupérés et répartis dans les brûlis de 1995, 2003, 2005 et 2007. Les coléoptères ont été inventoriés durant l’été 2010 et plus de 6 000 spécimens répartis dans les huit familles étudiées ont été capturés. À l’état naturel, quatre phases de colonisation se sont succédées pendant les cinq premières années après feu. Les assemblages des communautés de coléoptères saproxyliques sont quant à eux altérés par la récupération et ce, pour une période d’au moins sept ans.
Abstract
This study aims to describe the natural state of communities of eight saproxylic beetle families known to be associated with burned forest from a sample done at stump level and in commercial black spruce (Picea mariana (Mill)) stands residual to salvage logging (natural state) from burns of 1995, 2003, 2005, 2007, 2009 and 2010. The study also aims to compare these communities to those found in salvaged black spruce stands distributed in burns of 1995, 2003, 2005 and 2007. Beetles were sampled during summer 2010 and over 6 000 specimens among the eight studied families were captured. In its natural state, four colonization phases have succeeded along the first five postfire years. Saproxylic beetle assemblages were affected by salvage logging for a period of seven years.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ...vii
Liste des tableaux ... ix
Liste des figures ... xi
Remerciements ... xiii
Avant-Propos ... xv
INTRODUCTION GÉNÉRALE ... 1
Les feux de forêt ... 1
Le bois mort : un élément clé de la diversité biologique ... 2
Importance des feux pour les coléoptères saproxyliques ... 3
Problématique ... 5
Impacts des coupes de récupération sur la faune et la flore ... 6
Développement durable et aménagement écosystémique ... 7
Contexte de l’étude ... 8
CHAPITRE 1 - SAPROXYLIC BEETLE SUCCESSION ALONG A 15 YEARS POSTFIRE CHRONOSEQUENCE IN THE COMMERCIAL BOREAL FOREST.. 13
Résumé ... 14 Abstract ... 15 1 Introduction ... 16 2 Methods ... 18 2.1 Study area ... 18 2.2 Stand description ... 18 2.3 Beetle sampling ... 20 2.4 Statistical analysis ... 20
2.4.1 Habitat attributes along the chronosequence ... 21
2.4.2 Saproxylic beetle abundance and species richness along the chronosequence .. 21
2.4.3 Beetle assemblages along the chronosequence ... 22
2.4.4 Association between saproxylic beetles and habitat attributes along the chronosequence ... 22
3 Results ... 23
3.1 Overview ... 23
3.2 Habitat attributes along the chronosequence ... 24
3.3 Saproxylic beetle abundance and species richness along the chronosequence ... 25
3.4 Beetle assemblages along the chronosequence ... 25
3.5 Saproxylic beetle communities and habitat attributes along the chronosequence .. 25
viii
CHAPITRTE 2 - EFFECTS OF SALVAGE LOGGING ON SAPROXYLIC BEETLE SUCCESSION ALONG A 12 YEARS POSTFIRE CHRONOSEQUENCE IN THE
COMMERCIAL BOREAL FOREST ... 51
Résumé ... 52 Abstract ... 53 1 Introduction ... 54 2 Methods ... 56 2.1 Study area ... 56 2.2 Stand description ... 57 2.2 Beetle sampling ... 58 2.4 Statistical analysis ... 59 2.4.1 Habitat attributes ... 59
2.4.2 Beetle abundance and species richness ... 59
2.4.3 Beetle assemblages in residual versus salvaged stands over time ... 59
2.4.4 Residual versus salvage stands associated beetles ... 60
3 Results ... 61
3.1 Overview ... 61
3.2 Effects of salvage logging on habitat attributes structure along the chronosequence ... 61
3.3 Effects of salvage logging on beetle abundance and species richness along the chronosequence ... 61
3.4 Effects of salvage logging on beetle assemblages along the chronosequence ... 62
3.5 Beetles associated with residual or salvaged stands along the chronosequence .... 62
4 Discussion ... 63
4.1 Effects of salvage logging on saproxylic beetle communities along the chronosequence ... 63
4.2 Saproxylic beetles associated exclusively with salvaged stands ... 66
4.3 Effect of salvage logging on elaterids’ association along the chronosequence ... 66
5 Conclusion ... 67
Acknowledgments ... 67
References cited ... 75
Appendix A2 Species list and number of beetles captured for each treatment of each postfire year in black spruce boreal forest ... 80
CONCLUSION GÉNÉRALE ... 83
Dynamique temporelle après feu ... 83
Aménagement écosystémique des brûlis ... 85
Investigations futures ... 88
Liste des tableaux
Table 1. 1 Habitat attributes (average ± standard error) measured in postfire black spruce
stands along a 15 years chronosequence. ... 33
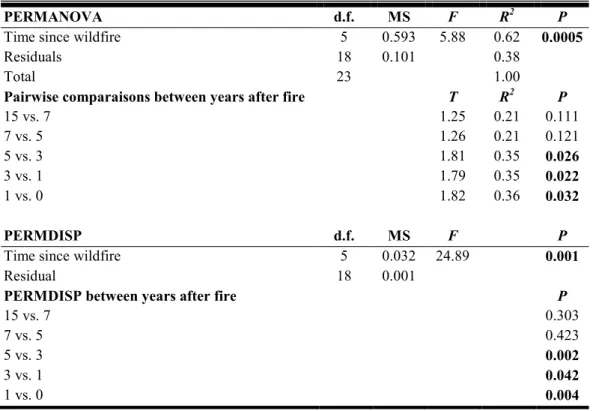
Table 1. 2 PERMANOVA and PERMDISP results showing the effect of time since
wildfire on beetle assemblages. Pairwise comparisons between years, using t-tests, are shown for PERMANOVA and PERMDISP. ... 34
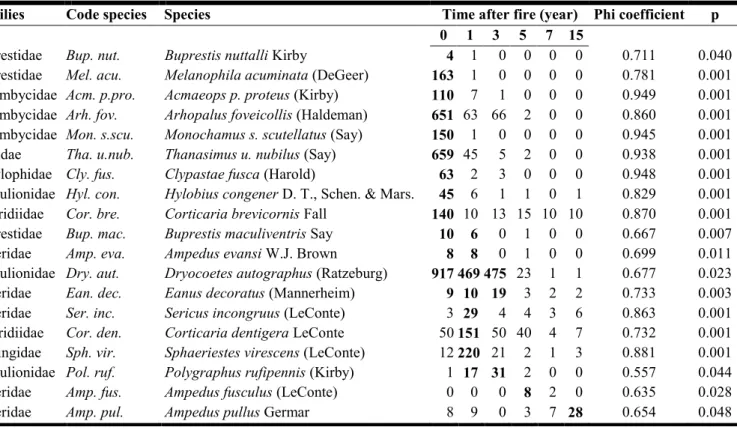
Table 1. 3 Beetle species significantly associated (p < 0.05) with a postfire year or a
combination of postfire years from point-biserial group-equalized phi coefficient analysis (Pearson correlation). Number of individuals in bold refers to the total number of specimens captured for each year with which a species was positively associated. Code species column refers to the abbreviations of the full name species and those codes were used in the RDA instead of the full name species. ... 35
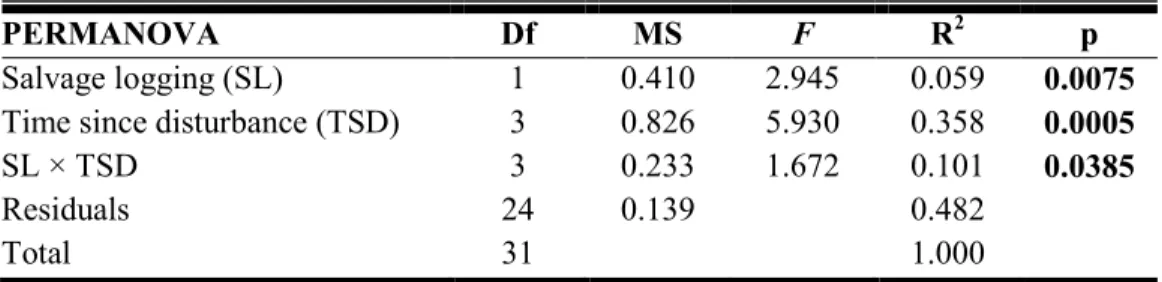
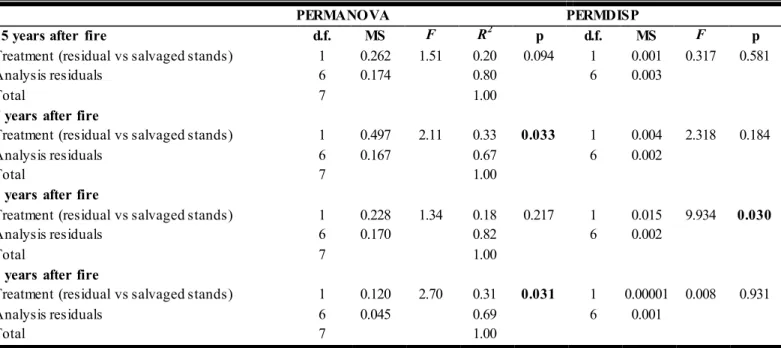
Table 2. 1 PERMANOVA results showing the effect of salvage logging, time since
disturbance and their interaction on the beetles’ assemblages. Significant effects are outlined in bold (α = 0.05). ... 69
Table 2. 2 PERMANOVA results showing the by-year effects of salvage logging on
postfire beetle assemblages. Significant effects are outlined in bold (α = 0.05). ... 70
Table 2. 3 Beetle species significantly associated (p <0.05) with residual or salvaged stands
of a postfire year or a combination of postfire years from point-biserial
group-equalized phi coefficient analysis (Pearson correlation). Number of individuals in bold refers to the total number of specimens captured for each treatment and year with which a species was positively associated. ... 71
Liste des figures
Figure 1. 1 Study area showing selected burns with their respective time (year) since
wildfire. X represent burns with a surface area less than 275 hectares. ... 36
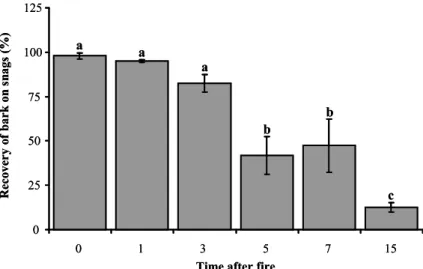
Figure 1. 2 ANOVA’s results comparing % bark covering on trunks of snags along the
chronosequence (average ± standard error). Letters represent statistical differences at α < 0.05. ... 37
Figure 1. 3 Average (± se) water content (%) along a 15 years postfire chronosequence in
black spruce boreal forest for A) snags, B) DDW and C) stumps. Different letters indicate significant differences at α < 0.05. ... 38
Figure 1. 4 Comparison of the water content (average ± se in %) between black spruce
DDW, stumps and snags for each year, separately, along a 15 years postfire
chronosequence in the boreal forest. Letters indicate significant differences at α < 0.05. ... 39
Figure 1. 5 Average (± se) abundance (A) and species richness (B) of beetles along a 15
years postfire chronosequence in black spruce boreal forest. Letters indicate signigicant differences at α < 0.05. Anova’s were done on fourth root-transformed values for the abundance. ... 40
Figure 1. 6 RDA ordination of beetles caught in postfire black spruce stands of the boreal
forest. Centroids of stands of each postfire time since disturbance are illustrated by the number of years in bold. Species are marked with a cross while habitat attributes are illustrated with arrows in bold. All species were used in the analysis but only those which were significantly associated with specific postfire years (or a combination of several ones) in the species-habitat associations analysis (Pearson’s point-biserial correlation; see table 3) were illustrated on the ordination. Also, only significant habitat attributes are shown: basal area of black spruce snags and volume of black spruce DDW of each decay class. The code species, presented in table 3, were used instead of the full name species. Habitat attribute codes were: R. sna. = recent snag, M. sna. = medium snag, O. sna. = old snag, R. DDW = recent down deadwood,
M. DDW = medium down deadwood and O. DDW = old down deadwood. ... 41
Figure 2.1 Study area showing selected burns with their respective time (year) since
wildfire. The X mark represents a 15 year burn that was smaller than 275 hectares. ... 72
Figure 2.2 Student paired t-test’s results comparing A) the basal area (m²/ha) of snags
(average ± standard error), B) the volume (m³/ha) of DDW (average ± standard error) and C) the basal area of dead saplings (average ± standard error) between residual and salvaged stands for each postfire years. Values in bold indicate significant results (p < 0.05). ... 73
Remerciements
Tout d’abord, je tiens à remercier mon directeur de recherche, le Dr Éric Bauce pour la liberté et la latitude qu’il m’a accordées lors de la réalisation de mes travaux. Je dois exprimer ma gratitude à Éric ainsi qu’à mon co-directeur, le Dr Jacques Ibarzabal, pour l’aide financière obtenue, laquelle a permis la réalisation de cette maîtrise. Je tiens aussi à leur présenter mes sincères remerciements pour m’avoir permis de présenter mes résultats de recherche à diverses occasions, notamment lors de congrès scientifiques tel que le
Symposium International sur la dynamique et les services écologiques du bois mort dans les écosystèmes forestiers. La participation à ces congrès m’a permis d’évoluer grandement
au niveau de ma formation académique et professionnelle.
Merci infiniment à mon co-directeur, le Dr Christian Hébert du laboratoire sur l’écologie et la diversité des insectes forestiers (ÉcoDIF). Christian est l’un des chercheurs en entomologie les plus passionnés que j’ai pu rencontrer lors de ma formation. En plus de m’avoir permis d’effectuer mes travaux de maîtrise dans son laboratoire, celui-ci m’a constamment fait bénéficier de ses larges connaissances au cours de nombreuses discussions à saveur scientifique. Merci pour ses judicieux conseils et pour son esprit critique. Je dois aussi souligner son dévouement, son ouverture d’esprit et sa grande disponibilité offerte lors de la direction de ma maîtrise. Christian est certainement un modèle d’inspiration pour l’ensemble des étudiants qui évoluent à ses côtés.
J’adresse aussi mes remerciements au coordonnateur du consortium iFor, le Dr Richard Berthiaume, pour son encadrement, son soutien et ses multiples implications lors de ma maîtrise. C’est toujours pertinent, constructif et quelquefois inévitable (!) de discuter de différents sujets avec Richard. Un grand merci aussi à Georges Pelletier, taxonomiste au Centre de Foresterie des Laurentides, pour ses formations d’identification d’insectes qui ont grandement facilité et accéléré cette étape de ma maîtrise. Je dois également remercier
xiv
Une attention particulière à mon ami de longue date, Jean-Philippe Légaré qui m’a permis de mieux connaître l’entomologie forestière en m’engageant comme auxiliaire de recherche lors de mon baccalauréat. L’expérience acquise à ce moment a constitué une source d’inspiration pour cette maîtrise. J’exprime également ma gratitude à mon généreux collègue et ami, Jonathan Boucher, pour sa disponibilité, son esprit critique et pour m’avoir épaulé tout au long de mon parcours. Merci à tous mes collègues qui ont contribué aux travaux de laboratoire et un merci exclusif aux membres du laboratoire EcoDIF de Christian Hébert : Sébastien Bélanger, Olivier Norvez, Yannick Cadorette-Breton, Francis Desjardins et Ermias T. Azeria pour les moments inoubliables que nous avons passés ensemble.
Finalement, je remercie infiniment ma famille; mes parents et leur conjoint respectif pour leur aide et leur confiance, ma sœur et mon frère pour leur amour et leurs encouragements lors de mon cheminement. Un merci très spécial à mon amour, Chantal, pour avoir été ma grande complice ainsi que d’avoir été ma source de motivation et de persévérance pendant ce processus académique et professionnel qui comporte parfois des moments moins enthousiastes. Merci à vous tous d’avoir rendu tant de choses possibles!
Avant-Propos
Ce mémoire de maîtrise est constitué de deux chapitres « Saproxylic beetle succession along a 15 years postfire chronosequence in the commercial boreal forest » et « Effects of salvage logging on saproxylic beetle succession along a 12 years postfire chronosequence in the commercial boreal forest » rédigés en anglais et sous la forme d’articles scientifiques destinés à être publiés dans des journaux scientifiques au cours de l’année 2013. Ces deux chapitres sont précédés d’une introduction et suivis d’une conclusion écrites en français. Le candidat à la maîtrise a participé à la sélection des sites ainsi qu’à l’installation du dispositif d’échantillonnage. Il a également effectué l’échantillonnage et la description des attributs de l’habitat dans les sites, identifié la plupart des insectes étudiés et fait l’analyse statistique des données. Les deux chapitres furent écrits entièrement par le candidat à la maîtrise, encadré et soutenu par les commentaires et conseils des coauteurs Christian Hébert, Jacques Ibarzabal, Richard Berthiaume et Éric Bauce. Ainsi, l’étudiant a le statut d’auteur principal pour les deux articles paraissant dans ce mémoire. Cette étude a été financée par le Fonds Québécois de la Recherche sur la Nature et les Technologies (FQRNT) dans le cadre du Programme de recherche en partenariat sur l’aménagement et l’environnement forestiers-II, par le consortium de recherche iFor (Université Laval) et le Service Canadien des Forêts de Ressources Naturelles Canada (SCF-NRCan).
Introduction générale
Les écosystèmes de la forêt boréale sont régis par des perturbations naturelles telles que des feux de forêt, des épidémies d'insectes ou des chablis (Pothier, 2001; Gauthier et al., 2008). Ces évènements peuvent se produire à grande échelle et sont d’ailleurs les principales causes de la diversité du paysage en forêt boréale. Ils y modifient la structure forestière en créant, dans le temps, des mosaïques d’arbres de dimensions, d’âges et d’essences différentes (Gauthier et al., 2008).
Les feux de forêt
Les feux de forêt constituent une perturbation majeure en forêt boréale québécoise (Bergeron et al., 2001; Gauthier et al., 2008). En effet, en 2010, près de 257 000 hectares (ha) de forêt y ont brûlé (SOPFEU, 2010) alors que la moyenne annuelle est d’environ 56 000 ha (moyenne couvrant la période de 1973 à 2004, (MRNF, 2012b)). Bien que les feux de forêt ont longtemps été considérés comme des « désastres naturels » produisant des déserts biologiques, plusieurs études ont récemment mis en évidence l’importance de cette perturbation pour la dynamique et les successions des écosystèmes forestiers (Bergeron et
al., 2001; Pausas et Keeley, 2009; Drapeau et al., 2010; Nappi et al., 2011). Puisque les
feux de forêt peuvent brûler de grandes superficies, ils sont considérés comme étant parmi les principales causes de changements, qui sont à leur tour essentielles à la diversité, au renouvellement et à la survie des écosystèmes boréaux (Fernández Fernández et Salgado Costas, 2004; Gauthier et al., 2008; Bowman et al., 2009; Nappi et al., 2011). Le feu permet, notamment, l’établissement rapide d’une nouvelle succession végétale composée principalement d’espèces ayant la capacité de germer et de croître rapidement et facilement après le passage du feu (Pausas et al., 2004). En effet, les essences retrouvées dans les régions où la fréquence des feux est élevée se sont adaptées et ont évolué pour devenir plus résistantes et résilientes (Pausas et Keeley, 2009). À titre d’exemples, certains pins et
2
de végétation inférieure et le houppier, ce qui fait que les cônes sont souvent protégés des flammes (Mauri Ortuno et al., 2009). Le pin gris (Pinus banksiana Lamb.) et l’épinette noire (Picea mariana (Mill.)) quant à eux possèdent des cônes sérotineux et semi-sérotineux, respectivement, dont l’ouverture et la libération des semences sont favorisées par l’exposition à la chaleur (Deslauriers et al., 1996). Ainsi, ces trois essences ont une plus grande capacité de recolonisation et initient rapidement une nouvelle succession végétale après le passage du feu.
Le bois mort : un élément clé de la diversité biologique
À l’échelle du paysage, les feux de forêt constituent une importante source de bois mort ou moribond en forêt boréale (Nappi et al., 2004; Kennedy et Fontaine, 2009). La quantité, la qualité et la diversité du bois mort sont des éléments clés pour le maintien d’une grande diversité d’organismes saproxyliques (Saint-Germain et al., 2004b; Drapeau et al., 2010; Nappi et al., 2010). Par définition, les organismes saproxyliques nécessitent, pendant au moins une partie de leur cycle vital, du bois mort ou moribond, ou des champignons du bois, ou encore la présence d’autres organismes saproxyliques (Speight, 1989). Les chicots sur pied, les débris ligneux au sol, les souches, les branches et les racines grossières représentent divers types de bois mort ou moribond retrouvés à la suite d’un feu (Harmon et
al., 1986). Ceux-ci peuvent avoir subi diverses intensités de brûlage, ce qui résulte en une
sévérité du feu variable créant, à l’échelle du paysage, une distribution et une variabilité complexe de la ressource bois mort. Selon la composition forestière initiale, un feu de grande superficie laisse des peuplements brûlés et non-brûlés de composition d’essences différentes et de structures d’âges variés, ce qui accroît l’hétérogénéité de la distribution de cette ressource (Nappi et al., 2011). De plus, au fil du temps après un feu, les chicots se cassent et tombent pour devenir des débris ligneux au sol (Ausmus, 1977; Swift, 1977a-b; Harmon et al., 1986). La densité du bois diminuera graduellement durant tout le processus de décomposition alors que le contenu en eau diminuera pendant le stade de chicot et augmentera par la suite, lorsque les chicots tomberont au sol et deviendront des débris ligneux (Paletto et Tosi, 2010). Par conséquent, à la suite d’un feu, le bois mort procure une différenciation temporelle de niches écologiques (Simandl, 1993) caractérisées par différentes qualités nutritives (Tinker et Knight, 2000).
Cette diversité spatio-temporelle du bois mort, ainsi que les conditions spécifiques observées à la suite d’un feu (augmentation de la température, diminution de la compétition inter-spécifique, une couche organique amincie et un sol minéral parfois exposé (Wikars, 1992; Nappi et al., 2004)) procurent une variété de conditions écologiques intéressantes pour plusieurs communautés végétales et animales (Butts et McComb, 2000; Nappi et al., 2003, 2004; Similä et al., 2003), particulièrement pour les insectes (Siitonen, 2001). Au fur et à mesure que le temps passe après le passage du feu, les communautés se modifient de manière relativement synchrone avec les changements des attributs de l’habitat (Nappi et
al., 2011). Ainsi, l’hétérogénéité spatio-temporelle des peuplements brûlés est primordiale
pour le maintien de la diversité et les successions naturelles qui y sont associées.
Importance des feux pour les coléoptères saproxyliques
La particularité des feux de forêt, comparativement aux autres perturbations naturelles, est leur capacité à générer instantanément une grande quantité de bois mort sur de grandes superficies (Tinker et Knight, 2000). Cette abondance soudaine d’arbres tués par le feu constitue des habitats de qualité pour plusieurs espèces d’insectes, notamment les coléoptères saproxyliques (Wikars, 1992; Saint-Germain et al., 2004c). Plusieurs familles de coléoptères utilisent le bois récemment brûlé pour compléter leur cycle vital et accroître leur population, ce qui permet à plusieurs espèces de persister dans le paysage (Jonsell et
al., 1998). En raison de la grande quantité de bois mort retrouvé dans un brûlis, plusieurs
espèces d’insectes seraient fortement associées aux brûlis (Saint-Germain et al., 2004c; Boucher et al., 2012). Certaines auraient même développé des adaptations permettant de détecter des composés volatiles émanant de la fumée ou les ondes infrarouges émises par la chaleur afin d’atteindre les brûlis plus facilement (Evans, 1966; Evans et Kuster, 1980; Schütz et al., 1999). Des espèces pyrophiles auraient donc évolué dans le contexte des feux de forêt et en seraient dépendantes (Nappi et al., 2004).
4
rapidement les brûlis afin de s’y diriger. Parfois, certaines espèces sont retrouvées dans les brûlis avant même que le feu ne soit éteint (Evans, 1966). C’est d’ailleurs le cas du Buprestidae Melanophila acuminata DeGeer, lequel détecte les ondes infrarouges ce qui lui permettrait de faire partie de la phase initiale de colonisation, en arrivant très tôt et en pondant ses œufs à la base des conifères alors que le peuplement brûle toujours (Evans, 1966). Le bois récemment brûlé procure des sites de pontes privilégiés permettant le développement d’espèces xylophages et sous-corticales puisque la valeur nutritive du cambium est alors peu affectée (Saint-Germain et al., 2004c; Boulanger et Sirois, 2007). De plus, la prolifération de champignons, majoritairement de type ascomycete, sont une source de nourriture de prédilection pour plusieurs espèces mycophages, dont la famille des Lathridiidae (Muona et Rutanen, 1994; Boulanger et Sirois, 2007). À noter que la composition forestière avant feu (essences, diamètre, hauteur, densité du peuplement, quantité de débris ligneux au sol, etc.) et la sévérité du feu s’avèrent être d’importants facteurs qui diversifient spatialement les assemblages d’espèces de la phase initiale (Hanks, 1999; Nappi et al., 2010; Boulanger et al., 2011).
Au fil du temps après un feu, d’autres phases de colonisation par les coléoptères saproxyliques se succéderont suivant les changements graduels des attributs de l’habitat brûlé (Boulanger et Sirois, 2007; Nappi et al., 2010). Les chutes de chicots au sol, jumelées à l’augmentation de l’humidité dans les débris ligneux nouvellement générés, entraîneront des changements graduels dans les assemblages d’espèces de coléoptères saproxyliques (Boulanger et Sirois, 2007; Nappi et al., 2010). Des communautés spécifiques seront également attirées par des mycéliums et des carpophores qui se développeront sur le bois alors que l’habitat sous-cortical disparaîtra progressivement, dû à la perte de l’écorce (Kaila
et al., 1997; Rukke, 2002; Jonsell et Weslien, 2003). Ainsi, des coléoptères saprophages et
mycophages spécifiques succéderont à la phase initiale de colonisation au fur et à mesure que le bois brûlé se décomposera et que ses propriétés initiales se modifieront (Boulanger et Sirois, 2007). De plus, certains coléoptères, se nourrissant des racines d’arbres de plantes ou de graminées ou directement des jeunes plants, seront présents lors de la régénération de la végétation (Muona et Rutanen, 1994).
Problématique
L’exploitation de la matière ligneuse en forêt boréale génère environ 60 % de l’activité économique de l’industrie forestière du Canada (Burton et al., 2003). Le Québec est un acteur de taille puisque 20 % des forêts canadiennes s’y retrouvent et 70 % de celles-ci sont productives commercialement (MRNF, 2010). Ainsi, les feux de forêt peuvent engendrer des pertes économiques importantes en termes de matières ligneuses si le bois brûlé n’est pas récupéré. Conséquemment, certains gouvernements provinciaux du Canada, notamment celui du Québec, favorisent, dans leurs politiques sur les forêts, la récupération du bois brûlé par l’entremise de plans spéciaux d’aménagement. Au Québec, les volumes de bois récolté dans les brûlis ont augmenté depuis les années 90 (Purdon et al., 2002; Saint-Germain et Greene, 2009), et les récentes diminutions de la possibilité forestière, annoncées en 2004 (Coulombe et al., 2004), ont probablement contribué à cette augmentation. À titre d’exemple, en 2005, environ 20 % du volume total de bois récolté dans les forêts publiques du Québec était issu des brûlis, soit près de 6.2 millions de mètres cubes (m³) (Parent, 2008; MRNF, 2012a). Selon la loi québécoise, les plans spéciaux peuvent déroger des normes d’interventions émises par le gouvernement et régissant la récolte des forêts vertes ou perturbées. À titre d’exemple, jusqu’à tout récemment, la récolte des bois brûlés et non-brûlés à l’intérieur d’un brûlis se faisait par coupes avec protection de la régénération et des sols (CPRS), récoltant toutes les tiges marchandes (DHP ≥ 9.1 cm) accessibles (Purdon et
al., 2002; Nappi et al., 2004). Cette intensification du double régime de perturbation soit
l’interaction du feu et de la coupe de récupération, s’avère de plus en plus inquiétante en termes de conservation (Lindenmayer et al., 2008; Boucher, 2011) et pourrait avoir des conséquences à grande échelle dont le dépassement de l’intervalle de variabilité naturelle (Bouchard et Munson, 2009). D’ailleurs, il a été démontré que la perte de certains attributs des forêts brûlées, causés par la récupération, avait des impacts négatifs sur la faune et la flore (Nappi et al., 2004), notamment pour les successions écologiques naturelles (Lindenmayer et Ough, 2006). De surcroît, la récupération après feu pourrait même excéder
6
intensif (Siitonen, 2001) et la suppression soutenue des feux de forêt (Wikars, 1992), a eu pour conséquence de rendre les coléoptères saproxyliques parmi les organismes les plus à risque d’extinction en Fennoscandie (Hyvärinen et al., 2006).
Impacts des coupes de récupération sur la faune et la flore
Le prélèvement des chicots et des arbres mourants à l’intérieur d’un brûlis diminue grandement l’abondance des insectes saproxyliques au stade larvaire, ce qui a des impacts importants sur le nombre de proies disponibles pour certains oiseaux insectivores (Morissette et al., 2002; Purdon et al., 2002). Ces impacts sont d’autant plus importants puisqu’ils surviennent dans les premières années après feu, là où l’abondance des insectes saproxyliques est la plus élevée (Boulanger et Sirois, 2007). De plus, une grande partie des sites de nidification, des gîtes, des lieux de reproduction et de chasse (ex. perchoir) pour les oiseaux et les mammifères sont éliminés (Nappi et al., 2011). La soustraction de ces tiges a également des impacts sur le potentiel de régénération des peuplements récupérés, puisque les réserves de graines semencières (sources in situ) sont extraites du territoire (Greene et Johnson, 2000; Gauthier et al., 2008). Cela est davantage problématique pour l’épinette noire dont les graines sont libérées plus tardivement comparativement au pin gris (Greene et Johnson, 1999). Cependant, même si les semences du pin gris sont libérées dans les premiers mois après le passage du feu, celles-ci ou les semis peuvent être endommagés par le passage successif de la machinerie ou encore, peuvent être défavorisés par un assèchement plus rapide des sols et une altération des lits de germination (Purdon et al., 2002; Nappi et al., 2011). La récolte des îlots non brûlés peut également avoir des conséquences négatives pour les essences moins adaptées aux conditions des brûlis (ex. le mélèze laricin (Larix laricina (Du Roy)), le sapin baumier (Abies balsamea (L.)) et l’épinette blanche (Picea glauca (Moench))) lesquelles nécessitent la présence de semenciers pour se régénérer (Galipeau et al., 1997; Greene and Johnson, 2000). Ces îlots servent également de refuges et sont donc importants pour les espèces animales moins adaptées aux nouvelles conditions du brûlis (Greene et Johnson, 2000).
La récolte du bois dans un brûlis réduit la quantité et la qualité du bois mort au sol à moyen terme puisque les chicots qui devraient tomber au sol dans les années suivant la
perturbation sont retirés peu de temps après le feu. Cela entraîne des conséquences irréversibles pour les communautés associées à cet habitat et ce, à long terme (Boulanger et Sirois, 2007; Nappi et al., 2011). La succession naturelle des organismes impliqués dans le recyclage des éléments nutritifs est donc rompue en partie, ce qui pourrait entraîner des répercussions sur le renouvellement de l’écosystème (Speight, 1989; Cobb et al., 2010). En effet, il a été démontré que les larves d’insectes xylophages jouent un rôle important dans le recyclage des nutriments du sol engendrant des contrecoups positifs sur la croissance des plantes colonisatrices des milieux brûlés (Cobb et al., 2010).
Développement durable et aménagement écosystémique
Depuis le début des années 90, on considère davantage le concept de conservation de la diversité biologique en tant que critère important dans l’atteinte des objectifs d’aménagement durable des forêts (CCMF, 1995, 1997; CSNF, 1998; CCMF, 2003; CSNF, 2003). C’est lors de la Conférence des Nations Unies sur l'environnement et le développement tenue à Rio de Janeiro en 1992, connue sous le nom de « Sommet de la Terre », que l’on a reconnu l’importance de la gestion durable des forêts, et duquel a découlé l’adoption de plusieurs principes d’aménagement durable (CCMF 2003). Cette « Déclaration de principe sur les forêts » a imposé des changements dans nos pratiques sylvicoles dans le but de bénéficier d’une économie soutenue à long terme tout en assurant la protection de l’environnement et le maintien des fonctions des écosystèmes. Depuis le début des années 2000, le concept d’aménagement forestier écosystémique suscite un grand intérêt au sein de la communauté scientifique de même qu’auprès des gestionnaires forestiers (Grenon et al., 2010). En adhérant à ce concept, l’aménagement forestier doit refléter l’hétérogénéité engendrée par les perturbations naturelles à l’échelle du peuplement ainsi qu’à l’échelle du paysage. Ce concept vise la protection, la conservation et la mise en valeur des ressources, trois composantes qui sont responsables du virage dans la gestion des ressources naturelles. Cette nouvelle approche vise à assurer la pérennité des ressources
8
terme, le maintien des multiples fonctions de l’écosystème et, par conséquent, de conserver les bénéfices sociaux et économiques que l’on en retire » (Gauthier et al., 2008).
Lors des dernières années, quelques suggestions ont été faites afin que le Ministère des Ressources Naturelles et de la Faune (MRNF) établisse des lignes directrices lors de la confection des plans spéciaux d’aménagement. Ces suggestions avaient pour but d’assurer le maintien de la biodiversité et des processus naturels associés aux brûlis tout en favorisant une rentabilité économique durable des activités de récoltes après feu (Nappi et al., 2011). Ce n’est qu’en 2010, à la suite d’un projet pilote mené dans un brûlis de l’île René-Levasseur, au Québec, que les premiers plans à caractère écosystémique ont été mis en application au Québec. Les plus récentes suggestions présentées pour la province de Québec sont parues dans le document de Nappi et al. (2011) intitulé « La récolte dans les forêts brûlées : Enjeux et orientations pour un aménagement écosystémique ». Les grandes lignes de ces orientations sont le maintien des peuplements brûlés sur une surface de l’ordre de 30 % des superficies brûlées à l’échelle d’une unité d’aménagement et de 15 % à l’échelle d’un brûlis dans le but de préserver la variabilité naturelle de la biodiversité et des processus écologiques associés à cette perturbation naturelle. La superficie de forêt brûlée résiduelle, faisant partie du 30 % à conserver, devra être réévaluée à tous les cinq ans afin d’assurer une démarche d’aménagement adaptative intégrant les nouvelles connaissances sur les effets du feu et des coupes de récupération.
Contexte de l’étude
Afin d’évaluer les effets de la récupération des brûlis sur l’intégrité du milieu et sur les successions naturelles après feu, nous suggérons d’utiliser les communautés d’arthropodes et, plus précisément, les insectes saproxyliques comme indicateurs. Les arthropodes sont une composante majeure des écosystèmes et jouent un rôle capital dans leur fonctionnement (Kim, 1993). Bien que les insectes représentent plus de 80 % du règne animal, ils forment toutefois le groupe le moins étudié sur la planète (Samways, 1993). Toutefois, les coléoptères constituent l’ordre d’insectes le mieux connu et le plus diversifié, tant au plan écologique que taxinomique. Ils sont donc plus faciles et moins coûteux à échantillonner et constituent un groupe indicateur à fort potentiel pour évaluer l’impact des
stress anthropiques sur le milieu (Kim, 1993). La grande quantité de bois mort contenue dans les brûlis fait en sorte que les coléoptères saproxyliques sont les insectes les plus abondants et diversifiés qui colonisent ce type d’habitat (Wikars, 2002; Saint-Germain et
al., 2004a; Boulanger et Sirois, 2007; Boulanger et al., 2010). Dans le cadre de cette étude,
c’est donc sur ce groupe d’organismes que nous avons choisi de travailler.
Plus précisément, nous étudions les successions naturelles de huit familles de coléoptères saproxyliques (Buprestidae, Cerambycidae, Cleridae, Corylophidae, Curculionidae, Elateridae, Lathridiidae et Salpingidae) pour ensuite décrire les effets des coupes de récupération sur ces successions dans les brûlis d’épinettes noires de la forêt boréale du Québec. Ces huit familles ont été sélectionnées sur la base de leur forte association avec les peuplements brûlés (Saint-Germain et al., 2004c; Boulanger et Sirois, 2007; Boucher et al., 2012). Non seulement ces huit familles renferment des espèces qui sont presqu’exclusivement trouvées dans les brûlis, mais elles s’y retrouvent en grande abondance comparativement à d’autres types d’habitats contenant du bois mort (Boucher et
al., 2012). Les coupes de récupération pourraient donc avoir des effets négatifs à long
terme sur le maintien de ces espèces dans le paysage. De plus, en termes de rôles écologiques, ces huit familles ont des fonctions écologiques diversifiées (Grove, 2002; Saint-Germain et al., 2004c; Boulanger et Sirois, 2007; Boucher et al., 2012). En effet, les larves de Buprestidae et de Cerambycidae sont xylophages et se développent directement dans le phloème ou dans le xylème du bois récemment mort ou moribond (Arnett Jr. et al., 2002), alors que les Scolytinae (Curculionidae) sont sous-corticaux et se développent en se nourrissant sous l’écorce (Bright Jr., 1976). Les autres espèces de la famille des Curculionidae sont plutôt polyphages et leurs larves se nourrissent principalement de racines ou de pousses des jeunes plants (Arnett Jr. et al., 2002). Les Cleridae et les Salpingidae sont des prédateurs d’espèces saproxyliques (Muona et Rutanen, 1994; Arnett Jr. et al., 2002), alors que les Corylophidae et les Lathridiidae sont des mycophages saproxyliques (Arnett Jr. et al., 2002). Certaines espèces d’Elateridae seraient reconnues
10
Plusieurs espèces des huit familles sélectionnées sont aussi connues pour être associées avec les brûlis récents (0 à 3 ans après feu) de la zone circumpolaire (Alaska, Canada, Fennoscandie, Suisse et Russie) (Wikars, 1992; Muona et Rutanen, 1994; Wikars, 1994, 1997a; Siitonen, 2001; Saint-Germain et al., 2004c; Boulanger et Sirois, 2007; Moretti et
al., 2010; Boucher, 2011). Cependant, peu d’études ont évalué les successions de ces
coléoptères à moyen terme (3 à 15 ans après feu) et aucune, à notre connaissance, n’a étudié les impacts des coupes de récupération sur ces successions. Boulanger et Sirois (2007) ont déjà étudié les assemblages d’arthropodes saproxyliques d’une chronoséquence d’une durée de 29 ans après feu dans les peuplements d’épinettes noires se situant dans la zone non-exploitée du nord du Québec. Leurs résultats ont démontré deux phases de colonisation par les arthropodes saproxyliques. En effet, ils indiquent la présence d’une première phase débutant tôt après feu, surtout représentée par des espèces xylophages, sous-corticales et mycophages. La deuxième phase surviendrait environ dix ans après feu, lorsque les chicots tombent au sol générant de nouveaux débris ligneux, entraînant ainsi l’arrivée de nouvelles espèces associées à ce type de bois mort, tels des saprophages et certains prédateurs. Notre étude utilise une chronoséquence plus fine que celle de Boulanger et Sirois (2007), avec six classes d’âges le long d’une chronoséquence de 15 ans après feu.
En outre, ce qui rend notre étude particulièrement unique est le fait d’avoir choisi de travailler au niveau des souches d’épinettes noires dans les brûlis se situant dans la zone exploitée de la forêt boréale du Québec. Dans cette zone, se situant sous le 52ième parallèle, les arbres sont plus gros par rapport à la forêt non-commerciale du nord du Québec. Quant aux souches, elles constituent un micro-habitat ayant des propriétés (température et humidité) différentes et plus stables que celles de la partie plus aérienne des chicots, soit le tronc (Abrahamsson et Lindbladh, 2006). La plus grande stabilité temporelle des souches en tant qu’habitat, comparativement aux chicots, vient certainement du fait que les chicots finiront par tomber au sol pour devenir des débris ligneux, alors que les souches resteront généralement en place, sauf s’il y a un déracinement par chablis. Au Québec, très peu d’études se sont penchées sur la valeur écologique des souches en tant que micro-habitat potentiel pour les coléoptères saproxyliques, même après coupe en forêt verte. Dans cette étude, nous évaluons le taux d’activité des coléoptères saproxyliques au niveau des souches
à l’aide d’un échantillonnage fait avec des pièges à impacts troncaux. Ce type de piège est reconnu pour être efficace dans la capture des coléoptères saproxyliques susceptibles d’utiliser le substrat sur lequel le piège est installé pour se reproduire et compléter leur cycle vital (Kaila, 1993).
Un premier volet de l’étude vise à décrire les successions naturelles après feu pour les coléoptères saproxyliques. Plus spécifiquement, nous avons d’abord comme objectifs 1) de vérifier si les souches constituent un micro-habitat plus stable que les chicots ou les débris ligneux au sol 2) de décrire la succession post-feu des coléoptères saproxyliques au niveau des souches et le long d’une chronoséquence de 15 ans (abondance, richesse en espèces, assemblages d’espèces) et 3) de déterminer combien de phases distinctes de colonisations sont détectables le long de cette chronoséquence. Ensuite, un deuxième volet vise à déterminer les impacts que peut avoir la récupération du bois brûlé sur celles-ci et à évaluer la valeur des souches résiduelles en tant que mesure de mitigation des effets de cette pratique d’aménagement. Ainsi, les objectifs en lien avec ce volet sont : 1) de déterminer si les souches résiduelles à la coupe de récupération peuvent maintenir les communautés de coléoptères saproxyliques associées aux brûlis; 2) d’explorer les effets de la récupération après feu sur la dynamique temporelle de ces communautés et 3) de déterminer si il y a des espèces qui sont associées avec des peuplements non-récupérés exclusivement, pour plusieurs années consécutives. Il est important pour nous d’identifier de telles espèces puisqu’elles sont probablement celles dont les populations sont les plus susceptibles d’être affectées négativement par les coupes de récupération.
Chapitre 1
Saproxylic beetle succession along a 15 years postfire
chronosequence in the commercial boreal forest
Olivier Jeffrey1, Christian Hébert2, Jacques Ibarzabal3, Richard Berthiaume1 and Éric Bauce1
1 Université Laval, Faculté de foresterie, de géographie et de géomatique, Pavillon Abitibi-Price, Québec, Québec, G1K 7P4, Canada
2 Natural Resources Canada, Canadian Forest Service, Laurentian Forestry Centre, 1055 du P.E.P.S., P.O. Box 10380, Stn. Sainte-Foy, Québec, Québec, G1V 4C7, Canada
3 Université du Québec à Chicoutimi, 555 boulevard de l’Université, Chicoutimi, Québec, G7H 2B1, Canada
14
Résumé
Ce chapitre vise 1) à vérifier si les souches représentent un micro-habitat plus stable que les chicots et/ou les débris ligneux au sol, 2) à décrire la succession après feu des coléoptères saproxyliques au niveau des souches et 3) à déterminer combien de phases distinctes de colonisation par ces coléoptères peuvent être détectées le long d’une chronoséquence de 15 ans après le passage du feu. Les coléoptères ont été inventoriés durant l’été 2010 dans des brûlis de 1995, 2003, 2005, 2007, 2009 et 2010. Un peu plus de 5 500 coléoptères répartis dans les 8 familles étudiées ont été capturés. Les résultats ont révélé une abondance et une richesse en espèces plus élevées lors des trois premières années après feu. De plus, quatre phases de colonisation par les coléoptères saproxyliques ont été détectées durant les cinq premières années après feu. La dynamique temporelle du bois mort semble influencer les assemblages d’espèces pendant ces cinq premières années.
Mots-clés : Biodiversité, Succession, Coléoptère saproxylique, Feu de forêt, Souche, Bois mort, Piège à impact troncaux
Abstract
This chapter aims 1) to verify if stumps represent a more stable habitat than either snags or logs, 2) to describe postfire succession of saproxylic beetles at the stump level and 3) to determine how many distinct succession phases we may detect along a 15 postfire years chronosequence. Beetles were sampled during summer 2010 from burns of 1995, 2003, 2005, 2007, 2009 and 2010. Slightly more than 5 500 beetles among the height studied families were captured. Results revealed higher abundance and species richness during the three first postfire years. In addition, four saproxylic beetles colonization phases were detected during the five first postfire years. Temporal dynamics of deadwood seems to influence species assemblages during these five postfire years.
Keywords: Biodiversity; Succession; Saproxylic Beetles: Wildfire; Stump; Deadwood; Trunk widow trap
16
1 Introduction
Wildfires constitute one of the most important natural disturbance in boreal forest (Bergeron et al., 2001; Gauthier et al., 2008). Several studies have highlighted the importance of wildfire on forest dynamics and ecosystem’s successions (Bergeron et al., 2001; Pausas and Keeley, 2009; Drapeau et al., 2010; Nappi et al., 2011). Indeed, several plant species have the ability to germinate quickly and grow rapidly after fire, thus initiating new successions (Pausas and Keeley, 2009). These plants have evolved in a context of wildfire and are recognized as fire-adapted species (Pausas and Keeley, 2009). Therefore, fire influences stand structure and vegetation composition and thus generates new ecological conditions for a large diversity of organisms (Bergeron et al., 2002).
Forest wildfire also constitutes an important source of dead wood in boreal forest (Tinker and Knight, 2000; Siitonen, 2001; Nappi et al., 2004; Kennedy and Fontaine, 2009). Compared with other types of disturbances like windthrows, insect outbreaks and harvesting, wildfires generates large amounts of recent dead wood all at once and over large areas (Tinker and Knight, 2000). The amount, quality and diversity of dead wood is a key component at the ecosystem level for maintaining a large diversity of saproxylic species (Bader et al., 1995; Christensen and Emborg, 1996; Siitonen, 2001; Humphrey et
al., 2004), those that depend on deadwood (Speight, 1989). Several saproxylic insects are
known to take advantage of the sudden abundance of newly-killed trees by fire (Saint-Germain et al., 2004c; Boucher et al., 2012) and some have developed adaptations to detect heat or smoke emitted by wildfires (Evans, 1966; Wikars, 1994; Schütz et al., 1999). As time elapses after fire, snags fall to the ground (Ausmus, 1977; Swift, 1977b; Swift, 1977a; Harmon et al., 1986). Indeed, while wood density decreases progressively from the first to the last decay stage, water content decreases during the snag stage (first decay stages) but increases afterwards when snags fall to the ground and become logs (Paletto and Tosi, 2010). Thereby, dead wood provides a temporal differentiation of ecological niches (Simandl, 1993) characterized by varying food quality (Tinker and Knight, 2000). This spatio-temporal variability in dead wood benefit to numerous organisms (Butts and McComb, 2000; Nappi et al., 2003; Similä et al., 2003; Nappi et al., 2004), specially
saproxylic insects (Siitonen, 2001). Therefore, wildfire also provides conditions to rapidly set up new saproxylic insect successions.
Most studies addressing postfire stand colonization by saproxylic insects in North America have focused on communities shortly after fire (Saint-Germain et al., 2004b-c; Boulanger et
al., 2011; Azeria et al., 2011, 2012) and particularly on xylophagous species responsible for
lumber degradation (Cerezke, 1977; Saint-Germain et al., 2004a; Saint-Germain et al., 2007). The only study looking at mid-term successions was carried out in black spruce (Picea mariana (Mill.)) forests of Northern Quebec (Boulanger and Sirois 2007). The authors recognized two phases in the successional pattern of saproxylic arthropods along a 29 years chronosequence after fire. The initial colonization begins during the year of the fire while the second phase occurs only when snags fall to the ground, usually after a decade (Boulanger and Sirois, 2007). The authors indicated that this succession pattern was rather slow compared with the one described by Esseen et al. (1992) in Scandinavian old-growth boreal forests. This could be related to the cold climate, which was typical of the lower subarctic region, the decomposition rates of postfire snags being exceptionally low in this region (Boulanger and Sirois, 2006). Moreover, postfire beetle communities of the Boulanger and Sirois (2006) study were poorer than in southern boreal forest where species richness was at least twice higher (Saint-Germain et al., 2004a-b).
In order to provide knowledge for improving management of postfire boreal forest of commercial size, we studied succession of eight beetle families (Buprestidae, Cerambycidae, Cleridae, Corylophidae, Curculionidae, Elateridae, Lathridiidae and Salpingidae) in 10 burns along a 15 years chronosequence. These beetle families contained saproxylic species (Grove, 2002; Saint-Germain et al., 2004c; Boucher et al., 2012) which are closely associated with recently burned black spruce forests (Boucher et al., 2012). We selected those families because they initiate successions and should be the most vulnerable to increasing postfire salvage logging activities (Boucher et al., 2012). Moreover, we sampled beetles using trunk window traps placed at the stump level where insects may still
18
temperature and water content (Abrahamsson and Lindbladh, 2006)). Our objectives were 1) to verify if stumps represent a more stable habitat than either snags or logs, 2) to describe postfire succession of saproxylic beetles at stump height, along a 15 years postfire chronosequence in the commercial boreal forest and 3) to determine how many distinct succession phases we may detect along the chronosequence.
2 Methods
2.1 Study area
The study area covered 80 000 km2 and belong to two bioclimatic subdomains of North-Western Quebec, Canada: the western spruce-moss and the northern balsam fir white birch subdomains (from 48°49’ to 50°43’ N and from 70°10’ to 75°51’W). The climate was characterized by an average annual air temperature varying between 0 and -2.5°C and annual precipitations ranging from 800 to 1 000 mm (Wilson, 1971; Grondin, 1996). This continental climate was characterized by fewer precipitations than in eastern Quebec and thus provided a shorter fire cycle ranging between 90 and 190 years (MRN, 2000; Boucher
et al., 2003). Black spruce stands dominated the landscape and jack pine (Pinus banksiana
Lamb.), balsam fir (Abies balsamea (L.) Mill.), trembling aspen (Populus tremuloides Michx.), paper birch (Betula papyrifera Marsch.) and tamarack (Larix laricina (Du Roi) K. Koch) were observed as companion species.
2.2 Stand description
We selected twenty-four black spruce stands among ten burns corresponding to 6 different years along a chronosequence that covered 15 years after wildfire: one burn occurred in 2010, three in 2009, two in 2007, one in 2005, one in 2003 and two in 1995 (Figure 1). Four replicate stands were established in each of the six years after burn. As the number of burns available for each category (years after burn) varied along the chronosequence, the number of replicate stands in each burn also varied, from one (2009 and 1995 burns) to four (2003, 2005 and 2010 burns). This was mainly due to the poor accessibility and availability of the burns. Selected stands varied between 60 and 100 years old and burned at moderate or high severity (i.e., all trees were dead at time of site selection). All wildfires occurred in
the late-spring/early-summer of the coinciding year. We loaded ecoforest and burn severity maps, provided by the Ministère des ressources naturelles (MRN), in ArcMap 9.2 (ESRI, 2009) to facilitate stand selection. Each replicate stand was distanced by at least 1.5 km to ensure data independence.
Stand attributes were described within a 400 m² circular plot. Tree species and diameter at stump height (DSH, i.e. 15 cm above root or ground level (MRNF, 2005)) were recorded for every snag > 9 cm diameter at breast height (DBH). The percentage of bark, for every 5 %, covering trunks of snags was also estimated. Tree species and DBH were recorded for every dead and live sapling (> 1.30 m height and ≤ 9 cm DBH) within a circular 40 m² plot centered on the 400 m² plot. Four 11.28 m transects were drawn from the plot center toward each cardinal points to estimate the volume (m³/ha) of down dead wood (DDW). Each DDW larger than 5 cm intercepted across the transects was identified when possible and its diameter was measured perpendicularly to the log at the intersection point (Warren and Olsen, 1964). The DDW volume was estimated according to the method of Van Wagner (1982). The decay stage of each snag, stump, sapling or DDW was determined on the basis of the Hunter (1990) classification which recognizes seven decay stages for snags and five for DDW. The Hunter (1990) classification relies largely on the presence of residual branches or twigs (non applicable for stumps), residual bark and dead wood texture. Thus, stump decay stages were determined with the DDW classification, using the residual bark coverage and wood texture as criteria. A correlation matrix between deadwood attributes was produced to identify collinearity problems (r > 0.7). As adjacent decay classes of deadwood were highly correlated, we combined them into three categories: young, medium and old dead wood. For snags, Hunter (1990) decay classes were combined as follow: young = class 3, medium = classes 4 and 5, and old = classes 6 and 7 (note that the old category refer to broken snags). For stumps and DDW, decay classes were combined for: young = classes 1 and 2, medium = class 3 and old = classes 4 and 5.
20
were also compared with 5-cm thick disks collected on three different DDW. Disks were weighted (wet weight) and then oven dried at 65°C until weight stabilized which corresponded to the dry weight (requires a minimum of 36 hours). Water content was expressed as a percentage of wet weight and was calculated with the following formula (Akbulut and Linit, 1999):
2.3 Beetle sampling
Three trunk-window traps (TWT), known for their efficiency to sample saproxylic beetles (Kaila, 1993; Boulanger and Sirois, 2007), were installed at the stump height (window just above the highest root) on three different snags of each stand. All traps were installed between May 20th and 30th of 2010 and were in operation until August 26th of 2010. Traps were distanced by a minimum of five meters and disposed in order to form an equilateral triangle. These TWT consisted of a 15 × 40 cm Plexiglas® panel installed vertically and perpendicularly to the stump in order to intercept beetles. A 15 cm diameter funnel was placed below the panel to lead beetles in a 500 ml collecting vial filled with 225 ml of a 40% ethanol and 5% household vinegar solution in order to kill and preserve insects. Samples were collected bi-weekly (six collections) and taken back to the Laurentian Forestry Centre (LFC, Quebec, Canada) where they were kept at 4 °C until sorting and identification.
As suggested by Boucher et al. (2012), we focused on beetles of eight beetle families closely associated with recently burned forests. Almost all beetles of these height families were identified at the species level and vouchers have been conserved in the Forest Insect Ecology and Diversity (EcoDIF) laboratory of LFC.
2.4 Statistical analysis
All beetle species identified were retained for analysis.
100 . ) ( . ) ( . . x weight wet g weight dry g weight wet content Water
2.4.1 Habitat attributes along the chronosequence
One way ANOVAs were used to compare the basal area of black spruce snags, stumps and dead saplings, the basal area of living saplings of black spruce and jack pine, the volume of black spruce DDW (overall and per decay categories) and the percentage of bark recovering trunks of snags between years along the postfire chronosequence. Also, in order to verify if stumps represent a more stable habitat than either snags or logs, we compared the water content of the each type of deadwood along the chronosequence. We used one-way nested ANOVAs in which the estimates from the three disks were nested in each replicate stand. When ANOVA was significant (P < 0.05), we used the least significant difference (LSD) for comparing means between treatments. Then, we used one-way nested ANOVAs with disk samples being nested within each deadwood type in each replicate plot, for comparing water content between the three types of deadwood for each postfire year separately. The nested samples was justified by the fact that we had three disk samples for each type of deadwood in each of four replicate stands representing specific number of years after fire. Two one-way ANOVAs were chosen in order to answer our specific objectives (water content variation for each deadwood type along the chronosequence and difference between each deadwood types for each postfire year). We considered the F value of the test of hypotheses using type III mean of square for site × treatment as an error term to calculate the F value. The least significant difference (LSD) at P = 0.05 was used to compare means of each significant ANOVAs. Data were transformed (log x+1) to satisfy the normality and homogeneity of variance assumptions of ANOVA except for water content data that already met ANOVA assumptions. ANOVAs were performed using the GLM procedure of the Statistical Analysis System (SAS) v.9.2 (SAS Institute Inc., 2000-2004).
2.4.2 Saproxylic beetle abundance and species richness along the chronosequence
22
ANOVA. ANOVAs were performed using the GLM procedure of the Statistical Analysis System (SAS) v.9.2 (SAS Institute Inc., 2000-2004).
2.4.3 Beetle assemblages along the chronosequence
To assess the effects of time since wildfire on beetle assemblages, we performed Permutational Multivariate Analysis of Variance (PERMANOVA (Anderson, 2001)) using distance matrices produced with the Bray-Curtis dissimilarity as default with the adonis procedure in the vegan package (Oksanen, 2011) of R (R-Development-Team, 2009). The adonis procedure (type III ADONIS) accounted for all habitat attributes and examined how these affected beetle assemblages between postfire years along the chronosequence. A significant P-value in PERMANOVA may indicate that differences were observed in beetle assemblages between postfire years and/or in the within-postfire years dispersion, or both (Oksanen, 2011). Habitat attributes data were normalized by column maximum and a Hellinger transformation was applied on beetle species (Legendre and Gallagher, 2001). This procedure reduces the influence of both rare and abundant species on the overall assemblage pattern. The significance of differences in beetle assemblages along the chronosequence was tested by permutations (n = 999). Differences between each combination of postfire years were tested using pairwise PERMANOVA comparisons. Permutation analysis of homogeneity of multivariate group dispersions (PERMDISP;(Anderson, 2006)) was also used to determine if beetle assemblages differed only by their within-treatment dispersion calculated from the average distance of stands to their group centroid on the basis of principal coordinate axes. For this analysis, we used the betadisper procedure of the vegan package (Oksanen, 2011) in R (R-Development-Team, 2009) for this analysis.
2.4.4 Association between saproxylic beetles and habitat attributes along the chronosequence
Multivariate analyses were used to assess which habitat attributes were linked with variation in species assemblage along the chronosequence. A canonical redundancy analysis (RDA) was conducted on Hellinger-transformed data using the RDA procedure of the vegan package (Oksanen et al., 2009) in R (R-Development-Team, 2009). According to
(Legendre and Gallagher, 2001), Hellinger-transformation reduces the weight of rare species which are recorded sporadically in some sites but not in others even if they might be present. Habitat attributes used in RDA were the mean basal area of young, medium and old snags and the mean volume of young, medium and old DDW. Centroids were used to position the geometrical center of stands of each postfire year.
To identify species positively associated with a specific postfire year along the chronosequence or with a combination of postfire years, we have used the point-biserial group-equalized phi coefficient (Pearson correlation), as described by De Cáceres and Legendre (2009). We applied the MULTIPATT procedure in the Indicspecies package of R (De Cáceres, 2010). This analysis calculates correlation coefficients which take into account absences outside the target groups (in our case, a postfire year or group of postfire years) as well as presences in stands of that group, thus increasing the power of the associations. Therefore, the analysis is more context dependent than indicator indices such as the IndVal index (Dufre ne and Legendre, 1997) for the determination of species-habitat associations (De Cáceres and Legendre, 2009). We performed this analysis with all species identified.
3 Results
3.1 Overview
Among the eight studied families, 5 510 beetles belonging to 72 species were caught and identified. Captures in postfire years 1 and 2 accounted for 79 % of captures with 3 090 beetles caught during the year of the fire (year 0) and 1 246 for postfire year 1. Only 1 173 (21 %) beetles were sampled in the other postfire years: 749, 199, 103 and 38 respectively 3, 5, 7 and 15 years postfire. Overall, the three most abundant species were Dryocoetes
autographus (Ratzeburg), a scolytid with 1 886 specimens captured followed by Arhopalus foveicollis (Haldeman), a cerambycid with 782 specimens captured and Thanasimus
24
3.2 Habitat attributes along the chronosequence
Even if there was no significant difference in the total snag basal area (F 5, 18 = 2.23, P = 0.0963), as well as for the basal area of recent (F 5, 18 = 2.25, P = 0.0939) and medium (F 5, 18 = 1.95, P = 0.1358) snags, a decreasing trend was observed for total and recent snags between 7 and 15 years after fire (Table 1.1). Basal area of broken snags (old class) increased significantly (F5, 18 = 2.96, P = 0.0403) during the first three years and stabilized for the rest of the chronosequence. The total volume of DDW was significantly lower for the very year of the fire (F5, 18 = 6.44, P = 0.0013) while the volume of medium DDW increased progressively (F5, 18 = 5.45, P = 0.0032) along the first five postfire years of the chronosequence (Table 1.1). There was no significant change in overall and all decay categories of dead saplings along the chronosequence (Table 1.1). Living jack pine saplings began to be significantly present 15 years after fire (F 5, 18 = 4.89, P = 0.0053) while black spruce saplings were nearly absent along the chronosequence (F 5, 18 = 1.05, P = 0.4185) (Table 1.1).
Bark recovering trunks of snags was significantly highest during the first 3 postfire years (Figure 1.2). There was a significant loss of bark (> 50 %) for postfire years 5 and 7 and another significant loss for postfire year 15 in which only 13 % of bark was still covering snag boles (Figure 1.2). The water content of snags decreased significantly and abruptly (F 23, 48 = 8.86, P < 0.0001) one year after fire and continued to decrease slowly along the chronosequence (Figure 1.3A). In DDW, the water content decreased significantly (F 23, 48 = 2.45, P = 0.0045) between 3 and 5 years after fire and then, did not change until at least 15 years post fire (Figure 1.3B). No significant difference in water content was observed in stumps along the 15 years chronosequence (F 23, 48 = 1.70, P = 0.0606) (Figure 1.3C). When we compared the water content between the three different types of deadwood for each postfire year separately, we observed significant differences 1 year after fire (F11, 24 = 22.80, P = 0.002), 3 years after fire (F11,24 = 23.30, P = 0.002) as well as 5 years after fire (F11, 24 = 6.20, P = 0.035) (Figure 1.4). For these years, water content was consistently higher in DDW compared with water content in snags and stumps according to the LSD test. Even if it was not significant in postfire years 7 and 15, we observed a trend showing greater water content in DDW and stumps compared with snags.
3.3 Saproxylic beetle abundance and species richness along the chronosequence
The abundance of saproxylic beetles was highest (F5, 18 = 35.10, P < 0.0001) during the year of the fire (year 0) and dropped significantly the following year (year 1) and again between years 3 and 5 after fire (Figure 1.5). After this second drop, saproxylic beetle abundance remained stable until at least 15 years after fire. Species richness also decreased with time after fire but more progressively (F5, 18 = 7.45, P = 0.0006) (Figure 1.5B).
3.4 Beetle assemblages along the chronosequence
PERMANOVA revealed that time since wildfire had significant effects on beetle assemblages (Table 1.2). Pairwise comparisons of the PERMANOVA indicated differences between postfire years for up to postfire year 5 (Table 1.2). Afterwards, no significant difference was observed. PERMDISP results revealed that time after fire had also a significant effect on the within-treatment dispersion (F5, 18 = 24.89, P = 0.001). This indicates that the differences revealed by PERMANOVA do not result only from differences in species assemblages across treatments but also from within-treatment dispersion. PERMDISP indicated differences between the same years as the pairwise comparisons of the PERMANOVA (Table 1.2).
3.5 Saproxylic beetle communities and habitat attributes along the chronosequence
The RDA ordination was significant (F = 3.49, P = 0.005, 199 permutations) and 62.6 % of the variance was explained by the first two axes (Axis 1: 47.35 %, Axis 2: 15.1 %) (Figure 1.6). Centroids of younger burned stands (0, 1 and 3 years after fire) were on the right side of the first axis of the triplot while those of older burned stands (5, 7 and 15 years after fire) were on the left of the axis. The recent snags as well as the old DDW vectors were related to younger burned sites. The recent snag vector was associated with several xylophagous beetles during the very year of the fire (year 0) while the old DDW vector pointed toward the centroids of stands burned 1 and 3 earlier, along species such as Dryocoetes