UN
IV
E
R
S
I
TÉ DU
QUÉBEC
À
MONTR
ÉAL
ANALYSE
D
E
L
'
EX
PR
ESS
ION
D
E
MFSD2A
,
LE
R
ÉCE
PT
EU
R D
E
LA
SYNCYTINE-2
,
PAR L'ÉTU
D
E
D
E
SON
PROMOT
EU
R AIN
SI QU
E
SA
LOCA
LISATION
CEL
L
ULA
IRE
ET EXT
RA
CELLULA
IR
E (EXOSO
M
ES)
AU
NIV
EAU
PLA
CE
NTAIRE.
M
É
MOIR
E
PR
ÉSE
NT
É
C
OMM
E E
XIG
ENCE
PARTI
E
LL
E
D
E
LA
MAÎTRIS
E EN
BIOLOGI
E
PAR
XAV
I
E
R
E
LISS
EEFF
UNIVERSITÉ DU QUÉBEC
À
MONTRÉAL
Service des bibliothèques
Avertissement
La diffusion de ce mémoire se fait dans le respect des droits de son auteur, qui a signé
le
formulaire Autorisation de reproduire et de diffuser un travail de recherche de cycles
supérieurs (SDU-522
-
Rév.0?-2011 ). Cette autorisation stipule que
«conformément
à
l'article 11 du Règlement no 8 des études de cycles supérieurs
, [l'auteur] concède
à
l'Université du Québec
à
Montréal une licence non exclusive d'utilisation et de
publication de la totalité ou d'une partie importante de [son] travail de recherche pour
des fins pédagogiques et non commerciales.
Plus précisément,
[l'auteur] autorise
l'Université du Québec
à
Montréal
à
reproduire
,
diffuser, prêter, distribuer ou vendre des
copies de [son] travail de recherche
à
des fins non commerciales sur quelque support
que ce soit, y compris l'
Internet. Cette licence et cette autorisation n'entraînent pas une
renonciation de [la] part [de l'auteur]
à
[ses] droits moraux ni
à
[ses] droits de propriété
intellectuelle
.
Sauf entente contraire, [l'auteur] conserve la liberté de diffuser et de
commercialiser ou non ce travail dont [il] possède un exemplaire.
»
R
E
M
E
R
C
I
E
M
E
NT
S
Ce
tr
ava
il
a é
t
é
r
éa
li
sé a
u d
é
p
a
rt
e
ment
d
es sc
i
e
n
ces
bi
o
l
og
iqu
es
d
e
l
'U
ni
ve
r
s
it
é
du Qu
é
bec
À
M
o
ntr
é
al
so
u
s
la
directi
o
n
du Dr B
e
n
o
it
Barb
e
au
e
t
la
co
dir
e
cti
o
n du Dr
E
ri
c
Ra
ssa
rt, m
e
mbr
es
du
ce
ntre d
e
r
ec
h
e
r
c
h
e
B i
o
M
e
d
.
J
e
ti
e
n
s à
r
e
m
e
r
c
i
e
r
s
inc
è
r
e
m
e
nt B
e
n
o
it
e
t
E
ri
c
p
o
ur
m
'avo
ir
p
e
rmi
s
d
'a
ll
e
r au
b
o
ut d
e ce
t
te
m
a
îtri
se
d
a
n
s
d
e
b
o
nn
es co
nditi
o
n
s
.
J
e
n
'o
ubli
e
p
as
l
a
particip
a
ti
o
n
imp
o
rt
a
nt
e
d
e
l
a
Dr
e
Juli
e
L
a
f
o
nd qui
a
t
o
uj
o
u
rs é
t
é
d
e
tr
ès
b
o
n
s co
n
se
il
s a
in
s
i qu
e
t
o
u
s
l
es a
utr
es
pr
o
f
esse
ur
s
qui
o
nt p
e
rmi
s,
t
o
ut
a
u
l
o
n
g
d
e
m
a s
c
o
l
a
rit
é
,
d
e
f
o
r
g
er
l
a
per
so
nn
e
qu
e
je
s
ui
s a
ujourd
"
hui
.
J
e
n
'o
ubli
e
p
as
t
o
ut
es
l
es
p
e
r
so
nn
es
f
o
rmidable
s
ave
c
l
es
qu
e
ll
es
j
'
a
i
e
u
l
e
privil
ège
d
e
tr
ava
ill
e
r dur
a
nt
ces
d
e
rni
è
r
es a
nn
ées
,
qu
e
c
e
so
it d
'
autr
es é
tudi
a
nt
s,
t
ec
hnici
e
n
s, e
n
se
i
g
nant
s e
t ch
e
r
c
h
e
ur
s
.
E
nfin j
e
ti
e
n
s à
r
e
m
e
r
c
i
e
r
très s
p
éc
i
a
l
e
m
e
nt l
es
m
e
mbr
es
d
e
m
o
n l
a
b
o
r
a
t
o
ir
e
,
qUI
o
nt
é
t
é
un
e
f
o
r
ce a
u qu
o
tidi
e
n
e
t qui
so
nt d
eve
nu
s à
m
es ye
u
x
un
e
n
o
u
ve
ll
e
f
a
mill
e.
M
e
r
c
i
Ca
r
o
lin
e
d
e
m
'avo
ir
lan
cé
d
e
l
a g
l
ace
p
o
ur m
e
m
o
ti
ve
r
qu
a
nd
j
'e
n
a
v
ai
s
b
eso
in
,
d
'
a
v
o
ir
p
a
11icip
é ac
tiv
e
ment
à
m
es
m
a
nip
s e
t p
o
ur
t
o
ut
c
e
qu
e
tu fai
s
e
n
co
re
a
uj
o
urd'hui. M
e
rci
C
l
é
m
e
nt p
o
ur
ce
tt
e a
miti
é
que j
e
n
e sa
ur
a
i
s
d
éc
rir
e.
M
e
rci
a
u
ss
i
à
K
ev
in
, M
e
ll
is
h
a
, Y
o
n
g, Z
h
e
nl
o
n
g et A
nt
o
in
e
d
'
avo
i
r é
t
é
l
à.
J
e
ti
e
n
s
final
e
m
e
nt
à
d
é
di
e
r
ce
tr
ava
il
à
m
a fa
mill
e e
t m
es a
mi
s,
m
a
i
s
plu
s
p
a
rticuli
è
r
e
m
e
nt
à
m
a
m
è
r
e, A
nn
e,
m
o
n p
è
r
e, É
ri
c,
m
es
fr
è
r
es
M
a
r
c e
t L
o
ui
s a
in
s
i qu
e
m
a sœ
ur,
M
a
r
ga
u
x
,
an
s
qui j
e
n
e se
r
a
i
s
j
a
m
a
i
s
d
eve
nu
l'
h
o
mm
e
qu
e
j
e s
ui
s
a
uj
o
urd
'
hui
.
M
e
rci d
e
m
'
av
o
ir
so
ut
e
nu
,
d
'avo
ir
c
ru
e
n m
o
1
e
t
s
urt
o
ut d
e
m'
a
vo
ir
p
e
rmi
s
d
e
d
é
m
a
rr
e
r
ce
tt
e
n
o
u
ve
ll
e v
i
e a
u
Ca
n
a
d
a
.
TABLE
D
ES
MAT
I
È
RES
L
I
STE
D
ES
F
I
GURES .
.
...
..
....
..
....
.
.
.
...
...
..
.
...
.
.
.
.
..
...
.
...
vi
LIST
E
D
ES
TABLEAUX
...
..
.
...
.
...
.
...
...
...
..
....
.
...
..
.
.
...
.
...
.
...
.
...
..
.
viii
LIST
E
DES
ABRÉV
I
AT
I
ONS ...
...
..
.
...
.
...
..
....
.
...
.
.
.
...
.
...
...
....
.
...
....
...
i
x
L
I
STE
DES
UNITÉS
...
..
.
.
...
.
...
.
...
.
...
.
...
...
... x
i
R
ÉSUMÉ
...
.
..
.
...
..
...
.
...
.
..
.
...
x
ii
I
NT
R
ODUCT
I
ON
.
.
.
...
.
...
.
....
...
..
..
...
.
...
.
.
.
..
....
...
.
...
1
CHAP
I
TRE
1
ÉTAT
DES
CONNA
I
SSANCES
....
...
...
.
...
.
.
...
..
...
.
...
..
...
...
... 4
1.1
Les
rétroviru
s ...
.
.
..
...
..
...
.
.
.
... 4
1.2
Les HERY
...
.
..
...
.
.
...
.
...
....
...
.
...
..
...
.
...
.
....
...
..
.
...
...
.... 9
1
.3
Le
placenta ...
....
...
...
..
...
.
...
.
...
.
...
.
...
1
3
1
.4
Les promoteurs
géno
mique
s
...
.
....
.
...
.
...
..
...
..
..
..
...
.
...
16
1.5
MFSD2a .
..
....
.
..
.
..
.
..
..
....
.
....
.
...
.
...
.
...
. 1
8
1
.4
Les exosomes ..
.
.
.
...
.
...
.
....
.
...
.
...
.
...
.
..
.
...
.
....
24
CHAP
I
T
R
E
Il
HYPOTH
ÈSES
D
E
TRAVA
I
L
.
.
...
.
...
.
...
.
....
..
...
.
...
...
...
..
... 27
CHAP
I
T
R
E
Ill
MAT
É
R
IEL ET
M
ÉT
HODOLOGI
E
....
...
.
...
.
....
...
.
.
...
.
....
.
....
.
...
.
... 28
3.1
Recherche
et caractérisation des ARN de MFSD2a dans
l
es
ce
llul
es BeWo,
JAR, JEG-3
et CTV
...
.
...
.
....
...
...
...
..
..
.
....
....
..
..
.
.
..
... 29
3.
1
.
1
Ext
raction
des ARN
totaux
des ce
llul
es
HEK293T,
BeW
o
, JAR.
JEG
-
3
et
CTV
...
.
.
.
...
.
...
..
...
.
...
.
...
.
..
..
...
.
... 29
3.
1
.2
D
étec
tion de
s
A
R
Nm codants po
u
r MFSD2a
...
...
...
29
3.
1
.3
Vér
i
fication de
la
po
s
i
ti
o
n
du
site
d
'
initiati
on
de
l
a transcr
ipti
on
.
....
..
...
30
IV
3.2.1 Clonage des régions en amont du gène MFSD2a dans le plasmide pGL3-Basic ... 32 3.2.2 Transfection des diftërentes constructions dans les cellules I-IEK293T,
BeWo, JAR, JEG-3 et CTV ... 33 3.2.3 Dosage de l'activité luciférase et identification de la région promotrice. 33 3.3 Détection de la protéine MFSD2a au niveau cellulaire et exosomal ... 34 3.3.1 Transfection des cellules HEK293T, COS-7, BeWo et microporation des
cellules CTV ... 34 3.3.2 Détection de la protéine dans des lysats cellulaires et exosomes par
im1nunobuvardage ... 34 3.3.3 Vérification de la présence de MFSD2a membranaire sur les cellules et
exosomes de cellules HEK293T, transfectéres avec MFSD2-V5, par cytométrie en flux et immunotluorescence ... 36 3.4 Tests statistiques ... 38 CHAPITRE IV
RÉSULTATS ... 39 4.1 Caractérisation des ARNm de MFSD2a dans les lignées cellulaires BeWo, JAR
etJEG-3 ... 39 4.1.1 Analyses RT-PCR pour MFSD2a sur les ARN totaux de cellules
HEK293T, BeWo, CTV, JAR et JEG-3 ... 39 4.1.2 Analyse 5' RACE des AR totaux de HEK293T afin d'identifier le site
d'initiation de transcription ... 40 4.2 Localisation et caractérisation de la région promotrice du gène MFSD2a ... 42 4.2.1 Clonage de la région en amont du gène MFSD2a dans le plasmide
PGL3-Basic ... 42 4.2.2 Analyse de l'activité promotrice de MFSD2a par l'utilisation de mutants
de délétions ... 43 4.3 Détection de la protéine MFSD2a dans les cellules et exosomes des cellules
HEK293T, BeWo et CTV ... 47 4.3.1 Détection de la protéine MFSD2a dans le cerveau et le cytotrophoblastes
villeux par immunobuvardage ... 47 4.3.2 Vérification de la présence de MFSD2a membranaire sur les cellules par
i1nmunotluorescence ... 49 4.3.3 Vérification de la présence de MFSD2a dans les exosomes par cytométrie
v
CHAPITRE V o o o o oooooooo . . . .. . o . . . .. . . o . . . . o . . . OOOoO . .. . . .. . . o . . . .. .. . . O O S 6 DISCUSSION ET CONCLUSIONS ... 5 6 5 01 Caractérisation de I'ARNm ... o 5 6 5 . 2 Caractérisation de la région promotrice 0 . . OOOOo . . o . . . . o . . . OOoO . . . . o . . . oooooo . . . 00 . . 5 8 5 0 3 Localisation de la protéine MFSD2a ... o 60 BIBLIOGRAPHIE o o o o o o o ooo o o o o o o o o o o o o o o o ooooooo o o o ooooo o o o o o o o o o o o o o o o o o o o o o o o o o o o o ooo o o o o o oooo o o oo o o oo o o oooooooooooo 6 5
LISTE DES FIGURES
Figure Page
1.1 Organisation générale de I"ARN d'un rétrovirus ... 5
1.2 Cycle de réplication des rétrovirus ... 7
1.3 Représentation schématique de la séquence intégrée d'un rétrovirus ... 8
1.4 Mécanisme d'endogénisation rétroviral ... 10
1.5 Arbre phylogénétique des rétrovirus humains ... !! 1.6 Conséquence de l'interaction entre une protéine d'enveloppe et son récepteur ... 12 1. 7 Schéma de l'unité meterno-fœtale et de la villosité choriale ... 1 3 1 .8 ldenti
ti
cation de la région promotrice de Syncytine-2 répondant à la forskoline dans les cellules BeWo ... 16 1.9 Promoteur minimal complexé avec I'ARN polymerase Il et les GTFs montrant les éléments de régulations ... 17 1.10 Niveau d'expression des ARNm et protéique de MFSD2a dans différents tissus ... 1 9 1.11 Analyse in situ de section de villosités choriales humaines pour l'expression de Syncytine-2 et MFSD2a ... 20 1.12 Domaines transmembranaires et représentation 3D de 1' isofonne 2 de MFSD2a (530 aa) ... 21 1. 13 Schéma des interactions connues avec MFSD2a ... 221 . 14
8
iogenèse des exosomes ... 253.1 Isolement des exosomes par ultracentrifugation différentielle ... 36
3.2 Schema de bille de phényl-sépharose avec des exosomes fixés à leur surface et marqués avec des anticorps ... 38
VIl
4.1 Analyse de l'expression de MFSD2a dans les lignées cellulaires de
choriocarcinomes ... 39 4.2 Produit de PCR de la dernière PCR nichée de la réaction de S'RACE des
ARN totaux de cellules HEK293T ... 40 4.3 S'RACE effectué sur les ARN totaux de cellules HEK293T ... .41 4.4 Schéma des diftërentes régions du promoteur du gène MFSD2a cloné dans le
plasmide pGL3-Basic ... 42 4.5 Niveaux d'expression relative de la luciférase des différents clones dans les
cellules HEK293T ... 43 4.6 Activité promotrice des différents mutants de délétions du promoteur dans les cellules BeWo ... 44 4.7 Induction de l'activité promotrice des mutants de délétion de MFSD2a dans
les cellules BeWo suite
à
l'activation par la forskoline ... 46 4.8 lmmunobuvardage anti-MFSD2a sur lysats de cerveaux ou CTV humains . .47 4.9 lmmunobuvardage anti-VS sur lysats de cellules fusionnant, exprimantMFSD2a ou MFSD2a-V5 et Syncytin-2 ... 48 4.10 Vérification de la détection et colocalisation du tag VS et MFSD2a dans les
cellules COS-7 ... 49 4.11 Vérification de l'expression de MFSD2a et MFSD2a-V5 dans les cellules
HEK293T ... 50 4.12 Analyse de l'expression de MFSD2a-V5 au cours du temps par
immunofluorescence dans des cellules HEK293T ... 51 4.13 Co-expression de MFSD2a- VS et Syncytine-2 dans des cellules HEK293T.52 4.14 Détection de MFSD2a-V5 dans les cellules HEK293T transtèctées avec
MFSD2a- VS et Syncytine-2 ... 53 4.15 Détection de la protéine MFSD2a
à
la surface des exosomes provenants deLISTE D
ES
TABLEAUX
Tableau Page
Tableau III.I Condition de PCR et amorces pour la détection des ARNm codants et les clonages de la région promotrice de MFSD2a ... 30
LISTE DES
AB
RÉV
IATIONS
aa: ac
ides
aminés
ADN
:
Ac
ide
Desoxiribonucléique
ARN
:
Ac
id
e Ribonucl
é
ique
CMV
:
Corps
Multivésiculaire
CTV: Cytot
roph
ob
lastes
Villeux
FSK: Forskoline
GCM 1 :Gli
al Ce
ll
s
Missing
H
o
molog
1
HERY
: Rétrovirus end
ogènes
hum
ain
(Human Endogenous Retro Viruses)HSP : Heat
Shock
Prote
in
LPC : Lysophosph
atidy
lcho
lin
e
L TR:
Lo
ng Terminal Repeat
MFSD2a: Major
Faci
litato
r Sup
erfam
il
y
Domain-containing protein
2A
nt
:
nucléot
ides
PBS
:
Tampon
phosphate
sa
lin
(Phosphate-buffered saline)P
LA
P : Pla
ce
nt
a
!
A
lk
a
lin
e
Ph
os
ph
a
t
ase
R
ACE:
R
a
pid
A
mplifi
ca
ti
o
n
o
f
e
DN
A
End
R
T-
PC
R
: R
eve
rse
T
r
a
nscripti
o
n
-
P
o
l
y
m
e
r
ase C
h
a
in R
eac
tion
S
ID
A
:
Sy
ndr
o
m
e
d
e
I'
Immunod
éfic
i
e
n
ce Ac
qui
se
STB
:
Sy
n
cy
ti
o
troph
o
bl
as
t
e
SU
:
G
lycopr
o
t
é
in
e
d
e S
ur
face
Sy
n
cy
t
i
n
e
-1
:
S
1
Sy
n
cyt
in
e
-
2
:
S2
TM
:
Do
m
ai
n
e T
r
a
n
s
m
e
m
bra
n
a
ir
e
TSG
:
T
um
o
r
S
u
sce
ptibility
Ge
n
e
TSS
:
T
r
a
nscripti
o
n
S
t
a
r
t
Si
te
V
II-I
:V
irus d
e
l
'
immunodéfi
cie
n
ce H
um
a
i
ne
V
I
L: Vés
i
c
ul
es
I
nt
ra
L
umin
a
l
es
LI
STE
D
ES UN
I
TÉS
o
c
:
D
eg
r
és Ce
1
c
iu
s
% :p
o
ur
ce
nt
age
M:
m
o
1/
1
1
:
1itr
e
g: g
r
a
mm
e
~t :mi
c
r
o
m
:
mili
n :n
a
n
o
RÉSUMÉ
La protéine MFSD2a est un récepteur membranaire exprimé dans la plupart des tissus du corps humain. Dans le placenta, elle forme un complexe liga nd-récepteur avec Syncytine-2. Ceci permet la formation et le renouvellement du syncytiotrophoblaste, une zone d'échange facilitée entre le sang de la mère et du fœtus. Contrairement
à
Syncytine-2, ni la régulation de l'expression, ni sa présence à la surface des cellules ou leurs exosomes ne sont connus pour MFSD2a. Ce projet a donc pour but de déterminer ces caractéristiques. Nous supposons quïl existe une modulation transcriptionnelle importante de MFSD2a au niveau placentaire, et que la protéine est présente à la surface des cellules et leurs exosomes. Afin de tester ces hypothèses, trois étapes seront nécessaires : 1) rechercher et caractériser les ARN m codants pour MFSD2a dans diftërents types cellulaires; 2) localiser la région promotrice du gène MFSD2a et 3) détecter la protéine MFSD2a dans différents types cellulaires et leurs exosomes. Pour ce faire, nous aurons recours à l'utilisation de techniques suivantes : RT-PCR, S'RACE, immunobuvardage, essais luciférase, cytométrie en tlux et microscopie confocale. Les résultats obtenus montrent qu'ilexiste des éléments de régulation synergique en amont du gène codant pour MFSD2a et que son expression peut être induite par le biais de son promoteur. La forskoline augmente l'activité de la région promotrice de MFSD2a de la même manière que celle de Syncytine-2. La localisation de la protéine MFSD2a, à la membrane et a
l'intérieur des syncytia,
à
été mise en évidence dans différents types cellulairesà
l'aide de la microscopie confocale et dans des exosomes grâce a la cytométrie en flux. La poursuite de l'étude de cette protéine est impottante afin d'améliorer nos connaissances fondamentales et notre compréhension des maladies placentaires.INTRODUCTION
Cette recherche s'inscrit dans une problématique générale de compréhension du rôle des protéines rétrovirales endogènes humaines et de leurs partenaires d'interaction au niveau placentaire, afin de déterminer leurs impacts potentiels dans un cadre pathologique.
Les rétrovirus endogènes humains (HERY) sont des rétrovirus qui ont infecté des cellules germinales humaines il y a plusieurs dizaines de millions d'années (van der Kuyl, 20 12). Suite
à
une accumulation de mutations dans leur génome, ces rétrovirus ont perdu leur capacité de réplication et d'infection. Cependant, cet1ains gènes persistent et sont toujours en mesure de coder efficacement pour des protéines d'enveloppe comme les Syncytines. Les Syncytines-1 et -2 (S 1 et S2) sont des protéines d'enveloppe rétrovirales qui conféraient au virus sa capacité fusogénique (Blaise et al., 2003). Celles-ci leur permettaient d'infecter les cellules en interagissent avec des protéines membranaires fréquemment retrouvées à la surface des cellules, comme MFSD2a. En effet, MFSD2a est un symporteur de lysophosphatydilcholine (LPC) présent dans beaucoup de tissus du corps humain (Uhlen et al., 20 15). La relation ligand-récepteur qui existe aujourd'hui entre Syncytine-2 et MFSD2a se retrouve au niveau du placenta et permet la fusion des cellules trophoblastiques (Renard et al., 2005). Ces cellules vont former le syncytiotrophoblaste (STB), une zone d'échange privilégiée entre la mère et le fœtus.Le placenta est un organe transitoire, présent uniquement au cours de la grossesse, qui permet les échanges nutritionnels et le maintien de l'équilibre immunitaire entre la mère et le fœtus. Il a aussi été démontré que le placenta est une
2
source
importante
d
e vés
icul
es extrace
llula
ir
es
t
e
ll
es
qu
e
les exoso
m
es (Sark
e
r
e
t al.
,
20
1
4)
.
Les exoso
m
es so
nt d
es vés
i
c
ul
es
d'
e
n
v
ir
o
n 4
0 à
1
00
nm pr
ove
n
a
nt du
co
mp
a
rtim
e
nt
e
nd
oso
m
a
l.
D
a
n
s
le
c
y
t
o
pl
as
m
e ce
llul
aire, ce
rt
a
in
s e
n
doso
m
es vo
nt
s
ubi
r
d
es
in
vag
in
a
ti
o
n
s
d
e
leur
m
e
mbr
a
n
e ve
r
s
la
lumiè
r
e e
t
fo
rm
e
r d
es
c
o
rp
s
multi
vés
i
c
ul
a
ires (C
MV
) co
nt
e
n
a
nt d
es vés
i
c
ul
es
intr
a
-lumin
a
l
es (
VI
L).
L
a
fu
s
i
o
n d
e
ce
rt
a
in
s C
MV
ave
c
la
me
mbr
a
n
e cellul
a
ire
lib
è
re
les
VIL d
ans
l'es
pac
e
ext
r
ace
llul
a
i
re (
K
ell
e
r
e
t
a
l.
,
2006)
.
U
n
e
f
o
i
s
lib
é
r
ée
d
a
n
s
l
e
d
o
m
a
in
e ex
tr
ace
llul
a
ir
e
,
o
n l
es a
pp
e
ll
e a
l
o
r
s exoso
m
es
.
Ces
d
ern
i
e
r
s
j
o
u
e
nt un r
ô
l
e
m
aje
ur d
a
n
s
l
a
co
mmuni
ca
ti
o
n int
erce
llul
a
i
re e
t
leur
é
tud
e se
mbl
e ê
tr
e
un
e vo
i
e
pr
o
m
et
t
e
u
se
p
o
ur
la
d
éco
u
ve
r
te
d
e
bi
o
m
a
r
q
u
e
ur
s (
Mit
c
h
ell
e
t
al.
, 20
1
5).
L'é
tud
e
d
e
l'
ex
pr
ess
i
o
n
d
es Syncy
tin
es
-1
e
t -
2
d
a
n
s
l
es ce
llul
es
tr
o
ph
o
bl
as
tiqu
es e
t
les exoso
m
es
pl
ace
nt
a
ir
es
i
ss
u
s
d
e
f
e
mm
es e
n
ce
intes
n
o
rm
ales ou
pr
ééc
l
a
mptiqu
es a
m
o
ntr
é
un
e
diminu
t
i
o
n d
e
l
e
ur
ex
pr
ess
i
o
n
.
P
o
ur M
FS
D
2a,
l
a
co
mp
a
r
a
i
so
n d
e so
n
ex
pr
ess
i
o
n
a
u ni
vea
u
des ce
llul
es trop
h
o
bl
ast
iqu
es
i
ss
u
es
d
e
pl
ace
nt
as
n
or
m
a
u
x ve
r
s
u
s
pr
ééc
la
mp
t
i
q
u
es a
m
o
ntr
é
un
e d
im
inu
tio
n
de so
n
exp
r
ess
i
o
n
e
n
cas
d
e p
r
ééc
l
a
m
ps
i
e (To
u
fa
il
y et a
l.
,
20
1
5). O
n n
e a
i
t cepe
nd
a
n
t
p
as
auj
o
urd
'
hui
co
mm
e
nt
est
r
ég
ul
ée
l'
ex
pr
ess
i
o
n d
e MFS
D
2a e
t bi
e
n qu
e
l
a Sy
n
cy
tin
e-2
so
it
pr
ése
nt
e à
l
a s
ur
face
d
es exoso
m
es, cec
i n
'a
j
a
m
a
i
s é
t
é vérifié
p
our
M
FS
D
2a.
Co
n
s
id
é
r
a
nt l
es
in
fo
rm
a
ti
o
n
s p
r
écé
d
e
nt
es,
le s
uj
e
t pr
o
p
osé
« A
n
alyse
d
e
l'
exp
r
ess
i
o
n
d
u r
éce
p
te
ur
de
l
a Sy
n
cyt
in
e
-
2 (MFS
D
2a)
p
a
r l'
ét
ud
e de so
n p
ro
m
o
t
e
ur
a
in
s
i qu
e sa
l
oca
lisat
i
o
n
ce
llul
a
ir
e e
t
ext
r
ace
llul
a
ir
e (exoso
m
es) a
u ni
vea
u
pl
acenta
ir
e
»
a
p
o
ur
o
bj
ec
ti
fs
d
e :
1)
rec
he
r
che
r
e
t d
e ca
r
ac
t
é
ri
se
r
les A
R
N
m d
e
M
FS
D
2a
d
a
n
s
l
es
lig
n
ées ce
llul
a
ir
es
B
e
W
o
,
.J
A
R
,
J
EG
-
3 a
in
s
i qu
e
l
es
cy
t
o
t
ro
ph
o
bl
as
t
es vill
e
u
x (CT
V
)
,
2)
d
e
l
oca
li
se
r
e
t
ca
ra
c
t
é
ri
se
r
la
r
ég
i
o
n
p
r
o
m
o
tri
ce
du
gè
ne
M
FS
D
2a e
t
3)
d
e
d
é
t
ec
t
e
r
la
pr
o
t
é
in
e
M
FS
D
2a
d
a
n
s
l
e
s
ce
llul
es
B
e
W
o e
t
CT
V
a
in
s
i
q
u
e
d
a
n
s
l
es exoso
m
es
pl
acen
t
a
ir
es.
3
Les implications théoriques et appliquées de ce projet sont respectivement. l'approfondissement des connaissances fondamentales sur MFSD2a, sa potentielle implication au niveau placentaire et son rôle éventuel dans la prééclampsie.
CHAPITRE 1
ÉTAT DES CONNAISSANCES
1.1 Les rétrovirus
Les virus sont des agents infectieux, parasites obligatoires, ne possédant qu'un seul type d'acide nucléique (ADN ou ARN) et totalement dépendent des mécanismes cellulaires de leurs hôte pour survivre. Ils infectent tous les types cellulaires et peuvent parfois produire d'importantes modifications cellulaires (Madigan et al., 2006). David Baltimore, prix Nobel de médecine 1975, est l'auteur d'une classification, qui porte son nom, et qui permet de classer les virus en sept groupes selon différentes caractéristiques génomiques (ADN/ARN, sens, nombre de copies, etc.) (Baltimore. 1971 ).
Les rétrovirus font partie du groupe VI de la classification de Baltimore. Cela signifie qu'ils sont des virus à ARN, possèdent une capside icosaédrique enveloppée et une structure génomique comprenant deux molécules d. ARN sens simple brin à polarité positive (Baltimore, 1971). Ils ont une taille d'environ 90 à 120 nanomètres et sont très répandus dans le monde animal. Ils sont la cause de beaucoup de maladies, peuvent induire des cancers, irnmunodéfïcience (tel que le SIDA) ou des anémies. Ils sont capables d'infecter beaucoup de types cellulaires différents et leur présence peut avoir un effet nocif
à
court (quelques semaines) ouà
long terme (plusieurs années) (McGuire et al., 1971, De Gruttola et al., 1986).5
Le génome des rétrovirus possède une organisation générale de I'ARN viral comme suit (Figure 1.1) : 5' RIU5-gag-pro-po/-env-U3/R 3· (Voevodin et Marx, 2009).
5· LTR 3.
c
a
p~
Ri
usl
PBS 1 LGAG - POL ENV 1 PI'T
~
U3i
R~AAAA
Figure 1.1 Organisation générale de l' ARN d'un rétrovirus.
Les différentes régions sont les suivantes (Cann, 20 16) :
R: est une séquence terminale longue répétée aux deux extrémités qUI sera la première partie de l"ADNe .
U5 et U3 : sont les longues séquences répétées correspondant respectivement aux extrémités 5' et 3' de l"A RN (Seibert et al., 1995).
PBS (Primer Binding Site) et PTT: La séquence PBS est une séquence d'attachement de I'ARNt sur I'ARNm. L'ARNt servira d'initiateur pour la rétro-transcription. La séquence PTT est la région nécessaire
à
l'amorçage de la rétro-transcription du brin (+).L: cette séquence contient trois différents signaux. Un premier nécessaire à la fixation des ribosomes sur la molécule d' ARN (Patschinsky et al., 1986), le deuxième aide la formation de dimères d' ARN (Dhar et al., 1980) et le troisième est impliqué dans l'encapsidation des ARN viraux (Darlix, 1986).
Gag est un gène codant pour les protéines de structures comme la matrice, capside et nucléocapside.
6
P
o
l
es
t un
gène
c
o
d
a
nt p
o
ur la
tr
ansc
ripta
se
in
ve
r
se
,
la
rib
o
nu
clé
a
se
H
e
t
1'int
ég
rase.
E
n
v es
t un
gè
n
e co
d
a
nt p
o
ur
les
pr
o
t
é
in
es
d
'
e
n
ve
l
o
pp
e.
Ce
rt
a
in
s
ré
tr
ov
iru
s,
c
o
mm
e
l
e
VIH
, co
nti
enn
e
nt d
es gè
n
es a
cc
esso
ir
es
c
omme
rev, tai, vif; vpu, vpr, nef; et
c,
qui
l
es a
id
e
nt
à
inf
e
ct
er
c
e
rt
a
in
s
t
y
p
es
c
ellul
a
ir
es o
u
à se
d
é
f
e
ndr
e co
ntr
e
l
e sys
t
è
m
e
immunit
a
ir
e (C
ull
e
n
a
nd
Gree
n
e,
19
89
)
.
Le cy
cl
e
r
é
pli
ca
tif d
es
ré
tr
ov
iru
s es
t bi
e
n p
a
rticuli
e
r
,
ca
r
il
n
écess
it
e
un
A
DN
int
e
rm
é
di
a
ir
e (F
i
g
ur
e
1
.
2). Co
mm
e
il
a é
t
é
d
éc
rit p
a
r P
o
mmi
e
r
e
t
al.(2
00
5)
,
l
e v
iru
s
suit
plu
sie
ur
s é
t
a
p
es; à
l'entrée,l
e virus
inf
ec
t
e
un
e
c
e
llule e
n fu
s
i
o
nn
a
nt
so
n
e
n
ve
l
o
pp
e a
v
e
c
la
m
e
mbran
e cellul
a
ir
e o
u
avec
la
m
embra
ne
d
e
l
'
end
oso
m
e
tardi
f s'
il
a été e
nd
ocy
t
é (
un
c
han
ge
m
e
nt d
e
pH d
a
n
s
l'
e
nd
oso
m
e
peut pr
ovo
qu
e
r un
e
m
o
diti
ca
ti
o
n
co
nf
o
rma
ti
one
lle
d
es
pr
o
t
é
in
es
d
'e
n
ve
l
o
ppe du
v
iru
s
lui
p
erme
tt
a
nt
al
ors
d
e
fu
sionn
er
a
ve
c
la
m
e
mbr
a
n
e
d
e
l'
end
oso
me
) (Kub
o e
t
a
l.
,
2
0
12)
.
La c
a
p
side se
r
e
tr
ouve a
lo
r
s
d
a
n
s
le
c
y
t
o
pl
as
m
e où la
décapsidationp
e
rm
e
ttra
de libé
r
e
r
I'ARN
v
ir
a
l.
Ce
d
erni
er va ê
tr
e e
ns
uite rétrotranscrit e
n
A
DN
g
r
â
c
e à
l'
a
c
ti
v
it
é
d
e
l
'
enzy
m
e
v
ir
ale T
ran
s
cript
ase
in
ve
r
se
.
Ce
tt
e é
t
a
p
e
d
onn
e
lieu
à
l
a
producti
on
d
'
un ADN
p
r
ov
ir
a
l
do
ubl
e
brin
q
ui
va
s'intégt·erda
n
s
l
e gé
n
o
m
e de
l
a ce
llul
e
h
ôte v
i
a
l
'
ac
ti
o
n
d
e
l
a p
r
o
t
é
in
e v
ir
a
le a
pp
e
l
ée
lnt
ég
r
ase. U
n
e
f
o
i
s
int
ég
r
é,
la
transcriptiond
e cet A
D
N
sui
v
i
e
d
e
la
tr
a
du
c
ti
on
d
es A
RNm
v
irau
x
permettra
l
a
pr
o
ducti
o
n d
e
di
ve
r
ses
pr
oté
in
es (ex
:
ca
p
sid
e
,
glyco
pr
o
t
é
in
e
d
'e
nv
e
l
o
pp
e
,
Tra
n
sc
ript
ase
in
ve
r
se e
t
lntég
r
ase
)
qui
vo
nt
a
l
o
r
s ê
tr
e
assembléesp
o
ur f
o
rm
e
r d
e
n
o
u
vea
u
x v
iri
o
n
s. Ces
d
e
rni
e
r
s
so
rtir
o
nt d
e
la cellul
e
p
a
r
bourgeonnement.Ces
t
lo
r
s
du b
o
ur
geo
nn
e
m
e
nt
qu
e
la
p
a
rti
c
ul
e v
ir
a
l
e o
bti
e
nt
so
n
e
n
ve
lo
pp
e
.
Elle es
t
co
n
s
titu
ée
d
e
l
a
bi
co
u
c
h
e
lipidiqu
e
m
e
mbr
a
n
a
ir
e
d
e
l
a ce
llul
e
h
ô
t
e e
nri
c
hi
e
p
a
r l
es
pr
o
t
é
in
es co
d
ées
p
a
r
le gè
n
e
env.U
n
e
fo
i
s séc
r
étés,
les v
iri
o
n
s
d
evro
nt
s
ubir un
e é
tap
e
d
e
maturationava
nt d
'ê
tr
e
f
o
n
c
ti
o
nn
e
ls e
t d
e
p
o
u
vo
ir
infec
t
er
d
'a
utr
es ce
llul
es (
P
o
mmi
e
r
e
t
a
l.
,
2
00
5).
Figure
1.2
.,-"'<~-r ... J')Sic1r..cra RNA lntcgmse R<M!rSe tr.!nserlptass V•us adsorption a F~on inl~tOI'S1
Vlrus-cell fusk>n ~~ ~nslaUon f'olypep:i<le~
r
<>le<>sc
~
• Proteolytioproce"
s
~
. inhbitors ~ by viroJprote::
~Vir~
~
!:._'!!!RNA assembkt at V';
V
tf!('::_ll" the celt membmneJIQ;JJf,W
Budding ~
7
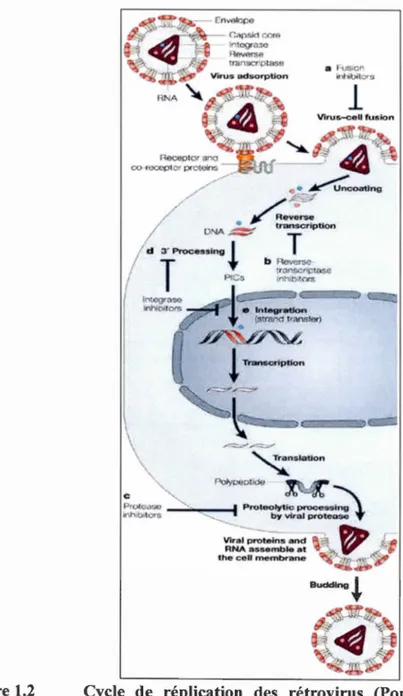
Cycle de réplication des rétrovirus
(Pommier
et al., 2005).
Repr
ése
ntati
o
n d
es é
t
a
pe
s
d
'
infecti
o
n
,
tr
a
n
sc
ripti
o
n inv
e
r
se,
int
ég
r
a
ti
o
n
et
r
é
plicati
o
n
dans
un
cellule.
P
o
ur infect
e
r une
cellule
,
un
virus va
pr
e
mi
è
r
e
m
e
nt
se
fi
xe
r
à
la
m
e
mbr
a
n
e ce
llulair
e
p
ar sa
pr
oté
in
e
d
'e
nv
e
l
o
pp
e, s
p
éc
ifiqu
e
d
'
un r
éce
pt
e
ur.
L" ARN
gé
n
o
miqu
e sera
alors
libér
é
d
a
n
s
l
e cytoplasme,
r
ét
r
otra
n
sc
rit
e
n
A
DN pui
s
mi
gré a
u
n
oya
u
et
int
ég
r
é a
u
gé
n
o
m
e ce
llulaire.
Ce
la p
e
rm
e
ttr
a
au
v
iru
s
d
'
utili
s
er ensuite
l
a
m
ac
hin
e
rie
cellulaire
d
e
la
cellule
pour la pr
o
ducti
o
n d
e
n
o
u
ve
ll
es
p
a
rti
c
ule
s vi
r
a
l
es et
pr
o
p
age
r l
'
infecti
o
n
.
8
Les protéines d'enveloppe jouent un rôle crucial pour le virus. Codées par le gène env, ce sont les protéines responsables de la tïxation des virions sur les récepteurs spécifiques. Ces complexes protéiques sont divisés en deux parties principales, la glycoprotéine de surface (SU) qui est l'antigène majeur, et la pottion transmembranaire (TM) qui maintient le SU à la surface membranaire (Perez et al., 1992) (Figure 1.3). L'intéraction de la SU avec le récepteur membranaire de la cellule hôte va induire un changement de conformation de la portion TM, ce qui expose alors le peptide de fusion et permet son insettion dans la membrane cellulaire, catalysant ainsi la fusion du virion avec la cellule hôte (Flint,
2004
).
env
su
TM-
---
---®
~~;;j
-
NHR1
ISU1
( ccl
CHR MPER1
MSD1
' '
'
'
'
'
'
'
Cytopl. tai!]Figure 1.3
Représentation schématiqu
e
de la
séquence intégr
ée d
'
un
rétroviru
s
(Denner, 2016).
La partie TM de la protéine d'enveloppe se divise en neuf régions : peptide de fusion (FP) (entouré en rouge), région proximale du peptide de fusion (FPPR), région hélicale N (NHR), domaine immunosuppresseur (!SU), boucle cysteine-cysteine (C-CC), région hélicale C terminale (CHR), région membranaire proximale externe (MPER), domaine transmembranaire (MSD) et queue cytoplasmique (Cytopl. Tai!).Parmi les sous unités de la TM, le fragment le plus important est le peptide de fusion (FP). Sans lui, toute l'activité de la protéine d'enveloppe est inhibiée car elle ne peut plus jouer son rôle d'initiation de la fusion.
9
1.2 Les HERY
À
la diftërence des rétrovirus exogènes, qui cherche à intégrer leur matérielgénétique dans des cellules spécifiques, les rétrovirus endogènes sont déjà intégrés dans toutes les cellules de l'organisme (Denner, 20 16). Grâce au séquençage du génome humain, il a été montré que 45% de notre ADN est composé d'éléments transposables comme les rétroéléments ou les transposons. Cependant, environ 5 à 8% de la totalité de notre génome est constitué de séquences ayant des homologies avec des rétrovirus infectieux et ces séquences sont transmises de génération en génération (van der Kuyl, 20 12). L'existence de ces séquences peut être expliquée par le cycle réplicatif des rétrovirus qui possèdent la capacité de s'intégrer dans l'ADN de l'hôte. Il y a des millions d'années, certains rétrovirus ancestraux ont intégré leur ADN viral dans des cellules germinales humaines. Ceci a conduit à une transmission verticale de ces séquences virales d'une génération à l'autre et on parle alors de rétrovirus« endogènes » humains (HERY) (van der Kuyl, 2012) (Figure 1.4). Les HERVs sont divisés en trois classes (1, Il et III) (Figure 1.5) et chaque classe contient plusieurs sous-groupes. Ils sont classés en fonction de leur sim i 1 itude avec différents rétrovirus infectieux. Les H ER Vs de classe l sont apparentés aux gammarétrovirus, ceux de la classe 11 sont apparentés aux bétarétrovirus et ceux de la classe III aux spumavirus (van der Kuyl, 20 12).
horizontal transmission
.
n
.
''""'
-
i
"'
-
>pede>)
in
~!:
s
i
...
i
-+
i
retrov1rus ~AAA ~viral RNA ' ifgermline infectioni
' transmission to offsprin = vertical transmissionlnt;g,.ted provl"l DNA
i
1
~
ENDOGENIZATION•
1 Il fe captured syncytin•
i i i
10Figure 1.4 Mécanisme d'endogénisation rétroviral (Dupressoir· et al., 2012). Les rétrovirus ont la capacité d'insérer leur matériel génétique dans le génome des cellules infectées. L'infection conduit habituellement
à
une production de virions qui propageantl'infection, horizontalement,
à
d'autres individus. Dans de rares occasions, les virus peuvent infecter des cellules de lignées germinales, ce qui conduit alorsà
une transmission vetticaledu proviru dans toutes les cellules et donc à son endogénisation. Au cours de l'évolution, la majorité des gènes ont subi des mutations délétères, mais certains sont toujours fonctionnels,
Endogenous and exogenous retroviruses of humans ••ogtf'lous.;. no tMooenoU't· res El 0
..
Il lill 1 ..,. 1 0--~ 0- - ~FigUJ·e 1.5 Arbre phylogénétique des rétrovirus humains (van der Kuyl,
2012). Représentation des différentes branches de l'arbre phylogénétique des
rétrovirus humains présentés avec leurs organisations génomiques type.
Ces virus sont maintenant inactifs. Une accumulation d'altération génétique a
fait en sorte que seuls quelques rares éléments sont toujours capables de produire des protéines fonctionnelles (van der Kuyl, 20 12). Parmi les protéines conservées, on trouve surtout des protéines d'enveloppe, permettant la fusion de la particule virale
avec la cellule cible, qui s'exprimaient autrefois à la surface des particules virales et
qui se retrouvent aujourd'hui exprimées à la surface de certaines cellules (van der Kuyl, 2012). La fusion cellulaire débute par l'adhésion cellulaire à l'aide d'une
interaction de type ligand-récepteur, formant des faisceaux d.hélices A
lpha
et aidé par des molécules signalétiques (Larsson et al., 2008). Syncytine-1 se lieà
son récepteurSLCIA5/ASCT2/RDR, un transporteur d'acide aminé et récepteur rétroviral de type
D (Blond et al., 2000a, Malassine et al., 2005). Syncytine-2 se lie
à
son récepteurMFSD2a
(Major Facilitator Su;m:famil
y
Domain
Co
ntainin
g 2)
(Esnault et al..1
2
De
l
a
mê
m
e
mani
è
r
e
qu
'
un
e
particul
e vira
l
e
fu
s
i
o
nn
era
it
avec
un
e ce
llul
e,
l
es
protéin
es
d'e
n
ve
l
oppe Sy
n
cytin
e-1
(
H
ERV-W)
et
-
2 (HERV-
F
RD)
,
indui
se
nt
,
par
l
e
ur
inte
ractio
n
a
vec
l
e
ur
s
récepteurs
,
M
FSD2a
,
l
a f
u
s
i
on des cytotro
phobl
astes
v
ill
eux au co
ur
s
du déve
l
oppement pl
acentaire (Blai
se et
al.
,
2003
,
Renard
et
a
l.
,
2005)
(F
i
g
ur
e
1
.6).
Cec
i permet
l
a
fo
rmati
on d
'
un
sy
ncytium
,
appe
l
é
sy
n
cytiotropho
blas
te
(STB)
,
qui pe
rmet l
es échanges entre
la
mère et
l
e
fœtus (vo
ir
déta
il
s
dans
l
a secti
o
n 1.
3)
(Mi
et
a
l.
,
2000)
(C
h
en
et
a
l.
,
2012
).
Da
n
s
l
e cas
de
la
Sy
ncytin
e-2, c'est
l
a
protéine
MFS
D2a
qui joue
l
e
rô
l
e
de
réce
pte
ur.
Co
mme
il
a
déj
à
été
montré
par de
Pa
r
seva
l
et He
idm
a
nn
(2005),
l
e
place
nta est
un
e
zo
ne
prétë
rentie
ll
e d
'ex
pressio
n des
HER Ys.
Bi
e
n
qu
e
l
es
L
T
R j
o
u
ent
l
e rô
l
e de
promoteur
po
ur l
'ex
press
i
o
n
des
H
E
RY
,
l
es é
l
é
ment
s
de
r
ég
ulati
o
n
s e
nd
ogè
n
es
vo
i
s
in
s
pe
u
ve
nt
auss
i
intlu
ence
r l
e
ur
ex
press
ion
(Li
a
nd
Karl
sson, 20
1
6). Les
H
E
RY peuve
nt
a
u
ss
i
jo
ue
r
un r
ô
l
e
dan
s
l
a
rég
ul
atio
n
de
l
'ex
press
ion
d
es gè
nes
avo
i
s
in
ants (Prudh
o
mme et
a
l.
,
2005) (vo
ir
fi
g
ur
e
1
.8 e
t secti
o
n
1.
3).
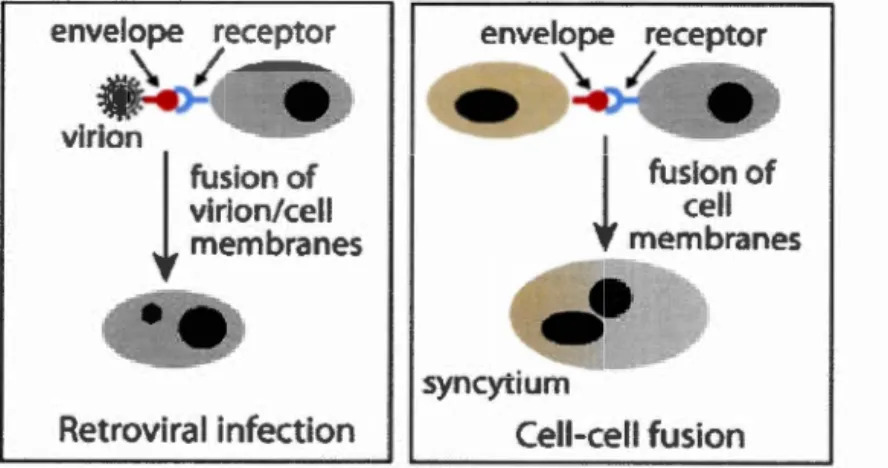
virionl
fusion of virion/cell membranes Retroviral infection syncytium Cell-cell fusionFigure 1.6 Conséquence de l'interaction entre une protéine d'enveloppe et son récepteut·: fusion du virion avec sa cellule cible (gauche) ou fusion des cellules formant un syncytium (droite) (Dupt·essoir et al., 2012).
13
1.3 Le placenta
Le placenta est un organe transitoire présent uniquement lors de la grossesse et qui assure les échanges métaboliques entre la mère et le fœtus. Il protège aussi le fœtus contre les bactéries et autres substances toxiques. Le placenta croit jusqu'à la 36c semaine, d'abord par hyperplasie puis par hypertrophie des cellules du trophoblaste (Roberts et al., 20 16).
À
terme, il forme un disque d'environ 22 cm de diamètre pour 2,5 cm d'épaisseur pesant environ 500g (Burton and Fowden, 20 15). Il possède deux faces, une fœtale (ou choriale) avec une bordure en brosse et une basale rattachée à la paroi utérine (Ganapathy et al., 2000). La chambre intervilleuse et les villosités choriales se localisent entre ces deux faces (Figure 1.7). Elles sont considérées comme les unités structurales et fonctionnelles du placenta humain et peuvent atteindre une surface de 14 m2 au terme d'une grossesse normale (Burton and Fowden, 20 15). -;;; E "' " 2 ~"
"'
E " -fetal vessel - maternai bloodC:!liïJ~
~
nl~-
cytotro
ph
ob
la
st
(CT) syncytio trophoblast (ST) extravillous trophoblasts (EYT) uterine arteryFigure 1.7 Schéma de l'unité meterno-fœtale et de la villosité choriale
(modifié à partir de (Lavialle et al., 2013)).
Selon Burton et Fowden (2015), la villosité choriale n'est constituée dans sa structure définitive que vers la troisième semaine après la fécondation. Une première
- -
-14
vague prolitërative de cytotrophoblastes va coloniser le syncytiotrophoblaste interlacunaire formant alors l'ébauche de la villosité choriale. Les colonnes de cytotrophoblastes seront
à
leur tour envahies par une prolifération mésenchymateuse d'origine embryonnaire, ce qui permettra la croissance de la villosité.Le placenta assure cinq fonctions qui sont essentielles au développement fœtal: 1) respiratoires par les échanges gazeux, 2) nutritionnelles par le transport de métabolites et dïons, 3) excrétoires par le transpo1t des déchets, 4) endocrines par la production d'hormones et 5) immunologiques. Il permet la greffe semi-allogénique du fœtus en étant l'intermédiaire entre deux systèmes immunitaires (Simpson et al., 1992, Faber, 1993). Toutes ces fonctions sont modulées par la qualité du syncytiotrophoblaste qui se forme et se renouvelle par la fusion des cytotrophoblastes (Larsson et al,. 20 Il). Cette fusion est possible grâce à la présence de protéines fusogéniques faisant partie de la famille des HERY : les Syncytines-1 et -2 (HE RY-W et HERY -FRD) (Blond et al., 1999; Blaise et al., 2003). La Syncytine-2 possède aussi un potentiel immunosuppresseur qui pourrait protéger le fœtus contre le système immunitaire de la mère (Mangeney et al., 2007).
La prééclampsie (PE) est une complication obstétricale fréquente, multisystémique qui touche 2 à 10% des femmes (Foucade et al., 20 14). Elle se définit par l'apparition d'un épisode d'hypertension artérielle persistant avec une pression a1térielle diastolique supérieure ou égale à 90 mmHg et une protéinurie supérieure à 0,3g par jour. Dans certains cas, elle peut évoluer en éclampsie et mettre alors en danger la vie de la mère ou de l'enfant (Foucade et al., 20 14). La cause de cette maladie n'est pas connue. Elle touche les femmes souvent après 20 semaines de grossesse. La maladie peut également survenir plus tardivement, peu de temps avant l'accouchement ou parfois même après l'accouchement (Foucade et al., 2014). De manière intéressante, un défaut d'expression des Syncytine a été associé à la prééclampsie et il a été montré que la diminution de l'expression des Syncytine-1 et