Remerciements
En premier lieu, je tiens à remercier vivement mon directeur de thèse, le Dr Abdel Saoudi qui m’a accueilli au sein de son équipe pour effectuer mon M2R puis cette thèse. Grâce à ta confiance et tes conseils éclairés, j’ai pu mener à bien cette thèse et publier un article en premier auteur. Ce bout de chemin sous ta direction m’a permis d’acquérir des qualités scientifiques (rigueur, persévérance, autonomie) indispensables pour obtenir un post-doc aux Etats-Unis.
Je remercie très chaleureusement le Dr Gilbert Fournié, « inventeur » de mon sujet de thèse. Grâce à votre perspicacité et votre persévérance, la lignée de rats BNm est née. Votre « bébé » m’a été confié et ce fut un vrai plaisir de travailler en leur compagnie durant ces quatre années.
Je tiens particulièrement à remercier le Dr Anne Dejean. Merci pour… tes mille et un dons : la rigueur, la démarche scientifique, des conseils toujours avisés, tes petites mains pour effectuer des expériences. Scientifiquement, tu m’as beaucoup apporté mais ce n’est pas tout : ton soutien sans faille, ta sympathie, ta bonne humeur et tes nombreux conseils m’ont donné la force et la foi pour aller avec succès au bout de notre aventure.
Mes remerciements vont également au Pr Roland Liblau, au Dr Daniel Dunia et au Dr Nicolas Blanchard. Vos nombreux conseils lors des réunions de labo et entre deux manips ont toujours été très judicieux et constructifs.
Je remercie le Pr Roland Liblau, qui me fait l’honneur de présider ma thèse ainsi que le Dr Piaggio, le Pr Hugot et le Pr Lefranc, qui ont accepté d’être mes rapporteurs.
Je tiens également à remercier tous les membres actuels de l’équipe AS : Isa, pour tes nombreux conseils et coups de main, Céline pour tes connaissances en « paires de bases » toujours les bienvenus et ton aide. Enfin merci à Christophe, qui continue sur le sujet Themis (malgré ces quelques infidélités, fais attention au virus « Vav » !). Tu as été d’une grande aide technique et morale. Je remercie aussi les membres de l’équipe qui ont trouvé leur bonheur professionnel ailleurs : Laurence qui m’a pris sous son aile pour le M2R, ta rigueur scientifique, ta patience et ta gentillesse m’ont beaucoup aidé durant cette année difficile ; Christine qui m’a souvent donné des coups de main (notamment pour une manip de chimères… 16h, je mélange les moelles osseuses, hé hop, nous voilà parties à l’animalerie pour
sacrifier d’autres rats et purifier d’autres cellules !), tu es d’une incroyable gentillesse ; Lucile et Laure qui m’ont aussi beaucoup aidé pour les manip, votre bonne humeur a été très appréciable. Un grand merci à Audrey qui de voisine de pipettes est devenue une amie de « pipelettes », de covoiturage, de petites bouffes entre amis, de ciné… Tu as été un soutien considérable : toujours là quand on a besoin de réconfort, détente et rire, avec des conseils toujours justes et appropriés. Surtout ne change pas…
Je remercie les membres des équipes de Roland, Daniel et Nicolas. Leur disponibilité, leur gentillesse et leur gaité permettent de travailler dans de très bonnes conditions. J’espère retrouver cette ambiance de travail conviviale aux Etats-Unis.
Mes derniers remerciements professionnels s’adressent aux personnels des plateaux techniques, en particulier le personnel de l’animalerie, de cytométrie en flux et d’histologie. Votre compétence, disponibilité et gentillesse furent d’une aide indispensable.
Mes remerciements vont maintenant à la famille et aux amis qui représentent des piliers inestimables dans la vie.
Tout d’abord, merci à mes parents et ma Galotte pour leur soutien et leur compréhension. Tous les bons moments passés ensemble (beaux voyages, week-ends…) sont inoubliables et indispensables pour décompresser un peu. Vivement les prochains… Istanbul en perspective puis les Etats-Unis !
Je remercie mes copains de l’escalade : Camille (dit p’tit gros) et Aitzi, Guillaume (dit Dsp), Pierre, Seb (dit Sichi) et Lorène, François, Yan et Sabrina, Guillaume (dit Gluck), Gaël et Elo, Sonia, Mathieu, Jeff et Chris, Alice,… Vous m’avez permis de m’évader et de passer de très bons moments remplis de fous rires. Merci d’avoir été aussi compréhensifs (surtout quand vous m’avez emmené en falaise, mes publis, mon ordi et moi !). « On s’casssse ! ». Un énorme merci à mes copains de Bordeaux, toujours dans mon cœur malgré la distance…
Enfin, un énorme (et le mot est faible) à mon Julien qui est un être exceptionnel. Ta gentillesse, ta compréhension et surtout ton amour sont des éléments clés de ma réussite. Cette thèse est un peu aussi la tienne… Merci pour tous les bons moments passés ensemble et tous ceux à venir !
Sommaire
Liste des abréviations 6
Liste des illustrations 8
Résumé 11
Abstract 12
Avant propos 13
INTRODUCTION 15 I Développement thymique des lymphocytes Tαβ conventionnels 16 1 Le choix du lignage T et expression du pré-TCR 16
2 La sélection β 20
3 La sélection positive des lymphocytes T 21
4 Choix du lignage CD4/CD8 22
4.1 Le modèle stochastique 25
4.2 Le modèle instructif et le concept de la « force du signal » 25 4.3 Le modèle de la « durée du signal » 26 4.4 Modèle de la cinétique de signalisation : un modèle consensus non classique 28 4.5 Mécanismes moléculaires du choix du lignage CD4/CD8 30
II La tolérance centrale 35
1 Mécanisme de la délétion clonale 35
2 Les acteurs cellulaires et moléculaires de la délétion clonale 37
III La tolérance périphérique 40
1 La tolérance passive 42
1.1 L’ignorance 42
1.2 L’anergie conale 42
1.3 La déviation immune 43
1.4 La délétion clonale 43
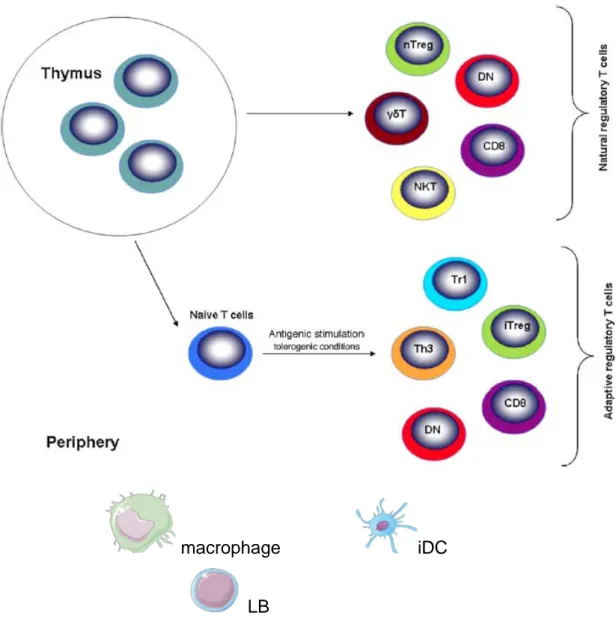
2 La tolérance dominante 44
2.1 Existence de différentes populations régulatrices 44 2.2 Développement thymique des lymphocytes Tαβ régulateurs Foxp3+ 46
2.3 Phénotype des nTreg 52
2.4 Découverte du facteur de transcription des Treg : Foxp3 53
2.5 Contrôle de l’homéostasie des Treg 56
2.6 Recirculation et localisation des Tregs 59
2.7 Mécanismes d’action des Treg 62
2.8 Treg et contrôle des différentes réponses immunes 66 2.9 Conséquences d’un défaut qualitatif et/ou quantitatif des Treg 68 IV La réponse immunitaire orchestrée par les lymphocytes T CD4 effecteurs 69
1 Fonctions des lymphocytes T CD4 effecteurs 70
2 Différenciation des lymphocytes T CD4 naïfs en cellules effectrices 72 3 Les voies de signalisation spécifiques à chaque lignage Th 74
3.1 Voie de signalisation Th1 74
3.2 Voie de signalisation Th2 75
3.3 Voie de signalisation Th17 76
3.5 Inter-‐régulation entre facteurs de transcription de chaque lignage 77 V L’intestin : un organe paradoxal d’un point de vu immunologique 77
1 Anatomie de l’intestin 80
2 Les tissus lymphoïdes associés aux intestins 82
3 Les cellules épithéliales intestinales : la première barrière 82
4 Le système immunitaire intestinal 84
4.1 Le système immunitaire inné 84
4.2 Le système immunitaire adaptatif 88
4.3 Rôle de la flore intestinale 88
5 Mécanismes de tolérance intestinale 91
5.1 L’ignorance intestinale 91
5.2 Mécanismes actifs de tolérance 91
VI Les maladies chroniques inflammatoires des intestins 98
1 Physiopathologie des maladies chroniques inflammatoires des intestins 101 1.1 Rôle de la flore commensale intestinale 101 1.2 Rupture de la fonction de barrière des cellules épithéliales intestinales 102
1.3 Rôle des cellules myéloïdes 102
1.4 Rôle des lymphocytes T CD4 effecteurs 104
1.5 Défauts de la population Treg 107
2 Etiologie des maladies chroniques inflammatoires des intestins 108
2.1 Facteurs génétiques 110
2.2 Facteurs environnementaux 115
3 Traitements des maladies chroniques inflammatoires des intestins 115 4 Modèles animaux des maladies chroniques inflammatoires des intestins 116 4.1 Modèles induits par des molécules chimiques 117 4.2 Modèles induits par manipulations génétiques 118 4.3 Le modèle de transfert cellulaire adoptif 120
4.4 Les modèles animaux spontanés 121
OBJECTIFS 125
RESULTATS 126
Résumé de l’article 127
Article 129
Résultats supplémentaires 172
DISCUSSION GENERALE ET PERSPECTIVES 175
Liste des illustrations et tables
Figure 1. Les stades de différenciation des thymocytes.
Figure 2. La localisation des thymocytes dans le thymus selon leurs stades de différenciation.
Figure 3. Les premiers modèles de choix du lignage T CD4/CD8.
Figure 4. Expression des corécepteurs CD4 et CD8 à la surface des thymocytes. Figure 5. Modèle de la cinétique de signalisation : un modèle consensus de choix du lignage CD4/CD8.
Figure 6. Mécanismes moléculaires du choix du lignage T CD4/CD8. Figure 7. Les différents mécanismes de tolérance centrale.
Figure 8. Sélection des thymocytes selon leur affinité pour les complexes CMH-peptide du soi.
Figure 9. Répertoire antigénique des mTEC et DC thymiques.
Figure 10. Les différents mécanismes de tolérance périphérique passive. Figure 11. Existence de différentes populations régulatrices.
Figure 12. Modèle de différentiation des Treg à deux étapes.
Figure 13. Modèle hypothétique de sélection des Treg selon l’affinité de leur TCR. Figure 14. Importance chez la souris (A) et l’homme (B) de l’existence des lymphocytes T CD4 régulateurs Foxp3+.
Figure 15. L’IL-2, une cytokine majeure pour l’homéostasie des Treg. Figure 16. Rôle de l’acide rétinoïque dans la localisation des Treg.
Figure 17. Mécanismes de suppression des Treg directement dur les Tconv. Figure 18. Mécanismes de suppression des Treg sur les Tconv via les CPA. Figure 19. Les différentes sous-populations T CD4 effectrices.
Figure 20. Anatomie de l’appareil digestif.
Figure 21. Représentation schématique de la paroi de l’intestin grêle Figure 22. Les GALT.
Figure 23. Capture de l’antigène au sein des GALT.
Figure 24. La réponse immune physiologique au niveau des intestins.
Figure 25. Balance entre les micro-organismes constituant la flore intestinale symbiotique et les micro-organismes pathogènes.
Figure 26. Les niches intestinales de Treg.
Figure 27. Répartition des différentes populations de Treg au niveau de l’intestin. Figure 28. Réponse immune en cas de MICI.
Figure 29. Les MICI : des pathologies multifactorielles. Figure 30. Découverte des gènes de susceptibilité aux MICI. Figure 31. Structure de la protéine Themis.
Figure 32. Voie de signalisation proximale du TCR.
Figure 33 : Themis, un nouvel acteur de la signalisation proximale du TCR. Figure 34 : Modèle biphasique de différenciation en LT Th2.
Figure 35 : Représentation schématique de partenaires de NFAT et de leur rôle. Figure 36 : Arbre phylogénétique de 132 souches de rats de laboratoire.
Figure 37 : Importance des GWAS pour la découverte de région de susceptibilité à des pathologies auto-immunes.
Figure 38 : Un locus ou un gène prédispose à plusieurs désordres auto-immuns. Figure 39 : Un polymorphisme dans une locus contenant Themis confère une susceptibilité à la SEP.
Table 1. Caractéristiques de la MC et de la RCH.
Table 2. Modèles de MICI dépendant des lymphocytes T CD4. Table 3. Gènes de susceptibilité à la MC et/ou la RCH.
Table 4. Modèles animaux de MICI causés par un défaut de Treg.
Table 5. Modèles animaux de MICI causés par une activation excessive des LT CD4 effecteurs.
Liste des abréviations
- AIRE : autoimmune regulator - AP-1 : activator protein-1
- APECED : autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy - BN : Brown Norway
- CD : classe de différenciation - Ced : maladie Coeliaque
- CMH : molécule majeure d’histocompatibilité - CPA : cellule présentatrice d’antigènes
- cTEC : cellule épithéliale thymique
- CTLA-4 : cytotoxic T lymphocyte associated antigen-4 - DAG : di-acyl-glycérol
- DC : cellule dendritique - DN : double négatif - DP : double positif
- DSS : dextran sodium sulfate
- ERK : extracellular signal-regulated kinase - ETP : early thymic progenitor
- Foxp3 : Forkhead box P3 immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome
- GALT : intestinal-associated lymphoid tissue ou tissus lymphoïdes associés aux intestins
- GATA3 : GATA-binding protein
- GITR : glucocorticoid induced tumor necrosis factor family-related gene/protein
- GWAS : Genome-wide association studies ou étude d’association génomique - ICOS : inducible costimulator
- IEC : cellule épithéliale intestinale - IEL : lymphocyte intra-épithélial - IFN : interféron
- Ig : immunoglobuline - IL : interleukine
- IPEX : immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome
- LAP : latency-associated peptide - LAT : linker for activation of T cells - LB : lymphocyte B
- Lck : lymphocyte-specific protein tyrosine kinase - LT : lymphocyte T
- MALT : mucosa-associated lymphoid tissue ou tissus lymphoïdes associés aux muqueuses
- MC : maladie de Crohn
- MICI : maladie inflammatoire des intestins - mLN : ganglion lymphatique mésentérique - mTEC : cellule épithéliale thymique médullaire - NFAT : nuclear factor of activated T cells - NK : natural killer
- PLCγ1 : phospholipase Cγ1 - RA : acide rétinoïque
- RAG : recombination activating gene - RCH : rectocolite hémorragique
- RORγt : Retininoic acid-related orphan receptor γt - Runx : runt-related transcription factor
- SNP : single nucleotide polymorphism - SP : simple positif
- STAT : Signal Transducers and Activators of Transcription - T-bet : T-cell-specific T-box transcription factor
- Tconv : lymphocyte T CD4 régulateur CD25+ Foxp3+ - TCR : T cell receptor ou récepteur des lymphocytes - TGF-β : transforming growth factor-β
- Th : lymphocyte T CD4 helper ou auxiliaire
- Th-POK : T-helper-induicing POZ/Kruppel-like factor - TLR : Toll like-receptor
- TNBS : acide trinitro benzene sulfonique - TNF : tumor necrosis factor
- TRA : antigène restreint aux tissus
Résumé
Les maladies inflammatoires chroniques de l’intestin sont des désordres chroniques inflammatoires dont l’étiologie est complexe et multifactorielle (facteurs environnementaux et génétiques). Le défi actuel est l’identification de variants alléliques responsables du développement de ces pathologies et l’analyse de leur contribution dans la physiopathologie. De façon intéressante, nous avons identifié une mutation spontanée dans la souche de rat Brown-Norway (BN) responsable d’une lymphopénie restreinte au compartiment T CD4, prenant origine dans le thymus et intrinsèque aux cellules T. Cette mutation a été fixée et une nouvelle lignée générée a été appelée BNm pour “BN muté”. Les rats BNm développent spontanément des lésions inflammatoires affectant toutes les parties de l’intestin. Macroscopiquement, elles se caractérisent par la présence d’oedèmes et d’érythèmes associée à un épaississement de la paroi intestinale. Les analyses histologiques ont révélé des infiltrations multifocales de la paroi intestinale, composés de cellules polynucléaires, de macrophages et de quelques cellules T ; et la présence de granulomes. Cette infiltration cellulaire a été confirmée par une augmentation de l’activité de la myéloperoxidase et de l’expression de cytokines pro-inflammatoires au sein des tissus lésés. Ainsi, les caractéristiques de l’inflammation intestinale développée par les rats BNm sont similaires à celles décrites chez les patients atteints de la Maladie de Crohn. Cette pathologie est associée à une hyperactivation des lymphocytes T CD4 en périphérie. Les lymphocytes T CD4 issus de rats BNm présentent un profil de sécrétion de cytokines altéré caractérisé par une sécrétion augmentée d’IL-4, d’IL-5, d’IL-13 et d’IL-17A. De plus, les lymphocytes T régulateurs CD4+ CD25+ des rats BNm présentent un défaut fonctionnel in vitro qui est associé avec le développement de l’inflammation intestinale. En effet, la prévalence et la sévérité du désordre intestinal peuvent être fortement réduites par le transfert de lymphocytes T régulateurs sauvages. Enfin, une analyse de liaison suivie d’une dissection génétique nous a permis d’identifier Themis comme le gène muté chez les rats BNm. Ainsi, Themis peut être considéré comme un gène candidat de susceptibilité aux pathologies inflammatoires chroniques compte tenu de son rôle dans l’homéostasie de l’intestin.
Abstract
Inflammatory bowel diseases (IBD) are chronic inflammatory disorders caused by multifactorial factors in a genetically predisposed host. The current challenge lies on the identification of the causal gene variants and on the analysis of their contribution to disease physiopathology. We identified a spontaneous mutation in Brown-Norway rats responsible for a lymphopenia restricted to the CD4 T cell compartment that originates from the thymus and is T cell autonomous. This mutation was fixed and named BNm for “BN mutated”. Interestingly, BNm rats spontaneously develop inflammatory lesions on all sections of the intestine. Oedema and erythema associated with a shortening of the intestine and thickening of the intestinal wall were evidenced. Histological analysis revealed intestine wall multifocal infiltration composed of polynucleated cells, macrophages with few T cells. Granuloma were often observed. This infiltration was confirmed by an increased myeloperoxidase activity and high levels of proinflammatory cytokines in injured tissus. Thus, the intestinal inflammation developed by BNm rat shares many features with Crohn’s disease. This disease is concomitant with CD4 T cell hyperactivation in secondary lymphoid organs. CD4 T cells from BNm rat present an altered cytokine profile with an increased secretion of IL-4, IL-5, IL-13 and IL-17A, compared to control rats. Furthermore, BNm deficiency leads to impaired regulatory T cell function in vitro and is associated with IBD development. Indeed, the occurrence of the pathology can be prevented by transfer of wild type regulatory T lymphocytes. Linkage analysis and a genetic dissection led us to identify Themis as the mutated gene. Thus, Themis should be considered henceforth as a candidate susceptibility gene for chronic inflammatory diseases through its effects on CD4 T cell polarization and regulatory T cell suppressive functions.
Avant propos
Les maladies inflammatoires chroniques de l’intestin (MICI), qui regroupent la maladie de Crohn et la rectocolite hémorragique sont des désordres inflammatoires chroniques affectant le tube digestif. Elles représentent actuellement un problème majeur de santé publique. En effet, ces 50 dernières années, ces pathologies ont connu une progression importante et touchent aujourd’hui plus d’une personne sur 1000 dans les pays industrialisés. "Multifactorielles", elles résultent d’interactions complexes entre plusieurs gènes et divers facteurs environnementaux. Par conséquent, il est important de comprendre le contrôle génétique et la physiopathologie de ces maladies au niveau cellulaire et moléculaire afin de développer de nouvelles stratégies thérapeutiques. Cependant, chez l'Homme, leur étude génétique se heurte à l'hétérogénéité génétique des populations et à la variabilité des facteurs environnementaux. L'utilisation de modèles murins permet de contourner ces difficultés (lignées pures génétiquement homogènes, environnement "contrôlé"). La connaissance des régions de synténie entre les génomes humain et des espèces animales permet l'application des résultats expérimentaux à la pathologie humaine.
Actuellement, la majorité des gènes associés au développement des MICI sont des gènes codant pour des protéines nécessaires à la fonction du système immunitaire suggérant ainsi que ces maladies résultent d’une dérégulation du système immunitaire. Cependant, le nombre de gènes responsables clairement identifiés reste faible. De plus, les mécanismes cellulaires et moléculaires par lesquels ces gènes influencent les MICI restent inconnus. L’enjeu actuel est de découvrir de nouveaux gènes responsables du développement des MICI chez l’Homme et de disséquer les mécanismes physiopathologiques mis en jeu. Pour cela, il faudrait disposer de modèles animaux de MICI reproduisant au mieux la physiopathologie des MICI humaines.
Dans ce contexte, le but de ma thèse a consisté à identifier le gène muté chez la souche de rat Brown-Norway, gène responsable du développement spontané d’une MICI dont les lésions macroscopiques et microscopiques sont similaires à celles décrites chez les patients atteints de la maladie de Crohn. Les mécanismes cellulaires impliqués dans la physiopathologie de cette MICI ont été disséqués. Avant de présenter les résultats de cette étude, une introduction va synthétiser nos
connaissances actuelles sur le développement des lymphocytes Tαβ, les mécanismes de tolérance.
I Développement thymique des lymphocytes T
αβ
conventionnels
La moelle osseuse et le thymus sont les deux organes lymphoïdes primaires assurant la génération des cellules composant le sang : les érythrocytes et les cellules du système immunitaire quelque soit leur origine, myéloïde ou lymphoïde. Les cellules composant la lignée myéloïde sont les monocytes, macrophages, cellules dendritiques (DC) et granulocytes. La lignée lymphoïde comprend les lymphocytes B (LB) et T (LT).
Le processus de maturation des érythrocytes, des cellules d’origine myéloïde et des LB a entièrement lieu dans la moelle osseuse. Les LT, quant à eux, commencent leur différenciation dans la moelle osseuse et l’achèvent dans le thymus, à l’exception d’une sous-population de LT intraépithéliaux qui termine leur maturation au niveau de l’intestin (Rocha 2007; Cheroutre and Lambolez 2008). Deux populations de LT se développent dans le thymus : les LT exprimant un récepteur T (TCR) γδ et les LT portant un TCRαβ. Ces derniers comprennent des LT effecteurs et régulateurs.
1 Le choix du lignage T et expression du pré-TCR
Les cellules migrant de la moelle osseuse vers le thymus sont en nombre restreint et appelées ETP (early thymic progenitors). Ces cellules atteignent la jonction cortico-médullaire du thymus grâce à l’expression de différentes molécules telles que les récepteurs aux chimiokines CCR (Chemokine (C-C motif) receptor) 7 et CCR9 (Uehara, Grinberg et al. 2002; Uehara, Song et al. 2002; Krueger, Willenzon et al. 2010) ainsi que la molécule d’adhésion PGL1 (P-selectine glycoprot ligand 1) (Rossi, Corbel et al. 2005) et l’intégrine α4β7 (Scimone, Aifantis et al. 2006).
Extrait de Fayard et al., Science Signaling, 2010 (Fayard, Moncayo et al. 2010).
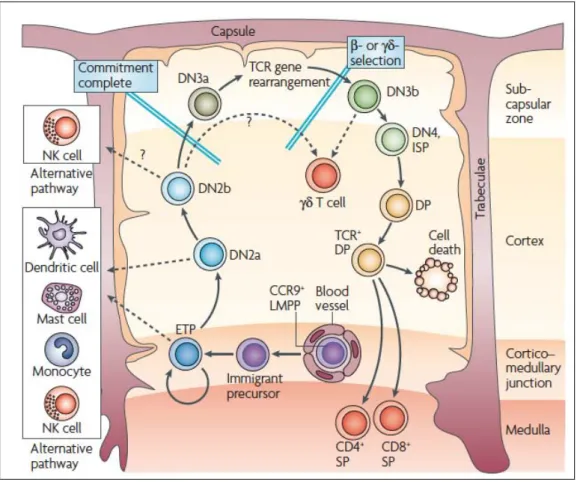
Figure 1. Les stades de différenciation des thymocytes.
Dans le thymus, la maturation des LT est divisée en différents stades de différenciation. Plusieurs points de contrôle rythment la différenciation des thymocytes. Au stade DN3, la sélection β permet de contrôler la fonctionnalité de la chaine β réarrangée du TCR. Puis, seuls les thymocytes DP reconnaissant les complexes CMH-peptides du soi avec une affinité intermédiaire survivent à la sélection positive et négative et deviennent des cellules CD4 ou CD8 SP.
Les ETP sont des cellules multipotentes, caractérisées par l’expression des molécules membranaires c-Kit, Sca et par l’absence d’expression de Lin, CD25, CD4 et CD8 (Bhandoola, von Boehmer et al. 2007; Schwarz, Sambandam et al. 2007). L’absence de ces deux derniers marqueurs permet de les nommer cellules double négatives (DN). Ces cellules représentent 2 à 5% des thymocytes. Le stade DN se divise en quatre stades de différenciation définis sur la base de l’expression des molécules CD44 et CD25 (Godfrey and Zlotnik 1993) (Figure 1). Les DN1 (CD44+CD25-) sont les cellules les plus immatures. Les stades suivants sont DN2 ou cellules pro-T (CD44+CD25+), DN3 ou cellules pre-T précoces (CD44-CD25+) et enfin DN4 ou cellules pre-T tardives (CD44-CD25-). Ces étapes de différenciation ont lieu dans le cortex thymique.
La perte de la multipotence des DN est progressive et les engage dans le lignage T. Les DN1 se divisent peu et peuvent encore se différencier en LB, monocytes, mastocytes, natural killer (NK) et DC (Figure 2). Les progéniteurs DN2 ont perdu leur capacité à se différencier en LB mais peuvent encore s’engager dans le lignage des DC. Le passage du stade DN2 à DN3 engage définitivement les thymocytes dans le lignage T. Différents facteurs régulent l’engagement dans ce lignage : Notch1 est nécessaire mais pas suffisant (Maillard, Fang et al. 2005; Chi, Bell et al. 2009; Radtke, Fasnacht et al. 2010). D’autres facteurs de transcription, tels que les protéines Runx1 (runt-related transcription factor), GATA-3 (GATA-binding protein-3) et E-box, coopèrent avec Notch1 pour initier la différenciation T (Rothenberg, Moore et al. 2008). L’engagement dans le lignage T se caractérise notamment par l’expression des enzymes RAG (recombination activating genes) 1 et 2 permettant le réarrangement des gènes somatiques codant pour les chaînes β, γ et δ du récepteur T à l’antigène (Mombaerts, Iacomini et al. 1992; Shinkai, Rathbun et al. 1992). Ce processus associe trois segments de gènes séparés les uns des autres dans la lignée germinale : les segments V (variable), D (diversity) et J (joining) (Brandt and Roth 2002). Ils codent pour le domaine variable du TCRαβ impliqué dans la reconnaissance de l’antigène. Ce mécanisme est appelé « recombinaison VDJ ». Il est complexe, aléatoire et permet la génération d’un grand nombre de TCRαβ de spécificités différentes. Au stade DN3, il permet l’expression du TCRγδ et du pré-TCR. Le pré-TCR est constitué de la chaîne β réarrangée associée aux chaînes CD3 et pré-Tα (Saint-Ruf, Ungewiss et al. 1994). En l’absence de chaîne α
Extrait de Rothenberg et al., Nature Reviews Immunology, 2008 (Rothenberg, Moore et al. 2008).
Figure 2. La localisation des thymocytes dans le thymus selon leurs stades de différenciation.
Les ETP migrent de la moelle osseuse vers le thymus via la circulation sanguine. Certaines de ces cellules multipotentes vont progressivement s’engager dans le lignage T. Dans le cortex thymique, les cellules Double Négative (DN) vont alors se différencier en thymocytes Doubles Positifs (DP). Puis, la maturation des cellules CD4 et CD8 Simple Positives (SP) a lieu dans la médulla thymique.
NK : cellule Natural killer, iSP : cellule immature SP.
réarrangée, la chaîne pré-Tαpermet l’expression stable de la chaîneβ. Les thymocytes exprimant un TCRγδ fonctionnel se différencient en LTγδ alors que les cellules exprimant le pré-TCR s’engagent dans le lignage Tαβ (Rothenberg 2002).
2 La sélection β
La sélection β est le premier point de sélection des futurs LTαβ. Elle consiste à vérifier la fonctionnalité de la chaîne β réarrangée. A cause des délétions et insertions de nucléotides concomitantes à la recombinaison VDJ, la plupart des réarrangements du TCRβ sont incorrects et n’aboutissent pas à la synthèse d’une protéine fonctionnelle. Durant la sélection β, une signalisation via le pré-TCR, le récepteur pour la chimiokine SDF1 (stromal cell-derived factor-1) , CXCR4 (CXC-chemokine receptor-4) (Janas, Varano et al. 2010; Trampont, Tosello-Trampont et al. 2010), et Notch1 (Ciofani, Knowles et al. 2006; Maillard, Tu et al. 2006), sont nécessaires pour la survie et l’entrée dans le dernier cycle important de prolifération ayant lieu dans le thymus. Seuls les thymocytes sélectionnés positivement suite à l’expression d’une chaîne β fonctionnelle atteignent le stade DN4. Les thymocytes entrent ensuite dans une phase de repos. Ils cessent de proliférer et diminuent l’expression des enzymes RAG1/2 ce qui exclue toute possibilité d’exprimer un second pré-TCR. Ce processus est appelé « exclusion allélique » du locus TCRβ (Khor and Sleckman 2002). Ces thymocytes commencent à exprimer le corécepteur CD8 puis CD4 devenant ainsi des cellules double positives (DP). A ce stade, l’expression du pré-TCR diminue. Le réarrangement des segments V et J codant pour la chaîne α du TCR commence, après réexpression de la machinerie protéique nécessaire à ce processus. Si ce réarrangement n’est pas fonctionnel, un second réarrangement le remplace. Ce prsocessus est répété jusqu’à l’appariement correct des chaînes α et β (Borgulya, Kishi et al. 1992). Le complexe entier du TCRαβ est alors exprimé à la membrane cellulaire.
La transition des DP en LT matures nécessite des étapes supplémentaires de sélection permettant la génération d’un répertoire de LT matures utiles et non auto-réactifs. Ces points de contrôle correspondent à la sélection positive et négative que nous allons aborder dans les paragraphes suivants.
3 La sélection positive des lymphocytes T
La sélection positive est le processus qui permet de restreindre la spécificité des thymocytes au CMH du soi, sélectionnant ainsi les LT « utiles » à l’organisme (Zerrahn, Held et al. 1997). Elle a lieu dans le cortex thymique.
Ce processus de sélection positive a principalement été étudié dans des modèles de souris chimériques. Le compartiment hématopoïétique, compartiment radiosensible, est détruit par irradiation létale puis reconstitué suite à une greffe de moelle osseuse. Les cellules radiosensibles sont ainsi d’origine du donneur alors que les cellules radiorésistantes sont d’origine du receveur. Ces travaux ont révélé que la spécificité des LT est restreinte par le CMH exprimé par les cellules radiorésistantes du receveur (Bevan 1977; Zinkernagel, Callahan et al. 1978). Le rôle du thymus a ensuite été montré lors d’expériences de chimères thymectomisées puis greffées avec des thymus allogéniques. Les LT présents dans ces souris sont restreints par le CMH exprimé par l’épithélium thymique transplanté (Fink and Bevan 1978; Zinkernagel, Callahan et al. 1978). Compte tenu de la grande diversité des TCR générés suite à la recombinaison somatique, la sélection positive permet d’éliminer les thymocytes qui ne reconnaissent pas le complexe ligand-CMH du soi, soit 85% des thymocytes (Merkenschlager, Graf et al. 1997). Ces thymocytes ne reçoivent pas de signal par leur TCR et meurent alors par « négligence ».
Au niveau cellulaire, les thymocytes DP sélectionnés positivement reçoivent un signal de survie leur permettant de continuer leur maturation en LT. Ce signal est délivré suite à la reconnaissance de peptides présentés via les molécules du CMH à la surface des cellules épithéliales du cortex thymique (cTEC). L’expression des molécules de CMH (complexe majeur d’histocompatibilité) de classe I et II uniquement à la surface des cTEC suffit à la génération de LT (Cosgrove, Chan et al. 1992; Laufer, DeKoning et al. 1996; Capone, Romagnoli et al. 2001). Au contraire, l’expression des molécules de CMH de classe I et II restreinte aux mTEC ne permet pas la production de cellules T (Cosgrove, Chan et al. 1992). Nos connaissances actuelles sur la nature de ces ligands impliqués dans la sélection positive sont limitées. In vivo, une corrélation positive existe entre la diversité des peptides présentés par les cTEC et la complexité du répertoire des cellules T (Goldrath and Bevan 1999). Les cTEC possèdent leur propre machinerie moléculaire nécessaire à l’apprêtement et la présentation de l’antigène. Elle se caractérise principalement par
leur capacité macroautophagique (Nedjic, Aichinger et al. 2008) et l’expression de cathepsines, en particuliers la cathepsine L (Honey, Nakagawa et al. 2002), de la TSSP (peptidase thymus-specific serine protease) (Gommeaux, Gregoire et al. 2009) et du thymoprotéasome (Murata, Sasaki et al. 2007). Ainsi, ils génèreraient des peptides qui sont différents de ceux utilisés par les cellules présentatrices d’antigènes (CPA) thymiques et périphériques.
4 Choix du lignage CD4/CD8
La co-expression des co-récepteurs CD4 et CD8 est une caractéristique unique aux thymocytes DP. Les co-récepteurs CD4 et CD8 sont des protéines transmembranaires requises pour la signalisation par le TCR. Leurs domaines extracellulaires se lient spécifiquement à des motifs invariants des molécules du CMH de classe II et I respectivement. Leurs domaines intracellulaires sont nécessaires pour la transduction du signal. Ils permettent le recrutement et l’activation de la tyrosine kinase Lck (lymphocyte-specific protein tyrosine kinase) impliquée dans l’initiation de la transduction du signal via le TCR (Doyle and Strominger 1987; Norment, Salter et al. 1988; Shaw, Schroter et al. 1989; Turner, Brodsky et al. 1990). Les thymocytes DP, qui expriment simultanément ces deux co-récepteurs, reçoivent des signaux via leur TCR indépendamment de leur restriction aux molécules du CMH de classe I ou II. Ainsi, théoriquement, tous les TCR potentiellement « utiles » peuvent générer un signal de sélection positive qui protège les cellules DP de la mort cellulaire. Les thymocytes DP sélectionnés positivement atteignent alors le dernier stade de maturation dans le thymus : les stades simple positif (SP) CD4 (CD4+CD8-) ou CD8 (CD4-CD8+) (Figure 1) (Ellmeier, Sawada et al. 1999). Cette dernière étape de différenciation des thymocytes DP implique la baisse de l’expression d’un des deux corécepteurs et le choix définitif du lignage CD4 ou CD8. Deux principaux modèles ont été proposés pour expliquer ce choix : les modèles stochastique ou instructif. Ils se distinguent principalement par l’arrêt aléatoire ou instruite, respectivement, de la transcription d’un des deux corécepteurs. Les modèles de choix du lignage CD4/CD8 initialement conçus devaient représenter deux modèles extrêmes couvrant l’ensemble des possibilités logiques (Janeway 1988). Depuis, la révision de ces deux modèles a abouti à l’intégration de deux
Extrait de Singer et al., Nature Reviews Immunology, 2008 (Singer, Adoro et al. 2008).
Figure 3. Les premiers modèles de choix du lignage T CD4/CD8.
Les mécanismes sous-jacents au choix du lignage CD4/CD8 ont été expliqués via différents modèles. (a) Le premier fut le modèle stochastique. Il propose que les thymocytes cessent d’exprimer le corécepteur CD4 ou CD8 de façon aléatoire. (b) Le choix du lignage d’après le modèle instructif et de la « force du signal » est dépendant de la force du signal reçu par le TCR. Si ce signal est intense, le thymocyte DP se différencie en cellules CD4 SP. (c) Un autre modèle fut proposé
suite à l’ajout d’une nouvelle notion, la « durée du signal ». Un signal long et/ou intense favorise l’engagement du thymocyte dans le lignage CD4.
nouvelles notions : la « force » et la « durée » du signal reçu par le TCR (Singer, Adoro et al. 2008) (Figure 3).
4.1 Le modèle stochastique
Ce premier modèle (Figure 3a) suggère que l’arrêt de la transcription du gène
CD4 ou CD8 a lieu de façon aléatoire (Chan, Cosgrove et al. 1993; Davis, Killeen et
al. 1993) et qu’une seconde étape de survie dépendante du TCR (appélée « rescue step ») est nécessaire durant la sélection positive. Par conséquent, seuls les thymocytes SP exprimant un TCR dont la spécificité est appariée à l’expression du corécepteur survivent et se différencient en LT matures. Mais, les principes essentiels de ce modèle furent contredits par des observations expérimentales (Keefe, Dave et al. 1999; Itano and Robey 2000; Sarafova, Erman et al. 2005). Par exemple, le découplage entre la restriction du TCR pour la molécule du CMH II et son engagement dans le lignage CD8 invalide ce modèle (Sarafova, Erman et al. 2005).
4.2 Le modèle instructif et le concept de la « force du signal »
Le modèle instructif du choix du lignage CD4/CD8 postule que lors de la sélection positive, les signaux reçus via le TCR indiquent aux cellules DP de spécifiquement arrêter la transcription du corécepteur non apparié (Figure 3b). Par conséquent, ce modèle sous-entend que les signaux reçus par un TCR restreint aux molécules de CMH de classe I sont distincts de ceux transmis par un TCR restreint aux molécules de CMH de classe II. Dans le modèle original, les corécepteurs CD4 et CD8 ont été décrits comme transduisant des instructions qualitativement différentes (Seong, Chamberlain et al. 1992). Cependant, un modèle alternatif a été proposé suite à l’intégration d’une donnée supplémentaire, la « force du signal ». Les thymocytes DP seraient instruits par des différences dans la force du signal reçu après co-engagement simultané du TCR et du corécepteur lors de la sélection positive (Itano, Salmon et al. 1996). La partie cytoplasmique de la molécule CD4 liant significativement plus de tyrosine kinase Lck que la queue intracellulaire du CD8 (Shaw, Amrein et al. 1989; Wiest, Yuan et al. 1993), le co-engagement du TCR et du CD4 génère un signal plus fort que le co-engagement du TCR et du CD8. La force relative de ces signaux est à l’origine de l’arrêt spécifique de la transcription du gène
CD4 ou CD8 (Itano, Salmon et al. 1996). Mais des travaux ont ensuite révélé que la
force du signal n’impacte pas le choix du lignage CD4/CD8 et ont ainsi discrédité le modèle instructif et de la « force du signal » (Bosselut, Feigenbaum et al. 2001; Erman, Alag et al. 2006).
4.3 Le modèle de la « durée du signal »
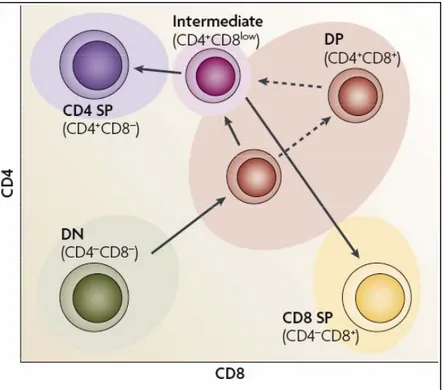
Ce dernier modèle est une alternative au modèle instructif et de la « force du signal » (Figure 3c). Une notion importante y a été ajoutée : la durée du signal transmis par le TCR. En plus de la force du signal, sa durée serait décisive dans le choix du lignage CD4/CD8. Dans ce modèle, les signaux de longue durée reçus par le TCR indiquent aux cellules DP de stopper la transcription du gène Cd8 et de se différencier en CD4 SP tandis que les signaux de courte durée entraînent l’arrêt de l’expression de la molécule CD4 et la maturation en CD8 SP (Yasutomo, Doyle et al. 2000). Tous les thymocytes DP ayant reçu un signal de survie lors de la sélection positive diminuent l’expression du corécepteur CD8 pour devenir des cellules CD4+CD8low, précurseurs communs des cellules CD4 et CD8 SP (Lundberg, Heath et al. 1995; Suzuki, Punt et al. 1995; Brugnera, Bhandoola et al. 2000) (Figure 4). Par conséquent, le signal reçu par les TCR restreints aux molécules de CMH de classe I dans les thymocytes CD4+CD8low est d’une plus courte durée que lorsque le signal est transmis par des TCR restreints aux molécules de CMH de classe II (Singer 2002). Cette diminution d’expression sélective pour le corécepteur CD8 s’explique par une baisse de la transcription du gène Cd8 et non par l’internalisation des corécepteurs CD8 présents à la surface cellulaire (Barthlott, Kohler et al. 1997; Bosselut, Guinter et al. 2003).
Ainsi, le concept de la durée du signal, en tant que déterminant majeur dans l’engagement dans le lignage CD4 ou CD8, est une caractéristique principale du modèle dernièrement établi : la cinétique de signalisation.
Extrait de Singer et al., Nature Reviews Immunology, 2008 (Singer, Adoro et al. 2008).
Figure 4. Expression des corécepteurs CD4 et CD8 à la surface des thymocytes.
Les thymocytes DN dépourvus des co-récepteurs CD4 et CD8 se différencient en cellules DP exprimant CD4 et CD8. Ces thymocytes DP diminuent ensuite l’expression de la molécule CD8 et sont qualifiés de cellules CD4+CD8low. Le processus de choix du lignage déterminera si la cellule CD4+CD8low deviendra CD4 ou CD8 SP. Dans le premier cas, elle cessera complètement d’exprimer le corécepteur CD8 tandis qu’une différenciation en thymocyte CD8 SP nécessite la réexpression du récepteur CD8 et l’arrêt de l’expression de la molécule CD4.
4.4 Modèle de la cinétique de signalisation : un modèle consensus non
classique
Ce dernier modèle réconcilie l’ensemble des différents principes des modèles classiques (Figure 5). Il propose que l’engagement dans le lignage CD4 ou CD8 est déterminé par la durée du signal transduit par le TCR et par le signal transmis par des cytokines, en particulier l’IL-7 (Brugnera, Bhandoola et al. 2000; Singer 2002; Singer and Bosselut 2004).
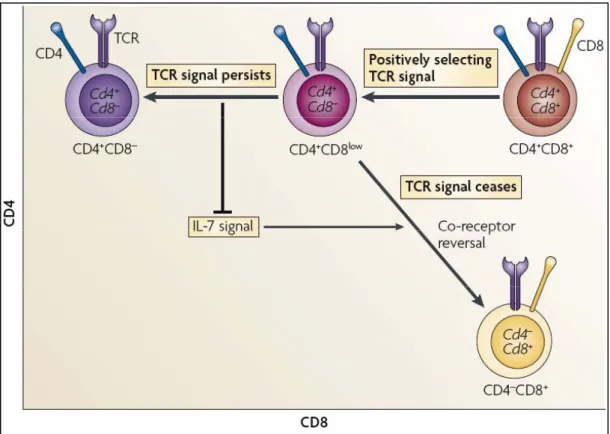
Le modèle de la cinétique de signalisation propose que, en premier lieu, les thymocytes DP sélectionnés positivement cessent d’exprimer le corécepteur CD8 (Brugnera, Bhandoola et al. 2000; Singer 2002; Singer and Bosselut 2004). Les signaux transmis par les TCR restreints aux molécules de CMH de classe II sont indépendants de la molécule CD8. Ils pourront donc persister en l’absence de la transcription du gène CD8 et aboutir à un engagement dans le lignage CD4. Au contraire, la signalisation des TCR restreints aux molécules de CMH de classe I cessera en l’absence de la transcription du gène CD8. La ré-expression du corécepteur CD8 sera initiée, permettant la génération de cellules CD8 SP. Ainsi, suite à la baisse d’expression du récepteur CD8, la durée de la signalisation transmise par le TCR permet précisément d’identifier le lignage approprié aux thymocytes.
Dans ce modèle, la sélection positive et le choix du lignage sont des évènements séquentiels et non concomitants. Ainsi, le choix du lignage s’effectue à ce stade de différenciation intermédiaire et est déterminé par la persistance ou l’arrêt du signal via le TCR. Ce modèle propose aussi que la persistance ou l’arrêt du signal via le TCR ait une corrélation inverse avec la signalisation induite par les cytokines dont le récepteur présente une chaîne commune γ. Cette famille de cytokines est appelée la famille de la chaîne γ commune aux récepteurs de cytokines. Elle regroupe l’IL-2, l’IL-4 l’IL-7, l’IL-9, l’IL-15 et l’IL-21. Ces cytokines, en particulier l’IL-7, jouent un rôle de senseur pour le signal induit par le TCR (Brugnera, Bhandoola et al. 2000; Singer 2002; Singer and Bosselut 2004).
Extrait de Singer et al., Nature Reviews Immunology, 2008 (Singer, Adoro et al. 2008).
Figure 5. Modèle de la cinétique de signalisation : un modèle consensus de choix du lignage CD4/CD8.
Le modèle de la cinétique de signalisation prend en compte la durée du signal reçu par le TCR ainsi que la nécessité de signaux transmis par des récepteurs aux cytokines. Un signal persistant par le TCR bloque la signalisation par l’IL-7R et entraîne la maturation de la cellule DP en thymocyte CD4 SP. Au contraire, l’arrêt de la signalisation par le TCR dans les cellules CD4+CD8low associé à une signalisation
par l’IL-7R permet l’engagement de ces thymocytes dans le lignage CD8. Ce modèle consensus est le dernier proposé.
4.5 Mécanismes moléculaires du choix du lignage CD4/CD8
La compréhension du choix du lignage CD4/CD8 a été améliorée suite à l’identification des facteurs de transcription impliqués dans la régulation de la transcription des gènes Cd4 et Cd8. Les facteurs les plus importants sont Th-POK (T-helper-inducing POZ/Kruppel-like factor, aussi nommé cKROX ou ZFP67), Runx3, TOX (thymus HMG (high-mobility group) box protein), GATA3 (Figure 6).
Th-POK
Le facteur de transcription Th-POK est une protéine à doigts de zinc codée par le gène Zbtb7b (zinc-finger-and-BTB-domain-containing7B) (He, Dave et al. 2005).
La découverte de ce facteur de transcrition fut fortuite : une mutation spontanée dans le gène Zbtb7b a eu lieu chez les souris HD (helper deficient) (He, Dave et al. 2005). Ces animaux présentent un défaut de différenciation thymique des thymocytes restreints aux molécules de CMH de classe II qui les redirige vers le lignage CD8 (Keefe, Dave et al. 1999). En périphérie, la conséquence est une lymphopénie T CD4. La mutation ponctuelle chez ces souris est située dans le second domaine à doigt de zinc de la protéine. Le facteur de transcription exprimé est ainsi incapable de se lier à l’ADN (He, Dave et al. 2005). Par conséquent, la différenciation en LT CD4 requière une molécule Th-POK fonctionnelle. Des expériences de surexpression de Th-POK durant le développement thymique ont révélé que la majorité des thymocytes se différenciait en cellules CD4 SP, indépendamment de la restriction au CMH de leur TCR (He, Dave et al. 2005; Sun, Liu et al. 2005). Ainsi, Th-POK est nécessaire et suffisant pour l’engagement dans le lignage CD4, il représente une molécule régulatrice majeure dans le choix du lignage CD4 et la maturation en LT CD4 (Kappes and He 2006). En accord avec ces résultats, la transduction rétrovirale de Th-POK dans les LT CD8 matures conduit à une diminution de leurs capacités cytotoxiques et au développement par ces LT CD8 de certaines caractéristiques des LT CD4 auxiliaires (Jenkinson, Intlekofer et al. 2007). Ce travail suggère que l’expression de Th-POK est continuellement réprimée dans les LT CD8 matures et révèle un certain degré de plasticité de cette population T.
Th-POK est tout d’abord exprimé par les thymocytes CD4+CD8low (He, Park et al. 2008) et son expression augmente suite à une signalisation persistante via le TCR (He, Park et al. 2008). Cette observation est en accord avec le concept du
Extrait de Singer et al., Nature Reviews Immunology, 2008 (Singer, Adoro et al. 2008).
Figure 6. Mécanismes moléculaires du choix du lignage T CD4/CD8.
L’expression de différents facteurs de transcription est requise lors de la différenciation des thymocytes en cellules CD4 ou CD8 SP. L’expression des facteurs nucléaires Th-POK et TOX engage les thymocytes CD4+CD8low dans le lignage CD4 SP. L’expression de Runx3 est décisive pour l’engagement dans le lignage CD8 SP.
modèle de la cinétique de signalisation. Au niveau moléculaire, Th-POK maintient la transcription du gène CD4 tout en empêchant celle de gènes impliqués dans la différenciation CD8, tels que Runx3 (Taniuchi, Osato et al. 2002). En périphérie, il est exprimé par les LT CD4 et non par les LT CD8 (He, Dave et al. 2005; Sun, Liu et al. 2005).
Les protéines Runx
Les protéines Runx sont des membres de la famille des facteurs de transcription à domaine « runt ». Ces protéines présentent des similarités structurelles et des sites conservés de liaison à l’ADN (Levanon and Groner 2004). Dans le thymus, Runx1 est principalement exprimé par les thymocytes DN et Runx3 par les cellules SP CD8 sélectionnées positivement (Taniuchi, Osato et al. 2002).
L’expression de Runx3 par les thymocytes sélectionnés positivement est faible (Liu, Taylor et al. 2005; Sato, Ohno et al. 2005). Elle augmente lors de la différenciation des cellules CD4+CD8low en thymocytes CD8 SP, permettant la réexpression du corécepteur CD8 (Sato, Ohno et al. 2005). Les protéines Runx1 et 3 se lient au répresseur transcriptionnel du gène Cd4 et inhibent l’expression du gène
Cd4. Ceci indique un rôle pour les protéines Runx dans le choix du lignage CD4/CD8
(Taniuchi, Osato et al. 2002). Enfin, ces protéines sont capables de se lier à une séquence du gène Zbtb7b et ainsi d’éteindre l’expression de Th-POK (Setoguchi, Tachibana et al. 2008), ce qui représente un autre moyen pour promouvoir la différenciation des thymocytes en CD8 SP. Selon le modèle de la cinétique de signalisation, la signalisation via l’IL-7 et certainement d’autres cytokines favorise directement la surexpression de Runx3 par les thymocytes au stade intermédiaire CD4+CD8low (Park, Adoro et al. 2010).
TOX
Le facteur de transcription TOX appartient à la famille des protéines à boîte HMG. Ces protéines possèdent un site de liaison à l’ADN (Schilham and Clevers 1998; Stros, Launholt et al. 2007). Il régule l’expression de gènes en modulant localement la structure de la chromatine et le recrutement d’autres facteurs nucléaires. L’augmentation de l’expression de TOX dans les cellules DP sélectionnées positivement jouerait un rôle dans la sélection positive et/ou le choix du lignage CD4/CD8 (Wilkinson, Chen et al. 2002). L’analyse de souris déficientes
pour ce facteur nucléaire révèle que la maturation des thymocytes sélectionnés positivement en cellules CD4+CD8low est interrompue. Ces cellules acquièrent un phénotype CD4lowCD8low. Le résultat est une absence de différenciation en LT CD4, mais pas en LT CD8 (Aliahmad and Kaye 2008). La protéine TOX est requis pour le maintien et la surexpression du corécepteur CD4 dans les thymocytes DP sélectionnés positivement (Aliahmad and Kaye 2008; Hedrick 2008). Ainsi, elle serait primordiale pour un signal persistant via le TCR dans les thymocytes CD4+CD8low et par conséquent pour la différenciation en LT CD4.
GATA3
Le gène GATA3 code pour un facteur de transcription de la famille GATA, protéines nucléaires à doigts de zinc. Il régule positivement la transcription de gènes à différents stades du développement thymique (Hendriks, Nawijn et al. 1999; Hernandez-Hoyos, Anderson et al. 2003). En effet, GATA3 est exprimé par les ETP et est requis pour la différenciation des thymocytes vers les stades DN (Hendriks, Nawijn et al. 1999). Il joue aussi un rôle important dans le développement des cellules CD4 SP. En effet, GATA3 est préférentiellement exprimé par les thymocytes CD4 SP (Hendriks, Nawijn et al. 1999). Son expression augmente dans les cellules sélectionnées positivement (Hernandez-Hoyos, Anderson et al. 2003). Une expression soutenue de GATA3 inhibe la différenciation en LT CD8 (Nawijn, Ferreira et al. 2001). De plus, son inactivation conditionnelle au stade DP diminue drastiquement le nombre de cellules CD4 SP mais pas celui des CD8 SP (Pai, Truitt et al. 2003). Cette étude révèle que GATA3 joue un rôle dans la survie et/ou la différenciation des thymocytes s’engageant vers le lignage CD4. Contrairement à Th-POK, GATA3 n’influencerait pas l’engagement dans le lignage CD4 (Hernandez-Hoyos, Anderson et al. 2003). Cependant, l’expression précoce de GATA3 par rapport à Th-POK ou RUNX3 dans les thymocytes nouvellement sélectionnés suggère qu’il fonctionne en amont de ces facteurs de transcription. Par conséquent, l’étude de son rôle dans le choix du lignage CD4/CD8 est plus difficile à analyser.
Extrait de Goodnow et al., Nature, 2005 (Goodnow, Sprent et al. 2005).
Figure 7. Les différents mécanismes de tolérance centrale.
Des LT auto-réactifs sont générés dans le thymus. La tolérance centrale permet de rendre silencieux les thymocytes potentiellement dangereux. Ces processus sont la délétion clonale (a), l’édition du récepteur (b) et la régulation par des facteurs intrinsèques et extrinsèques (c, d). L’anergie constitue un dernier processus (non illustré sur ce schéma).
II
La tolérance centrale
Chaque lymphocyte ne produit qu’un seul réarrangement V(D)J codant pour un TCR parmi des millions possibles. Si le TCR exprimé réagit avec une forte affinité pour le complexe CMH-peptide du soi, cette cellule est autoréactive et donc potentiellement dangereuse. Elle doit être neutralisée. Pour cela, différentes stratégies existent (Figure 7). L’anergie, la ré-édition du TCR et l’intervention de facteurs intrinsèques et extrinsèques rendent silencieux les thymocytes potentiellement néfastes. Ces stratégies sont donc fortement risquées, leur activation contre des antigènes du soi ne pouvant être totalement exclue. Par contre, la délétion clonale conduit à la mort les thymocytes potentiellement dangereux. Je vais donc me focaliser sur ce dernier mécanisme de tolérance centrale qui semble le plus efficace.
1 Mécanisme de la délétion clonale
Suite à la sélection positive qui enrichit la population T en cellules exprimant avec succès un TCR reconnaissant les complexes CMH-peptide du soi présentés par les cTEC, les thymocytes migrent dans la médulla thymique où ils y séjournent 4 à 5 jours avant d’atteindre la périphérie (McCaughtry, Wilken et al. 2007). C’est à ce niveau qu’a lieu la délétion clonale. Elle permet, via l’induction d’apoptose, l’élimination des thymocytes auto-réactifs, c’est-à-dire reconnaissant avec une forte affinité des peptides du soi (Figure 8). En effet, 20 à 50% des TCR générés suite à la recombinaison somatique des gènes V(D)J se lient aux antigènes du soi présentés par les molécules du CMH avec une affinité potentiellement dangereuse (Laufer, DeKoning et al. 1996; Zerrahn, Held et al. 1997).
Les souris exprimant un TCR transgénique représentent un modèle de choix pour analyser les mécanismes de la délétion clonale. Les expériences les plus pertinantes utilisent des souris exprimant un TCRαβ transgénique spécifique de l’antigène HY à partir stade DP (expression physiologique). Bien que les thymocytes DP exprimant le TCR spécifique de HY rencontrent cet antigène, la délétion clonale est effective au stade SP (Baldwin, Sandau et al. 2005). Ainsi, selon ce modèle, la délétion clonale aurait lieu à un stade tardif du développement thymique, au stade SP.
Extrait de Hogquist et al., Nature Reviews Immunology, 2005 (Hogquist, Baldwin et al. 2005).
Figure 8. Sélection des thymocytes selon leur affinité pour les complexes CMH-peptide du soi.
L’affinité du TCR pour le complexe CMH-ligand du soi exprimé à la surface des TEC et des CPA thymiques détermine le devenir du thymocyte. Si la reconnaissance de ce complexe est trop faible ou trop forte, les cellules meurent par négligence ou sélection négative respectivement. Une affinité intermédiaire permet la sélection positive du thymocyte et ainsi sa survie.
2 Les acteurs cellulaires et moléculaires de la délétion clonale
La médulla thymique joue un rôle crucial dans la sélection négative. Les souris déficientes pour les facteurs de transcription Rel-B (v-rel reticuloendotheliosis viral oncogene homolog B) (Burkly, Hession et al. 1995; Weih, Carrasco et al. 1995), TRAF6 (TNF receptor-associated factor 6) (Akiyama, Maeda et al. 2005) ou pour le récepteur à la lymphotoxine β (LT-βR) (Boehm, Scheu et al. 2003; Chin, Lo et al. 2003) présentent une jonction cortico-médullaire désorganisée associée à une médulla de taille réduite témoignant d’un nombre réduit de mTEC. Chez ces souris, la sélection positive semble normale mais la sélection négative est fortement perturbée ce qui prouve le rôle crucial de la zone médullaire dans ce processus. Les cellules responsable de la sélection négative sont les mTEC, cellules épithéliales radiorésistantes, et les DC, cellules d’origine hématopoïétiques et radiosensibles. La différence de radiosensibilité de ces deux types cellulaires a permis de décortiquer leur rôle respectif dans l’induction de tolérance au soi dans des expériences de chimères hématopoïétiques. Dans le thymus, la médulla est également le site principal d’expression de molécules de costimulation, nécessaire pour cette étape de sélection thymique.
Extrait de Klein et al., Nature Reviews Immunology, 2009 (Klein, Hinterberger et al. 2009).
Figure 9. Répertoire antigénique des mTEC et DC thymiques.
Les mTEC et les DC sont impliquées dans le processus de sélection négative des thymocytes auto-réactifs. Leur efficacité dépend des antigènes qu’elles apprêtent et présentent à leur surface. Sous le contrôle du facteur de transcription AIRE, les mTEC expriment de façon ectopique des antigènes normalement restreints aux tissus (TRA). Les DC présentent des ligands du soi de différentes origines. En effet, elles sont capables de capturer les TRA présentés par les mTEC. Des DC périphériques peuvent migrer par le sang depuis les tissus périphériques. Ainsi, les DC présenteraient des TRA mais également d’antigènes dérivés de la flore commensale et de l’alimentation.
Rôle des cellules épithéliales médullaires
Les mTECs sont des cellules distinctes des cTEC de part leur morphologie et leur expression génique. Elles sont capables d’induire l’anergie et la délétion des thymocytes potentiellement dangereux. Une avancée majeure dans la description des fonctions spécifiques des mTEC est la découverte du facteur de transcription AIRE (AutoImmune REgulator). Ce facteur de transcription permet aux mTEC l’expression ectopique d’antigènes dont l’expression est normalement restreinte aux tissus (TRA) (Figure 9) (Anderson, Venanzi et al. 2002). Chez l’Homme, une déficience en AIRE se traduit par le développement d’un syndrome auto-immun polyendocrinien appelé APECED pour « autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy” (Nagamine, Peterson et al. 1997). Il se caractérise par une candidose cutanéo-muqueuse, une hypoparathyroïdie et une insuffisance rénale d’origine auto-immune (Ahonen 1985; Ahonen, Miettinen et al. 1987). Les souris déficientes pour AIRE présentent des manifestations auto-immunes similaires au syndrome APECED humain. Elles se caractérisent par une infiltration lymphocytaires multi-organes et la présence d’auto-anticorps circulants (Ramsey, Winqvist et al. 2002). L’expression d’AIRE est indispensable pour la génération d’un répertoire T non auto-réactif (Liston, Lesage et al. 2003; Anderson, Venanzi et al. 2005). Cependant, AIRE ne semble pas réguler l’expression de tous les TRA. Par exemple, les mTECs de souris déficientes pour AIRE expriment la protéine réactive C (CRP), spécifiquement exprimée dans le foie (Anderson, Venanzi et al. 2002).
Rôle des cellules dendritiques
Les DC sont impliquées dans l’élimination des thymocytes spécifiques d’antigènes du soi (Figure 9). L’expression des molécules de CMH de classe II restreinte aux DC est suffisante pour éliminer les thymocytes CD4 SP auto-réactifs (Brocker, Riedinger et al. 1997). D’élégantes expériences des Dr Gallegos et Dr Bevan ont montré que les DC thymiques sont capables de présentation croisée d’antigènes du soi, c’est-à-dire d’apprêter des antigènes exogènes et de les présenter via les molécules du CMH de classe I (Gallegos and Bevan 2004). Ceci leur permet d’induire une délétion clonale plus large, à la fois des thymocytes CD4 SP et CD8 SP. Les DC sont également capables de capturer des antigènes
présentés par les mTEC et de les présenter (Koble and Kyewski 2009). Cependant, le rôle des mTECs ne se réduit à un réservoir d’antigènes pour les DC (Hinterberger, Aichinger et al. 2010). Les DC thymiques sont générées dans le thymus à partir d’un précurseur commun aux LT (Ardavin, Wu et al. 1993). L’équipe du Dr von Adrian a démontré l’immigration physiologique de DC périphériques au sein du thymus. Ces DC sont capables de sélectionner négativement des thymocytes CD4 SP spécifiques d’un antigène présent en périphérie (Bonasio, Scimone et al. 2006). Ce mécanisme permettrait une présentation des TRA non exprimés par les mTEC ainsi que des antigènes exogènes dérivés de la flore commensale intestinal et de l’alimentation.
Les molécules de costimulation
L’expression de molécules de costimulation telles que CD40, CD80 et CD86 contribue à la mise en place de la tolérance centrale par les mTEC et les DC. L’absence d’expression ou le blocage de CD80 ou CD86 révèle leur rôle dans l’élimination des clones auto-réactifs (Gao, Zhang et al. 2002; Buhlmann, Elkin et al. 2003). De façon similaire, le blocage de la molécule CD40 empêche la délétion des thymocytes induite par les superantigènes (Foy, Page et al. 1995). Ces études sont non exhaustives, ce processus de mort cellulaire imlique certainement d’autres molécules de costimulation.
III La tolérance périphérique
Bien que les mécanismes de tolérance centrale soient efficaces, ils sont cependant insuffisants pour éliminer la totalité des thymocytes auto-réactifs et pour prévenir totalement l’apparition de pathologies auto-immunes. Pour remédier à cela, des processus de tolérance périphérique sont mis en place. Les différents mécanismes de tolérance périphériques peuvent être passifs (Figure 10) tels que l’ignorance, l’anergie, la déviation immune et la délétion ; ou actifs. Dans ce dernier cas, ils nécessitent l’intervention de populations T régulatrices.
Extrait de Walker et al., Nature Reviews Immunology, 2002 (Walker and Abbas 2002).
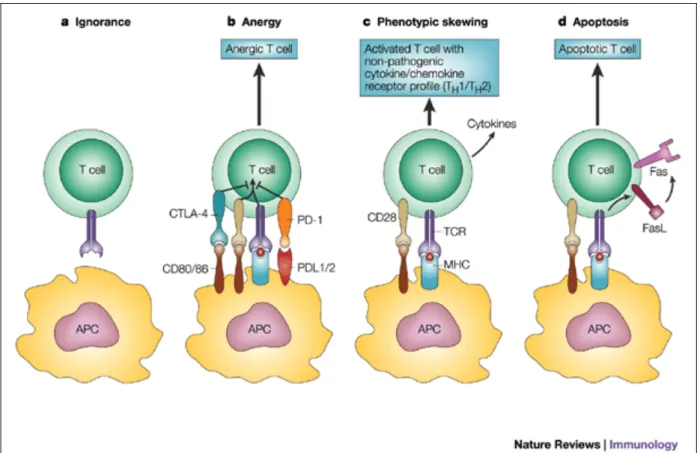
Figure 10. Les différents mécanismes de tolérance périphérique passive.
Certains LT auto-réactifs générés dans le thymus atteignent la périphérie. Là, des mécanismes supplémentaires de tolérance sont mis en place pour les rendre inoffensifs. (a) L’ignorance est la séquestration de l’antigène du soi. Les LT sont ainsi prévenus de toute activation. (b) L’anergie d’un LT est induite par la reconnaissance d’un complexe CMH-antigène du soi dont il est spécifique, à la surface d’une CPA immature ne délivrant pas de signaux de costimulation. (c) Le principe de la déviation phénotypique est le suivant. Pour contrôler une réponse immune délétère, certains LT se différencient dans le lignage Th opposé. (d) Enfin, la délétion clonale est l’élimination physique du LT auto-réactif par induction d’apoptose.
1 La tolérance passive 1.1 L’ignorance
La séparation physique entre les LT et les cellules parenchymateuses exprimant les TRA constitue une barrière à la reconnaissance de complexes CMH-peptide du soi (Figure 10a). Les LT naïfs expriment le récepteur aux chimiokines CCR7 et l’intégrine CD62L, ce qui leur permet de circuler entre les organes lymphoïdes secondaires via le sang et la lymphe (Banchereau and Steinman 1998; Mempel, Henrickson et al. 2004; Celli, Lemaitre et al. 2007). Par conséquent, leur exclusion des tissus diminue fortement la probabilité qu’ils rencontrent des cellules exprimant des TRA. Des cellules T CD8 naïves, matures et exprimant un TCR transgénique de forte affinité pour un ligand sont incapables d’induire des manifestations auto-immunes dans des souris exprimant ce même peptide uniquement dans le pancréas (Ohashi, Oehen et al. 1991). Cette expérience montre que les LT ignorent la présence des complexes CMH-ligand du soi présents à la surface des cellules pancréatiques. Ce phénomène d’ignorance peut également être expliqué par une expression de l’antigène en dessous du seuil requis pour l’activation des LT (Kurts, Miller et al. 1998).
1.2 L’anergie conale
Le processus d’anergie clonale est défini comme une induction de tolérance par des CPA immatures présentant des antigènes du soi mais en absence de molécules de costimulation (Figure 10b). La rencontre du LT auto-réactif avec une telle CPA rend le LT non fonctionnel.
Les molécules CD28 et CTLA-4 (cytotoxic T lymphocyte associated antigen-4) exprimées par les LT et CD80/86 présentes à la surface des CPA jouent un rôle primordial dans l’induction d’anergie clonale. En effet, la neutralisation des molécules CD80/86 par une protéine de fusion immunoglobuline/CTLA-4 interrompt la progression de la maladie lupique chez les souris NZBWF1 (Finck, Linsley et al. 1994). Dans un autre modèle, le blocage de CTLA-4 altère l’induction d’anergie clonale (Perez, Van Parijs et al. 1997). La molécule PD-1 (programmed cell death-1) est une autre protéine responsable de la régulation négative de l’activation des LT. L’expression élevée de PD-1 par les LT anergiques implique cette molécule dans l’induction et le maintien de la tolérance périphérique (Khoury and Sayegh 2004;