UNIVERSITÉ DE PICARDIE JULES VERNE FACULTÉ DE MÉDECINE D’AMIENS
Année 2016 Thèse N° 2016-133
EVALUATION DES DOULEURS POST-OPERATOIRES ET DU
REFLEXE OCULO-CARDIAQUE APRES INJECTION SOUS
TENONIENNE DE ROPIVACAINE EN DEBUT DE CHIRURGIE DE
STRABISME CHEZ L’ENFANT.
THÈSE POUR LE DIPLÔME D’ÉTAT DE DOCTEUR EN MÉDECINE SPÉCIALITÉ OPHTALMOLOGIE
PRÉSENTÉE ET SOUTENUE PUBLIQUEMENT LE 21 SEPTEMBRE 2016
Par ABBOUD Moussa
JURY :
Président du jury et directeur de Thèse :
Madame le Professeur Solange MILAZZO
Membres du Jury :
Monsieur le Professeur Henri SEVESTRE
Madame le Professeur Marie-Antoinette SEVESTRE-PIETRI
Monsieur le Professeur Johann PELTIER
2 À mon maître et directeur de thèse
Madame le Professeur Solange MILAZZO Professeur des Universités-Praticien Hospitalier Chef du service d’ophtalmologie du CHU d’Amiens Pôle des 5 sens
Vous m’avez fait l’honneur d’être ma directrice de thèse et de présider mon jury. Merci pour votre encadrement et votre disponibilité tout au long de l’internat, vous avez toujours été bienveillante à mon égard.
Opérer à vos côtés a été d’un grand enrichissement.
3 Monsieur le Professeur Henri SEVESTRE
Professeur d'Anatomie et de Cytologie Pathologiques à l'UFR de Médecine d'Amiens Chef du Service d'Anatomie et Cytologie Pathologiques du CHU d’Amiens Picardie Adjoint au chef de l’Oncopôle
Vous me faites l’honneur de juger ce travail et de participer à ce jury. Je vous remercie pour votre accueil dans votre service pendant six mois, cela a été une très belle expérience. Je tiens à vous exprimer mes sentiments les plus respectueux.
4 Madame le Professeur Marie-Antoinette SEVESTRE-PIETRI
Professeur des Universités – Praticien Hospitalier Médecine vasculaire
Vous me faites l’honneur de juger ce travail et de participer à ce jury. Acceptez pour cela ma plus sincère reconnaissance
5 Monsieur le Professeur Johann PELTIER
Professeur des Universités – Praticien Hospitalier Chef du Service de Neurochirurgie
(Anatomie)
Vous me faites l’honneur de juger ce travail et de participer à ce jury. Acceptez pour cela ma plus sincère reconnaissance.
6 Monsieur le Docteur Pierre JEZRAOUI
Praticien Hospitalier
Département d'Anesthésie et de Réanimation
Vous me faites l’honneur de juger ce travail et de participer à ce jury.
Vous avoir comme anesthésiste à nos côtés est une vraie chance et un grand plaisir. Acceptez pour cela ma plus sincère reconnaissance.
7
Remerciements
À mes parents, vous m’avez transmis la volonté de travailler et de réussir, et surtout vous avez toujours été là pour moi, mon bonheur et ma réussite, je vous aime.
À mon frère Firas, mes sœurs Safaa et May, la distance nous a séparé depuis une douzaine d’années, si je suis arrivé ici, c’est aussi grâce à vous, nous resterons une belle famille unie.
À mes amis Mohamad, Fouad, Stéphane, Amer, Nizar, Moussa…les années passent et les amitiés restent.
À William mon ami, mon cointerne, mon futur cochef, je suis heureux d’avoir fait toutes ces années avec toi.
À Laurent mon ami, je te remercie pour ta disponibilité et ton aide même pendant tes vacances.
À mes cointernes d’ophtalmologie Hussein, Ghita, Claire, Allan, Romain, Camille, Sophie, Maxence, Sarah, Nesrine, Oman, Erwan, Orlane, merci pour votre bonne humeur, on forme tous ensemble une belle équipe.
À mes anciens cointernes devenus chefs, Andréi, Véronique, Fanny, Nabil, Julie, pour cette belle expérience à vos côtés.
À tous les médecins qui ont participé à ma formation Dr Bouyahiaoui, Issam, Eugène, Dr Jany, Dr Blin, Dr El Amali, Dr Bitar, Dr Benzerroug, Pr Brémond, Dr Crétu.
À Damya, Oana, Abdelhamid, Malek, Dr Alem avec qui je vais avoir grand plaisir à travailler ces deux prochaines années.
8
SOMMAIRE
I. INTRODUCTION ... 12
II. GENERALITES ANATOMIQUES ET PHYSIOLOGIQUES ... 14
A. RAPPELS ANATOMIQUES ... 14
1. La conjonctive ... 14
2. Les muscles oculomoteurs (MOM) ... 14
3. La gaine du globe oculaire ... 14
B. LE REFLEXE OCULOCARDIAQUE ... 18
C. L’ANESTHESIE SOUS TENONIENNE DE ROPIVACAINE ... 18
1. PARAMETRES D’ACTIONS ... 19
D. TECHNIQUES ET REALISATION ... 19
E. COMPLICATIONS LOCALES ... 19
F. COMPLICATIONS GENERALES ... 19
G. LA ROPIVACAINE ... 19
III. SYNDROME DE STRABISME PRECOCE ... 21
A. DEFINITION ... 21
B. FACTEURS DE RISQUES ... 21
C. AGE D’APPARITION ... 22
D. ANOMALIE DE LA VISION BINOCULAIRE ... 23
E. AMBLYOPIE ... 23
F. ANOMALIES MOTRICES ... 23
1. Types de strabisme ... 23
2. Signes sur L'œil fixateur... 23
3. Signes sur l'œil dévié ... 24
G. LE TRAITEMENT DU STRABISME ... 25
IV. MOYENS ET OJECTIFS DE LA CHIRURGIE ... 26
A. L’ANESTHESIE ... 26
B. TESTS OPERATOIRES SOUS ANESTHESIE ... 27
1. Signe de l'anesthésie ... 27
2. Test d'élongation musculaire ... 27
3. Test de duction ... 27
C. OBJECTIFS DE LA CHIRURGIE CHIRURGIEN/PATIENT ... 28
D. REGLES GENERALES... 28
1. Moments de la chirurgie ... 28
9
E. INTERVENTIONS SUR LES MUSCLES DROITS ... 28
1. Affaiblissement d’un muscle ... 28
2. Renforcement d’un muscle ... 29
F. INTERVENTION SUR LES MUSCLES OBLIQUES ... 29
G. SUITES OPERATOIRES IMMEDIATES ... 29
1. Etat oculaire ... 29
2. Résultat strabologique ... 29
H. SUITES OPERATOIRES A DISTANCE ... 30
V. MATERIEL ET METHODES ... 31 A. Type d’étude ... 31 B. Patients ... 31 C. Critères d’inclusion ... 31 D. Critères d’exclusion ... 31 E. Le bilan préopératoire ... 31 F. Protocole opératoire ... 32
G. Protocole et paramètres de l’étude ... 33
H. Analyses statistiques ... 33 VI. RESULTATS ... 35 A. Données démographiques ... 35 B. Douleurs postopératoires ... 38 C. Fréquence cardiaque ... 44 D. Mydriase peropératoire ... 45 VII. DISCUSSION ... 46 VIII. CONCLUSION ... 51
10
Résumé
INTRODUCTION : La chirurgie du strabisme chez l’enfant est considérée comme une chirurgie douloureuse. Elle est pratiquée sous anesthésie générale. Autre que les douleurs, le réflexe oculocardiaque est déclenché par la manipulation oculaire chirurgicale, surtout par la traction musculaire.
MATERIEL ET METHODES : Nous avons réalisé dans le service d’ophtalmologie au CHU Amiens, une étude prospective, randomisée, monocentrique, comparative évaluant l’effet de l’anesthésie sous ténonienne de ropivacaïne 2mg/ml en début d’intervention de strabisme chez l’enfant opéré de strabisme sous anesthésie générale, sur les douleurs postopératoires, le reflexe oculocardiaque et la mydriase.
RESULTATS : L’étude a inclus 70 patients, 35 patients dans le groupe avec ropivacaïne et 35 patients dans le groupe sans ropivacaïne. Il n’existait pas une différence statistiquement significative pour les douleurs postopératoires entre les 2 groupes à 30 minutes, 6 et 24 heures postopératoire (respectivement p=0.43 p=0.57 p=1). Il n’y avait pas de différence significative pour la consommation d’antalgiques en postopératoire (p=0.75). Concernant le reflexe oculocardiaque, la différence de survenue de bradycardie entre les 2 groupes est statistiquement significative (p=0.02). L’incidence de survenue de mydriase dans le groupe avec ropivacaïne est de 97%.
CONCLUSION : La ropivacaïne semble jouer un rôle protecteur contre la bradycardie peropératoire lors de la chirurgie du strabisme et sans avoir d’influence sur les douleurs postopératoires.
Mots clés : anesthésie locale, ropivacaïne, analgésie, mydriase, réflexe oculocardiaque, strabisme
11
Abstract
INTRODUCTION : The strabismus surgery for childrens is considered as a painful surgery. It is performed under general anesthesia. Other than pain, oculocardiac reflex is triggered by the ocular surgical manipulation, especially by muscular pull.
MATERIALS AND METHODS : In the CHU d’Amiens ophthalmology department, we performed a prospective, randomized, single-center, comparative study evaluating the effect of sub-tenon anesthesia whith ropivacaine 2 mg / ml for postoperative pain, reflex oculocardiac and mydriasis, at the start of the strabismus child surgery under general anesthesia.
RESULTS : The study included 70 patients, 35 patients in the ropivacaine group and 35 patients in the group without ropivacaine. There was no statistically significant difference for postoperative pain between the 2 groups at 30 minutes, 6 and 24 postoperative hours (respectively p = 0.43 p = 0.57 p = 1). There was no significant difference in the consumption of analgesics after surgery (p = 0.75). Regarding oculocardiac reflex, for bradycardia, there was a statistically significant difference between the two groups (p = 0.02). The incidence of mydriasis occurred in the group with ropivacaine is 97%.
CONCLUSION : Ropivacaine appears to play a protective role against intraoperative bradycardia during strabismus surgery without influence on postoperative pain.
12
I.
INTRODUCTION
L'anesthésie en ophtalmologie est connue depuis longtemps. Historiquement l’année 1884 a été une année charnière pour l'anesthésie ophtalmologique, puisque Carl Koller a découvert le chlorhydrate de cocaïne comme agent anesthésique topique pour effectuer la chirurgie oculaire et Herman Knapp a utilisé la cocaïne en injection rétrobulbaire afin de réaliser des énucléations. Diverses techniques anesthésiques locaux ont évolué depuis ce temps, permettant ou non l’akinésie [1].
L’anesthésie sous ténonienne (AST) a été introduite dans la pratique clinique au début des années 1990 comme une alternative simple, sûre, efficace et polyvalente. Elle est également connue comme anesthésie parabulbaire ou bloc épiscléral. L'AST agit par action sur les nerfs ciliaires courts puisqu’ils traversent la capsule de Tenon. L’akinésie est obtenue par blocage direct des fibres nerveuses motrices antérieures qui rentrent dans les muscles extra-oculaires [1].
L’anesthésie pour la chirurgie ophtalmologique s’adresse aussi bien à des enfants qu’aux adultes. Elle peut être générale et/ou locorégionale selon le type d’intervention et de patient. Les nombreuses innovations technologiques de la chirurgie ophtalmologique et le perfectionnement des instruments de microchirurgie et des adjuvants endo-oculaires influencent directement l’anesthésie qui doit assurer l’akinésie, l’analgésie et l’hypotonie oculaire.
La chirurgie ophtalmologique pédiatrique se réalise sous anesthésie générale. La chirurgie ophtalmologique, bien que considérée comme peu douloureuse, peut l’être lors de la chirurgie du strabisme.
La chirurgie de strabisme pédiatrique peut présenter outre la douleur, d’autres effets indésirables per et postopératoires incluant principalement les nausées et vomissements postopératoires (NVPO) et le réflexe oculocardiaque (ROC).
L’évaluation de la douleur est plus difficile chez l’enfant surtout chez les plus jeunes. Lors de leurs survenues, différents antalgiques de différentes classes et de différents paliers peuvent alors être prescrits pouvant ainsi majorer les effets secondaires des antalgiques utilisés en peropératoire. C’est pourquoi une anesthésie sous ténonienne (de 1 à 2.5 ml de ropivacaïne à 0.5 ou 0.75 %) est réalisée en fin d’intervention après sutures du plan conjonctival.
13 La survenue de bradycardie lors de la chirurgie de strabisme reste un évènement stressant pour le chirurgien et l’anesthésiste. En effet, la chirurgie ophtalmologique est très pourvoyeuse de bradycardie qui peut aboutir à l’arrêt cardiaque. La manipulation des muscles oculomoteurs lors de la chirurgie de strabisme est à l’origine du déclenchement du réflexe oculocardiaque. Celui-ci se présente sous forme d'une possible bradycardie massive ou d'une brady-arythmie, souvent avec une baisse de la fréquence cardiaque de 10% à 20%, allant parfois même jusqu'à l'asystolie. Le ROC est aussi appelé réflexe vagal trijumeau, puisque la partie afférente de la transmission neuronale passe par le nerf trijumeau et celle efférente par le nerf vague. Comme première mesure, il est nécessaire d'interrompre le stimulus chirurgical. Généralement, il faut suivre avec un traitement médicamenteux à l'atropine et approfondir l'AG. Avec la pose d'un bloc rétrobulbaire (RB), les fibres sensorielles (afférentes) du nerf trijumeau sont bloquées, c'est pourquoi un réflexe de conduction est rarement déclenché dans ce cas. Malgré l'application d'un bloc rétrobulbaire, un ROC peut toutefois être déclenché. De ce fait, un monitoring cardiaque est indispensable pendant l’intervention.
Plusieurs études ont montré une faible incidence de survenue de bradycardie grave lors de la chirurgie de strabisme après utilisation des agents anesthésiques locaux [2].
Nous avons réalisé dans le service d’ophtalmologie au CHU d’Amiens, une étude prospective comparative sur l’effet de l’anesthésie sous-ténonienne de ropivacaïne à 2mg/ml en début d’intervention de chirurgie de strabisme pédiatrique réalisée sous anesthésie générale.
Nous évaluons ainsi dans notre étude, l’effet de l’injection sous ténonienne de ropivacaïne en début d’intervention de strabisme chez l’enfant sur :
L’analgésie postopératoire Le ROC
14
II.
GENERALITES ANATOMIQUES ET PHYSIOLOGIQUES
A. RAPPELS ANATOMIQUES
1. La conjonctive
Elle tapisse la face postérieure des paupières, se recourbe en formant des culs-de-sac, pour venir tapisser le globe oculaire jusqu’au limbe de la cornée où elle va fusionner avec la gaine du globe (capsule de Tenon).
2. Les muscles oculomoteurs (MOM)
Au nombre de six, comprennent les quatre muscles droits et les deux muscles obliques [3]. Le muscle droit médial, latéral, supérieur et inférieur s’insèrent tous en arrière à l’apex orbitaire (sur le tendon de Zinn autour du nerf optique) et sur le globe, légèrement en avant de l’équateur. Ces quatre muscles, avec la cloison qui les relie deux à deux, délimitent le cône musculo-aponévrotique du cône rétrobulbaire (figure 1).
Les muscles obliques sont pour, l’essentiel situés en dehors du cône, de même que le releveur de la paupière supérieure qui longe la face supérieure du droit supérieur.
Le muscle droit externe est innervé par la VI ͤ paire crânienne, le muscle oblique supérieur par la IV ͤ , les autres le sont par la III ͤ.
L’insertion sclérale des muscles droits se fait via leur tendon d’une largeur moyenne de 10mm mais de longueur différente pour chacun des muscles. Leur distance d’insertion vis-à-vis du limbe est différente et augmente du droit médial, au droit supérieur dans le sens horaire (classique spirale de Tillaux : classiquement 5, 6, 7 et 8mm respectivement pour les muscles droits médial (MDM)l, inférieur (MDI), latéral (MDL) et supérieur (MDS)). Les valeurs précises apportées par De Gottrau sont reportées dans le tableau 1 et la figure 2.
3. La gaine du globe oculaire
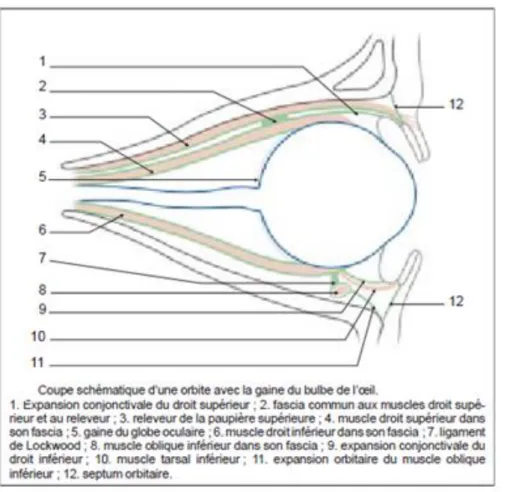
La gaine du globe oculaire aussi appelée capsule de Tenon (figure 3a et 3b) est une membrane fibro-élastique recouvrant la sclère depuis le limbe scléro-cornéen jusqu’au nerf optique. Plus mince en avant, elle comporte deux feuillets délimitant une cavité virtuelle : l’espace épiscléral ou espace de Tenon.
15 Les six MOM, entourés de leur fascia, perforent la gaine et fusionnent avec elle avant d’atteindre la sclère. Le fascia de chaque muscle droit est relié à celui des muscles voisins par une membrane intermusculaire constituant un cône à sommet postérieur : le cône fascio-musculaire, où cheminent les nerfs oculomoteurs, le nerf optique et l’artère ophtalmique.
Figure 1 : origine des MOM et des éléments vasculo-nerveux associés d’après : A Ducasse P De Gottrau [3]
16 Tableau 1 : Les principales données biométriques des muscles droit et de leurs rapports avec le globe oculaire (d’après De Gottrau).
Figure 2 : Insertion des muscles droits et spirale de Tillaux d’après : A Ducasse, P De Gottrau [3]
17 Figure 3a : Coupe schématique d‘une orbite avec la gaine du bulbe de l’œil d’après : A Ducasse, P De Gottrau [3]
18 B. LE REFLEXE OCULOCARDIAQUE
Le réflexe oculocardiaque (ROC) consiste en une bradycardie vagale provoquée par une stimulation de la sphère oculaire. Son incidence au cours de la chirurgie ophtalmique est évaluée entre 16 et 90 % selon l'intervention et l'anesthésie utilisée [4].
Voies anatomiques et stimulus déclenchant
La voie afférente emprunte la branche ophtalmique du nerf V jusqu'à son noyau sensitif situé dans le plancher du quatrième ventricule. La voie efférente débute au niveau du plancher du quatrième ventricule dans le noyau du nerf vague (X). Il est déclenché par une pression excessive sur le bulbe oculaire et la traction sur les muscles oculomoteurs (chirurgie du strabisme, des paupières, décollement de rétine). La survenue d'un ROC peut être favorisée par l'hypoxie, l'hypercapnie et l'acidose et par une anesthésie trop légère.
Symptomatologie
Il se manifeste par une bradycardie sinusale (FC<50 voire 30/mn). D’autres troubles cardiaques (de conduction ou de rythme) peuvent se produire jusqu'à l'arrêt sinusal (parfois prolongé). Le ROC est un réflexe épuisable.
Prévention
La prévention repose avant tout sur des manipulations douces de l'œil par le chirurgien. Les anesthésies locorégionales atténuent les manifestations les plus délétères du ROC, en raison du blocage de ses afférences. Lorsque la fréquence cardiaque est inférieure à 40-45/mn et que la bradycardie persiste malgré l’arrêt des manipulations chirurgicales, l’injection intraveineuse de 10 à 15 µg/kg d’atropine est justifiée mais pas en prévention en raison de ses effets délétères Certains agents d’induction comme le sevofurane le limitent.
C. L’ANESTHESIE SOUS TENONIENNE DE ROPIVACAINE
Comme toute anesthésie locorégionale ophtalmologique, elle doit assurer l’akinésie, l’analgésie et la normotonie oculaire. Son effet est volume-dépendant [5].
19 1. PARAMETRES D’ACTIONS
L’analgésie
Par son action périphérique directement au niveau du site opératoire, elle permet d’obtenir une analgésie per et postopératoire après imprégnation des nerfs ciliaires courts et longs. Elle est obtenue avec un volume de 2 à 6 ml.
L’akinésie
Elle est obtenue pour un volume de 6 à 9 ml par imprégnation des gaines des muscles droits Elle peut pour des volumes supérieurs à 6 ml entrainer des blocages de l’orbiculaire.
La pression intraoculaire
Le but est d’éviter principalement l’hypertonie oculaire en particulier lors des chirurgies à globe ouvert.
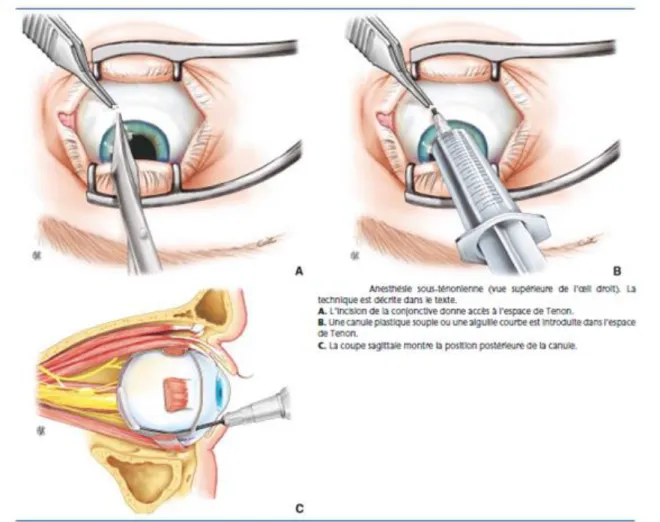
D. TECHNIQUES ET REALISATION Par abord chirurgical (figure 4) :
Le chirurgien aborde la gaine du globe par une incision pour glisser une canule mousse dans l’espace épiscléral, jusqu’au pôle postérieur de l’œil. Elle assure aussi une bonne analgésie postopératoire immédiate [6].
E. COMPLICATIONS LOCALES
Les plus fréquentes sont aussi mineures : chémosis quasi-constant et hémorragie sous-conjonctivale. Les plus graves sont communes aux anesthésies péri-bulbaires (Perforation du globe oculaire, lésions d’un MOM avec parésie/paralysie oculomotrice et diplopie consécutive, hématome rétrobulbaire). L’atteinte d’un MOM peut survenir soit par lésion traumatique du muscle ou de son nerf soit par myotoxicité de l’anesthésique local [7].
F. COMPLICATIONS GENERALES
Elles peuvent être neurologiques (paresthésies péribuccales, engourdissement, vertiges, somnolence…), cardiaques (hypovolémie et collapsus) ou allergie (les dérivés amides ne contiennent plus de conservateurs, ne devraient plus provoquer de phénomènes allergiques).
G. LA ROPIVACAINE
Anesthésique local de type amide de longue durée d'action avec des effets anesthésiques et analgésiques. Sa posologie usuelle est de 2mg/ml. Le mécanisme d'action consiste en une diminution réversible de la perméabilité membranaire des fibres nerveuses aux ions sodium.
20 Ainsi, la vitesse de dépolarisation diminue et le seuil d'excitabilité augmente, induisant un blocage local de l'influx nerveux. Elle bloque ainsi les fibres sensorielles nociceptives (fibres A-delta et C A) de manière plus intense que les fibres motrices Beta. C’est pourquoi à des doses élevées elle induit une anesthésie chirurgicale, alors qu'à des doses plus faibles, elle donne lieu à un bloc sensitif, associé à un bloc moteur limité et stable [8].
Le délai d'installation et la durée d'efficacité de l'anesthésie sont dépendants du site d'administration, mais semble en moyenne être de 10-20 mn pour le délai d’action et de 3h pour sa durée d’action pouvant même aller jusqu’à 6h. Ces temps ne sont pas influencés par la présence d'un vasoconstricteur (par exemple, l’adrénaline : épinéphrine).
Figure 4 : Anesthésie sous-ténonienne à l’aiguille mousse d’après J.-P Haberer, Anesthésie en ophtalmologie EMC 21-780-A-10
21
III. SYNDROME DE STRABISME PRECOCE
A. DEFINITION
Le strabisme précoce, ou plutôt « le syndrome de strabisme précoce », correspond à l'ensemble des signes oculomoteurs et visuels survenant progressivement quand une déviation permanente des axes visuels est présente avant l'apparition des liens binoculaires, en pratique avant l'âge de six mois de vie [9].
Il traduit un dérèglement définitif de l'acquisition de la vision binoculaire. D’autant plus profond que l'apparition est précoce dans la vie. Son identification a permis de s'en servir de borne dans la classification des strabismes, séparant deux sortes de strabisme en fonction de ce qu'on peut espérer des résultats du traitement :
- Les strabismes apparaissant après acquisition de la vision binoculaire, ou strabismes normosensoriels, pour lesquels le traitement peut faire espérer une guérison motrice et sensorielle
- Les strabismes précoces, apparaissant au cours de ce développement et l'entravant profondément le traitement ne peut alors que limiter les conséquences, sans jamais obtenir de guérison.
L'ensemble de signes sensoriels ou moteurs qui le constituent forme le syndrome. Certains signes en sont caractéristiques. D'autres sont moins spécifiques [10]. Le terme "essentiel" (strabisme essentiel à début précoce de Hugonnier) est parfois rajouté pour signifier l'absence de cause connue (paralytique, musculaire ou accommodative). Le syndrome est assez fréquent entre 2 et 5 % de la population générale, représentant 30 à 50 % des désordres oculomoteurs.
B. FACTEURS DE RISQUES
La ou les causes du syndrome de strabisme précoce n'ont pas été isolées jusqu'ici. Ce syndrome apparaît dans la grande majorité des cas de manière fortuite, chez 2 à 5 % de la population. On parlera donc plus de facteurs de risques que de cause.
Hérédité : 33 % tous strabismes confondus et 20 % pour le seul strabisme précoce. Certains
syndromes tels que la trisomie 21 sont plus fréquemment associés au syndrome de strabisme précoce [11].
22
Lésions neurologiques périnatales : haute fréquence de strabismes précoces (20 à 40 % selon
les auteurs). C'est dans cette population qu’on retrouve le plus d'éxotropies, à tel point que la présence d'une éxotropie précoce doit faire pratiquer un bilan neuro-pédiatrique systématique.
Prématurité : Elle est associée à une haute fréquence de strabismes précoces, par immaturité
anatomique et fonctionnelle des structures permettant le développement de la vision binoculaire.
Privation visuelle unilatérale précoce : Le syndrome de strabisme précoce n'est pas toujours
inné. Des anomalies oculaires apparues très tôt après la naissance ou présentes à la naissance peuvent le provoquer comme dans la cécité congénitale unilatérale (cataracte unilatérale, malformation...), la vision binoculaire ne peut se développer et on voit apparaître un syndrome de strabisme précoce ou plutôt un hémi-syndrome (syndrome du monophtalme congénital de Spielmann). Il s'agit d'un strabisme précoce acquis, preuve que les strabismes précoces ne sont pas tous de cause prénatale [11].
Amétropie (le plus souvent modérée) :
- 40 % d'hypermétropes légers (<2 δ) - 40 % d'hypermétropes moyens (2 à 5δ) - 10 % d'hypermétropes forts (>5δ) - 10 % de myope
Divers : Divers facteurs ont été incriminés (tabac, alcool, antibiotiques etc.). Toutefois les
études ne sont pas homogènes sur ce plan et il semble que si on trouve plus de strabisme dans ces cas c'est plus par les lésions neurologiques ou malformatives qui y sont associées que par une réelle prédisposition au strabisme précoce.
C. AGE D’APPARITION
Le syndrome de strabisme précoce débute avant six mois d'âge, phase de maturation fondamentale du système optomoteur. Il existe une période de transition entre strabismes précoces et strabismes normosensoriels, de six à 18 mois. Certains strabismes déclenchés après 18 mois sont en fait des strabismes précoces dont la déviation horizontale devient apparente mais qui étaient présents auparavant sous forme de micro-strabismes comme le montrent les anomalies profondes de la vision binoculaire.
23 D. ANOMALIE DE LA VISION BINOCULAIRE
L'anomalie sensorielle pathognomonique du syndrome de strabisme précoce est l'absence irréversible de correspondance rétinienne normale.
E. AMBLYOPIE
Elle est retrouvée dans 10 à 40 % des cas en l'absence de prévention. Cet aspect à lui seul justifie la prise en charge médicale précoce de tout strabisme de l'enfant. Elle est liée à la neutralisation permanente de l'œil dévié dans un strabisme non alternant et n'est donc pas spécifique du syndrome de strabisme précoce.
F. ANOMALIES MOTRICES
1. Types de strabisme
80 % d'ésodéviations (typiquement de grand angle, assez stable)
10 % d'exodéviations, à ne pas confondre avec une exophorie décompensée (un contexte neurologique est à rechercher)
10 % de microstrabismes, pouvant décompenser secondairement en raison d'une amétropie importante ou d'une amblyopie.
2. Signes sur L'œil fixateur
Attraction vers l'adduction (fixation en adduction) (cf. photos 1)
Elle est pathognomonique du syndrome de strabisme précoce. Elle est responsable d'une attitude de fixation en torticolis, tête tournée du côté de l’œil fixateur, celui-ci se portant spontanément en adduction. Le torticolis change de direction selon l'œil fixateur. Il s'agit d'une position de meilleur confort visuel que le patient prend spontanément. Elle est responsable de la fixation croisée et du Torticolis de fixation.
Nystagmus manifeste latent
Forme particulière de nystagmus, il est spécifique et pathognomonique du syndrome de strabisme précoce. C’est un nystagmus à ressort dont la phase lente a une vitesse croissante. On le dit :
- Manifeste : présent en fixation binoculaire, latent : apparaissant à l'occlusion, manifeste latent
24 - il bat du côté de l’œil fixateur
- souvent associé à la fixation en adduction et à la DVD
- s'il est manifeste, peut-être, à lui seul, responsable d'une malvoyance
Asymétrie du nystagmus optocinétique (NOC)
En fixation monoculaire, on observe un aspect d'inexcitabilité optocinétique dans le sens nasotemporal alors qu’il est présent quand le tambour tourne dans le sens temporonasal.
Incyclotorsion de fixation
Ce signe est moins prononcé et moins fréquent que la fixation en adduction. La fixation se fait tête penchée sur l'épaule de l'œil fixateur, afin de compenser une incyclotorsion de fixation.
3. Signes sur l'œil dévié
Déviations dissociées
Ce sont des déviations apparaissant ou se modifiant lorsque la stimulation visuelle devient asymétrique comme lors de l'occlusion.
a-Divergences verticales dissociées (DVD) (cf. photos 3 et 4)
Elle est la plus connue des déviations dissociées. Elle d'origine centrale et de physiopathologie non totalement élucidée. La DVD non spécifique mais en association fréquente avec le strabisme précoce.
b-Déviation horizontale dissociée (DHD) (cf. photo 2)
Apparaissant lors de l'occlusion toujours en éso-déviation est souvent associée au nystagmus manifeste latent et la déviation torsionnelle dissociée directement associée voire inclut dans le phénomène de DVD.
c-Déviations non spécifiques
Ce sont des déviations apparaissant hors occlusion, lors de l'étude de la motilité oculaire, parfois concomitantes. Elles ne sont pas spécifiques des strabismes précoces. L'élévation en adduction (photos 5 et 6) peut être liée à une hyperaction de l'oblique inférieur (le plus souvent) mais aussi à une DVD ou à un droit médial hyperactif sur l'œil non fixateur en excyclotorsion ou encore une anomalie de position des poulies tenoniennes. Les syndromes alphabétiques, chez l'enfant,
25 sont plutôt en « V », associés à une hyperaction de l'oblique inférieur. Mais ils peuvent s'inverser avec le temps et devenir en « A », alors souvent associés à une DVD.
Photos du Pr Milazzo (Service d’ophtalmologie du CHU d’Amiens)
G. LE TRAITEMENT DU STRABISME
Les objectifs et les principes du traitement sont aujourd’hui clairement définis [12]. Le traitement des strabismes concomitants a trois objectifs :
- Corriger l’amétropie : la correction optique totale après réfraction sous cycloplégie de l’amétropie est une nécessité absolue ; en amenant le parcours accommodatif à son niveau physiologique, elle permet de rompre le cercle vicieux de l’excès de convergence et du spasme d’accommodation.
26 - Prévenir ou si nécessaire traiter l’amblyopie : la prévention doit être immédiate, le traitement doit être entrepris le plus tôt possible et son résultat consolidé ensuite jusqu’à l’âge de 8 à 10 ans.
- Corriger et stabiliser la déviation des axes visuels en visant l’orthoposition ou à défaut un angle résiduel minimum inférieur ou égal à 10 dioptries horizontalement et 4 verticalement ; en premier lieu dans un but fonctionnel qui permettra le développement d’une union binoculaire et d’une stéréoscopie de plus ou moins bonne qualité, garante de stabilité angulaire dans le temps et surtout de confort visuel et conjointement dans un but esthétique.
Le résultat idéal du traitement est d’obtenir un microstrabisme (lunettes portées), sans torticolis de fixation, avec une motilité oculaire harmonieuse et une vision symétrique des deux yeux. L’intervention chirurgicale lorsqu’elle est nécessaire est envisagée plus ou moins précocement avec possibilité d’utiliser la toxine botulique comme alternative thérapeutique à des âges très précoces ou comme traitement adjuvant, au besoin répétée. Elle diminue de manière durable l’angle de déviation dans 90% des cas, voire elle évite la chirurgie dans 40 à 65% des cas. Quand la chirurgie est nécessaire, c’est d’ailleurs souvent en raison du déséquilibre vertical associé et non pour le strabisme horizontal. Elle évite ou diminue l’anatomisation de la déviation et facilite le cas échéant la chirurgie ultérieure qui est généralement pratiquée vers l’âge de 3-4 ans. Elle est indiquée chez l’enfant s’il persiste une déviation horizontale importante (>15 Δ) et en cas de variabilité majeure.
IV. MOYENS ET OJECTIFS DE LA CHIRURGIE
A. L’ANESTHESIE
Il est capital car il joue un rôle dans le choix de l'œil à opérer dans les strabismes et intervient dans l'appréciation de l'élongation musculaire dans toute la chirurgie oculomotrice. Il doit donc être reproductible et assurer une anesthésie suffisamment profonde pour éviter une bradycardie lors de la traction musculaire (ROC). L'utilisation de curares à élimination rapide permet d'apprécier correctement l'élongation musculaire et impose une intubation trachéale ou un masque laryngé [13].
27 Au CHU d’Amiens, l’anesthésie générale pour la chirurgie du strabisme est induite par un hypnotique (diprivan) associé à un morphinique (sufentanil). Le curare n’est pas utilisé. L’analgésie postopératoire est réalisée par le paracétamol et/ou profénid (AINS). Si les douleurs ne sont pas soulagées, l’acupan est alors prescrit en absence de contre-indication.
B. TESTS OPERATOIRES SOUS ANESTHESIE
1. Signe de l'anesthésie
L’anesthésie générale peut influencer sur l'angle strabique. Avant d'apprécier la position des yeux sous anesthésie, celle-ci doit être stable et profonde depuis 10 minutes, un myosis bilatéral en est le témoin.
Dans les troubles oculomoteurs, la position des yeux sous anesthésie générale permet de définir si un œil reste plus dévié que l'autre, si la déviation est plus marquée ou moins importante qu'à l'état de veille. On peut comparer la position des yeux à l'état de veille avec celle sous AG et en déduire, dans les strabismes, l'œil qui présente la pathologie la plus importante (ce n'est pas obligatoirement l'œil qui semble directeur à l'état de veille). Toutes ces variations vont guider le chirurgien dans la conduite à tenir vis-à-vis du strabisme à opérer. Pour cette raison, le patient et ses parents sont toujours avisés de ce test afin de ne pas être surpris du choix de l'œil opéré.
2. Test d'élongation musculaire
Ce test apprécie l'élongation d'un muscle libéré de ses ailerons ténoniens. Il nécessite pour être précis un myomètre et une réglette millimétrée. Il est réalisé avec ses instruments pour les muscles droits (cf. Rapport de la SFO de strabismes pour la méthode p.352). Le test d'élongation musculaire permet ainsi de doser la chirurgie de façon précise, évitant de trop raccourcir un muscle déjà hypo-élongable ou de reculer trop intensément un muscle hyper-élongable.
3. Test de duction
Il se fait avant toute incision conjonctivale. Il apprécie en bloc la liberté du muscle et de son système capsulo-ténonien. Il est donc le plus souvent utilisé quand cliniquement, une parésie est notée (fracture orbitaires, parésie, syndrome de rétraction ou fibrose oculomotrice).
Le tes d’élongation musculaire n’est pas effectué au CHU d’Amiens à cause d’une absence de curarisation lors de l’anesthésie générale. En effet certains auteurs (Pr Brérad et Pr Mitsui) ont constaté, sous anesthésie générale, des variations de la déviation en fonction du temps et de
28 l’éclairage, et ont noté la persistance d’une activité électromyographique. Pour ces raisons, ils ont considéré que la position des yeux sous anesthésie générale n’avait pas de valeur clinique.
C. OBJECTIFS DE LA CHIRURGIE CHIRURGIEN/PATIENT
Elle intervient comme étape du traitement et non comme finalité et fait donc partie de l'ensemble de la stratégie thérapeutique du strabisme. La chirurgie du strabisme est une chirurgie réparatrice, visant à rétablir autant que possible la normalité oculomotrice. Le but que se fixe le chirurgien avant d'opérer un strabisme n'est pas toujours celui attendu par le patient ou la famille. Les deux parties doivent en tout cas bien s'accorder sur la finalité de l'intervention.
D. REGLES GENERALES
Il est recommandé de ne pas opérer plus de deux muscles droits par œil lors d’un même temps opératoire, sauf exception
1. Moments de la chirurgie
Il n’y a pas d’âge précis mais un moment adapté à chaque type de strabisme. Le plus tôt possible (meilleure plasticité cérébrale) mais après un traitement médical (correction optique totale vérifiée, amblyopie stabilisée, alternance, parfois prismes, rééducation…) et sur un strabisme stable au moins six mois, sauf exception et surtout pour lequel le résultat du traitement médical est non satisfaisant et en impasse.
2. Bilan préopératoire
Il doit apporter les éléments dont le chirurgien a besoin pour mener à bien l’intervention et sera en sa possession lors de l’intervention. Il comprend le bilan réfractif, sensoriel et oculomoteur.
E. INTERVENTIONS SUR LES MUSCLES DROITS
1. Affaiblissement d’un muscle Recul musculaire
On réinsère le muscle en arrière de son insertion sclérale physiologique. Son efficacité est exceptionnelle. On peut considérer qu’elle est quasi-nulle en dessous de 2mm pour un muscle droit médial (MDM) et 3mm pour un muscle droit latéral (MDL).
29 Fixation postérieure
Technique chirurgicale développée à partir de la Fadenoperation de Cüppers en 1976 permettant de fixer le muscle contre la sclère en arrière de l’équateur. Elle est utile pour les déviations inconstantes, variables, disparaissant sous AG d’origine tonique. Ces deux techniques peuvent être associées pour traiter les deux composantes des ésotropies voire d’autres déviations (DVD par exemple). Le positionnement de la fixation est important car trop éloignée, elle devient paralysante alors que trop antérieure, elle est inefficace. La distance recommandée par rapport à l’insertion sclérale du muscle est de : 13 mm pour les MDM et MDS, 11 mm pour les MDI et 15 mm pour les MDL.
2. Renforcement d’un muscle
Il s’agit de retendre un muscle afin d’augmenter son efficacité. Le plus souvent, le geste consiste à le raccourcir en éliminant une longueur donnée de la partie antérieure du tendon par résection ou plissement. Le renforcement est utilisé pour des muscles hypoactifs (paralysie par exemple) et/ou hyper-élastiques. La résection pour un MDM varie de 2 à 7 mm et pour un MDL entre 3 et 9 mm.
F. INTERVENTION SUR LES MUSCLES OBLIQUES
Les mêmes interventions de renforcement sont réalisables sur les muscles obliques et selon les mêmes principes que pour les muscles droits.
G. SUITES OPERATOIRES IMMEDIATES
1. Etat oculaire
Une gêne oculaire et visuelle sont possibles pendant quelques heures à quelques jours. Des complications infectieuses ou inflammatoires sont rarement observées, allant de simples sécrétions abondantes et chémosis jusqu’à un gonflement palpébral, une exophtalmie et des douleurs orbitaires voire cellulite. La rougeur conjonctivale est variable selon l’état local et le type d’incision.
2. Résultat strabologique
Après un bilan oculomoteur sommaire réalisé en postopératoire immédiat, même si le résultat est d’emblée appréciable, il n’est pas toujours le reflet du résultat final. Plusieurs semaines ou
30 mois peuvent être nécessaire avant d’obtenir une stabilisation de l’état oculomoteur. Des sous et des sur-corrections sont possibles ainsi que des diplopies.
H. SUITES OPERATOIRES A DISTANCE
L’état local est vérifié à chaque consultation. On recherche toutes (les complications rares mais possibles) : Lâchage de sutures et perte d’un muscle, réaction allergique, kystes conjonctivaux, granulomes, variation de la réfraction, ischémie du segment antérieur, diplopie, anomalies de la motilité, modification de la statique fente palpébrale. Une prise en charge orthoptique postopératoire est souhaitable et peut débuter rapidement dans les jours qui suivent. Elle permet de suivre l’évolution, de rassurer ou au contraire, d’alerter en cas de problème. Parfois une rééducation postopératoire rapide est demandée.
31
V.
MATERIEL ET METHODES
A. Type d’étude
Il s’agissait d’une étude prospective, monocentrique au CHU d’Amiens, comparative, randomisée, évaluant l’injection sous ténonienne de ropivacaïne en début de chirurgie de strabisme chez l’enfant sur les douleurs post-opératoires et le reflexe oculocardiaque. Les patients ont été opérés entre mai 2014 et février 2016.
B. Patients
Soixante-dix patients ont été inclut prospectivement dans notre étude. Les patients ont été repartis successivement dans 2 groupes selon la présence ou l’absence d’injection de ropivacaïne. Le choix d’injection de ropivacaïne est réalisé d’une façon successive (1 patient sur 2 a reçu une injection).
Tous les patients ont été opéré par le même chirurgien, sous anesthésie générale. Le consentement parental a été requis par une fiche d’information signé.
C. Critères d’inclusion - âge inférieur à 18 ans
- Strabisme d’indication chirurgicale n’ayant jamais été opéré - Aucun antécédent de chirurgie ophtalmologique
D. Critères d’exclusion - Allergie à la ropivacaïne
- Reprise chirurgicale
- Anomalies pupillaires pouvant fausser l’interprétation de la survenue ou non de la mydriase - Antécédents d’herpès ou zona ophtalmique (pouvant avoir léser le ganglion ciliaire)
- Refus des parents l’utilisation des données personnelles de l’enfant pour analyse - paralysies oculomotrices (traumatisme, atteinte neurologique centrale et périphérique)
E. Le bilan préopératoire
32 -les antécédents familiaux et personnels du patient
-l’âge de 1ère consultation et l’âge du patient au moment de l’injection toxine
-une réfraction sous cycloplégie (atropine ou skiacol en fonction des antécédents et de l’âge du patient) ainsi qu’une acuité visuelle avec correction optique
-un bilan orthoptique complet
-l’examen général du patient et surtout du faciès et des fentes palpébrales
-un examen du segment antérieur et du fond d’œil dilaté, témoignant de l’intégrité conjonctivale et bord pupillaire avec normalité du reflexe photomoteur
-des photographies du visage et dans les 9 positions du regard
F. Protocole opératoire
La chirurgie était toujours réalisée par le même chirurgien. Tous les patients étaient pris en charge par le même anesthésiste. Au CHU d’Amiens, l’anesthésie générale pour la chirurgie du strabisme est induite par un hypnotique (Diprivan) associé à un morphinique (Sufentanil). Le curare n’est pas utilisé. La chirurgie consistait à une cure uni ou bilatérale d’un ou de 2 muscles oculomoteurs.
Lors de l’installation, les photographies des 9 positions du regard étaient affichées sur une potence à la disposition du chirurgien, le signe de l’anesthésie était vérifié ainsi que le diamètre pupillaire.
Lors de l’intervention, après incision conjonctivale et avant toute mobilisation des MOM, on injecta la ropivacaïne à l’aide d’une canule à bout mousse en sous-ténonien, on contrôlait le diamètre pupillaire à 2 puis à 5 minutes avant toute mobilisation des MOM, l’ECG était contrôlé en permanence ainsi que les autres paramètres hémodynamiques pour la surveillance du ROC, en cas de stimulation du ROC (bradycardie sinusale, asystolie…), celui-ci pouvait alors s’amender spontanément après avoir relâché les MOM et ne plus survenir par épuisement du ROC et donc sans injection d’atropine nécessaire, ou s’il persistait ou récidivait lors de la mobilisation des MOM, de l’atropine leur était alors injectée.
33 G. Protocole et paramètres de l’étude
Les patients ont été répartis dans 2 groupes, le premier ayant reçu une injection sous ténonienne de ropivacaïne et le second sans anesthésie sous ténonienne. L’évaluation des douleurs était réalisée par l’échelle FLACC (Face Legs Activity Cry Consolability) avec une cotation de 0 à 10 (tableau 2).
0 = détendu et confortable 1-3 = léger inconfort 4-6 = douleur modérée
7-10 = douleur sévère ou inconfort majeur
La douleur a été évalué à 30 minutes, 6 heures et 24 heures post-opératoires par les infirmières de la salle de réveil et du service d’hospitalisation.
Les patients n’ayant pas reçu une injection sous ténonienne de ropivacaïne ont bénéficié d’une injection de paracétamol en intraveineux en peropératoire (15mg/kg). Le groupe avec injection de ropivacaïne n’a pas reçu d’antalgiques en peropératoire. Nous avons aussi noté le recours aux antalgiques postopératoires par le nombre de prise d’antalgiques.
Nous avons aussi noté l’apparition d’une bradycardie peropératoire (fréquence cardiaque inférieur à 60) ainsi que la fréquence cardiaque la plus basse atteinte pendant l’intervention chirurgicale et la nécessité d’utilisation d’atropine en cas d’une bradycardie sévère persistante après arrêt de la manipulation oculaire.
La survenue de mydriase en cas d’injection de ropivacaïne dans les 5 minutes suivant l’injection a été signalé par l’équipe chirurgicale, témoignant ainsi de l’efficacité de l’injection sur le ganglion ciliaire en cas de positivité.
Toutes ces données était marquée sur une feuille protocolaire, validée par les équipes chirurgicales, anesthésiques et par l’ensemble de l’équipe paramédicale (IBODE, IADE, IDE et aide-soignant). Cette feuille était nominative et intégrée au dossier médical.
H. Analyses statistiques
Les données ont été collectées sur un fichier Excel® (Microsoft Corp.). Les caractéristiques des patientes sont présentées avec les méthodes classiques de la statistique descriptive : fréquences et pourcentages pour les variables catégorielles ; médianes, valeurs extrêmes, moyennes et
34 écart-type pour les variables continues. Les variables qualitatives sont comparées par le test du Chi 2 ou le test de Fisher en l’absence des conditions requises. Les variables quantitatives sont comparées par le test t de Student ou par le test de Wilcoxon en cas d’absence de normalité des variables. Une probabilité <5% (p<0.05) était considérée comme significative. Le logiciel utilisé est R Core Team version 3.2.2 (2015). R : A language and environment for statistical computing.
Tableau 2 : Version française de l’échelle d’évaluation comportementale de la douleur FLACC
(face-legs-activity-cry-consolability)
35
VI. RESULTATS
A. Données démographiques
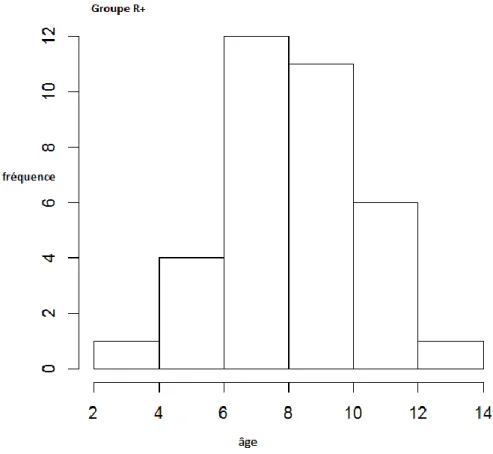
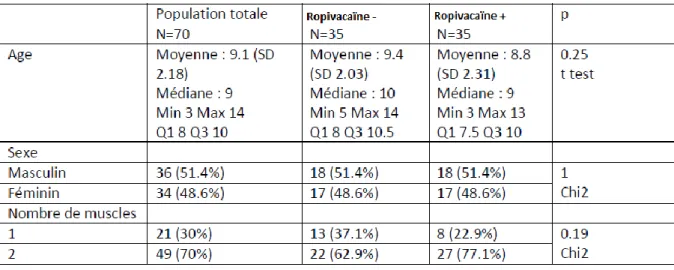
L’étude a été réalisée sur 70 patients, 35 patients dans le groupe « injection de ropivacaïne » (R+) et 35 patients dans le groupe « pas injection de ropivacaïne » (R-).
L’âge moyen est de 8.8 ans dans le groupe R+ (SD 2.31) et de 9.4 ans (SD 2.03) dans le groupe R-. Les 2 groupes étaient comparables au niveau âge puisque nous ne trouvons pas de différence statiquement significative entre les 2 groupes (p=0.25). La répartition de sexe est égale dans les 2 groupes avec 18 garçons (51.4%) et 17 filles (48.6%).
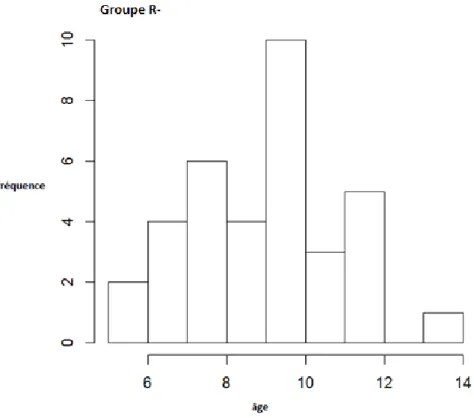
36 Figure 6 : Histogrammes de répartition d’âges dans le groupe R-
37 Pour le nombre de muscles opérés, la chirurgie concernait un muscle par œil dans 22.9% des cas et 2 muscles par œil dans 77.1% cas dans le groupe R+. Dans le groupe R- la chirurgie concernait un muscle par œil dans 37.1% des cas et 2 muscles par œil dans 62.9% des cas. Les 2 groupes étaient comparables au niveau nombre de muscles opérés par œil puisque nous ne trouvons pas de différence statiquement significative entre les 2 groupes (p=0.19).
Au total, les deux groupes étaient comparables pour l’ensemble des variables préopératoires avec aucune différence significative (p>0.05 pour tous les paramètres : p=0.25 pour l’âge, p=1 pour le sexe et p=0.19 pour le nombre de muscles opérés) (Tableau 3).
38 B. Douleurs postopératoires
A 30 minutes postopératoires :
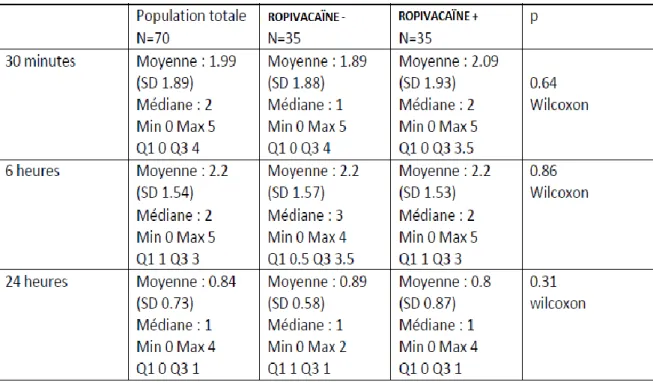
L’évaluation de la douleur à 30 minutes postopératoires retrouve paradoxalement une moyenne de 2.09 sur l’échelle FLACC dans le groupe R+ et de 1.89 dans le groupe R-. La comparaison des 2 moyennes selon la formule de wilcoxon ne retrouve pas une différence statistiquement significative puisque p=0.64. Pour un score FLACC ≤3 (douleurs minimes), la proportion des patients dans le groupe R+ (74%) est légèrement plus importante par rapport au groupe R- (66%), mais cette différence est statistiquement non significative puisque p=0.43 selon le test CHI2 (tableau 4 et 5).
A 6 heures postopératoires :
L’évaluation de la douleur à 6 heures postopératoires retrouve une moyenne de 2.2 sur l’échelle FLACC dans les 2 groupes. La comparaison des 2 moyennes selon la formule de wilcoxon ne retrouve pas une différence statistiquement significative puisque p=0.86. Pour un score FLACC ≤3 (douleurs minimes), la proportion des patients dans le groupe R+ (80%) est légèrement plus importante par rapport au groupe R- (74%), mais cette différence est statistiquement non significative puisque p=0.57 selon le test CHI2 (tableau 4 et 5).
A 24 heures postopératoires :
L’évaluation de la douleur à 24 heures postopératoires retrouve une moyenne de 0.8 dans le groupe R+ et de 0.89 dans le groupe R-. La comparaison des 2 moyennes selon la formule de wilcoxon ne retrouve pas une différence statistiquement significative puisque p=0.31. Pour un score FLACC ≤3 (douleurs minimes), la proportion des patients dans le groupe R+ (97%) est légèrement moins importante par rapport au groupe R- (100%), mais cette différence est statistiquement non significative puisque p=1 selon le test CHI2 (tableau 4 et 5).
39 Tableau 4 : Comparaison de la moyenne des douleurs entre les 2 groupes à 30 minutes, 6 et 24 heures selon la formule de Wilcoxon.
Tableau 5 : Comparaison des proportions de douleurs minimes (FLACC≤3) entre les 2 groupes à 30 minutes, 6 et 24 heures postopératoires par le test de CHI2.
40
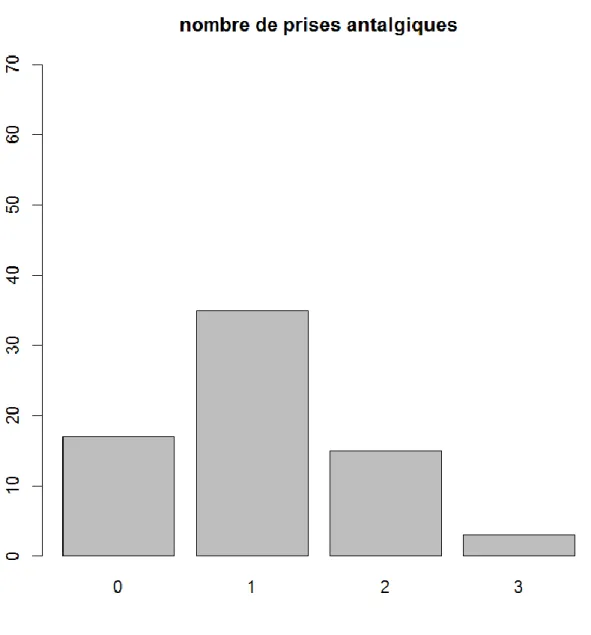
Nombre de prise d’antalgiques :
Dans la population totale, on remarque que 76% des patients ont eu recours aux antalgiques postopératoires (au moins une prise) contre 24% de patients qui n’ont eu aucune consommation d’antalgiques en postopératoires. La proportion des patients qui ont eu recours à une seule prise d’antalgiques est la plus importante dans la population totale (figure 8).
Figure 8 : Histogramme montrant les proportions de patients en fonction de nombre de prise d’antalgiques postopératoires dans la population générale.
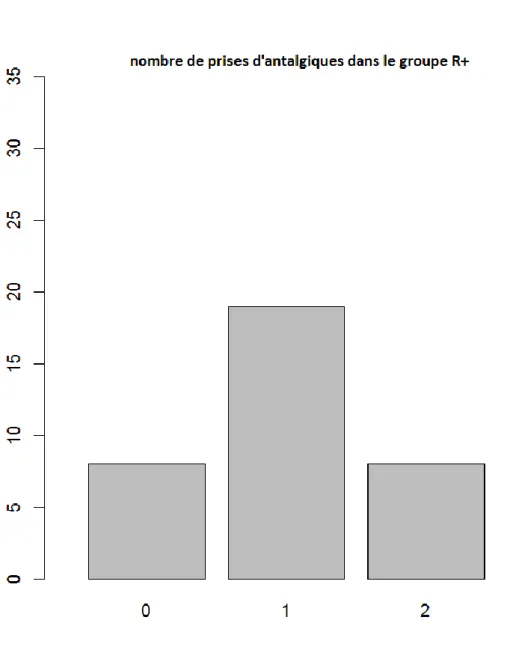
Cette répartition des patients en fonction de nombre de prise d’antalgiques a la même tendance dans les 2 groupes où nous avons remarqué que la majorité de patients ont eu recours à une
41 seule prise (figure 9 et 10). On peut noter aussi que 3 patients (3/35) ont consommé 3 prises d’antalgiques dans le groupe R- alors qu’il n’y avait pas de patients dans le R+ (0/35) qui ont eu recours à cette fréquence de prises d’antalgiques.
Figure 9 : Histogramme montrant les proportions de patients en fonction de nombre de prise d’antalgiques postopératoires dans le groupe avec ropivacaïne.
42 Figure 10 : Histogramme montrant les proportions de patients en fonction de nombre de prise d’antalgiques postopératoires dans le groupe sans ropivacaïne.
La comparaison des 2 groupes au niveau de nombre de prises d’antalgiques ne retrouve pas une différence statistiquement significative puisque p=0.75 selon la formule de wilcoxon. (Tableau 6 et 7).
43 Tableau 6 : Proportion des patients qui ont eu recours à au moins une prise d’antalgiques dans chaque groupe : absence de différence statistiquement significative p=0.78 (CHI2).
Tableau 7 : Proportion des patients en fonction du nombre de prises d’antalgiques dans chaque groupe : absence de différence statistiquement significative p=0.75 (wilcoxon).
44 C. Fréquence cardiaque
L’évaluation de la fréquence cardiaque minimale atteinte en peropératoire retrouve une moyenne de 70.11 battements par minute (bpm) dans le groupe R+ et de 55.94 bpm dans le groupe R-. La comparaison des 2 moyennes retrouve une différence statistiquement significative entre les 2 groupes puisque p=0.001 selon le test de student (tableau 8).
La proportion des patients qui ont eu une bradycardie peropératoire (FC<60bpm) est de 17% dans le groupe R+ et de 43% dans le groupe R-. Cette différence est statistiquement significative p=0.02 selon le test de CHI2 (tableau 8).
On peut noter aussi que 2 patients dans le groupe R- ont eu besoin d’atropine en peropératoire pour une bradycardie persistante malgré l’arrêt de toute manipulation chirurgicale alors qu’un seul patient dans le groupe R+ a eu besoin d’atropine. Il n’a pas eu de comparaison statistique entre les 2 groupes pour l’utilisation d’atropine à cause de la faible fréquence de cet événement.
Tableau 8 : Comparaison de moyennes de la fréquence cardiaque minimale peropératoire et de la survenue de bradycardie entre les 2 groupes. La différence est statistiquement significative entre les 2 groupes pour les 2 paramètres étudiés.
45 D. Mydriase peropératoire
L’incidence de la survenue de mydriase dans le groupe R+ est de 34 patients sur 35 (97%). Un seul patient n’a pas eu de mydriase après injection sous ténonienne de ropivacaïne. L’analyse des antécédents de ce patient ne retrouve pas d’uvéites ou d’anomalies iriennes connues qui pouvaient expliquer l’absence de mydriase. Nous n’avons pas pu comparer ce phénomène sur le 2éme œil du patient puisqu’il était opéré d’un seul côté.
46
VII. DISCUSSION
L’anesthésie sous-ténonienne avec la ropivacaïne en début de chirurgie de strabisme n’a pas eu d’influence dans notre étude sur les douleurs postopératoires et notamment sur la fréquence de consommation d’antalgiques en postopératoire. Nous n’avons pas pu prouver l’efficacité de la ropivacaïne dans la réduction des douleurs postopératoires puisque la différence entre les 2 groupes n’était pas statistiquement significative (p>0.05 pour tous les intervalles de temps étudiés). Concernant le reflexe oculocardiaque, on a pu montrer une réduction statistiquement significative de l’incidence de bradycardie peropératoire (p<0.05).
On trouve dans la littérature plusieurs études qui ont évalué l’effet de la ropivacaïne sur les douleurs postopératoires en chirurgie ophtalmologique générale (chirurgie de la cataracte, chirurgie du segment postérieur…) mais aucune de ses études n’a étudié son effet sur les douleurs dans la chirurgie de strabisme et notamment en injection sous ténonienne.
Le choix de la ropivacaïne en péribulbaire par rapport aux autres anesthésiques locaux dans la chirurgie de la cataracte a été dictée par sa capacité à causer une durée moindre et plus courte du bloc moteur, à des doses identiques par rapport à la bupivacaïne. Cependant l’analgésie sensitive est plus prolongée avec la ropivacaïne [14].
L’étude de BERGMAN et Al a comparé l’effet d’injection sous ténonienne de ropivacaïne 0.75% par rapport au sérum physiologique sur les douleurs postopératoires dans la chirurgie de décollement de rétine sous anesthésie générale et a déduit à une réduction statistiquement significative des douleurs associée à une moindre utilisation d’antalgiques postopératoire [6]. FARMERY a comparé dans son essai l’effet d’une anesthésie sous ténonienne contre placebo (solution saline) dans la chirurgie vitréo-rétinienne chez l’adulte et a conclu à une réduction significative de la consommation d’antalgiques péri-opératoires et une diminution de la bradycardie peropératoire [15].
OZCAN et Al ont démontré la supériorité de la ropivacaïne en péribulbaire sur le mélange bupivacaïne-lidocaïne dans la chirurgie de cataracte pour la réduction des douleurs post opératoires, mais moins efficace pour la qualité du bloc moteur [16].
47 SETHI et Al ont démontré dans un essai randomisé en double aveugle, réalisé sur 63 nourrissons, la supériorité de l’anesthésie sous ténonienne sur le fentanyl pour l’analgésie postopératoire, dans la chirurgie de cataracte chez le nourrisson [17]. Cette supériorité a été retrouvé par CHHABRA et Al dans une étude chez les enfants opérés d’une chirurgie vitréo-rétinienne [18].
Une revue de la littérature réalisée par GUAG et Al pour l’anesthésie locale dans la chirurgie de cataracte (anesthésie topique contre sous ténonienne) a retrouvé que l’anesthésie topique est moins efficace sur la douleur dans les heures qui suivent l’intervention et supérieure au bloc sous ténonien à 24 heures postopératoire [19].
L’étude de STEIB a évalué l’influence de l’injection sous ténonienne de bupivacaïne lors de la chirurgie de strabisme pédiatrique sur les douleurs postopératoires et le ROC. Elle a porté sur 40 enfants randomisés pour recevoir une injection sous ténonienne de bupivacaïne 0.5% ou une injection saline avant le début de la chirurgie. Il conclut que la bupivacaïne en début d’intervention réduisait significativement les douleurs à 30 minutes postopératoires (p<0.001) ainsi que la consommation d’antalgiques (p<0.01). L’incidence du ROC fut aussi significativement réduite (p<0.01) [20].
BAKR RH et Al ont analysé dans un essai en double aveugle chez des jeunes enfants de 2 à 6 ans l’effet de la bupivacaïne en injection sous ténonienne contre une solution saline sur les douleurs postopératoires ainsi que le ROC. Il en conclut à une diminution statistiquement significative des douleurs uniquement en postopératoire immédiat (à 30 minutes) et sans efficacité sur les autres intervalles de temps et une réduction significative du ROC (p<0.05) [21].
RAMACHANDRAN et Al ont trouvé des résultats comparables aux nôtres [22], dans une étude randomisée en double aveugle évaluant l’efficacité du bloc sous ténonien sur la réduction des douleurs postopératoires et l’incidence du reflexe oculocardiaque dans la chirurgie du strabisme pédiatrique. L’étude était réalisée sur 67 enfants âgés de 2 à 12 ans, séparés en deux groupes, le premier recevant un bloc sous ténonien et le second du fentanyl par voie intraveineuse. L’évaluation de la douleur était faite par l’échelle CHEOPS. Ils déduisent à une absence de différence statistiquement significative pour le score des douleurs postopératoires en salle de réveil et jusqu’à 24 premières heures après la chirurgie. L’incidence du ROC était significativement plus élevée dans le groupe recevant le fentanyl.
48 Notre étude ne permet pas de conclure à une réduction des douleurs postopératoires en utilisant la ropivacaïne en sous ténonien, à l’inverse des autres études précitées qui ont conclu à une diminution des douleurs avec la bupivacaïne. Ces résultats peuvent être dû à l’absence d’un groupe contrôle utilisant un placebo comme une solution saline en injection sous ténonienne dans notre étude. L’évaluation des douleurs par des équipes paramédicales différentes peut aussi contribuer à un biais d’évaluation. Cela pourrait aussi être dû aux différents facteurs comme l’existence de plusieurs gestes chirurgicaux utilisés (recul musculaire, cuppers, antéroposition musculaire) qui sont probablement différemment douloureux, ainsi au nombre de muscles opérés pour chaque patient.
Pour le ROC, nous aboutissons aux mêmes conclusions que les autres études publiées utilisant d’autres anesthésiques locaux en sous ténonien où nous trouvons une diminution significative de l’incidence du ROC.
Pour la mydriase : des hypothèses différentes ont été formulées pour expliquer le phénomène [13] :
La libération de messagers chimiques de la conjonctive et/ou du muscle traumatisé ; le détachement du muscle de la sclérotique, menant à la perturbation de partie de la circulation ciliaire antérieure avec ischémie partielle de l’Iris
La traction de l'œil dans les positions extrêmes de regard fixe, avec l'étirement mécanique des nerfs dans l'orbite, aboutissant au signe de Toumay (mydriase présente dans le regard fixe latéral extrême)
Nous n’avons retrouvé qu’une seule étude [13] ayant analysée l’effet mydriatique de la ropivacaïne par voie sous-ténonienne dans la chirurgie du strabisme. L’étude de Savino fut réalisée sur 16 adultes. L’objectif était de démontrer que la mydriase induite n’était pas secondaire à la libération de messagers chimiques par la conjonctive et/ou le muscle traumatisés (hypothèse émise par C.B. James [23] qui avançait également que le détachement du muscle de la sclérotique, menait à la perturbation d’une partie de la circulation ciliaire antérieure avec ischémie partielle de l'Iris) mais liée à la ropivacaïne. Dans laquelle, un groupe contrôle (C) ayant reçu une solution saline par voie ST (volume 2.5-3ml) fut comparé à un groupe ayant reçu la ropivacaïne (R) d’un même volume par voie ST et dans les deux cas de la même manière,
49 à savoir après incision conjonctivale et avant tout geste sur les MOM. Le groupe R vit son diamètre pupillaire doublé développant ainsi une mydriase alors que le diamètre pupillaire restait inchangé dans le groupe C. Cela démontre que le phénomène n'est pas lié à la libération de messagers chimiques locaux ou systémiques (c'est-à-dire, l'adrénaline) de la conjonctive et/ou des muscles traumatisés soulignant bien le rôle de la ropivacaïne par voie sous ténonienne. D’autant plus, que la mydriase dans le groupe R était initialement irrégulière, débutant dans le quadrant où fut réalisée l’injection ST de Ropivacaïne.
Notre observation retrouvait une mydriase dans 97 % contre 100% dans l’étude de Savino. Un seul œil ne fut pas en mydriase. Il s’agissait d’un patient opéré que d’un œil. Une comparaison avec l’œil control-latéral ne fut donc pas possible.
Ils émirent l’hypothèse qu'il peut être lié à un bloc de ganglion ciliaire pharmacologique par la ropivacaïne arrivant avant le détachement de muscle seulement dans l'œil opéré. Hypothèse également soutenue par notre étude étant donné que l’injection fut réalisée avant mobilisation des MOM et de mobiliser le globe dans les positions extrêmes (et donc pas de signe de Tournay).
L’anesthésie sous ténonienne a été présenté comme un bloc simple, sûr et efficace dans les années 1990 [24,25,26,27]. Cependant des rapports de cas de complications mineures et majeures voire mortelles ont été signalées.
Les complications mineures telles que le chémosis et l’hémorragie sous conjonctivale ne sont pas menaçantes pour la vue et ne rendent pas la chirurgie plus compliquée. Elles peuvent être limiter par une dissection conjonctivale minutieuse et en appliquant une légère pression sur le globe après l’injection sous ténonienne, ce qui réduit l’expansion de l’hémorragie et du chémosis [28].
Dans les complications majeures, deux cas d’anesthésie du tronc cérébral après anesthésie sous ténonienne ont été rapportés dans la littérature. L’étiologie exacte de la propagation de l’agent anesthésique local au niveau du système nerveux central n’est pas claire, mais l’hypothèse de la propagation directe de l’anesthésique local dans l’espace sous arachnoïdien peut être avancée. Rüshen et al [29] ont suggéré que l’anesthésique local aurait traversé le fourreau dural du nerf optique à travers une perforation qui a eu lieu lors de la dissection de l’espace sous ténonien à la pointe des ciseaux de Westcott. Les symptômes et les signes vont de la
50 somnolence, confusion à des paralysies des nerfs crâniens, des convulsions, une dépression respiratoire et un arrêt cardiaque.
D’autres complications graves peuvent survenir lors d’une anesthésie sous ténonienne comme la perforation du globe. Frieman et Friedberg [30] ont rapportés un épisode de perforation du globe chez un patient aux antécédents de chirurgie de décollement de rétine. Un deuxième cas a été signalé par Faure et Al [31].
Trois cas d’hémorragies rétrobulbaires ont été publiés. La survenue d’hémorragie est arrivée entre l’injection sous ténonienne et le début de la chirurgie [32,33,34]. L’hypothèse étiologique est le traumatisme direct des vaisseaux sanguins par la canule d’injection.
Plusieurs cas d’ischémies rétiniennes par occlusion de l’artère centrale de la rétine ont été rapportés [35,36,37]. La cause de cette complication reste inconnue mais semble due à une augmentation de la pression intraoculaire (> pression artérielle moyenne de l’artère ophtalmique ou artère centrale de la rétine).
Enfin, plusieurs cas de diplopie après une anesthésie sous ténonienne pour chirurgie ophtalmologique autre que le strabisme ont été publiés [38,39,40]. Le mécanisme supposé est le traumatisme direct du muscle par les ciseaux ou la canule d’injection, ou par le biais de la myotoxicité de la solution anesthésique locale.
Dans notre étude nous n’avons enregistré aucun cas de complications graves. La fréquence des complications mineures n’était pas évaluée comme elles n’ont aucun effet sur la chirurgie et les douleurs postopératoires.
Enfin, notre étude a pour force d’être prospective, randomisée, avec un nombre élevé de patients opérés par le même chirurgien. Cependant il existe quelques limites dans notre étude. Elle était monocentrique limitant ainsi la généralisation des résultats. L’analyse en double aveugle était absente dans notre essai. L’évaluation de la douleur postopératoire était réalisée par des équipes paramédicales différentes, pouvant contribuer à un biais d’évaluation.
51
VIII. CONCLUSION
Notre étude prospective, randomisée n’a pas prouvé une réduction statistiquement significative des douleurs postopératoires dans la chirurgie de strabisme chez l’enfant en utilisant la ropivacaïne comme anesthésique local. Son action antalgique a été démontré dans d’autres chirurgies ophtalmologiques autre que la chirurgie de strabisme.
Cela pourrait être dû aux différents facteurs comme l’existence de plusieurs gestes chirurgicaux utilisés (recul musculaire, cuppers, antéroposition musculaire) qui sont probablement différemment douloureux, ainsi au nombre de muscles opérés pour chaque patient.
Une autre étude prenant en considération tous ces facteurs sera nécessaire afin de confirmer ou d’affirmer l’action de la ropivacaïne sur les douleurs postopératoires dans la chirurgie de strabisme chez l’enfant.
L’action préventive de la ropivacaïne contre la bradycardie peropératoire est confirmée par notre étude avec une valeur prédictive élevée. La ropivacaïne a diminué significativement l’incidence de bradycardie sévère qui reste un évènement stressant pour le chirurgien et pour l’anesthésiste.
La survenue de mydriase chez la grande majorité des patients injecté de ropivacaïne prouve son action de bloc pharmacologique au niveau du ganglion ciliaire
![Figure 1 : origine des MOM et des éléments vasculo-nerveux associés d’après : A Ducasse P De Gottrau [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/5637157.136231/15.892.111.622.285.867/figure-origine-éléments-vasculo-nerveux-associés-ducasse-gottrau.webp)
![Figure 2 : Insertion des muscles droits et spirale de Tillaux d’après : A Ducasse, P De Gottrau [3]](https://thumb-eu.123doks.com/thumbv2/123doknet/5637157.136231/16.892.120.815.144.446/figure-insertion-muscles-droits-spirale-tillaux-ducasse-gottrau.webp)