Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR de médecine et de pharmacie
Laboratoire pharmacologie des anti-infectieux (Poitiers) (Diplôme National - Arrêté du 25 mai 2016) École doctorale : Biologie-santé - Bio-santé (Limoges)
Secteur de recherche : Médecine
Présentée par : Matthieu Boisson
Étude de la nébulisation de deux antibiotiques en ventilation mécanique
Directeur(s) de Thèse : Olivier Mimoz, Nicolas Gregoire Soutenue le 29 novembre 2016 devant le jury Jury :
Président Karine Nouette-Gaulain Professeur et praticien hospitalier, Université de Bordeaux Rapporteur Jacques Duranteau Professeur et praticien hospitalier, Université Diderot, Paris Rapporteur Stephan Ehrmann Professeur et praticien hospitalier, Université de Tours Membre René Robert Professeur et praticien hospitalier, Université de Poitiers
Membre Hervé Dupont Professeur et praticien hospitalier, Université de Picardie, Amiens
Pour citer cette thèse :
Matthieu Boisson. Étude de la nébulisation de deux antibiotiques en ventilation mécanique [En ligne]. Thèse Médecine. Poitiers : Université de Poitiers, 2016. Disponible sur Internet <http://theses.univ-poitiers.fr>
L’UNIVERSITÉ DE POITIERS
École Doctorale n° 524 Bio-Santé du PRESS Limousin-Poitou-Charentes
Secteur de Recherche : Médecine
INSERM U1070 – Pharmacologie des agents anti-infectieux
Pour l’obtention du grade de
DOCTEUR DE L’UNIVERSITÉ DE POITIERS
Présentée et soutenue le
29 novembre 2016
par
Matthieu BOISSON
Étude de la nébulisation de deux antibiotiques
en ventilation mécanique
Directeurs de Thèse
Pr Olivier MIMOZ
Dr Nicolas GRÉGOIRE
Membres du jury
Pr Karine NOUETTE-GAULAIN
, Université de Bordeaux
Présidente
Pr Jacques DURANTEAU
, Université Paris Diderot de Paris VII
Rapporteur
Pr Stephan EHRMANN
, Université François Rabelais de Tours
Rapporteur
Pr Hervé DUPONT
, Université Picardie Jules Vernes d’Amiens
Examinateur
REMERCIEMENTS
A Monsieur le Professeur Olivier MIMOZ
Merci pour m’avoir donné le goût à la recherche, pour m’avoir guidé pendant toutes ces années. Merci pour la qualité de vos enseignements, pour m’avoir fait confiance dans la conduite de ce travail et pour avoir toujours su trouver les mots justes pour maintenir la motivation nécessaire.
A Monsieur le Docteur Nicolas GREGOIRE
Merci pour ton aide précieuse, ta patience et ton écoute. Merci pour m’avoir accompagné depuis toutes ces années dans le monde de la modélisation.
A Monsieur le Professeur Jacques DURANTEAU
Merci de me faire l’honneur d’avoir accepté d’être rapporteur de ce travail. Je vous remercie pour votre disponibilité.
A Monsieur le Professeur Stephan EHRMANN
Merci de me faire l’honneur d’avoir accepté d’être rapporteur de ce travail et ainsi de partager votre expertise dans le domaine de la nébulisation d’antibiotiques.
A Monsieur le Professeur Hervé DUPONT
Merci d’avoir accepté de juger ce travail. Je suis très honnoré que vous ayez accepté de faire le voyage pour participer à ce jury.
A Madame le Professeur Karine NOUETTE-GAULAIN
Merci de me faire l’honneur de participer à ce jury. Merci pour votre gentillesse et votre disponibilité.
A Monsieur le Professeur René ROBERT
Merci pour la qualité de vos enseignements depuis mon externat. Soyez assuré de ma profonde reconnaissance pour avoir accepté de juger ce travail.
A Monsieur le Professeur William COUET
Merci pour votre accueil au sein de l’équipe, merci pour vos précieux conseils tout au long de la réalisation de ce travail. Merci par avance pour ce que nous construirons ensemble dans les prochaines années.
A Madame le Professeur Sandrine MARCHAND
Merci pour ta rigueur et tes conseils avisés. Sois assurée de ma profonde reconnaissance.
A Monsieur le Professeur Bertrand DEBAENE
Pour la rigueur de votre enseignement, votre loyauté envers votre équipe et votre engagement pour le bien commun, travailler à vos côtés est un honneur. Merci pour votre confiance, j’espère ne jamais vous décevoir.
A Monsieur le Docteur Denis FRASCA
Ton soutien, ta gentillesse, ta capacité à trouver les mots justes pour redonner confiance et remotiver ont contribué grandement à la finalisation de ce travail. C’est une joie de travailler au quotidien à tes côtés et une chance de pouvoir construire ensemble notre avenir au sein du département d’anesthésie-réanimation.
A Marielle CORMIER et Mirza HADZIC
Merci pour la disponibilité et la rigueur dont vous avez fait preuve lors de votre participation à ce travail.
A Valérie, pour ton aide précieuse dans la dernière ligne droite.
A Christophe ADIER, Patrice GOBIN, Matthieu JACOBS, Isabelle LAMARCHE et à toute l’équipe INSERM U-1070,
A Anne-Laure, Dorothée, Nadia, Sabrina, A l’équipe de réanimation chirurgicale,
A l’équipe du bloc commun, et à tous mes collègues anesthésiste-réanimateurs, A Isabelle et Laurence,
Aux internes et étudiants dont j’ai la charge, A Xavier,
A Amandine, Anne-Bénédicte, Bénédicte, Dorothée, Elisabeth, Fabien, Grégory, Mathieu, Nicolas, Pierre-Etienne, les deux Serge, Thibaut, Valérie et tous mes amis,
« On ne voit bien qu’avec le cœur.
L’essentiel est invisible pour les yeux.
»
Antoine
DES
AINT-E
XUPERY,
Le petit prince.
RÉSUMÉ
Les pneumopathies acquises sous ventilation mécanique (PAVM) sont responsables d’une mortalité élevée. La nébulisation d’antibiotiques permet d’améliorer l’efficacité de leur traitement. Pour autant, aucune donnée pharmacocinétique portant sur la colistine et la gentamicine ne permet de recommander un schéma posologique particulier.
Nous avons comparé les propriétés pharmacocinétiques plasmatique et intra-pulmonaire de la colistine (administrée sous forme de prodrogue, le colistiméthate sodique ou CMS) et de la gentamicine selon le mode d’administration (nébulisation ou perfusion intraveineuse) chez des patients de réanimation présentant une PAVM.
Les concentrations intra-pulmonaires de colistine et de gentamicine étaient, respectivement, de 10 à 40 et 50 à 70 fois supérieures, après nébulisation, à celles retrouvées après administration d’une même dose par voie intraveineuse. La nébulisation permettrait également de limiter le risque de toxicité systémique avec une biodisponibilité inférieure à 10 %.
En assurant de fortes concentrations intra-pulmonaires et un faible passage systémique, la nébulisation de CMS et de gentamicine pourrait être une bonne alternative à leur administration intraveineuse dans le traitement des PAVM.
Mots-clés : aérosolthérapie, nébulisation, colistine, CMS, gentamicine, aminoside, pneumopathie acquise sous ventilation mécanique, pharmacocinétique
ABSTRACT
Ventilator-associated pneumonia (VAP) is associated with high mortality. Nebulization of antibiotics improves outcome of patient with VAP. However, pharmacokinetic data concerning colistin and gentamicin allowing for optimal dosing regimen recommendation are lacking.
We compared systemic and pulmonary concentrations of colistin (administered as an inactive prodrug, colistin methanesulfonate or CMS) and gentamicin according to the route of administration (nebulization and intravenous infusion) in critically ill patients with VAP.
Intra-pulmonary concentrations of colistin and gentamicin were 10 to 40-fold and 50 to 70-fold much higher after nebulization than after the same dose by intravenous route, respectively. Nebulization has also the theoretical potential advantage to improve patients’ safety in relation to the colistin biodisponibility lower than 10 %.
With high intra-pulmonary concentrations and very low systemic absorption, CMS and gentamicin nebulization may be good alternatives to intravenous infusion for VAP treatment. Keywords: aerosolization, nebulization, colistin, CMS, gentamicin, aminoglycoside, ventilator-associated pneumonia, pharmacokinetic
LISTE DES PUBLICATIONS
Articles publiés
Boisson M, Grégoire N, Couet W, Mimoz O. Colistin in critically ill patients. Minerva
Anestesiologica 2013 Feb;79(2):200-8 (Article I).
Boisson M, Jacobs M, Grégoire N, Gobin P, Marchand S, Couet W, Mimoz O. Comparison of intrapulmonary and systemic pharmacokinetics of colistin methanesulfonate (CMS) and colistin after aerosol delivery and intravenous administration of CMS in critically ill patients. Antimicrob Agents Chemother 2014 Dec;58(12):7331-9 (Article II).
Articles soumis
Boisson M, Grégoire N, Cormier M, Gobin P, Marchand S, Couet W, Mimoz O. Intrapulmonary and systemic pharmacokinetics of colistin methanesulfonate (CMS) and colistin after aerosol delivery of 0.5 MIU of CMS in critically ill patients. Soumis dans
Journal of Antimicrobial Chemotherapy (Soumission I).
Marchand S, Boisson M, Grégoire N, Lamarche I, Laroche J, Mimoz O, Couet W. Biopharmaceutical characterization of nebulized antimicrobial agents in rats: 6. amikacin and gentamicin. Soumis dans Antimicrobial Agents and Chemotherapy (Soumission II).
Communications orales
Boisson M, Mimoz O. Pharmacocinétique et pharmacodynamie de la colistine en réanimation.
28ème Réunion Interdisciplinaire de Chimiothérapie Anti-Infectieuse, 4-5 décembre 2008,
Paris, France.
Boisson M, Marchand S, Couet W, Debaene B, Mimoz O. Étude de la pharmacocinétique du colistiméthate (CMS) et de la colistine après administration de CMS par aérosol chez 5
patients sous ventilation mécanique. 52ème Congrès National d’Anesthésie et de
Réanimation. 22-25 septembre 2010, Paris, France.
Boisson M, Marchand S, Grégoire N, Gobin P, Mimoz O, Couet W. Plasma pharmacokinetics and epithelial lining fluid (ELF) concentrations of colistin after nebulization or intravenous administration of colistinmethane sulfonate (CMS) in critical care patients.
52nd Interscience Conference on Antimicrobial Agent and Chemotherapy, 9-12
Boisson M, Grégoire N, Couet W, Debaene B, Mimoz O. Distribution de la colistine dans le film alvéolaire après nébulisation et administration intraveineuse (IV) de colistiméthate
(CMS) chez 6 patients sous ventilation mécanique. 54ème Congrès National d’Anesthésie
et de Réanimation. 19-22 septembre 2012, Paris, France.
Boisson M, Grégoire N, Couet W, Debaene B, Mimoz O. Diffusion intra-alvéoloaire de la colistine et du colistiméthate sodique (CMS) après nébulisation et administration intraveineuse (IV) de CMS chez 12 patients de réanimation sous ventilation mécanique
(VM). 55ème Congrès National d’Anesthésie et de Réanimation. 18-21 septembre 2013,
SOMMAIRE
I. INTRODUCTION GÉNÉRALE ... 12
I.1. INCIDENCE DES PNEUMOPATHIES ACQUISES SOUS VENTILATION MECANIQUE ... 12
I.2. RESISTANCES ... 12
I.3. IMPASSE THERAPEUTIQUE ... 16
II. RATIONNEL DE LA NÉBULISATION D’ANTIBIOTIQUES... 19
II.1. LA BARRIERE ALVEOLO-CAPILLAIRE ... 19
II.2. L’APPORT DES ETUDES EXPERIMENTALES ... 21
II.3. EFFICACITE ... 22 III. LA COLISTINE ... 24 III.1. GENERALITES ... 24 III.2. PHARMACODYNAMIE ... 24 III.3. PHARMACOCINÉTIQUE ... 29 III.4. TOXICITÉ ... 32
III.5. REVIEW:COLISTIN IN CRITICALLY ILL PATIENT (ARTICLE I) ... 34
III.6. CONCLUSION ... 57 IV. LA GENTAMICINE ... 58 IV.1. GENERALITES ... 58 IV.2. PHARMACODYNAMIE ... 58 IV.3. PHARMACOCINETIQUE ... 60 IV.4. TOXICITE ... 61 IV.5. CONCLUSION ... 63 V. ÉTUDE PHARMACOCINETIQUE-PHARMACODYNAMIQUE DU CMS ET DE LA COLISTINE APRES ADMINISTRATION PARENTERALE ET NEBULISEE DE CMS CHEZ DES PATIENTS SOUS VENTILATION MECANIQUE ... 64
V.1. COMPARISON OF INTRAPULMONARY AND SYSTEMIC PHARMACOKINETICS OF COLISTIN METHANESULFONATE (CMS) AND COLISTIN AFTER AEROSOL DELIVERY AND INTRAVENOUS ADMINISTRATION OF CMS IN CRITICALLY ILL PATIENTS (ARTICLE II) ... 64
V.2. INTRAPULMONARY AND SYSTEMIC PHARMACOKINETICS OF COLISTIN METHANESULFONATE (CMS) AND COLISTIN AFTER AEROSOL OF 0.5 MIU OF CMS IN CRITICALLY ILL PATIENTS (SOUMISSION I) ... 90
VI. ÉTUDE PHARMACOCINETIQUE DE LA GENTAMICINE APRES NÉBULISATION .... ... 111
VI.1. BIOPHARMACEUTICAL CHARACTERIZATION OF NEBULIZED ANTIMICROBIAL AGENTS IN RATS:6.AMIKACIN AND GENTAMICIN (SOUMISSION II) ... 111
VI.2. COMPARAISON PHARMACOCINETIQUE INTRA-PULMONAIRE ET PLASMATIQUE DE LA GENTAMICINE ADMINISTREE PAR VOIE INTRAVEINEUSE OU NEBULISEE CHEZ DES PATIENTS PRESENTANT UNE PNEUMOPATHIE ACQUISE SOUS VENTILATION MECANIQUE ... 122
VII. DISCUSSION ... 143
VIII. CONCLUSION GENERALE ET PERSPECTIVES... 149
LISTE DES ABRÉVIATIONS
AFSSAPS : agence française de sécurité sanitaire des produits de santé AMM : autorisation de mise sur le marché
AMR : antimicrobial resistance
ANSM : agence nationale de sécurité du médicament ARN : acide ribonucléique
ATP : adénosine triphosphate AUC : area under curve BAL : bronchoalveolar lavage BGN : bactérie à Gram négatif CBA : colistin-based activity CFU : colony-forming unit CG : cocci à Gram
CGP : cocci à Gram positif
CLSI : clinical and laboratory standards institute Cmax : concentration plasmatique maximale
CMI : concentration minimale inhibitrice CMS : colistiméthate sodique
CPP : comité de protection des personnes CV : coefficient of variation
Da : dalton
EARSN : european antimicrobial resistance surveillance network ECDC : european centre for disease prevention and control ELF : epithelial lining fluid
EMA : european medicines agency EMEA : europe middle east and africa
EUCAST : european committee on antimicrobial susceptibility testing FDA : food and drug administration
Fr : french
FQRP : fluoroquinolone-resistant pseudomonas aeruginosa HPLC : high performance liquid chromatography
ICU : intensive care unit
IDSA : infectious diseases society of america IIV : interindividual variability
IMC : indice de masse corporelle
INICC : international nosocomial infection control consortium IOV : interoccasion variability
IU : international unit IV : intra-veineux
LBA : lavage broncho-alvéolaire
LC-MS/MS : liquid chromatography coupled to tandem mass spectrometry LOQ : limit of quantification
LPS : lipopolysaccharide
MIC : minimum inhibitory concentration
MRSA : methicillin-resistant staphylococcus aureus NDPE : normalized prediction distribution errors NEB : nébulisation
NNIS : national nosocomial infections surveillance
PAVM : pneumopathie acquise sous ventilation mécanique PK-PD : pharmacocinétique-pharmacodynamique
RSE : relative standard error
SAMR : staphylococcus aureus résistant à la méticilline SAPS II : new simplified acute physiology score
SHA : solution hydro-alcoolique
SOFA : sequential organ failure assessment
SPILF : société de pathologie infectieuse de langue française SSC : surface sous la courbe
Tmax : délai d’atteinte de la concentration plasmatique maximale
T½ : demi-vie
UI : unité internationale VPC : visual predictive check
I.
INTRODUCTION GÉNÉRALE
I.1.
I
NCIDENCE DES PNEUMOPATHIES ACQUISES SOUS VENTILATIONMECANIQUE
Les infections associées aux soins sont un vrai enjeu de santé publique en raison de leur fréquence et de leurs conséquences individuelles et collectives. Selon les études, en réanimation, les pneumopathies acquises sous ventilation mécanique (PAVM) représentent près de la moitié de l’ensemble des infections associées aux soins (Vincent et al. 1995), touchant 9 à 28 % des patients ventilés (Chastre & Fagon 2002, Cook et al. 1998, Haley et al. 1981, NNIS 2004). Elles sont responsables d’une prolongation de la durée de ventilation mécanique de près de dix jours, de la durée de séjour en réanimation et donc d’hospitalisation, d’une augmentation de la consommation en antibiotique et donc de l’émergence de bactéries multi-résistantes et d’une mortalité élevée allant de 24 à 50 % selon les pathogènes responsables (Celis et al. 1988, Rello et al. 2002, Torres et al. 1990).
I.2.
R
ÉSISTANCESEn Europe, selon un rapport de l’European Center for Disease Prevention and Control (ECDC), 25 000 personnes décèdent chaque année d’une infection secondaire à une bactérie multi-résistante. Dans certains pays (principalement du sud de l’Europe), la résistance des bactéries à Gram négatif (BGN) aux antibiotiques usuels (fluoroquinoles, céphalosporines, carbapénèmes, etc.) dépasse les 25 %. Ainsi, chaque année, ces infections représentent un coût hors frais de santé estimé à 1,5 milliards d’euros (ECDC & EMA 2009).
I.2.1.
Les caractéristiques des BGN
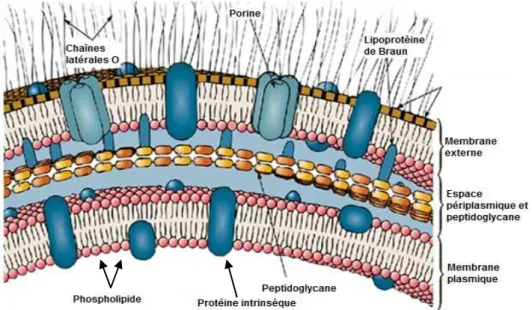
Les BGN sont caractérisées par une structure bi-membranaire composée par une membrane externe, un espace péri-plasmique et la membrane plasmique.
La membrane externe est une bi-couche composée de phospholipides et de lipopolysaccharide (LPS). De nombreuses protéines sont insérées au sein de cette membrane avec notamment les protéines de transport ou porines et les protéines d’adhérence ou adhésines. L’espace péri-plasmatique est une zone de stockage d’enzymes. La membrane plasmatique est, quant à elle, constituée uniquement de phospholipides. Elle présente également à sa surface des porines (Figure 1) (Fauchère & Avril 2002).
Figure 1 – Structure membranaire des BGN
I.2.2.
Les mécanismes de résistance des BGN
Du fait de cette structure particulière, les BGN sont en mesure de développer rapidement des mécanismes de défense aux antibiotiques. Ainsi, les principaux mécanismes de résistances aux antibiotiques sont (Ho et al. 2010) :
- la production d’enzymes inactivatrices des antibiotiques (β-lactamases, enzymes
modifiant les aminosides par fixation de différents radicaux),
- la modification du site de fixation des antibiotiques (principal mécanisme de
résistances aux fluoroquinolones),
- la modification de la membrane externe entraînant une diminution de la
perméabilité aux antibiotiques (notamment les porines),
- l’activation des pompes d’efflux sur la membrane externe.
I.2.3.
Épidémiologie des résistances des bactéries à Gram négatif
Lors de son rapport publié en 2012 (janvier 2004 à décembre 2009), le INICC (International Nosocomial Infection Control Consortium), regroupant 36 pays, retrouve en réanimation un taux de résistance élevé des BGN avec, notamment pour les Pseudomonas
aeruginosa isolés dans les PAVM, 46 % de résistance aux fluoroquinolones, 43 % à
l’imipénème, 40 % à la pipéracilline-tazobactam et 38 % à la ceftazidime (Rosenthal et al. 2012).
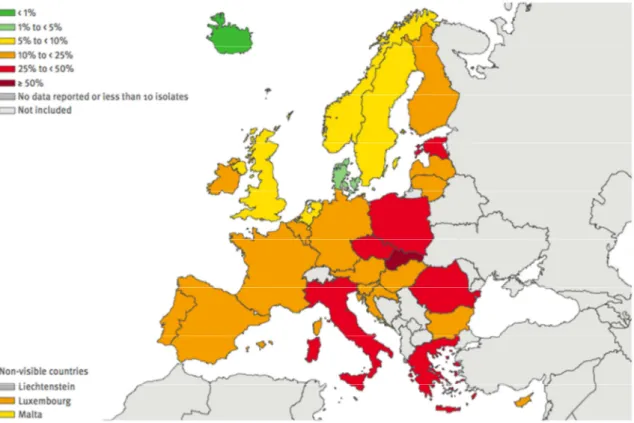
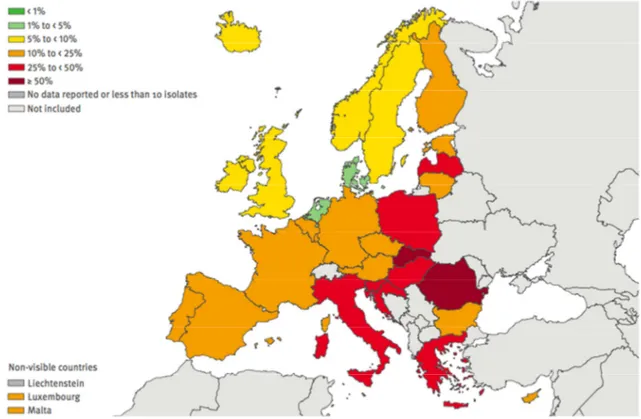
Dans l’Union Européenne, dans son rapport 2013, l’agence européenne de surveillance des résistances aux antibiotiques (European Antimicrobial Resistance Surveillance Network) rapporte que le phénomène de multi-résistance des BGN intervient dans les mêmes proportions, même si l’on note une grande disparité entre les pays européens, avec une plus forte résistance dans les pays de l’Europe de l’Est et la Grèce. Ainsi, en 2013, toujours concernant les Pseudomonas aeruginosa, la résistance atteint 20 % (de 0 à 53 % selon les pays) pour les fluoroquinolones (Figure 2), 18 % (de 3 à 61 %) pour les carbapénèmes (Figure 3), 16 % (0 à 51 %) pour les aminosides (Figure 4), 13 % (0 à 49 %) pour la pipéracilline-tazobactam (Figure 5) et 12 % (0 à 44 %) pour la ceftazidime (ECDC 2014).
Isolées dans 58 % des PAVM, les BGN sont très largement impliquées dans leur survenue et tout particulièrement celles au pouvoir pathogène le plus élevé comme
Pseudomonas aeruginosa et Acinetobacter baumannii, isolées dans 32 % des PAVM (Chastre
& Fagon 2002).
Figure 2 – Proportion de souches isolées de
Pseudomonas
résistantes aux fluoroquinolones en Europe en 2013 (ECDC 2014)Figure 3 – Proportion de souches isolées de
Pseudomonas
résistantes aux carbapénèmes en Europe en 2013 (ECDC 2014)Figure 4 – Proportion de souches isolées de
Pseudomonas
résistantes aux aminosides en Europe en 2013 (ECDC 2014)Figure 5 – Proportion de souches isolées de
Pseudomonas
résistantes à la pipéracilline-tazobactam en Europe en 2013 (ECDC 2014)I.3.
I
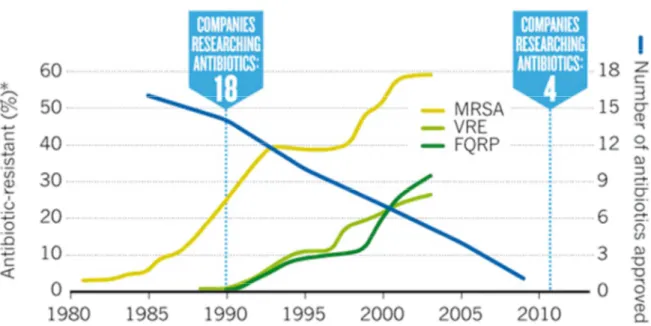
MPASSE THÉRAPEUTIQUELe développement des résistances, notamment lié à une large utilisation des antibiotiques, associé au faible développement de nouvelles molécules anti-infectieuses rend aujourd’hui complexe le traitement des infections associées aux soins. À l’aune du faible développement de nouvelles molécules et de la forte progression des résistances (Figure 6), de nombreux experts prédisent un scénario catastrophe dans les deux prochaines décennies. Aussi, si la découverte de la pénicilline est considérée comme l’une des avancées médicales les plus importantes du XXe siècle, le désintérêt des firmes pharmaceutiques dans la Recherche et le Développement de nouveaux antibiotiques fait craindre un retour en arrière dans la prise en charge des maladies infectieuses.
Figure 6 – Représentation de l’évolution de la proportion de bactéries résistantes comparée au nombre de nouveaux antibiotiques approuvés par la FDA (Cooper & Shlaes
2011)
(MRSA = Staphylocoques aureus Méthicilline-Résistant, VRE = Entérocoque faecium résistant à la Vancomycine, FQRP = Pseudomonas aeruginosa résistant aux Fluoroquinolones)
Depuis 10 ans déjà, l’IDSA (Infectious Diseases Society of America), la société américaine des maladies infectieuses, a tenté d’alerter l’opinion publique et le pouvoir politique dans un rapport annuel intitulé « Bad bugs, no drugs » sur les dangers à court terme du gap thérapeutique en infectiologie (Talbot et al. 2006). En effet, face à l’augmentation des coûts de développement et face à la faible rentabilité des antibiotiques, l’industrie pharmaceutique a préféré privilégier le marché des maladies chroniques. Ainsi, en 2004, sur 506 médicaments en phase de développement, seuls 5 étaient des antibiotiques. Onze ans plus tard, même si des efforts ont été faits dans le développement de molécules contre les SAMR, aucune nouvelle molécule n’a été développée et peu sont en cours de développement contre les BGN multi-résistantes (Boucher et al. 2009).
En 2014, dans un rapport réalisé à la demande du gouvernement britannique, des experts prédisent dix millions de morts par an liés à des bactéries multi-résistantes en l’absence de plan d’action. Les maladies infectieuses retrouveraient alors la première place des causes de mortalité dans le monde après le cancer (AMR 2014).
Aussi, la limitation de l’arsenal thérapeutique contre ces bactéries a contraint les cliniciens à utiliser des molécules anciennes, délaissées en raison d’une toxicité supposée (Talbot et al. 2006). C’est dans ce contexte que la Commission Européenne et le National
Institute of Allergy and Infectious Diseases aux États-Unis ont lancé des programmes de
recherche sur la colistine et d’autres anciens antibiotiques.
Dans ce contexte, l’objectif de notre thèse a été d’évaluer la pharmacocinétique de la colistine et de la gentamicine nébulisées chez des patients de réanimation présentant une PAVM.
II.
RATIONNEL DE LA NÉBULISATION
D’ANTIBIOTIQUES
La pratique de la nébulisation est ancienne et remonte au début de l’antibiothérapie avec, à la fin des années 40, les premières nébulisations de polymyxines, puis rapidement de pénicillines et d’aminosides (Kuhn 2001). Initialement, son utilisation, bien souvent empirique, reposait sur les connaissances physiopathologiques de la barrière alvéolo-capillaire. Malheureusement, l’absence de formulation propre à la voie nébulisée la rendait mal tolérée, avec notamment des bronchospasmes et des irritations des voies aériennes supérieures (excipients de type phénols ou sulfites, hyperosmolarité, acidité, etc.) et le manque de développement de nébulisateurs performants a limité considérablement son utilisation (Quon et al. 2014). Ce n’est qu’à la fin des années 90, avec le développement des thérapeutiques pour la prise en charge des patients atteints de la mucoviscidose, et dans les années 2000, avec les premiers modèles animaux de PAVM, que la nébulisation d’antibiotiques s’est développée.
II.1.
L
A BARRIÈRE ALVÉOLO-
CAPILLAIRELa barrière alvéolo-capillaire est constituée de l’épithélium alvéolaire, d’un tissu conjonctif et d’un réseau capillaire. L’épithélium alvéolaire est formé par les pneumocytes de type I à large cytoplasme et recouvrant 90 % de la surface alvéolaire et les pneumocytes de type II, plus nombreux mais de taille réduite, assurant la production de surfactant. La membrane apicale des pneumocytes est recouverte par une couche liquidienne ou ELF (epithelial lining fluid). D’une épaisseur de 0,2 à 0,3 µm, elle est composée d’une phase aqueuse séparant les cellules épithéliales et d’une phase lipidique située à l’interface gaz-liquide communément appelée surfactant (Figure 7).
À l’état physiologique, la diffusion d’antibiotique est limitée par l’endothélium capillaire d’une part et par l’épithélium alvéolaire d’autre part. Ainsi, la barrière alévéolo-capillaire est virtuellement imperméable, notamment du fait des jonctions serrées. Le mécanisme principal de passage de la barrière est une diffusion passive dépendante des propriétés physico-chimiques de chaque molécule (lipophilie/hydrophilie, ionisation, fixation protéique, etc.). Compte tenu du faible nombre de jonctions inter-cellulaires, le passage des molécules hydrophiles est très faible, à la différence des molécules lipophiles qui ne sont pas bloquées par les membranes cellulaires. La nébulisation d’antibiotiques est donc
particulièrement intéressante pour les antibiotiques hydrophiles (comme la colistine ou les aminosides).
Au décours de l’infection, plusieurs processus peuvent altérer le fonctionnement de la barrière alvéolo-capillaire. Ainsi, la réaction inflammatoire locale entraîne une altération de l’épithélium alvéolaire et tend à le rendre plus perméable, ce qui pourrait faciliter la diffusion de l’antibiotique du plasma vers l’alvéole. Mais associé à ce phénomène, le comblement alvéolaire, induit par le processus inflammatoire, altère les échanges gazeux entraînant un effet shunt.
Figure 7 – Alvéole pulmonaire normale (partie gauche) et inflammatoire (partie droite) (Ware & Matthay 2000)
II.2.
L’
APPORT DES ÉTUDES EXPÉRIMENTALESII.2.1.
Augmenter la concentration alvéolaire
L’objectif théorique de la nébulisation est d’obtenir une forte concentration d’antibiotique au site de l’infection tout en limitant ses effets secondaires systémiques.
Plusieurs études animales se sont intéressées à la concentration intra-alvéolaire en antibiotique après nébulisation. Ainsi, Goldstein et al. ont démontré, sur un modèle de porcs ventilés à poumons sains, que la concentration d’amikacine intra-pulmonaire était 10 fois supérieure après une nébulisation d’1 g d’amikacine, comparée à une administration parentérale d’une dose moyenne de 300 mg d’amikacine (15 mg/kg) (Goldstein et al. 2002b). La même équipe, cette fois-ci sur un modèle porcin de PAVM à Escherichia coli, a retrouvé une concentration intra-pulmonaire d’amikacine 3 à 30 fois supérieure après nébulisation d’une dose 3 fois supérieure comparée à l’administration parentérale. Les concentrations intra-pulmonaires après nébulisation étaient significativement plus basses chez les porcs les plus gravement atteints (Goldstein et al. 2002a). Toujours concernant les aminosides avec la tobramycine sur un modèle murin, Marchand et al. ont mis en évidence, à l’état d’équilibre, des concentrations de tobramycine dans l’ELF près de 250 fois supérieures après nébulisation en comparaison avec l’administration d’une même dose par voie intraveineuse (Marchand et
al. 2015b). Concernant la colistine, toujours chez le rat, Gontijo et al. ont comparé
l’administration nébulisée et parentérale de 0,35 mg/kg de colistine. Alors que la colistine était indosable dans l’ELF après administration intraveineuse, sa concentration moyenne dans l’ELF était de 112 ± 29 µg/mL 2 heures après la nébulisation.
II.2.2.
Limiter la toxicité systémique
La barrière alvéolo-capillaire limite la diffusion passive des antibiotiques du plasma vers le poumon mais aussi du poumon vers le plasma. Cette propriété supposée du fait de la structure histologique a été démontrée dans de nombreuses études expérimentales confirmant ainsi l’intérêt de la nébulisation d’antibiotiques connus pour avoir une toxicité systémique. Aussi, que ce soit avec l’amikacine (Goldstein et al. 2002a,b), la tobramycine (Marchand et
al. 2015b) ou la colistine (Gontijo et al. 2014b, Lu et al. 2010), et même à doses élevées, la
II.3.
E
FFICACITÉIl faudra attendre les années 90, dans le contexte de prise en charge des patients atteints de la mucoviscidose, avec le développement de formulations propres à la nébulisation, pour avoir les premières études démontrant l’efficacité de la nébulisation d’antibiotiques.
Bien que dans la littérature, une majorité d’essais sur la nébulisation d’antibiotiques porte sur la mucoviscidose, un nombre conséquent d’études a porté sur l’utilisation de la nébulisation d’antibiotiques dans la prévention ou le traitement des PAVM principalement contre les BGN et avec les aminosides et les polymyxines.
Dans la mucoviscidose, avec trois essais randomisés contre placebo dont un en double aveugle, Ramsey BW et al. ont montré l’efficacité de la nébulisation de tobramycine chez près de 600 patients colonisés à Pseudomonas aeruginosa avec une réduction des exacerbations et une amélioration de la fonction ventilatoire (Ramsey et al. 1993, 1999).
Chez les patients sous ventilation mécanique, de nombreuses études se sont intéressées à la nébulisation d’antibiotiques. Avant les années 2000, celle-ci était principalement utilisée dans la prévention des PAVM. Dans une méta-analyse réalisée par Falagas et al. et incluant 1877 patients sous ventilation mécanique (huit études dont trois non randomisées), la nébulisation d’antibiotiques préventive (gentamicine, polymyxines, tobramycine et ceftazidine) a permis de réduire de 50 % le taux de PAVM (Falagas et al. 2006b).
Dans le traitement des PAVM, les premières études remontent au milieu des années 2000, notamment pour la prise en charge des bactéries multi-résistantes. Ainsi, dans une étude rétrospective portant sur 21 patients avec une PAVM à Pseudomonas aeruginosa ou
Acinetobacter baumannii multi-résistants ayant reçu une antibiothérapie intraveineuse non
adaptée et de la colistine nébulisée, Kwa et al. ont retrouvé une efficacité bactérienne chez 86 % des patients (Kwa et al. 2005). En 2008, dans une étude portant sur 60 patients, Michalopoulos et al. ont également retrouvé ce type de résultats (Michalopoulos et al. 2008). En 2012, dans une étude prospective observationnelle, Lu et al. ont démontré la non-infériorité de la nébulisation de colistine en comparaison à l’association béta-lactamines/aminosides ou fluoroquinolones dans le traitement des PAVM à Pseudomonas
aeruginosa ou Acinetobacter baumannii multi-résistants (Lu et al. 2012). Les résultats de
cette étude ont été confirmés, plus récemment, dans une étude randomisée portant sur 149 patients (Abdellatif et al. 2016). En effet, Abdellatif et al. ont démontré que la nébulisation de
colistiméthate sodique (CMS) était aussi efficace que son administration parentérale dans le traitement de PAVM à BGN, tout en diminuant l’incidence de l’insuffisance rénale aiguë (17,8 % vs 39,4 %) et en réduisant de cinq jours la durée de ventilation mécanique chez les patients survivants. Enfin, concernant les aminosides (gentamicine, amikacine) entre autres, Palmer et al., dans une étude prospective randomisée en double aveugle, a démontré que la nébulisation d’antibiotiques en association avec une antibiothérapie parentérale permettait d’éradiquer le microorganisme responsable de l’infection dans 26 cas sur 27 vs 2 cas sur 23 dans le groupe placebo (Palmer & Smaldone 2014).
III.
LA COLISTINE
III.1.
G
ÉNÉRALITÉSLa colistine est un polypeptide de la famille des polymyxines, du groupe E. Les polymyxines constituent une famille propre d’antibiotiques d’origine naturelle. Découvertes dans les années 40, elles sont produites par différentes espèces de Bacillus polymyxa (Benedict & Langlykke 1947). Elles sont constituées d’une dizaine de groupes distincts dont seuls deux sont utilisés en pratique clinique : la polymyxine B et la polymyxine E, plus connue sous le nom de colistine (Evans et al. 1999). Les polymyxines sont bactéricides sur la majorité des BGN. Commercialisées à la fin des années 50, elles ont rapidement été délaissées du fait d’une néphro et neurotoxicité. Aujourd’hui, avec l’émergence de souches multi-résistantes, elles sont devenues un traitement de recours indispensable.
En France, la polymyxine B est utilisée sous forme de topiques alors que la polymyxine E est administrée sous forme d’une pro-drogue, le CMS, par voie nébulisée ou parentérale (Frasca et al. 2008).
III.2.
P
HARMACODYNAMIEIII.2.1.
Structure biochimique
La colistine présente une structure basique avec un anneau peptidique hydrophile composé de 8 à 10 acides aminés et une chaîne latérale hydrophobe se terminant par un acide gras. Son poids moléculaire est d’environ 1 200 Da (Storm et al. 1977). Les polymyxines sont donc des antibiotiques amphiphiles avec une diffusion intra-cellulaire limitée mais une diffusion extra-cellulaire homogène.
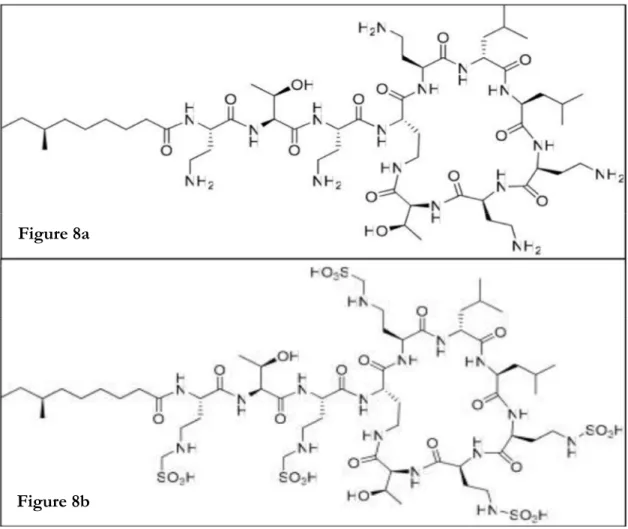
En raison de sa mauvaise tolérance, la colistine (polymyxine E) est administrée sous forme de pro-drogues inactives : le sulfate de colistine ou le CMS. Le CMS est rapidement hydrolysé en colistine dans le plasma (Figure 8). La colistine reste stable plusieurs jours à température ambiante (Baines & Rifkind 1964).
Figure 8 – Structure chimique de la colistine (Figure 8a) et du colistiméthate sodique ou CMS (Figure 8b) (Wallace
et al.
2010)III.2.2.
Mécanisme d’action
La colistine est bactéricide sur la majorité des BGN. Grâce à sa propriété amphiphile, elle agit sur les membranes cytoplasmiques des bactéries. Son anneau polycationique interagit avec la partie anionique, appelé lipide A, des LPS qui composent la membrane externe des BGN. Elle diminue la stabilité membranaire des LPS en rompant, de façon compétitive, les
ponts formés par le Ca2+ et le Mg2+ (Figure 9) (Schindler & Osborn 1979). Cette interaction,
par l’augmentation de la perméabilité membranaire et le relargage du contenu cellulaire qu’elle entraîne, induit un déséquilibre osmotique aboutissant à la mort bactérienne (Koike et
al. 1969). De plus, au niveau plasmatique, les polymyxines neutraliseraient les LPS circulants,
limitant ainsi le pouvoir endotoxinique de certaines BGN (Bannatyne et al. 1977). Figure 8b
Figure 9 – Action de la colistine sur la membrane bactérienne (Martis
et al.
2014)III.2.3.
Spectre
La colistine a un spectre d’activité étroit (Tableau I). Elle est principalement active sur les entérobactéries (à l’exclusion de Proteus spp., Morganella morganii, Providencia spp. et
Serratia spp.) et sur Acinetobacter spp. et Pseudomonas aeruginosa (Storm et al. 1977). Les
bactéries à Gram positif, les cocci à Gram négatif et la majorité des bactéries anaérobies, champignons et parasites sont naturellement résistants à la colistine (Catchpole et al. 1997).
En raison de la rareté des données pharmacocinétiques et pharmacodynamiques, l’évaluation in vitro de l'efficacité des polymyxines a été difficile pendant de nombreuses années. En 2005, le Clinical and Laboratory Standards Institute (CLSI) aux États-Unis a recommandé la normalisation des tests pour déterminer la concentration minimale inhibitrice (CMI) pour la colistine en utilisant le sulfate de colistine plutôt que le CMS (CLSI 2005). Même aujourd'hui, les tests de sensibilité à la colistine par les méthodes habituelles (diffusion sur disque) ne sont pas recommandés par le CLSI ni par l’European Committee on
Antimicrobial Susceptibility and Resistance (EUCAST) et la méthode de dilution en bouillon
reste toujours la référence.
Pour l’EUCAST, les valeurs seuils pour la sensibilité et la résistance sont ≤ 2 mg/L et > 2 mg/L pour les entérobactéries et ≤ 4 mg/L et > 4 mg/L pour P. aeruginosa (EUCAST
2012). Pour le CLSI, les valeurs seuils sont ≤ 2 mg/L et ≥ 8 mg/L pour P. aeruginosa, ≤ 2 mg/L et ≥ 4 mg/L pour Acinetobacter spp., et ≤ 2 mg/L et ≥ 8 mg/L pour les autres non-enterobactéries (CLSI 2011). Le CLSI n’indique pas de valeurs critiques pour les entérobactéries.
Tableau I – Spectre de la colistine parmi les BGN (Frasca
et al.
2008)III.2.4.
Résistance
III.2.4.1. Épidémiologie
Jusqu’à récemment, le phénomène de résistance acquise à la colistine était rare, probablement du fait, d’une part, de leur mécanisme d’action indépendant de la synthèse bactérienne et, d’autre part, d’une faible utilisation de la molécule (Catchpole et al. 1997). Malheureusement, l’augmentation de l’utilisation des polymyxines s’est accompagnée d’une augmentation du nombre de cas de résistance acquise décrits dans la littérature. Ainsi, bien que dans son rapport 2006-2009, le SENTRY Antimicrobial Surveillance Program ait retrouvé un faible niveau de résistance à la polymyxine B et à la colistine parmi une large collection de BGN à travers le monde, il constate une augmentation du taux de résistance en Amérique Latine et en Asie-Pacifique entre 2006 et 2009. Concernant la colistine, 0,9 % des
Acinetobacter spp., 0,2 % des Escherichia coli, 1,5 % des Klebsiella spp. et 0,4 % des Pseudomonas aeruginosa étaient résistants (Gales et al. 2011).
Bien qu’aucune étude observationnelle n’ait recherché les facteurs de risque associés à la résistance aux polymyxines, l’utilisation antérieure de colistine a été retrouvée comme
Entérobactéries Pseudomonas Autres bacilles à Gram négatif Anaérobies
E. coli P. aeruginosa Acinetobacter B. melaninogenicus Citrobacter P. fluorescens S. maltophilia B. oralis
Klebsiella P. putida Moraxella Enterobacter P. maltophilia H. infleunzae
Salmonella Bordetella
Shigella Pasteurella
L. pneumophila
Proteus P. pseudomallei V. cholerae B. fragilis Providencia P. cepacia V. el tor
Morganella P. picketti Serratia Brucella Nocardia Camplylobacter Espèces sensibles Espèces résistantes
facteur de risque indépendant de développement de résistance à la colistine dans des études rétrospectives (Matthaiou et al. 2008).
III.2.4.2. Mécanismes de résistance
Les mécanismes de résistance à la colistine décrits concernent des modifications des membranes externe et cytoplasmique des BGN ou de leurs composants tels que les LPS.
Les mécanismes de résistance les mieux décrits concernent le lipide A, un des composés des LPS, site d’interaction avec les polymyxines. Ainsi la modification de la composition du lipide A par amino-arabinose est responsable d’une perte de charges négatives. Les modifications de charge induisent une diminution de l’affinité des LPS pour les polymyxines (Lee et al. 2004). Le deuxième mécanisme de résistance concerne la réduction du nombre de LPS membranaires. Mais ce mécanisme est également médié par une modification de la composition du lipide A (Moffatt et al. 2010). Enfin, l'activation des pompes à efflux, bien décrites pour d'autres antibiotiques cationiques tels que les aminosides (Hocquet et al. 2003), a également été identifiée chez le Pseudomonas aeruginosa pour la colistine (Pamp et al. 2008). Ce dernier phénomène permettrait d’expliquer celui de résistance adaptative.
L’hétérorésistance (résistance manifestée par une fraction de la population microbienne qui est considérée comme étant sensible à l'antibiotique) à la colistine a été décrite pour la première fois chez A. baumannii en 2006 (Li et al. 2006b). Depuis cette étude, ce phénomène a été décrit pour d'autres BGN et semble fréquent parmi les souches sensibles à la colistine (Bergen et al. 2008). La présence potentielle d’une sous-population résistante à la colistine avant tout traitement et l'observation d’une croissance rapide de cette sous-population en monothérapie incitent à la prudence et à l'utilisation de la colistine en association avec un autre antibiotique.
Ainsi, jusqu’à peu, l’ensemble des mécanismes de résistance à la colistine connus était médié par modification chromosomique de la souche. Très récemment, à l’instar des carbapénèmes et des béta-lactamines, il a été mis en évidence l’émergence d’un mécanisme de résistance à la colistine médié par un plasmide (mcr-1) chez Escherichia coli en Chine (Liu
et al. 2016). Depuis, nombre de publications ont fait part de la présence de mcr-1 dans
d’autres pays. Ainsi, dans le SENTRY Antimicrobial Surveillance Program 2014-2015, 4,9 % des E. coli résistants à la colistine étaient porteurs du plasmide mcr-1 avec une présence dans dix pays différents (Belgique, Allemagne, États-Unis, Russie, etc.) (Castanheira et al. 2016).
III.2.5.
Synergie
Pour limiter la survenue de résistance à la colistine, de nombreuses associations d’antibiotiques ont été étudiées. Leur comparaison est difficile du fait de l’utilisation de différentes méthodes microbiologiques (ex : E-test, microdilution, etc.). Majoritairement in
vitro, leur transposition aux situations cliniques est délicate.
Pour autant, un effet synergique a été rapporté entre la rifampicine et la colistine sur
Acinetobacter baumannii (Giamarellos-Bourboulis et al. 2001), entre la ceftazidime et la
colistine sur Pseudomonas aeruginosa (Gunderson et al. 2003), et entre les carbapénèmes et la colistine sur Klebsiella pneumoniae (Deris et al. 2012).
L’association aux fluoroquinolones, si elle améliore l’activité bactéricide, n’a pas démontré d’effet synergique (Rynn et al. 1999).
III.3.
P
HARMACOCINÉTIQUEDe nos jours, la colistine est majoritairement utilisée pour le traitement des infections ou des colonisations à BGN multi-résistantes. Elle est administrée par voie parentérale sous forme de CMS ou par voie nébulisée sous forme de sulfate de colistine ou de CMS. De nombreuses études récentes permettent de mieux appréhender son utilisation selon les situations cliniques. Pendant des années, les données pharmacocinétiques sur la colistine ont reposé sur des méthodes microbiologiques. En raison de la poursuite de l’hydrolyse du CMS en colistine dans les liquides biologiques et du fait de leur incapacité à distinguer le CMS de sa forme active, ces méthodes doivent être abandonnées. Ainsi, les méthodes microbiologiques doivent être remplacées par des méthodes de dosage capables de dissocier la pro-drogue de la drogue, comme la chromatographie en phase liquide couplée à la spectrométrie de masse en tandem (LC-MS/MS) (Li et al. 2006a). En séparant de façon quantitative les différents composants des polymyxines mais aussi les différentes formes (CMS et la colistine), ces méthodes de dosage ont permis l'émergence d’une connaissance précise de la pharmacocinétique du CMS et de la colistine dans diverses populations (réanimation, mucoviscidose, insuffisance rénale, etc.) (Gobin et al. 2010).
III.3.1.
Administration parentérale
Chez le volontaire sain, après administration parentérale, la majeure partie du CMS est directement excrétée sous forme inchangée dans les urines par sécrétion tubulaire et seule une fraction relativement faible (30 %) est hydrolysée en colistine. La colistine est majoritairement éliminée par voie non rénale par des mécanismes mal connus (Figure 10), la fraction filtrée par le glomérule subissant une très importante réabsorption tubulaire (Couet et
al. 2011, 2012).
Figure 10 – Représentation schématique de la dégradation du CMS en colistine adaptée de Li
et al.
(Liet al.
2006a) et de Couetet al.
(Couetet al.
2012)Chez le patient atteint de mucoviscidose à fonction rénale conservée, à l’état d’équilibre, la demi-vie du CMS a été évaluée à 2,07 ± 0,87 h et celle de la colistine à 4,18 ± 1,32 h (Li et al. 2003a). En cas d'insuffisance rénale, l'excrétion rénale du CMS est diminuée, entraînant une plus grande fraction de la dose convertie en colistine et un allongement de la demi-vie d’élimination justifiant une adaptation posologique.
Chez les patients de réanimation, les modifications du volume de distribution et l’altération de la fonction rénale entraînent également une augmentation de la demi-vie de la colistine. Aux posologies habituellement recommandées, les études modernes réalisées chez des patients de réanimation à fonction rénale préservée, retrouvent une demi-vie d’élimination moyenne du CMS et de la colistine respectivement de 4,6 et 14,4 h. Néanmoins, malgré une augmentation importante de la demi-vie, à l’état d’équilibre, la concentration plasmatique médiane en colistine était autour de 2,36 mg/L, ce qui est faible comparativement aux CMI des bactéries habituellement isolées. Pourtant, le délai entre le début du traitement de CMS et l'état d'équilibre aux concentrations efficaces est primordial, non seulement parce que
l'initiation tardive d’un traitement antibactérien approprié est associée à une mortalité accrue, mais aussi parce que de faibles concentrations de colistine sont associées à une majoration de la survenue des phénomènes de résistance. Aussi, pour atteindre la concentration cible plus rapidement, les auteurs recommandent l'administration d'une dose de charge (Garonzik et al. 2011).
Chez l’insuffisant rénal, compte tenu de ces éléments, il est nécessaire d’adapter les posologies et les intervalles d’administration du CMS à la clairance de la créatinine du patient. Le CMS et la colistine sont efficacement épurés par hémodiafiltration continue (Li et
al. 2005) et par hémodialyse intermittente (Marchand et al. 2010a).
La diffusion tissulaire du CMS et de la colistine a été peu étudiée. La colistine est étroitement liée avec les membranes lipidiques de nombreux organes dont les poumons et le cerveau (Kunin & Bugg 1971). Bien que d’anciennes études expérimentales retrouvent une faible diffusion des polymyxines dans les différents tissus, plusieurs études récentes prouvent le contraire. Ainsi, dans le liquide céphalo-rachidien, à l’état d’équilibre, la concentration de colistine est de près de 25 % celle de la concentration plasmatique (Jiménez-Mejías et al. 2002). Dans un contexte de péritonite, à l’état d’équilibre, les concentrations intra-péritonéales de colistine sont proches des concentrations plasmatiques (Mimoz et al. 2012).
III.3.2.
Administration nébulisée
La colistine est depuis de nombreuses années utilisée sous forme inhalée particulièrement chez les patients atteints de mucoviscidose. Elle est administrée sous deux formes, le sulfate de colistine et le CMS. L’administration nébulisée garantit une forte concentration au siège de l’infection tout en assurant un faible passage plasmatique.
Chez des volontaires sains, après administration de 0,3 million d’UI de sulfate de colistine avec un inhalateur, le pic plasmatique médian est atteint au bout de 1,1 h avec une concentration maximale médiane de colistine très faible de 0,09 mg/L (Westerman et al. 2007).
Chez des patients atteints de mucoviscidose colonisés à Pseudomonas aeruginosa, après nébulisation de 2 millions d’UI de sulfate de colistine, le pic plasmatique faible (0,17 ± 0,04 mg/L) est obtenu 1,5 ± 0,3 h après le début de l’administration, alors même que les
concentrations obtenues dans les crachats sont au moins dix fois supérieures aux valeurs seuils de CMI (Ratjen et al. 2006).
En réanimation, chez des patients sous ventilation mécanique, leur utilisation est actuellement peu développée. Cela s’explique principalement par un faible dépôt de l’aérosol dans le poumon profond avec les anciens nébulisateurs (jet-nébulisateur). Ainsi, avec le développement de nouveaux nébulisateurs (ultra-sonique ou à membrane vibrante), plus performants, assurant une diffusion dans l’ensemble de l’arbre bronchique, la nébulisation d’antibiotiques prend toute sa place dans l’arsenal thérapeutique des PAVM (Dhand & Guntur 2008). Michalopoulos et al. ont montré son efficacité dans le traitement des PAVM en association à une antibiothérapie parentérale chez 83 % des patients (Michalopoulos et al. 2008). Ainsi, chez des patients sous ventilation mécanique recevant, pour une pneumopathie à BGN, une nébulisation de 1 million d’UI de CMS toutes les 8 h, les concentrations intra-alvéolaires en colistine sont près de 5 fois supérieures aux concentrations plasmatiques (Athanassa et al. 2012). Enfin, plus récemment, Abdellatif et al, dans une étude randomisée chez 149 patients ayant une PAVM à BGN, ont démontré que la nébulisation de colistine était aussi efficace que l’administration parentérale tout en diminuant la néphrotoxicité et la durée de ventilation mécanique (Abdellatif et al. 2016).
III.4.
T
OXICITÉIII.4.1.
Néphrotoxicité
À ses débuts, la forte incidence de la néphrotoxicité associée à la colistine était probablement liée à l'utilisation de posologies élevées (près de trois fois les schémas posologiques actuels), le manque d'adaptation de la posologie du CMS à la fonction rénale et la confusion possible quant aux différentes unités (mg ou UI) utilisées pour l'étiquetage des produits.
Au cours des dernières études observationnelles, l'incidence de la néphrotoxicité (augmentation de plus de 50 % du taux de créatinine de base) variait de 7,4 à 30 % (Falagas et
al. 2005, 2006a; Pogue et al. 2011). Chez les patients atteints de mucoviscidose, la colistine
est moins néphrotoxique que les aminosides encore largement utilisés dans cette population (Al-Aloul et al. 2005). Dans une étude comparant l'efficacité de la colistine à l’imipénème dans le traitement des pneumopathies acquises sous ventilation dues à Acinetobacter
baumannii, l’incidence de l’insuffisance rénale était similaire, quel que soit le traitement
administré (Rattanaumpawan et al. 2010).
La néphrotoxicité se manifeste essentiellement par une nécrose tubulaire aiguë. Classiquement, elle survient dans les quatre premiers jours suivant le début du traitement et la fonction rénale se normalise dans les trois à neuf semaines après l'arrêt du traitement.
III.4.2.
Neurotoxicité
La neurotoxicité a été moins étudiée que la néphrotoxicité. Comme pour cette dernière, c'est un phénomène réversible concentration-dépendant qui se manifeste sous différentes formes, telles que paresthésies des extrémités, vertiges, troubles visuels, ataxie, désorientation temporo-spatiale, délire et blocage neuromusculaire. Dans les études récentes, la survenue d’une neurotoxicité est un événement peu fréquent à rare, avec une incidence de 0 à 7 % (Molina et al. 2009). Un cas de convulsions et d'apnée a récemment été publié chez un patient traité par de la colistine et du méropénème (Spapen et al. 2011). La concentration résiduelle de colistine était environ quatre fois plus élevée que les taux habituellement retrouvés à l’état d’équilibre chez les patients de réanimation.
III.4.3.
Effets secondaires respiratoires
La nébulisation des polymyxines peut induire un bronchospasme, une toux ou une sensation d’oppression thoracique. Ces effets, avec une fréquence de près de 30 % dans certaines séries, ont été principalement décrits chez des patients présentant une bronchopathie chronique et tout particulièrement les patients atteints de la mucoviscidose (Alothman et al. 2005, Cunningham et al. 2001). Néanmoins, l’adjonction de bronchodilatateurs permet de limiter la survenue de ces effets secondaires (Cunningham et al. 2001). Par ailleurs, ces effets ont été rapportés avec une nébulisation de sulfate de colistine plus irritant. Les études cliniques plus récentes, préférant le CMS, ne retrouvent pas une telle fréquence.
III.4.4.
Autres effets secondaires
Des cas de réactions d'hypersensibilité à la colistine ont également été signalés, comme de l'urticaire, des éruptions cutanées, de la fièvre, mais aussi des troubles gastro-intestinaux.
Le risque de développement de colite pseudo-membraneuse existe comme avec n'importe quel antibiotique, même s’il semble néanmoins rare.
III.5.
R
EVIEW:
C
OLISTIN INC
RITICALLYI
LLP
ATIENT(A
RTICLEI)
La première partie de notre travail a consisté à réaliser une synthèse des données disponibles dans la littérature sur la colistine en réanimation. Ce travail a fait l’objet d’une publication sous le format d’une revue de la littérature présentée ci-après selon le format (références, numérotation figures et tableaux) original de la revue Minerva Anestesiologica. Seule une traduction en français de l’abstract a été ajoutée.
Colistin in critically ill patients
Matthieu Boisson1,2,3, Nicolas Grégoire1,2,, William Couet1,2,4, Olivier Mimoz1,2,3
1Inserm U1070, Pôle Biologie Santé, 1 rue Georges Bonnet, 86000 Poitiers, France
2Université de Poitiers, UFR Médecine-Pharmacie, 6 rue de la milétrie, 86000 Poitiers, France
3Département d’Anesthésie-Réanimation, CHU de Poitiers, 2 rue de la milétrie, 86000
Poitiers, France
4Service de Toxicologie-Pharmacocinétique, CHU de Poitiers, 2 rue de la milétrie, 86000
Poitiers, France
Minerva Anestesiologica 2013 Feb;79(2):200-8
PMID: 23241733
RÉSUMÉ
La colistine est un vieil antibiotique de réutilisation récente comme traitement de sauvetage contre des infections à bactéries à Gram négatif multi-résistants. Parce qu'elle est administrée sous forme de pro-drogue inactive, le colistiméthate sodique (CMS), rapidement hydrolysée en colistine, les études pharmacocinétiques utilisant les méthodes de dosages microbiologiques sont peu fiables. Avec le développement récent de nouvelles méthodes de dosages utilisant la chromatographie liquide à haute performance (HPLC), des données pharmacocinétiques précises sur le CMS et la colistine sont maintenant disponibles dans des populations diverses. Cet article a pour but de mettre à jour les données préexistantes sur la pharmacodynamie, la pharmacocinétique, la sécurité et les indications de la colistine, avec un focus particulier sur les patients de réanimation.
Mots-clés : colistine – bactérie à Gram négatif – réanimation – pharmacocinétique – pharmacologie – sécurité
ABSTRACT
Colistin is a re-emerging old antibiotic that is used as a salvage treatment against multidrug-resistant Gram-negative infections. Because it is administrated as an inactive prodrug, colistin methanesulfonate (CMS) that undergoes rapid hydrolyze to colistin, pharmacokinetic studies using biological assays are unreliable. With the recent development of new assays using high performance liquid chromatography (HPLC) accurate pharmacokinetic of CMS and formed colistin is now available in various populations. This article aims to update previous reports on pharmacodynamics, pharmacokinetics, safety and clinical use of colistin, with a special focus on data useful to treat critically ill patients.
Key words: Colistin - Gram-negative bacteria - Intensive care units - Pharmacokinetics - Pharmacology – Safety
INTRODUCTION
Bacterial resistance is increasing worldwide, mainly among Gram-negative pathogens. Infections with multiple-drug resistant Gram negative pathogens may be difficult to treat due to the lack of available effective treatment. This phenomenon is particularly problematic with non-fermentative bacilli like Pseudomonas aeruginosa and Acinetobacter baumannii, or with carbapenemase-producing Enterobacteriaceae (1).
The limited development of new molecules and the sharp increase of resistance to common antibiotics have required the use of older antibiotics abandoned because of toxicity. Colistin is an old antibiotic having entered clinical use in 1958 and abandoned in the early 1980s because of reported neurotoxicity and nephrotoxicity. Usually administrated as an inactive prodrug, colistin methanesulfonate (CMS), colistin is bactericidal against most Gram-negative bacilli including Pseudomonas aeruginosa and Acinetobacter baumannii, and it is used as a salvage treatment against multidrug-resistant Gram-negative bacteria (2). Because colistin is an old antibiotic never subjected to usual drug development procedures now mandated for new molecules, lot of required information to optimize its administration is lacking. Moreover, as CMS is converted into colistin within the body, both CMS and colistin may be simultaneously present within plasma and therefore specific analytical assays able to separate colistin and CMS is a prerequisite to get reliable pharmacokinetic information.
Several extensive reviews have been published yet on colistin. This article aims to update the previous reports, with a special focus on data useful to treat critically ill patients.
PHARMACODYNAMICS
Chemical structure
Colistin is a polypeptide belonging to the family of polymyxins, produced by Bacillus
polymyxa subspecies colistinus (3). It is composed of at least thirty different polymyxin
compounds, the most effective being colistin A (polymyxin E1) and colistin B (polymyxin E2) (4). Colistin has a basic structure with a hydropholic polycationic peptide ring composed of 10 amino acids and an hydrophobic fatty acid tail (5), and its molecular weight is around 1200 Da (6). Therefore, colistin is an amphiphilic antibiotic with very limited intracellular distribution but homogeneous distribution within the extra-cellular body water.
Given the relative toxicity associated with its parenteral or inhaled administration colistin is given as an inactive prodrug, CMS. In vivo, CMS undergoes a rapid hydrolyze to a series of intermediate methanesulfonated derivatives and eventually to colistin (Figure 1) (7,32). As opposed to CMS which is rapidly hydrolyzed in plasma, colistin is stable for several days at room temperature.
Available products are labelled differently with respect to content depending on countries. Equivalence between formulations is as follows: 1 million IU of CMS is equal to 80 mg of CMS or 30 mg of colistin base activity.
Figure 1 – Schematic representation of the disposition of colistin methanesulfonate (CMS) and colistin generated from it in the body following intravenous administration of CMS, adapted from Couet et al. (32)
Mechanism of action
Colistin acts on the cytoplasmic membrane of Gram-negative bacilli. Its polycationic portion interacts electrostatically with the anionic portion of lipopolysaccharides (LPS) that
compound the outer membrane. Colistin competitively displaces Ca2+ and Mg2+ bridges that
stabilize LPS (8). This interaction increases membrane permeability leading to a loss of integrity of the membrane and an increase in the permeability of the cell envelope, leakage of cellular contents, and subsequently, bacterial death (9). The ability of polymyxins to bind LPS gives them a theoretical antiendotoxin activity (10) and hemoperfusion with polymyxin-immobilized fiber has been proposed for the treatment of septic shock (11). By acting on the bacterial wall, colistin has bactericidal activity independent of bacterial metabolism. This may explain in part the delay observed between marketing of colistin and emergence of resistance to this antibiotic (12).
Spectrum
Colistin has a narrow antibacterial spectrum (Table I). It is highly active against most
Enterobacteriaceae (excluding Proteus spp., Morganella morganii, Providencia spp. and Serratia spp.) and against Acinetobacter spp. and Pseudomonas aeruginosa (6). Colistin has
no activity against Gram-positive or Gram-negative cocci, Gram-positive bacilli, most anaerobic bacteria, fungi and parasites (12).
Due to the paucity of pharmacokinetic and pharmacodynamic data, in vitro evaluation of colistin efficacy was difficult for many years. In 2005, the Clinical and Laboratory Standards Institute (CLSI) in the United-States recommended standardization of tests for determining the minimal inhibitory concentration (MIC) for colistin using colistin sulphate rather than CMS (13). Even today, colistin susceptibility testing by usual methods (i.e., disk diffusion) is not recommended by the CLSI and the European Committee on Antimicrobial Susceptibility Testing (EUCAST) and the broth dilution method is still the reference.
The EUCAST breakpoints for susceptibility and resistance are ≤ 2 mg/L and > 2 mg/L for
Enterobacteriaceae and ≤ 4 mg/L and > 4 mg/L for P. aeruginosa, respectively (14). For the
CLSI, these breakpoints are ≤ 2 mg/L and ≥ 8 mg/L for P. aeruginosa, ≤ 2 mg/L and ≥ 4 mg/L for Acinetobacter spp., and ≤ 2 mg/L and ≥ 8 mg/L for other
Table I – Colistin antibacterial spectrum
Resistance
Epidemiology
Gram-positive bacteria and some Gram-negative bacilli are naturally resistant to colistin (Table I). Until recently, acquired resistance to colistin was uncommon, which may be attributed to its mechanism of action and its low clinical use (12). Unfortunately, with the renewed interest in colistin use, description of cases of acquired resistance is increasing (16, 17). In its latest report, the SENTRY Antimicrobial Surveillance Program finds a low resistance rate to colistin against a large worldwide collection of Gram-negative bacteria. Indeed, only 0.4 % of P. aeruginosa, 0.9 % of Acinetobacter spp. and 1.5 % of Klebsiella spp. were resistant to colistin. However, a trend to greater resistance was observed in the Asia-Pacific and Latin American region between 2006 and 2009 (18). Furthermore, 12 % of the
Klebsiella resistant to imipenem were also resistant to colistin, compared with only 1.4 % in
the overall Klebsiella spp. Collection (19). The development of resistance to colistin is in favor of limiting its use to situations where colistin remains one of the few still effective antimicrobial agents.
No observational study has assessed the risk factors associated with resistance to colistin. Few retrospective studies have explored this issue. The previous use of colistin was the only independent risk factor for development of resistance to colistin (20).
Enterobacteriaceae Pseudomonas Others Gram-negative bacilli Anaerobic
E. coli P. aeruginosa Acinetobacter B. melaninogenicus Citrobacter P. fluorescens S. maltophilia B. oralis
Klebsiella P. putida Moraxella Enterobacter P. maltophilia H. infleunzae
Salmonella Bordetella
Shigella Pasteurella
L. pneumophila
Proteus P. pseudomallei V. cholerae B. fragilis Providencia P. cepacia V. el tor
Morganella P. picketti Serratia Brucella Nocardia Camplylobacter Sensitive species Resistant species