Étude des traits de résistance au parasite Varroa
destructor chez l'Abeille mellifère (Apis mellifera)
Mémoire
Stéphanie Rouleau-Breton
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Étude des traits de résistance au parasite Varroa destructor chez l’Abeille
mellifère (Apis mellifera)
Mémoire
Stéphanie Rouleau-Breton
Sous la direction de :
Pierre Giovenazzo, Ph.D., directeur de recherche
Nicolas Derome, Ph.D., codirecteur de recherche
Résumé
Actuellement, l’ectoparasite Varroa destructor est considéré comme la plus grande menace pathogène pesant sur la survie de l’Abeille mellifère (Apis mellifera). En plus d’engendrer des dommages directs aux abeilles par la consommation répétitive de leur corps gras et de leur hémolymphe et par la dépression de leur système immunitaire, les varroas affectent également indirectement les abeilles par la transmission de plusieurs agents pathogènes viraux. En absence de traitements périodiques, la plupart des colonies d’abeilles mellifères s’effondrent dans une période de deux ou trois années suivant l’infestation initiale de Varroas. Face à la pression sélective engendrée par cet Acarien, certaines colonies d’abeilles mellifères ont développé des comportements de résistance. Parmi ces comportements, nous retrouvons le Varroa Sensitive Hygiene (VSH) qui permet aux ouvrières de détecter la présence du parasite dans le couvain d’abeille et de le retirer. De plus, ce comportement est également fortement associé au trait Suppressied Mite Reproduction (SMR), c’est-à-dire, à la baisse du succès reproducteur des varroas dans le couvain d’abeille. Ainsi, les abeilles dotées du comportement VSH sont capables de réduire le niveau d’infestation de leur ruche et de le maintenir à un faible niveau. C’est pourquoi la sélection d’abeilles ayant ce trait comportemental pourrait s’avérer être une solution efficace et durable pour pallier les problèmes engendrés par le Varroa. Cependant, la sélection pour un caractère comporte un certain risque puisqu’il peut advenir que la sélection d’un trait engendre également des répercussions négatives sur d’autres caractères désirables. C’est pourquoi un des objectifs de ce projet est de confirmer la relation entre le VSH et le SMR, et de déterminer les facteurs probables engendrant les problèmes de fertilité du Varroa. Le second objectif quant à lui est de déterminer si la sélection du comportement VSH permet aux colonies de combattre efficacement les varroas sans que cela porte atteinte à la sélection d’autres critères importants en apiculture.
Abstract
Currently, the ectoparasite Varroa destructor is considered to be the greatest threat to the survival of the honey bee (Apis mellifera). In addition to causing direct damage to bees through repeated consumption of their fat bodies and depression of their immune system, Varroa also indirectly affects bees through the transmission of several pathogens. In the absence of periodic treatment, most honey bee colonies collapse within two to three years of the initial Varroa infestation. Faced with the selective pressure generated by this mite, some colonies of honey bees have developed a resistance behavior. This behavior, called Varroa Sensitive Hygiene (VSH), allows workers to detect the presence of the parasite in bee brood and remove it. In addition, this behavior is also strongly associated with the
Suppressed Mite Reproduction (SMR) trait, i.e., the decrease in Varroa reproduction in bee brood.
Thus, bees with VSH behavior are able to reduce the level of infestation of their hive and maintain it at a low level. Therefore, the selection of bees with this behavioral trait could prove to be an effective and sustainable solution to the problems caused by varroas. However, selecting for a trait involves a certain risk since it may happen that the selection of a trait also has a negative impact on other desirable traits. Therefore, the first objective of this project is to confirm the relationship between VSH and SMR, and to determine the likely factors leading to mite fertility problems. The second objective is to determine whether the selection of VSH behavior allows colonies to effectively control Varroa without compromising the selection of other important criteria in beekeeping.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Glossaire des termes apicoles ... ix
Remerciements ... xi
Avant-propos ... xiii
Introduction générale ... 1
Chapitre 1 : État des connaissances ... 2
1.1. Apis mellifera ... 2
1.1.1. Un insecte eusocial ... 2
1.1.2. Cycle de vie ... 2
1.1.3. Les envahisseurs de la ruche... 5
1.2. Varroa destructor ... 5
1.2.1. Cycle de vie ... 5
1.2.2. Développement du Varroa ... 6
1.3. Le changement d’hôte ... 10
1.4. La Varroase ... 11
1.4.1 Les effets directs ... 11
1.4.2. Les effets indirects ... 11
1.5. Les traitements ... 12
1.5.1. Les acaricides synthétiques ... 12
1.5.2. Les acaricides naturels ... 12
1.5.3. Les méthodes alternatives ... 13
1.6. Notre approche : la sélection du comportement Varroa Sensitive Hygiene (VSH) ... 13
1.6.1. Suppressed Mite Reproduction (SMR) ... 15
1.6.2. La réoperculation des cellules de couvain par les ouvrières ... 15
1.7. Les risques de la sélection ... 16
1.8. Objectifs et hypothèses ... 17
Chapitre 2 : Étude du trait Suppressed Mite Reproduction (SMR)... 19
2.1. Matériel et méthodes ... 19
2.1.3. Évaluation du comportement VSH des colonies ... 21
2.1.4. Évaluation du trait SMR des colonies ... 24
2.1.5. Manipulation du couvain par les abeilles ... 26
2.1.6. Analyses statistiques ... 28
2.2. Résultats ... 28
2.2.1. Relation entre le comportement VSH, le rucher, la lignée génétique et le trait SMR ... 28
2.2.2. Facteurs associés à la manipulation du couvain par les abeilles ... 30
2.3. Discussion ... 33
Chapitre 3 : High expression of Varroa Sensitive Hygiene (VSH) behavior does not affect honey bee colonies performance ... 36
3.1. Résumé ... 36
3.2. Abstract ... 37
3.3. Introduction ... 38
3.4. Material and methods ... 39
3.4.1. Experimental colonies ... 39
3.4.2. VSH evaluation ... 39
3.4.3. Performance criteria evaluation ... 40
3.4.4. Mite population growth ... 41
3.4.5. Statistical analysis ... 43
3.5. Results ... 43
3.5.1. VSH behavior of experimental colonies ... 43
3.5.2. Effect of VSH behavior on performance criteria ... 43
3.5.3. Effect of VSH behavior on V. destructor population growth ... 47
3.6. Discussion ... 47 3.7. Acknowledgements ... 50 3.8. Data availability ... 50 Conclusion générale ... 51 Limite de l’étude ... 52 Perspective ... 53 Bibliographie ... 55
Liste des tableaux
Tableau 2.1. Moyenne des différents paramètres (± SE) associés aux problèmes de reproduction des
varroas parmi 40 colonies d’abeilles mellifères provenant de 9 lignées génétiques du Centre de recherche en sciences animales de Deschambault.……….32
Table 3.1. Analysis of variance of VSH behavior, genotype and apiary on four performance criteria of
honey bee colonies and on Varroa destructor population growth. Significant P-values (< 0,05) are in bold...45
Liste des figures
Figure 1.1. Cycle de développement des trois castes de l’abeille mellifère (Apis mellifera). Les images
proviennent d’Alex Wild (https://www.alexanderwild.com/) et sont libres de droits lorsque leur utilisation est pédagogique. Les informations ont été adaptées de Winston (1987).…………..………..……4
Figure 1.2. Cycle de reproduction d’une femelle Varroa fondatrice dans une cellule de couvain
d’ouvrière. Le schéma provient d’Arista Bee Research et sa diffusion a été approuvé par la fondation (https://aristabeeresearch.org/fr/resistance-a-varroa/). L’illustration est de Merit de Jong.……….……..8
Figure 1.3. Représentation d’une famille de Varroa destructor à l’intérieure d’une cellule de couvain.
La photo provient de Mélissa Girard et sa diffusion a été approuvée par cette dernière.…………...9
Figure 1.4. Abeilles exprimant le comportement de résistance aux varroas (VSH). Le schéma provient
d’Arista Bee Research et sa diffusion a été approuvé par la fondation (https://aristabeeresearch.org/fr/resistance-a-varroa/). L’illustration est de Merit de Jong.………….…14
Figure 2.1. Cartes indiquant l’emplacement des ruchers de l’expérience. La première carte du haut
représente l’emplacement des ruchers sur une carte du Canada. La seconde carte en bas indique l’emplacement des ruchers à l’intérieur de la province du Québec. Leurs coordonnées GPS, de gauche à droite, sont les suivantes; Bérubé: 46°41'55"N; 71°45'02"O, Langlois: 46°42'13"N; 71°37'00"O, Dubuc: 46°42'27"N; 71°34'33"O, Delisle: 46°43'08"N; 71°33'08"O.………..……...………….……20
Figure 2.2. Cage d’exclusion de reine maison. Cette cage restreint les déplacements de la reine au
cadre qui est placé à l’intérieur, ce qui permet l’obtention d’une surface de couvain uniforme du même âge. Photo de Stéphanie Rouleau-Breton.………...………...…………...…22
Figure 2.3. Cadre de couvain modifié utilisé pour l’évaluation du comportement VSH (Photos de
Stéphanie Rouleau-Breton). A Un cadre Langstroth coupé en deux qui est placé dans la colonie FI. B Les deux moitiés du cadre séparé de leur monture après l’infestation des cellules par les varroas. C Un demi-cadre dans sa monture qui est introduit dans la colonie expérimentale pour évaluer son pourcentage VSH.……….………..………...…….23
Figure 2.4. Phénotypes des varroas en fonction de l’âge de leur hôte, Apis mellifera. Adaptée de
Büchler et al. 2017, photos de Fanny Mondet.………...……25
Figure 2.5. L’activité de réoperculation de l’abeille mellifère est confirmée par le trou mat à l’intérieur
de l’opercule. Photo de Stéphanie Rouleau-Breton.…………...………..………...…….…27
Figure 2.6. Relation entre le comportement VSH et le trait SMR parmi 40 colonies d’abeilles
mellifères……….29
Figure 2.7. Pourcentage SMR des 40 colonies du projet en fonction de leur lignée génétique. Les
comparaisons entre les lignées ont été réalisées à l’aide d’un test de Tukey. Les colonnes avec des lettres distinctes sont significativement différentes (P < 0,05).……….……...………...…..……...31
Figure 3.1. Evaluation of the hygienic behavior of a colony. Liquid nitrogen is poured into a metallic
cylinder inserted into the brood. The frame is then returned into the broodnest for 24h. After this period, the percentage of brood removed is recorded. In the top right picture, the colony cleaned almost everything, while in the bottom picture, the colony was not as hygienic.……….42
Figure 3.2. Expression of VSH behavior per colony in both VSH tests. The yellow dots represent the
results obtained during the first test (mid-July) and the orange dots represent the results of the second test (mid-August).
Table 3.1. Analysis of variance of VSH behavior, genotype and apiary on four performance criteria of
honey bee colonies and on Varroa destructor population growth. Significant P-values (< 0,05) are in bold...44
Figure 3.3. Relationship between hygienic behavior and VSH behavior among 61 honey bee
Glossaire des termes apicoles
Le vocabulaire employé en apiculture peut parfois varier d’une région et d’une personne à l’autre. Ainsi, afin d’éviter toute confusion, les définitions proposées ci-dessous sont celles adoptées dans ce manuscrit.
Colonie : regroupement de la reine, ses ouvrières et ses faux-bourdons.
Couvain : ensemble des stades juvéniles (œuf, larve et pupe) de l’Abeille mellifère.
Comportement hygiénique : comportement de détection et nettoyage du couvain malade, parasité
ou mort.
Développement printanier : rapidité de développement d’une colonie au printemps. Faux-bourdons : mâle d’Apis mellifera.
Hausse / cadre : élément mobile de la ruche en forme de « boîte » qui permet de modifier l’espace
disponible à la colonie. Les hausses contiennent des cadres qui serviront aux différentes tâches de la colonie (stockage du miel, stockage du pollen, élevage du couvain, etc.).
Opercule : bouchon de cire sécrété par les ouvrières qui permet la fermeture des alvéoles.
Operculation / désoperculation / réoperculation : l’operculation désigne la mise en place de
l’opercule de cire par les ouvrières, alors que la désoperculation est son retrait (partiel ou complet). La réoperculation a lieu lorsqu’une cellule qui a déjà été fermée par une ouvrière est ouverte puis refermée de nouveau.
Ruche : désigne les hausses qui abritent les colonies. Dans ce manuscrit, le terme ruche est parfois
interchanger avec celui de colonie.
Rucher : emplacement occupé par des colonies.
Suppressed Mite Reproduction (SMR) : trait de résistance de l’Abeille mellifère au parasite Varroa
destructor par la diminution de son taux de reproduction.
Varroa : Acarien ectoparasite obligatoire de l’Abeille mellifère.
Varroa Sensitive Hygiene (VSH) : comportement hygiénique de résistance de l’Abeille au parasite
Varroa destructor.
À la mémoire de Chuck, mon grand-papa, à qui aucune dédicace ne saurait rendre hommage.
Remerciements
Comme plusieurs le savent, un projet de recherche ne se fait pas seul. Tout au long de ce périple, j’ai été accompagné de personnes merveilleuses sans qui la portée de ma maîtrise ne serait pas la même. Il y a tant de gens à remercier, alors j’espère n’en oublier aucun!
En premier lieu, je tiens à remercier mon directeur de maîtrise, Pierre Giovenazzo, de m’avoir permis de participer à ce projet et de m’avoir soutenu tout au long de sa réalisation. Son optimisme et son enthousiasme sans égal m’ont toujours maintenu d’aplomb dans la poursuite de ma maîtrise. Et surtout, un gros merci de m’avoir fait découvrir le merveilleux monde de l’apiculture (et des parasites)! Je voudrais également remercier mon codirecteur, Nicolas Derome, d’avoir éveillé ma curiosité scientifique et de m’avoir donné ma toute première expérience en recherche lorsque j’étais au baccalauréat. Merci d’avoir cru en moi et de continuer de me supporter.
Pour le support financier, je tiens à remercier le Ministère de l’Agriculture, de l’Alimentation et des Affaires rurales de l’Ontario (OMAFRA). Merci également au Centre de recherche en sciences animales de Deschambault (CRSAD) pour le support matériel.
Un gros merci au laboratoire Giovenazzo et à l’équipe apicole du Centre de recherche en sciences animales de Deschambault sans qui ce projet n’aurait jamais eu lieu. Un merci particulier à Ségolène Maucourt, pour m’avoir prodigué de nombreux conseils; Andrée Rousseau, pour ses réponses à mes nombreux courriels de paniques; Marie-Lou Morin, pour son assistance de terrain indispensable; Mireille Lévesques, pour son aide en laboratoire; Émile Houle, pour son ingéniosité incroyable et Marilène Paillard, pour son support physique autant que moral.
Finalement, les derniers, mais non les moindres : merci à mes amies, ma famille et mon conjoint qui m’ont épaulé tout au long de mon parcours. Merci à Evelyne Lemay, Laurie Isabel, Yohanna Klanten et Marie-Alex Langlois de m’avoir écouté parler d’abeilles à n’en plus finir. Merci également pour nos séances de découragements et d’encouragements à persévérer dans nos projets respectifs. Merci à mes parents pour leurs constants encouragements à poursuivre mes études. Merci à mon conjoint,
en R. Merci également de toujours me pousser à me dépasser et à donner le meilleur de moi-même au quotidien.
Avant-propos
La rédaction de ce mémoire a été réalisée par insertion d’articles. Ainsi, le 2e chapitre de ce mémoire,
intitulé Étude du trait Suppressed Mite Reproduction (SMR), a été rédigé de facture traditionnelle, alors que le 3e chapitre de celui-ci a été composé sous forme d’article scientifique en anglais. Ce dernier
sera soumis pour publication dans l’édition spéciale Honey breeding du journal Insects. Il s’intitule
High expression of Varroa Sensitive Hygiene (VSH) behavior does not affect honey bee colonies performance et l’auteure principale est Stéphanie Rouleau-Breton. Les coauteurs sont Nicolas
Derome, Ph.D., professeur titulaire au département de biologie à l’Université Laval et Pierre Giovenazzo, Ph.D., professeur adjoint au département de biologie de l’Université Laval et titulaire de la CLE en sciences apicoles.
Introduction générale
L’agriculture moderne positionne l’Abeille mellifère (Apis mellifera) au centre de son économie. En effet, l’importance des services de pollinisation en fait un outil indispensable pour augmenter la profitabilité des agriculteurs. Toutefois, ce contexte de production intensive contraint également les abeilles à faire face à de nombreux défis.
Les colonies en transhumance sont soumises à l’application massive de pesticides, à la perte de diversité florale, au stress du transport ainsi qu’à l’apparition de parasites et de maladies. Jusqu’alors, la majorité de ces problèmes ont été surmontés par l’ajout de suppléments nutritifs et l’application de pesticides. Toutefois, au cours des dernières décennies, l’introduction d’un nouveau parasite, Varroa
destructor, met en doute la capacité des scientifiques à contrer cet adversaire. En effet, de plus en
plus de populations de varroas, autrefois contrôlés par l’application d’acaricides de synthèse, émergent résistantes à ces produits (Ellis et al. 2001). Il en revient alors à l’Abeille combattre ce parasite d’elle-même.
Face à la pression exercée par le Varroa, certaines colonies d’Abeilles mellifères ont développé des comportements de résistance. Parmi ces comportements, nous retrouvons le Varroa Sensitive Hygiene (VSH), qui octroie aux ouvrières la capacité de réduire le niveau d’infestation en parasites dans leur ruche (Harbo et Harris, 2005). De plus, ce comportement est également étroitement associé à une baisse du niveau de reproduction des varroas (SMR) (Harbo et Hoopingarner, 1997). C’est pourquoi la sélection de ce comportement pourrait s’avérer être une solution idéale pour contrer le Varroa. Toutefois, avant d’incorporer ce caractère au sein d’un programme de sélection, il est primordial d’analyser les conséquences probables que cela pourrait engendrer afin d’éviter des répercussions non désirées.
Ainsi, le premier objectif de ce projet de maîtrise est de mesurer la relation entre le comportement VSH et la baisse de fécondité des varroas (SMR), et d’estimer les causes probables de ce phénomène (Chapitre 2). Le second objectif, quant à lui, est de déterminer si l’expression du comportement VSH affecte la performance des colonies d’abeilles (Chapitre 3).
Chapitre 1 : État des connaissances
1.1. Apis mellifera
L’Abeille mellifère, Apis mellifera, est un Arthropode, de la classe des Insectes et de l’ordre des Hyménoptères. Celle-ci est originaire d’Europe, mais suite à l’intervention de l’Humain, occupe désormais tous les continents, à l’exception de l’Antarctique (Seeley, 1995). En raison de sa grande dispersion, il s’agit du pollinisateur domestiqué le plus important mondialement (Danforth, 2007).
1.1.1. Un insecte eusocial
A. mellifera est un insecte eusocial vivant en colonie. Le maintien de l’harmonie au sein de celle-ci est
assuré par les activités des différentes castes qui la compose. Tout d’abord il y a la reine, l’unique femelle fertile de la colonie, qui assure le développement de celle-ci par la ponte constante d’œufs, en plus de régulariser la vie au sein de la colonie par l’émission de phéromones (Winston, 1987). Par la suite il y a les ouvrières, des femelles stériles, dont le nombre varie au cours de l’année. Celles-ci assurent différents rôles dans la colonie en fonction de leur âge. Les jeunes abeilles ont comme fonction de prendre soin de la reine et du couvain, alors que les ouvrières les plus âgées ont comme rôle la récolte du pollen, du nectar, de la propolis et de l’eau, en plus d’assurer la défense de la colonie. Qui plus est, les ouvrières maintiennent l’homéostasie de la ruche par la conservation de la température et de l’humidité presque constante, malgré les conditions externes (Sammataro et al. 2000). Pour compléter, la dernière caste est composée des mâles, nommés faux-bourdon, dont l’unique fonction connue est d’inséminer la reine lors de son vol nuptial. Alors que la reine peut survivre plusieurs années, les ouvrières et les faux-bourdons ne vivent habituellement que quelques mois.
1.1.2. Cycle de vie
Le cycle de vie de l’abeille est séparé en quatre grandes étapes : l’œuf, la larve, la pupe, et l’adulte. Initialement, l’abeille débute sa vie sous la forme d’un œuf, pondu par la reine dans un alvéole. Lors de son éclosion, elle émerge sous la forme de larve et poursuit son développement dans sa cellule. La pupation se fait suite à l’operculation de l’alvéole par les ouvrières nourricières à l’aide de leurs glandes à cire, ce qui permet à la larve de tisser un cocon de soie pour réaliser sa transformation
en pupe. Afin de compléter son développement, la pupe subit une dernière mue, puis émerge de sa cellule sous la forme d’adulte. La durée de chacune de ces étapes varie en fonction de la caste de l’abeille. En général, le développement complet de la reine requiert 16 jours, alors que celui des ouvrières est de 21 jours et celui des mâles est de 24 jours (Winston, 1987). Le temps de chacune de ces étapes en fonction de la caste est représenté à la Figure 1.1.1.
Figure 1.1. Cycle de développement des trois castes de l’abeille mellifère (Apis mellifera). Les images
proviennent d’Alex Wild (https://www.alexanderwild.com/) et sont libres de droits lorsque leur utilisation est pédagogique. Les informations ont été adaptées de Winston (1987).
1.1.3. Les envahisseurs de la ruche
Les envahisseurs qui réussissent à contourner les défenses des abeilles bénéficient des conditions favorables de la ruche pour leurs propres développement et reproduction. La majorité des envahisseurs qui accomplissent un tel exploit sont des Acariens (Sammataro et al. 2000). Ceux-ci constituent le groupe le plus large et le plus diversifié d’êtres s’associant aux abeilles (Sammataro et
al. 2000). Malgré le fait que plusieurs de ces Acariens s’avèrent être inoffensifs pour l’Abeille mellifère,
certains d’entre eux nuisent au développement de la colonie.
1.2. Varroa destructor
Varroa destructor (Anderson et Trueman, 2000) est un Acarien ectoparasite obligatoire de l’Abeille.
Celui-ci passe la majorité de sa vie dans l’obscurité de la ruche, préférentiellement dans les cellules de couvain, mais peut également être présent sur les abeilles adultes (Sammataro et al. 2000; Rosenkranz et al. 2010). À ce jour, Varroa destructor est considéré comme la plus grande menace pesant sur l’Abeille mellifère (Sammataro et al. 2000; Rosenkranz et al. 2010; Nazzi et Le Conte, 2016). Plusieurs raisons expliquent l’impact majeur de ce parasite sur les colonies d’abeilles. Premièrement,
V. destructor est un nouveau parasite de l’Abeille mellifère. Alors que celui-ci s’est rapidement ajusté
à son nouvel hôte, l’adaptation de l’Abeille s’est réalisée beaucoup plus difficilement, se traduisant ainsi par une relation hôte-parasite fortement instable (Rosenkranz et al. 2010; Nazzi et LeConte, 2016). Deuxièmement, la dissémination rapide de l’acarien à l’échelle mondiale résulte en une difficulté de trouver un environnement exempt du parasite (Rosenkranz et al. 2010). Troisièmement, en absence de traitements périodiques, la plupart des colonies d’abeilles mellifères dans les climats tempérés s’effondrent dans une période de deux ou trois années (Rademacher et Harz 2006; Boecking et Genersch 2008; Rosenkranz et al. 2010). Or, l’utilisation de ces traitements accroît les dépenses des apiculteurs, en plus de comporter des risques de contamination des produits de la ruche (Rosenkranz
et al. 2010).
1.2.1. Cycle de vie
Le cycle de vie de V. destructor se sépare en deux étapes distinctes : l’étape phorétique et l’étape de reproduction. Au cours de la première étape, la femelle Varroa s’accroche à une abeille adulte et se
nourrit de son hémolymphe et de ses corps gras (Ramsey, et al. 2019). Généralement, celle-ci va se positionner sous les sternites de son hôte afin d’éviter de se faire déloger par le comportement de toilettage des abeilles ou lors de leurs activités hors de la ruche (Fernandez et al. 1993; Sammataro et
al. 2000). En se positionnant sur une abeille adulte, le Varroa est transporté au couvain, où celui-ci
pourra entreprendre sa phase de reproduction. Plusieurs études mettent en évidence que le Varroa est capable de reconnaître l’âge et la fonction des abeilles adultes, ce qui expliquerait leur préférence pour les abeilles nourricières, celles-ci ayant comme fonction l’entretien du couvain (Kraus, 1993; Kuenen et Calderone, 1997). De plus, lors de la phase phorétique, il peut advenir que les varroas se fassent transporter par des abeilles butineuses, ce qui permet leur transfert vers d’autres colonies (Nazzi et Le Conte, 2016).
La seconde phase du cycle de vie du Varroa est la phase de reproduction. Lors de cette étape, la femelle va entrer dans une cellule de couvain quelques heures avant son operculation et prendre place dans la nourriture larvaire au fond de la cellule. Suite à l’operculation et à la consommation de la nourriture par la larve, le Varroa est libéré et commence à se nourrir de son hôte (Ifantidis et al. 1988). Près de 70 heures après l’operculation de la cellule, la femelle Varroa va débuter sa ponte (Ifantidis, 1983; Steiner et al. 1994). Le premier œuf pondu n’est pas fertilisé et se développera en mâle en raison de la détermination sexuelle haplodiploïde de l’acarien (Rosenkranz et al. 2010). Subséquemment, tous les œufs pondus (à 36 heures d’intervalle) seront fertilisés et deviendront des jeunes femelles. Lors d’un cycle complet de reproduction de l’acarien, près de 5 œufs sont pondus dans une cellule de couvain d’ouvrière, alors que 6 œufs peuvent être pondus dans le couvain de faux-bourdon (Martin, 1994; Rosenkranz, 2003). Or, la majorité de la progéniture femelle du Varroa n’aura pas le temps d’atteindre la maturité avant la naissance de l’abeille, et de ce fait, mourra.
1.2.2. Développement du Varroa
Suite à leur éclosion, les progénitures se nourrissent de leur hôte au site préparé par leur mère nommé « zone d’alimentation ». Ce site est généralement localisé sur le 5e segment de la pupe, près du site
d’accumulation fécale des parasites, où ceux-ci se rendront une fois leur alimentation terminée(Donzé et Guerin, 1994; Kanbar et Engels, 2003). De leur sortie de l’œuf jusqu’à leur dernière mue, la progéniture de Varroa passe par les stades de protonymphe et de deutonymphe. Le temps de
maturation sexuelle est d’environ 5,8 jours pour les femelles et 6,6 jours pour les mâles (Rehm et Ritter, 1989; Donzé et Guerin, 1994; Martin, 1994). Une fois la maturité atteinte, le mâle commence à se reproduire avec ses sœurs au site d’accumulation fécale (Donzé et al. 1996). Celui-ci se reproduira à répétition avec la première femelle à atteindre la maturité, jusqu’à ce que la femelle suivante atteigne la maturité et arrive à son tour au site d’accumulation fécale (Rosenkranz et al. 2010). Au moment de l’émergence de l’abeille, la femelle Varroa fondatrice quitte la cellule avec ses progénitures matures, laissant derrière elle les femelles immatures et le mâle. La Figure 1.2 illustre le cycle de reproduction complet du Varroa à l’intérieur d’une cellule de couvain, alors que la Figure 1.3 montre une famille complète de varroas à l’intérieur d’une cellule.
Figure 1.2. Cycle de reproduction d’une femelle Varroa fondatrice dans une cellule de couvain
d’ouvrière. Le schéma provient d’Arista Bee Research et sa diffusion a été approuvé par la fondation (https://aristabeeresearch.org/fr/resistance-a-varroa/). L’illustration est de Merit de Jong.
Figure 1.3. Représentation d’une famille de Varroa destructor à l’intérieure d’une cellule de couvain.
1.3. Le changement d’hôte
Au début des années 1900, Apis mellifera a été réunie avec son espèce sœur, Apis cerana, dont elles étaient séparées par allopatrie depuis près de 10 000 ans (Oldroyd, 1999). Or, Apis cerana était parasité par un Acarien connu sous le nom de Varroa jacobsoni, un parasite se nourrissant de l’hémolymphe des abeilles et des pupes en développement (Nazzi et Le Conte, 2016). Conséquemment, le rassemblement dans l’espace des deux espèces sœurs a permis à Varroa
jacobsoni, maintenant connu sous le nom de Varroa destructor, d’étendre sa gamme d’hôtes d’Apis cerana à Apis mellifera (Oldroyd, 1999). Ainsi, lorsque les colonies d’A. mellifera ont de nouveau été
exportées, le parasite s’est rapidement rependu au travers le globe (Boecking et Genersch, 2008). L’association de Varroa destructor et d’Apis cerana est un phénomène de longue date, ce qui expliquerait le peu de préjudices que cause l’acarien à son hôte (Oldroyd, 1999; Rath 1999). En effet, sur son hôte naturel, la reproduction de V. destructor est presque entièrement limitée au couvain mâle, dont la production survient à intervalle inégal et représente une faible proportion du couvain total (Boecking et Genersch, 2008). De plus, en absence de couvain mâle, l’acarien est restreint à exister sous phase phorétique, ce qui diminue grandement ses chances de survie face au comportement de défense de son hôte. Par conséquent, les populations d’acariens sont maintenues à un niveau relativement faible dans les colonies d’A. cerana (Rath, 1999; Oldroyd, 1999), ce qui réduit considérablement les effets ressentis par ce parasitisme.
Cependant, l’association de V. destructor et d’A. mellifera est très récente, ce qui se traduit par un fort déséquilibre de la relation hôte-parasite. En effet, bien que les acariens aient une nette préférence pour le couvain mâle, ceux-ci ont aussi développé la capacité de se reproduire avec succès dans le couvain d’ouvrière chez A. mellifera (Fuchs, 1992; Boot et al. 1997; Boecking et Genersch, 2008). Ainsi, ce changement d’hôte procure un avantage considérable au parasite puisque désormais,
V. destructor peut se reproduire presque continuellement dans l’année (Martin, 2001). Cette adaptation
se traduit par une augmentation à tendance exponentielle de la population de V. destructor qui mène à l’effondrement des colonies d’abeilles dans les quelques années suivant l’infestation initiale (Martin, 2001; Boecking et Genersch, 2008). Qui plus est, les mécanismes de défense d’A. mellifera face à son envahisseur semblent être moins efficaces que ceux employés par son espèce sœur (Fries et al. 1996), n’ayant pas profité d’une aussi longue période de coévolution (Rath, 1999). C’est pourquoi le parasite
Varroa destructor est considéré comme l’une des plus grandes menaces pesant sur l’abeille mellifère
(Rosenkranz et al. 2010).
1.4. La Varroase
1.4.1 Les effets directs
L’Abeille est affligée de multiples façons par la Varroase. Tout d’abord, les varroas affectent directement leur hôte lors de leur développement ontogénique en se nourrissant de leurs corps gras et leur hémolymphe, ce qui engendre une diminution significative du poids de l’abeille lors de sa sortie de la cellule (Ramsey et al. 2019; Rosenkranz et al. 2010). Chez les ouvrières, cette perte de poids se traduit par une durée de vie considérablement réduite, alors que chez les faux-bourdons, cela a pour conséquence de diminuer leur performance lors de vol, et de ce fait, de réduire leur valeur sélective (Duay et al. 2002; Amdam et al. 2004). Qui plus est, lorsque les abeilles sont parasitées au cours de leur phase adulte, celles-ci semblent prolonger leurs absences de la colonie, en plus d’avoir un moindre taux de retour (Kralj et Fuchs, 2006).
1.4.2. Les effets indirects
D’autre part, la Varroase peut aussi affecter indirectement les abeilles par la transmission d’agents pathogènes. En effet, à ce jour, de nombreux virus ont été isolés de l’Abeille mellifère dont 5 [Kashmir
Bee VirusI (KBV), le Sacbrood virus (SBV), l’Acute Bee Paralysis Virus (ABPV), l’Israeli acute paralysis virus (IAPV) et le Deformed Wing Virus (DWV)] sont étroitement associés au Varroa (Boecking et
Genersch 2008). Or, avant la propagation de Varroa destructor, les virus n’étaient considérés que comme un problème mineur pour la santé des abeilles (Bowen-Walker et al. 1999). De ce fait, plusieurs études suggèrent que la salive du parasite induirait la réplication des particules virales latentes du DWN, en plus de provoquer l’immunodépression des pupes en développement (Yang et Cox-Foster, 2007; Rosenkranz et al. 2010), ce qui pourrait rendre les abeilles plus vulnérables au développement de maladies.
1.5. Les traitements
Une large gamme de traitements sont employés par les apiculteurs afin de maintenir les populations de varroas sous contrôle (Rosenkranz et al. 2010). Cependant, ces traitements nécessitent une application périodique, sans quoi, la majorité des colonies subiraient de profonds dommages, voire s’effondreraient, à cause de la Varroase dans les quelques années suivant l’infestation initiale (Boecking et Genersch, 2008). Parmi les traitements fréquemment employés, nous retrouvons les acaricides synthétiques, les acaricides naturels ainsi que les techniques biologiques (Rosenkranz et
al. 2010).
1.5.1. Les acaricides synthétiques
Les acaricides synthétiques comprennent l’organophosphate coumaphos (Checkmite®, Asuntol®,
Perizin®), la pyréthrine tau-fluvalinate (Apistan®, Klartan®, Mavrik®), la fluméthrine (Bayvarol®) et la
formamidine amitraze (Amitraz®, Apivar®, Miticur®)(Rosenkranz et al. 2010). Ces produits chimiques
dits « durs » sont parmi les moins chers et les plus faciles à appliquer. Cependant, l’emploi de tels composés n’est pas sans risque puisque ceux-ci persistent dans les produits de la ruche (Wallner, 1999), en plus de présenter un danger pour la santé des abeilles (Gregorc et al. 2018). Qui plus est, leur efficacité à long terme est aussi remise en question face à l’émergence de populations de V.
destructor résistantes (Ellis et al. 2001).
1.5.2. Les acaricides naturels
Les acaricides naturels sont des produits considérés « doux » pour l’environnement. Ceux-ci regroupent l’acide formique, l’acide oxalique, l’acide lactique et le thymol (Rosenkranz et al. 2010). L’utilisation de ces produits présente peu d’impact sur les produits de la ruche et pour l’environnement. Néanmoins, leur efficacité varie considérablement en fonction des conditions climatiques (Rosenkranz
1.5.3. Les méthodes alternatives
Plusieurs méthodes alternatives aux acaricides, liées à la biologie de l’hôte et du parasite, sont aussi employées par les apiculteurs. (Rosenkranz et al. 2010). Ces méthodes comprennent les traitements intensifs à la chaleur, l’utilisation de cellules plus petites, le saupoudrement des abeilles de sucre à glacer, et bien d’autres encore (Rosenkranz, 1987; Ellis et al. 2009a; Ellis et al. 2009b). Cependant, peu d’entre elles se sont avérées efficaces et davantage d’études doivent être effectuées afin de démontrer leur efficacité (Rosenkranz et al. 2010).
En considérant tous les problèmes se rattachant à l’utilisation d’acaricides et des autres méthodes de contrôle, de nouvelles alternatives durables doivent être développées afin de lutter contre la Varroase.
1.6. Notre approche : la sélection du comportement Varroa Sensitive Hygiene
(VSH)
Une solution alternative à l’utilisation d’intrants chimiques afin de limiter les effets de la varroase est la sélection de colonies ayant le comportement Varroa Sensitive Hygiene (VSH). Ce caractère, se définissant comme la capacité d’une colonie d’abeilles à limiter la charge du parasite, est fortement associé à l’expression de deux traits apparentés: les colonies résistantes VSH peuvent 1) détecter la présence des varroas à travers l’opercule du couvain en développement et 2) enlever le couvain parasité (Boecking et Spivak, 1999; Evans et Spivak, 2010). Lorsqu’une pupe infestée est retirée, la femelle Varroa est retirée en même temps, ce qui interrompt sa ponte (Figure 1.4). Si cette dernière ne tombe pas au fond de la ruche par le mouvement de retrait du couvain, elle a alors l’opportunité de monter sur l’abeille qui retire la pupe, et ainsi, de passer en phase phorétique.
Figure 1.4. Abeilles exprimant le comportement de résistance aux varroas (VSH). Le schéma provient
d’Arista Bee Research et sa diffusion a été approuvé par la fondation (https://aristabeeresearch.org/fr/resistance-a-varroa/). L’illustration est de Merit de Jong.
Le comportement défensif VSH ne tue pas nécessairement tous les acariens qui infestent les cellules, mais perturbe plutôt le cycle de reproduction de la femelle Varroa. En effet, dans les colonies sélectionnées pour le comportement VSH, une forte proportion des femelles varroas fondatrices deviennent non reproductives, c’est-à-dire que celles-ci n’arrivent pas à produire au moins une femelle fécondée viable au terme d’un cycle de reproduction dans le couvain (Harbo et Harris, 2001). Il semblerait que la femelle Varroa fondatrice entre dans une cellule de couvain à des fins de reproduction, mais sans produire de progénitures, ne produirait aucune descendance viable, ne pondrait pas ou aurait une ponte interrompue, ne produirait que des mâles ou produirait des progénitures trop tard pour que celles-ci atteignent la maturité (Harbo et Harris, 1999a). De ces faits, une colonie exprimant fortement ce trait serait en mesure de diminuer la population de varroas, ou du moins, de limiter sa croissance à un niveau très faible (Harbo et Harris, 1999a).
1.6.1. Suppressed Mite Reproduction (SMR)
Cet échec reproducteur des acariens est connu sous le nom de Suppressed Mite Reproduction (SMR). La littérature actuelle indique que le SMR est probablement le résultat du comportement VSH puisque le principal mécanisme de résistance des colonies ayant un fort taux SMR est le retrait du couvain parasité par le Varroa (Ibrahim et Spivak, 2004; 2006; Harbo et Harris 2005). Cette découverte représente un attrait majeur lors de la sélection de colonies puisque le SMR est un trait héritable (Harbo et Harris, 1999b; Harbo et Harris, 2001; Harbo et Harris 2009). Normalement, la fréquence d’acariens non reproducteurs dans les colonies d’A. mellifera se situe à un taux de 10 à 20% (Rosenkranz et Engels, 1994). Or, Harbo et Harris (2001) ont démontré qu’à l’aide de l’élevage sélectif, il est possible d’améliorer l’expression de ce trait.
1.6.2. La réoperculation des cellules de couvain par les ouvrières
Toutefois, le niveau SMR d’une colonie peut potentiellement résulter d’autres mécanismes que du comportement VSH. L’un des mécanismes possibles est la désoperculation et la réoperculation des cellules de couvain infestées. En effet, il a été démontrer que la réoperculation des cellules par les ouvrières est à la fois plus fréquente et plus ciblée dans les populations ayant développé de la résistance contre les varroas et présentant des taux d’acariens non reproducteurs élevés (Oddie et al. 2018; Martin et al. 2019). Ainsi, l’ouverture de la cellule au bon moment du développement du couvain
pourrait engendrer une désynchronisation du cycle de reproduction de l’acarien (Kirrane et al. 2011). Qui plus est, il a également été observé que la désoperculation et la réoperculation des cellules pourrait être suffisant pour provoquer la mort des progénitures immatures du Varroa (Harris et al. 2012).
1.7. Les risques de la sélection
La sélection génétique pour un caractère représente une solution intéressante face à la problématique qu’engendre les varroas, toutefois, celle-ci comporte également un certain risque puisqu’il peut advenir qu’il y ait un « coût » qui y soit associé (Moyers et al. 2018). En effet, la sélection pour un trait implique souvent des croisements consanguins, ce qui entraîne une réduction du patrimoine génétique des individus qui en sont issus (Moyers et al. 2018). Cette perte de diversité génétique rend, entre autres, les organismes plus sujets à des défauts héréditaires. Qui plus est, la sélection pour un caractère spécifique peut également engendrer des répercussions négatives sur d’autres caractéristiques désirables (Hill, 2013a). Cette réponse à la sélection peut survenir lorsque le caractère sélectionné a un effet pléiotropique (i.e. la particularité d’un gène d’agir sur plusieurs caractères) ou bien qu’il soit en déséquilibre de liaison avec les autres traits étudiés (i.e. il y a une proximité physique entre les locis contrôlant les traits étudiés) (Hill, 2013b). Ainsi, il est difficile de prévoir les retentissements de la sélection artificielle puisque cela peut résulter par une augmentation du trait désiré, mais également engendrer une sélection corrélée sur un ou plusieurs autres caractères. Les réponses corrélées sont souvent observées dans les programmes de sélection; alors que celles-ci sont parfois souhaitables, il peut également également advenir qu’il y ait des effets indésirables. Par exemple, les poulets de chairs sont sélectionnés depuis des années afin d’augmenter leur rythme de croissance corporel (Commission européenne, 2016). Les retentissements de cette sélection font qu’en date de 2016, les poulets commerciaux atteignaient leur poids d’abattage quatre fois plus rapidement que dans les années 1950 (Institut technique des filières avicole, cunicole et piscicole, 2015). Or, la croissance accélérée de ces animaux ne se fait pas sans conséquence puisque certains de leurs caractères métaboliques ont été modifiés par cette sélection (Commission européenne, 2016). Cela fait en sorte que les poulets de chair à croissance rapide souffrent désormais de nombreux maux, dont notamment d’anomalies aux pattes (Le Neindre et al. 2009; Biseray et al. 2014).
En apiculture, plusieurs caractéristiques associées à la performance des colonies sont maintenues dans divers programmes de sélection génétique de l’Abeille. Par exemple, le programme d’élevage du Centre de recherche en sciences animales de Deschambault (CRSAD) sélectionne depuis une dizaine d’années des lignées d’abeilles mellifères pour leur rusticité, c’est-à-dire pour leur aptitude productive, mais également pour leur résistance aux maladies et leur capacité à s’adapter aux conditions environnementales du Québec. Parmi les critères maintenus dans le cheptel, nous retrouvons le développement printannier, c’est-à-dire, la capacité d’une colonie à produire une grande quantité de couvain au printemps, le comportement hygiénique, soit le comportement de détection et nettoyage du couvain malade, parasité ou mort, le comportement défensif, défini par la tendance d’une colonie à attaquer ses envahisseurs, la production de miel et le taux de croissance de la population de varroas. Considérant les répercussions potentiellement néfastes que peut engendrer la sélection génétique, il serait intéressant de déterminer si l’expression du comportemental VSH permet aux colonies de de combattre efficacement les varroas, tout conservant leurs caractéristiques de performance.
1.8. Objectifs et hypothèses
Les objectifs principaux de la réalisation de cette recherche sont (1) de quantifier la relation entre le comportement VSH et le trait SMR, (2) de déterminer si la réoperculation des cellules du couvain engendre des problèmes de reproduction chez les acariens et (3) de quantifier l’impact de l’expression du comportement VSH sur les critères de performance employés dans le programme de sélection du Centre de Recherche en Sciences animales de Deschambault.
Face à ces objectifs, il est possible d’émettre les hypothèses et prédictions suivantes:
Hypothèse 1: Le comportement VSH est corrélé au trait SMR dans les colonies d’abeilles; Hypothèse 2: Les problèmes de reproduction des acariens sont expliqués par la manipulation
de l’opercule par les ouvrières;
Hypothèse 3: L’expression du comportement VSH va impacter la performance des colonies
Afin de vérifier l’hypothèse 1 et 2 (Chapitre 2), les paramètres suivants ont été évalués:
Paramètre 1: le taux d’expression du comportement VSH au sein des colonies du projet; Paramètre 2: le succès reproducteur des femelles varroas fondatrices (SMR);
Paramètre 3: la manipulation du couvain par les ouvrières (réoperculation).
Afin de vérifier l’hypothèse 3 (Chapitre 3), le paramètre suivant a été évalué :
Paramètre 4: les critères de performances des colonies d’abeilles mellifères. i) Le développement printanier;
ii) le comportement hygiénique; iii) le comportement défensif; iv) la production de miel;
Chapitre 2 : Étude du trait Suppressed Mite Reproduction (SMR)
2.1. Matériel et méthodes
2.1.1. Colonies expérimentales
Les colonies expérimentales employées au cours de ce projet sont issues de 9 lignées génétiques différentes et ont été créées au cours de l’été 2017 (n=40) avec des reines Apis mellifera hybrides provenant du programme de sélection du Centre de recherche en sciences animales de Deschambault (CRSAD).
De plus, un rucher de colonies fortement infestées de varroas (FI) (26 colonies avec taux d’infestation entre 10% et 40%) a été maintenu tout au cours de la saison apicole afin de réaliser les tests VSH et SMR.
2.1.2. Dispositif expérimental
Au cours du printemps 2018, les colonies expérimentales du projet ont été dispersées parmi 4 ruchers dans les environs de Neuville et Donnacona (Québec, Canada) :
1. Le rucher Bérubé (46°41'55"N; 71°45'02"O) 2. Le rucher Dubuc (46°42'27"N; 71°34'33"O) 3. Le rucher Delisle (46°43'08"N; 71°33'08"O)
4. Le rucher Langlois (46°42'13"N; 71°37'00"O)
Ces colonies ont été distribuées aléatoirement, mais un effort a été fait afin que toutes les lignées soient représentées dans chacun des ruchers. L’emplacement des ruchers est illustré à la Figure 2.1.
Figure 2.1. Cartes indiquant l’emplacement des ruchers de l’expérience. La première carte du haut
représente l’emplacement des ruchers sur une carte du Canada. La seconde carte en bas indique l’emplacement des ruchers à l’intérieur de la province du Québec. Leurs coordonnées GPS, de gauche à droite, sont les suivantes; Bérubé: 46°41'55"N; 71°45'02"O, Langlois: 46°42'13"N; 71°37'00"O, Dubuc: 46°42'27"N; 71°34'33"O, Delisle: 46°43'08"N; 71°33'08"O.
2.1.3. Évaluation du comportement VSH des colonies
L’évaluation du comportement VSH a été réalisée à la mi-juillet de l’été 2018 en se basant sur le protocole de Villa et al. (2009). En somme, les reines des colonies FI ont été mises en cage d’exclusion à reine (modèle maison, Figure 2.2) avec un cadre de couvain modifié (Figure 2.3A), pendant une période de 48h. Cette étape contraint les reines à pondre uniquement sur les cadres expérimentaux, ce qui permet l’obtention de grandes surfaces de couvain du même âge. Suite à cette période, chaque reine a été retirée des cages d’exclusion et replacée dans sa colonie. Les cadres sont restés l’intérieur des colonies FI jusqu’à ce que les cellules soient operculées et que les femelles varroas fondatrices aient envahi les cellules de couvain (9 à 10 jours).
Suite à l’infestation, les cadres (Figure 2.3A) ont été retirées et séparées en deux (Figure 2.3B). Le taux de parasitisme initial a été mesuré dans chaque demi-cadre en vérifiant un échantillon aléatoire de 100 cellules de couvain (50 cellules par côté de cadre) pour la présence de varroas. Pour ce faire, les cellules ont été désoperculées et les pupes retirées à l’aide de pince chirurgicale. La présence d’acariens sur les pupes et dans les cellules a ensuite été vérifiée avec minutie sous l’éclairage d’une lampe frontale. Une fois l’évaluation terminée, les demi-cadres ont été fixés dans une monture (Figure
2.3C) et placés au centre de la hausse à couvain d’une colonie à tester pour le comportement VSH.
Ce cadre est demeuré dans la colonie expérimentale pendant 7 jours. Après cette période, les demi-cadres ont récupéré et congelés à -18 °C pour un examen ultérieur.
Afin de compléter l’évaluation du comportement VSH d’une colonie, le taux de parasitisme final a été mesuré par le dénombrement des femelles varroas fondatrices présentes dans les cellules de chaque demi-cadre. Le comptage des femelles varroas fondatrices a été réalisé en ouvrant aléatoirement 100 cellules de couvain (50 cellules par côté de cadre) sur chaque demi-cadre. Cette évaluation a été réalisée en laboratoire en procédant de la même manière que pour l’évaluation initiale. Le pourcentage VSH a ensuite été obtenu pour chaque colonie expérimentale par l’équation suivante :
% VSH = % infestation final − % infestation initial
Figure 2.2. Cage d’exclusion de reine maison. Cette cage restreint les déplacements de la reine au
cadre qui est placé à l’intérieur, ce qui permet l’obtention d’une surface de couvain uniforme du même âge. Photo de Stéphanie Rouleau-Breton.
Figure 2.3. Cadre de couvain modifié utilisé pour l’évaluation du comportement VSH (Photos de
Stéphanie Rouleau-Breton). A Un cadre Langstroth coupé en deux qui est placé dans la colonie FI. B Les deux moitiés du cadre séparé de leur monture après l’infestation des cellules par les varroas. C Un demi-cadre dans sa monture qui est introduit dans la colonie expérimentale pour évaluer son pourcentage VSH.
A
C B
2.1.4. Évaluation du trait SMR des colonies
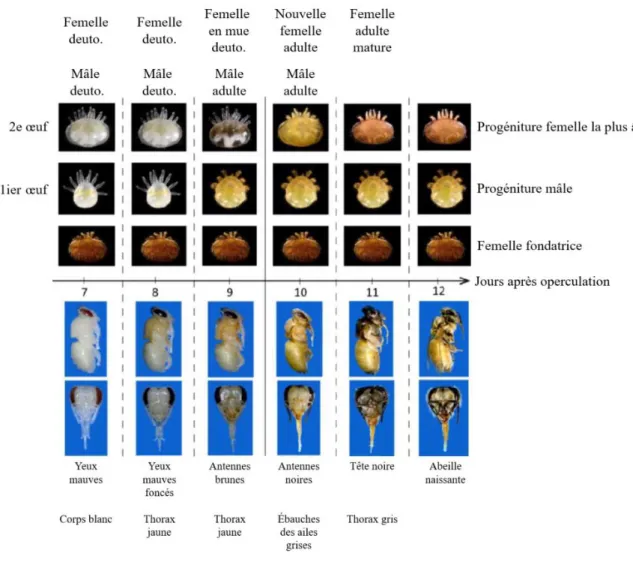
L’étude de la reproduction des varroas a été effectuée conformément au protocole de Büchler et al. (2017). En résumé, les cellules de couvain des demi-cadres utilisé pour l’évaluation VSH ont été ouvertes aléatoirement jusqu’à l’obtention de 35 cellules parasitées par une seule Varroa mère. Quand une cellule était parasitée, la composition de la famille d’acariens était décrite. La reproduction normale du Varroa associée aux différents stades de développement de l’abeille est illustrée à la Figure 2.4.. Au stade de développement correspondant à l’âge du couvain de nos cadres (9-10 jours post-operculation; antennes brunes et thorax jaune à antennes noires à ébauches des ailes grises)(Figure 2.4), une femelle Varroa fondatrice est normalement accompagnée d’au moins une fille deutonymphe et d’un mâle adulte. Si une cellule ne contient pas cette progéniture, la femelle Varroa fondatrice est alors considérée comme non-reproductrice (SMR). Le pourcentage SMR a ensuite été calculé comme suit:
% SMR = Nombre de cellules de couvain contentant une femelle Varroa non reproductrice
Nombre de cellules de couvain infestées par une seule femelle Varroa x 100
Figure 2.4. Phénotypes des varroas en fonction de l’âge de leur hôte, Apis mellifera. Adaptée de
2.1.5. Manipulation du couvain par les abeilles
La manipulation du couvain par les abeilles a été déterminée par le taux de désoperculation et de réoperculation de cellules de couvain. Pour ce faire, les cocons de soie à l’intérieur des opercules des cellules ont été observés à chaque fois qu’une cellule était ouverte, et ce, même si la cellule n’était pas parasitée. Si l’opercule présentait un trou mat (Figure 2.52.5), cela confirmait un maniement de cette cellule par les ouvrières puisqu’une cellule non manipulée présente un cocon de soie brillant.
Figure 2.5. L’activité de réoperculation de l’abeille mellifère est confirmée par le trou mat à l’intérieur
2.1.6. Analyses statistiques
L’effet du comportement VSH sur le trait SMR a été analysé par un modèle de régression linéaire à effets mixtes incorporant le comportement VSH, le rucher et la lignée génétique en tant qu’effets fixes et les numéros d’identification des colonies expérimentales comme effet aléatoire. Le degré de significativité du modèle a ensuite été vérifié par l’utilisation d’une ANOVA dans R (version 3.5.3). Étant donné que le comportement VSH n’avait pas d’effet significatif sur le trait SMR, une analyse plus poussée de différents critères associés à la manipulation du couvain par les ouvrières pouvant avoir un impact sur la reproduction des varroas a été poursuivie. Toutefois, la provenance génétique des ruches avait un fort effet significatif, et de ce fait, chacune des analyses subséquentes a pris en considération ce facteur. C’est-à-dire que tous les facteurs susceptibles d’avoir un impact sur le trait SMR ont été analysés à l’aide de comparaisons multiples avec un facteur de correction de Tukey entre les différentes lignées. Toutefois, l’effet de la lignée n’avait pas d’impact significatif pour certains de ces facteurs, ce qui a permis d’effectuer des tests de t sans tenir compte de la provenance génétique des colonies. Ainsi, un premier test de t pour données non appariées a été effectué entre le pourcentage de cellules réoperculées contenant un varroa fertile et celles contenant un varroa infertile, alors qu’un second test de t pour données non appariées a été effectué entre le nombre de progénitures par Varroa reproducteur dans une cellule réoperculée et non réoperculée. Le pourcentage de varroas réoperculé, le pourcentage de cellules contenant un Varroa fertile et le pourcentage de cellules réoperculées contenant un Varroa infertile ont été transformés à l’aide de la fonction Arc sinus (arcsin) pour pallier leur manque de normalité. Toutes les données ont ensuite été présentées dans leur échelle originale après analyse. Les effets ont été jugés significatifs à P < 0,05.
2.2. Résultats
2.2.1. Relation entre le comportement VSH, le rucher, la lignée génétique et le trait SMR
Les résultats obtenus suite à l’analyse du modèle de régression linéaire indiquent qu’il n’y a pas de relation significative entre le comportement VSH et le trait SMR (F = 0,68; dl = 1, 9; P = 0,43). Ce résultat est illustré graphiquement à la Figure 2.7.
Figure 2.6. Relation entre le comportement VSH et le trait SMR parmi 40 colonies d’abeilles mellifères. y = 35,66 + 0,12x
Le pourcentage de varroas femelles fondatrices rencontrant des problèmes de reproduction dans le couvain d’abeille (SMR) est significativement différent entre les lignées génétiques (F = 5,10; dl = 8, 9; P = 0,01). Ce résultat est illustré graphiquement à la Figure 2.7 et synthétisé dans le Tableau 2.1.
2.2.2. Facteurs associés à la manipulation du couvain par les abeilles
Les résultats des comparaisons multiples indiquent que le pourcentage de réoperculation général des cellules de couvain est significativement différent entre les lignées génétiques (Tableau 2.1).
Le pourcentage de cellules réoperculées contenant un Varroa, le pourcentage de cellules réoperculées contenant un Varroa fertile, le pourcentage de cellules réoperculées contenant un Varroa infertile, le nombre moyen de progénitures de Varroa reproductrices dans une cellule réoperculée et le nombre moyen de progénitures de Varroa reproductrices dans une cellule non réoperculée sont tous des facteurs qui ne varient pas significativement entre les différentes lignées (Tableau 2.1).
Les résultats du test de t entre le pourcentage de cellules réoperculées contenant un Varroa fertile et le pourcentage de cellules réoperculées contenant un Varroa infertile n’indiquent aucune différence entre ces deux critères (t = -0,95; dl = 78; P = 0,35). Toutefois, la réalisation d’un second test de t entre le nombre moyen de progénitures de Varroa reproductrices dans une cellule réoperculée et le nombre moyen de progénitures de Varroa reproductrices dans une cellule non réoperculée indique qu’il y a une différence significative entre ces deux critères (t = 2,48; dl = 70; P = 0,02). En effet, les cellules contenant une Varroa reproductrice avec un nombre plus élevé de progénitures sont plus manipulées que les cellules qui contiennent une Varroa reproductrice avec moins de progénitures (Tableau 2.1).
Figure 2.7. Pourcentage SMR des 40 colonies du projet en fonction de leur lignée génétique. Les
comparaisons entre les lignées ont été réalisées à l’aide d’un test de Tukey. Les colonnes avec des lettres distinctes sont significativement différentes (P < 0,05).
b a ab ab ab ab ab ab ab
Tableau 2.1. Moyenne des différents paramètres (± SE) associés aux problèmes de reproduction des varroas parmi 40 colonies d’abeilles
mellifères provenant de 9 lignées génétiques du Centre de recherche en sciences animales de Deschambault.
Lignées 1 2 3 4 5 6 7 8 9 Total
Nb de colonies testées 4 5 4 5 7 5 3 4 3 40
Nb de cellules examinées 848 1176 1003 1748 1927 832 801 877 684 9896
Nb de cellules examinées par colonie 212,00 ± 24,85 235,20 ± 34,60 250,75 ± 38,09 349,60 ± 82,00 275,29 ± 49,95 166,40 ± 10,16 267,00 ± 65,49 219,25 ± 5,30 228,00 ± 31,95 247,40 ± 19,33
% SMR 27,86 ± 5,76a 33,71 ± 3,98ab 22,86 ± 3,09a 36,35 ± 1,56ab 34,29 ± 3,41ab 52,00 ± 5,06b 46,67 ± 2,52ab 34,29 ± 4,21ab 32,38 ± 6,67ab 35,69 ± 1,80 % de réoperculation général 76,66 ± 12,55ab 71,27 ± 10,19ab 52,33 ± 7,66ab 69,37 ± 9,56ab 40,13 ± 5,91a 47,38 ± 9,40ab 47,26 ± 8,16ab 48,36 ± 9,49ab 86,75 ± 9,42b 58,31 ± 3,65 % de Varroas réoperculées 96,43 ± 3,57 85,71 ± 6,94 81,43 ± 5,28 85,71 ± 6,06 68,57 ± 9,12 71,43 ± 11,46 76,19 ± 6,67 77,14 ± 11,84 96,19 ± 2,52 80,79 ± 2,98 % de cellules réoperculées contenant Un Varroa fertile 98,91 ± 1,09 85,13 ± 8,02 84,23 ± 3,99 88,08 ± 5,93 71,27 ± 9,75 73,97 ± 9,94 79,85 ± 5,62 83,61 ± 11,96 95,65 ± 4,35 83,21 ± 2,91 Un Varroa infertile 89,17 ± 7,86 88,08 ± 5,10 79,67 ± 11,84 79,73 ± 6,23 65,86 ± 9,39 71,43 ± 15,00 72,18 ± 7,57 68,49 ± 15,01 97,78 ± 2,22 77,91 ± 3,48
Nb de progénitures par Varroa reproductrice
Réoperculé 3,46 ± 0,09 3,42 ± 0,05 3,78 ± 0,12 3,34 ± 0,14 3,55 ± 0,16 3,32 ± 0,14 3,22 ± 0,19 3,61 ± 0,20 3,64 ± 0,26 3,48 ± 0,05
Non réoperculé 3,00* 3,01 ± 0,75 3,46 ± 0,32 3,63 ± 0,14 3,06 ± 0,25 3,38 ± 0,56 3,13 ± 0,13 2,31 ± 0,52 3,00* 3,13 ± 0,15
Varroas fertiles = Les varroas fondatrices sont considérées fertiles si elles produisent au moins une femelle fécondée viable au terme d’un cycle de reproduction dans le couvain.
Les différences entre les lignées pour les divers critères ont été réalisées à l’aide de tests de Tukey. Les colonnes avec des lettres distinctes sont significativement différentes (P < 0,05). S’il n’y a pas de lettre, aucune différence significative n’a été observée entre les lignées.
2.3. Discussion
Selon les résultats de notre étude, aucune relation entre le comportement VSH et le trait SMR n’a été détectée. Il est toutefois impossible de conclure sur une absence de relation entre ces deux critères. En effet, bien que certaines recherches suggèrent que le niveau de fertilité des varroas fondatrices décroît après l’introduction d’un cadre de couvain pendant une semaine dans une colonie VSH (Harbo et Harris, 2005; Villa et al. 2009; Harbo et Harris, 2009), une étude plus récente de Kirrane et al. (2015) suggère plutôt que cet effet se fasse ressentir à délais, c’est-à-dire que les varroas auraient de la difficulté à se reproduire lors de l’invasion subséquente d’une cellule de couvain. En effet, la manipulation du couvain par les ouvrières pourrait désynchroniser le cycle reproducteur de l’acarien avec celui de son hôte, engendrant ainsi une baisse de fertilité ultérieure du parasite (Kirrane et al. 2011). La présente étude tend également à soutenir cette dernière hypothèse, puisqu’aucune relation entre le comportement VSH et le trait SMR n’a été constatée, alors que les deux mesures ont été effectuées au même moment, et ce, sur le même cadre de couvain.
Toutefois, il a tout de même été possible de détecter un niveau d’expression différentiel du trait SMR entre les diverses lignées du projet. Ce résultat suggère que les problèmes de reproduction des varroas pourraient être expliqués par d’autres éléments que le comportement VSH, et que ces caractéristiques pourraient être d’origine génétique. Ainsi, une étude plus approfondie de facteurs pouvant expliquer une baisse du niveau reproducteur des varroas associés à la manipulation du couvain par les abeilles a été poursuivie.
Pour débuter, le pourcentage de réoperculation générale du couvain par les abeilles a été observé et il a été déterminé que celui-ci était significativement différent entre les lignées génétiques. Or, la lignée 6, qui était la lignée la plus SMR, n’exprimait qu’un niveau intermédiaire de réoperculation générale, alors qu’il aurait été possible de croire qu’elle serait celle qui exprimerait le plus fortement cette caractéristique. Ce résultat concorde avec les études de Villa et al. (2009) ainsi que Kirrane et al. (2015), qui suggèrent que la réoperculation du couvain, sans distinction pour son contenu, ne serait pas un bon critère pour déterminer si une colonie est potentiellement résistante aux acariens. Toutefois, ce résultat contraste également avec les résultats d’Oddie et al. (2018) qui ont observés que ce mécanisme était significativement plus fréquent chez les colonies résistantes aux varroas que les colonies sensibles au parasite.
Par la suite, il nous a semblé que la réoperculation spécifique des cellules de couvain infestées par les varroas serait un critère plus approprié pour détecter l’aptitude SMR des colonies. Or, telle qu’observée précédemment pour la réoperculation générale du couvain, cette caractéristique ne différait pas significativement entre les différentes lignées du projet. Ce résultat est plutôt étonnant considérant que l’étude réalisée par Oddie et al. (2018) démontrait que les colonies ayant développé de la résistance naturellement contre les varroas présentaient un taux de réoperculation ciblé plus élevé que les colonies susceptibles. Ainsi, il aurait été plausible de croire que la lignée 6 présenterait également cette caractéristique. Or, dans le cadre de notre étude, la réoperculation spécifique des cellules de couvain infestées par les varroas ne permet pas de détecter un niveau de résistance naturel aux parasites. Quelques études antérieures ont suggéré que les colonies SMR ciblaient préférentiellement les cellules de couvain infestées par des varroas fertiles, ce qui expliquerait le grand nombre de varroas stériles retrouvés dans celles-ci (Harbo et Harris, 2005; Harbo et Harris 2009). Toutefois, les résultats obtenus dans notre projet abondent davantage avec une étude réalisée par Harris et al. (2010) qui démontre qu’aucune sélection préférentielle n’est effectuée par les abeilles. En effet, en observant notre lignée la plus SMR, il est possible de constater qu’aucune distinction n’est effectuée entre les varroas fertiles et les varroas stériles puisque les pourcentages de réoperculation de ces cellules ne sont pas significativement différents entre nos lignées.
Toutefois, le taux d’oviposition du Varroa semble être un facteur influent sur le potentiel SMR des colonies puisque le nombre de progénitures pondu par femelle fondatrice influence la capacité des ouvrières à détecter leur présence sous l’opercule de cire. En effet, le pourcentage de réoperculation des cellules de couvain variait en fonction du nombre de varroas s’y trouvant; celui-ci tendait à être plus élevé lorsque la Varroa mère avait pondu davantage de progénitures. Ce résultat suggère ainsi que le trait SMR est activé par l’atteinte d’un seuil de densité d’acariens dans une cellule. Cette hypothèse vient soutenir celle émise par Harris (2007) qui suggère que les colonies VSH ont un seuil de tolérance moins élevé face à la densité d’acariens dans leur colonie que les abeilles non résistantes. En somme, il est bien difficile de conclure sur les causes probables du trait SMR. En effet, le comportement VSH, la réoperculation générale du couvain, la réoperculation spécifique des cellules de couvain infestées par les varroas et la fertilité des acariens ne semblent ne pas être des facteurs