SARAH CHOUINARD-CASTONGUAY
RELATION ENTRE L'ALLAITEMENT ET LE
PROFIL MÉTABOLIQUE CHEZ DES FEMMES
AYANT EU UN DIABÈTE GESTATIONNEL
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en Nutrition
pour l'obtention du grade de Maître es sciences (M.Sc.)
DÉPARTEMENT DES SCIENCES DES ALIMENTS ET DE NUTRITION FACULTÉ DES SCIENCES DE L'AGRICULTURE ET DE L'ALIMENTATION
UNIVERSITÉ LAVAL QUÉBEC
2012
Résumé
Au Canada, l'incidence de diabète gestationnel (DbG) est en augmentation. Les femmes ayant reçu un diagnostic de DbG représentent une population à risque de diabète de type 2 (DbT2). L'allaitement serait associé à des effets bénéfiques sur la santé de la mère. En effet, l'allaitement augmenterait la perte de poids post-partum. Il aurait aussi un effet immédiat favorable sur la tolérance au glucose. Cependant, il demeure incertain pour le moment si l'allaitement prévient ou retarde le développement du DbT2 à long terme. Les travaux de ce mémoire visent à déterminer l'impact de l'allaitement sur la concentration, la sensibilité et la sécrétion d'insuline. Les résultats présentés dans ce mémoire suggèrent des effets bénéfiques à long terme de l'allaitement sur le profil d'insuline.
Abstract
In Canada, the incidence of gestational diabetes mellitus (GDM) is increasing. Women who received a GDM diagnostic are at particular risk of developing type 2 diabetes (T2D). Lactation seems to be associated with positive effects on the mother's health. Indeed, lactation increases weight lost in the post-partum period. It also appears to have an immediate favorable effect on glucose tolerance. However, it remains uncertain if lactation prevents or delays T2D development in the long term. This work aims to determine the impact of lactation on insulin concentration, sensitivity and secretion. Results presented in this M.Sc. thesis suggest that lactation has a long term effect on insulin profile.
Avant-Propos
Dans les pages qui suivent, vous retrouverez les travaux exécutés au cours de ma maîtrise sous la supervision de Julie Robitaille. Pour réaliser ce projet de recherche, j'ai tout d'abord participé au recrutement des participantes (appel, prise de
rendez-vous). À l'aide d'autres membres de mon équipe, j'ai contribué aux rencontres des participantes au cours desquelles j'ai administré des questionnaires et pris des mesures anthropométriques. Finalement, après avoir participé à la saisie des données, j'ai réalisé la majeure partie des analyses statistiques et de l'interprétation des résultats. J'ai aussi réalisé la revue de littérature et la rédaction d'un article scientifique.
Les travaux de recherche effectués dans le cadre ma maitrise ont mené à la rédaction d'un article scientifique ayant pour titre Relationship between Lactation Duration and Postpartum Insulin Profile among Women with Prior Gestational Diabetes dont le manuscrit est présenté de façon intégrale au chapitre 2. Le manuscrit rapporte les résultats d'une étude d'association entre l'allaitement et le profil d'insuline (concentration, sensibilité et sécrétion d'insuline). Cet article, dont je suis la première auteure, a été soumis pour publication à la revue scientifique European Journal of Endocrinology en octobre 2012.
La rédaction du manuscrit inclus dans cette thèse n'aurait pas été possible sans la généreuse participation des coauteurs. Je tiens donc à les remercier de leur aide et des commentaires judicieux et formateurs qu'ils m'ont proposés durant la rédaction du manuscrit. Dr. Julie Robitaille a supervisé ce projet de recherche. Elle a aussi été d'une grande aide, car elle a dirigé l'analyse des données et a assisté à la préparation du manuscrit. Dr. S. John Weisnagel et Dr. André Tchernof ont participé à l'élaboration du projet et ont participé à l'interprétation des résultats. Tous les auteurs ont révisé le manuscrit.
Je tiens à mentionner ma gratitude envers les organismes suivants pour le support financier qu'ils ont offert pour le projet : les Instituts de recherche en santé du Canada
IV
(IRSC) et le Fonds de la recherche en santé du Québec (FRSQ) ainsi que pour mes études : Diabète Québec.
J'ai eu la chance, tout au long de ma maitrise, d'être entourée par des gens exceptionnels professionnellement et personnellement.
J'aimerais premièrement adresser toute ma reconnaissance à ma directrice, Dr Julie Robitaille, professeure au département de science des aliments et de nutrition à l'Université Laval. Je la remercie beaucoup de m'avoir fait découvrir le merveilleux monde de la recherche en m'accueillant dans son équipe de recherche et pour la générosité dont elle a toujours fait preuve. J'aimerais remercier Julie pour la qualité de son encadrement, pour ses commentaires constructifs et ses encouragements. Elle a toujours été d'une grande disponibilité et m'a toujours répondu avec le sourire. Je voudrais la remercier pour le soutien financier et l'environnement de travail privilégié qu'elle m'a offerts durant mes études graduées et pour les opportunités qu'elle m'a données de présenter mes travaux de recherche à de nombreux congrès d'envergure nationale et internationale.
Mes remerciements vont également aux collègues et professionnelles de recherche, présents et passés, de l'Institut des nutraceutiques et des aliments fonctionnels (INAF), que j'ai fréquenté avec un grand bonheur durant mes études supérieures. Il est toujours plaisant et stimulant d'être dans un environnement où on se sent bien, qui nous donne le goût de nous rendre au travail le matin et où l'on sait qu'on peut compter sur les gens qui nous entourent. J'aimerais remercier tous les gens de l'INAF et de l'Université Laval pour avoir fait de ces deux dernières années une expérience exceptionnelle.
Un merci particulier à Véronique pour les nombreuses belles discussions, scientifiques ou non et pour l'entraide que nous avons eux au cours de nos études.
Finalement, j'aimerais adresser des remerciements à ma famille pour avoir toujours été fière de moi et sans qui la réalisation de cette maitrise n'aurait jamais été possible.
Merci à ma mère, de m'avoir transmit sa passion pour l'alimentation. Sans elle, je n'aurais peut-être pas atterri en nutrition. Je la remercie aussi pour sa générosité et pour les petites attentions qu'elle a toujours eues pour chacun de ses trois enfants.
Merci à mon père de m'avoir enseigné la persévérance et la ténacité au travail. J'ai toujours eu un bon exemple d'une personne vaillante et j'ai appris de lui à ne pas remettre au lendemain ce qui peut être fait aujourd'hui.
J'ai eu la chance d'avoir des parents qui m'ont encouragée dans mes études tout en me laissant le choix de ce que je voulais faire.
Merci à ma sœur, Laurie, de toujours avoir été là pour moi et de m'avoir encouragée dans les moments moins faciles.
Merci à mon frère, Anthony, d'avoir su me changer les idées lors de fins de semaine.
Merci à ma filleule, Amelia, de m'avoir inspirée sur le sujet de l'allaitement, même si son arrivée a quelque peu retardé la rédaction de ce mémoire.
Table des matières
Résumé i Abstract i Avant-Propos iii Table des matières ix Liste des tableaux xi Liste des figures xiii Liste des abréviations xv
Introduction 1 Chapitre 1 : Problématique 3 1. Diabète gestationnel 3 1.1 Epidemiologic du DbG 3 1.2 Diagnostic du DbG 3 1.3 Physiopathologie du développement du DbG 5
1.4 Conséquences du DbG pour l'enfant 7 1.5 Conséquences du DbG pour la mère 8
2. Diabète de type 2 9
2.1 Epidemiologic du DbT2 dans la population générale 9 2.2 Conséquences néfastes d'un DbT2 mal contrôlé 10 2.3 Epidemiologic du DbT2 chez les femmes avec antécédent de DbG 10
2.4 DbT2 après un DbG 11 2.5 Formules de la sensibilité à l'insuline 12
2.6 Formules de la sécrétion d'insuline 14
2.7 Prévention du DbT2 15
3. Allaitement 17
3.1 Recommandations 17 3.2 Situation au Canada 18 3.3 Effets de l'allaitement chez l'enfant 20
3.3.1 Mécanismes 22 3.4 Effets de l'allaitement chez la mère 23
3.4.1 Mécanismes 29 3.4.2 Barrières à l'allaitement 30
Objectif et hypothèse 33
Objectif 33 Hypothèse 33
Description de la population à l'étude 35
Chapitre 2 : Manuscrit 37
Relation entre la durée d'allaitement et le profil d'insuline chez des femmes ayant
eu un diabète gestationnel 37
Conclusion 65 Bibliographie 69
Liste des tableaux
Chapitre 1Tableau 1 : Critères diagnostiques du DbT2 12 Tableau 2 : Formules pour calculer des indices de sensibilité à l'insuline 14
Tableau 3 : Formules pour calculer des indices de sécrétion à l'insuline 15 Tableau 4 : Initiation et durée moyenne de l'allaitement selon différentes
catégories d'EVlC 30 Chapitre 2
Table 1: Characteristics of the participants 57 Table 2: Association between lactation and insulin concentrations, sensitivity
and secretion 59 Table 3: Association between lactation duration and insulin concentrations,
sensitivity and secretion 61 Table 4: Multiple linear regression analyses of the relationships between
Liste des figures
Chapitre 1Figure 1 : Critères diagnostiques du DbG selon l'ACD 4 Figure 2 : Relation entre la sensibilité à l'insuline et la sécrétion d'insuline 7
Figure 3 : Risque de développement du DbT2 après un diagnostic de DbG 11 Figure 4 : Incidence du DbT2 dans l'étude DPP chez des femmes avec un
antécédent de DbG 16 Figure 5 : Pourcentage des mères qui ont allaité ou essayé d'allaiter leur dernier
enfant au Canada entre 2001 et 2008 19 Figure 6 : Réinitialisation du métabolisme par l'allaitement après une grossesse 24
Liste des abréviations
ACD Association canadienne du diabète ASC Aire sous la courbe
CARDIA Coronary Artery Risk Development in Young Adults Study DbG Diabète gestationnel
DbT2 Diabète de type 2
DPP Diabetes Prevention Program
ESCC Enquête sur la santé dans les collectivités canadiennes GDM Gestational diabetes mellitus
HAPO Hyperglycemia and Adverse Pregnancy Outcomes HDL Lipoprotéines de haute densité
HGPO Hyperglycémie provoquée par voie orale
HOMA-B Homeostasis model assessment for beta-cell function HOMA-IR Homeostasis model of assessment for insulin resistance HOMA-IS Homeostasis model of assessment for insulin sensitivity hPGH Hormone de croissance placentaire humaine
hPL Lactogène placentaire humaine IC Intervalle de confiance
IMC Indice de masse corporel
INAF Institut des nutraceutiques et des aliments fonctionnels ISI Insulin sensitivity index
ISSI-2 Indice de sensibilité-sécrétion d'insuline LDL Lipoprotéines de faible densité
MCR Metabolic clearance rate OR Odds ratio
OMS Organisation mondiale de la santé
SWIFT Study of Women, Infant Feeding, and Type 2 Diabetes T2D Type 2 diabetes
Introduction
Au Canada, l'incidence de diabète gestationnel (DbG) est en augmentation (1-3). Les femmes ayant reçu un diagnostic de DbG représentent une population à risque de diabète de type 2 (DbT2). En effet, le DbG et le DbT2 ont une étiologie commune (4). Le DbG pourrait donc servir de signal pour la prédisposition au DbT2. Le DbT2 est un problème de santé publique majeur en raison de sa prévalence en augmentation au Canada et de son haut taux de morbidité et de mortalité (5). L'adoption de saines habitudes de vie chez les femmes avec un antécédent de DbG s'avère primordiale particulièrement parce que le DbT2 peut être prévenu ou retardé par l'adoption de saines habitudes de vie (6-8). Des études ont démontré que les habitudes de vie ne seraient pas optimales chez les femmes avec un antécédent de DbG (9, 10). La promotion d'une combinaison d'allaitement, de saine alimentation et d'activité physique pourrait diminuer les risques de DbT2, particulièrement chez des femmes avec un antécédent de DbG (11).
Les travaux de ce mémoire visent à déterminer l'impact du mode de vie, particulièrement de l'allaitement, sur la concentration, la sensibilité et la sécrétion d'insuline. L'allaitement est en augmentation au Canada au cours des dernières années (12). Il aurait un effet positif pour l'enfant ayant été en contact avec un environnement de DbG. Il serait aussi associé à des effets bénéfiques sur la santé de la mère, mais les effets à long terme, qui perdureraient après l'arrêt de l'allaitement, sont peu étudiés. Les travaux de ce mémoire ont pour objectif d'étudier l'effet de l'allaitement sur la santé de la mère plusieurs années après l'accouchement.
J'ai tout d'abord cherché à mettre en contexte la situation des femmes qui ont eu une grossesse compliquée par un DbG. Ce travail présente donc, dans un premier temps, la description du DbG. J'y décrit entre autres son développement, son diagnostic ainsi que les conséquences qu'il entraine. Par la suite, le DbT2, qui est la principale conséquence du DbG, est décrit. Le développement du DbT2 ainsi que les différentes façons de dépister son évolution sont présentés. L'importance de trouver les moyens de lutter efficacement contre le DbT2 est également soulevée. Finalement, j'aborde
de manière approfondie l'allaitement avec sa situation actuelle au Canada et une revue de la littérature de ses effets bénéfiques chez les enfants et chez les mères en insistant sur le DbG. L'objectif et l'hypothèse des travaux de ce mémoire sont ensuite présentés, de même que le manuscrit rapportant les résultats de l'étude réalisée. Finalement, une conclusion vient clore ce mémoire.
Chapitre 1 : Problématique
1. Diabète gestationnel
1.1 Épidémiologie du DbG
Le DbG est défini comme une intolérance au glucose qui se manifeste ou qu'on dépiste pour la première fois pendant la grossesse (13). Au Canada, son incidence est en augmentation depuis les dernières années (1-3). D s'apparente à la progression de la prévalence du DbT2 et de l'obésité (1-3). La prévalence du DbG varie d'une population à l'autre et reflète l'incidence sous-jacente du diabète dans la population (3). La prévalence du DbG varie de 3,8 % dans les populations non autochtones à entre 8 % et 18 % chez les Autochtones (3, 14, 15). Il n'existe pas de données sur sa prévalence au Québec, mais en 2001, elle était de 3,6 % en Ontario (2).
1.2 Diagnostic du DbG
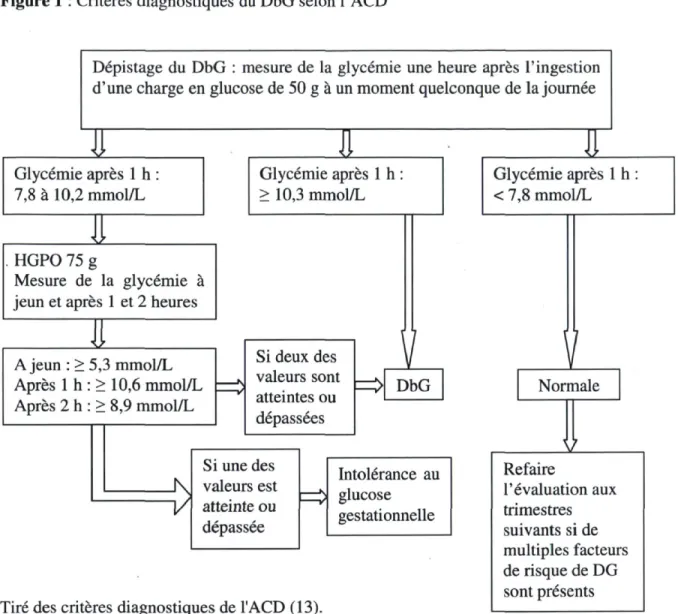
Pour dépister le DbG, la glycémie une heure après l'ingestion d'une charge de glucose de 50 g est mesurée. Selon l'Association canadienne du diabète (ACD), un DbG est diagnostiqué si la glycémie une heure après la charge en glucose est de 10,3 mmol/L ou plus. Si le résultat du test de dépistage est entre 7,8 et 10,2 mmol/L, une épreuve d'hyperglycémie provoquée par voie orale (HGPO) de 75 g de glucose de deux heures est nécessaire. Les valeurs anormales de glycémies sont > 5,3 mmol/L à jeun, > 10,6 mmol/L une heure après l'ingestion du glucose et > 8,9 mmol/L deux heures après l'ingestion du glucose. Si deux des trois valeurs sont atteintes ou dépassées, un DbG est diagnostiqué (Figure 1) (13).
Figure 1 : Critères diagnostiques du DbG selon l'ACD
Dépistage du DbG : mesure de la glycémie une heure après l'ingestion d'une charge en glucose de 50 g à un moment quelconque de la journée
Glycémie après 1 h : 7,8 à 10,2 mmol/L i z Glycémie après 1 h > 10,3 mmol/L ±Z-HGPO 75 g Mesure de la glycémie à jeun et après 1 et 2 heures
A jeun : > 5,3 mmol/L Après 1 h : > 10,6 mmol/L Après 2 h : > 8,9 mmol/L Si deux des valeurs sont atteintes ou dépassées
ï
DbGÊ
Si une des valeurs est atteinte ou dépassée Intolérance au N glucose gestationnelleTiré des critères diagnostiques de l'ACD (13).
iz. Glycémie après 1 h < 7,8 mmol/L
V
NormaleIL
Refaire l'évaluation aux trimestres suivants si de multiples facteurs de risque de DG sont présentsSelon les nouveaux critères diagnostiques du DbG adoptés par l'Association internationale de l'étude du diabète durant la grossesse, près de 18 % des grossesses seraient compliquées par un DbG (16). Toutefois, l'ACD n'a pas adopté ces critères pour l'instant.
Un dépistage du DbG doit être effectué chez toutes les femmes enceintes, entre les 24e et 28e semaines de la grossesse. Si de multiples facteurs de risque de DbG sont présents, le dépistage doit être effectué au premier trimestre et l'évaluation doit être refaite aux trimestres suivants. Les facteurs de risque qui justifient que le dépistage
du DbG soit fait au premier trimestre selon l'ACD sont un diagnostic antérieur de DbG, un accouchement d'un enfant de poids élevé, l'appartenance à un groupe ethnique à haut risque (Autochtones, Hispaniques, Sud-Asiatiques, Africaines), être âgée de 35 ans ou plus, un indice de masse corporel (IMC) de 30 kg/m2 ou plus, le syndrome des ovaires polykystiques, l'acanthosis nigricans et la prise d'un corticostéroïde (13).
Dans la littérature, il existe d'autres caractéristiques des femmes qui seraient plus à risque de développer un DbG qui ne sont pas mentionnées ou qui sont légèrement différentes des lignes directrices de diagnostic de l'ACD. Les femmes âgées de plus de 25 ans, qui ont déjà eu un métabolisme du glucose anormal, qui ont une histoire familiale de DbT2 ou qui sont membres d'un groupe ethnique avec de hauts taux de prévalence de DbT2 seraient plus à risque (17, 18). D'autres caractéristiques ayant trait à la grossesse comme un histoire de DbG (19), particulièrement en association avec un excès de poids entre les grossesses ou un DbG diagnostiqué tôt durant la grossesse et requérant l'utilisation de l'insuline (20) ainsi que l'IMC pré-grossesse et le gain de poids durant le premier trimestre de la grossesse (21) constituent aussi des facteurs de risque du DbG.
1.3 Physiopathologie du développement du DbG
Le maintien de l'homéostasie glucidique implique principalement trois tissus : le pancréas, le foie et les tissus insulinodépendants captant le glucose. Dans des conditions normales, l'élévation de la glycémie suite à un repas stimule la sécrétion de l'insuline par les cellules P du pancréas afin d'augmenter la captation du glucose par le muscle squelettique, le foie et, dans une moindre mesure, le tissu adipeux. Elle freine aussi la production hépatique de glucose et ce, afin de garder une glycémie normale. L'homéostasie du glucose dépend d'une interaction dynamique finement orchestrée entre la sensibilité à l'insuline des tissus et la sécrétion de l'hormone par le pancréas (22).
Durant une grossesse, il y a une adaptation du métabolisme maternel pour assurer une croissance adéquate du fœtus. Entre autres, une résistance à l'insuline s'installe afin d'augmenter la disponibilité du glucose pour le fœtus (4). Cette augmentation de la résistance aurait une étiologie multifactorielle. Premièrement, les hormones placentaires joueraient un rôle important. En effet, la résistance à l'insuline apparait à mesure que le placenta croît. Plusieurs hormones placentaires induiraient la résistance à l'insuline chez des femmes enceintes ou non, comme la lactogène placentaire humaine (hPL) (23, 24), l'hormone de croissance placentaire humaine (hPGH) (25) et la progestérone (26, 27). De plus, durant une grossesse, le gras corporel augmente sur une relative courte période, ce qui peut résulter en une diminution de la sensibilité à l'insuline. Le mécanisme qui explique pourquoi l'obésité est néfaste pour la santé serait entre autres lié à l'état chronique d'inflammation de bas niveau dans le tissu adipeux (28). L'obésité serait directement reliée à la libération d'un nombre plus élevé d'adipokines pro-inflammatoires à partir du gras, qui cause l'inflammation et la résistance à l'insuline non seulement dans le tissu adipeux, mais aussi dans les tissus plus éloignés (28). Certains peptides pro-inflammatoires, notamment la leptine, le tumor necrosis factor-alpha et la résistine sont aussi sécrétés par le placenta et sont donc d'autant plus élevés durant la grossesse (29-32).
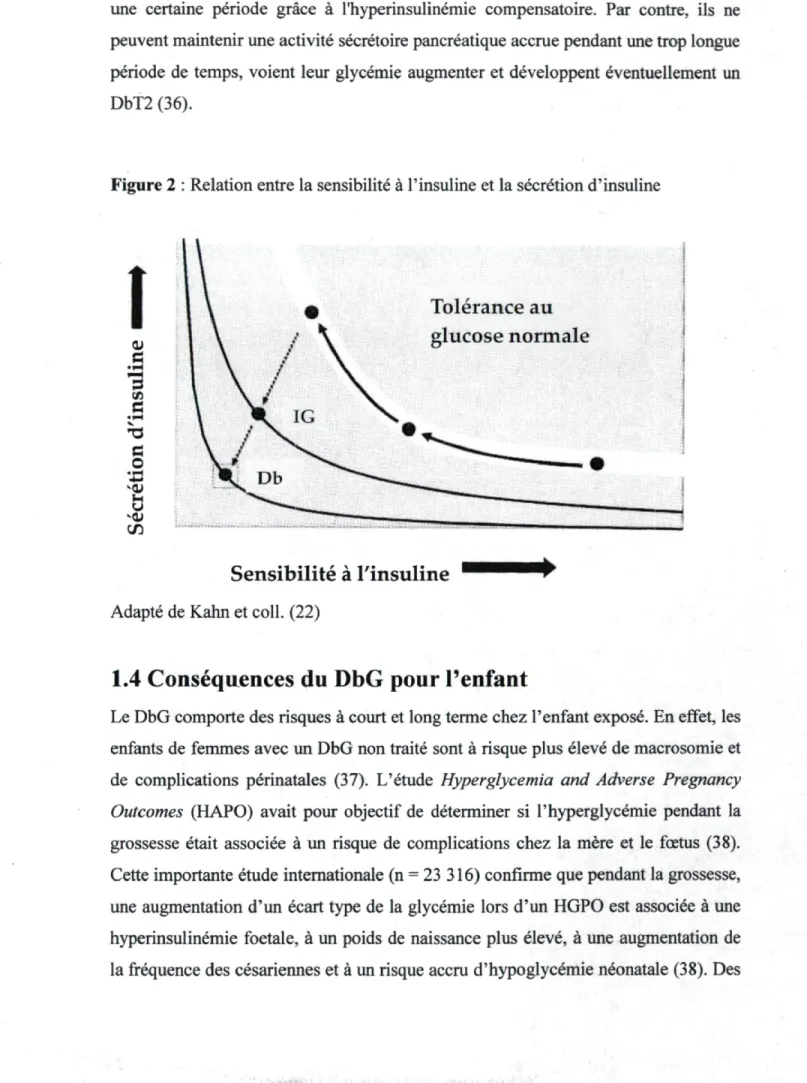
La relation entre la sensibilité à l'insuline et la sécrétion d'insuline est réciproque et non linéaire (Figure 2). Pour maintenir une glycémie normale, les changements dans la sensibilité à l'insuline doivent être suivis par un changement approprié de la sécrétion d'insuline (22). Pour une grossesse normale, la sécrétion d'insuline augmente pour compenser et maintenir les niveaux de glycémie normale (33). Pour une grossesse affectée par un DbG, la sécrétion d'insuline n'augmente pas assez pour le degré de sensibilité à l'insuline et une intolérance au glucose apparait (34, 35).
Un phénomène semblable se produit dans le DbT2 en dehors de la grossesse (22). Lors d'une diminution de la sensibilité à l'insuline, on observe une augmentation compensatoire de la sécrétion pancréatique d'insuline afin d'éviter l'apparition d'une hyperglycémie. Certains individus sont aptes à maintenir leur glycémie normale pour
une certaine période grâce à l'hyperinsulinémie compensatoire. Par contre, ils ne peuvent maintenir une activité sécrétoire pancréatique accrue pendant une trop longue période de temps, voient leur glycémie augmenter et développent éventuellement un DbT2 (36).
Figure 2 : Relation entre la sensibilité à l'insuline et la sécrétion d'insuline
I
O).5
v fi O •J3"S
enSensibilité à l'insuline
Adapté de Kahn et coll. (22)1.4 Conséquences du DbG pour l'enfant
Le DbG comporte des risques à court et long terme chez l'enfant exposé. En effet, les enfants de femmes avec un DbG non traité sont à risque plus élevé de macrosomie et de complications périnatales (37). L'étude Hyperglycemia and Adverse Pregnancy Outcomes (HAPO) avait pour objectif de déterminer si l'hyperglycémie pendant la grossesse était associée à un risque de complications chez la mère et le fœtus (38). Cette importante étude internationale (n = 23 316) confirme que pendant la grossesse, une augmentation d'un écart type de la glycémie lors d'un HGPO est associée à une hyperinsulinémie foetale, à un poids de naissance plus élevé, à une augmentation de la fréquence des césariennes et à un risque accru d'hypoglycémie néonatale (38). Des
-8
données probantes démontrent que l'hyperglycémie de la mère durant la grossesse peut aussi avoir un impact à long terme sur l'enfant. En effet, la présence du DbG met l'enfant exposé à risque de développer de l'obésité et une intolérance au glucose surtout si son poids de naissance est élevé par rapport à l'âge gestationnel et si la mère est obèse (39-42). Dans une cohorte d'enfants canadiens de 7 à 11 ans nés de mères qui avaient présenté un DbG pendant la grossesse, 7 % des enfants présentaient une intolérance au glucose (42) alors que la prévalence moyenne de DbT2 pour le même groupe d'âge était d'environ 0,3 % en 2008-2009 au Canada (5). Chez une population d'Indiens Pimas, les enfants de femmes qui avaient un DbG avaient une prévalence plus élevée de DbT2 (43). Jusqu'à 7 0 % des enfants qui avaient été exposés au diabète in utero présentaient un DbT2 à 25 à 34 ans (43).
Si des moyens peuvent être trouvés afin de contrôler adéquatement la glycémie durant la grossesse, l'enfant sera en contact avec un environnement intra-utérin normal et sera moins à risque de souffrir d'effets indésirables. Un bon contrôle du diabète peut réduire le taux de macrosomie (17, 44, 45), de dystocie de l'épaule et d'accouchement par césarienne (45), mais il reste incertain pour l'instant à savoir si cela est suffisant pour prévenir les complications à long terme.
1.5 Conséquences du DbG pour la mère
Certaines études ont montré que la prévalence du syndrome métabolique était supérieure chez les femmes qui présentent un DbG, surtout chez celles qui étaient obèses et qui n'étaient pas caucasiennes (46-49). Par contre, une autre étude n'a pas trouvé de différence avec les femmes sans DbG (50). L'ACD recommande d'envisager le dépistage de toutes les composantes du syndrome métabolique après l'accouchement chez les femmes qui ont présenté un DbG (13).
Le DbG se résout la plupart du temps avec l'accouchement, mais une résistance à l'insuline et un défaut de sécrétion d'insuline restent fréquents dans la période post-partum (51-53). Ces défauts persistent après l'accouchement et accroissent le risque d'anomalie de la glycémie à jeun, d'intolérance au glucose et de DbT2 (54, 55). Il y a
un déclin de la fonction des cellules p chez ces femmes dans la première année post-partum, ce qui contribue à leur risque de développer le DbT2 (56). De plus, le DbG partage de nombreux facteurs de risque avec le DbT2 incluant un IMC élevé, une histoire d'intolérance au glucose, une histoire familiale de DbT2 et l'appartenance à un groupe ethnique avec un risque élevé de DbT2 (4). Les femmes ayant reçu un diagnostic de DbG représentent donc une population à risque de DbT2. L'epidemiologic ainsi que le développement du DbT2 après un DbG sont discutés dans la prochaine section.
2. Diabète de type 2
2.1 Epidemiologic du DbT2 dans la population générale
Selon les dernières données disponibles au Canada, en 2008-2009, le DbT2 a été diagnostiqué chez 2,4 millions d'adultes, ce qui représentait 6,8 % de la population (5). Terre-Neuve-et-Labrador, la Nouvelle-Ecosse et l'Ontario affichaient les taux de prévalence de DbT2 diagnostiqués (standardisés selon l'âge) les plus élevés au Canada (6,5 %, 6,1 % et 6,0 % respectivement), alors que le Nunavut, l'Alberta et le Québec affichaient les taux les plus bas (4,4 %, 4,9 % et 5,1 % respectivement) (5). De 1998-1999 à 2008-2009, la prévalence du diabète diagnostiqué chez les Canadiens a augmenté de 70 % (5). La plus forte hausse relative à la prévalence a été observée au sein des groupes d'âge des 35 à 39 ans et des 40 à 44 ans, où la proportion a doublé (5). Vraisemblablement, cette hausse chez les groupes d'âge plus jeunes s'explique, du moins en partie, par la hausse des taux d'embonpoint et
d'obésité (5). Si les taux d'incidence et de mortalité se maintiennent aux niveaux observés avec les données de 2008-2009, on estime que le nombre de Canadiens vivant avec le diabète s'élèvera à 3,7 millions d'ici 2018-2019 (5).
10
2.2 Conséquences néfastes d'un DbT2 mal contrôlé
Pratiquement toutes les parties du corps peuvent subir des conséquences d'un diabète mal contrôlé. Les deux types de complications les plus courantes à long terme sont les complications microvasculaires (les retinopathies, les nephropathies et les neuropathies) et les complications macrovasculaires (les maladies cardiovasculaires) (57). Beaucoup d'organes peuvent être touchés, car avec le temps, l'hyperglycémie affaiblit les parois des vaisseaux sanguins qui approvisionnent tous les tissus. En moyenne, les personnes avec un DbT2 mourront de 5 à 10 ans plus tôt que celles qui n'ont pas le DbT2 (58, 59). Ce plus haut taux de mortalité est surtout attribuable aux maladies cardiovasculaires (60, 61) qui sont environ deux à trois fois plus fréquentes chez les diabétiques contrairement à la population générale (62-64). Heureusement, le taux de mortalité a substantiellement diminué chez les personnes diabétiques aux États-Unis entre 1997 et 2006 (65). Les nombreuses conséquences néfastes du DbT2 expliquent pourquoi il est important de cibler les populations à risque et soulèvent l'importance de trouver des moyens efficaces afin de diminuer le développement de celui-ci.
2.3 Epidemiologic du DbT2 chez les femmes avec antécédent
de DbG
Le risque de développer le DbT2 est plus élevé suite à un diagnostic de DbG. L'incidence de DbT2 augmente nettement dans les cinq ans après la grossesse (19). Dans les 5 à 16 ans suivant la grossesse, le risque de développer un DbT2 chez ces femmes est évalué entre 17 % et 63 % dépendamment de la population et des facteurs de risque (66). En utilisant des données populationnelles ontariennes, un groupe de Toronto a observé que la probabilité de développer le DbT2 était de près de 20 %, neuf ans après l'accouchement chez des femmes avec un DbG. La probabilité était de seulement 2 % chez des femmes sans DbG (Figure 3) (2).
11
Figure 3 : Risque de développement du DbT2 après un diagnostic de DbG
0 . 3 0 0 . 2 5
-I °-
2
°
0.15 — W i t h gestational diabetes — W i t h o u t gestational diabetes 9.0 yr (18.9%) T i m e , dTiré de Feig et coll. (2)
2.4 DbT2 après un DbG
Il est essentiel d'effectuer des tests après l'accouchement pour déterminer si le diabète est toujours présent ou s'il y a un risque de DbT2. Selon l'ACD, les femmes devraient passer un test entre six semaines et six mois après une grossesse compliquée par un DbG (13). Toutefois, il n'y a pas de suivi convenable selon les recommandations chez de nombreuses femmes après l'accouchement (67, 68). Le test diagnostique le plus fréquemment utilisé en clinique est l'HGPO. On y mesure la capacité du corps à gérer une quantité de glucose, soit la tolérance au glucose. Les sujets doivent se présenter à jeun, le matin, et boire une solution liquide contenant 75 grammes de glucose. Des prélèvements sanguins sont effectués à différents temps et deux valeurs sont particulièrement importantes en pratique clinique, soit la glycémie à jeun et la glycémie après 120 minutes. Les critères diagnostiques du DbT2 chez les
12
femmes avec un antécédent de DbG sont basés sur ces deux valeurs et sont les mêmes que dans la population générale (Tableau 1) (13).
Tableau 1 : Critères diagnostiques du DbT2
Glycémie à jeun
(mmol/L) Glycémie 2 h post HGPO (mmol/L)
Anomalie de la glycémie à 6,1-6,9 -jeun Anomalie de la glycémie à 6,1-6,9 et <7,8 jeun isolée Intolérance au glucose <6,1 et 7,8-11,0 isolée Anomalie de la glycémie à 6,1-6,9 et 7,8-11,0 jeun et intolérance au glucose Diabète >7,0 ou >H,1
Tiré des critères diagnostiques de l'ACD (13).
Tel qu'énoncé précédemment, l'homéostasie du glucose dépend d'une interaction dynamique finement orchestrée entre la résistance à l'insuline des tissus et la sécrétion de l'hormone par le pancréas. Lorsqu'une baisse progressive de la sensibilité à l'insuline et de la fonction des cellules P se produit, la glycémie normale passe à l'hyperglycémie (69). Il importe donc d'utiliser des mesures appropriées afin d'évaluer la sensibilité à l'insuline et la sécrétion d'insuline.
2.5 Formules de la sensibilité à l'insuline
La méthode de référence pour évaluer la sensibilité à l'insuline est le clamp euglycémique-hyperinsulinémique décrit par DeFronzo en 1979 (70). La glycémie est maintenue constante grâce à une perfusion d'insuline exogène à débit continu associée à une perfusion variable de glucose (70). La production hépatique de glucose est alors inhibée et le débit de glucose nécessaire pour maintenir la glycémie
13 constante correspond à la quantité de glucose utilisée par les tissus périphériques (70). Ainsi, plus la quantité de glucose perfusée est importante, plus la sensibilité à l'insuline est élevée (70). Le clamp euglycémique-hyperinsulinémique est une méthode fiable, sensible et reproductible. Par contre, comme c'est une méthode qui demande beaucoup de temps, de techniques, qui est coûteuse et qui est difficile à mettre en œuvre en dehors d'un milieu spécialisé, elle est plutôt utilisée en recherche qu'en clinique. De plus, la sécrétion d'insuline ne peut être évaluée au cours de la même épreuve. Une alternative bien validée existe, le clamp hyperglycémique, et permet d'évaluer dans un même test, la sécrétion d'insuline et la sensibilité à l'hormone (70). La glycémie du sujet est augmentée à 5,5 mmol/L au-dessus de sa glycémie basale par une perfusion de glucose et est gardée constante. Le taux d'infusion du glucose est un indice du métabolisme du glucose (70).
Comme façon plus simple d'évaluation de la résistance à l'insuline, il est possible d'utiliser des mesures de glucose et d'insuline obtenues à jeun ou durant un HGPO. Puisqu'une diminution de la sensibilité à l'insuline entraîne un hyperinsulinisme compensatoire pour maintenir l'homéostasie glucidique, la mesure de l'insulinémie, comparativement à la glycémie correspondante, apparaît donc comme un index simple de la sensibilité à l'insuline. Elle peut être calculée à l'aide de plusieurs formules (Tableau 2). Des travaux de recherche ont démontré que ces indices corrélaient significativement avec la valeur de sensibilité à l'insuline obtenue lors du clamp euglycémique-hyperinsulinémique (71-74). Les indices de sensibilité à l'insuline basés sur des valeurs à jeun (comme THomeostasis model of assessment for insulin sensitivity (HOMA-IS)) sont beaucoup plus simples et faciles à utiliser, car ils ne nécessitent qu'une prise de sang à jeun. Une étude a conclu que l'indice HOMA-IS pourrait représenter une méthode alternative pour calculer la sensibilité à l'insuline quand seulement les valeurs à jeun sont disponibles (73). De plus, les indices obtenus d'un HGPO, utilisant donc des données exprimant la capacité du corps à métaboliser une charge de glucose, et incorporant des mesures anthropométriques sont plus complexes (Cederholm, metabolic clearance rate (MCR) et insulin sensitivity index (ISI)). Par contre, ils corrèlent mieux avec les résultats d'un clamp
euglycémique-14
hyperinsulinémique (73). Ils seraient donc supérieurs aux autres indices de sensibilité à l'insuline (73).
Tableau 2 : Formules pour calculer des indices de sensibilité à l'insuline
Indices Formules Références HOMA-IS 1 / ([insuline à jeun * glucose à jeun] / 22,5) (75)
Cederholm (75 000 + [glucose à jeun - glucose 120 min] * 1,15 (76) * 180 * 0,19 * poids) / (120 * log [moyenne insuline] *
moyenne glucose)
Matsuda 10 000 / V (glucose à jeun * insuline à jeun * (74) [moyenne glucose * moyenne insuline])
MCR (18,8- [0,271 * IMC] - [0,0052 * insuline 120 min] - (71) HGPO [0,27 * glucose 90 min])
ISI HGPO (0,226 - [0,0032 * IMC] - [0,0000645 * insuline 120 (71) min] - [0,00375 * glucose 90 min])
Adapté de Piché et coll. (73)
2.6 Formules de la sécrétion d'insuline
Tel que mentionné précédemment, durant le clamp hyperglycémique, la glycémie du sujet est maintenue stable par une perfusion de glucose permettant d'évaluer la sécrétion d'insuline (70). Bien que le clamp reste la méthode de référence, plusieurs études ont montré que les valeurs obtenues de l'HGPO pouvaient être utilisées pour estimer la fonction des cellules P du pancréas (Tableau 3) (77). Un indice qui apparait comme approprié et simple d'utilisation est le rapport entre l'augmentation de l'insulinémie et celle de la glycémie pendant les 30 premières minutes de l'HGPO, appelé indice insulinogénique (78). Des variantes du mode de calcul de l'indice insulinogénique ont été proposées à partir des concentrations d'insuline à 0 et 30 minutes et de la glycémie à 30 minutes (71) ainsi qu'à partir des concentrations de glucose et du peptide C à 0 et 30 minutes (79). Finalement, le Homeostasis model assessment for beta-cell function (HOMA-B) est également un indice de sécrétion d'insuline dérivé de mesures de glucose et d'insuline à jeun (75).
15 Le produit de la sensibilité à l'insuline et de la sécrétion d'insuline obtenu grâce à un test de tolérance au glucose par voie intraveineuse (clamp) appelé l'indice de disposition, peut aussi être utilisé pour évaluer la réponse sécrétoire du pancréas en fonction de la sensibilité à l'insuline (80). Puisqu'un changement de sensibilité à l'insuline est accompagné, en temps normal, d'un changement réciproque de la sécrétion de l'hormone, l'indice de disposition reste constant. Toute diminution de l'indice reflète alors l'incapacité du pancréas à compenser pour la résistance à l'insuline (80). L'indice de sensibilité-sécrétion d'insuline (ISSI-2), une autre formule semblable et corrélée à l'indice de disposition, mais qui peut être calculée à l'aide d'un HGPO, a été utilisé chez des populations de femmes avec un antécédent de DbG (56, 81, 82). Cet indice a démontré une relation hyperbolique à travers une gamme de tolérance au glucose et pourrait donc être un indice potentiel pour mesurer la fonction des cellules P (82). Selon Buchanan (34), une comparaison valide de la fonction des cellules P peut être obtenue seulement quand les individus sont regroupés pour leur degré d'insuline, ce que ces deux dernières formules permettent.
Tableau 3 : Formules pour calculer des indices de sécrétion à l'insuline
Indices Formules Références
lere phase
Stumvoll 700 + (1,283 + [1,829 * insuline 30 min]) - ([138,7 (71) * glycémie 30 min] + [3,372 * insuline à jeun]) Insulinogénique insuline 30 min - insuline à jeun / glucose 30 min - (78)
glucose à jeun
Peptide C / peptide C 30 min - peptide C à jeun / glucose 30 (79) glucose min - glucose à jeun
HOMA-B 20 * (insuline à jeun/ 6) /(glucose à jeun -3,5) (75) ISSI-2 aire sous la courbe insuline (ASC) / ASC glucose * (82)
indice Matsuda
2.7 Prévention du DbT2
Étant donné l'étiologie commune entre le DbT2 et le DbG ainsi que le risque élevé de DbT2 associé au DbG, les femmes ayant un antécédent de DbG représentent une
16
population à risque élevé qui bénéficierait grandement de stratégies de prévention. Pour un succès dans la réduction de l'incidence du DbT2 dans cette population, il est essentiel de connaître les caractéristiques du mode de vie qui ont un impact sur le développement du DbT2 chez ces femmes à risque.
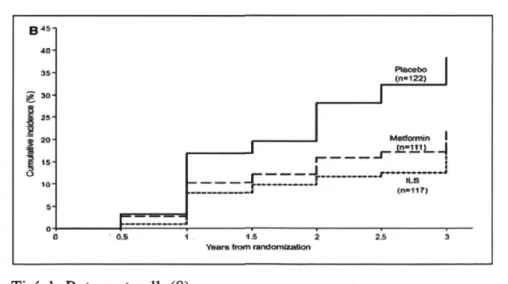
Le DbT2 peut être prévenu ou retardé même chez les femmes avec un antécédent de DbG par la modification des habitudes de vie. En effet, l'étude Diabetes Prevention Program (DPP) a démontré qu'une intervention intensive dont l'objectif était la pratique d'activité physique de 150 minutes par semaine et une perte de poids modérée de 7 % par l'activité physique ainsi que l'alimentation permettait de réduire l'incidence du DbT2 de 53 % (Figure 4) (8). Ces résultats suggèrent que les femmes avec un antécédent de DbG devraient bénéficier d'un suivi approprié pour tenter de diminuer le développement du DbT2.
Figure 4 : Incidence du DbT2 dans l'étude DPP chez des femmes avec un antécédent de DbG .40-35 g 3 °-§ 25 | 20 I 1S 10-5 Placebo (n-122) f~ tic sriVi j ILS (n-)17) 1.5 2 Years from randomization
Tiré de Ratner et coll. (8)
L'ACD recommande la modification des habitudes de vie par l'adoption d'une saine alimentation et la pratique d'activité physique (13). Elle encourage aussi les femmes à allaiter afin de prévenir le DbT2 (13).
17
3. Allaitement
3.1 Recommandations
Les lignes directrices de l'ACD recommandent l'allaitement, tant pour la santé des enfants que la santé des femmes (13). En 2001, l'Organisation mondiale de la santé (OMS) a modifié sa recommandation pour faire passer la durée de l'allaitement maternel exclusif à six mois plutôt que quatre à six mois (83, 84). Selon la définition de l'OMS, on entend par allaitement maternel exclusif la pratique consistant à nourrir un bébé exclusivement de lait maternel (incluant du lait maternel qui a été extrait). On peut également donner au bébé des vitamines, des minéraux ou des médicaments. L'eau, les substituts du lait maternel, les autres liquides et les aliments solides sont toutefois exclus (85).
Santé Canada a examiné soigneusement la littérature avant de faire sa recommandation. Les résultats démontrent que l'allaitement maternel exclusif jusqu'à l'âge de six mois conférerait une protection additionnelle aux nourrissons contre les infections gastro-intestinales (86). En effet, le lait maternel contient certains anticorps et autres facteurs d'immunité qui contribuent à protéger l'organisme contre les infections et les maladies (87). Une importante étude prospective menée au Belarus, où les conditions sanitaires sont semblables au Canada, démontre que les nourrissons allaités exclusivement au sein pendant au moins six mois présentent une diminution statistiquement significative du risque d'infections gastro-intestinales comparativement aux nourrissons allaités exclusivement pendant trois mois, puis partiellement allaités jusqu'à l'âge de six mois (88). Selon les données scientifiques disponibles, les nourrissons nés à terme et en santé qui sont allaités exclusivement durant six mois ont un taux de croissance et un statut en fer similaires à ceux des nourrissons allaités exclusivement pendant trois à quatre mois (89-91). Il n'a toutefois pas été démontré que le fait de prolonger l'allaitement maternel exclusif de deux mois, donc de passer de quatre mois à six mois, réduisait le risque de développer des allergies (91). L'allaitement présente aussi de nombreux avantages pour la mère. Certaines études dans des pays en voie de développement démontrent un rythme de
18
perte de poids légèrement plus élevé chez les femmes qui allaitent leur bébé exclusivement pendant une plus longue période (86). En effet, les résultats combinés de deux études indiquent que les femmes ayant allaité exclusivement pendant six mois avaient perdu, en moyenne, une livre de plus que les femmes ayant allaité exclusivement durant quatre mois (91). Par contre, aucune étude dans des pays développés n'a été menée spécifiquement pour observer la différence entre l'allaitement de quatre ou six mois sur la perte de poids. Un autre élément important est que ce mode d'alimentation favorise le développement d'une relation spéciale entre la mère et son bébé. De plus, le lait maternel est le meilleur aliment pour favoriser la croissance et le développement des bébés. À mesure que les bébés grandissent, le lait se transforme pour répondre à leurs nouveaux besoins. Le lait maternel est celui que les bébés digèrent le plus facilement : il contient la quantité adéquate de protéines, de glucides, de graisses, de vitamines et de minéraux (87).
À la lumière des preuves scientifiques présentées par l'OMS ainsi que d'autres données récentes pertinentes au contexte canadien, Santé Canada a décidé d'aller dans le sens de la recommandation de l'OMS. En 2004, Santé Canada a formulé la recommandation suivante :
L'allaitement maternel exclusif est recommandé pendant les six premiers mois de la vie chez les nourrissons nés à terme et en santé étant donné que le lait maternel est le meilleur aliment permettant d'assurer une croissance optimale. À partir de l'âge de six mois, on recommande de donner au nourrisson des aliments solides ayant une teneur élevée en nutriments, plus particulièrement en fer, tout en poursuivant l'allaitement maternel jusqu'à l'âge de deux ans et même au-delà (86).
3.2 Situation au Canada
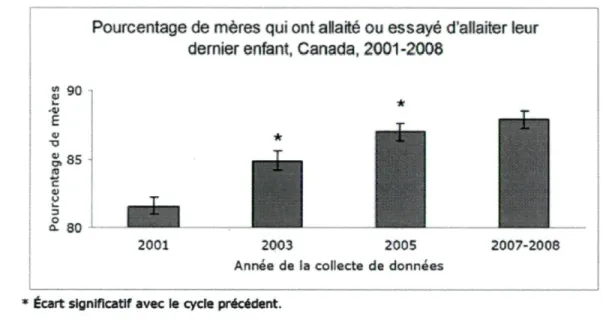
Au Canada, la proportion de femmes qui allaitent a augmenté au cours des dernières années. D'après l'Enquête sur la santé dans les collectivités canadiennes (ESCC), le pourcentage de mères qui ont allaité ou essayé d'allaiter leur dernier enfant a augmenté considérablement entre 2001 et 2005 (12). Comparativement à 2001 (81,6 %), un nombre plus élevé de mères a rapporté avoir allaité ou essayé d'allaiter leur dernier enfant en 2003 (84,9 %), ce qui est également vrai pour 2005 (87,0 %) en
19
comparaison avec 2003 (12). Par contre, aucune différence significative dans le pourcentage de mères qui ont déclaré avoir choisi l'allaitement n'a toutefois été constatée entre 2007-2008 (87,9 %) et 2005 (Figure 5) (12).
Figure 5 : Pourcentage des mères qui ont allaité ou essayé d'allaiter leur dernier enfant au Canada entre 2001 et 2008
Pourcentage de mères qui ont allaité ou essayé d'allaiter leur dernier enfant, Canada, 2001-2008
S so £ S, 85 a S. 80 * 2001 2003 2005
Année de Ea collecte de données
2007-2008
* Écart significatif avec le cycle précédent. Source: Santé Canada
Source de données: Statistique Canada, Enquête sur la santé dans les collectivités canadiennes (ESCC), 2001, 2003, 2005, 2007-2008
Tiré de Santé Canada (12)
L'allaitement varie en fonction des caractéristiques sociodémographiques. En effet, il augmente avec l'âge, le revenu du ménage et le niveau de scolarité de la mère (12). De plus, les femmes d'origine ethnique ou de race asiatique (96,2 %), noire (95,7 %) ou autre (93,5 %) sont plus nombreuses à allaiter que les femmes de race blanche (86,3 %) (12). Les femmes vivant en zone urbaine (88,7 %) sont plus nombreuses à allaiter que les femmes en région rurale (81,5 %) et les femmes vivant dans les provinces de l'Atlantique (73,8 %) ou au Québec (83,8 %) sont moins nombreuses à allaiter que la moyenne nationale (87,9%) (12). Les trois principales raisons invoquées par les mères concernant leur décision de ne pas allaiter sont que
20
l'alimentation au biberon est plus facile, que la mère présente un problème de santé et que l'idée d'allaiter n'est pas attirante (12).
Selon l'ESCC, 23,1 % des mères ont poursuivi l'allaitement exclusif de leur dernier enfant pendant la période recommandée de six mois ou plus au Canada (12). L'allaitement exclusif varie aussi en fonction des caractéristiques sociodémographiques. Cette fois-ci, le revenu du ménage n'est pas différent selon les catégories d'allaitement exclusif (12). Par contre, il augmente avec l'âge et le niveau de scolarité de la mère (12). De plus, les femmes ayant des antécédents culturels ou raciaux asiatiques (34,3 %) ou autres (32,7 %) sont plus nombreuses à allaiter exclusivement durant six mois que les femmes de race blanche (20,8 %) (12). Les femmes vivant en zone urbaine (24,3 %) sont plus nombreuses à allaiter exclusivement pour six mois que les femmes en région rurale (17,7 %) (12). Les femmes vivant dans les provinces de l'Atlantique (14,4 %) ou au Québec (15,6 %) sont moins nombreuses à allaiter exclusivement que la moyenne nationale (23,1 %) (12). Les principales raisons pour expliquer la décision des femmes d'arrêter d'allaiter exclusivement leur enfant sont que la quantité de lait est insuffisante, que le bébé est prêt pour l'alimentation solide et que l'enfant s'est sevré de lui-même (12).
3.3 Effets de l'allaitement chez l'enfant
La période postnatale serait une des périodes qui pourrait programmer métaboliquement le risque de maladies chroniques de l'individu (92-94). De plus, cette période serait un prédicteur important du surplus de poids durant l'enfance (95-97) et l'adolescence (98). Étant donné que les enfants de mère avec un DbG ont des taux plus élevés d'obésité durant l'enfance et de DbT2 durant l'enfance et l'adolescence (99), il est d'autant plus important d'étudier cette population.
L'allaitement diminuerait la variabilité de l'IMC dans une population. En effet, il protégerait contre l'embonpoint et l'obésité, mais aussi contre le poids insuffisant, car il conférerait une protection contre la suralimentation et la sous-alimentation (100). C'est possiblement pourquoi les études de comparaison de moyenne ne permettent
21 pas toujours de voir un effet de l'allaitement sur le poids (100). L'allaitement pourrait diminuer le risque de développer de l'obésité, de l'hypertension, des maladies cardiovasculaires et le DbT2 plus tard dans la vie (101-104). Dans les pays développés, il existe des associations entre l'allaitement et un risque diminué de faire de l'embonpoint durant l'enfance et l'adolescence, même quand les études prennent en considération l'obésité maternelle et les habitudes de vie (105-108). D'après une revue de la littérature de Gunderson et coll. (109), l'allaitement résulterait en une diminution du risque d'embonpoint de 20 à 50 % plus tard dans la vie dépendamment de la durée et de l'exclusivité de l'allaitement. En effet, il existerait une relation dose-réponse avec l'augmentation de la durée d'allaitement et le risque serait moindre avec l'allaitement exclusif (109). L'ajustement pour l'obésité de la mère, le poids à la naissance et d'autres facteurs confondants atténue généralement l'association, mais ne la supprime pas (109). Une méta-analyse de Harder et coll. (108) a permis d'observer une forte relation dose-réponse entre la durée d'allaitement et le risque d'embonpoint. En effet, une diminution de 4 % du risque d'embonpoint a été observée par mois d'allaitement (108). Une durée plus longue d'allaitement diminuerait la prévalence d'embonpoint peu importe la catégorie de poids pré-grossesse de la mère, mais le risque d'embonpoint reste tout de même plus élevé chez les enfants de mère obèse (110). Il existe donc une association entre l'allaitement exclusif prolongé et la diminution du risque d'embonpoint chez les enfants et les adolescents de la population générale.
Pour les enfants de mères ayant eu un DbG, il existe moins d'études qui ont vérifié le lien entre l'allaitement et le risque d'embonpoint et celles-ci combinent souvent des enfants ayant été exposés ou non à un DbG. Dans la Nurses ' Health Study, le risque d'embonpoint chez les enfants de 9 à 14 ans de mères avec le DbG ou un prédiabète durant la grossesse était inversement associé avec le fait d'avoir été allaité durant les six premiers mois de leur vie (111). Dans la même étude, une association semblable a été observée chez les enfants de mères sans DbG de poids normal ou qui faisaient de l'embonpoint (111). Dans une étude récente, les enfants de femmes qui ont eu un DbG et qui ont été allaités six mois ou plus avaient un IMC moyen plus faible durant
22
l'enfance comparativement aux enfants ayant été allaité moins de six mois (112). Parmi les enfants ayant été allaités moins de six mois, le fait d'avoir été exposé à un environnement intra-utérin de diabète était associé à un IMC, un tour de taille et un pourcentage de tissus adipeux plus élevés (113). Pour ceux qui avaient été allaités six mois et plus, l'effet de l'exposition au DbG sur l'adiposité n'était pas significatif (113).
Pour ce qui est du risque de DbT2, dans une population d'Indiens Pimas âgés entre 10 et 39 ans, l'allaitement exclusif comparativement aux préparations lactées à deux mois a été associé à une prévalence plus faible de DbT2 chez les enfants de femmes n'ayant pas eu de DbG (6,9 % vs 11,9 %) (104, 114). Dans la même cohorte, chez les enfants de femmes ayant eu un DbG, la prévalence du DbT2 était plus faible chez les enfants allaités exclusivement à deux mois comparativement aux enfants n'ayant pas été allaités (30,1 % vs 43,5 %) mais la différence n'était pas significative (114).
L'allaitement pourrait donc protéger contre le surpoids durant l'enfance et réduire le niveau d'adiposité plus élevé observé chez les enfants exposés au diabète in-utéro. Par contre, à ce jour, les évidences que l'allaitement protège les enfants de mères ayant eu un DbG du développement du DbT2 ne sont pas concluantes surtout à cause du petit nombre d'études disponibles.
3.3.1 Mécanismes
Les mécanismes responsables des effets favorables de l'allaitement sur les enfants semblent multiples. Certains constituants du lait maternel pourraient expliquer ces associations. Des substances bioactives influenceraient la balance énergétique et la déposition de gras chez l'enfant. En effet, des expériences in vitro ont montré que des facteurs bioactifs du lait maternel pourraient moduler les facteurs de croissance qui inhibent la différenciation des adipocytes (115, 116). La composition du lait maternel et plus particulièrement ces substances bioactives qui ne sont pas présentes dans les préparations lactées, pourrait avoir une influence protectrice sur la programmation métabolique et la régulation du gras corporel et de la croissance (112). L'homéostasie
23 de l'énergie durant l'enfance pourrait aussi être régulée par le niveau d'hormones (leptine et ghréline) présentes dans le lait humain (109). Aussi, des concentrations plus élevées d'insuline observées chez des enfants nourris aux préparations lactées comparativement aux enfants allaités pourraient stimuler la déposition de gras et mener au développement des adipocytes (117). Il y a aussi moins de protéines dans le lait maternel que dans les préparations lactées (109); un apport élevé en protéines durant l'enfance a été relié à un IMC plus élevé plus tard dans la vie (118-120).
3.4 Effets de l'allaitement chez la mère
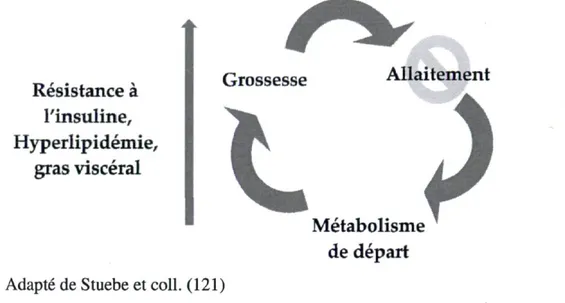
En plus d'avoir des bénéfices pour l'enfant, l'allaitement aurait également un impact positif sur la santé de la mère. Une hypothèse de réinitialisation du métabolisme par l'allaitement après une grossesse a été suggérée par Stuebe et coll. (121). Durant une grossesse, des changements métaboliques qui supportent le développement du fœtus et permettent l'accumulation de réserves d'énergie en anticipation de l'allaitement surviennent. Ces effets, qui sont délétères en dehors de la grossesse, mais qui sont normaux chez les femmes enceintes, comme la résistance à l'insuline, l'hyperlipidémie et l'accumulation de gras viscéral, reviendraient à l'état pré-grossesse grâce à l'allaitement (121). Sans l'allaitement, les changements métaboliques de la grossesse persisteraient pour une plus longue durée (Figure 6) (121).
24
Figure 6 : Réinitialisation du métabolisme par l'allaitement après une grossesse
Résistance à l'insuline, Hyperlipidémie, gras viscéral Grossesse Allaitement Métabolisme
de départ
Adapté de Stuebe et coll. (121)
L'allaitement après une grossesse pourrait conférer des effets bénéfiques à court et long terme sur le risque de maladie chronique chez la mère (122). Parmi un échantillon de 89 326 femmes de la Nurses' Health Study, les femmes qui ont allaité pour une durée totale de deux ans ou plus avaient 37 % moins de risque d'incidence de maladies coronariennes comparativement aux femmes qui n'ont pas allaités (123). De plus, une plus longue durée d'allaitement a été associée à une incidence moindre du syndrome métabolique plusieurs années après l'accouchement chez 704 femmes de la Coronary Artery Risk Development in Young Adults Study (CARDIA) (124). La réduction de l'incidence était encore plus grande chez les 84 femmes ayant eu un DbG (44 % à 86 % vs 39 % à 56 % pour les femmes sans DbG) (124). Dans une autre étude, les femmes qui avaient allaité avaient un risque moindre d'être caractérisées par le syndrome métabolique comparativement aux femmes n'ayant pas allaité après ajustement pour plusieurs variables confondantes (âge, tabac, parité, ethnie, statut socioéconomique, site de l'étude, activité physique, apport calorique et IMC au secondaire) (odds ratio (OR) : 0,79; 95 % intervalle de confiance (IC) : 0,63-0,99) (125). Le risque diminuait à mesure que la durée d'allaitement augmentait (OR : 0.88, 95 % IC : 0.77-0.99 par année d'allaitement) (125). Les femmes ayant rapporté avoir allaité pour plus de 12 mois dans leur vie étaient moins à risque de souffrir d'hypertension, d'hyperlipidémie, de maladie cardiovasculaire ou de DbT2 que les
25 femmes qui n'avaient jamais allaité, mais elles n'étaient pas moins à risque d'être obèses (126). De plus, dans une autre étude chez 177 749 femmes post-ménopausées coréennes, l'allaitement a diminué le risque d'hypertension (rapport du risque : 0.92, 95% IC : 0.90-0.96) (127). Durant un suivi de trois ans, les concentrations de cholestérol des lipoprotéines de faible densité (LDL) et l'insuline à jeun avaient augmenté davantage chez les femmes qui avaient eu un enfant et qui n'avaient pas allaité comparativement aux femmes qui avaient allaité ou qui n'avaient pas eu d'enfant (122). Le cholestérol des lipoprotéines de haute densité (HDL) avait diminué chez les femmes qui ont eu un enfant par comparaison aux femmes nul li pare s (122). Par contre, chez les femmes ayant allaité, une durée d'allaitement de trois mois ou plus était associée avec une moins grande diminution des concentrations de cholestérol HDL (122). Dans une autre étude chez des femmes ayant eu un DbG, une durée d'allaitement de 4 à 12 semaines n'avait pas d'effet sur les concentrations de cholestérol total, de cholestérol LDL ou de triglycérides (128). Par contre, les concentrations de cholestérol HDL étaient plus élevées dans le groupe qui allaitait (128).
Certaines études qui ont vérifié la relation entre l'allaitement et la rétention de poids à court terme après la grossesse, indiquent une perte de poids qui pourrait être significative à six mois post-partum (129, 130). En effet, dans l'étude North Carolina Special Supplemental Nutrition Program for Women, Infants, and Children, il n'y avait pas d'association entre l'allaitement et la rétention de poids chez 14 330 femmes à trois mois (129). Par contre, à six mois, les femmes qui allaitaient, que ce soit exclusivement ou non-exclusivement, avaient une rétention de poids qui était moindre comparativement aux femmes qui n'allaitaient pas (1,38 kg et 0,84 kg de moins, respectivement) (n=4922) (129). L'allaitement exclusif avait le plus grand effet protecteur (129). Une revue de la littérature a été effectué par Dewey et coll. (130) avec des études où le changement de poids post-partum était mesuré. Une plus grande perte de poids et de masse grasse, particulièrement de trois à six mois post-partum chez les femmes qui allaitent plus longtemps ont aussi été observées (130). Par opposition, d'autres chercheurs n'ont rapporté aucun effet de l'allaitement sur la
26
perte de poids à court terme (six mois après la grossesse) (131). Par contre, un moins grand gain de poids a été observé en moyenne huit ans et demi après la grossesse pour les femmes ayant allaité trois mois et plus comparativement aux femmes ayant allaité moins de trois mois (131). D'autres études appuient l'effet de l'allaitement sur l'obésité à plus long terme. En effet, chez 499 femmes suédoises de poids normal avant leur grossesse, les femmes qui étaient restées dans la catégorie de poids normal au fil du temps avaient allaité davantage que les femmes qui étaient caractérisées par de l'embonpoint ou de l'obésité 15 ans après l'accouchement (132). Dans une autre étude, l'allaitement exclusif de minimum quatre mois était associé avec un plus petit tour de taille et un plus faible pourcentage de gras cinq ans après l'accouchement (133). De plus, Wiklund et coll. (134) ont rapporté que les femmes qui ont allaité moins de six mois avaient un plus grand pourcentage de masse grasse que les mères qui avaient allaité plus de six mois, 16 à 20 ans après la dernière grossesse. Le fait de ne pas allaiter ou d'allaiter pour une courte période pourrait donc induire une rétention de poids et de masse grasse qui résulte en un risque cardio-métabolique augmenté plus tard dans la vie (134). En contrepartie, pas d'effet à long terme n'a été observé chez les femmes qui ont allaité 12 mois et plus comparativement aux femmes ayant allaité moins de 12 mois dans une autre étude, car celles-ci n'étaient pas moins à risque d'être obèses (126). L'allaitement diminuerait donc la rétention de poids post-partum, mais davantage d'étude sont nécessaire pour examiner l'effet de l'allaitement chez des femmes avec une histoire de DbG.
Pour ce qui est du DbT2, plusieurs études ont observé une diminution de l'incidence du DbT2 avec l'allaitement (126, 135-137). Les femmes ayant reporté avoir allaité plus de 12 mois dans leur vie avait 20 % moins de risque de développer le DbT2 à long terme (126). Dans une étude australienne chez 53 726 femmes âgées de 45 ans ou plus, les femmes qui avaient eu des enfants, mais qui n'avaient pas allaité, avaient environ 50 % plus de risque de développer le DbT2 comparativement aux femmes qui n'avaient pas eu d'enfant (136). Parmi les femmes qui avaient eu des enfants, l'allaitement était bénéfique, car une réduction du risque de DbT2 de 14 % par année d'allaitement a été observé (136). L'allaitement est encouragé particulièrement chez
27 des femmes ayant eu un DbG. Il a été démontré qu'il aurait un effet favorable sur la sensibilité à l'insuline à court (137) et long terme (138) chez ces femmes. En effet, dans l'étude Study of Women, Infant Feeding, and Type 2 Diabetes (SWIFT), 522 participantes ont été testées de six à neuf semaines après une grossesse compliquée par un DbG. Les femmes qui allaitaient exclusivement ou la plupart du temps, avaient un indice Homeostasis model of assessment for insulin resistance (HOMA-IR) plus faible et des valeurs plus faibles pour l'insulinémie à jeun et deux heures post HGPO (137). Ces femmes avaient aussi une plus faible prévalence de DbT2 ou de pré-diabète (137). Chez plus de 150 000 femmes de la Nurses' Health Study et la Nurses' Health Study II, la durée d'allaitement était associée à une réduction du risque de DbT2 (135). Chaque année d'allaitement était associée à une diminution de 15 % du risque de DbT2 indépendamment de l'IMC et d'autres facteurs confondants (135). Par contre, chez les femmes avec un antécédent de DbG, il n'y avait pas d'association entre l'allaitement et le DbT2 (135). Toujours chez des femmes ayant eu un DbG, une durée d'allaitement de 4 à 12 semaines était associée à un meilleur métabolisme du glucose indiqué par des valeurs plus faibles pour l'ASC pour la glycémie, la glycémie à jeun et la glycémie deux heures post HGPO après ajustements pour l'âge, l'IMC et l'utilisation d'insuline durant une grossesse (128). De plus, la prévalence de DbT2 à 4 à 12 semaines post-partum chez les femmes ayant allaité était réduite de moitié comparativement aux femmes n'ayant pas allaité (4,2 % vs 9,4 %) (128). Les résultats sont inconsistants, car dans deux études chez des femmes Latino, aucune association n'a été observé entre l'allaitement à 4 à 16 semaines (55) ou à 11 à 26 mois (139) et le développement du DbT2 après un DbG. Aussi, dans une plus récente étude chez des femmes coréennes avec un antécédent de DbG, l'allaitement à 6 à 12 semaines n'influençait pas la prévalence de DbT2 (140).
D'autres études ont montré des relations entre l'allaitement et les composantes du DbT2 sans nécessairement évaluer l'effet sur la prévalence du DbT2. Une association a été observée entre l'allaitement et l'insulinémie à jeun à long terme dans une étude prospective par Gunderson et coll. (122). En effet, l'insulinémie à jeun trois ans après la grossesse augmentait davantage pour les femmes qui ont allaité moins de trois
28
mois que pour les femmes qui ont allaité trois mois et plus (122). Dans le projet Viva, trois ans après l'accouchement, aucune association entre l'allaitement et l'insulinémie à jeun et la résistance à l'insuline n'a été observée (n=175) (138). Une association a toutefois été démontrée chez les femmes à risque de diabète (embonpoint ou obésité, intolérance au glucose durant la grossesse ou histoire familiale de DbT2) (138). En effet, la durée de l'allaitement était négativement associée avec l'insulinémie à jeun et la résistance à l'insuline chez ces femmes (n=97) (138). Les effets bénéfiques de l'allaitement pourraient donc être plus importants chez les femmes qui sont plus à risque de DbT2. Diniz et coll. (141) ont montré que l'allaitement était inversement relié à la réponse à l'insuline (l'ASC) et au pic d'insuline (plus haute concentration durant l'HGPO) indépendamment de l'adiposité de 12 à 18 mois après la grossesse (n=67). Il est incertain s'il s'agit d'un effet prolongé de l'allaitement, car 60 % des femmes allaitaient encore au moment de l'étude. Par contre, les auteurs de l'étude n'ont pas observé d'association entre la sensibilité à l'insuline et l'allaitement chez ces femmes (141). Dans une autre étude de 26 femmes avec un antécédent de DbG, l'allaitement n'a pas été associé à une meilleure sensibilité à l'insuline, mais plutôt à une sécrétion accrue d'insuline par les cellules P chez les femmes qui allaitent trois mois après la grossesse (142). Seulement cette étude semble avoir examiné la relation entre l'allaitement et la fonction des cellules p.
L'allaitement aurait un effet immédiat sur la tolérance au glucose chez des femmes avec un antécédent de DbG, mais les évidences des effets qui perdurent à long terme sont limitées et non-concluantes (55, 128, 139, 143, 144). Certaines études suggèrent toutefois un effet à long terme sur le métabolisme de la mère (122). Il demeure incertain pour le moment si l'allaitement prévient ou retarde le développement du DbT2 chez des femmes avec antécédent de DbG, mais les études semblent aller dans le sens d'un effet positif. Les différentes études actuellement disponibles sont souvent difficiles à comparer. En effet, elles n'utilisent pas toujours les mêmes mesures d'allaitement (allaitement : oui ou non, durée, exclusivité, moment de l'allaitement en cours, durée d'allaitement rétrospectif) et différents temps de suivi pour la caractérisation du profil métabolique. De plus, certaines études manquent de données
29 sur le profil de la femme (habitudes alimentaires, activité physique, etc.). Un mode de vie plus sain chez les femmes qui allaitent est possible et pourrait expliquer une partie de l'effet à long terme entre l'allaitement et un meilleur profil métabolique. Les études qui ne prennent pas en compte les habitudes de vie peuvent donc plus difficilement isoler l'effet de l'allaitement.
3.4.1 Mécanismes
Des mécanismes expliquant les effets bénéfiques de l'allaitement sur la santé de la mère ont été proposés. L'effet de l'allaitement sur la fonction des cellules P pourrait être causé par un effet direct de la prolactine. Des expériences in vitro sur des cultures d'îlots pancréatiques avec de la prolactine ont montré une augmentation de la sécrétion d'insuline (145). Une autre étude a examiné les effets de la prolactine sur la prolifération des cellules p durant la grossesse chez la souris (146). La prolactine stimulerait la prolifération des cellules P en diminuant l'expression de la ménine (146). La ménine, qui est une protéine produite par le gène MENI, supprime la prolifération des cellules de l'îlot et mène à une tolérance au glucose altérée durant la grossesse (146). Les niveaux de prolactine restent élevés durant l'allaitement, suggérant que l'hormone joue un rôle dans la régulation de la sécrétion de l'insuline et l'homéostasie du glucose après la grossesse (146). Le glucose (environ 50g/j) pourrait être préférablement utilisé pour la lactogénèse (la production et la sécrétion de lait) par la captation par les glandes mammaires via une voie non dépendante de l'insuline ce qui mènerait à un déchargement des cellules p du pancréas et à la préservation de la sécrétion d'insuline à long terme (147). Aussi, l'allaitement augmente la dépense énergétique de 15 à 25 % (147,148). En effet, de 400 à 500 kcal sont requises pour la production de lait durant les premiers six mois d'allaitement exclusif et 170 kcal seraient mobilisées des réserves de gras et/ou de la diminution d'activité physique (147, 149, 150). Une diminution de la rétention de poids en période post-partum pourrait être expliquée par ce phénomène. Des recherches supplémentaires effectuées spécifiquement durant l'allaitement sont nécessaires pour expliquer les mécanismes impliqués dans l'association entre l'allaitement et le profil
30
métabolique de la femme et aussi pour comprendre les mécanismes sous-jacents de l'effet prolongé de l'allaitement.
3.4.2 Barrières à r allaitement
Les femmes qui bénéficieraient le plus de l'allaitement, comme les femmes avec le DbT2 ou obèses, seraient celles qui allaitent le moins (151). L'obésité maternelle est associée à une diminution de l'intention, de l'initiation et de la durée de l'allaitement (152-155). En effet, les femmes qui font de l'embonpoint ou qui sont obèses auraient plus de risque d'arrêter d'allaiter avant six mois que les femmes de poids normal (156). Les taux d'allaitement seraient significativement plus faibles chez les femmes avec un IMC de 30 ou plus comparativement aux femmes ayant un poids normal (153). De plus, à mesure que l'IMC augmente, la durée moyenne d'allaitement semblait diminuer (Tableau 4) (153).
Tableau 4 : Initiation et durée moyenne de l'allaitement selon différentes catégories d'IMC
IMC (kg/m2) Initiation (%) Durée moyenne
(semaine)
20-25 89,2* 28,7*
>25-<30 86,9 26,1*
>30 82,3* 22,7*
* Significativement différent entre les groupes Tiré de Donath et coll. (153)
En fait, les femmes obèses seraient plus à risque d'avoir une production de lait retardée. Dans une revue de la littérature, des associations entre l'embonpoint ou l'obésité maternelle et un retardement de la lactogénèse ont été observées (155). Une étude a observé que les femmes obèses ont des réponses diminuées de la prolactine en réponse à la tétée dans la première semaine comparativement aux femmes de poids