Université de Montréal
Le CpG et le poly(I:C) agissent en synergie avec le
trastuzumab contre le cancer du sein HER2+
par
Roxanne Charlebois
Département de microbiologie, infectiologie et immunologie, Université de Montréal Faculté de Médecine
Mémoire présenté à la Faculté de Médecine en vue de l’obtention du grade de M.Sc.
en Microbiologie et Immunologie
Juin, 2015
1
Résumé
Chez la souris, la thérapie anti-HER2 est dépendante de la présence de cellules T CD8+IFN-γ+ et des réponses IFN de type I. Ces IFN sont induits par les TLRs suite à la reconnaissance de signaux de danger, appelés PAMPs et DAMPs. Les TLR-3 et TLR-9 sont tous deux de bons inducteurs d’IFN de type I et sont également capable d’agir en synergie afin d’augmenter les niveaux d’IFN-γ, de TNF-α et d’IL-12. Notre hypothèse fut que la stimulation de ces deux TLRs mènerait à l’amélioration de l’activité anti-tumorale du trastuzumab via le recrutement et l’activation des cellules immunitaires. Nos buts furent de confirmer le potentiel thérapeutique de la combinaison de l’anticorps anti-HER2, de l’agoniste de TLR-3, le poly(I:C), et de l’agoniste de TLR-9, le CpG ODN. Des études in vivo et in vitro nous ont permis de découvrir une synergie entre ces agents qui résulte en une cytotoxicité ciblée plus efficace. De plus, cette thérapie s’avéra efficace chez des modèles dépendants et CD8-indépendents. Les souris purent rejeter leur tumeur et demeurer sains plusieurs semaines après l’arrêt des injections. Ces souris étaient également protégées lors d’un challenge, soulignant ainsi la présence d’une immunité mémoire. Nous avons aussi découvert que l’administration combine de trastuzumab des deux agonistes de TLRs mène à des réponses systémiques. Des études de déplétion confirmèrent que les cellules T CD8+ sont cruciales pour la protection à long terme des animaux, mais que les pDC sont moins impliquées que ce que l’on pourrait croire. Leur absence n’a que modestement affecté les effets de notre thérapie. À l’opposé, les cellules NK sont d’importants médiateurs des effets thérapeutiques. Des expériences d’ADCC ont révélé que le CpG ODN et poly(I:C) ont tous deux la capacité d’améliorer les fonctions des cellules NK, mais que la stimulation simultanée des TLR-3 et TLR-9 permet de maximiser les effets bénéfiques du trastuzumab. De la même manière, l’addition de CpG ODN et de poly(I:C) aux anticorps anti-HER2 a permis d’augmenter les réponses pro-inflammatoires, plus spécifiquement l’IFN-γ, le TNF-α, l’IP-10 et l’IL-12.
Mots-clés: Immunothérapies, HER2/ErbB2, trastuzumab, TLR, in vivo, in vitro, souris Balb/c,
poly(I:C), CpG ODN, ADCC, NK cells, DC, pDC, CTL, IFN-γ, type I IFN, IL-12, TNF-α, IP-10
2
Abstract
In murine models, anti-HER2 therapy has been shown to be dependent on IFN-γ-producing CD8+ T cells and type I IFN responses. These IFN are induced by TLRs following the recognition of danger signals, called PAMPs or DAMPs. Both TLR-3 and TLR-9 are well known inducers of type I IFN and were also shown to act synergistically to enhance the levels of IFN-γ, TNF-α, and IL-12. Our hypothesis thus was that the stimulation of those two TLRs would lead to an enhancement of the activity of trastuzumab against tumor cells by the recruitment and activation of immune cells. Our goals were to assess the potential therapeutic effects of a combination of anti-HER2 mAbs, TLR-3 agonist poly(I:C) and TLR-9 agonist CpG ODN. In vivo and in vitro studies enabled us to discover a synergy between all agents resulting in a more efficient targeted cytotoxicity. Moreover, this therapy was fully effective in a CD8-dependant cell line as well as a CD8-independent one. Mice were able to completely reject their tumor and remain tumor-free weeks after the injections. Those mice were also protected against a rechallenge, thus underlining the presence of an immune memory. We also discovered that the combined administration of trastuzumab and the TLR agonists leads to systemic responses. Depleting studies confirmed that T CD8+ cells are crucial for the animal to remain tumor-free on the long term, but that pDC are far less involved than what we could have thought. Their absence only modestly affected the outcome of our therapy. On the counterpart, NK cells were important mediators of the therapeutic effect. ADCC assays revealed that both CpG ODN and poly(I:C) are able to enhance the functions of NK cells, but that simultaneous stimulation of the TLR-3 and TLR-9 allows to maximize the beneficial effects of trastuzumab. The same way, the addition of both CpG ODN and poly(I:C) to the anti-HER2 mAbs further enhanced pro-inflammatory responses, more specifically IFN-γ, TNF-α, IP-10 and IL-12.
Keywords: Immunotherapies, HER2/ErbB2, trastuzumab, TLR, in vivo, in vitro, Balb/c mice,
poly(I:C), CpG ODN, ADCC, NK cells, DC, pDC, CTL, IFN-γ, type I IFN, IL-12, TNF-α, IP-10
3
Table des matières
Résumé ... 1
Abstract ... 2
Table des matières... 3
Liste des tableaux193,58ma ... 6
Liste des figures ... 7
Liste des sigles ... 9
Liste des abréviations ... 13
Remerciements ... 14
Chapitre 1 : Introduction ... ii
1.1 Historique des thérapies anti-cancéreuses ... …ii
1.1.1.Chirurgies ... ii 1.1.2.Hormonothérapies ... iii 1.1.3.Irradiation ... iii 1.1.4.Chimiothérapies ... iv 1.1.5.Immunothérapies ... v 1.2 Cancer du sein ... v 1.2.1 Caractéristiques et incidence ... v
1.2.2 Stades et grades ... viii
1.2.3 Traitements ... ix
a) Cancer du sein ER+/PR+ ... ix
b) Cancer du sein HER2+ ... xi
c) Cancer du sein triple négatif ... xiii
1.3 ErbB2/HER2 ... xiv
1.4 L’Herceptin en détails ... xvii
1.4.1 Modèle de production ... xvii
1.4.2 Mécanismes d’action ... xix
1.4.3 Mécanismes de résistance ... xxi
4
1.5.1 Points de contrôle immunitaire ... xxiii
a) CTLA-4 ... xxiii
b) PD1 et PD-L1/2... xxiv
1.5.2 Récepteurs Toll-like ... xxv
a) TLR-3 ... xxvi
b) TLR-9 ... xxvii
Chapitre 2 : Hypothèse et objectifs ... xxx
2.1 Hypothèse ... xxx
2.2 Objectifs du projet ... xxx
Chapitre 3 : Matériels et méthodes ... xxxi
3.1 Traitement des tumeurs transplantées et immunité mémoire ... xxxi
3.2 Effets locaux ou systémiques ... xxxii
3.3 Rôle des CTL ... xxxiii
3.4 Rôle des lymphocytes T CD8+ ... xxxiv
3.5 Rôle des pDC ... xxxv
3.6 Rôle des cellules NK ... xxxv
3.7 Rôle de l’IFN-γ, du TNF-α, de l’IL-12 et de l’IP-10 ... xxxvii
3.8 Analyses statistiques ... xxxviii
Chapitre 4 : Résultats ... xxxix
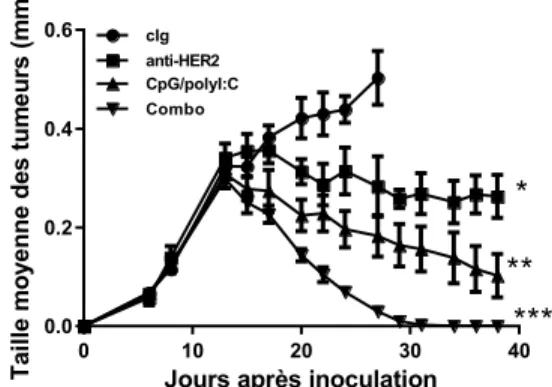
4.1 Présence d’une synergie entre l’anti-HER2 et les agonistes TLR in vivo... xxxix 4.2 Des réponses systémiques sont atteintes avec la thérapie combinée ... xl 4.3 In vivo, la thérapie encourage l’activité des CTL ... xli 4.4 Les deux agonistes TLR induisent une sécrétion prononcée d’IFN-γ par les cellules T CD8+... ... xlii 4.5 La présence des cellules T CD8+ est nécessaire pour la protection à long terme des individus traités ... xliii 4.6 Les pDC ne sont que faiblement impliquées dans les effets thérapeutiques... xliv 4.7 Les cellules NK sont essentielles à la synergie observée ... xlv 4.8 L’activité cytotoxique des cellules NK est maximisée en présence des deux agonistes de TLR... ... xlv
5
4.9 La thérapie combinée permet d’atteindre de forts niveaux d’IFN-γ, IP-10, TNF-α et IL-12... xlvii
Chapitre 5 : Discussion ... xlix 5.1 Le CpG ODN et le poly(I:C) agissent en synergie avec l’anti-HER2 in vivo... xlix 5.2 L’administration combinée de CpG/poly(I:C) et de trastuzumab offre des réponses systémiques ... l 5.3 La thérapie combinée résulte en une amélioration de l’activité CTL in vivo ... li 5.4 Le CpG ODN et le poly(I:C) induisent une production plus élevée d’IFN-γ par les cellules T CD8+ ... lii 5.5 Les cellules T CD8+ sont importantes pour la protection à long terme ... liv 5.6 Les pDC ne contribuent que modestement à la thérapie ... liv 5.7 La synergie observée est dépendante des cellules NK ... lv 5.8 Les deux agonistes sont nécessaires afin de maximiser la cytotoxicité médiée par les cellules NK ... lvi 5.9 La synergie induit de plus hauts niveaux d’IFN-γ, IP-10, TNF-α et IL-12 ... lvii Chapitre 6 : Conclusions ... lix Bibliographie... lxiii Annexe 1. Figures supplémentaires ... lxxvi
6
Liste des tableaux
Tableau 1. Statistiques d’incidence et de mortalité de certains cancers du Canada ... vii Tableau 2. Description des quatre stades de cancer du sein ... viii Tableau 3. Description des trois grades possibles de cancer du sein selon le score accordé ... ix
7
Liste des figures
Figure 1. Conformation et dimérisation des EGFR ... xvi Figure 2. Les voies signalétiques induites par HER2 ... xvii Figure 3. Voies de signalisation empruntées lors de la stimulation des différents TLRs ... xxix Figure 4. La combinaison d’anti-HER2, de CpG ODN et de polyI:C induit le rejet des tumeurs HER2+ ... xxxix Figure 5. La combinaison d’anti-HER2, de CpG ODN et de polyI:C induit le rejet des tumeurs HER2+ ... xxxix Figure 6. Les souris CR sont protégées lors d’un challenge subséquent. ... xl Figure 7. La combinaison d’anti-HER2, de CpG ODN et de polyI:C induit des réponses systémiques.. ... xl Figure 8. L’administration d’anti-HER2, de CpG ODN et de polyI:C induit une plus forte cytotoxicité médié par les CTLs. ... xli Figure 9. L’administration de CpG ODN et de polyI:C induit une plus forte stimulation des cellules T CD8+ produisant de l’IFN-γ ... xlii Figure 10. La déplétion in vivo des cellules T CD8+ élimine les effets du CpG ODN et du polyI:C, en plus de la protection à long terme de la combination chez les tumeurs TUBO. .. xliii Figure 11. La déplétion in vivo des cellules T CD8+ réduit l’efficacité de la combinaison chez les tumeurs H2N100 ... xliv Figure 12. La déplétion in vivo des pDC n’affecte que modestement l’efficacité du CpG ODN et du polyI:C, ainsi que la combinaison ... xliv Figure 13. La déplétion in vivo des cellules NK élimine les effets de l’anti-HER2 et réduit dramatiquement l’efficacité de la combinaison. ... xlvi Figure 14. La stimulation in vitro de cellules NK avec l’anti-HER2 et le CpG/polyI:C induit de plus hauts niveaux d’activité cytolytique chez ces cellules ... xlvii Figure 15. Les cellules immunitaires actives par l’anti-HER2, le CpG ODN et le polyI:C sécrètent plus de cytokines pro-inflammatoires ... xlviii Fig.Sup.1. Les deux agonistes sont nécessaires afin d’obtenir un effet maximal sur la croissance des tumeurs ... lxxvi
8
Fig.Sup.2. Stratégie employée lors de l’analyse des cellules T CD8+ produisant de l’IFN-γ ... lxxvi Fig.Sup.3. Stratégie employée lors de a confirmation des déplétions, ici suite à l’usage de l’anti-CD8β ... lxxvi Fig.Sup.4. Stratégie employée lors de la confirmation de la viabilité et de la pureté des cellules NK suite à l’enrichissement ... lxxvi Fig.Sup.5. La stimulation in vitro des PBMC, dont les cellules NK ont été retirées, avec l’anti-HER2 et le CpG/polyI:C induit peu d’activité cytotoxique. ... lxxvi Fig.Sup.5. Stratégie employée lors de l’analyse des cellules NK en dégranulation.. ... lxxvi Fig.Sup.6. La stimulation in vitro de PBMCs avec l’anti-HER2 et le CpG/polyI:C induit de plus hauts niveaux de dégraluation chez les cellules NK ... lxxvi
9
Liste des sigles
ADCC : cytotoxicité cellulaire anticorps-dépendante ADN : acide désoxyribonucléique
AP : phosphatase alcaline
APAF-1 : facteur activateur de l’apoptose 1 APC : cellule présentatrice d’antigène ARN : acide ribonucléique
BAD : promoteur de mort associée à Bcl-2 Bcl : protéine de lymphome de cellules B Bcl-2 : protéine 2 de lymphome de cellules B BRM : modulateur de réponse biologique cDC : cellules dendritiques conventionnelles Cdk : kinase cycline-dépendante
CDR : régions déterminant la complémentarité CHO : cellules ovariennes de hamster chinois CMH : complexe majeur d’histocompatibilité CpG ODN : oligonucléotides de motifs CpG CTL : lymphocyte T cytotoxique
CR : répondeur complet (complete responder) DAMP : patron moléculaire associé à un danger DC : cellules dendritiques
DCIS : carcinome canalaire in situ
EGFR : récepteur de facteurs de croissance épithéliaux ; peut aussi faire référence à HER1 ELK : facteur de transcription « ELK »
EMCS : ester N-[-maleimidocaproyloxy]succinimide ER : récepteur à l’œstrogène
ERDs : répresseurs du récepteur à l’œstrogène ERK : kinase extracellulaire régulée par signal
FADD : protéine associée à Fas avec domaine de mort
10 FLIP : protéine inhibitrice ressemblant à FLICE
FOS : facteur de transcription; homologue de l’oncogène viral d’ostéosarcome murin FBJ HER1 : récepteur épithélial humain 1
HER2 : récepteur épithélial humain 2 HER3 : récepteur épithélial humain 3 HER4 : récepteur épithélial humain 4 HRP : peroxydase de raifort
IFN-γ : interféron gamma
IGF-IR : récepteur du facteur de croissance I ressemblant à l’insuline IκB : inhibiteur de kappa B
IL-12 : interleukine 12
IP-10/CXCL10 : protéine interféron-inductible 10 IRF3 : facteur de transcription régulant l’interféron 3 IRF5 : facteur de transcription régulant l’interféron 5 IRF7 : facteur de transcription régulant l’interféron 7 JAK 1/2: kinases Janus 1 et 2
JNK : kinase « Jun »
JUN : facteur de transcription « JUN » KO : knock-out
LHRHs : agents hormonaux lutéinisants relâchant des hormones mAb : anticorps monoclonal
MAPK : protéine kinase activée par mitogène MAP2K : MAP kinase kinase
MAP3K : MAP kinase kinase kinase
MDSC : cellule suppressive myéloïde-dérivée
MEK : aussi nommé MAP2K; protéine kinase kinase mitogène-activée MFI : intensité moyenne de fluorescence
MIP : protéine inflammatoire de macrophage MMTV : virus de tumeur mammaire murine MUC4 : mucine 4
11
MYC : facteur de transcription; homologue de l’oncogène viral du myélocytomatose aviaire V-Myc
MyD88 : réponse primaire de la différentiation myéloïde 88 NF-κB : facteur nucléaire kappa B
NK : cellules natural killer NOD : non-obese diabetic NSG : NOD SCID gamma
OCT : température optimale de coupe (optimal cutting temperature) PAMP : patron moléculaire associé à un pathogène
PARP : polymérase poly ADP-ribose
PBMC : cellule mononucléée du sang périphérique pDC : cellules dendritiques plasmacytoïdes
poly(I:C) : acide polyinosinique-polycytidylique PRR : récepteur à reconnaissance de patron PTEN : homologue de phosphatase et tensine PR : récepteur à la progestérone
RAF : aussi nommé MAP3K; protéine kinase kinase kinase mitogène-activée
RANTES/CCL5 : sécrété et exprimé par les cellules T normales, régulé lors de l’activation Ras : GTPase « Ras»
RIP1 : protéine kinase sérine/thréonine 1 interagissant sur le récepteur SCID : immunodéficience combinée sévère
SDR : régions déterminant la spécificité
SERMs : modulateurs sélectifs de la réponse du récepteur à l’œstrogène STAT3 : transducteur de signal et activateur de transcription 3
TAA : antigène associé à la tumeur TCR : récepteur des cellules T TIR : récepteur Toll/interleukine-1 TLR-3 : récepteur Toll-like 3 TLR-9 : récepteur Toll-like 9
TNF-α : facteur de nécrose tumorale alpha Treg : cellule T régulatrice
12
TRIF : adaptateur contenant un domaine TIR induisant l’IFN-β TRAF2 : facteur 2 associé au récepteur TNF
VEGF : facteur de croissance endothéliale vasculaire WT : espèce sauvage (wild type)
13
Liste des abréviations
e.g. : exempli gratia (latin pour « exemple ») i.e. : id est (latin pour « c’est-à-dire »)
i.p. : intrapéritonéal(e) i.t. : intratumoral(e) i.v. : intraveineux(se) s.c. : sous-cutané(e)
14
Remerciements
J’aimerais remercier tous ceux qui ont participé de loin ou de près à l’avancement de mon projet de recherche ainsi qu’à la rédaction de ce mémoire.
Tout d’abord, merci à mon directeur de recherche, le Dr. John Stagg, de m’avoir accueillie au sein de son laboratoire et d’avoir participé activement à ma formation professionnelle et à l’avancement de mon projet pendant ces deux années.
Je tiens à souligner le travail incroyable effectuée par mes collègues au laboratoire, mais aussi au sein de l’Institut du Cancer de Montréal (ICM) et du Centre de Recherche du Centre Hospitalier de l’Université de Montréal (CRCHUM). Les collaborations faciles entre laboratoires de recherche ont été d’une aide précieuse. De plus, vos personnalités si diversifiées et agréables ont su rendre mon séjour à vos côtés des plus positifs.
Je remercie la généreuse participation du Dre. Isabelle Royal et du Dr. Jean-François Cailhier au comité de suivi de cette maîtrise, ainsi que celle de Pavel Chrobak à titre de parrain.
Finalement, merci à mes parents qui ont également contribué à leur façon en m’encourageant depuis longtemps à persévérer et me rendre aussi loin que possible dans tout ce que j’entreprends. Je tiens à vous remercier pour toute votre aide, morale ou matérielle, durant toutes mes études.
ii
Chapitre 1 : Introduction
1.1 Historique des thérapies anti-cancéreuses
1.1.1. Chirurgies
La notion de «cancer» peut être retracée jusqu’à 3000 ans av. J.-C à l’aide d’écrits d’ancienne Égypte ayant survécu à la poussière du temps. La traduction d’un papyrus, nommé le «papyrus Edwin Smith» de par son acheteur en 1862, dévoila un texte de traumatologie écrit par des anciens Égyptiens chirurgiens [1]. Il y est décrit huit cas de tumeurs et ulcérations du sein où le traitement prescrit était de cautériser le sein à l’endroit où la masse était palpable. Le texte se conclut cependant en soulignant que cette maladie est incurable.
En 460-370 av. J.-C., en Grèce antique cette fois-ci, l’illustre médecin Hippocrates emploie pour la première fois une terminologie bien précise selon les cas. Lorsqu’une masse n’est pas accompagnée d’une ulcération, il la nomme «carcinos», alors qu’en présence d’ulcération, il la nomme «carcinoma» [1]. La racine carcino fait référence au crabe et fut probablement choisie en référence aux projections faites par la tumeur.
Au 2e siècle ap. J.-C., un médecin Romain nommé Aulus C. Celsus écrivait qu’une masse excisée avec succès revenait toujours avec le temps [2]. Il traduisit également le mot «carcinos» en latin, ce qui donna le terme «cancer» pour la première fois [1]. Au même moment, un autre médecin et chirurgien Grec, nommé Galen, soulignait qu’un patient ayant une masse croissante était voué à en mourir [3]. Il utilisa le mot «oncos», c’est-à-dire «enflure» en grec, afin de décrire une tumeur. Pendant près de mille ans, les travaux de cet homme ancrèrent dans la mentalité populaire la théorie qu’un cancer était incurable. Ils avaient convaincu les gens que des traitements étaient futiles et même dangereux. En effet, l’excision chirurgicale d’une masse mettait la vie du patient en péril, principalement dû à la perte de sang importante. La mort était donc inévitable.
Au cours du 19e siècle, l’anesthésie apparu dans le domaine médical et mena à un développement rapide des techniques d’opérations chirurgicales. Parmi celles-ci, le professeur William S. Halsted, de l’Université Johns Hopkins, proposa la mastectomie radicale chez les patientes atteintes d’un cancer du sein [4]. Cette idée faisait suite aux travaux de W. Sampson
iii
Handley, un chirurgien londonien, qui croyait qu’un cancer s’étalait en envahissant le tissu adjacent au site d’apparition [5]. Halsted croyait ainsi qu’il était possible de guérir le cancer en excisant adéquatement le tissu atteint. Si une autre tumeur apparaissait, il s’agissait pour lui d’un tout nouveau cancer et non d’une dissémination. Alors qu’Halsted et Handley travaillaient sur ces chirurgies radicales, le chirurgien anglais Stephen Paget étudiait la notion de métastases et les facteurs qui déterminaient les organes qui seraient atteints. Il conclut avec une justesse surprenante que les cellules cancéreuses d’une première tumeur devaient emprunter la circulation sanguine afin d’envahir le corps, mais que seulement certains organes étaient propices à leur prolifération. Il fit d’ailleurs une analogie forte intéressante entre les métastases et des «graines voyageant avec le vent en toutes directions, mais qui ne peuvent survivre et croître qu’en sol fertile» [6].
1.1.2. Hormonothérapies
À la même époque, George T. Beatson s’intéressa aux relations entre les ovaires et la lactation. Il observa chez des lapines que le retrait chirurgical des ovaires menait à l’arrêt de production de lait. Cette découverte fut d’un grand intérêt, car elle démontrait le pouvoir qu’un organe avait sur l’activité d’un autre organe distant. Il décida d’étudier ces faits chez l’humain et découvrit qu’une ovariectomie chez des patientes atteintes d’un cancer du sein améliorait leur état de santé. Bien que l’hormone féminine produite par les ovaires, l’estrogène, ne fut identifiée que plus tard, cet homme venait de découvrir ses effets stimulateurs. Ses travaux menèrent éventuellement au développement de produits visant à réduire les niveaux d’estrogène, tel le tamoxifène et les inhibiteurs d’aromatases [7]. Cinquante ans plus tard, faisant suite à ces travaux, Charles Huggins observa des régressions importantes de cancers prostatiques chez les patients ayant subi une castration [8]. L’apparition de drogues inhibant les hormones masculines, i.e. les androgènes et la testostérone, offrirent des résultats bénéfiques aux patients.
1.1.3. Irradiation
Wilhelm Roentgen était un physicien du 18e siècle qui entreprit des expériences sur les rayons ainsi que leur nature. Alors qu’il étudiait un rayonnement particulier, il décida d’analyser le pouvoir pénétrant de son faisceau avec divers objets. À sa grande surprise, alors qu’il plaçait un morceau de plomb devant le dit faisceau, il put apercevoir les os de sa main. Un an plus tard,
iv
en 1896, il publia une photographie sur laquelle on pouvait voir les os de la main de sa femme ainsi que la bague qu’elle portait [9]. Il reçut le premier prix Nobel de physique en 1901 suite à la découverte de ce qu’il appela les «rayons X». L’usage de machines utilisant le radium, un élément radioactif, comme source de rayons X permit la naissance du diagnostic par radiation [9]. Peu de temps après, en France, il fut observé qu’une dose quotidienne de radiation offrait aux patients de meilleures chances de survie. La radiothérapie fut donc combinée au retrait chirurgical des tumeurs afin de réduire les risques de rechute. Cependant, quelques années plus tard, la communauté scientifique découvrit que les rayons pouvaient également mener au développement d’un cancer [9]. Les avancements en physique ainsi qu’en technologies au fil du temps permirent de mieux diriger les rayons émis et donnèrent naissance aux thérapies modernes. Ces dernières sont maintenant capables de cibler précisément la tumeur afin que les rayons n’atteignent pas les cellules normales et que les cellules tumorales, elles, reçoivent une dose maximale de radiation.
1.1.4. Chimiothérapies
Lors de la Première Guerre mondiale, les études effectuées sur les armes chimiques menèrent à la découverte de la «moutarde azotée», un dérivé du gaz moutarde. Ce produit s’avéra efficace dans le cadre du traitement du lymphome et fut la première étape menant au développement des agents alkylants, qui endommagent l’acide désoxyribonucléique (ADN) des cellules cancéreuses [10]. Peu de temps après, Sydney Farber découvrit que l’aminoptérine, un antagoniste de l’acide folique (vitamine B9), permettait de traiter efficacement des enfants atteints de leucémies aiguës [11]. Ce produit, agissant en bloquant la réplication de l’ADN, donna plus tard naissance au méthotrexate, qui est encore utilisé aujourd’hui. Il permit pour la première fois de guérir des cancers métastatiques. À partir de ce moment, plusieurs chercheurs centrèrent leur effort sur la découverte de nouvelles drogues qui affecteraient la biologie cellulaire du cancer et la notion de «chimiothérapie» fut instaurée. Il fut observé qu’une excision de la tumeur par chirurgie suivie d’une chimiothérapie permettait d’éliminer toutes cellules résiduelles qui auraient également échappé à la radiothérapie. Des études où l’on combina plusieurs drogues démontrèrent par la suite une efficacité surprenante envers des cancers à croissance rapide. Plusieurs types de cancer furent donc traités de cette manière afin de guérir les patients, ou du moins permettre de contrôler la prolifération de leur tumeur.
v
1.1.5. Immunothérapies
L’avancement technologique et le raffinement des méthodes d’analyse permirent à la communauté scientifique de mieux comprendre les procédés biologiques ainsi que les facteurs les régulant. Plusieurs notions firent leur apparition telles l’hématopoïèse, les réponses immunitaires innées et adaptatives, les processus contribuant à la carcinogenèse, etc. À titre d’exemple, les cytokines, comportant des interleukines, chimiokines, interférons et autres, furent découvertes. S’en suivi l’idée de recréer certains composés en laboratoire et de traiter des patients avec ces derniers afin de moduler des processus biologiques. Il devenait alors possible de cibler directement les cellules cancéreuses afin d’altérer leur croissance ou encore de stimuler l’immunité anti-tumorale du patient. La découverte de molécules spécifiques aux tumeurs, les antigènes tumoraux, ainsi que les avancés en biologie moléculaire soulevèrent la théorie qu’il serait possible de créer des anticorps ciblant des antigènes tumoraux. Les méthodes utilisant des recombinaisons ADN rendirent possibles cette production de masse d’anticorps spécifiques. Depuis, plusieurs sont utilisés couramment comme thérapie chez certains cancers et les scientifiques ne cessent leurs efforts afin d’en découvrir d’autres. Parmi les technologies en cours de développement, on retrouve également des vaccins comportant des antigènes tumoraux [12], des transferts adoptifs de cellules immunitaires [13] [14], des vaccins ADN [15] et autres.
L’arrivée des technologies modernes apporta avec elle une plus grande discrimination entre les cellules tumorales et les cellules normales chez les patients. Elle apporta ainsi également une augmentation de l’efficacité des traitements tout en réduisant les effets secondaires qui étaient observés avec les premières thérapies.
1.2 Cancer du sein
1.2.1 Caractéristiques et incidence
Au Canada, selon les statistiques anticipées pour 2015, le cancer du sein représentera 25,9% des 96 400 nouveaux cas de cancer et se classerait ainsi comme étant le plus commun chez les femmes adultes (Tab.1) [16]. Le nombre d’incidences s’est accru au début des années 1990 suite au développement des techniques de mammographie ainsi qu’à l’augmentation du
vi
nombre de patientes examinées. Depuis, certaines fluctuations ont été observées sans avoir été associées précisément à certains événements. Par contre, il est fort probable qu’elles soient reliées à des phénomènes tels l’arrivée des menstruations à un plus jeune âge, l’allaitement, l’entrée en ménopause à un âge plus mature, l’utilisation populaire des contraceptifs oraux ainsi que des grossesses à un âge plus tardif. Bien que le nombre de patients ayant succombé à leur cancer aie augmenté avec le temps, la vitesse de croissance, elle, diminue depuis 1988 grâce aux nouvelles thérapies développées. La mortalité associée aux cancers du sein s’élèverait malgré tout à 13,6% pour l’année 2015 et représenterait le deuxième type de cancer le plus mortel après le cancer du poumon au pays [17].
Parmi les différentes manières de classer les types de cancer du sein, on retrouve celle les divisant en sous-groupes selon l’expression de certains récepteurs clés. Il s’agit des récepteurs de l’œstrogène (ER), de la progestérone (PR) et HER2 [18]. Ce classement a pour but de donner des informations importantes aux cliniciens afin de mieux choisir les traitements appropriés pour une certaine patiente. Il suffit d’effectuer une biopsie et de faire quelques coupes histologiques, qui seront par la suite traitées par histochimie afin de détecter le ou les récepteurs surexprimés. Grâce à ces évaluations, la tumeur de la patiente peut ainsi être associée à l’une des catégories suivantes :
récepteurs endocrines positif (ER+/PR+)
HER2 positif (HER2+)
triple positif (ER+/PR+ et HER2+)
triple négatif (aucun des trois récepteurs)
De tous les cancers du sein, 75% possèdent le récepteur ER et environ 65% de ceux-ci expriment également le récepteur PR. Les cellules mammaires normales sont dépourvues de ces deux récepteurs, mais leur transformation en cellules tumorales induit leur expression. Lorsqu’ils sont stimulés, tous deux transmettent un signal qui emprunte les voies MAPK, PI3K/Akt et NF-κB [19] [20]. Tel que décrit auparavant, ces voies de signalisation résultent en signaux de survie et prolifération, ce qui encourage la croissance de la tumeur.
vii
Tableau 1. Statistiques d’incidence et de mortalité de certains cancers du Canada
Hommes Femmes Hommes Femmes
Nouveaux cas 100 500 Nouveaux cas 96 400 Morts 41 000 Morts 37 000
Prostate 23,9% Sein 25,9% Poumon 26,6% Poumon 27,0%
Colorectal 13,9% Poumon 13,5% Colorectal 12,4% Sein 13,6%
Poumon 13,5% Colorectal 11,5% Prostate 10,1% Colorectal 11,5%
Vessie 6,1% Utérus 6,5% Pancréas 5,6% Pancréas 6,2%
Lymphome
non-Hodgkin 4,5% Thyroïde 5,0% Vessie 4,0% Ovaire 4,7%
Les cancers exprimant HER2, quant à eux, représentent de 30 à 35% des cas totaux et sont associés à des patientes ayant des tumeurs plus agressives. Chez l’humain, les cellules saines comportent deux copies du gène HER2. Il arrive cependant qu’il y ait amplification du locus, ce qui résulte en plusieurs copies du gène dans la même cellule et donc une production accrue de la protéine HER2. Une surexpression de cette protéine mène ainsi à une forte stimulation des voies MAPK, JAK/STAT, PI3K/Akt et NF-κB via son hétérodimérisation avec HER3. De tous les cas de cancer du sein HER2+, il y en a environ 20% qui sont triple positifs [21]. Les voies de signalisation mentionnées sont donc stimulées par trois récepteurs différents à la fois, ce qui résulte en signaux de survie et de prolifération forts et soutenus au sein de la tumeur.
Les cancers du sein qualifiés de « triple négatifs » englobent 10 à 20% des cas, ce qui représente un peu plus d’une patiente sur 10 [22] [23]. Ils sont décrits comme plus agressifs que les autres types, car ils peuvent s’étendre à d’autres organes et sont fortement à risque de réapparaître après traitement. À titre comparatif, 77% des patientes atteintes de ce type de cancer survivent au moins 5 ans, alors que chez les autres la proportion atteint 93%. Il est également décrit que les cancers triple négatifs sont souvent d’un grade plus avancé (grade 3) lors du diagnostic. En plus, ce type de cancer du sein est majoritairement du genre «basal-like», c’est-à-dire ressemblant fortement aux cellules basales tapissant les canaux de lactation. Ce manque de différenciation empêche le système immunitaire de bien reconnaître le danger, ce qui associe
viii
d’autant plus ce type de cancer à une forte agressivité. Les statistiques démontrent que ce sont en grande partie les femmes afro-américaines et hispaniques, âgées de 40 à 50 ans, qui sont à risque d’être touchées. De plus, les femmes possédant une mutation BRCA1 qui développent un cancer du sein avant 50 ans sont pratiquement toujours de type triple négatif [24].
1.2.2 Stades et grades
Divers tests permettent de récolter de plus amples détails sur l’état de la patiente et l’avancement de son cancer. En plus des biopsies, on peut penser à la tomographie (PET scan), la tomodensitographie (CT scan), l’imagerie aux rayons X ou aux échographies. En plus de l’évaluation des récepteurs présents dans une tumeur, les médecins basent leur pronostic sur ce qu’on appelle le stade et le grade.
Le stade d’un cancer permet aux médecins d’identifier l’état de la tumeur, c’est-à-dire si elle est à un stade précoce, localement avancé ou métastatique. On distingue les tumeurs en quatre stades selon leur taille, l’invasion des nœuds lymphatiques et la présence de métastases [25]. Différents scénarios peuvent faire partie du même stade selon leur facteur prédictif tel que décrit dans le Tableau 2.
Tableau 2. Description des quatre stades de cancer du sein
Stade Scénario Taille de la tumeur Nœuds lymphatiques Métastases
1 1 ≤ 2 cm négatif aucun
2
1 ≤ 2 cm négatif aucun
2 entre 2 et 5 cm négatif ou positif aucun
3 > 5 cm négatif aucun
3
1 peu importe positif aucun ou près de la clavicule
2 > 5 cm positif aucun
3 ulcérée positif aucun
ix
En résumé, le stade I reflète un stade précoce et non invasif du cancer. Les stades II et III regroupent les cancers de taille moyenne ou s’étend étendus dans les tissus adjacents, avec une possible infiltration des nœuds lymphatiques. Finalement, le stade IV est le pire des scénarios où la tumeur s’est étendue à d’autres parties du corps et a formé des métastases. Dans le cas du cancer du sein, les métastases affectent surtout les poumons, le cerveau, les os et le foie.
Lorsqu’on parle de grade, on fait plutôt référence à l’allure des cellules tumorales et leur agressivité. Les pathologistes utilisent majoritairement le système Nottingham, une version modifiée de l’échelle Bloom-Richardson [26], pour évaluer les cancers du sein. Cette échelle évalue trois caractéristiques des cellules tumorales au microscope, soit leur degré de différenciation, de croissance et leur potentiel invasif, et leur donne à chacun un score de 1 à 3 [25]. Le total final obtenu par l’addition des trois est ce qui détermine le grade de la tumeur (Tableau 3).
Tableau 3. Description des trois grades possibles de cancer du sein selon le score accordé
Grade Score Cellules Croissance Potentiel invasif
1 3-5 bien différenciées faible faible
2 6-7 différenciées modérément modérée modéré
3 8-9 différenciées peu ou pas forte grand
1.2.3 Traitements
En termes de chirurgie et d’irradiation, tous les sous-types sont traités relativement de la même manière. La différence entre leur traitement réside dans le choix de chimiothérapie [27]. Par exemple, une tumeur possédant les récepteurs ER et PR sont sensibles aux thérapies hormonales, alors qu’un autre étant triple négative n’en bénéficiera peu ou pas.
a)
Cancer du sein ER+/PR+
Pour ce qui est des cas ER+ et PR+, les patients reçoivent des thérapies hormonales dans lesquelles on retrouve les modulateurs sélectifs de la réponse du récepteur à l’œstrogène (SERM),
x
les inhibiteurs d’aromatase, les répresseurs du récepteur à l’œstrogène (ERD) et les agents hormonaux lutéinisants relâchant des hormones (LHRH) [28]. Les SERMs agissent directement dans les tissus du sein en se liant aux récepteurs à l’œstrogène, ce qui a pour effet d’empêcher l’hormone de s’y lier et d’enclencher une cascade signalétique. Les SERMs peuvent être administrés par voie orale (pilules) autant chez les femmes pré-ménopausées que post-ménopausées. Les plus connus sont le Nolvadex® (tamoxifène) et le Fareston® (torémifène) [29]. Nolvadex® est employé pour réduire la probabilité de développer un cancer chez les patientes à haut risque ainsi que réduire les chances que le cancer soit invasif chez les patientes atteintes d’un carcinome canalaire in situ (DCIS). Les études cliniques effectuées ont démontré que les patientes sous ce médicament ont réduit leur risque de développer un cancer de 44% [30]. Nolvadex® est aussi employé chez les femmes ayant terminé leurs traitements préliminaires (chirurgie, irradiation et chimiothérapie).
Les inhibiteurs d’aromatase, comme leur nom l’indique, agissent en bloquant l’action de l’enzyme aromatase. Cette dernière a comme rôle de convertir une enzyme androgène en petites quantités d’œstrogène. Lorsque l’aromatase est inhibée, il en découle alors de moins grandes quantités d’œstrogène pouvant stimuler les cellules cancéreuses. Les inhibiteurs les plus utilisés sont l’Arimidex® (anastrozole), l’Aromasin® (exemestane) et le Femara® (letrozole) [29]. À titre d’exemple, Arimidex® est donné comme première ligne de traitement chez les femmes ER+//PR+, mais est également employé chez celles pour qui le tamoxifène n’agit plus [31]. Suite à des études cliniques, l’Arimidex® a su améliorer la survie des patientes de 13% ainsi qu’améliorer de 21% le temps de récurrence [32].Ces médicaments sont, comme les SERMs, donnés par voie orale. Cependant, ces produits sont seulement employés chez les femmes ménopausées, car ils ne peuvent empêcher les ovaires de produire de l’œstrogène. Chez ces femmes, cette hormone provient principalement des glandes surrénales et du tissu adipeux.
Les ERDs prennent également action dans le tissu mammaire même. Comparés au SERMs, qui créent un encombrement stérique, les ERDs se logent directement dans le récepteur de l’œstrogène. En plus d’empêcher l’hormone de s’y lier, ces agents induisent un changement de conformation du récepteur qui réduit l’efficacité du signal. De plus, il semble que les ERDs amènent une réduction du nombre de récepteurs à l’œstrogène à la surface des cellules cancéreuses. Le plus commun, le Faslodex® (fulvestrant), est employé chez les femmes ménopausées chez lesquelles les thérapies classiques (i.e. tamoxifène) ont échoué ou n’offrent
xi
plus de bénéfice [29] [33]. Ce médicament est administré par injection intramusculaire, généralement dans la fesse. Lors d’essais cliniques randomisés, les patientes ayant reçu le Faslodex ont démontré une amélioration de 19% du taux de survie [34].
Finalement, les LHRHs amènent également une réduction des niveaux d’œstrogène, cependant ils y arrivent en bloquant sa synthèse par les ovaires. Les femmes non-ménopausées peuvent recevoir cette thérapie par voie sous-cutanée lorsque leur cancer est à un stage précoce [29]. Une fois les traitements arrêtés, les ovaires peuvent produire de l’œstrogène de nouveau. À titre d’information, ces femmes peuvent recevoir du Zoladex® (goseréline), du Lupron® (leuprolide) ou du Trelstar® (triptoréline). Le premier est souvent prescrit en combinaison avec le tamoxifène chez les femmes pré-ménopausées afin de réduire au maximum leurs niveaux d’œstrogène. Il est également employé chez les femmes ayant des métastases ou un cancer du sein récurrent, voir même à titre de traitement palliatif [35]. Le Zoladex® offre une réponse positive dans environ 33% des cas et même une réponse complète chez certaines patientes (9%) [36].
b)
Cancer du sein HER2+
Chez les patientes ayant un cancer du sein HER2+ (incluant triple positif), les thérapies usent d’agents nommés « modulateurs de réponse biologique» (BRMs). Leurs buts sont de cibler les cellules tumorales afin de les tuer, les contrôler ou encore de changer leur comportement. Ils sont généralement prescrits chez les patientes à risque élevé et dans les cas de stades avancés ou métastatiques de cancer du sein. Un des BRMs fortement employés, l’Herceptin® (trastuzumab), est un anticorps spécialement créé afin de cibler les protéines HER2 à la surface des cellules tumorales et d’inhiber leurs signaux de croissance, menant ainsi à leur mort [29]. Les patientes soumises à cette thérapie reçoivent les doses d’anticorps par la voie intraveineuse. Dans la majorité des cas, l’Herceptin est prescrit à titre d’adjuvant et est combiné avec d’autres agents thérapeutiques de nature hormonale ou chimique. Dans d’autres cas, il est employé seul à titre de traitement de métastases jusqu’à ce qu’il y ait amélioration de l’état de santé [29] [37]. Les études cliniques ont démontré une amélioration de 44% de la survie globale des patientes ayant reçu une chimiothérapie combinée à l’Herceptin suite à leur chirurgie [38]. Dans un tel contexte, il y a cependant 15-20% d’entre elles qui ont une rechute. De plus, la majorité des patientes traitées
xii
pour leurs métastases développent une résistance pendant leur première année de traitement à l’Herceptin [39].
Kadcyla® (T-DM1) allie le trastuzumab à une molécule d’emtansine (DM1), une drogue cytotoxique nouvellement développée dans le cadre du cancer. Le T-DM1 est également injecté de manière intraveineuse, mais est plutôt employé chez les patientes atteintes de métastases ayant déjà reçu une thérapie à l’Herceptin, en combinaison ou non avec une chimiothérapie [29]. L’emtansine est un agent dérégulateur de microtubules qui agit en inhibant la polymérisation de la tubuline. Lors d’études in vitro, il fut démontré que cet agent possède un potentiel anti-cancéreux plus élevé que d’autres bien connus tels le méthotrexate ou la daunorubicine. Sachant en plus que les cancers du sein humains sont particulièrement sensibles aux agents ciblant la tubuline (e.g. le paclitaxel et le docétaxel), il fut proposé de créer un conjugué composé d’un anticorps de trastuzumab (Herceptin®) et d’une molécule de DM1. Ainsi, l’anticorps transporte la drogue avec lui jusqu’à la cellule tumorale puis se lie au récepteur HER2. S’en suit une internalisation du conjugué, puis la protéolyse prenant place dans le vésicule permet au DM1 d’être libéré et d’entreprendre l’inhibition des tubules [40]. Par contre, lors d’essais cliniques de phases I et II, le T-DM1 s’est avéré sécuritaire mais aucunement bénéfique chez des patients atteints d’un cancer HER2+ métastatique [41]. Bien que certains de ceux-ci puissent avoir une réponse initiale, la majorité développe rapidement une résistance à la drogue. Bien que les détails n’aient pas été élucidés, il a été suggéré que cette résistance soit due à une mauvaise liaison de l’anticorps à sa cible, un manque d’internalisation, une dégradation inefficace ou encore à au rejet du DM1 dans le milieu extracellulaire via des pompes protéiques [42].
Perjeta® (pertuzumab) est un autre anticorps injecté par voie intraveineuse qui fut créé afin de cibler HER2. La différence avec son grand frère le trastuzumab réside dans l’épitope que chacun reconnaît. En effet, le trastuzumab se lie au sous-domaine IV alors que le pertuzumab se lie au sous-domaine II de la protéine HER2. Ce nouvel anticorps a été construit suite à l’hypothèse voulant qu’il soit possible d’augmenter l’effet enclenché par l’inhibition d’HER2 en combinant les deux agents. Des études in vitro et in vivo ont pu confirmer cette dernière hypothèse en soulignant la présence d’une synergie entre le trastuzumab et le pertuzumab [43] [44]. Les études cliniques ont plus tard permis de comparer les effets des combinaisons trastuzumab-docétaxel et pertuzumab-trastuzumab-docétaxel. Il a été démontré qu’une plus grande proportion des patientes ont une réponse complète lorsqu’elles sont traitées avec le
xiii
pertuzumab en plus des deux autres agents (39,3% versus 21,5%) [45]. Il y eu également un essai clinique de phase III, nommée « MARIANNE », qui tenta de combiner le pertuzumab au T-DM1 chez des patientes atteintes d’un cancer du sein métastatique ou localement avancé. Il s’avéra qu’un tel traitement n’offre pas de réponses supérieures à une thérapie classique combinant une chimiothérapie (docétaxel or paclitaxel) et le trastuzumab [46].
Faisant place à une autre approche, la drogue nommée Tykerb® (lapatinib) est un inhibiteur de tyrosine kinase qui empêche les cellules tumorales de croître et de se diviser. Administrée par voie orale, le lapatinib est offert aux patientes souffrant d’un cancer avancé ou métastatique suivant des thérapies classiques (e.g. anthracycline ou trastuzumab), ou encore les femmes post-ménopausées suivant des thérapies hormonales et pour qui il n’y a plus d’effet. L’ajout du lapatinib aux thérapies déjà en cours permet un regain de réponses bénéfiques chez ces patientes [47]. Cette drogue agit en inhibant HER1 et HER2 à la fois en se liant au site de liaison de l’ATP situés sur les kinases. Il n’est alors plus possible de phosphoryler et d’activer ces récepteurs, ce qui empêche l’induction de signaux intracellulaires [48]. La double action du lapatinib est avantageuse, car il y a une plus forte inhibition des signaux de prolifération.
c)
Cancer du sein triple négatif
Les patientes atteintes d’un cancer triple négatif n’ont malheureusement pas autant de traitements approuvés que les autres. L’absence de cibles thérapeutiques spécifiques à la surface des cellules tumorales ne laisse qu’une option, soit la chimiothérapie. Les recherches effectuées à l’aide de différents modèles ont démontré que ce type de cancer est plus sensible aux chimiothérapies connues que les autres. Malheureusement, cette susceptibilité accrue n’est pas assez pour éviter à ces femmes de recevoir le pire pronostic de tous les types de cancer du sein. Plusieurs études ont été entreprises afin de découvrir des façons d’améliorer leur chance de survie. Parmi les molécules d’intérêt, les inhibiteurs de polymérase poly ADP-ribose (PARP), du facteur de croissance endothéliale vasculaire (VEGF) et d’EGFR [49] ressortent. PARP est une enzyme qui entre en jeu lorsque l’ADN cellulaire est endommagé et doit être réparé. La théorie est qu’en inhibant PARP, les cellules tumorales endommagées par les chimiothérapies perdent leur capacité de réparation et sont donc plus susceptibles d’en mourir. Diverses études tentent de combiner des inhibiteurs PARP, comme l’iniparib et l’oraparib, aux chimiothérapies classiques
xiv
incluant la carboplatine et la gemcitabine [50] [51]. Une de ces études a même réussi à induire une réponse positive chez 36% des participants [52].
Dans un tout autre contexte, le VEGF est une molécule impliquée dans l’angiogenèse. Pour avoir accès à de l’oxygène et des nutriments, une tumeur recrute des facteurs spécifiques afin de créer de nouveaux vaisseaux sanguins qui lui fourniront. L’Avastin® (bevacizumab) est un anticorps qui cible le VEGF et l’empêche ainsi de lier son récepteur. Cela diminue la capacité de former un nouveau réseau vasculaire au sein de la tumeur [53]. Un cousin de l’Avastin®, nommé Sutent® (sunitinib), fonctionne de la même manière. De manière in vitro, le sunitinib a su éliminer la croissance, la prolifération, la migration, la résistance à l’apoptose et l’angiogenèse de modèles de cancers triple négatifs humains [54]. Dans une étude clinique de phase II, cette drogue n’a cependant pas réussi à améliorer la survie des patientes lorsque comparé aux chimiothérapies classiques [55].
Les cancers du sein triple négatifs sont aussi reconnus pour exprimer une trop grande quantité d’EGFR/HER1. L’anticorps Erbitux® (cetuximab) a donc été développé dans un effort de couper les signaux de prolifération qui en découle normalement [56]. Les premiers résultats obtenus à l’aide d’études cliniques sont cependant mitigés : certaines patientes ont des réponses appréciables [57] alors que d’autres cas ne démontrent aucune différence [58]. Il est, en conclusion, nécessaire d’approfondir les recherches afin de trouver les cibles thérapeutiques les plus appropriées dans le cadre du cancer du sein triple négatif.
1.3 ErbB2/HER2
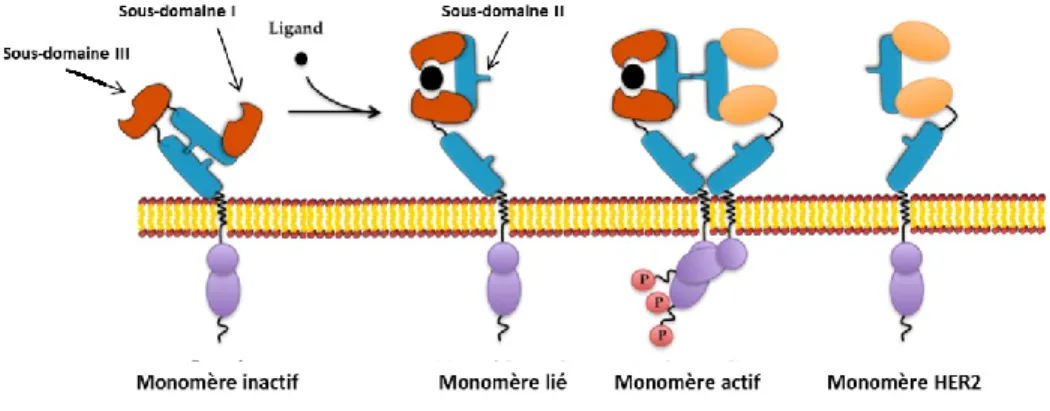
La protéine HER2 fait partie de la grande famille des récepteurs de facteurs de croissance épithéliaux (EGFR) humains, qui comprend au total quatre membres : HER1, HER2, HER3 et HER4. Ils sont formés de domaines extracellulaires, transmembranaires ainsi qu’intracellulaires. Plus spécifiquement, la partie extracellulaire de la protéine comporte quatre sous-domaines (I à IV). Ces récepteurs sont de type tyrosine kinase, signifiant qu’ils ont besoin de lier un ligand afin de pouvoir se dimériser et ensuite produire un signal. Dans le cas des EGFR, la reconnaissance d’un ligand mène à un changement de conformation permettant aux sous-domaines I et III d’interagir. Cette nouvelle forme de la protéine dévoile le sous-domaine II, qui est nécessaire à la
xv
dimérisation par sa liaison au même sous-domaine d’un autre EGFR (Fig.1) [59]. Lorsque les deux récepteurs se joignent, il s’en suit une transphosphorylation des domaines intracellulaires qui mène au recrutement de molécules nécessaires à la cascade signalétique. Dans une cellule normale, il peut y avoir activation de cette voie de signalisation par homodimérisation, mais aussi par hétérodimérisation. Seul le récepteur HER3 ne peut pas former d’homodimères, car son domaine kinase est inactif. Pour avoir production d’un signal cellulaire, il est donc nécessaire qu’il se paire avec un des trois autres récepteurs. Une fois les portions intracellulaires transphosphorylées, les protéines intracellulaires recrutées vont activer quatre voies majeures reliées à la survie et à la prolifération de la cellule. Il s’agit des voies JAK/STAT, MAPK et NF-κB (Fig.2) [60].
Dans le premier cas, la transphosphorylation des domaines intracellulaires mènent à l’activation des protéines JAK1/2 (kinases Janus 1 et 2) se trouvant tout près de la membrane. Une fois actives, ces dernières vont à leur tour activer du transducteur de signal et activateur de transcription 3 (STAT3) qui pourra alors migrer au noyau [61]. Parmi les gènes dont l’expression est régulée par STAT3, on retrouve des gènes anti-apoptotiques (survivines et membres de la famille Bcl (protéine de lymphome de cellules B)), ainsi que des gènes de croissance et prolifération (cycline D1, c-Myc) [62]. En ce qui concerne la voie MAPK (protéine kinase activée par mitogène), c’est la GTPase Ras qui est d’abord phosphorylée. Il y a ensuite une cascade d’activation des protéines RAF (MAP kinase kinase kinase), MEK (MAP kinase kinase) et ERK (kinase extracellulaire régulée par signal). La dernière active les facteurs de transcription ELK, MYC et JUN/FOS ciblant également des gènes de proliférations [63]. Finalement, dans le troisième scénario, les domaines intracellulaires actifs phosphorylent le complexe protéique TRAF2/RIP1/IκB/NF-κB [64]. Cette action mène au démantèlement du dit complexe, libérant par le même fait NF-κB (facteur nucléaire kappa B). Cette protéine migre ensuite au noyau et induit l’expression de gènes de survie comme les membres de la famille Bcl ainsi que XIAP (protéine inhibitrice d’apoptose reliée au X) et FLIP (protéine inhibitrice ressemblant à FLICE) [65], des inhibiteurs de caspases.
xvi
La particularité du récepteur HER2 réside dans le fait qu’il est toujours en conformation ouverte [59]. Nul ligand n’est nécessaire pour changer sa conformation et libérer le sous-domaine II. Aucun ligand n’est d’ailleurs connu pour le récepteur HER2. Son domaine de dimérisation étant toujours disponible, il devient aisé d’activer un autre récepteur et avoir une dimérisation suivie d’une transphosphorylation. Une surexpression d’HER2 par une tumeur rend la chose encore plus facile et confère ainsi un avantage à ces cellules. Le dimère le plus probable dans un contexte de cancer du sein est HER2 : HER3. Bien qu’HER3 est kinase-inactif, il est retrouvé sous une forme activée dans une grande proportion des cancers HER2+. Une des raisons établies est que HER3 permet d’activer directement la voie PI3K/Akt, alors que les dimères ne comportant pas ce récepteur ne le peuvent [59] [66]. Comme Akt permet l’activation des protéines NF-κB et p53, ainsi que l’inhibition de JNK et du promoteur de mort associée à Bcl-2 (BAD), associées à l’apoptose [67] [68], il est intéressant et avantageux pour une tumeur de favoriser l’hétérodimère HER2 : HER3. Une autre raison, basée sur des essais cliniques, est qu’en présence d’un inhibiteur de tyrosine kinase ciblant HER2, une cellule tumorale a comme réflexe d’augmenter son expression de HER3. La forte présence des deux récepteurs rend alors difficile de bloquer tous les dimères à la fois et de renverser leur phosphorylation [59].
Figure 1. Conformation et dimérisation des EGFR
(Source : adapté de
xvii
1.4 L’Herceptin en détails
Tel que mentionné auparavant, le traitement du cancer du sein HER2+ s’effectue à l’aide du trastuzumab, commercialement connu sous le nom d’Herceptin®. Il est généralement employé à titre d’adjuvant en combinaison avec la doxorubicine et le paclitaxel suite au retrait chirurgical de la masse tumorale. Il s’agit d’un anticorps monoclonal produit à grande échelle chez un modèle recombinant fortement utilisé, les cellules CHO [69]. Bien que l’Herceptin ait grandement amélioré le traitement et le taux de survie des femmes atteintes d’un cancer du sein, nous faisons encore face à environ 15% de patientes résistantes ou développant une résistance au fil du temps [70]. De plus, cette thérapie demeure très dispendieuse avec un coût moyen, au Canada, de 50 000$ par patiente traitée [71]. Plusieurs efforts sont donc investis dans le développement de meilleurs anticorps, de thérapies combinées ou d’adjuvants permettant d’augmenter les réponses anti-tumorales et, si possible, réduire le nombre de traitements et les coûts associés.
1.4.1 Modèle de production
Tel que mentionné ci-haut, le trastuzumab provient de la construction d’un clone recombinant à l’aide de cellules ovariennes de hamster chinois (CHO). Les cellules de
Figure 2. Les voies signalétiques induites par HER2
(Source : adapté de http://www.nature.com/nrgastro/journal/v8/n7/
xviii
mammifères sont un moyen de production de protéines fort utile, voir même préférable si l’on souhaite avoir des protéines correctement assemblées, structurées et modifiées post-traductionnellement. Les cellules CHO s’avère être le modèle le plus fiable en pharmacologie à des fins de production industrielle d’agents thérapeutiques. Les raisons expliquant ceci sont très simples. Premièrement, la culture de ces cellules pour la récolte de protéines a déjà été bien établie et les coûts associés sont similaires aux cultures bactériennes, c’est-à-dire peu coûteux. Deuxièmement, la demande sans cesse croissante d’agents thérapeutiques a apporté avec elle les récentes avancées chez ce qu’on appelle les « omiques » (omics), rassemblant la protéomique, la génomique, la transcriptomique et la métabolomique. De ce fait, les nouvelles technologies ont su améliorer les méthodes de construction de lignées cellulaires, menant entre autres à une productivité et qualité optimales du système d’expression des cellules CHO [72].
La plupart du temps, lorsqu’on souhaite produire des immunoglobulines, on cherche à combiner des gènes murins codant pour le site de liaison à l’antigène et des gènes humains codant pour la structure de l’anticorps. On se retrouve alors avec une immunoglobuline dite « chimérique » et, dans ce cas-ci, de par ses structures partiellement humaines, également décrite comme « humanisée ». De manière plus précise, il faut cibler les gènes V(D)J régulant respectivement les régions variables, de diversité et de jonction [73] [74]. Avant d’introduire une séquence de gènes dans notre clone, il faut d’abord savoir quelle séquence ADN permet d’obtenir l’anticorps ayant la plus forte spécificité et affinité avec notre protéine cible. Trois méthodes sont couramment utilisées afin de cribler les anticorps : l’ajout de régions déterminant la complémentarité (CDR), l’ajout de régions déterminant la spécificité (SDR) et le brassage de chaînes.
Dans le premier cas, plusieurs petits cadres de lecture, comportant des chaînes invariables humaines mais des CDR murins, sont insérés dans une bibliothèque de phages qui sont employés dans technique appelée « exposition par phage » (phage-display) [75]. Le principe de cette technique est que chaque phage contient une séquence ADN codant pour un anticorps spécifique. Cette séquence est associée aux gènes d’une protéine de capside du phage, ce qui implique que l’anticorps est exprimé à la surface de ce dernier. Lorsque plusieurs phages sont créés, on peut effectuer leur criblage en les mettant en présence de notre antigène d’intérêt et en sélectionnant ceux qui s’y lient le mieux (Fig.4A). On peut alors isoler ces phages et séquencer leur ADN afin de découvrir les gènes menant à leur immunoglobuline respective [75]. Cependant, bien que la
xix
spécificité envers notre épitope soit préservée, on n’obtient pas d’humanisation à 100% puisque les CDR sont d’origine murine. Il demeure alors une certaine probabilité de reconnaissance par le système immunitaire humain.
La deuxième méthode, l’ajout de SDR, est justement employée afin de réduire le potentiel immunogénique de notre anticorps. Les SDR sont des régions faisant partie des CDR et qui interagissent directement avec l’épitope. En insérant des SDR murins bien spécifiques comportant des résidus protéiques permettant de maintenir la conformation du CDR, on obtient un anticorps avec une plus forte proportion d’origine humaine et, donc, une immunogénicité plus faible. La technique d’exposition par phage suivi d’un criblage est également de mise lorsqu’on emploie cette méthode [75].
Finalement, la dernière méthode mentionnée permet d’obtenir une immunoglobuline totalement humaine. En effet, le brassage de chaînes, tel que son nom l’indique, permet d’échanger les chaînes légères et lourdes d’origine murine par des chaînes humaines (Fig.4D). Dans un premier lieu, toujours dans une bibliothèque de phages, c’est la chaîne légère de l’anticorps qui est remplacée. Les anticorps ayant une forte spécificité et affinité envers notre épitope de choix sont sélectionnés. Ce sont ensuite leur chaîne lourde qui est échangée par une chaîne humaine. De nouveau, les anticorps subissent un criblage et seuls les meilleurs sont retenus. Cette méthode de brassage est particulièrement intéressante, car elle mime le processus naturel de construction d’anticorps par lequel les plasmocytes « testent » chacune des chaînes avant d’obtenir l’immunoglobuline finale. De plus, la production de plusieurs différents isotypes d’anticorps est essentielle dans le cadre de traitement à long terme, car les patients finissent par produire une réponse immune dirigée contre l’anticorps de traitement [76].
1.4.2 Mécanismes d’action
Les mécanismes d’action du trastuzumab impliquent des effets directs et indirects sur les cellules tumorales surexprimant HER2. Dans un premier lieu, l’anticorps se lie au sous-domaine IV de la protéine et prévient la dimérisation de cette dernière avec un autre EGFR. Il en résulte une baisse des signaux intracellulaires regroupant, rappelons-le, les voies JAK/STAT, MAPK, PI3K/Akt et NF-κB [77]. Les cellules ont donc un arrêt de leur cycle de croissance en phase G1 et l’inhibiteur p27kp1 de kinase cycline-dépendante (Cdk) est activé [78]. Cet arrêt de signaux de prolifération et de survie mène inévitablement à l’apoptose des cellules via la répression de la
xx
protéine Bcl-2 [79]. Logée au niveau de la mitochondrie, Bcl-2 prévient normalement l’apoptose en liant le facteur activateur de l’apoptose 1 (APAF-1) ainsi qu’en contrôlant la perméabilité de la membrane mitochondriale. Sa répression résulte ainsi en son retrait de la membrane, ce qui permet au cytochrome c et APAF-1 d’aller activer les pro-caspases 8, 9 et 10 [80] [81] [82] [83], trois protéines majeures impliquées dans l’initiation de l’apoptose. Leurs actions combinées mènent alors à l’activation de la caspase 3, requise pour la condensation de la chromatine et la fragmentation de l’ADN [84].
Une hypothèse veut que la reconnaissance d’HER2 par l’anticorps mène également à son internalisation puis à sa dégradation. Ceci serait possible via le recrutement et l’activation de la ligase ubiquitine c-Cbl menant à une protéolyse [85]. Bien qu’on ne sache pas encore comment cette enzyme est induite lors de la reconnaissance d’HER2 par le trastuzumab, il est dit que le récepteur serait poly-ubiquitiné par c-Cbl et mènerait à sa forte dégradation.
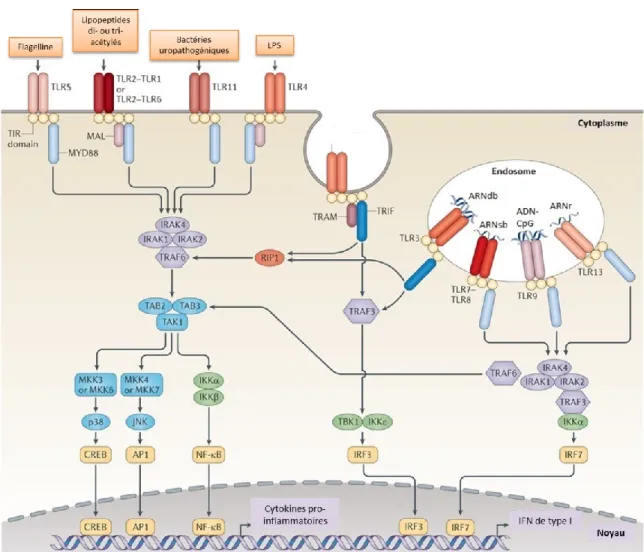
De manière indirecte, le trastuzumab agit en recrutant autant l’immunité innée qu’adaptative suite à l’opsonisation des cellules tumorales. Les patientes ayant été traitées avec cet anticorps ont démontré une plus grande infiltration lymphocytaire, mais également de plus hauts niveaux de cytotoxicité cellulaire anticorps-dépendante (ADCC). Cette infiltration est un facteur important dans le cadre du traitement du cancer du sein HER2+, tel que démontré par diverses études. Lors de l’analyse de plusieurs biopsies, une forte expression de gènes associés aux lymphocytes a été associée à un plus faible taux de récurrence chez les patientes [86]. Une autre étude fut menée afin de déterminer les facteurs moléculaires en jeux, par exemple l’angiogenèse, l’apoptose, les niveaux de réponses immunitaires, etc. Il fut découvert, chez les tumeurs HER2+, que le degré d’invasion des tumeurs est le processus moléculaire le plus important lors du pronostic [87]. Lors d’un essai clinique nommé « FinHER », il fut observé qu’une infiltration de lymphocytes augmente les effets thérapeutiques du trastuzumab. Plus en détails, cette étude indique que pour chaque augmentation de 10% d’infiltration du tissu, il y a une diminution du risque de récurrence de 18% [88]. De multiples études ont su souligner l’importance de cette cytotoxicité via l’utilisation de souris sans récepteur Fc fonctionnel ou cellule NK (natural killer), ou encore avec interféron gamma (IFN-γ) neutralisé [70] [89]. Toujours dans les premières actions de l’immunité, des études de déplétion ont permis de dévoiler l’importance des cellules dendritiques (DC) et de leurs réponses IFN de type I. En effet, des souris ne possédant pas de DC ou alors ayant le récepteur IFNAR1 bloqué ne réagissent plus
xxi
aussi bien au trastuzumab [70]. Puisque la production des IFN de type I est régulée par les TLRs, les réponses de souris génétiquement modifiées afin de ne pas exprimer la protéine adaptatrice MyD88 furent étudiées. Il s’avéra que ces animaux n’avaient pas les capacités de bien répondre à la thérapie anti-HER2. Mais encore, les TLR sont exprimés sur d’autres types cellulaires comme les monocytes/macrophages. La déplétion de ces cellules, via le ciblage de CD11b et l’utilisation de clodrolip (clodronate encapsulé dans des liposomes) [90], conclut que les effets du trastuzumab dépendent de celles-ci. De plus amples études de déplétion démontrèrent l’importance de la présence des cellules T CD8+. Leur production d’IFN-γ ainsi que leur importance au sein de l’immunité mémoire sont au cœur des effets thérapeutiques du trastuzumab [70].
Parmi les recherches effectuées au sujet de l’anticorps anti-HER2, une réduction de l’angiogenèse fut également pointée comme un mécanisme d’action important. Effectivement, le trastuzumab a su réduire la densité vasculaire au sein des tumeurs et, in vitro, la migration des cellules endothéliales. Ceci fut expliqué par une réduction de la production de facteurs pro-angiogéniques (i.e. VEGF, IL-8), alors que celle de facteurs anti-pro-angiogéniques (i.e. TSP-1) est augmentée [91].
1.4.3 Mécanismes de résistance
Bien qu’une thérapie anti-HER2 offre des effets bénéfiques chez certaines patientes, il semble que les cellules tumorales aient plus d’un tour dans leur sac. Tel que mentionné un peu plus tôt, l’inhibition d’HER2 mène à la surexpression d’HER3 à la surface cellulaire [59]. En agissant ainsi, la tumeur permet donc de garder une stimulation soutenue des voies de prolifération et de survie, incluant PI3K/Akt. De la même manière, les cellules tumorales peuvent augmenter leur expression de la mucine 4 (MUC4) qui, de par sa grosseur, créé un encombrement stérique près de HER2 qui empêche l’anticorps de rejoindre sa cible [92] [93]. Il en résulte également une inhibition de la reconnaissance immunitaire, ce qui mène ultimement à une inhibition de l’apoptose, une progression tumorale et à de possibles métastases [94]. MUC4 agit aussi en tant que ligand du récepteur HER2, activant ainsi les voies de prolifération et de survie. Suivant cette théorie, une lignée cellulaire mutante n’exprimant pas MUC4 fut décrite comme étant plus sensible au trastuzumab. Notons par contre que les niveaux d’expression d’HER2 ne sont pas corrélés d’aucune manière aux niveaux d’expression de MUC4.