Les effets de la consommation de chocolat noir riche en
polyphénols sur les composantes du syndrome
métabolique chez les femmes enceintes à risque de
prééclampsie
: sous-étude de l'essai clinique randomisé
CHOCENTA
Mémoire
Élise Lavoie Lebel
Maîtrise en épidémiologie - épidémiologie clinique - avec mémoire
Maître ès sciences (M. Sc.)
Québec, Canada
© Élise Lavoie Lebel, 2019
iii
RÉSUMÉ
Contexte
Plusieurs études suggèrent un effet bénéfique du chocolat sur les composantes du syndrome métabolique, mais ces effets chez les femmes enceintes ont été très peu évalués.
Objectifs
Évaluer les effets de la consommation de chocolat riche en flavanols et théobromine sur les composantes du syndrome métabolique chez la femme enceinte à risque de prééclampsie.
Méthodologie
131 femmes enceintes à risque de prééclampsie ont été randomisées dans le groupe expérimental (chocolat noir riche en flavanols et théobromine) ou dans le groupe contrôle (chocolat noir à faible teneur en flavanols et théobromine). Elles devaient consommer 30g de chocolat tous les jours pendant 12 semaines. Des mesures de la tension artérielle (TA), du bilan lipidique, de la glycémie, de l’insulinémie et du poids furent prises à la visite de randomisation et répétées à la semaine 12.
Résultats
Aucune interaction significative de groupe par temps ne fut observée pour la glycémie et l’insulinémie à jeun après 12 semaines. Un effet de temps significatif fut observé dans les deux groupes pour ce qui est de l’insulinémie à jeun (p<0.0001), avec des augmentations similaires à 12 semaines.
Une interaction groupe par temps significative a été observée pour les triglycérides (p=0.006), avec une détérioration plus marquée dans le groupe contrôle. Un effet de temps significatif fut observé pour les mesures de cholestérol (C)-total, C-LDL, C-HDL et du ratio C-total / C-HDL (p< 0.0001), avec une augmentation similaire dans les deux groupes. Une interaction significative de groupe par temps fut observée pour le poids (p=0.03), avec une augmentation plus marquée dans le groupe contrôle.
Conclusion
Les résultats suggèrent que la consommation de chocolat noir riche en flavanols et théobromine aurait un effet bénéfique sur la concentration de triglycérides chez les femmes enceintes à risque de prééclampsie, sans toutefois améliorer davantage la glycémie à jeun.
v
ABSTRACT
Background
Many studies suggest that dark chocolate consumption has beneficial effects on metabolic syndrome components in general population. However, there is no data in pregnant population.
Objectives
Study the effects of the consumption of chocolate rich in flavanols and theobromine on metabolic syndrome components in pregnant women at risk of preeclampsia.
Methods
131 pregnant women at risk of preeclampsia were randomized in the experimental group (HFHT chocolate) or in the control group (LFLT chocolate). These women had to eat 30g of chocolate every day for 12 weeks. Measures of blood pressure (BP), serum lipids, blood sugar, insulin and weight were done at the randomization visit and repeated at week 12.
Results
No significant group by time interaction was found in fasting glucose and fasting insulin concentrations after 12 weeks of chocolate consumption. A significant time effect was observed in fasting insulin concentrations in both HFHT and LFLT chocolate groups (p<0.0001), with similar increases in fasting insulin concentrations at 12 weeks.
A significant group by time interaction was observed for triglyceride concentrations (p=0.006), with a more pronounced deterioration in the LFLT group. Significant time effects were observed in total-C, LDL-C, HDL-C and total-C on HDL-C ratio (p< 0.0001), with similar increases in both HFHT and LFLT chocolate groups. A significant group by time interaction was noted for body weight (p=0.03), with a greater weight gain in the LFLT group.
Conclusion
Results suggest that consumption of HFHT chocolate could have beneficial effects on triglyceride concentrations in pregnant women. Our results also suggest that HFHT chocolate consumption during pregnancy in women at risk of PE does not conduct to more beneficial effect on fasting glucose concentrations compared to LFLT chocolate group.
vii
TABLE DES MATIÈRES
RÉSUMÉ ... III ABSTRACT ... V TABLE DES MATIÈRES ... VII LISTE DES TABLEAUX ... XI LISTE DES FIGURES ... XIII LISTE DES ABBRÉVIATIONS ET DES SIGLES ... XV REMERCIEMENTS ... XIX AVANT-PROPOS ... XXI
INTRODUCTION ... 1
CHAPITRE 1 ÉTAT DES CONNAISSANCES ACTUELLES ... 3
1.1. LE SYNDROME MÉTABOLIQUE ... 3
1.1.1. L’obésité et le profil lipidique ... 4
1.1.2. L’insulinorésistance ... 5
1.1.3. La tension artérielle ... 7
1.2. IMPACTS DU SYNDROME METABOLIQUE EN GROSSESSE ... 8
1.2.1. Profil lipidique ... 8
1.2.2. Le diabète gestationnel et l’insulinorésistance ... 8
1.2.3. L’hypertension gestationnelle et la prééclampsie ... 12
1.3. POLYPHÉNOLS ET MÉTHYLXANTHINE ... 15
1.3.1. Flavanols ... 15
1.3.1.1. Flavanols et risque cardiovasculaire ... 16
1.3.1.2. Flavanols et profil lipidique ... 17
1.3.1.3. Flavanols et insulinorésistance ... 18
1.3.1.4. Flavanols et tension artérielle ... 19
1.3.2. Théobromine ... 20
1.4. CHOCOLAT, PRÉÉCLAMPSIE ET COMPOSANTES DU SYNDROME MÉTABOLIQUE PENDANT LA GROSSESSE ... 20
1.4.1. Chocolat et prééclampsie ... 20
1.4.2. Chocolat et composantes du syndrome métabolique ... 21
1.4.3. Mécanismes potentiels responsables des effets des flavonoïdes ... 22
1.4.3.1. Effets sur la fonction endothéliale ... 22
1.4.3.2. Effets sur la fonction plaquettaire... 23
1.4.3.3. Effets sur le profil lipidique ... 24
1.4.3.4. Effets sur l’insulinorésistance et la tension artérielle ... 24
1.4.4. Biomarqueurs de la consommation de chocolat ... 24
CHAPITRE 2 HYPOTHÈSES ET OBJECTIFS DE RECHERCHE ... 25
2.1. HYPOTHÈSES... 25
2.1.1. Hypothèse nulle ... 25
2.1.2. Hypothèse alternative ... 25
2.2. OBJECTIFS DE RECHERCHE... 25
2.2.2. Objectif secondaire ... 25 CHAPITRE 3 MÉTHODOLOGIE ... 27 3.1. TYPE D’ÉTUDE ... 27 3.2. POPULATION À L’ÉTUDE ... 27 3.3. RECRUTEMENT ... 28 3.4. RANDOMISATION ... 28 3.5. INTERVENTION... 28
3.5.1. Description du groupe expérimental et du groupe contrôle ... 29
3.6. COLLECTE DES DONNÉES ET VARIABLES ... 30
3.6.1. Issues principales ... 31
3.6.1.1. Tension artérielle ... 32
3.6.1.2. Profil lipidique ... 32
3.6.1.3. Glycémie et insulinémie ... 32
3.6.1.4. Biomarqueurs de la consommation de chocolat ... 32
3.6.1.5. Évaluation des effets secondaires ... 33
3.6.2. Co-interventions et co-variables documentées durant le suivi ... 33
3.7. ANALYSES STATISTIQUES ... 33
3.8. TAILLE D’ÉCHANTILLON ET PUISSANCE STATISTIQUE ... 34
3.9. CONSIDÉRATIONS ÉTHIQUES ... 34
3.9.1. Risques et effets secondaires ... 34
3.9.2. Avantages et inconvénients reliés au projet ... 34
3.9.3. Confidentialité des données ... 35
3.9.4. Conditions de participation ou de retrait au projet ... 36
3.10. ÉQUIPE DE RECHERCHE ET RETOMBÉES ATTENDUES ... 36
CHAPITRE 4 INSERTION D’ARTICE ... 37
4.1. TITRE ORIGINAL ... 37 4.2. RÉSUMÉ EN FRANÇAIS ... 37 4.2.1. Contexte ... 37 4.2.2. Objectifs ... 37 4.2.3. Méthodologie ... 37 4.2.4. Résultats ... 38 4.2.5. Conclusion ... 38
4.3. RÉSUMÉ DANS LA LANGUE DE RÉDACTION DE L’ARTICLE ... 38
4.3.1. Background ... 38 4.3.2. Objective ... 38 4.3.3. Methods ... 39 4.3.4. Results ... 39 4.3.5. Conclusion ... 39 4.4. CORPS DE L’ARTICLE ... 39 4.4.1. Background ... 39 4.4.2. Methods ... 41 4.4.2.1. Study design ... 41 4.4.2.2. Population ... 41 4.4.2.3. Randomization ... 41 4.4.2.4. Intervention ... 41 4.4.2.5. Outcomes ... 42 4.4.2.6. Measurements ... 42
ix
4.4.2.7. Statistical analyses and sample size ... 43
4.4.2.8. Attrition, blinding and contamination bias ... 44
4.4.3. Results ... 44
4.4.3.1. Characteristics of the participants ... 44
4.4.3.2. Changes in lipid profile (Table 6) ... 45
4.4.3.3. Changes in glucose homeostasis (Table 6) ... 45
4.4.3.4. Changes in blood pressure ... 45
4.4.3.5. Changes in weight and BMI (Table 6) ... 45
4.4.3.6. Plasma epicatechin and catechin concentrations ... 46
4.4.3.7. Polyphenols food frequency questionnaire ... 46
4.4.3.8. Compliance ... 46
4.4.3.9. Retrospectives analyses in lipid changes according to epicatechin and theobromine plasma concentrations ... 46
4.4.4. Discussion ... 47
4.4.5. Conclusion ... 50
4.4.6. Acknowledgments ... 50
4.4.7. Disclosure of interest ... 50
4.5. TABLES AND FIGURES ... 51
CHAPITRE 5 DISCUSSION ... 63
CONCLUSION ... 69
BIBLIOGRAPHIE ... 71
xi
LISTE DES TABLEAUX
Tableau 1 - Définitions du syndrome métabolique ... 3
Tableau 2 - Critères diagnostiques du pré-diabète28 ... 6
Tableau 3 - Changements normaux du profil lipidique en grossesse33 ... 8
Tableau 4 - Classification des troubles hypertensifs de la grossesse44 ... 12
Tableau 5 - États indésirables et complications graves de la prééclampsie ... 13
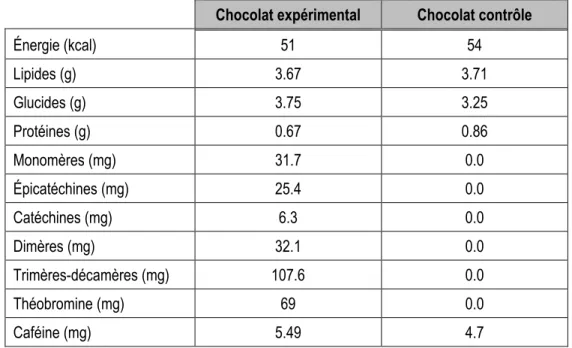
Tableau 6 - Composition des barres de chocolat (pour 10g) ... 29
Tableau 7 - Description des rencontres ... 30
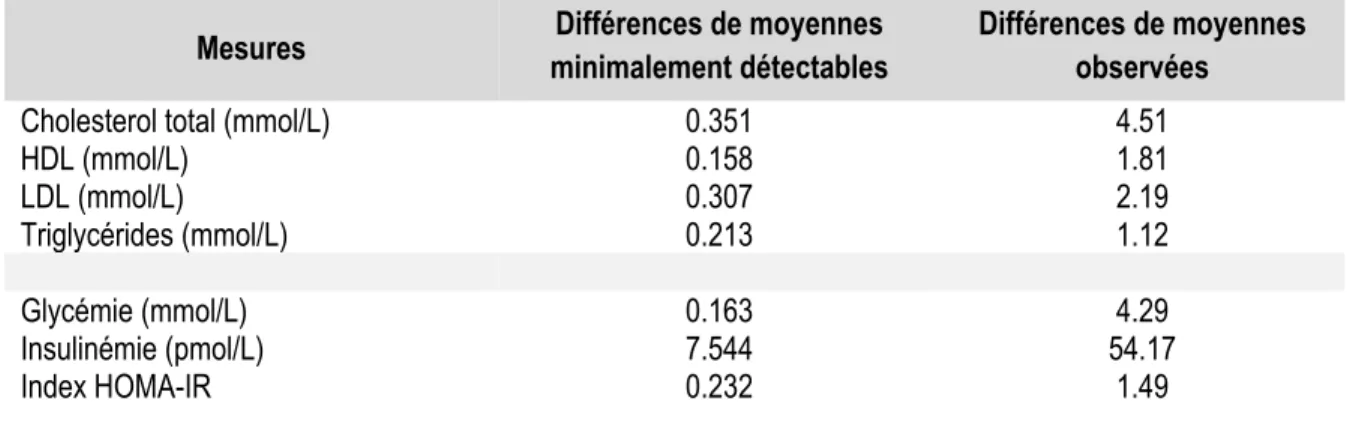
Tableau 8 - Différences de moyennes minimalement détectables ... 34
Tableau 9 - Différence entre les deux groupes pour le FFQ en polyphénols ... 67
Table 1 - Chocolate composition (10 g) ... 51
Table 2 - Minimal detectable differences in means ... 53
Table 3 - Changes in plasma biomarkers after 12 weeks of chocolate consumption ... 54
Table 4 - Demographic characteristics of women from HFHT and LFLT chocolate groups ... 55
Table 5 - Baseline anthropometric and metabolic characteristics of women from HFHT and LFLT chocolate groups ... 56
Table 6 - Changes in metabolic syndrome components in women from HFHT and LFLT chocolate groups... 57
Table 7 - Difference between the 2 groups in the polyphenols food frequency questionnaire ... 59
xiii
LISTE DES FIGURES
Figure 1 - Incidence du diabète par rapport au nombre de critères27 ... 5
Figure 2 - Algorithme de diagnostic de l’hypertension pour adultes32 ... 7
Figure 3 - Diagnostic du diabète gestationnel34 ... 10
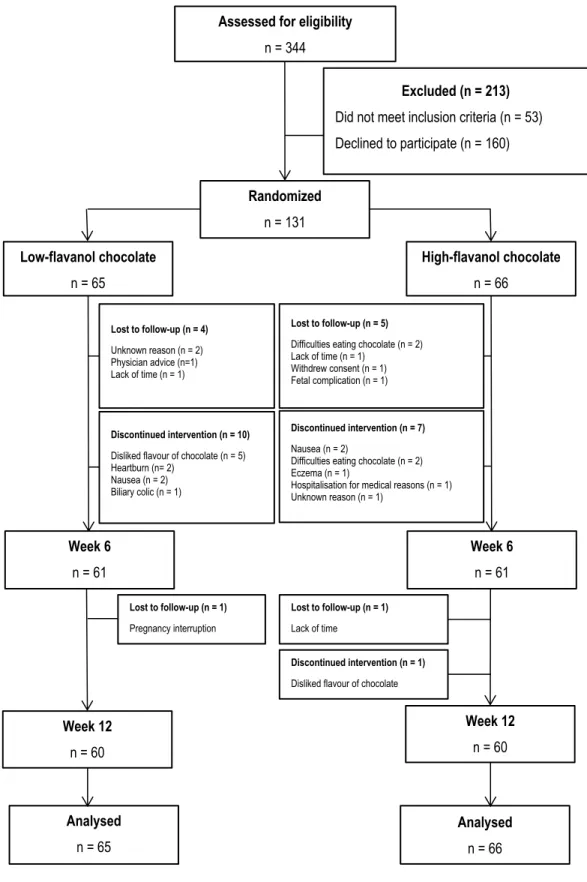
Figure 1 - Flow diagram of study participants ... 52
Figure 2 - Changes in lipid profile according to plasma theobromine concentrations ... 61
xv
LISTE DES ABBRÉVIATIONS ET DES SIGLES
AGJ : Anomalies de la glycémie à jeunBMI : Body mass index CT : Cholestérol total
ECR : Essai clinique randomisé FE : Fonction endothéliale
FFQ : Food frequency questionnaire GSJ : Glucose sérique à jeun
HbA1c : Hémoglobine glyquée
HDL : High-density lipoprotein
HFHT : High flavanol high theobromine HFLT : High flavanol low theobromine HGOP : Hyperglycémie orale provoquée
HOMA-IR : Homeostasis Model Assessment of Insulin Resistance HTA : Hypertension artérielle
IDL : Intermediate density lipoprotein IG : Intolérance au glucose
IMC : Indice de masse corporelle
INAF : Institut sur la nutrition et les aliments fonctionnels INSPQ : Institut national de santé publique du Québec ISJ : Insuline sérique à jeun
LDL : Low-density lipoprotein
LFHT : Low flavanol high theobromine LFLT : Low flavanol low theobromine
NCEP-ATP III : National Cholesterol Education Program Adult Treatment Panel NO : Oxyde nitrique
OMS : Organisation mondiale de la santé
PECH : Programme Éducatif Canadien sur l’Hypertension PI : Pulsatility Index
RCIU : Retard de croissance intra-utérin SM : Syndrome métabolique
SOGC : Société des Obstétriciens-gynécologues du Canada TA : Tension artérielle
TAD : Tension artérielle diastolique TAM : Tension artérielle moyenne TAS : Tension artérielle systolique TG : Triglycérides
Total-c : Total cholesterol
UtA PI : Uterine artety pulsatility index VLDL : Very low density lipoprotein VPN : Valeur prédictive positive VPP : Valeur prédictive négative
xvii
In every job that must be done, there is an
element of fun.
- Julie Andrews, Mary Poppins (1964) -
À ma mère, qui a su me transmettre
le goût de la recherche,
du dépassement de soi
et de la rigueur.
xix
REMERCIEMENTS
Tout d’abord, je tiens à remercier Dre Sylvie Dodin et Vicky Leblanc pour l’aide apportée pendant toutes ces années. Dre Dodin, vous avez continué de me suivre malgré toutes les embuches, la résidence, le congé de maternité, et j’en passe. Vicky, vous vous êtes jointe plus tard, mais je n’y serais pas arrivée sans vos commentaires, vos corrections, les analyses supplémentaires, et bien plus encore. J’ai été choyée de pouvoir travailler avec vous deux, et avec toute notre équipe. Un merci tout spécial à Claudine Blanchet et Carole Thiebaut qui ont rendu mon été de recherche et mon année à l’INAF encore plus agréable.
Finalement, je voudrais aussi remercier mon mari qui m’a encouragée à finaliser ce projet de longue haleine et ma mère qui, malgré les 4000 km qui nous séparent, m’a poussée vers la recherche et m’a inculqué le sens de la discipline.
xxi
AVANT-PROPOS
L’article présenté dans ce mémoire sera soumis à la revue Clinical Nutrition. Les tableaux, figures et références sont numérotés différemment dans ce mémoire afin de faciliter l’insertion de l’article. L’auteure de ce mémoire est également l’auteure principale de l’article qui y est inséré. Les coauteurs sont Vicky Leblanc1, Yves
Giguère2,3, Asma Babar1,4, Isabelle Marc2, Simone Lemieux1, Abdous Belkacem2, Emmanuel Bujold2,4, Elhadji
Anassour Laouan Sidi2, Laurent Bazinet1,5, et Sylvie Dodin1,2,4.
1Institut sur la Nutrition et les Aliments Fonctionnels, Université Laval, Québec, Canada.
2Centre de recherche, Centre hospitalier universitaire de Québec, Québec, Canada.
3Département de biologie moléculaire, de biochimie médicale et de pathologie, Université Laval, Québec,
Canada.
4Départment d’obstétrique, de gynécologie et de reproduction, Université Laval, Québec, Canada.
1
INTRODUCTION
Le syndrome métabolique (SM) est un ensemble de dérèglements métaboliques, dont une augmentation du tour de taille, une diminution des HDL sériques, une augmentation des triglycérides (TG), une hypertension
artérielle ainsi qu’une résistance à l’insuline1. Chez la femme enceinte, ces différents éléments revêtent une
importance particulière.
L’obésité maternelle et l’hypercholestérolémie influenceraient le développement fœtal, et prédisposerait le nouveau-né aux maladies cardiovasculaires2-4. Selon les données animales, l’hypercholestérolémie chez la
mère pourrait contribuer à une hypoglycémie chez le nouveau-né ainsi qu’à un petit poids à la naissance5.
D’autre part, l’hypertension gestationnelle complique environ 8% de l’ensemble des grossesses et augmente de 5 fois le risque de mortalité périnatale6. Le quart des femmes présentant une hypertension artérielle gravidique
développera une prééclampsie7.
Selon Diabète Canada (anciennement Association canadienne du diabète), le diabète gestationnel compliquerait de 3 à 20 % des grossesses, tout dépendant des facteurs de risque maternels ou des critères diagnostics utilisés. Le rapport de surveillance de l’Institut national de santé publique du Québec (INSPQ) publié
en 20178 fait état de l’évolution de la prévalence du diabète gestationnel au Québec de 1989 à 2012, ainsi que
des caractéristiques démographiques et des complications médicales qui y sont associées. Selon ce rapport, la prévalence de l’exposition des nouveau-nés au diabète gestationnel a presque triplé entre 1989 et 2012, passant de 24,7 à 75,5 pour 1 000 naissances. Cette condition est associée à de nombreuses complications, autant maternelles (augmentation du taux de césarienne, risque augmenté de développer un diabète de type 2 à long
terme) que fœtales (hypoglycémie à la naissance, macrosomie)9.
Plusieurs études réalisées dans différentes populations n’incluant pas de femmes enceintes suggèrent que les flavonoïdes auraient un effet bénéfique sur différentes composantes du syndrome métabolique. Une quantité importante de ces flavonoïdes est retrouvée dans le chocolat (catéchine, épicatéchine, procyanidine). Deux méta-analyses observent des effets positifs sur le taux de HDL et de LDL10,11. L’index HOMA-IR serait également
diminué lors de la prise de chocolat, comme le suggère les résultats de deux méta-analyses10,12, et l’insulinémie
à jeun et après un test de stimulation au glucose pourrait également être favorablement affectée10. Finalement,
les auteurs de 3 méta-analyses ont conclu à un effet bénéfique de la consommation de chocolat sur la tension artérielle (TA)13-15.
Le beurre de cacao, un gras dérivé des plantes de cacao majoritairement retrouvé dans le chocolat noir, contient en moyenne 33% d’acide stéarique, un acide gras saturé 18-C à chaîne longue. Bien que les gras saturés aient longtemps été associés avec le développement de l’athérosclérose, une méta-analyse de 60 essais cliniques
randomisés conclut que l’acide stéarique n’abaisse pas les HDL et n’augmente pas non plus les LDL ou le cholestérol total16. Aussi, un essai clinique récent montre qu’une prise quotidienne de 2 carrés de chocolat noir
(200 kcal, 12g de gras) pendant 4 semaines réduit significativement le cholestérol total et les LDL, sans affecter
significativement le poids17. Ces deux études ont été réalisées dans des populations n’incluant pas de femmes
enceintes.
Peu d’études cliniques ont vérifié les effets du chocolat sur les composantes du syndrome métabolique chez les femmes enceintes. Les résultats d’un essai clinique de faible qualité méthodologique (absence de randomisation, d’aveuglement et de groupe placebo) suggèrent toutefois une diminution de la tension artérielle systolique (TAS) et de la glycémie18 sans effet sur le bilan lipidique et le poids comparativement à un groupe de
femmes enceintes suivies en parallèle qui étaient libres d’augmenter leur apport calorique avec des aliments de leur choix. Selon des travaux plus récents, une consommation de chocolat riche en flavanols, tout en contrôlant pour le poids, réduirait la résistance à l’insuline qui se traduit par une baisse de la glycémie et de l’insulinémie19.
En résumé, les résultats des études réalisées chez les femmes enceintes et portant sur les effets de la consommation de chocolat riche en flavanols sur les composantes du syndrome métaboliques sont peu nombreux et contradictoires, ceci sans compter que leur interprétation est limitée par plusieurs faiblesses méthodologiques. Les données en lien avec les composantes du syndrome métabolique recueillies dans le cadre de notre essai clinique randomisé dont l’objectif principal était de vérifier l’effet de la consommation de chocolat riche en flavanols et en théobromine sur la fonction endothéliale des femmes enceintes à risque de prééclampsie seront explorées dans le cadre de ce mémoire de maitrise.
3
CHAPITRE 1 ÉTAT DES CONNAISSANCES
ACTUELLES
1.1. Le syndrome métabolique
Le syndrome métabolique (SM) est un ensemble de dérèglements métaboliques associés à des désordres primaires du tissu adipeux. Une inactivité physique combinée à un régime hypercalorique et une susceptibilité génétique entraînent une accumulation anormale de gras viscéral. Cette augmentation de la masse adipocytaire viscérale agit comme un organe en soi et communique avec les autres systèmes via une augmentation de l’activité des cytokines inflammatoires. Il en résulte une augmentation du tour de taille, une diminution des HDL sériques, une augmentation des triglycérides, une hypertension artérielle ainsi qu’une résistance à l’insuline1.
Ces 5 paramètres furent pris en compte par l’OMS et le NCEP-ATP III qui ont respectivement établi des critères diagnostiques du syndrome métabolique en 1999 et en 2001. Les critères du NCEP-ATP III ont par la suite été mis à jour par l’American Heart Association and the National Heart Lung and Blood Institute en 2005. Ces derniers sont les plus souvent utilisés20.
Tableau 1 - Définitions du syndrome métabolique
OMS (1998)1 NCEP-ATP III (2005)21
Critère requis
Résistance à l’insuline (inclus l’intolérance au glucose, l’anomalie de la glycémie à jeun, et le diabète de type 2)
Autres critères ≥2 des 5 critères suivants ≥3 des 5 critères suivants
Obésité
Obésité centrale :
Femmes : taille/hanches >0.85 Hommes : taille/hanches >0.90 Et/ou IMC > 30 kg/m2
Femmes : circonférence taille >88 cm Hommes : circonférence taille >102 cm
Glycémie à jeun (mmol/L) ≥5.5 mmol/L (100 mg/dL)
Et/ou médication Triglycérides (mmol/L) ≥1.7 mmol/L (150 mg/dL)
Et/ou médication ≥1.7 mmol/L (150 mg/dL) Et/ou médication HDL-C (mmol/L) Femmes : <1.0 mmol/L (39 mg/dL) Hommes : <0.9 mmol/L (35 mg/dL) Et/ou médication Femmes : <1.29 mmol/L (50 mg/dL) Hommes : <1.03 mmol/L (40 mg/dL) Et/ou médication
Hypertension (mmHg) ≥ 140/90 TAS >130 ou TAD >85
Et/ou médication
Microalbuminurie Taux d’excrétion urinaire ≥20 μg/min ou
1.1.1.
L’obésité et le profil lipidique
L’OMS définit l’obésité comme étant un indice de masse corporelle (IMC = poids (kg)/Taille (m)2) de 30 kg/m2
et plus, tandis qu’un surpoids réfère à un IMC entre 25 et 29.9 kg/m2. Une limitation de ces valeurs est toutefois
présente chez les personnes ayant une grande masse musculaire, mais la majorité des individus ayant un IMC entre 25 et 29.9 ont un excès de graisse22.
Le lien entre les risques cardiovasculaires et l’obésité remontent à une étude publiée en 1947 par Vague. Il y faisait entre autres la première définition de ce qu’est une distribution androïde ou gynoïde des graisses, correspondant respectivement à une distribution centrale versus périphérique. C’est à partir de ces recherches que l’obésité androïde est considérée comme étant le principal contributeur aux risques cardiovasculaires23.
Toujours en se basant sur ces données, un lien entre l’obésité et chaque composante du syndrome métabolique a été défini. Ainsi, l’état d’hyperinsulinémie serait dû à une augmentation de la sécrétion pancréatique d’insuline
secondaire à l’état de résistance à l’insuline24, état plus communément retrouvé chez les personnes obèses (le
lien entre les facteurs de risque métaboliques et la résistance à l’insuline ne sont toutefois pas encore pleinement
compris de nos jours)22, mais aussi à une diminution de l’extraction hépatique de l’insuline secondaire à une
augmentation de la concentration de testostérone libre25. Nous savons aujourd’hui que la graisse abdominale
est plus active métaboliquement comparativement à la graisse périphérique. Il y aurait donc plus de lipolyse, une augmentation de la production des acides gras libres et donc une augmentation des triglycérides sanguins26.
On retrouve 3 classes plus importantes de lipoprotéines, les LDL (low density lipoprotein), les HDL (high density lipoprotein) et les VLDL (very low density lipoprotein). La classe des IDL (intermediate density lipoprotein), qui se situe entre les VLDL et les LDL, est incluse en clinique dans la mesure des LDL. Les LDL contiennent une seule apolipoprotéine, nommée apolipoprotéine B-100 (apo B), lipoprotéine la plus athérogénique, donc celle la plus ciblée par les thérapies anti-cholestérol. Les VLDL sont des lipoprotéines riches en triglycérides et sont constituées de l’apo B-100, des apo C (C-I, C-II et C-III) et de l’apo E. Elles sont produites par le foie et sont les précurseurs des LDL. Une troisième classe de lipoprotéines, les chylomicrons, est également riche en triglycérides. Ils sont formés dans l’intestin à partir des aliments riches en gras de l’alimentation. Les apolipoprotéines des chylomicrons sont les mêmes que celles des VLDL, excepté pour l’apo B-100 qui est
remplacée par l’apo B-48. Lorsque dégradées, ces molécules comportent également un risque athérogénique22.
Les HDL sont constituées de l’apo A-I et de l’apo A-II, mais non d’Apo B, et leur taux sanguin est inversement proportionnel au risque cardiovasculaire.
5
1.1.2.
L’insulinorésistance
Selon les critères du NCEP, une hausse de la glycémie à jeun n’est pas nécessaire à la définition du syndrome métabolique. Cependant, selon l’étude WOSCOP, le syndrome métabolique est un bon indicateur d’un stade pré-diabétique, puisqu’on y établit un lien clair entre le nombre de facteurs de risque du syndrome métabolique et le risque de développer un diabète. Ainsi, le risque de diabète sur 5 ans passe de 2% en présence de 2 critères sur 5 à près de 12% en présence de 4 critères sur 5 (figure 1)27.
Figure 1 - Incidence du diabète par rapport au nombre de critères27
Dans son rapport paru en 1999, l’OMS établit une marche à suivre dans le diagnostic du diabète. D’abord, un diabète ne devrait jamais être diagnostiqué sur la base d’une seule valeur anormale de glycémie chez une personne ne présentant pas les symptômes classiques (fatigue, perte de poids, polyurie, polyphagie, polydipsie). Au moins une autre valeur anormale, qu’elle soit à jeun, au hasard ou suite à une hyperglycémie orale provoquée (HGOP), devra être obtenue. L’HGOP est surtout utilisée dans les cas où la glycémie au hasard varie dans un intervalle de valeurs indéterminées, et que la glycémie à jeun, elle, est en-dessous des valeurs permettant le diagnostic d’un diabète. Le test consiste à mesurer la glycémie à jeun, puis 2hrs après l’ingestion de 75 g de glucose. Un autre indicateur utilisé est l’hémoglobine glyquée (HbA1c), qui elle représente la glycémie
moyenne sur plusieurs semaines.
Selon les lignes directrices de Diabète Canada28, les valeurs utilisées pour le diagnostic du diabète sont les
suivantes :
Glycémie à jeun ≥ 7.0 mmol/L
À jeun = aucun apport calorique depuis au moins 8 heures ou
HbA1c ≥6.5%
Ne pas utiliser si diabète de type 1 suspecté ou
Glycémie aléatoire ≥ 11.1 mmol/L
Aléatoire = à tout moment de la journée, sans égard au moment du dernier repas
ou
Glycémie deux heures après l’ingestion de 75 g de glucose ≥ 11.1 mmol/L
Les lignes directrices de Diabète Canada établissent également un stade appelé pré-diabète qui inclut les anomalies de la glycémie à jeun (AGJ) et l’intolérance au glucose (IG). Les personnes présentant de telles anomalies, surtout dans un contexte de syndrome métabolique, courent un risque accru de maladies cardiovasculaires, mais ne sont pas exposées aux risques de microangiopathies diabétiques. L’IG serait plus étroitement liée aux maladies cardiovasculaires, tandis que les personnes présentant ces deux paramètres anormaux, elles, développeront plus souvent un diabète, tout en étant à risque de maladie cardiovasculaire. Les valeurs établies sont listées dans le tableau 2.
Tableau 2 - Critères diagnostiques du pré-diabète28
Tests Résultats Catégorie de pré-diabète
Glycémie à jeun (mmol/L) 6.1-6.9 AGJ
Glycémie 2h post HGOP 75g (mmol/L) 7.8-11.0 IG
HbA1c (%) 6.0-6.4 Pré-diabète
L’index HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) est l’outil le plus simple et le plus communément utilisé pour estimer la résistance à l’insuline 29. L’index est calculé à l’aide d’une formule utilisant
les valeurs de glucose sérique à jeun (GSJ) et d’insuline sérique à jeun (ISJ), le lien entre ces deux paramètres ayant été établi il y a de cela environ 40 ans. En effet, une augmentation du niveau d’insuline sérique à jeun correspond à une augmentation du degré de résistance à l’insuline30. La formule utilisée est la suivante 29 :
7 HOMA-IR = (ISJ ( mU mL))×(GSJ( mmol L )) 22,5
Ainsi, si le patient présence un index > 5,9, ou encore un index entre 2,8 et 5,9 avec un taux de HDL < 1,3 mmol/L (51 mg/dL), cela prédit avec une assez bonne spécificité et une bonne sensibilité la présence de résistance à l’insuline (SE : 89%, SP : 67%)31.
1.1.3. La tension artérielle
Depuis 1999, Hypertension Canada (anciennement le Programme Éducatif Canadien sur l’Hypertension, PECH) publie ses recommandations annuelles en matière d’hypertension. Ces lignes directrices32 établissent les
valeurs diagnostiques de l’hypertension utilisées au Canada, les plus récentes datant de 2018. La démarche diagnostique est présentée dans la figure 2.
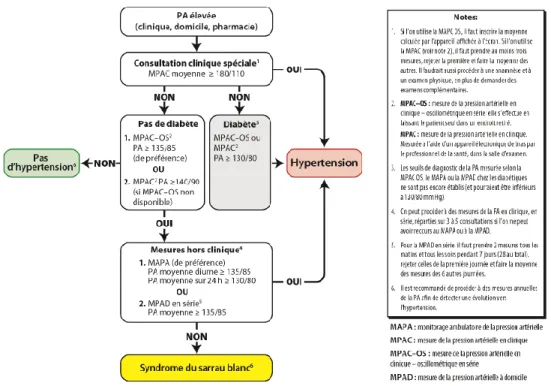
Figure 2 - Algorithme de diagnostic de l’hypertension pour adultes32
Pour une prise adéquate de la tension, il est important d’utiliser un appareil homologué, de respecter la technique recommandée par Hypertension Canada, et de prendre 3 mesures avec une moyenne faite avec les valeurs 2 et 3. Si applicable, il faut également dépister les atteintes macrovasculaires d’organes cibles (maladie vasculaire cérébrale, rétinopathie hypertensive, dysfonction ventriculaire gauche, coronaropathie), rechercher les facteurs de risque de maladie, néphropathie ou artériopathie oblitérante périphérique, et rechercher les facteurs de risque
cardiovasculaires (sédentarité, mauvaise alimentation, obésité abdominale, dysglycémie, tabagisme, dyslipidémie, stress ou non-observance médicamenteuse).
1.2. Impacts du syndrome métabolique en grossesse
1.2.1. Profil lipidique
L’obésité maternelle, l’hypercholestérolémie et le diabète influencent négativement le développement fœtal et prédisposent le nouveau-né aux maladies cardiovasculaires. En effet, une augmentation des stries lipidiques dans l’aorte de fœtus humains prématurés ainsi qu’une plus grande athérogenèse durant l’enfance sont associées à une hypercholestérolémie maternelle. Ces associations ont été établies grâce à des modèles animaux, mais concordent avec les données épidémiologiques chez l’humain2-4. On croit également que
l’hypercholestérolémie chez la mère pourrait contribuer à une hypoglycémie chez le nouveau-né et à un petit poids à la naissance en se fiant à un modèle animal5. Toutefois, l’utilisation de statine étant contre-indiquée en
grossesse, une emphase devra être portée afin d’identifier des cibles potentielles d’intervention en ce qui a trait au traitement de l’hypercholestérolémie chez la femme enceinte.
En grossesse, une augmentation du cholestérol total, des LDL, des VLDL et des triglycérides est normalement observée au courant des trimestres 1 à 3. La concentration des HDL quant à elle augmente normalement au courant des 2 premiers trimestres, puis diminue lors du troisième trimestre. Ces changements du profil lipidique ne nécessitent aucune intervention et les valeurs normales sont présentées dans le tableau 3.
Tableau 3 - Changements normaux du profil lipidique en grossesse33
Adulte non-enceinte 1er trimestre 2e trimestre 3e trimestre
Cholestérol total (mmol/L) <5.18 3.65 - 5.44 4.56 - 7.74 5.67 - 9.04
HDL (mmol/L) 1.04 - 1.55 1.04 - 2.02 1.35 - 2.25 1.24 - 2.25
LDL (mmol/L) <2.59 1.55 - 3.96 1.99 - 4.77 2.62 - 5.80
VLDL (mmol/L) 0.16 - 1.04 0.26 - 0.47 0.34 - 0.60 0.54 - 0.93
Triglycérides (mmol/L) <1.69 0.45 – 1.80 0.85 – 4.32 1.48 – 5.12
1.2.2. Le diabète gestationnel et l’insulinorésistance
Selon Diabète Canada34, le terme diabète gestationnel désigne un type de diabète qui est diagnostiqué pour la
première fois ou qui commence lors de la grossesse. Cette définition s’applique, que la patiente ait besoin d’un traitement pharmacologique ou qu’elle ait seulement besoin de modifier sa diète, ou encore si la condition persiste ou non après l’accouchement. Une intolérance au glucose précédant la grossesse et n’ayant pas été
9
diagnostiquée n’est toutefois pas exclue dans cette définition. Aussi, les femmes ayant souffert de diabète gestationnel devront être reclassées dans une des catégories habituelles d’intolérance au glucose chez l’adulte 6 à 12 semaines après l’accouchement au moyen d’une hyperglycémie orale provoquée (HGOP) 75g. Dans la majorité des cas, les résultats de glycémie rentreront à la normale9,35.
Selon les lignes directrices publiées par Diabète Canada en 201834, toutes les femmes enceintes qui ne sont
pas connues pour un diabète préexistant devraient systématiquement être dépistées entre la 24e et la 28e
semaine de gestation. L’approche la plus utilisée est le test de provocation du glucose (TPG). On y mesure le glucose plasmatique une heure après l’ingestion d’une charge de 50g de glucose pur dilué dans 150mL de liquide. Si après une heure le taux de glucose plasmatique est de 7,8 mmol/L ou plus, une hyperglycémie orale provoquée (HGOP) est indiquée en tant que test diagnostic. Si le taux de glucose plasmatique d’une heure est de 11,1 mmol/L ou plus, on peut alors poser le diagnostic de diabète gestationnel sans faire d’autres tests. Le test diagnostic recommandé par Diabète Canada est l’HGOP 75g. Les valeurs diagnostiques sont résumées dans la figure 3.
Chez les femmes à risque élevé de diabète de type 2 non-diagnostiqué, un dépistage précoce avant 20 semaines de grossesse est recommandé. Les facteurs de risque sont les suivants : âge maternel de 35 ans et plus, groupe ethnique à risque élevé (origine africaine, arabe, asiatique, hispanique, amérindienne, ou sud-asiatique), utilisation de corticostéroïdes, IMC ≥30kg/m2, pré-diabète, diabète gestationnel lors d’une grossesse
précédente, nouveau-né pesant plus de 4kg, histoire familiale de diabète de type 2 chez un frère, une sœur, ou un parent, syndrome des ovaires polykystiques ou acanthosis nigricans. Diabète Canada suggère la mesure de l’HbA1c, ou encore de la glycémie à jeun chez les femmes ayant une hémoglobinopathie ou une maladie rénale
pouvant affecter la mesure de l’HbA1c. Une HbA1c ≥6.5% ou une glycémie à jeun ≥7.0 mmol/L confirment le
diagnostic de diabète gestationnel. Si ces tests sont négatifs, le dépistage sera répété entre la 24e et 28e
Figure 3 - Diagnostic du diabète gestationnel34
Le diagnostic et le traitement adéquat du diabète gestationnel présentent plusieurs avantages au niveau périnatal. Cela permet entre autres la réduction du taux de macrosomie et de dystocie des épaules, une diminution des complications métaboliques néonatales immédiates liées à l’hyperglycémie maternelle et la prévention des effets à long terme du diabète gestationnel, tant chez la mère que chez l’enfant35.
Il n’existe pas de lignes directrices claires quant à l’utilisation de l’index HOMA-IR pour la prédiction du risque d’insulinorésistance chez la femme enceinte. On se rappelle que chez l’adulte, un index > 5,9, ou entre 2,8 et 5,9 avec un taux de HDL < 51 mg/dL ou 1,3 mmol/L prédit avec une bonne spécificité et une bonne sensibilité
une résistance à l’insuline31. Quelques études suggèrent toutefois des valeurs de référence chez la femme
enceinte. Une première étude réalisée au Japon en 2006 s’est intéressée aux valeurs de l’index chez les femmes présentant une tolérance normale au glucose ayant un poids normal et un surpoids et chez celles présentant
un diabète gestationnel à chaque trimestre de grossesse36. Selon cette étude, les valeurs de HOMA-IR sont
significativement plus élevées chez les femmes en surpoids avec une tolérance normale et chez celles ayant un diabète gestationnel que chez les femmes avec un poids normal. Aussi, le HOMA-IR avait tendance à augmenter au fil de la grossesse chez les patientes avec diabète gestationnel, mais pas chez les autres. Ainsi, ils ont établi qu’un index à 1.75 au premier trimestre (SE : 62.5%, SP : 79.8%, VPP : 22.7%, VPN : 95.7%) suggérerait la présence de diabète gestationnel. Les auteurs ont également observé des valeurs médianes de 1.92, 2.09 et 3.18 aux trimestres 1, 2 et 3 respectivement chez les femmes avec un diabète gestationnel.
11
Toutefois, ils n’ont pas suivi le même groupe du premier au troisième trimestre, mais ont plutôt formé trois groupes de femmes, un groupe pour chaque trimestre.
Dans une seconde étude menée en Grèce en 2007, une cohorte de femmes de poids normal sans diabète gestationnel a été suivie du premier au troisième trimestre37. Les résultats suggèrent que la résistance à
l’insuline augmente au fil de la grossesse chez l’échantillon recruté (valeurs médianes (25e – 75e intervalle
interquartile) : 1.9 (1.4-2.6) au premier trimestre, 1.8 (1.5-3.8) au second et 3.7 (2.8-4.7) au troisième). Les auteurs n’ont pas déterminé de valeurs seuil du HOMA-IR.
Une étude turque de 2008 s’est penchée sur l’index HOMA-IR et la valeur pouvant être utilisée pour
diagnostiquer un diabète gestationnel au premier trimestre38. Dans cette étude prospective à double insu, le
HOMA-IR a été mesuré chez 267 patientes entre la 10e et la 14e semaine de grossesse et un test d’HGOP a
été réalisé entre 24 et 28 semaines. Une valeur de référence de 2.60 (SE : 100%, SP : 94%, VPP : 82%, VPN : 100%) a ainsi été établie.
Paradisi et al. en 2010 ont pour leur part établi qu’une valeur de 1.24 au premier trimestre (RR = 14.12; 95% IC = 1.79 – 110.98) représentait un facteur de risque significatif de diabète gestationnel39.
Les auteurs d’une étude japonaise, réalisée cette fois en 2011, ont divisé les valeurs de l’index en quartiles (≤0.50, 0.51 – 0.74, 0.75 – 1.02, ≥1.03)40. Des rapports de cote de 1.09 (95% IC : 0.56 – 2.13), 1.36 (95% IC :
0.71 – 2.59) et 2.23 (95% IC : 1.19 – 4.19) pour les quartiles 2,3 et 4 respectivement ont été calculés. Les patientes du 4e quartile avait un risque presque 2 fois plus élevé (95% IC : 1.20 – 3.08) que celles des quartiles
plus bas de développer un diabète gestationnel.
Finalement, deux études furent menées en 2012, une en Inde41 et la seconde en Slovénie42. La première, par
Grewal et al, établit une valeur de référence à 1.17 (SE : 73.3%, SP : 61.6%) au premier trimestre. La seconde, par Skvarca et al, a établi au début de l’analyse une valeur de référence de 2.0 pour identifier une résistance à l’insuline. Dans cette dernière étude, 74 femmes enceintes étaient divisées en trois groupes, soit celles avec une tolérance au glucose normale, celles avec une intolérance au glucose et celles avec un diabète gestationnel. Leurs critères diagnostiques étaient basés sur un test d’HGOP à jeun utilisant 100g de glucose avec des mesures prises à jeun, 60 minutes, 120 minutes, et 180 minutes suivant l’ingestion. Les valeurs seuils établies étaient de ≥5.3 mmol/L à jeun, ≥10.0 mmol/L après 60 minutes, ≥8.6 mmol/L après 120 minutes, et ≥7.8 mmol/L après 180 minutes. Ainsi, un diagnostic d’intolérance au glucose était posé en présence d’un critère, et un diabète gestationnel était diagnostiqué si 2 critères ou plus étaient atteints. Une différence significative a été observée entre les groupes (p = 0.02). Plus précisément, l’analyse de pairs montre des différences entre le
groupe de tolérance normale et le groupe d’intolérance (p = 0.03), et entre le groupe de tolérance normale et le groupe avec diabète gestationnel (p = 0.02).
1.2.3.
L’hypertension gestationnelle et la prééclampsie
L’hypertension gestationnelle et la prééclampsie sont, au Canada, l’une des causes les plus importantes de décès et de morbidité maternelles et périnatales43. Selon les dernières directives publiées par la Société
d’Obstétrique et de Gynécologie du Canada en 201444, les troubles hypertensifs de la grossesse incluent
l’hypertension préexistante ou hypertension chronique, l’hypertension gestationnelle, la prééclampsie, et les autres effets hypertensifs. Les différentes définitions sont listées dans le tableau 4.
Tableau 4 - Classification des troubles hypertensifs de la grossesse44
Trouble Commentaire
Hypertension préexistante
(chronique) Définie comme étant une hypertension qui se manifeste avant la grossesse ou <20+0 semaines de gestation. En présence de comorbidité(s) La présence de comorbidités (p. ex. diabète sucré prégestationnel de type I ou II ou néphropathie) justifie la mise en œuvre d’une surveillance plus étroite de la TA en l’absence de grossesse, en raison de leur association avec une accentuation du risque cardiovasculaire.
En présence de symptômes de prééclampsie
Cette situation est également connue sous le nom de « prééclampsie surajoutée » et est définie par l’apparition d’au moins un des éléments suivants à ≥ 20 semaines :
• Hypertension réfractaire, ou
• Protéinurie récente ou en recrudescence, ou • Au moins un état indésirable, * ou
• Au moins une complication grave. *
La prééclampsie grave est définie comme une prééclampsie s’accompagnant d’au moins une complication grave.
Hypertension gestationnelle Définie comme étant une hypertension qui se manifeste pour la première fois à ≥20+0 semaines de gestation.
En présence de comorbidité(s) La présence de comorbidités (p. ex. diabète sucré prégestationnel de type I ou II ou néphropathie) justifie la mise en œuvre d’une surveillance plus étroite de la TA après la grossesse, en raison de leur association avec une accentuation du risque cardiovasculaire.
En présence de symptômes de
prééclampsie Les symptômes de prééclampsie pourraient ne se manifester que de nombreuses semaines à la suite de l’apparition d’une hypertension gestationnelle.
La prééclampsie est définie comme une hypertension gestationnelle s’accompagnant d’au moins un des éléments suivants :
• Protéinurie récente, ou
• Au moins un état indésirable, * ou • Au moins une complication grave. *
La prééclampsie grave est définie comme une prééclampsie s’accompagnant d’au moins une complication grave.
13
Prééclampsie La prééclampsie pourrait se manifester de novo. Elle est définie comme une
hypertension gestationnelle s’accompagnant d’au moins un des éléments suivants :
• Protéinurie récente, ou
• Au moins un état indésirable, * ou • Au moins une complication grave. *
La prééclampsie grave est définie comme une prééclampsie s’accompagnant d’au moins une complication grave.
Autres effets hypertensifs †
Effet hypertensif transitoire La hausse de la TA pourrait être attribuable à des stimuli environnementaux (p. ex. la douleur du travail).
Effet hypertensif circonstanciel Défini comme une TA qui s’avère élevée lorsqu’elle est mesurée en cabinet (TAS ≥140 mmHg ou TAD ≥90 mmHg), mais qui s’avère régulièrement normale (<135/85 mmHg) lorsqu’elle est mesurée en milieu ambulatoire ou à domicile.
Effet hypertensif masqué Défini comme une TA qui s’avère régulièrement normale lorsqu’elle est mesurée en cabinet (TAS <140 mmHg ou TAD <90 mmHg), mais qui s’avère élevée (≥135/85 mmHg) lorsqu’elle est mesurée en milieu ambulatoire ou à nouveau à domicile.
*Les états indésirables et les complications graves de la prééclampsie sont définis au Tableau 5.
†Ces effets pourraient en venir à se manifester chez les femmes dont la TA est élevée à < 20+0 ou à ≥ 20+0 semaines et chez qui la présence d’une hypertension / prééclampsie préexistante ou gestationnelle, respectivement, est soupçonnée.
On parle d’hypertension grave avec des valeurs de TAS ≥160 mmHg ou de TAD ≥110 mmHg obtenues 2 fois de suite à 15 minutes d’intervalle. Les états indésirables et les complications graves sont classés par systèmes et sont énumérés dans le tableau 5.
Tableau 5 - États indésirables et complications graves de la prééclampsie Système organique
affecté
États indésirables (qui entraînent la hausse du risque de complications graves)
Complications graves (qui justifient la tenue de l’accouchement)
Système nerveux central Maux de tête / symptômes visuels Éclampsie
PRES
Cécité corticale ou décollement rétinien Échelle de Glasgow < 13
AVC, AIT ou RIND
Cardiorespiratoire Douleur thoracique / dyspnée
Saturation en oxygène < 97 %
Hypertension grave non maîtrisée (sur une période de 12h, malgré l’utilisation de trois antihypertenseurs)
Saturation en oxygène <90%, nécessité d’avoir recours à ≥50% d’oxygène pendant >1h, intubation (pour des raisons autres
que la tenue d’une césarienne), œdème pulmonaire
Soutien inotrope positif
Ischémie ou infarctus du myocarde
Hématologique Hausse de la leucocytémie
Hausse du RIN ou du TCA Faible numération plaquettaire
Numération plaquettaire <50 × 109/L Transfusion de tout produit sanguin
Rénal Hausse du taux sérique de créatinine
Hausse du taux sérique d’acide urique
Atteinte rénale aiguë (créatinine > 150 µM sans antécédents de néphropathie) Nouvelle indication pour ce qui est de la dialyse
Hépatique Nausée ou vomissements
Douleur épigastrique ou au QSD Hausse des taux sériques d’ASAT, d’ALAT,
de LDH ou de bilirubine
Faible taux plasmatique d’albumine
Dysfonctionnement hépatique (RIN > 2 en l’absence de
CIVD ou de warfarine)
Hématome ou rupture hépatique
Fœto-placentaire FCF anormale
RCIU
Oligohydramnios
Absence ou inversion du débit en fin de diastole déterminée par vélocimétrie Doppler
Décollement s’accompagnant de symptômes indiquant un danger grave pour la mère ou le fœtus
Négativité de l’onde alpha du ductus venosus
Mortinaissance
PRES : syndrome d’encéphalopathie postérieure réversible; AIT : accident ischémique transitoire; RIND : accident ischémique cérébral régressif (< 48 h); RIN : Rapport international normalisé; TCA : temps de céphaline activée; QSD : quadrant supérieur droit; ASAT : aspartate aminotransférase; ALAT : alanine aminotransférase; LDH:
lacticodéshydrogénase; CIVD : coagulation intravasculaire disséminée; FCF : fréquence cardiaque fœtale.
Les manifestations cliniques de la prééclampsie sont secondaires à des changements anormaux au niveau placentaire, changements qui débutent bien avant les premiers symptômes. Roberts et Lain en décrivent la
physiopathologie en détail en 200245. Dans une grossesse normale, les artères spiralées responsables de la
perfusion placentaire subissent un remodelage suite à une colonisation trophoblastique, passant d’artères musculeuses de petit calibre à des vaisseaux sans endothélium (couche la plus interne des vaisseaux sanguins impliquée dans la régulation du tonus vasculaire) ni couche musculaire ou élastique avec un diamètre au moins quatre fois plus important. Ces changements auront pour effet d’augmenter préférentiellement la perfusion du placenta et sont complets autour de 20-22 semaines. Chez les patientes souffrant de prééclampsie, ces changements au niveau vasculaire sont incomplets et ne s’étendent pas au-delà de la portion superficielle des vaisseaux en raison d’un défaut de la seconde invasion throphoblastique des artères spiralées du myomètre survenant normalement vers la fin du premier trimestre, entraînant un apport sanguin insuffisant (stade 1). Cette ischémie placentaire et le stress oxydatif qui en résulte (stade 2) sont responsables de la libération de facteurs sériques spécifiques de l’endothélium vasculaire. Il en résulte une stimulation de la synthèse de thromboxane
15
A2 (TXA2) vasoconstrictrice, une diminution de la synthèse de prostaglandines vasodilatatrices et d’oxyde nitrique (NO) et l’apparition de marqueurs biochimiques endothéliaux (fibronectine, facteur VIII) avec pour conséquences, la stimulation de l’activité procoagulante et la disparition de la dilatation physiologique. On remarque aussi une vasoconstriction profonde secondaire à une augmentation de la sensibilité maternelle aux agents vasopresseurs circulants, et donc une diminution de la perfusion systémique.
En plus des mécanismes ci-haut mentionnés, la prééclampsie est étroitement liée à la fonction endothéliale maternelle. Plusieurs hypothèses existent quant à l’origine de cette dysfonction. D’abord, comme la prééclampsie est étroitement liée à la fonction placentaire, on croit qu’il pourrait y avoir certaines molécules produites en plus grande quantité par le placenta dont la perfusion est diminuée, tels que le TNF α, l’activateur du plasminogène tissulaire, et le malondialdéhyde. Le placenta pourrait aussi produire moins de facteurs «protecteurs» tels que les cytokines, les procoagulants et les produits stables du stress oxydatif. Des produits sanguins comme les plaquettes et les neutrophiles pourraient également être activés lors de leur passage au travers de l’espace intervilleux pour ensuite agir secondairement sur l’endothélium. En effet, lorsqu’activés, les plaquettes et les neutrophiles peuvent libérer des radicaux libres et ainsi léser l’endothélium maternel en créant un stress oxydatif à son contact. Une autre hypothèse serait qu’il y aurait une augmentation de la libération de petits fragments placentaires dans la circulation maternelle, qui formeraient des vésicules microvilleuses. Ces vésicules étant préparées pour accueillir le trophoblaste villeux réagissent mal à la présence d’érythrocytes et en altéreraient la morphologie, et donc altèreraient également la fonction des cellules endothéliales46.
Ces changements observés dans la prééclampsie auront un impact multi-organique avec un spectre clinique très large, selon la sévérité de la maladie. Entre autres, il peut y avoir une diminution de la perfusion rénale et de la filtration glomérulaire, des changements hépatiques avec des zones d’infarctus périportaux et des hémorragies, des troubles hématologiques tels qu’une hémolyse et une thrombocytopénie ainsi que des lésions au niveau cérébrale dues à un vasospasme réflexe et à un œdème vasogénique se manifestant par des céphalées et des troubles visuels, pouvant aller jusqu’aux convulsions (on parle alors d’éclampsie)47.
1.3. Polyphénols et méthylxanthine
1.3.1. Flavanols
Les polyphénols sont des métabolites secondaires synthétisés par les plantes et retrouvés dans plusieurs aliments, dont les fruits et légumes, les céréales, le chocolat et certains breuvages, comme le thé et le café. Il existe plus de 8 000 sous-types de polyphénols provenant de différents produits naturels, dont les flavonoïdes, les acides phénoliques, les coumarines et les tanins. Les composés phénoliques ici étudiés, les flavonoïdes, ont une forte activité antioxydante. On retrouve plus de 5 000 sous-groupes de flavonoïdes, dont plusieurs centaines se retrouvent dans notre alimentation48. Des différences structurales parmi les flavonoïdes permettent
de les classer en 6 sous-groupes, soit les flavonoles, les flavones, les flavanones, les isoflavones, les anthocyanines et les flavanols. Ceux contenus dans le chocolat sont les flavanols, que l’on retrouve également en moindre quantité dans le vin et le thé. Ces derniers y sont présents dans leur forme monomérique (catéchine, épicatéchine) et dans leur forme polymérique (proanthocyanidines)49.
1.3.1.1. Flavanols et risque cardiovasculaire
Une récente méta-analyse publiée en 2012 par Hooper et al10 s’intéresse aux effets du chocolat, du cacao et
des flavanols sur la santé cardiovasculaire. Quarante-deux essais cliniques randomisés visant à évaluer les effets du chocolat, du cacao, d’extraits de cacao ou de flavanols de cacao raffiné sur la santé cardio-vasculaire d’adultes ont été répertoriés. Dans ces essais cliniques, les principales variables étudiées étaient : la résistance à l’insuline en se basant sur l’index HOMA-IR, la glycémie et l’insulinémie, la fonction endothéliale à l’aide de la dilatation médiée par le flot (FMD), le profil lipidique (triglycérides, HDL, LDL et cholestérol total), la tension artérielle (systolique – TAS, diastolique –TAD et moyenne – TAM) ainsi que la protéine C réactive (CRP). Les ECRs incluent dans la méta-analyse portaient sur des résultats aigus ou à court terme (≤18 semaines). Les résultats suggèrent une amélioration de la FMD deux heures après l’ingestion de chocolat (3.19%; 95% IC :
2.04%, 4.33%; 11 études, 373 participants, I2 = 0%) ainsi qu’après une consommation à court terme (1.34%;
95% IC : 1.00%, 1.68%; 11 études, 382 participants, I2 = 0%). Une réduction de l’insulinémie à jeun (-2,65
μU/mL; 95% IC : -4.65, -0.65) et après un test de stimulation au glucose (-17 μU/mL; 95% IC : -20.7, -13.4 μU/mL à 30 min.) ainsi qu’une réduction de l’index HOMA-IR (-0.67; 95% IC : -0.98, -0.36) furent également observés après une consommation chronique. Aucun effet de la consommation chronique n’a été remarqué sur la
glycémie à jeun (-0.02 mmol/L; 95% IC : -0.22, 0.18) et sur l’HbA1c (0.02%; 95% IC : -0.09%, 0.14%; 3 études,
104 participants). Les triglycérides à jeun furent significativement réduits (-0.05; 95% IC : -0.09, -0.01), mais plus de 40% des effets venaient de deux petites sous-études (une de 23 participants, l’autre de 24). Aussi, comme les écarts-types rapportés étaient étonnamment petits, les analyses ont été refaites en considérant les écarts-types plutôt comme des erreurs-types. Avec ces changements, les effets sur les triglycérides n’étaient plus significatifs (-0.03 mmol/L; 95% IC : -0.08, 0.02 mmol/L; I2 = 0%). Des réductions significatives de la TAD
(-1.60 mmHg; 95% IC : -2.77, -0.43 mmHg; 22 essais, 918 participants, I2 = 52%) et de la TAM (-1.64 mmHg;
95% IC : -3.27, -0.01; 4 essais, 163 participants, I2 = 0%) après une prise chronique furent observées. Les effets
sur la concentration sérique de LDL et de HDL étaient marginalement significatifs (-0.07 mmol/L; 95% IC : -0.14,
-0.00 mmol/L; 21 études, 986 participants, I2 = 58% pour les LDL et 0.03 mmol/L; 95% IC : 0.00, 0.06 mmol/L;
21 études, 986 participants, I2 = 67% pour les HDL). Une prise aiguë n’a eu aucun effet significatif sur la TAD
(-1.38; 95% IC : -4.14, 1.38), et aucun effet ne fut observé sur la CRP (0.12; 95% IC : -0.42, 0.66), le cholestérol total (0.04; 95% IC : 0.11, 0.03) et la TAS (aigu : 1.75; 95% IC : 6.27, 2.77 et chronique : 1.50; 95% IC : -3.43, 0.43).
17
Des analyses de sous-groupes furent également réalisées selon la dose d’épicatéchines, la durée du traitement, la composition du traitement comparativement au contrôle, le risque cardiovasculaire de base et le sexe. Ces analyses de sous-groupes étaient cependant limitées par le nombre et la taille d’échantillon des études. Une amélioration de la FMD était observée avec toutes les doses d’épicatéchines, que ce soit lors de la prise aigue (90-150 min, I2 = 84%) ou chronique (2-18 semaines, I2 = 0%). De meilleurs effets sur la tension artérielle
systolique et diastolique étaient rapportés avec des doses plus élevées (>50 mg/jour). Des doses modérées (50-100 mg/jour) d’épicatéchines étaient associées à une amélioration de la glycémie à jeun et du taux de triglycérides, mais les résultats portant sur la glycémie étaient très hétérogènes (I2 = 80%). Les résultats stratifiés
par durée de traitement montrent une amélioration de la FMD en aigu et en chronique, alors que seules les
études de moins de 3 semaines ont noté une amélioration de la glycémie à jeun (I2 = 82%), des LDL (I2 = 35%)
et du cholestérol total (I2 =67%). Une augmentation des HDL fut seulement observée lors des études de plus
de 3 semaines. Les effets n’étaient pas concluants pour ce qui est de la tension artérielle et des triglycérides. Dans les analyses de sous-groupes comparant le traitement expérimental et le placebo, et celles tenant compte du risque cardiovasculaire de base, aucune différence n’a été notée. Toutefois, le cacao contenant d’autres ingrédients potentiellement bioactifs qui pouvaient être absents dans le placebo, comme l’acide stéarique, le potassium et les méthylxanthines, les analyses de Hooper et al concluent que les effets sur la FMD sont probablement dus aux flavanols, bien que les autres éléments contenus dans le cacao pourraient contribuer aux effets sur la glycémie et sur les LDL. Finalement, le nombre d’essais permettant une telle analyse étant limité, les résultats sont à interpréter avec prudence.
1.3.1.2. Flavanols et profil lipidique
Une méta-analyse parue en 2010 réalisée par Jia et al11 s’est intéressée aux effets à court terme de la
consommation de produits du cacao sur le profil lipidique. Les auteurs ont retenu 8 essais cliniques randomisés, qu’ils ont d’abord analysés par rapport aux changements à court terme du cholestérol total, de la concentration de LDL et de la concentration de HDL. Ils ont ensuite procédé à des analyses de sous-groupes selon la dose de cacao, l’état de santé des participants et la durée de la prise de produit chocolaté. Le cholestérol total a été affecté de façon marginale (-5.82 mg/dL; 95% IC : -12.39, 0.76; P = 0.08) en comparaison avec le groupe contrôle avec une certaine hétérogénéité des résultats (I2 = 49%, P = 0.06). Les LDL quant à eux furent
significativement diminués (-5.87 mg/dL; 95% IC : -11.13, -0.61; P = 0.03) sans hétérogénéité des résultats (I2
= 0%, P = 0.58). Les changements au niveau des HDL n’étaient pas statistiquement significatifs (1.12 md/dL; 95% IC : -2.70, 4.95; P = 0.56).
La première analyse de sous-groupe selon la dose de cacao montre que le cholestérol total et les LDL sont significativement abaissés dans le groupe de faible (<260 mg) consommation de chocolat (CT : -9.92 mg/dL; 95% IC : -15.71, -4.14; P = 0.0008; LDL : -8.07 mg/dL; 95% IC : -15.15, -0.99; p = 0.03) et ne le sont pas dans
les groupes de moyenne (260-665 mg) et haute consommation (≥665 mg). L’analyse selon l’état de santé établit qu’une consommation de cacao pourrait réduire de façon significative le cholestérol total et les LDL chez les participants présentant des risques cardio-vasculaires de base (CT : -8.01 mg/dL; 95% IC : -13.83, -2.20; P = 0.007; LDL : -7.60 mg/dL; 95% IC : -14.70, -0.51; P = 0.04), mais n’aurait aucun effet sur les sujets sains. Finalement, une analyse de sous-groupe selon la durée du traitement (≤ de 6 semaines ou > de 6 semaines) a été réalisée. Sept études ont été utilisées pour le sous-groupe de courte durée, alors que seulement 2 ont pu être utilisées pour l’analyse de longue durée. Une réduction marginale des LDL a été observée dans le sous-groupe de courte durée (-5.18 mg/dL; 95% IC : -10.80, 0.44; P = 0.07) et aucun effet dans le sous-groupe de longue durée (0.22 mg/dL; 95% IC : -6.20, 6.64; P = 0.95). Le cacao avait aussi une tendance à diminuer le cholestérol total dans le groupe à court terme (-6.16 mg/dL; 95% IC :-13.73, 1.42; P = 0.11), mais pas dans le groupe à long terme (1.52 mg/dL; 95% IC : -5.75, 8.79; P = 0.68). Aucun effet à court terme ne fut observé quant aux HDL (-0.82; 95% IC : -3.25, 1.61, P = 0.56). Un effet significatif a cependant été observé à long terme (4.67; 95% IC : -5.27, 14,62, P = 0.004).
Tokede et al50 ont publié en 2011 une seconde méta-analyse portant sur les effets du chocolat noir et des
produits du cacao sur les lipides sériques. Ils ont retenu 10 essais cliniques dont les durées de traitement allaient de 2 à 12 semaines. Les résultats sont globalement semblables à ceux obtenus par Jia et al. avec une diminution significative des LDL de 5.90 mg/dL (95% IC : 10.47, 1.32) et du cholestérol total de 6.23 mg/dL (95% IC : -11.60, -0.85) et aucun effet pour les HDL et les TG. Selon les analyses de sous-groupes, la réduction des LDL est seulement significative avec une prise d’environ 2 semaines. De plus, il n’existe pas de relation dose-effet et les résultats sont indépendants de l’état de santé de base quoique les effets sur les LDL et le CT étaient plus grands chez les participants ayant des facteurs de risque cardiovasculaires documentés.
1.3.1.3. Flavanols et insulinorésistance
Rappelons d’abord les résultats obtenus dans la méta-analyse de Hooper et al10 mentionnés plus haut quant
aux effets des flavonoïdes sur les marqueurs du métabolisme du glucose et de l’insuline. Y ont été observés une réduction de l’insulinémie à jeun (-2,65 μU/mL; 95% IC : -4.65, -0.65) et après un test de stimulation au glucose (-17 μU/mL; 95% IC : -20.7, -13.4 μU/mL à 30 min.) ainsi qu’une réduction de l’index HOMA-IR (-0.67; 95% IC : -0.98, -0.36). Aucun effet n’a été remarqué sur la glycémie à jeun (-0.02 mmol/L; 95% IC : -0.22, 0.18) et sur l’HbA1c (0.02%; 95% IC : -0.09%, 0.14%; 3 études, 104 participants).
Une méta-analyse datant de 2011 menée par Shrime et al12 rapporte des résultats comparables à ceux de
Hooper et al quant à l’indice HOMA-IR, soit une réduction de 0.94 (95% IC : 0.59, 1.29; P < 0.001) avec la consommation de chocolat riche en flavonoïdes sans hétérogénéité significative (I2 = 33.6; P = 0.197). En raison
19
Par ailleurs, deux essais cliniques randomisés menés à double insu ont été réalisés récemment, l’un par Desideri et al51 portant sur les effets du chocolat sur la fonction cognitive chez les patients âgés souffrant d’un déficit
cognitif léger et le second par Curtis et al52 s’intéressant aux effets du chocolat sur le risque cardio-vasculaire
de femmes post-ménopausées atteintes de diabète de type II. Une diminution significative de l’index HOMA-IR dans les groupes de consommation élevée (-1.6 ± 1.0; P < 0.0001) et intermédiaire (-0.9 ± 0.2; P < 0.0001) de flavanols comparativement au groupe de faible consommation (-0.1 ± 0.5; P = 0.29) a été observée dans le premier essai clinique. Une diminution significative de l’index HOMA-IR (-0.78; P = 0.004), sans effets sur l’HbA1c
(-0.10; P = 0.46) et la glycémie à jeun (-0.60; P = 0.09) ont été rapportés dans le deuxième.
1.3.1.4. Flavanols et tension artérielle
Les résultats de tension artérielle obtenus par Hooper et al10 mentionnés plus haut montrent une réduction
significative de la TAD (-1.60 mmHg; 95% IC : -2.77, -0.43 mmHg; 22 essais, 918 participants, I2 = 52%) et de
la TAM (-1.64 mmHg; 95% IC : -3.27, -0.01; 4 essais, 163 participants, I2 = 0%) après une prise chronique, mais
aucun effet sur la TAS (aigu : -1.75; 95% IC : -6.27, 2.77 et chronique : -1.50; 95% IC : -3.43, 0.43). Pour ce qui
est de la méta-analyse de Shrime et al12, 20 des 24 études conservées comportaient des données à propos de
la TAS avec une hétérogénéité significative (I2 = 82.7; P < 0.001) Selon cette analyse, une consommation de
chocolat riche en flavonoïdes pendant au moins 2 semaines diminuerait la TAS de 1.63 mmHg (95% IC : 0.13, 3.12; P = 0.033). La TAD ne fut pas affectée.
En plus des résultats obtenus dans ces deux méta-analyses qui étudiaient les risques cardio-vasculaires en
général, trois autres méta-analyses, l’une réalisée en 2007 par Taubert et al13 et les deux autres en 2010 par
Ried et al14 et Desch et al15 ont étudié les effets du chocolat spécifiquement sur la tension artérielle. Les auteurs
de la première méta-analyse, soit celle de Taubert et al, ont inclut 5 études dans leur analyse quant aux effets de la prise de cacao sur la tension artérielle. Une diminution significative de la TAS de 4.7 mmHg (95% IC : -7.6, -1.8 mmHg; P = 0.002) et de la TAD de -2.8 mmHg (95% IC : -4.8, -0.8 mmHg; P = 0.006) a été notée.
Cependant, une hétérogénéité considérable des résultats était présente pour la TAS (P < 0.001, I2 = 87.6%)
ainsi que pour la TAD (P < 0.001, I2 = 87.6%).
Les auteurs de la méta-analyse de Ried et al, quant à eux, ont inclut 15 études dans son analyse. Ceux-ci y observent aussi une réduction de la TAS (-3.16; 95% IC : -5.98, -1.23 mmHg, P = 0.001) et de la TAD (-2.02, 95% IC : -3.35, -0.69 mmHg, P = 0.003). L’hétérogénéité entre les groupes était élevée (TAS : I2 = 74% et TAD :
I2 = 62%), ce qui a motivé des analyses de sous-groupes selon la tension artérielle de base. Deux groupes
furent formés, soit un groupe avec hypertension (TAS ≥ 140 mmHg, TAD ≥ 80 mmHg), et l’autre normotendu (TAS < 140 mmHg, TAD < 80 mmHg). Les analyses du groupe hypertendu montraient une diminution significative (TAShyper : -5.02; 95% IC : -7.99, -2.05 mmHg; P = 0.0009, TADhyper : -2.73; 95% IC : -4.89, -0.58