HAL Id: dumas-01915958
https://dumas.ccsd.cnrs.fr/dumas-01915958
Submitted on 8 Nov 2018
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Multirésistance aux biothérapies moléculaires dans la
polyarthrite rhumatoïde : étude observationnelle et
rétrospective chez 385 patients
Laëtitia Richard
To cite this version:
Laëtitia Richard. Multirésistance aux biothérapies moléculaires dans la polyarthrite rhumatoïde : étude observationnelle et rétrospective chez 385 patients. Médecine humaine et pathologie. 2018. �dumas-01915958�
FACULTE MIXTE DE MEDECINE ET DE PHARMACIE DE ROUEN
ANNEE UNIVERSITAIRE 2017-2018
Diplôme d’Etat
PAR
Laëtitia RICHARD
Née le 13 janvier 1991 à Rouen
Présentée et soutenue publiquement le 9 octobre 2018
MULTIRESISTANCE AUX BIOTHERAPIES
MOLECULAIRES DANS LA POLYARTHRITE
RHUMATOIDE : ETUDE OBSERVATIONNELLE ET
RETROSPECTIVE CHEZ 385 PATIENTS.
PRESIDENT DE JURY : Monsieur le Professeur Olivier VITTECOQ
DIRECTEUR DE THESE : Monsieur le Professeur Thierry LEQUERRÉ
MEMBRES DU JURY :
Monsieur le Professeur Jean DOUCET
Madame le Docteur Sophie POUPLIN
THESE POUR LE DOCTORAT EN MEDECINE
ANNEE UNIVERSITAIRE 2017 - 2018 U.F.R. DE MEDECINE ET DE-PHARMACIE DE ROUEN
---
DOYEN : Professeur Pierre FREGER
ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET
I - MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie
Mme Gisèle APTER Havre Pédopsychiatrie
Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique
Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire
Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale
Mr Olivier BOYER UFR Immunologie
Mme Sophie CANDON HCN Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales Mr Philippe CHASSAGNE (détachement) HCN Médecine interne (gériatrie) – Détachement Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale
Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
Mr Pierre CZERNICHOW (surnombre) HCH Epidémiologie, économie de la santé Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Pierre DECHELOTTE HCN Nutrition
Mr Stéphane DERREY HCN Neurochirurgie
Mr Frédéric DI FIORE CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale
Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales
Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie
Mr Jean François GEHANNO HCN Médecine et santé au travail
Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie
M. Guillaume GOURCEROL HCN Physiologie
Mr Dominique GUERROT HCN Néphrologie
Mr Olivier GUILLIN HCN Psychiatrie Adultes
Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence
Mr Pascal JOLY HCN Dermato – Vénéréologie
Mme Bouchra LAMIA Havre Pneumologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie
Mr Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
M. David MALTETE HCN Neurologie
Mr Christophe MARGUET HCN Pédiatrie
Mme Isabelle MARIE HB Médecine interne
Mr Jean-Paul MARIE HCN Oto-rhino-laryngologie
Mr Loïc MARPEAU HCN Gynécologie - Obstétrique
Mr Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie
M. Benoit MISSET HCN Réanimation Médicale
Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie
Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie Mr Didier PLISSONNIER HCN Chirurgie vasculaire
Mr Gaëtan PREVOST HCN Endocrinologie
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence
Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction
Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie
Mr Guillaume SAVOYE HCN Hépato-gastrologie
Mme Céline SAVOYE–COLLET HCN Imagerie médicale
Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive
Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion
M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale
Mr Jean-Jacques TUECH HCN Chirurgie digestive Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale
Mr Eric VERIN HB Service Santé Réadaptation
Mr Eric VERSPYCK HCN Gynécologie obstétrique
Mr Olivier VITTECOQ HB Rhumatologie
Mme Marie-Laure WELTER HCN Physiologie
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie
Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire
Mr Gérard BUCHONNET HCN Hématologie
Mme Mireille CASTANET HCN Pédiatrie
Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé
Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mr Gaël NICOLAS HCN Génétique
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire
Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
PROFESSEUR AGREGE OU CERTIFIE
Mr Thierry WABLE UFR Communication
II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
Mme Isabelle DUBUC Pharmacologie
Mme Dominique DUTERTE- BOUCHER Pharmacologie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Gilles GARGALA (MCU-PH) Parasitologie
Mme Nejla EL GHARBI-HAMZA Chimie analytique
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
M. Jérémie MARTINET (MCU-PH) Immunologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale
Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE Mme Anne-Sophie CHAMPY Pharmacognosie M. Jonathan HEDOUIN Chimie Organique
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mme Isabelle DUBUS Biochimie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie
Mme Martine PESTEL-CARON Microbiologie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
III – MEDECINE GENERALE
PROFESSEUR
Mr Jean-Loup HERMIL (PU-MG) UFR Médecine générale
MAITRE DE CONFERENCE
Mr Matthieu SCHUERS (MCU-MG) UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS – MEDECINS GENERALISTE
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale
Mr Philippe NGUYEN THANH UFR Médecine générale
Mme Marie Thérèse THUEUX UFR Médecine générale
MAITRE DE CONFERENCES ASSOCIE A MI-TEMPS – MEDECINS GENERALISTES
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Marianne LAINE UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905) Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (med) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079)
Mr Nicolas GUEROUT (med) Chirurgie Expérimentale
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076)
Mr Frédéric PASQUET Sciences du langage, orthophonie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME
CB - Centre Henri Becquerel CHS - Centre Hospitalier Spécialisé du Rouvray CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
Par délibération en date du 3 mars 1967, la faculté a arrêté que les
opinions émises dans les dissertations qui lui seront présentées
doivent être considérées comme propres à leurs auteurs et qu’elle
n’entend leur donner aucune approbation ni improbation.
Remerciements
Je souhaite tout d’abord remercier mon directeur de thèse le Professeur Thierry Lequerré, pour m’avoir guidée tout au long de ce travail. Merci pour vos conseils, votre soutien, votre implication, votre disponibilité et pour tout ce que vous m’avez enseigné au cours de mon internat.
Je souhaite remercier le Professeur Olivier Vittecoq, pour m’avoir fait l’honneur d’être le Président du jury de ma thèse. Merci pour ces années d’internat, riches de vos enseignements, où vous avez été un chef de service et coordonnateur de DES bienveillant, accessible, et soucieux du devenir de ses internes. Je souhaite remercier le Professeur Jean Doucet, pour m’avoir fait l’honneur d’intégrer avec enthousiasme mon jury de thèse. Je souhaite remercier le Docteur Sophie Pouplin, pour m’avoir fait l’honneur de faire partie de mon jury de thèse. Merci pour tout ce que tu m’as appris, pour ta disponibilité (malgré des journées toujours bien chargées !), toujours dans la bonne humeur grâce à ton rire légendaire et communicatif ! Je souhaite remercier le Docteur Didier Alcaix, pour m’avoir fait l’honneur d’intégrer mon jury de thèse. Merci pour ces quelques mois très enrichissants passés à vos côtés dans votre service, que je me réjouis d’intégrer dans quelques semaines.
Je tiens également à remercier le Docteur Henri Gondé, pharmacien au CHU de Rouen, pour son aide précieuse tout au long de ce travail, du recensement des patients à l’analyse statistique. Merci Henri pour ta grande réactivité, ta disponibilité. J’ai eu beaucoup de plaisir à travailler avec toi. Merci également à André Gillibert d’avoir répondu à nos interrogations.
Je remercie également Christine et Géraldine, secrétaires du service, que j’ai sollicité pendant des mois avec mes listes de dossiers ! Merci pour votre aide, sans laquelle le recueil de données aurait été moins exhaustif. Je souhaiterais maintenant remercier toutes les personnes qui ont compté tout au long de mon cursus, qu’il s’agisse de collègues, d’amis (ou même les deux !) ou de membres de ma famille. Merci aux praticiens hospitaliers du service de Rhumatologie du CHU de Rouen, Macha, Gilles, et également au Docteur Daragon et à Christopher pour vos précieux conseils, tout ce que vous m’avez appris pendant ces années d’internat (et même d’externat ! Macha tu avais déjà entrepris de me faire prendre goût à l’échographie !). J’ai eu la chance d’apprendre à vos côtés, et de m’enrichir des connaissances de chacun d’entre vous.
Merci également au Docteur Charles Zarnitsky, ainsi qu’à Laure et Quentin, pour m’avoir accompagnée dans mes premiers pas d’interne lors ce premier semestre où j’ai énormément
appris grâce à vous tous. Merci également à l’ensemble de l’équipe soignante du service de Rhumatologie du Havre, que j’aurai plaisir à retrouver prochainement.
Merci aux chefs du service de Rhumatologie d’Elbeuf, Mathieu, Maud et Fernando, ainsi qu’à l’équipe soignante pour ce semestre très agréable et enrichissant sur le plan humain et professionnel, dont je garde un excellent souvenir. Merci aux Docteurs Hélène Bacquet-Deschryver et Anne-Joëlle Weber, avec qui je n’ai pas eu l’occasion de travailler, mais qui m’ont accueillie chaleureusement dans leur service afin de consulter des dossiers lorsque j’en ai eu besoin. Merci aux rhumatologues libéraux qui m’ont accueillie dans leur cabinet, les Docteurs Pascal Patoz, Christophe Humez, Pascal Bennet, Isabelle Benizeau et Thibault Vandhuick. Merci pour votre accueil et votre confiance, et pour vos précieux conseils. Merci à tous les médecins du service de Médecine Interne du CHU de ROUEN, et en particulier aux Professeurs Hervé Levesque, Isabelle Marie et Ygal Benhamou, ainsi qu’aux Docteurs Nicolas Girszyn, Gaëtan Sauvêtre, Stéphanie Ngo avec qui j’ai eu l’occasion de travailler. Merci pour votre accueil et vos enseignements. Et à Vincent Langlois ! Merci pour ces trois mois passés avec toi en HPDD, tu m’as tellement appris, toujours dans la bonne humeur, et toujours à l’écoute avec Vincent et moi tes internes. Après s’être croisés pendant mon externat, j’ai été ravie de t’avoir pour chef pendant mon internat, et me fait désormais une joie de pouvoir te retrouver au Havre (on l’avait espéré, on y est ! Tu pourras m’envoyer tous les cas d’ostéoporose que tu veux !).
Merci aux médecins du service d’Imagerie Médicale du CHU de ROUEN, et en particulier à l’équipe d’imagerie ostéo-articulaire les Docteurs Paul Michelin, Mathilde Etancelin-Jamet, Grégoire Leleup, Laurent Poidevin, Florence Vincent pour votre accueil, votre patience au cours de ce semestre passé parmi vous.
Merci à toute l’équipe de l’IRMS2, et plus particulièrement aux Docteurs Mehdi Roudesli,
Victor Decrette, Claire Delpouve, Lucie Behague, nos rhumatologues infiltrés FX Julien et Marie, Dominique (dit Jackie), Laurence (mon coach en Zumba !), Mayllé (« référente universitaire », cette fois c’est le jour J !) et Cécile (j’ai enfin trouvé quelqu’un d’aussi amoureuse des chats que moi !), pour votre accueil chaleureux et ce dernier semestre passionnant ! Vous me manquerez !
Merci à toute l’équipe soignante du service de Rhumatologie de Rouen (je vais forcément en oublier, pardonnez-moi !) pour les moments partagés ensemble, vos encouragements : Mumu, Justine, Marine, Fanny, Béatrice, Christine, les Sylvie, Céline, Stéphanie, Edith, Zohra, Marie-France, Aminata, les cadres Madame Magnen, Madame Delanis et également à Bois-Guillaume Madame Raes, nos kinés et notre psychologue Sylvie Chambellan. Et France que j’ai retrouvée au CHU après toutes ces années ! Et bien sûr une pensée particulière pour Nathalie Cozette.
Merci à Sandrine Parisse et à toutes les secrétaires du service (là encore je risque d’en oublier…) : Bénédicte, Elia, Jessica, Christine, Géraldine… C’est toujours un plaisir de travailler avec vous, nous avons de la chance de vous avoir.
Merci à mes anciens co-internes, devenus chefs :
Marie et Julien (déjà cités mais ils le méritent bien !), Victor, Alexandra D., Caro, Pascal, Nicolas, François, Christelle, Sara (on en aura appris de choses ensemble en préparant ta thèse !). Merci pour tout ce que j’ai appris à vos côtés, vos encouragements, et tous ces moments partagés ensemble. Merci à Agathe pour sa relecture de mon anglais médical, et pour sa présence au quotidien en stage, toujours disponible pour nous accompagner, avec toujours un mot pour nous rassurer. Tu vas me manquer ! Merci à tous mes co-internes de rhumato pour ces moments partagés ensemble, en stage ou lors de nos formations : Tout d’abord Camille M., Alex P. et Sandra, vous restez ma promo de cœur les filles !!
Ma petite Alice (oui Alice Colignon, interne en Rhumatologie ?!), découverte et adoptée pendant ces 9 mois de CHU, au cours de nos échanges sur la rhumatologie mais aussi de pauses musicales en HDJ, de nos soirées à la SFR, de nos discussions, de tes séances de coaching ! Ariane et ses potins, et sa sémiologie très personnelle… Il aura fallu ce dernier semestre pour qu’on se découvre vraiment ! Et puis Camille Prum-Delepine notre maman, Charles, Tiffany, Pauline, Marine, Camille Darras, Alice R., Juliette et leur bonne humeur, et les plus jeunes que j’apprendrai à connaitre. Merci également à mes co-internes d’autres spécialités ou d’autres CHU, rencontrés aux cours de mes stages (ça fait pas mal de monde, je vais encore en oublier…) : Delphine Simon dont la bonne humeur m’a détendue pendant mon premier semestre, Vincent Eble dont le calme a su m’apaiser, Marie Beaufrère que l’on aurait bien gardée avec nous à Rouen, Vincent Grémain pour toutes ces soirées passées à l’HPDD après la petite madeleine bien méritée de 19h, Kladoum et sa musique du monde (Alice et moi sommes devenus fans de Maitre Gazonga), Doriane et Alexandre pour leurs mémorables imitations, mes co-internes de radio Matthieu, Benjamin, Guillaume et David pour leur sens inégalable du canular et du rempla. Merci à Mélina et Julien, mes acolytes de la fac. On a formé une super équipe tous les trois, des bancs de la fac à notre « retraite » studieuse avant l’ECN, je crois qu’on s’est encouragés les uns les autres, je suis heureuse que chacun d’entre nous ait pu suivre la voie qu’il avait choisi. Mon pitchounou, on en a partagé des fous rires dans les amphis ou à la BU, des moments plus tristes aussi… Qu’aurais-je fait sans toi ! Je reste nostalgique de ces années de fac qui m’ont permis de rencontrer mon meilleur ami. Même si l’internat nous a un peu éloignés, tu tiens toujours une place de choix parmi mes proches. Merci à Philippe, mon brillant parrain de médecine. Merci à toi (et à Maude également), pour tous ces précieux conseils pendant toutes ces années ! On s’est vraiment bien trouvés tous les deux ! Merci à Camille et Eléonore pour ses années de lycée et cette P1, qui, grâce à vous, reste dans ma mémoire comme un bon souvenir finalement !
Merci à Jean-Claude et Marie-Odile Simottel, pour m’avoir fait découvrir l’univers de la médecine et toujours encouragée dans cette voie.
Merci à mes amies de collège et lycée, Laura et Adeline, pour avoir gardé le contact malgré toutes ces années et nos chemins différents, sans me reprocher mes réponses tardives ou mon manque de temps, en partageant ensemble de courts moments mais toujours riches. Merci à toute l’équipe du CATV : la danse, ma bouffée d’oxygène ! Merci à Anne et Catherine, pour leur bienveillance et leur compréhension pendant toutes ces années, à toutes les copines de la danse (Virginie, Barbara, Agathe, Eléonore, Elodie, Delphine, Tiphaine, Violaine… impossible de toutes vous citer !!) pour votre bonne humeur, et une dédicace spéciale à Alicia et Stéphane, avec qui on a réinventé les « terrasses du mercredi de Ry » avant les cours !
Et Annabelle… Notre amitié a bien dépassé le cadre de la danse ! Je n’imagine même plus ma vie sans toi !! Mon « âme sœur », ma Meredith à moi… Et Fabien, qui est devenu mon ami lui aussi ! Des kits de survie aux alertes SMS des résultats du tennis, de nos escapades automobiles à nos créations de 3h du matin, vous avez été un soutien de taille, vous m’avez reboostée, consolée, encouragée… Merci les amis ! Je ne serais pas moi-même si je n’avais pas un mot pour mon Marquis, fidèle compagnon au cours de ces longues heures passées devant mon ordinateur, spectateur en avant-première de toutes mes présentations, et sans aucun doute le Maine Coon le plus connu de tout le CHU ! Merci à ma famille : A mon grand-père et mes autres grands-parents qui ne sont malheureusement plus là. A Raphaëlle, merci d’être toujours là, après toutes ces années. A mes parents, sans qui rien n’aurait été possible. Merci Papa et Maman pour votre soutien, votre courage. Vous avez toujours cherché à me préserver, à faire en sorte que je puisse me concentrer sur mes études, vous m’avez soutenue dans les épreuves, écoutée dans mes moments de doutes, supportée même lorsque j’ai imposé mes programmes de révision et mes horaires à tout le monde ! Je suis heureuse de pouvoir partager ce moment avec vous, j’espère pouvoir vous rendre fiers et un jour vous rendre ce que vous m’avez donné. Je vous aime. Et à mon frère, Mickaël. Tu m’as apporté tant de choses… entre autres, tu m’as transmis le goût de l’effort, de l’exigence, du dépassement de soi. Et de petites phrases dont toi seul avait le secret pour m’encourager ! Je crois que tu aurais adoré partager ce moment avec moi. Tu me manques… Ton souvenir m’accompagne chaque jour.
Table des matières
I. INTRODUCTION ... 18 A. Les biothérapies moléculaires dans la polyarthrite rhumatoïde : arsenal thérapeutique en 2018 ... 18 1. Les anti-TNFa ... 19 a. Infliximab ... 19 b. Etanercept ... 19 c. Adalimumab ... 19 d. Certolizumab pegol ... 20 e. Golimumab ... 20 2. L’antagoniste du récepteur du l’IL-1 (IL-1RA) ... 20 3. L’inhibiteur de la co-stimulation des lymphocytes T ... 21 4. L’anti-récepteur de l’IL-6 ... 21 5. L’anti-lymphocytes B ... 22 6. Les inhibiteurs des JAK-STAT ... 22 7. Résumé des mécanismes d’action ... 23 B. Efficacité et maintenance thérapeutique ... 24 1. Définitions et objectifs thérapeutiques ... 24 2. Comparaison de l’efficacité des différentes biothérapies ... 25 3. Comparaison du taux de maintenance thérapeutique des différentes biothérapies ... 25 C. Facteurs influençant la réponse aux traitements biologiques ... 26 1. Facteurs liés aux caractéristiques des patients ... 26 a. Sexe ... 26 b. Age ... 27 c. Indice de masse corporelle (IMC) ... 27 d. Tabagisme ... 28 e. Traitements associés ... 28 f. Comorbidités ... 29 2. Facteurs liés aux caractéristiques de la maladie ... 29 a. Activité de la maladie ... 29 b. Syndrome inflammatoire biologique ... 29 c. Retentissement fonctionnel ... 30 d. Facteur rhumatoïde et anticorps anti-peptides cycliques citrullinés (anti-CCP) ... 30 D. Mécanismes de résistance et de multirésistance ... 30 1. Généralités……….30 2. La résistance aux traitements dans la polyarthrite rhumatoïde ... 31 a. Résistance aux traitements de fond conventionnels ... 31 b. Résistance aux biothérapies ... 32 i. innée ... 32 ii. acquise ... 32 II. OBJECTIFS DE L’ETUDE ... 33 III. MATERIELS ET METHODES ... 34 A. Sélection des patients répondeurs et multirésistants ... 34 B. Recueil des données ... 35 1. Données démographiques ... 36 2. Données générales et comorbidités ... 36 a. Données à l’initiation de la première biothérapie ... 36 b. Evolution ... 373. Données rhumatologiques ... 37 a. Données à l’initiation de la première biothérapie ... 37 b. Evolution ... 38 C. Analyse statistique ... 38 IV. RESULTATS ... 40 A. Sélection des patients et données générales sur la file active de patients ... 40 B. Caractéristiques des patients multirésistants à l’initiation de la première biothérapie et facteurs associés à la multirésistance ... 43 1. Données démographiques ... 43 2. Caractéristiques anthropométriques ... 44 3. Tabagisme, facteurs de risque cardio-vasculaires et autres comorbidités ... 45 4. Caractéristiques anamnestiques ... 47 5. Caractéristiques cliniques ... 47 6. Caractéristiques radiographiques et biologiques ... 50 7. Activité de la maladie ... 50 8. Traitements associés ... 51 C. Evolution sous traitement ... 53 1. Survenue d’évènements sous biothérapie ... 53 2. Activité de la PR des patients multirésistants aux changements de biothérapie pour échec primaire ou secondaire ... 54 D. Analyse en sous-groupe ... 54 V. DISCUSSION ... 56 A. Résultats commentés ... 56 1. Définition de la multirésistance ... 56 2. Schéma de l’étude ... 57 3. Données générales ... 58 4. Caractéristiques des patients multirésistants et facteurs associés ... 59 5. Analyse en sous-groupe ... 63 B. Forces et limites de l’étude ... 63 VI. CONCLUSION ... 65 VII. REFERENCES BIBLIOGRAPHIQUES ... 66 VIII. ANNEXES ... 71 IX. RESUME ... 74
I. INTRODUCTION
La polyarthrite rhumatoïde (PR) est le rhumatisme inflammatoire chronique le plus fréquent. En France, sa prévalence est estimée à 0,31 %, avec une forte disparité entre les femmes et les hommes, respectivement à 0,51 % et 0,09 %, et l’origine géographique [1]. Cette maladie, d’origine multifactorielle (facteurs génétiques, environnementaux…), se caractérise par une inflammation de la membrane synoviale, et mène parfois à une atteinte structurale (chondrolyse, érosions) et des déformations articulaires, sources de handicap. Il existe dans certains cas une atteinte systémique (pulmonaire, hématologique, oculaire, vasculaire). Elle majore le risque cardio-vasculaire et de lymphome. Son impact en termes de mortalité est non négligeable, avec une réduction de l’espérance de vie de 5 à 10 ans selon les études. Son pronostic a cependant été révolutionné au cours des deux dernières décennies, notamment par l’avènement des biothérapies moléculaires [2,3]. D’après les données de l’assurance maladie, en 2011, les coûts de santé liés à la PR s’élevaient à 974 335 000 euros soit 0,67 % des dépenses de l’assurance maladie tous régimes confondus.
A. Les biothérapies moléculaires dans la polyarthrite
rhumatoïde : arsenal thérapeutique en 2018
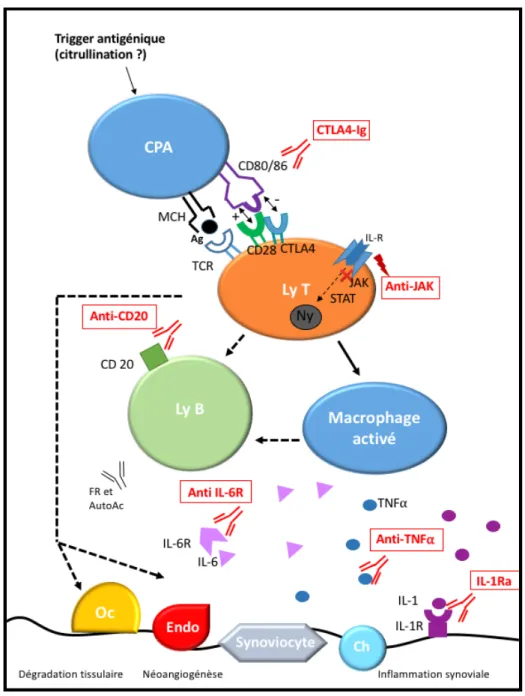
Sur le plan physiopathologique, le rôle clé des lymphocytes B, des lymphocytes T et de leurs interactions, et surtout celui des cytokines pro-inflammatoires (essentiellement TNFa, IL-1, IL-6) a été mis en évidence. Elles sont en effet à l’origine d’une amplification de la réaction inflammatoire, synoviale et systémique, d’une prolifération cellulaire, d’une néo-angiogenèse et d’une dégradation osseuse par activation des ostéoclastes [4,5]. Ces différents acteurs de la cascade inflammatoire constituent autant de cibles thérapeutiques potentielles. Les biothérapies sont pour la plupart des anticorps dirigés contre ces cibles ou inhibant leur mode d’action.
1. Les anti-TNFa
a. Infliximab
Il s’agit d’un anticorps monoclonal chimérique (composé d’une région antigénique murine et d’une région constante humaine) dirigé contre le TNFa soluble et membranaire, empêchant ainsi sa liaison avec son récepteur. Il est indiqué chez les patients ayant une maladie active, en association avec le méthotrexate (MTX), lorsque la réponse aux traitements de fond, dont le MTX, est inappropriée, et chez les patients ayant une maladie active, sévère et évolutive non traitée auparavant par le MTX ni par les autres DMARD (Disease-Modifying AntiRheumatic Drug). Son autorisation de mise sur le marché (AMM) a été obtenue en 1999. Il est administré par voie intraveineuse uniquement, à la posologie de 3 mg/kg/8 semaines dans la PR. Son coût s’élève à 290,52 euros (hors taxes) par flacon (base de données du Vidal mise à jour en juillet 2018). Des biosimilaires sont désormais disponibles.
b. Etanercept
Protéine de fusion récepteur soluble du TNFa-IgG, associant une portion de liaison au ligand et un fragment Fc, l’etanercept empêche l’interaction du TNFa (et b) avec son récepteur. Il a obtenu l’AMM en 2000 dans le traitement de la PR modérément à sévèrement active, en association avec le MTX, en cas de réponse inadéquate aux traitements de fond, dont le MTX. Il peut également être utilisé en monothérapie en cas d’intolérance au MTX ou lorsque la poursuite du MTX est inadaptée, et chez les patients ayant une maladie active, sévère et évolutive non traitée auparavant par le MTX. Il s’administre par voie sous-cutanée à la posologie de 25 mg 2 fois par semaine ou 50 mg 1 fois par semaine. Son coût est de 736,63 euros pour 4 stylos de 50 mg (Vidal juillet 2018). Des biosimilaires sont également disponibles.c. Adalimumab
Il s’agit d’un anticorps monoclonal humain, se liant au TNFa et empêchant son interaction avec son récepteur. L’adalimumab a également depuis 2003 l’indication dans le traitement de la PR modérément à sévèrement active, en association avec le MTX, en cas de réponse inadéquate aux traitements de fond, dont le MTX, et peut être utilisé en
monothérapie en cas d’intolérance au MTX ou lorsque la poursuite du MTX est inadaptée. L’adalimumab peut également être proposé chez les patients ayant une maladie active, sévère et évolutive non traitée auparavant par le MTX. Administré par voie sous-cutanée, sa posologie est à 40 mg tous les 14 jours, pour un coût de 755,35 euros par mois (Vidal juillet 2018). Des biosimilaires devraient être prochainement disponibles.
d. Certolizumab pegol
Anticorps monoclonal humanisé pegylé, dirigé contre le TNFa soluble et membranaire, il associe un fragment Fab’ humain et une molécule de polyethylène glycol afin d’en augmenter la demi-vie. Le certolizumab pegol a l’AMM depuis 2009 dans le traitement de la PR modérément à sévèrement active, en association avec le MTX, en cas de réponse inadéquate aux traitements de fond, dont le MTX, ou en monothérapie en cas d’intolérance au MTX ou lorsque la poursuite du MTX est inadaptée, et chez les patients ayant une maladie active, sévère et évolutive non traitée auparavant par le MTX. Après une dose de charge par voie sous-cutanée de 400 mg toutes les 2 semaines pendant 4 semaines, il est administré à raison de 200 mg toutes les 2 semaines ou 400 mg par mois. Son coût s’élève à 717,58 euros par mois (Vidal juillet 2018).e. Golimumab
Il s’agit d’un anticorps monoclonal humain produit sur un modèle murin, dirigé contre le TNFa soluble et membranaire. Le golimumab a depuis 2009 l’AMM dans le traitement de la PR selon les mêmes conditions que le certolizumab pegol. Il s’administre par voie sous-cutanée, à la posologie de 50 mg par mois, pour un coût de 816,60 euros (Vidal juillet 2018).2. L’antagoniste du récepteur de l’IL-1 (IL-1RA)
L’anakinra est un antagoniste du récepteur de l’IL-1 (IL-1RA), développé initialement dans le traitement de la PR, en association au MTX, chez les patients dont la réponse au MTX seul n’est pas satisfaisante (AMM 2002). Son efficacité reste cependant relative, et il semble d’après les méta-analyses avoir une efficacité moindre par rapport aux anti-TNFa[6]. Il est désormais plutôt utilisé dans les maladies auto-inflammatoires, et semble avoir également un intérêt dans la prise en charge des pathologies micro-cristallines. Il s’administre
quotidiennement par voie sous-cutanée à la posologie de 100 mg. Son coût est de 252,93 euros pour 7 jours.
3. L’inhibiteur de la co-stimulation des lymphocytes T
L’abatacept est une protéine de fusion composée d’une immunoglobuline fusionnée avec le domaine extracellulaire du CTLA-4, antigène des lymphocytes T cytotoxiques. L’interaction entre le CD28 et son ligand CD80/86, exprimé par les cellules présentatrices d’antigènes, constitue un signal de co-stimulation nécessaire à l’activation du lymphocyte T. Le CTLA4, physiologiquement en compétition avec le CD28 vis-à-vis du ligand CD80/86, avec une affinité plus forte, a au contraire une action inhibitrice sur ce signal, dont le blocage a pour conséquence l’inhibition de la prolifération des lymphocytes T et de la production de cytokines pro-inflammatoires. Le principe de l’abatacept est de reproduire cette inhibition à visée anti-inflammatoire. L’abatacept est indiqué depuis 2007 dans la PR active, modérée à sévère, en association avec le MTX, chez les patients ayant eu une réponse inadéquate à un ou plusieurs traitements de fond antérieurs incluant le MTX ou un anti-TNFa. Il est disponible sous forme intraveineuse à dose adaptée au poids (312,95 euros par flacon de 250 mg), ou par voie sous-cutanée à la posologie de 125 mg par semaine (soit 210,18 euros par semaine) avec ou sans dose de charge intraveineuse (Vidal juillet 2018).
4. L’anti-récepteur de l’IL-6
Le tocilizumab, anticorps monoclonal humanisé dirigé contre le récepteur de l’IL-6 (IL-6R), inhibe l’action de cette cytokine pro-inflammatoire dont le rôle est crucial dans la cascade inflammatoire (activation des lymphocytes T, différentiation des lymphocytes B en lymphocytes B matures et production des protéines de l’inflammation par les hépatocytes). Il est indiqué depuis 2009 dans le traitement de la PR active, modérée à sévère, en association au MTX ou en monothérapie chez les patients ayant présenté soit une réponse inadéquate, soit une intolérance à un ou plusieurs traitements de fond (DMARDs) ou à un ou plusieurs anti-TNFa. Il peut être administré par voie intraveineuse à la dose de 8 mg/kg/4 semaines (263 euros par flacon de 200 mg), ou par voie sous-cutanée à la posologie de 162 mg/semaine (soit 923,04 euros par mois) selon la base de données du Vidal de janvier 2018.
Un autre anticorps monoclonal humain dirigé contre le récepteur de l’IL-6, le sarilumab, a obtenu son AMM dans le traitement de la PR en 2018, en cas de réponse inadéquate ou intolérance à un ou plusieurs traitements de fond, en 2ème et 3ème intention, après échec d’un ou plusieurs DMARDs tels que le MTX, ou d’un ou plusieurs médicaments biologiques, de préférence en association au MTX, ou en monothérapie (en cas d’intolérance au MTX ou lorsque le traitement avec le MTX est inadapté́). Il s’administre par voie sous-cutanée à la dose de 200 mg toutes les 2 semaines, et devrait être prochainement commercialisé.
5. L’anti-lymphocytes B
Il s’agit d’un anticorps monoclonal chimérique, le rituximab, dirigé contre le CD20 exprimé à la surface des lymphocytes B. D’abord commercialisé dans le cadre du traitement des hémopathies malignes, et après avoir constaté son efficacité sur le plan articulaire chez les patients atteints de PR et traités pour un lymphome, il a obtenu en 2006 son AMM dans le traitement de la PR active, sévère, en association au MTX, chez les patients ayant présenté une réponse inadéquate ou une intolérance aux traitements de fond, dont au moins un anti-TNFa. Il s’administre classiquement à la dose de 1000 mg par voie veineuse à J1 et J15, avec possibilité de retraitement après au moins 6 mois. Son coût s’élève à 3324 euros par cure. Deux biosimilaires sont désormais disponibles.
6. Les inhibiteurs des JAK-STAT
Les inhibiteurs de JAK-STAT sont des molécules de synthèse, et donc n’appartenant pas stricto-sensu aux biothérapies moléculaires, mais qui restent cependant des thérapies ciblées. Ils permettent l’inhibition des JAK kinases de la voie JAK-STAT, essentielles dans la signalisation intracellulaire, empêchant ainsi la transcription des gènes codant pour la synthèse des cytokines pro-inflammatoires. Deux molécules sont à ce jour commercialisées en France : le tofacitinib et le baricitinib, administrées par voie orale. Elles ont obtenu l’AMM en 2017 dans le traitement de la PR, après échec d’un DMARD ou d’un biologique. Leur coût s’élève à 734,70 euros par mois (Vidal juillet 2018).
7. Résumé des mécanismes d’action
La figure suivante (Figure 1) résume les différentes cibles thérapeutiques des biothérapies et leurs mécanismes d’action [4,5,7].
Figure 1 : Cibles physiopathologiques des biothérapies dans la polyarthrite rhumatoïde, élaboré à partir des schémas de Choy EH et al. ; Noack M et al. ; Scott DL et al. Légende : CPA : cellule présentatrice ; CMH : complex major histocompatibility ; Ly T : lymphocyte T ; Ly B : lymphocyte B ; Ag : peptide antigénique ; AutoAc : autoanticorps ; Ny : noyau ; Oc : ostéoclaste ; Endo : cellule endothéliale ; Ch : chondrocyte
B. Efficacité et maintenance thérapeutique
1. Définitions et objectifs thérapeutiques
L’activité de la maladie peut être évaluée par plusieurs scores, dont le DAS28 (Disease
Activity Score) qui est le plus largement utilisé à l’heure actuelle. Le DAS28 est un score
composite intégrant le nombre d’articulations douloureuses et gonflées, l’EVA activité globale du patient ainsi qu’un paramètre biologique (VS ou CRP). D’autres scores d’évaluation tendent à émerger dans la pratique courante, tels que le SDAI (Simplified Disease Activity Index) ou le CDAI (Clinical Disease Activity Index). L’utilisation de ces scores permet d’apprécier l’activité de la maladie et l’obtention de la rémission. En effet, l’activité de la maladie est jugée élevée pour un DAS28 > 5.1, modérée pour un DAS 28 compris entre 3.2 et 5.1, faible pour un DAS28 ≤ 3.2, et on parle de rémission lorsque le DAS28 est inférieur à 2.6.
Il existe des définitions plus strictes de la rémission, tels que celles de l’ACR/EULAR
(American Congress of Rheumatology/European League Against Rheumatism) 2011, qui
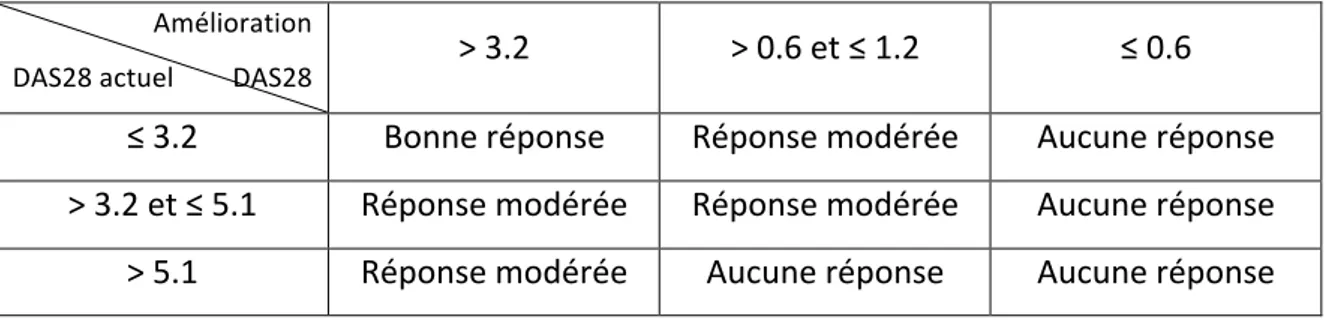
correspond à un SDAI ≤ 3.3 et/ou la rémission booléenne (nombre d’articulations douloureuses et nombre d’articulations gonflées ≤ 1, CRP ≤ 1mg/dl, et EVA globale ≤ 1/10). L’utilisation du DAS28 permet également d’apprécier la réponse au traitement selon les critères EULAR (Tableau 1). Tableau 1 : Critères de réponse EULAR selon le DAS 28. Amélioration
DAS28 actuel DAS28 ˃ 3.2 ˃ 0.6 et ≤ 1.2 ≤ 0.6
≤ 3.2 Bonne réponse Réponse modérée Aucune réponse
˃ 3.2 et ≤ 5.1 Réponse modérée Réponse modérée Aucune réponse
˃ 5.1 Réponse modérée Aucune réponse Aucune réponse
L’objectif thérapeutique est d’atteindre une activité minimale de la maladie, à savoir la rémission pour les PR récentes, voire une activité faible pour les PR plus anciennes.
L’échec primaire peut être défini par l’absence d’amélioration clinique au cours des 12 à 16 premières semaines du traitement.
L’échec secondaire correspond quant à lui à une diminution ou une perte d’efficacité après une phase d’amélioration initiale après l’initiation du traitement [8].
2. Comparaison de l’efficacité des différentes biothérapies
Il existe à ce jour peu d’études face/face cherchant à mettre en évidence la supériorité d’une molécule sur les autres (EXXELERATE : certolizumab pegol versus adalimumab ; AMPLE : abatacept versus adalimumab ; ADACTA : tocilizumab versus adalimumab en monothérapie ; MONARCH : sarilumab versus adalimumab en monothérapie ; ORAL Strategy : tofacitinib en monothérapie ou associé au MTX versus adalimumab + MTX). Une méta-analyse de la Cochrane menée par Singh et al. a cherché à réaliser une comparaison indirecte de la réponse ACR50 des différentes biothérapies. Elle ne met cependant pas en évidence de différence significative en terme d’efficacité entre les différentes molécules, hormis une infériorité de l’anakinra par rapport à l’etanercept (Odds Ratio = OR = 0,34 avec un intervalle de confiance à 95% = IC95% compris entre 0,14 et 0,81), et une supériorité de l’adalimumab par rapport à l’anakinra (OR= 2,20 ; IC95% : 1,01-4,75) [6].En deuxième ligne de traitement, en cas d’échec d’un premier anti-TNFa, l’étude ROC (Rotation Or Change) a cherché à comparer deux stratégies thérapeutiques : rotation de biothérapie au sein de la classe des anti-TNFa, versus changement de biothérapie pour une molécule non anti-TNFa (abatacept, tocilizumab et rituximab). Cet essai randomisé, multicentrique, en ouvert, a montré une supériorité des biothérapies non-anti-TNFa en cas d’échec d’un premier anti-TNFa, concernant la réponse EULAR à 24 semaines, 6 mois et 12 mois [9].
3. Comparaison du taux de maintenance thérapeutique des
différentes biothérapies
On peut également chercher à comparer les différentes biothérapies en termes de maintenance thérapeutique, qui est un critère composite permettant d’apprécier l’efficacité mais aussi la tolérance, la satisfaction du patient et son adhésion vis-à-vis du traitement.
Leon L. et al., dans une étude observationnelle rétrospective et longitudinale concernant les biothérapies initiées entre 1999 et 2013, ont montré qu’à 1 an, le taux de maintenance
thérapeutique s’élevait à 68%, toutes biothérapies et lignes de traitement confondues, alors qu’il n’excédait pas plus de 10% après 10 ans. La cause la plus fréquente de l’arrêt était la survenue d’effets indésirables (45,8%) suivie de près par l’inefficacité (40,8%). La durée médiane de survie du traitement était dans cette étude de 2,26 ans [10]. Dans une étude comparant le taux de maintenance des 5 anti-TNFa, du tocilizumab et de l’abatacept, celui des deux dernières était significativement supérieur, lié respectivement à un plus faible taux d’arrêt pour inefficacité pour l’un, et un plus faible taux d’arrêt pour effets indésirables pour l’autre [11]. Concernant les anti-TNFa, une méta-analyse de la littérature a montré un taux d’arrêt toutes causes confondues de 21% à 6 mois, et dépassant 50% à 4 ans. Parmi eux, l’etanercept avait un taux d’arrêt significativement inférieur par rapport à l’infliximab et l’adalimumab à 3 et 4 ans [12].
C. Facteurs influençant la réponse aux traitements
biologiques
Il apparait donc nécessaire d’identifier des facteurs prédictifs de réponse ou de non-réponse aux traitements, afin de proposer une médecine plus personnalisée, et de proposer à chaque individu le traitement qui lui sera le plus bénéfique.
1. Facteurs liés aux caractéristiques des patients
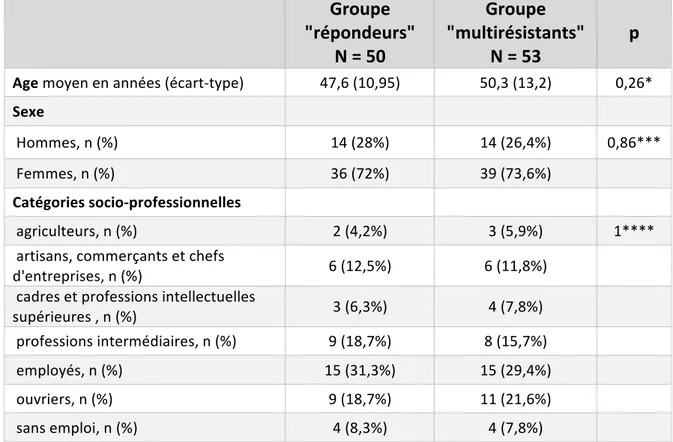
a. Sexe
Concernant les anti-TNFa, le sexe masculin serait un élément prédictif de réponse, et associé à une rémission prolongée, d’après les données des registres allemands [13] et européens (étude ReAct [14]). Celles issues du registre suédois (étude GISEA [15]) n’ont cependant pas retrouvé d’association significative. Concernant le rituximab, les données du registre britannique concernant la réponse au traitement à 6 mois ont également mis en évidence une plus faible chance de réponse au traitement chez les femmes [16]. Il n’y a pour l’heure pas de données pour le tocilizumab, l’abatacept, ou les inhibiteurs de JAK-STAT.b. Age
Si certaines études ont rapporté que l’âge jeune était un facteur prédictif de réponse au traitement par anti-TNFa [13,14], les données sont contradictoires, cela n’a pas été confirmé dans d’autres registres [15].
Pour le tocilizumab, Pers et al. ont mis en évidence une plus faible propension à la réponse au traitement et à atteindre la rémission sous traitement chez les patients âgés [17,18].
L’âge élevé a également été associé à de plus faibles chances de réponse au traitement par rituximab [16].
A l’inverse, il semblerait, d’après les données du registre danois DANBIO, que l’âge avancé soit un élément prédictif de réponse à l’abatacept [19], mais aucune association significative n’a été mise en évidence dans une autre étude française issue des données du registre ORA.
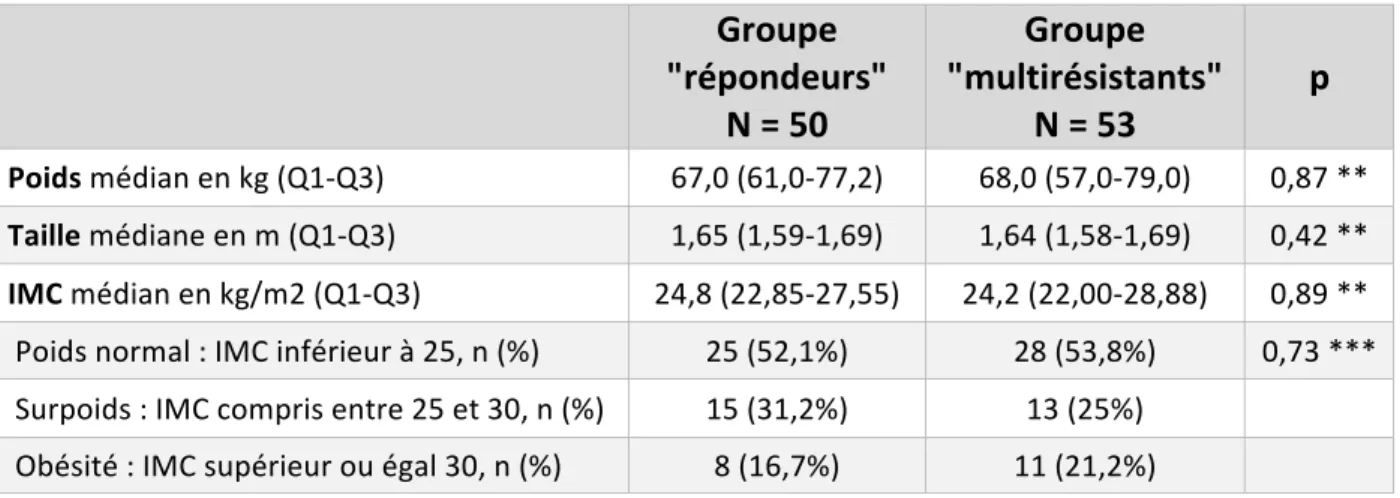
c. Indice de masse corporelle (IMC)
Concernant les anti-TNFa, de nombreuses études ont cherché à évaluer l’impact de l’obésité (définie comme un IMC supérieur ou égal à 30 kg/m2 par l’Organisation Mondiale de la Santé) sur la réponse au traitement. Les données issues des cohortes les plus conséquentes, à savoir la cohorte GISEA et BeSt, ont toutes deux mis en évidence une moins bonne réponse au traitement chez les patients obèses [20,21]. Cela a également été confirmé par une étude prospective portant sur 89 patients aux Pays-Bas [22]. Il semble que l’infliximab soit l’anti-TNFa dont la réponse est la plus influencée par l’IMC bien qu’il soit administré avec une dose adaptée au poids [20]. L’étude PANABA, regroupant les données de 10 cohortes prospectives européennes n’a pas montré d’influence de l’IMC sur la réponse à l’abatacept administré par voie intra-veineuse [23]. Cela était également le cas dans une analyse post-hoc de l’étude ACQUIRE, et ce quelle que soit le mode d’administration [24].
Quant au tocilizumab, des études rétrospectives ont permis de constater l’absence d’influence de l’IMC sur la réponse EULAR à 6 mois et l’obtention de la rémission sous tocilizumab par voie intra-veineuse [25,26]. Cependant, l’étude prospective BREVACTA, comparant le tocilizumab en sous-cutané au placebo, suggère une moindre efficacité de la
molécule administrée par cette voie pour des poids extrêmes, supérieurs à 100 kg, pouvant s’expliquer par une moindre biodisponibilité [27].
Pour le rituximab, une étude rétrospective et monocentrique sur 114 patients n’a également pas mis en évidence de différence significative en termes de réponse EULAR et de taux de rémission selon l’IMC [28].
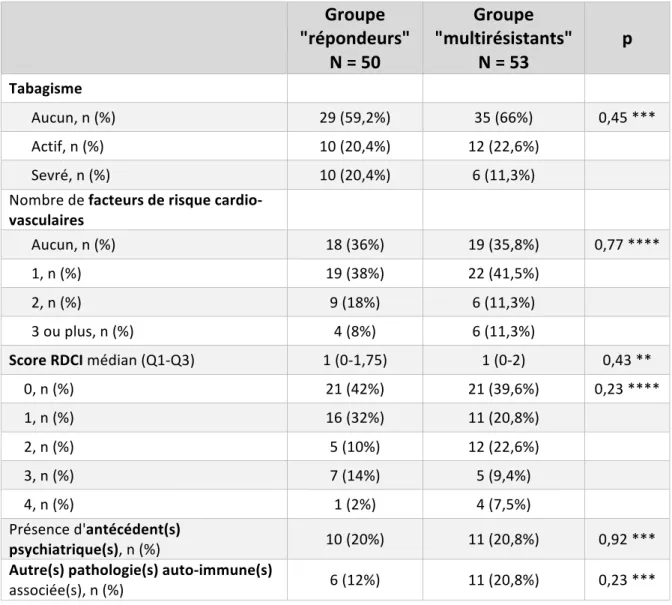
d. Tabagisme
Le tabagisme actif semble être un facteur associé à une moins bonne réponse et un moindre taux de rémission sous anti-TNFa, d’après les données de cohortes européennes [29–31], et cela de façon plus marquée sur le plan statistique pour l’infliximab [30]. Concernant le tocilizumab, une étude française sur 204 patients n’avait pas retenu de corrélation entre l’existence d’un tabagisme et la réponse au traitement [17].Quant aux traitements par rituximab et abatacept, certaines données présentées au congrès de l’ACR, respectivement en 2014 par Chatzidionysiou et al. et en 2015 par Finckh et al., ont suggéré que le tabagisme actif était associé à une moindre réponse à 6 mois et 1 an, uniquement dans les formes de PR avec anticorps anti-CCP positifs en ce qui concerne le rituximab.
e. Traitements associés
Concernant les anti-TNFa, Burmester et al ont montré que la naïveté face aux anti-TNFa était un facteur prédictif de réponse [14], et d’autres études ont mis en évidence que l’exposition à de multiples traitements biologiques antérieurs était associée à une moins bonne réponse [13]. Les données issues du registre britannique ont fait état d’une moins bonne réponse en l’absence de traitement par anti-inflammatoires non stéroïdiens (lié aux comorbidités du patients), ou de MTX (cf « développement d’anticorps anti-médicaments »), sans influence du nombre antérieurs de DMARDs utilisés [30].
Au sujet du tocilizumab, les données sont contradictoires : si Pers et al. n’avaient pas mis en évidence de corrélation entre le nombre de traitements antérieurs et la réponse thérapeutique [17], une autre étude a plus récemment rapporté qu’un nombre élevé de DMARDs ou de biothérapies était associé à une moins bonne réponse à 3 mois [32].
Il apparait également que l’exposition antérieure à des traitements biologiques, et notamment aux anti-TNFa, réduit les chances de réponse au rituximab [33,34]. Il existe peu de données concernant l’abatacept, les données du registre français ORA n’ont pas montré d’influence du nombre de biothérapies ou de DMARDs antérieurs sur la réponse au traitement [35].
f. Comorbidités
Il existe peu de données concernant l’impact des comorbidités sur la réponse aux traitements biologiques. Quelques études ont montré qu’un faible nombre (£ 1) de comorbidités était prédictif d’une meilleure réponse aux anti-TNFa [14,36]. Concernant le tocilizumab, il a été rapporté que l’absence de pathologies cardio-vasculaires avant le début du traitement serait associée à une meilleure réponse à 6 mois [17].
2. Facteurs liés aux caractéristiques de la maladie
a. Activité de la maladie
Il existe des données contradictoires concernant l’activité de la PR à l’initiation du traitement, évaluée par le score DAS28.
Tandis que Burmester et al. mettaient en évidence qu’un DAS 28 bas était prédictif de réponse aux anti-TNFa [14], les données du registre britannique ne retrouvaient pas d’association significative [30].
Pour le tocilizumab et le rituximab, les données sont là encore discordantes [16,19,32,34].
En ce qui concerne l’abatacept, Gottenberg et al. ont montré que le DAS28 était significativement plus élevé à l’initiation du traitement chez les patients répondeurs [35].
b. Syndrome inflammatoire biologique
S’il est apparu nettement dans plusieurs études que l’existence d’une élévation de la vitesse de sédimentation (VS) et de la proteine C-réactive (CRP) à l’initiation du traitement pourrait être un élément prédictif de réponse au tocilizumab [17,32], les données sont
contradictoires en ce qui concerne les anti-TNFa, et on ne dispose pas de données pour l’abatacept et le rituximab.
c. Retentissement fonctionnel
Dans la littérature, il apparait pour l’ensemble des biothérapies (à l’exception des inhibiteurs de JAK-STAT pour lesquels on ne dispose pas encore de données) qu’un faible retentissement fonctionnel à l’initiation du traitement, évalué par le score HAQ (Health Assessment Questionnaire), est prédictif de bonne réponse au traitement [15,16,19,34].
d. Facteur rhumatoïde et anticorps anti-peptides citrullinés
(anti-CCP)
Différentes études ont montré que la positivité du facteur rhumatoïde et des anti-CCP, ainsi que leur taux, était associés à une moindre réponse aux anti-TNFa [37–39]. La double positivité (facteur rhumatoïde et anti-CCP) est associée à un meilleur taux de maintien thérapeutique pour l’abatacept [40], mais seule la positivité des anti-CCP a été associée de manière significative à la réponse EULAR à 6 mois (résultat non significatif pour le facteur rhumatoïde) d’après les données du registre ORA [35]. Il semble également exister une corrélation positive avec le taux des anti-CCP [41]. La positivité du facteur rhumatoïde et des anti-CCP a également été mise en évidence comme un facteur prédictif de réponse au rituximab [42], avec une influence du taux d’anti-CCP. En effet, des taux élevés majoraient de 3 à 4 fois les chances de répondre au traitement [33].D. Mécanismes de résistance et de multirésistance
1. Généralités
Les mécanismes de multirésistance aux traitements ont été largement étudiés dans d’autres domaines de la médecine, notamment en cancérologie ou encore en infectiologie, pour lesquels les mécanismes ont été mieux compris.
En effet, en cancérologie, le rôle majeur des transporteurs ABC a été identifié. Il s’agit d’une famille composée d’au moins 48 transporteurs, incluant des pompes à efflux transmembranaires telles que P-gp (P-glycoprotein) ou la protéine MDR1 (Multi-drug resistance-1), influençant la réponse aux chimiothérapies. Il existe également bien d’autres mécanismes favorisant la résistance aux traitements : surexpression de protéines anti-apoptotiques, dégradation des molécules par autophagie, hypoxie, réparation des dommages ADN causé par la chimiothérapie, ou encore régulation épigénétique [43].
Concernant la multirésistance aux agents anti-infectieux, celle-ci peut également être le fait de mécanismes biochimiques via les pompes à efflux. Il existe par ailleurs des causes génétiques, de transmission verticale mais aussi horizontale par la transmission de plasmides. La cible bactérienne ou virale peut également être le siège de mutation, entrainant l’inefficacité du traitement. La multirésistance peut aussi acquise au fil des lignes successives de traitement par sélection de souches résistantes [44].
2. La résistance aux traitements dans la polyarthrite
rhumatoïde
a. Résistance aux traitements de fond conventionnels
En ce qui concerne la PR, ces mécanismes ont surtout été étudiés pour les DMARDs. Plusieurs études ont suggéré le rôle de la glycoprotéine-P (P-Gp) et d’autres pompes à efflux telles que MRP1 [45,46]. En effet, une étude ancienne menée par Jorgensen et al. a montré l’expression de la P-Gp dans la membrane synoviale de patients atteints de PR, et cette expression semblait associée au nombre de DMARDs utilisé (p<0,01 pour plus de 3 DMARDs) [47]. Par ailleurs, une surexpression de la P-Gp par les lymphocytes de patients atteints de PR par rapport à des sujets sains a été mise en évidence, et cela à un degré supérieur chez les patients présentant une polyarthrite active (DAS28 > 5,1) malgré l’utilisation de 2 DMARDs ou d’un DMARD associé à une corticothérapie pendant plus de 2 ans [48]. Llorente et al. ont également rapporté une activité de la P-Gp au niveau des lymphocytes plus élevée chez les patients réfractaires aux DMARDs par rapport aux patients répondeurs (P=0,06). Il semble également y avoir une corrélation entre cette activité de la P-Gp et le taux
l’expression de la P-Gp par le TNFa. Mais il est également possible que cette corrélation reflète uniquement une activité plus forte de la maladie sous traitement chez les patients sur-exprimant la P-Gp, et témoigne donc de leur résistance au traitement. D’autres études ont également fait état d’une possible régulation de l’activité et/ou de l’expression de la P-gp via les cytokines, mais les données sont contradictoires [50].
Concernant le MTX, son action sur le métabolisme des folates l’expose à d’autres mécanismes de résistance qui lui sont propres, liés à certains polymorphismes portant sur des gènes impliqués dans le métabolisme des folates [51].
b. Résistance aux biothérapies
i)
Innée
Celle-ci a été relativement peu étudiée, essentiellement au sujet des anti-TNFa. Plusieurs polymorphismes génétiques ou Single Nucleotide Polymorphism (SNP) ont été identifiés comme pouvant influencer la réponse aux anti-TNFa ou au rituximab, mais seul un nombre restreint de ces derniers a été confirmé [52,53].
ii)
Acquise
L’acquisition d’une résistance sous biothérapie est à l’heure actuelle mieux comprise, notamment en ce qui concerne la classe des anti-TNFa, grâce à la mise en évidence de leur immunogénicité, pouvant expliquer l’échec secondaire. En effet, Maini et al. rapportait la présence d’anticorps anti-infliximab chez 21% des patients sous 3 mg/kg et 7% sous 10 mg/kg, réduit respectivement à 7 et 0% grâce à l’adjonction de MTX [54]. L’infliximab apparait clairement le plus immunogène du fait de son caractère chimérique. Concernant les autres anti-TNFa, les données varient entre les études, notamment en raison de techniques de dosages différentes [55,56]. L’etanercept semble le moins immunogène des anti-TNFa, un constat qui pourrait s’expliquer par sa conformation particulière (protéine de fusion). La présence de ces anticorps semble associée à la survenue de réactions allergiques [57], et à une diminution de la réponse [58,59]. Concernant les molécules telles que l’abatacept, le tocilizumab et le rituximab, elles semblent quant à elles peu immunogènes, le taux d’anticorps anti-médicament mis en évidence restant inférieur à 4% dans les différentes études [60–63].II. OBJECTIFS DE L’ETUDE
Le développement des biothérapies et leur diversité ont contribué à révolutionner la prise en charge et le pronostic de la PR.
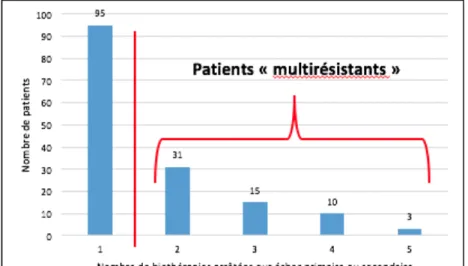
Cependant, nous avons pu constater l’émergence d’une population particulière de patients, pouvant être qualifiés de « multi-résistants ».
Il n’existe pas de définition consensuelle de la multirésistance aux traitements biologiques, et peu de données à ce sujet. Un travail original, rétrospectif, établi à partir des données du registre britannique (British Society for Rheumatology Biologics Register, BSRBR), mené par Kearsley-Fleet L. et al. et présenté au congrès de l’ACR en 2017, a tenté de mieux décrire cette population [64]. Il a comparé les données de patients décrits comme réfractaires, ayant utilisé 3 classes thérapeutiques ou plus (toutes causes d’arrêt confondues), à des patients dont la biothérapie initiale par anti-TNFa était maintenue plus de 10 ans. Les patients réfractaires représentaient 5% de la population étudiée. Il ne semblait alors pas y avoir de différence significative entres les 2 groupes, hormis un retentissement fonctionnel initial plus important chez les patients résistants. Cette étude, malgré son effectif important de patients, présente plusieurs limites, notamment en incluant dans sa définition tous les motifs d’arrêt, et l’existence de données manquantes.
L’objectif principal de notre étude est de décrire les caractéristiques cliniques et paracliniques des patients multi-résistants. Dans notre travail, la multirésistance est définie par l’échec, primaire ou secondaire, d’au moins 2 biothérapies. L’objectif secondaire était d’identifier des facteurs associés à la multirésistance aux traitements biologiques dans la PR.
III. MATERIELS ET METHODES
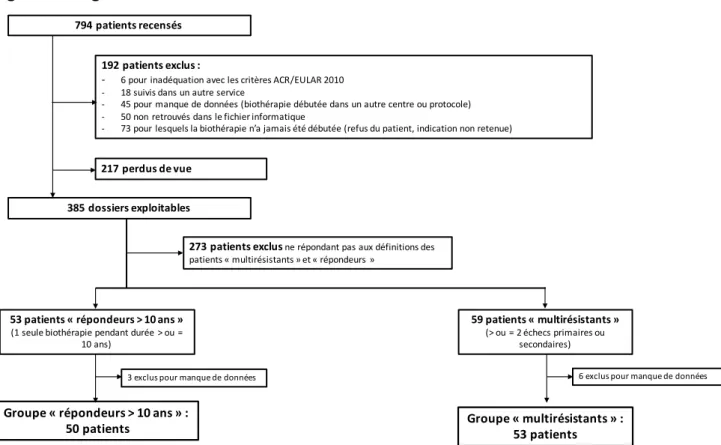
A. Sélection des patients répondeurs et multirésistants
Dans un premier temps, nous avons recensés les patients admis pour l’administration d’une biothérapie moléculaire dans le cadre d’une PR, entre janvier 2007 et juillet 2017, en hôpital de jour de Rhumatologie au Centre Hospitalier Universitaire (CHU) de Rouen, à l’aide : - du logiciel Pharma version 5.8 (éditeur : Computer Engineering) pour les patients ayant reçu une biothérapie entre le 01/01/2010 et le 01/07/2017 pour une indication renseignée « polyarthrite » au CHU de Rouen. Tous les biomédicaments (à l’exception de l’anakinra) sont remboursés en sus des GHS. Dans le cadre du Contrat de Bon Usage, il est donc obligatoire pour le prescripteur de renseigner l'indication puis au préparateur/pharmacien de la rentrer dans le logiciel lors de la dispensation. Cela permet d'extraire par indications toutes les consommations pour ces médicaments. De plus, concernant les biothérapies par voie sous-cutanée, la première injection s’effectuant au CHU de Rouen en hospitalisation de jour, elle est délivrée par la pharmacie intra-hospitalière et est soumise aux mêmes règles de prescription et de remboursement. Pour l’anakinra, seules les dates de dispensation ont pu être obtenues, permettant ensuite de retrouver les patients correspondants via le système d’informatisation des dossiers du CHU de Rouen.- du codage de la CIM-10 pour les patients répondant au codage M06.9 (polyarthrite rhumatoide) ou Z51.2 (autres chimiothérapies) en hôpital de jour de Rhumatologie au CHU de Rouen entre le 01/01/2007 et le 13/07/2010. Chacun des dossiers de cette base de données a été étudié rétrospectivement, sur une période de suivi allant de l’initiation de leur première biothérapie au mois de décembre 2017. Ont été exclus :
- les patients étant suivis dans un autre service du CHU de Rouen ou ayant été suivi antérieurement pour biothérapie dans un autre établissement
- les patients ne remplissant pas les critères diagnostiques de PR ACR/EULAR 2010
- les patients n’ayant jamais reçu la biothérapie (répondant au codage M06.9 mais pas Z51.2; commandée à la pharmacie mais non administrée)
- les patients perdus de vue, sans connaitre le motif d’arrêt de la dernière biothérapie reçue dans notre service Grâce au suivi standardisé des patients (comptes-rendus informatisés d’hospitalisation de jour et de suivi en consultation annuelle de renouvellement de biothérapie comportant les données cliniques et paracliniques usuelles), nous avons, pour chaque dossier exploitable de notre file active de patients (remplissant les critères ACR/EULAR 2010 et ayant reçu au moins une biothérapie dans notre service), recueilli le nombre de biothérapies reçues, la nature de chacune d’entre elles, sa durée et son éventuel motif d’arrêt : échec primaire, échec secondaire ou autre cause (effet indésirable ou survenue d’une contre-indication à la poursuite de la biothérapie). L’échec primaire était défini comme l’absence d’efficacité d’une biothérapie maintenue au minimum 4 mois et ayant conduit à son arrêt. L’échec secondaire était défini comme une inefficacité, survenant après une période initiale d’efficacité du traitement, et ayant conduit à son arrêt du fait de cette inefficacité [65]. A partir de ce recueil, nous avons identifié et sélectionné parmi les patients de notre file active, 2 groupes de patients : - un groupe de « patients multi-résistants », correspondant aux patients ayant présenté au moins 2 échecs, primaires et/ou secondaires, à différentes molécules. Dans la littérature, il n’a pas été retrouvé de définition consensuelle de la multirésistance aux biothérapies. - un groupe de « patients répondeurs », correspondant aux patients n’ayant reçu qu’une seule biothérapie efficace, pour une durée supérieure ou égale à 10 ans.
En vue d’une analyse supplémentaire, nous avons identifié, au sein du groupe « multirésistants », un sous-groupe de patients ayant présenté au moins 2 échecs primaires à différentes molécules, afin de les comparer également au groupe « répondeurs ».
B. Recueil des données
Les données cliniques et radiographiques de ces patients ont été recueillies grâce au suivi standardisé dans les comptes-rendus d’hospitalisation de jour et de consultation de suivi ou de renouvellement intra-hospitalier de biothérapie, et/ou dans les cahiers d’observation issus des archives en cas de données manquantes. Certains patients ont été contactés partéléphone lorsque la consultation des archives n’avait pas permis de recueillir certaines données. Lorsque le nombre de données manquantes pour un même dossier était trop important (>2 parmi les données démographiques et le tabagisme) ou que le DAS28 VS et CRP à l’initiation de la première biothérapie était indisponible, le patient était exclu de l’analyse finale. Pour certaines données fréquemment manquantes (HAQ, délai avant initiation du premier DMARD), elles ont été signalées dans la partie Résultats. Les données biologiques ont été obtenues à partir des examens réalisés au laboratoire du CHU de Rouen.
1. Données démographiques
Les informations recueillies étaient : - le sexe - l’âge à l’introduction de la première biothérapie - le poids (en kilogrammes) et la taille (en mètres) avec calcul de l’IMC (en kg/m2) à l’initiation de la première biothérapie
- la catégorie socio-professionnelle à l’initiation du traitement biologique, ou antérieure concernant les patients retraités, selon la nomenclature de l’Institut National de la Statistique et des Etudes Economiques (INSEE) de 2003.