L’étude de l’interaction entre les chondrocytes et le
collagène modifié par le 4-Hydroxynonénal :
Implication dans le développement de l’arthrose
par Rana El Bikai
Département de Pharmacologie, Université de Montréal Faculté de médecine.
Mémoire présenté à la Faculté des études supérieures en vue de l’obtention du grade de maîtrise (M.Sc.)
en Pharmacologie
Janvier, 2010
Faculté des études supérieures et postdoctorales
Ce mémoire intitulé :
L’étude de l’interaction entre les chondrocytes et le collagène modifié par le 4-Hydroxynonénal :
Implication dans le développement de l’arthrose
Présenté par : Rana El Bikai
A été évalué par un jury composé des personnes suivantes :
• Ghayath Baroudi, président-rapporteur
• Mohamed Benderdour, directeur de recherche • Hassan Fahmi, co-directeur
Résumé
OBJECTIF: Récemment, nous avons démontré que la modification du collagène type II (Col II) par le 4-hydroxynonénal (HNE), un produit de la peroxydation lipidique, est augmentée dans le cartilage arthrosique sans qu’on sache la signification de cette augmentation dans la pathogenèse de l’arthrose. L’objectif de cette étude vise à démontrer que cette modification affecte l’interaction chondrocytes/matrice extracellulaire (MEC) et en conséquence induit des changements phénotypiques et fonctionnels de ces cellules. METHODES: Des plaques de culture ont été préalablement cotées avec du Col II puis traitées avec du HNE (0.1-2 mM) excepté le puits contrôle. Les chondrocytes ont été ensuite ensemencés puis incubés pendant 48 heures. La viabilité des cellules est évaluée par le test MTT. Le Western blot est utilisé pour mesurer l’expression des molécules d’adhésion (l’ICAM-1 et l’intégrine α1β1), de la cyclooxygenase-2 (COX-2), du Col II ainsi que la phosphorylation de la p38 MAPK, ERK1/2 et NF-κB-p65. La RT-PCR en temps réel est utilisée pour mesurer l’expression de l’ARNm de l’ICAM-1, des intégrines α1β1, de la COX-2 et de la métalloprotéinases-13 (MMP-13). La détermination de l’expression de l’ICAM-1 à la surface des cellules est réalisée par cytométrie de flux. Des kits commerciaux ont servi pour mesurer le niveau de la MMP-13, de la prostaglandine E2 (PGE2), de l’activité de la caspase-8 et de la phosphorylation de la p38 MAPK, ERK1/2 et
NF-κB-p65. RESULTATS: La modification du Col II par 0.2 mM HNE induit significativement l’expression des molécules d’adhésion telles que l’ICAM-1 et l’intégrine α1β1, de la MMP-13 sans avoir un effet sur la morphologie, la survie et le phénotype
cellulaires. Nos résultats montrent aussi une forte augmentation de la phosphorylation de la p38 MAPK, d’ERK1/2 et de NF-κB-p65. Cependant, la modification du Col II par 2 mM HNE affecte la morphologie et la viabilité cellulaires et induit l’activité de la caspase-8. Elle inhibe fortement l’expression des integrines α1β1 et du Col II ainsi que la phosphorylation de l’ERK1/2 et de NF-κB-p65, mais par contre, induit significativement la production de la COX-2 et son produit la PGE2 ainsi que la phosphorylation de la p38
MAPK. Fait intéressant, le prétraitement des complexes HNE/Col II par 0.1 mM de carnosine empêche les changements phénotypiques et fonctionnels des chondrocytes. CONCLUSION : Ces nouveaux résultats suggèrent le rôle important de la modification du Col II par le HNE dans l’arthrose, en affectant le phénotype et le fonctionnement cellulaires des chondrocytes. La carnosine, par sa capacité de neutraliser le HNE, a révélé d’être un agent promoteur dans le traitement de l’arthrose.
Mots clés : Arthrose, chondrocyte, peroxydation lipidique, 4-hydroxynonénal, collagène type II, phénotype, catabolisme, inflammation, carnosine.
Abstract
OBJECTIVE: The regulation of cell phenotype and function by the surrounding environment is deeply altered by the oxidative modifications of extracellular matrix (ECM) components that modify their structural and functional properties. This modification may be one cause involved in cartilage degradation in osteoarthritis (OA). Type II collagen (Col II) was reported to be targeted for 4-hydroxynonenal (HNE) binding, a very reactive product of lipid peroxydation. In the present study, we investigated whether HNE-binding to Col II affects OA chondrocytes phenotype and function and then, we determined the protective role of carnosine treatment in preventing these changes. METHODS: Isolated human OA chondrocytes were seeded in control wells and in HNE/Col II adducts-coated plates and incubated afterwards for 48 hours. Adhesion molecules at protein and mRNA levels were determined by Western blotting, flow cytometry and real-time RT-PCR. Commercial kits were used to evaluate cell death, caspase-8 activity and levels of prostaglandin E2 (PGE2), matrix metalloproteinase-13 (MMP-13), MAPK and NF-κB-p65.
Col II, cyclooxygenase-2 (COX-2), MAPK and NF-κB-p65 levels were assessed by Western blotting. RESULTS: After 48 hours of incubation, the modification of Col II by 0.2 mM HNE induced strongly the expression of ICAM-1, integrin α1β1, MMP-13 and slightly COX-2 as well as PGE2 release without affecting cell morphology and viability as
well as Col II expression. However, the modification of Col II with 2 mM HNE induced shape changes of cells from typical chondrocyte-like polygon shape to round semi-detached, affecting cells viability and inducing caspase-8 activity. It inhibited the expression of ICAM-1, integrin α1β1 and Col II, but in contrast, induced strongly PGE2
release and COX-2 expression. All these effects were prevented by 0.1 mM carnosine treatment, an HNE trapping drug. Carnosine was added to HNE-modified, Col II-coated plates 1h before cell seeding. Upon examination of different signalling pathways involved in these responses, we found that modified Col II with 2 mM HNE inhibited strongly the phosphorylation of ERK1/2 and NF-κB-p65 but induced strongly p38 MAPK. In contrast, the results indicated that MAPK and NF-κB-p65 were activated when cells were incubated with modified Col II by 0.2 mM HNE. CONCLUSION: The interaction between chondrocytes and collagen-bound HNE modulates different signalling pathways via adhesion molecules regulation and consequently leads to the expression of catabolic and inflammatory factors. Carnosine was shown to be an efficient HNE trapping agent able to counteract these effects.
Keywords: Osteoarthritis, chondrocyte, lipid peroxydation, 4-hydroxynonenal, type II collagen, phenotype, catabolism, inflammation, carnosine.
Table des matières
Résumé Français i
Abstract iii
Table des matières v
Liste des figures viii
Liste des abréviations ix
Dédicace xi
Remerciements xii
Chapitre 1 : Introduction
1
1- Introduction
sur
l’arthrose
2
2- Structure et composition d’une articulation saine
2
2.1- Le cartilage articulaire 4 2.1.1- Le collagène 4 2.1.2- Les protéoglycans 6 2.1.3- Les chondrocytes 6 2.2- L’os sous-chondral 6
3- L’articulation
arthrosique
7
3.1- Destruction du cartilage articulaire 7
3.2- Remodelage de l’os sous-chondral 10
3.3- Les ostéophytes 11
4- Le rôle des facteurs inflammatoires et cataboliques dans la
pathogenèse de l’arthrose
12
4.1- Les molécules pro-inflammatoires 14
4.1.1- Cyclooxygénases et prostaglandines E2 14 4.1.2- Les cytokines pro-inflammatoires : L’interleukine 1β (IL-1β) 15
4.2- Les facteurs cataboliques 16
4.2.1- Les protéinases 16
4.2.2- Les métalloprotéinases de la matrice (MMPs) 17
5- L’interaction entre la matrice extracellulaire et les chondrocytes 21
5.1- Les intégrines 23
5.2- ICAM-1 25
6- Les
stress
oxydatif
26
6.1- Les lipides et la cellule 26
6.2- Le stress oxydatif et les molécules antioxydantes 26
6.3- La peroxydation lipidique 27
6.3.1- Le 4- Hydroxynonénal (HNE) 31
7- La formation des complexes HNE/protéines
34
8- La modification de la matrice extracellulaire par les produits
oxydatifs
36
9- HNE et voies de signalisations
39
10- Les chélateurs des produits de la peroxydation lipidique
40
11- La carnosine : Un trappeur
de
HNE
42
12- Objectif
43
13- Hypothèse
44
Chapitre 2 : Article
45
Abstract
47
Introduction
49
Material and Methods
52
Results
59
Discussion
63
Figure
Legends
74
Figures
77
Chapitre
3 : Discussion
83
Chapitre 4 : Conclusion
96
Chapitre 5 : Références
99
Liste des figures
Chapitre 1 : Introduction
Figure 1 : La différence entre une articulation saine et une articulation arthrosique 3 Figure 2 : Les différentes zones constituant le cartilage articulaire 5 Figure 3 : L’homéostasie du cartilage contrôlée par les cytokines 9 Figure 4 : Le déséquilibre anabolique et catabolique 13
Figure 5 : Les protéinases 18
Figure 6 : Le clivage du collagène 19 Figure 7 : Le stress oxydatif et le 4-Hydroxynonénal (HNE) 28 Figure 8 : La peroxydation lipidique 30 Figure 9 : La structure du 4-Hydroxynonénal (HNE) 33 Figure 10 : La complexation du 4-Hydroxynonénal (HNE) avec d’autres molécules 37
Chapitre 3 : Discussion
Figure 11 : Altération de l’interaction entre cellule et matrice extracellulaire modifiée par le 4-Hydroxynonénal (HNE) 86
Liste des abréviations
AGEs: Advanced Glycation End Products. AP-1: Activator Protein-1.
Arg: Arginine. Ca2+: Calcium. CAR: Carnosine.
Col II : Collagène type II.
COMPs : Cartilage Oligomeric Protein. COX : Cyclooxygénase.
COX-1 : Cyclooxygénase-1. COX-2 : Cyclooxygénase-2. CYS: Cystéine.
CYS-374: Cystéine 374.
DDR 2: Discoidin domain Receptors 2. DDR: Discoidin Domain Receptors. DNPH: 2, 4-Dinitrophenylhydrazine.
ERK: Extacellular Signal Regulated Kinase. FAK: Focal Adhesion Kinase.
GLY: Glycine.
GPxs: Glutathion Peroxydase.
GrB: Growth factor receptor-Bound protein. GSH: Glutathione.
GST: Gluatathion-S-Transferase. HHE: 4-Hydroxy-2-Hexenal. HIS: Histidine.
HNE: 4-Hydroxynonénal.
ICAM-1: Inter-Cellular Adhesion Molecule 1. IGF-1: Insulin-like Growth Factor-1.
IL-1R: Interleukin-1 Receptor. IL-1α : Interleukin-1α.
IL-1β : Interleukin-1β. IL-6 : Interleukin-6 IL-8: Interleukin-8
iNOS: inducible Nitric Oxide Synthase. JNK: c-Jun N-Terminal Kinase.
KO: Knock-Out.
LFA-1: Leucocyte Function Associated Antigen-1. LPO: Peroxidation Lipidique.
MAPK: Mitogen-Activated Protein Kinase. MDA: Malondialdehyde.
MEC: Matrice extracellulaire.
MMP-1: Matrix MetalloProteinase-1. MMP-13: Matrix MetalloProteinase-13. MMP-8: Matrix MetalloProteinase-8. MMPs: Matrix MetalloProteinases.
MTT: 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, a tetrazole. NF-κB p65: Nuclear Factor kappa B.
NK: Natural Killer. NO: Nitric Oxide.
PBS: Phosphate Buffered Saline. PGE2: Prostaglandine E2. PGs : Prostaglandines. PKC: Protein Kinase C.
RAGE : Receptor for the Advanced Glycation End Product. ROS: Reactive Oxygen Species.
SOD: Superoxide Dismutase.
TGF β: Transforming Growth Factor β. TGF -β1: Transforming Growth Factor β 1. TNF α: Tumor Necrosis Factor α.
À mes parents qui m’ont encouragé tout au long de mon parcours,
À mes amis qui étaient présents en tout temps et m’ont aidé à surmonter les moments difficiles,
Et surtout à mon frère et ma cousine qui représentent ma famille au Canada,
Remerciements
Un spécial remerciement à mon directeur de Recherche Dr. Mohamed Benderdour, pour sa patience et son encouragement continu au cours de ma maîtrise et qui est pour moi un exemple de gentillesse, d’intelligence et de clairvoyance. Je le remercie pour m’avoir accueillit dans son laboratoire et m’avoir donné le goût de la recherche.
Je lui souhaite le meilleur dans sa carrière et dans la vie. Un Grand Merci.
Je remercie Dr. Shi Qin pour ses conseils et sa patience. Je tiens également à remercier Dr. Julio Fernandes pour nous avoir permis l’accès à son laboratoire et surtout pour son enthousiasme et son encouragement.
Je remercie Dr. Karim Maghni pour sa précieuse collaboration, qui nous a permis d’enrichir mon projet de recherche en utilisant la technique du FACS. Je remercie aussi bien Dr. Mélanie Welman pour sa gentillesse et pour avoir accepté d’entamer cette technique sous sa supervision et surtout pour m’avoir appris cette technique, je tiens à lui exprimer toute ma gratitude.
N’oubliant pas le Centre de Recherche pour son accueil et les IRSC pour le financement de ce projet et pour leur incitation continue pour la recherche.
Finalement, je remercie les membres du jury qui ont consacré leur temps pour l’étude de mon mémoire, j’apprécie leurs efforts et leurs supports.
1- INTRODUCTION SUR L’ARTHROSE
L’ostéoarthrose, un sous type d’arthrite, est une maladie chronique dont souffre la majorité de la population âgée et ceci cause un problème socio-économique majeur. L’arthrose est caractérisée par une destruction progressive du cartilage au niveau de l’articulation, une fibrose de la capsule articulaire et un remodelage de l’os sous-chondral causant l’apparition d’ostéophytes (Figure 1). Elle atteint le plus souvent les genoux, les hanches et les mains. Le diagnostic de l’arthrose se fait grâce à une radiographie, montrant une déformation articulaire. Les symptômes de la maladie sont des douleurs modérées ou aigues au niveau de l’articulation, entrainant des limitations de mouvement, et des bruits de craquements, de plus, des inflammations articulaires secondaires peuvent être détectées (Guccione et al., 1994). Les facteurs de risques potentiels menant au développement de l’arthrose sont: l’obésité, les facteurs génétiques, l’âge et les activités physiques forcées (Helmick et al., 1995; Lawrence et al., 1998).
2- STRUCTURE ET COMPOSITION D’UNE ARTICULATION SAINE
Une articulation, par définition est une jonction permettant de relier deux extrémités osseuses leur donnant ainsi une mobilité l’une par rapport à l’autre. Les extrémités osseuses d’une articulation sont enrobées d’un cartilage articulaire, cette mince couche de matériaux minéraux et organiques contribue à l’amortissement des choques et à la lubrification de l’articulation. Les deux tissus prédominants au niveau articulaire sont le cartilage et l’os sous-chondral.
Figure 1 : La différence entre une articulation saine et une articulation arthrosique. Schéma montrant l’évolution de l’articulation, en passant d’un état normal vers un état arthrosique.
2.1- Le cartilage articulaire
Le cartilage est un tissu conjonctif avasculaire et non innervé, il enrobe les extrémités osseuses et permet d’absorber les choques mécaniques rendant ainsi l’articulation plus résistante (Mow et al., 1992). Le cartilage est en majorité constitué de collagène, de protéoglycans et d’eau, ce dernier étant le constituant majeur (65-85 %) (Mankin and Thrasher, 1975). D’autres constituants de la matrice existent tels que l’acide Hyaluronique, les COMPs, les aggrégans, etc. Dans ce tissu existe un seul type cellulaire : les chondrocytes, qui sont responsables du renouvellement de la MEC au niveau du cartilage (Setton et al., 1999). La répartition et la forme de ces constituants varie selon la profondeur du cartilage. Il en existe quatre zones constituant le cartilage : Une zone superficielle, une zone moyenne ou transitionnelle, une zone profonde et une zone calcifiée (Venn, 1979) (Figure 2).
2.1.1- Le collagène
Le collagène est le constituant majeur du cartilage à part l’eau. Il existe plusieurs types de collagène, mais le plus abondant est le collagène type II (Col II). Les molécules de collagènes s’associent en forme de fibrilles de différentes tailles et épaisseurs. La disposition de ces fibrilles varie en fonction de la profondeur du tissu cartilagineux (Clark, 1991). Le Col II est formé de trois chaines identiques de polypeptides ((α I)2, (α II)1) qui s’enroulent et forment une triple hélice. Ce réseau de collagène articulaire procure une
Figure 2 : Les différentes zones constituant le cartilage articulaire. Le schéma A montre la répartition des chondrocytes en fonction des différentes zones du cartilage. Et le schéma B indique la disposition des fibres de collagène et des protéoglycans dans ces zones. Dans la zone superficielle, on observe une condensation des fibres de collagène qui sont disposées parallèlement à la surface articulaire, et une faible contenance en protéoglycans. Dans la zone moyenne, les fibres de collagène sont disposées aléatoirement et la contenance en protéoglycans est au maximum. Finalement, dans la zone profonde, les fibres de collagène sont épaisses et perpendiculaires par rapport à l’os sous-chondral. Dans cette zone, la présence de protéoglycans est minime.
résistance contre les choques subit au niveau de l’articulation, de plus, il aide à maintenir la forme et le volume de ce tissu conjonctif (Martel-Pelletier et al., 2008).
2.1.2- Protéoglycans
Les protéoglycans sont les deuxièmes constituants majeurs du cartilage articulaire après le collagène. Un protéoglycan est formé d’une chaine primaire de protéines de laquelle irradient de nombreuses chaines de glycosaminoglycanes. La structure macromoléculaire de ces protéines les rend très volumineux. Les protéoglycans sont hydrophiles et sont caractérisés par leur flexibilité et leur capacité à se déformer réversiblement suite à un stress mécanique (Muir, 1983).
2.1.3- Les chondrocytes
Les chondrocytes (2% du volume total du cartilage) (Poole AR, 2001) baignent dans une MEC formée majoritairement par de l’eau, du Col II et de protéoglycans. L’interaction entre les cellules et la MEC est crucial pour la subsistance de ce type cellulaire vue l’inexistante interaction cellule-cellule. Les chondrocytes vivent dans un milieu anaérobique, l’apport en nutriments et l'élimination des déchets se fait par diffusion à travers la MEC. Les chondrocytes sont responsables du renouvellement et de la maintenance de cette matrice (Martel-Pelletier et al., 2008).
2.2- L’os sous-chondral
L’os sous-chondral est protégé par le cartilage articulaire qui l’enrobe. Les constituants de cet os sont : les ostéoblastes qui sont responsables de la formation osseuse, les ostéoclastes qui ont pour rôle de dégrader le tissu osseux, les ostéocytes et la MEC. Cette matrice est formée de molécules minéralisées telles que l’ostéocalcine, de cristaux hydroxyapatites et de molécules non minéralisées telles que le collagène type I. L’équilibre de cette composition osseuse est importante afin de garder l’homéostasie des tissus osseux et cartilagineux (Burr, 2004). L’os peut être séparé anatomiquement en deux entités: Le plateau de l’os chondral et l’os chondral trabéculaire. Le plateau de l’os sous-chondral est un os cortical non poreux et pauvrement vascularisé. Il est séparé du cartilage articulaire par la zone calcifiée qui constitue la limite entre les tissus osseux et cartilagineux (Goldring, 2008).
3- L’ARTICULATION ARTHROSIQUE
L’équilibre et l’homéostasie au niveau des tissus articulaires sont cruciaux pour maintenir une articulation saine. Au moment où cet équilibre est rompu, des changements phénotypiques et morphologiques apparaissent et mènent à une destruction du cartilage articulaire (von der Mark K, 1986; von der Mark et al., 1977), un remodelage osseux et par la suite une perte de la fonction articulaire normale. Les stress mécaniques, le stress oxydatif, l’âge et plein d’autres facteurs conduisent au déséquilibre entre les fonctions anaboliques et cataboliques, conduisant ainsi à la destruction du cartilage articulaire et à l’apparition d’ostéophytes (Martel-Pelletier et al., 2008).
3.1- Destruction du cartilage articulaire
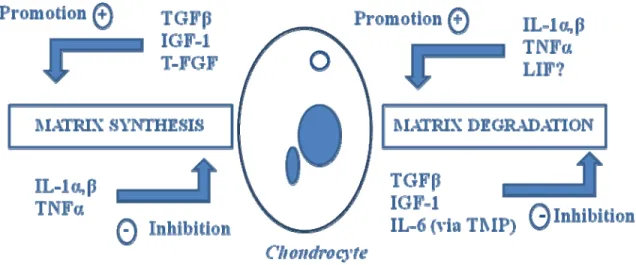
Les chondrocytes étant le seule type cellulaire existant au niveau du cartilage, ils sont alors les seuls à maintenir l’homéostasie de ce tissu. Malgré leur faible présence ils sont capables de maintenir et régénérer la MEC. Les chondrocytes ont une forte activité métabolique, ils maintiennent l’équilibre entre (i) le processus anabolique contrôlé par le facteur de croissance 1 analogue à l'insuline (IGF-1) et le facteur de croissance transformant beta1 (TGF-β1) qui stimulent la production des macromolécules de collagène et de protéoglycans (Westacott and Sharif, 1996) ; et (ii) le processus catabolique contrôlé par les cytokines pro-inflammatoires telles que l’interleukine-1 beta (IL-1β) et le facteur de nécrose tumorale alpha (TNF-α) qui stimulent la synthèse les métalloprotéases (MMPs) responsables de la dégradation de la MEC (Mankin et al., 1971). Lorsque le diagnostic de l’arthrose est déclaré, ceci indique que le déséquilibre de cette homéostasie est établi. Dans le cas d’arthrose précoce, on observe généralement une accumulation d’eau au niveau du cartilage, ce qui mène à l’altération structural du réseau de collagène et ainsi la perte de l’élasticité articulaire. Au cours du développement de la maladie, on a une perte graduelle des protéoglycans et un clivage de la triple hélice de collagène conduisant à la dégradation progressive du cartilage (Mankin et al., 1971). Les chondrocytes tentent de réparer les dommages causés mais l’équilibre entre la synthèse et la dégradation est rompue favorisant le processus catabolique, en augmentant la synthèse de cytokines pro-inflammatoires et des facteurs cataboliques (Mankin et al., 1971) (Figure 3).
Figure 3 : L’homéostasie du cartilage contrôlée par les cytokines. Le schéma ci-dessus montre l’effet de différentes cytokines pro-inflammatoires sur la MEC. Les cytokines « dites cataboliques » telles que l’IL-1α, β et le TNFα induisent la synthèse des métalloprotéases (MMPs) responsables de la dégradation de la MEC. Les cytokines « dites anaboliques » telles que le TGFβ et IGF-1 stimulent la production des constituants majeurs de la MEC tels que le collagène et des protéoglycans (Westacott and Sharif, 1996).
3.2- Remodelage de l’os sous-chondral
L’arthrose atteint autant les os que le cartilage articulaire. Des changements structuraux au niveau de l’os sous-chondral apparaissent et un remodelage de ce tissu mène à son épaississement, à la formation d’ostéophytes, à la libération de minéraux de la MEC et à la perte de l’élasticité articulaire (Boyd et al., 2002; Mansell et al., 1997; Neilson et al., 2004). L’os devient survascularisé et le développement de microfissures au niveau de la MEC contribue à ce remodelage. Des altérations au niveau de cette matrice ont lieu telle que la modification de la production des cytokines pro-inflammatoires, un changement structural du collagène et un changement au niveau de la minéralisation (Bailey et al., 2002). Le processus de remodelage est initié par une phase de résorption, qui implique l’activation des ostéoclastes. Ces derniers ont pour rôle de dégrader la matrice osseuse minéralisée (Teitelbaum, 2007; Teitelbaum and Ross, 2003). Suite à cela, la phase de formation commence et ceci indique une nouvelle formation osseuse par les ostéoblastes. Durant cette étape, on observe soit une minéralisation rapide caractérisée par un délai où le dépôt de matières minérales est rapide et suivie par une très faible minéralisation menant à la formation d’un os hypo-minéralisé facile à se déformer sous-pression (Burr, 2004; Day et al., 2001; Li and Aspden, 1997). Soit que cette étape peut être caractérisée par une minéralisation lente avec un dépôt minérale continue tout au long de la phase de formation. Ainsi, on aura un os hyper-minéralisé résistant aux agressivités subit au niveau de l’articulation mais plus facile à se casser. Ces deux formes de minéralisations mènent à une malformation osseuse (Day et al., 2001; Day et al., 2004). De plus, une atteinte du
collagène au niveau de la MEC semble jouer un rôle additionnel dans le remodelage osseux. En effet, on observe au niveau de l’os arthrosique une augmentation de l’hydroxylation et une présence anormale de chaines homotrimérique (α I)3 au lieu des
chaines hétérotrimériques (α I)2(α II)1 de collagène. Ces deux changements, l’hydroxylation
et la formation des chaines homotrimériques de type I sont responsables de la diminution des propriétés mécaniques de l’os (Bailey et al., 2002; Banse et al., 2002; McBride et al., 1998).
3.3- Les ostéophytes
Les ostéophytes sont des excroissances osseuses et fibrocartilagineuses, ils sont localisés aux extrémités de l’os, leur détection par radiographie est une évidence clinique de l’arthrose. Les cellules souches mésenchymateuses et les cellules du périoste présentes à la surface de l’os sont considérés comme la source de formation d’ostéophytes (Ackerman and Ahmad, 2000; Shirasawa et al., 2006). Le processus débute par une différentiation de ces cellules en chondrocytes qui s’hypertrophient par la suite, dû à l’ossification endochondral, conduisant à l’apparition de cette excroissance osseuse nommée ostéophyte. De plus, la production locale des facteurs de croissance telle que le TGFβ et l’IGF-1 promouvoit le développement de ces ostéophytes (Blaney Davidson et al., 2007; van der Kraan and van den Berg, 2007). Cependant, d’autres facteurs semblent moduler ce processus, comme le niveau d’oxygène présent au niveau de l’articulation et la pression dynamique des fluides. Par exemple, un pourcentage de 12-15% d’oxygène, qui est considéré comme un faible niveau, initie la chondrogenèse. De plus une faible pression
dynamique exercée par les fluides promouvoit cette différentiation favorisant ainsi la formation d’ostéophytes (Mukherjee et al., 2001; O'Driscoll et al., 1997).
4- LE RÔLE DES FACTEURS INFLAMMATOIRES ET CATABOLIQUES DANS LA PATHOGENÈSE DE L’ARTHROSE
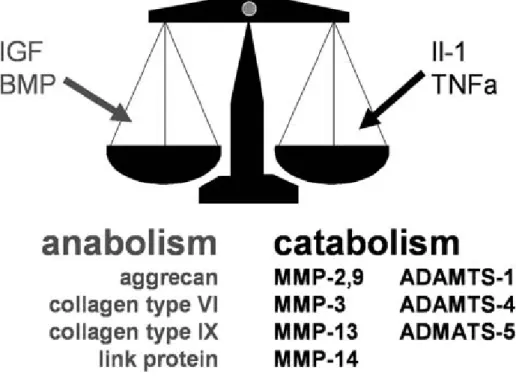
Au contraire de l’arthrite rhumatoïde, l’arthrose n’est pas considérée comme une maladie inflammatoire primaire, malgré qu’on retrouve au niveau de l’articulation arthrosique des molécules pro-inflammatoires, des cytokines et des facteurs de croissances. Dans le cartilage articulaire et même dans l’os sous-chondral on observe un déséquilibre entre les fonctions anaboliques (la synthèse) et les fonctions cataboliques (la résorption), ce qui mène à une destruction précoce du cartilage, un remodelage osseux et à une perte permanente de la structure et de la fonction articulaire normale. Les cytokines tel que l’IL-1β et la TNF α sont produites par les synoviocytes, les cellules mononuclées ou par le cartilage articulaire lui-même. Ces molécules stimulent l’expression géniques des MMPs tel que la MMP-13 et empêchent les chondrocytes de réparer la MEC dégradée. De plus, ces cytokines sont capables de stimuler la production de la prostaglandine E2 (PGE2) et la
libération de l’oxyde nitrique (NO) via l’induction de la cyclooxygenase-2 (COX-2) et la forme inductible de NO synthase (iNOS) respectivement (Farahat et al., 1993; Fernandes et al., 2002; Haraoui et al., 1991; Sofat, 2009) (Figures 4).
Figure 4 : Le déséquilibre anabolique et catabolique. Dans l’arthrose, la production des facteurs cataboliques sont plus favorisés que celle des facteurs anaboliques, ce qui mène à la destruction éventuelle du cartilage au niveau de l’articulation (Aigner et al., 2006).
4.1- Les facteurs pro-inflammatoires
4.1.1- Cyclooxygénases (COXs) et prostaglandines E2 (PGE2)
Les prostaglandines (PGs) appartiennent à la famille des eicosanoïdes, elles peuvent être sécrétées par presque tous types cellulaires. L’acide arachidonique qui est un acide gras polyinsaturé et provenant de notre apport alimentaire, est la source de la production des PGs (Funk, 2001; Smith, 1989). In vivo, la cyclooxygénase (COX) est une enzyme qui est capable de le transformer en PGs. Brièvement, l’acide arachidonique réside au niveau de la membrane phospholipidique des cellules, sa libération se fait grâce à une enzyme la phospholipase A2. Une fois libéré, il sera oxygéné par une deuxième enzyme la COX
donnant des produits intermédiaires tel que la prostaglandine H2, qui seront à leurs tours
transformés en produits finaux dans une chaine de réaction aboutissant à la production de la PGE2 (Bingham and Austen, 1999; Smith et al., 2000; Vane et al., 1998). Plusieurs
isoformes de cette enzyme existent, la forme COX-1 est constitutivement exprimée dans les tissus et contribue à leur homéostasie. Cependant, la COX-2, qui représente la forme induite de la COX, est régulée par les cytokines pro-inflammatoires, par les oncogènes et par les facteurs de croissance. Les PGs sont des marqueurs d’inflammation, dont leur production dépend largement de l’expression de la COX-2 (Dubois et al., 1998; Vane et al., 1998). Dans les tissus articulaires arthrosiques, on rapporte un niveau très élevé de la PGE2.
La production de cette molécule par les chondrocytes inhibe la synthèse du collagène, et induit la production des MMPs (Bunning and Russell, 1989). D’autre part, la PGE2 stimule
montrées que la PGE2 est capable de moduler la résorption osseuse en stimulant la
différentiation des cellules souches en ostéoclastes. Enfin la PGE2 est considérée comme
une molécule pro-inflammatoire vu sa capacité d’induire différents facteurs cataboliques et inflammatoires (Robinson et al., 1975).
4.1.2- Les cytokines pro-inflammatoires : Interleukine 1beta (IL-1β)
Les cytokines pro-inflammatoires jouent un rôle très important dans l’initiation et la progression de l’arthrose. L’IL-1β comme le TNFα induisent la production d’autres cytokines telles que l’IL-6 et l’IL-8 par les chondrocytes et les cellules synoviales. En plus, ils stimulent la synthèse de PGE2 et des protéinases (Bertolini et al., 1986). Il a été rapporté
que l’IL-1β est sécrétée dans son état actif dans le liquide synovial, la membrane synoviale et le cartilage provenant des patients atteints d’arthrose. Afin d’exercer son effet biologique, l’IL-1β se fixe à son récepteur à la surface des chondrocytes. Cette cytokine possède deux récepteurs l’IL-1R type I et type II ; le type I possède une plus grande affinité à l’IL-1β et c’est grâce à ce récepteur que les signaux de transduction sont transmis à la cellule. Plusieurs études démontrent que l’expression de l’IL-1R type 1 et l’IL-1β sont augmentées au niveau des chondrocytes et des synoviocytes arthrosiques, respectivement. Ceci rend les chondrocytes plus sensible aux stimulations par les IL-1β grâce à l’expression accrue de son récepteur, l’IL-1R type 1 (Martel-Pelletier et al., 1992; Sadouk et al., 1995). Cette cytokine exerce plusieurs effets sur les chondrocytes, elle atténue l’expression des constituants majeurs du cartilage tel que le Col II et les protéoglycans, tout en défavorisant les activités anaboliques (Goldring et al., 1988; Lefebvre et al., 1990). De plus, l’IL-1β est
impliquée dans la régulation de l’expression de certaines voies de signalisations, comme la voie des MAPK (Mitogen Activated protein Kinase), plus particulièrement les ERK (extracellular signal regulated kinase), la p38 MAPK, la JNK (c-Jun N-Terminal kinase) et le NF-κB (nuclear factor-kappa B) (Aigner et al., 2006; Mengshol et al., 2000). Lorsque l’IL-1β active la voie des MAPK, elle induit indirectement l’expression de la COX-2 et alors la production de la PGE2, ce qui amplifie l’inflammation au niveau articulaire.
4.2- Les facteurs cataboliques 4.2.1- Les protéinases
Comme déjà décrit plus haut, l’arthrose est caractérisée par une destruction du cartilage articulaire et par un remodelage osseux. La principale cause de ce dommage est la présence des protéinases au niveau de l’articulation. Dans les conditions normales, l’activité protéolytique de ces enzymes est contrôlée au niveau transcriptionnel et post-traductionnel (Murphy and Willenbrock, 1995). Normalement, ces enzymes contribuent à l’homéostasie de certains tissu, elles sont essentielles dans le développement embryonnaire, dans la croissance et dans le remodelage de certains tissu où la MEC doit se dégrader et se renouveler. Par exemple, lors de la croissance des os long, l’ossification endochondral est suivie par un remplacement du cartilage avasculaire par une matrice osseuse minéralisée et richement vascularisée (Ballock and O'Keefe, 2003; Ornitz and Marie, 2002; Provot and Schipani, 2005). Dans le cas de l’arthrose, les protéinases sont synthétisées par les chondrocytes d’une façon incontrôlable. Il existe cinq classes de protéinases, et elles sont classifiées selon le groupement chimique qui participe à l’hydrolyse des ponds peptidiques.
En premier lieu, on trouve des protéases à cystéine, à aspartate et à thréonine qui sont activés à pH acide dans le milieu intracellulaire. Ensuite, on trouve les protéases à sérine et les MMPs qui sont activés à pH neutre et agissent au niveau extracellulaire (Barrett, 1994). On s’intéresse dans cette étude surtout aux MMPs et plus spécifiquement à la MMP-13 qui est active dans le milieu extracellulaire et en particulier dans la matrice cartilagineuse (Figure 5). Les MMPs appartiennent à la famille des protéinases Zinc-dépendant, elles sont distinguées par leurs motifs de zinc qui sont hautement conservés et qui contiennent trois résidus d’histidines liés au zinc qui constituent le site catalytique (Stocker et al., 1995).
4.2.2- Les Métalloprotéinases de la matrice (MMPs)
Le réseau de collagène a une structure assez rigide et solide menant ainsi à la formation d’un cartilage résistant. Dans l’arthrose, la destruction des fibres de collagène est irréversible. Ces fibres sont formées par trois chaines de polypeptides qui s’enroulent pour former une triple hélice de droite, cette structure est assez résistante aux attaques protéolytiques. La collagénase, qui fait partie de la famille MMP, est la seule enzyme capable de cliver les trois chaines de la triple hélice produisant ainsi deux fragments de longueur différentes. Le premier fragment aura une dimension égale au trois quart de la longueur initial de la fibre de collagène et le quart restant constituera le deuxième fragment (Netzel-Arnett et al., 1991) (Figure 6).
Figure 5: Les Protéinases. Schéma montrant les différentes classes de protéinases, et les pH correspondant à leur état actif (Cawston and Wilson, 2006).
Figure 6: Le clivage du collagène. La collagénase coupe les fibres de collagène en deux fragments de différentes tailles, conduisant à la destruction du cartilage (Borkakoti, 2000).
En se basant sur la spécificité du substrat on peut distinguer différents types de MMPs, les collagénases, les stromelysines et les gélatinases. La famille des collagénases regroupe trois types de MMPs, la MMP-1 (fibroblaste collagénase 1), la MMP-8 (neutrophile collagénase 2) et la MMP-13 (collagénase 3). Malgré que toutes ces MMPs clivent les fibres de collagène, mais chacune a une affinité différentes envers un type de collagène (Netzel-Arnett et al., 1991). Par exemple, la MMP-8 a une préférence pour le collagène type I, alors que la MMP-13 en a une préférence envers le Col II. Concernant la destruction du cartilage, la MMP-13 est considéré l’enzyme principale contribuant à ce dommage vu sa grande affinité envers le Col II qui est le constituant majeur du cartilage articulaire. La synthèse de la MMP-13 est régulée par les cytokines et les molécules pro-inflammatoires qui se fixent sur leur récepteur au niveau des chondrocytes et médisent leur signal intracellulaire (Birkedal-Hansen et al., 1993). De même que le cartilage, l’os subit un remodelage et une dégradation de la matrice. Les ostéoclastes sont les principaux acteurs du remodelage osseux, ils sécrètent des ions H+ afin de décalcifier les matériaux minéraux de la matrice. Suite à cela, commence la dégradation de la matrice dans un environnement acide (pH entre 4 et 5) et hypercalcifié (entre 40 et 50 mM de Ca2+) (Delaisse, 1992). Les MMPs sont essentiels pour l’initiation du processus de résorption ostéclastique, puisque les MMPs et surtout la MMP-13 sécrété par les ostéoblastes, sont responsables de la dégradation du collagène au niveau de la surface osseuse. La destruction du réseau de collagène est essentielle afin de libérer la matrice des molécules non-minéralisé, permettant aux ostéoclastes de se fixer sur la matrice osseuse minéralisée et procéder avec la résorption (Takaishi et al., 2008). Pour conclure, dans l’arthrose on a une inflammation secondaire au
niveau des tissus articulaires (cartilagineux et osseux), ceci est mis en évidence par la production des cytokines et des molécules inflammatoires. Ces molécules stimulent les chondrocytes et les ostéoblastes à sécréter des médiateurs cataboliques tels que la MMP-13 qui sera responsable de la dégradation du réseau de collagène. Cette destruction est à l’origine de la disparition du cartilage articulaire et à l’initiation du processus de résorption osseuse et par la suite son remodelage. Donc les MMPs jouent un rôle très essentiel dans la progression de l’arthrose.
5- L’INTERACTION ENTRE LA MATRICE EXTRACELLULAIRE ET LES CHONDROCYTES
Dans le cartilage articulaire, on retrouve une faible proportion de chondrocytes. Étant donné qu’ils sont le seul type cellulaire existant, les chondrocytes jouent un rôle crucial dans le maintient de la stabilité et de l’homéostasie de ce tissu. Au niveau du cartilage, les chondrocytes ne communiquent pas entre elles mais par contre elles sont dépendantes de leur interaction avec la MEC. Les signaux sont transmis via des ligands solubles qui diffusent à travers la membrane et agissent au niveau des chondrocytes, ou par contact direct entre des molécules de la matrice et leurs récepteurs correspondant au niveau des cellules (van der Kraan et al., 2002). La MEC est un élément important dans la régulation de différentes fonctions cellulaires telles que la prolifération, la différentiation et l’expression du phénotype. Cette régulation se fait grâce à des « récepteurs d’adhésion » qui attachent les cellules aux molécules de la matrice et ceci dans les deux modèles in vivo et in vitro (Hynes, 1992). À la surface des chondrocytes on retrouve des récepteurs de la
matrice qui lient la MEC vers les constituants internes de la cellule tels que les éléments du cytosquelette et les composantes protéiques impliquées dans la transduction du signal. L’attachement des cellules aux molécules de la MEC via les récepteurs de surface stabilise le phénotype cellulaire. Une des familles les plus décrites des récepteurs de surface est l’intégrine, qui est une superfamille de glycoprotéines constituées de deux sous-unités distincts α et β (Hynes, 2002). Les chondrocytes expriment les deux sous-unités de l’intégrine à leur surface aussi bien que d’autres types de « récepteurs d’adhésion » tels que les CD44, l’annexine V (ou anchorine CII) et l’ICAM-1 (intracellular adhesion molecule-1) (Knudson et al., 1996; Loeser et al., 1995; Woods et al., 1994). Une autre famille de récepteur aussi importante que l’intégrine est exprimée par les chondrocytes, la famille des DDR (Discoidin doamin receptors). Les DDR appartiennent à la superfamille des récepteurs Tyrosine Kinase qui ont comme ligand le collagène. Le nanisme est une caractéristique des souris n’exprimant pas le récepteur DDR2 et ceci est dû à la diminution de la prolifération des chondrocytes au niveau de la plaque de croissance (Leitinger and Kwan, 2006; Shrivastava et al., 1997). Par contre, des études ont démontré une surexpression de ce récepteur au niveau des chondrocytes articulaires chez les souris arthrosique, ce qui met en évidence l’implication du DDR2 dans le développement de l’arthrose (Labrador et al., 2001; Xu et al., 2005). Les annexines V (anchorines II) exprimés à la surface des chondrocytes s’adhèrent spécifiquement au Col II. Lorsque l’anticorps anti-anchorine II masque le site de fixation de cette molécule, les chondrocytes se détachaient du Col II indiquant l’importance de ces molécules dans l’adhésion cellulaire. (Reid et al., 2000). Les CD44 sont des récepteurs membranaires qui se fixent au Hyaluronane. Cette
liaison affecte le fonctionnement des chondrocytes et l’homéostasie du cartilage (Ishida et al., 1997). Le blocage de ce récepteur par son anticorps induit la dégradation du cartilage. En conclusion, la MEC est importante pour la régulation de certaines fonctions des chondrocytes, donc une simple perturbation au niveau de cette interaction pourrait modifier l’activité des cellules en modulant la voie de signalisation, le phénotype et leur morphologie (Knudson et al., 2000).
5.1- Les intégrines
L’intégrine est une glycoprotéine transmembranaire hétérodimérique constituée d’une sous-unité α et d’une autre sous-sous-unité β. Cette protéine a un domaine extracellulaire lié à des protéines spécifiques de la matrice et un autre domaine cytoplasmique qui interagit avec le cytosquelette et les protéines de signalisation à l’intérieur de la cellule (Gumbiner, 1996). Les chondrocytes expriment à leur surface des sous-ensembles de la famille des intégrines, certains sont des récepteurs de la fibronectine (α5β1, αVβ3, αVβ5), d’autres sont des récepteurs de la laminine (α6β1) et d’autres sont les récepteurs du collagène (α1β1, α2β1, α10β1) (Egerbacher and Haeusler, 2003; Loeser, 2000; Loeser, 2002). L’intégrine se lie généralement aux composants de la MEC au niveau d’une séquence arginine-glycine-aspartate (RGD) (Ruoslahti, 1991). Une fois que les molécules de la matrice reconnaissent les intégrines un signal de transduction est généré et parvient du milieu externe vers l’intérieur de la cellule, ce qui s’appelle un signal « outside-in » (Loeser et al., 2000). Une panoplie de complexes protéiques se forment lorsque les cellules s’attachent à la matrice via les intégrines et c’est grâce à ces complexes que le signal est conduit vers l’unité
effectrice (le cytosquelette) à l’intérieur de la cellule (Clancy et al., 1997; Damsky and Werb, 1992; Parsons et al., 1994; Ruoslahti, 1991). La signalisation engendrée par les intégrines a fait le sujet de plusieurs études, ce qui a mis en évidence l’implication de ce récepteur dans l’homéostasie du cartilage (Loeser, 2002; Millward-Sadler and Salter, 2004). Les études faites sur la signalisation induite par l’intégrine in vitro indiquent que la perte de la sous-unité α1 spécifique pour l’adhésion au collagène mène à l’apoptose et à l’anomalie de la forme des chondrocytes. L’étude menée par Hirsch et al. démontre que l’utilisation d’un anticorps contre l’intégrine induit une répression de la différentiation hypertrophique et réduit la viabilité des chondrocytes (Hirsch et al., 1997). In vivo, le knockout (KO) des gènes des intégrines α10 et α1 résulte en une retardation de la croissance et en un disfonctionnement de la plaque de croissance (Bengtsson et al., 2005; Zemmyo et al., 2003). Au niveau de l’os, les récepteurs exprimés à la surface des cellules osseuses interagissent avec différentes protéines de la matrice telle que le collagène type I, la thrombospondine, la fibronectine, l’ostéopontine et la vitronectine. Certaines études démontrent la capacité de ces protéines à altérer la croissance, la morphologie et l’expression phénotypique des cellules osseuses (Masi et al., 1992; Seyedin and Rosen, 1990). Les ostéoblastes expriment différents sous-type d’intégrines tels que les sous-unités α1, α2, α3, α4, α5, αV et les sous-unités β2 et β3 qui jouent un rôle très important dans l’attachement des cellules à la matrice et dans la régulation de la formation et la résorption osseuse (Gronowicz and Derome, 1994; Grzesik and Robey, 1994). Ces récepteurs transmettent alors les informations de la matrice vers l’intérieur de la cellule à l’aide de
signaux de transduction mettant en œuvre différentes voies de signalisation comme la voie MAPK et des FAK (focal adhesion kinase) (Clark and Brugge, 1995).
5.2- ICAM-1
Plusieurs études ont démontré la présence de cytokines pro-inflammatoires au niveau de l’articulation arthrosique, ces molécules seront responsables de moduler l’activité des chondrocytes et seront capables de recruter des leucocytes à ce site inflammatoire via le récepteur ICAM-1. Ce dernier est une glycoprotéine exprimée à la surface cellulaire, elle a été définie par un anticorps monoclonal qui inhibe l’agrégation du phorbol ester lors de la stimulation par des leucocytes (Dustin et al., 1986). L’ICAM-1 agit comme un ligand des LFA-1 (Leucocyte function associated antigen-1) présents à la surface des lymphocytes, macrophages/monocytes, granulocytes et les cellules NK (Natural killer) (Marlin and Springer, 1987; Rothlein et al., 1986). Au cours de l’inflammation, les leucocytes et les lymphocytes stimulent et régulent l’expression de l’ICAM-1 au niveau de certaines cellules, telles que les kératinocytes, les fibroblastes et les cellules endothéliales (Horner et al., 1995; Yong and Khwaja, 1990). D’où l’importance de l’expression de l’ICAM-1 à la surface des chondrocytes à des fins d’adhésion et d’interaction leucocytaires au niveau du cartilage endommagé. Pitzke et al. ont démontré que l’expression de l’ICAM-1 est constante et très élevée au niveau des chondrocytes isolés de leur MEC. Cette perte de matrice semble induire l’expression de cette molécule d’adhésion à la surface cellulaire (Pitzke et al., 1994). En général, les études faites sur l’expression de l’ICAM-1 à la surface des chondrocytes montrent que ces cellules n’expriment pas cette molécule
constitutivement, mais par contre elle est induite par le traitement à l’IL-1α (Davies et al., 1991; Davies et al., 1992).
6- LE STRESS OXYDATIF 6.1- Les lipides et la cellule
Dans la nature, les acides gras polyinsaturés jouent un rôle physiologique très important, ils procurent de l’énergie aux cellules et ils sont à la base de la structure membranaire. De plus, ils jouent un rôle important dans la signalisation cellulaire et la régulation de certains gènes. Les molécules lipidiques constituent à peu près 30 à 80% de la masse cellulaire et le restant sont des protéines. L’insaturation existante dans les chaines d’acides gras détermine la température de fusion des triglycérides et la fluidité des membranes biologiques. La membrane cellulaire est formée d’une bicouche phospholipidique ce qui donne la fluidité et la flexibilité à cette structure et procure une perméabilité à certaines molécules telles que l’eau (Catala, 2009; Poulos, 1995).
6.2- Les stress oxydatif et les systèmes antioxydants
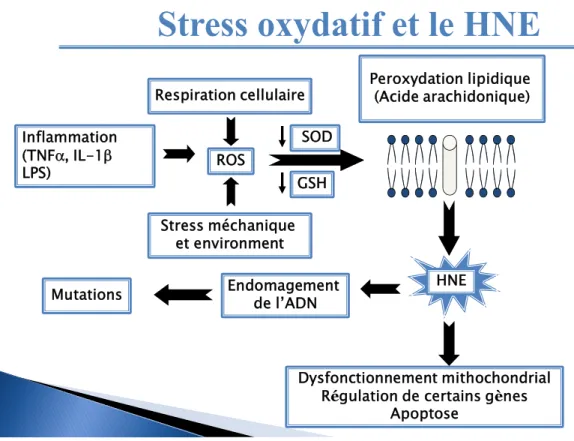
Dans les cellules aérobiques, environ 2% de la quantité d’oxygène consommé lors de la respiration cellulaire seront utilisés dans la génération des radicaux libres d’oxygène (ROS). Dans les cellules humaines, le niveau des ROS est contrôlé par l’existence de deux systèmes antioxydants qui maintiennent leur niveau physiologique. Le premier système est constitué de composés de faibles poids moléculaires qui limitent la propagation des radicaux libres dérivant du stress oxydatif. Une molécule très importante jouant ce rôle est
le Glutathion (GSH) qui est le substrat de deux enzymes la Glutathion peroxydase (GPxs) et la Glutathion-S-transférase (GST). Ce système est considéré comme la première ligne de défense contre les radicaux libres (Acworth IN, 1997). La deuxième ligne de défense sera attribuée aux constituants du deuxième système qui sont les enzymes antioxydantes. Le rôle de ces enzymes est plutôt préventif, parmi ces protéines on a la superoxyde dismutase (SOD) qui est une enzyme capable de décomposer l’anion superoxyde prévenant ainsi l’initiation de la peroxydation lipidique et le dommage cellulaire (Awasthi et al., 1975; Takahashi et al., 1987) (Figure 7).
6.3- La peroxydation lipidique
Le stress oxydatif est considéré comme un modulateur majeur de la cascade de signalisation modulant les différentes fonctions cellulaires telles que la prolifération, les réponses inflammatoires, la stimulation des molécules d’adhésion et la production de chimokines. Il est dû à un déséquilibre entre le système pro-oxydant et le système antioxydant (Sies and Cadenas, 1985). La peroxydation lipidique est un mécanisme en chaîne de dégradation des acides gras membranaires conduisant à la formation d’hydroperoxydes instables, responsables de la diminution de la fluidité membranaire, qui intervient dans certaines pathologies dans lesquelles le stress oxydant est impliqué. La membrane cellulaire est formée d’une bicouche phospholipidique contenant des chaines d’acide gras polyinsaturées.
ROS
SOD
HNE
Peroxydation lipidique (Acide arachidonique)
Stress oxydatif et le HNE
GSH Respiration cellulaire Inflammation (TNFα, IL-1β LPS) Stress méchanique et environment
Mutations Endomagementde l’ADN
Dysfonctionnement mithochondrial Régulation de certains gènes
Apoptose
Figure 7 : Le stress oxydatif et le 4-Hydroxynonénal (HNE). Les radicaux libres d’oxygène sont capables d’attaquer la membrane cellulaire et induire la peroxydation lipidique qui aboutira à la production du HNE.
Ces derniers sont le plus susceptible à la peroxydation lipidique dû à la présence de la double liaison et du groupement méthylène (-CH2-), dont l’atome d’hydrogène est
fortement réactif ; ce qui facilite aux ROS de les attaquer tel que le HO
˙
. Lors de la phase d’initiation le radical libre d’oxygène arrache un atome d’hydrogène du méthylène afin de former une molécule d’eau et produit ainsi un radical libre d’acide gras instable. Ensuite vient la phase de la propagation, vue l’instabilité du radical libre créé lors de l’étape précédente, celui-ci réagit avec une nouvelle molécule d’oxygène et produit une molécule intermédiaire aussi instable. Cette dernière molécule créée va agir par la suite avec une molécule du même genre ou avec une molécule d’oxygène et ainsi on aura un cycle vicieux où de nouveaux radicaux agiront de la même façon. Enfin, la phase terminale est caractérisée par une quantité élevée de radicaux libres afin d’obtenir la probabilité pour que deux radicaux agissent ensemble et ne plus engendrer de nouvelles molécules instables (Catala, 2006) (Figure 8). La peroxydation lipidique nuit au fonctionnement de la cellule, elle est capable de modifier la fluidité et la perméabilité de la membrane, elle peut changer le métabolisme de la cellule et causer des altérations au niveau du transport ionique à travers la membrane (Nigam and Schewe, 2000).Figure 8 : La peroxydation lipidique. Schéma montrant les différentes phases de la peroxydation lipidique.
La peroxydation lipidique engendre la production de plusieurs aldéhydes, les plus étudiés jusqu’à maintenant sont : le 4-Hydroxy-2- nonénal (HNE), le 4-Hydroxy-2-hexenal (HHE), le malonaldéhyde (Heimdal et al.) et l’acroléine. Tous comme les radicaux libres, ces aldéhydes se lient aux groupements nucléophiles des protéines, aux aminophospholipides et aux acides nucléiques. Leur longue durée de demi-vie les rends capables de propager leurs effets vers des cellules voisines. Le HNE est considéré l’aldéhyde principal formé lors de la peroxydation lipidique. Il est formé à partir des acides gras suivants : L’acide linoléique et l’acide arachidonique (Esterbauer et al., 1991; Uchida, 1999).
6.3.1- Le 4-Hydroxynonénal (HNE)
Le HNE est un constituant naturel des tissus membranaires des mammifères produit lors de la peroxydation lipidique. Il est devenu le centre d’intérêt de plusieurs études vu sa capacité à moduler les signaux de transduction et contribuer à la modification post-traductionnels de certaines protéines. Plusieurs études se sont intéressées au sujet du HNE libre et son pouvoir de nuire au fonctionnement de la cellule, tel que mis en évidence par une précédente étude de notre laboratoire (Vaillancourt et al., 2008). En outre, l’adduction de cet aldéhyde avec des biomolécules et l’altération de leur fonction n’a pas suscité beaucoup d’intérêts dans ces études. Alors, notre laboratoire s’est pris en charge d’étudier un aspect particulier de la liaison du HNE aux protéines menant à l’utilisation de la technique ELISA dans le but de quantifier les complexes HNE-protéines modifiées dans les liquides synoviaux et les extraits cellulaires provenant des patients atteints d’arthrose. La
particularité de la présente étude relève sur le fait que le HNE est capable de se lier au Col II et modifier ses propriétés, dans la perspective d’étudier sa contribution potentiel dans le développement de l’arthrose (Morquette et al., 2006; Shi et al., 2006; Vaillancourt et al., 2007). Le HNE est considéré comme un aldéhyde cytotoxique, un marqueur du stress oxydatif et comme un agent contribuant à la pathogenèse de différentes maladies, entre autre l’arthrose. Le HNE est une molécule relativement stable dû à la double liaison existante entre les carbones α et β, rendant ainsi le carbone γ déficient en électron. Cette caractéristique permet au HNE de se lier à différentes protéines cellulaires et altérer leur fonctionnement. La présence du HNE à faible concentration non toxique, peut réguler différentes fonctions cellulaires telle que les voies de signalisations, l’expression de certains gènes et la prolifération cellulaire. Dans des conditions physiologiques normales, la concentration du HNE varie entre 0.1 et 0.3 mM. En outre, cet aldéhyde s’accumule au niveau des membranes lors de l’augmentation du stress oxydatif et la concentration varie alors entre 10 μM et 5 mM (Catala, 2009; Esterbauer et al., 1991; Uchida, 2003; Uchida et al., 1998) (Figure 9). Avec ses effets biologiques, il est considéré comme un modulateur patho-physiologique des signaux de transduction, de la régulation transcriptionel et de la modification post-translationel (Bennaars-Eiden et al., 2002; Dianzani, 2003; Eaton et al., 1999). La modification post-traductionel est actuellement considérée comme le mécanisme majeure qui touche l’activité et les propriétés protéiques (Eaton et al., 1999; Vilardo et al., 2001). Le HNE a aussi le pouvoir de moduler plusieurs voies de signalisation et facteurs de transcription telles que la p38 MAPK, la protéine kinase C, le NF-κB-p65, et l’AP-1 (activator protein-1). L’accumulation des protéines modifiées par le HNE au niveau des
Figure 9 : La structure du 4-hydroxynonénal (HNE). Ce schéma montre l’emplacement des doubles liaisons qui rendent le HNE plus réactif (Schaur, 2003).
tissus est un processus dépendant de multiples facteurs, en plus de l’ampleur de la production de radicaux libres. Ces facteurs sont : (i) la capacité intrinsèque de la cellule à métaboliser le HNE libre ou lié en molécules non toxiques, par la réduction du HNE en 1-4-dihydroxynonene, ou par son oxydation en un acide 4-hydroxynonenoic ou par sa conjugaison avec le GSH (Aldini et al., 2003; Eaton et al., 1999; Ullrich et al., 1997) ; (ii) la susceptibilité de la dégradation protéolytique des protéines modifiées, par les protéasomes (Bulteau et al., 2001; Davies, 1987; Davies and Delsignore, 1987; Davies and Goldberg, 1987). La liaison du HNE aux protéines est réversible dans certaines conditions grâce à la réaction avec le GSH, mais dans la majorité des conditions cette liaison est irréversible. Les adduits HNE-protéines sont non seulement des marqueurs du stress oxydatif mais sont aussi responsables de la modification des fonctions cellulaires, de la modulation des signaux de transduction qui mènent à l’adaptation de la réponse cellulaire ou à l’apoptose. Ils sont responsables aussi de la modulation du système énergétique mitochondrial et de l’état redox (Benderdour et al., 2003; Brune et al., 1996; Chen et al., 1999; Leonarduzzi et al., 2000).
7- LA FORMATION DES COMPLEXES HNE/PROTÉINES
Les protéines sont la cible la plus importante du HNE, on estime que 1-8% du HNE formé par les cellules va certainement modifier les protéines (Siems and Grune, 2003). Le site de liaison des protéines au HNE est défini par plusieurs conditions, tels que la polarité du microenvironnement entourant et l’accessibilité au niveau de la structure tertiaire et
quaternaire des protéines. Ceci a été démontré par une étude qui a traité des myoglobines et des apomyoglobines par le HNE, ce qui a résulté en une modification accrue de l’apomyoglobines due à sa structure dégagée (Siems and Grune, 2003). Une autre étude a mis en évidence l’impact de la polarité et l’accessibilité dans la modification des molécules d’actines. Parmi les différents résidus cystéine (Cys) existant au niveau du filament d’actine, seul la CYS-374 s’est liée au HNE vue sa structure « ouverte » et l’acidité du groupement thiol (influencé par l’environnement acide de la CYS-374). La modification des protéines par le HNE représente donc le mécanisme majeur qui influence les processus physiologiques et pathologiques au niveau de la cellule (Aldini et al., 2005a; Petersen and Doorn, 2004). Le HNE est un aldéhyde réactif, capable de modifier les propriétés structurales et fonctionnelles des protéines. Le HNE possède trois groupements fonctionnels extrêmement réactifs qui confèrent à cet aldéhyde sa réactivité. La présence d’une double liaison entre deux carbones C=C et le groupement carbonyle C=O procure une charge positive au carbone 3. Cette charge est amplifiée dû à la présence de l’hydroxyle OH au niveau du carbone 4 (Poli and Schaur, 2000). En général, le HNE réagit plus avec les thiols et les groupements amines. Lors de la réaction Michael, on observe une addition nucléophilique au niveau de la double liaison carbone C=C. Les composés ajoutés à cette double liaison sont les amino-lysines, les éthanols amine, les guanines et les groupes imidazoles, d’où la formation des complexes HNE-CYS, HNE-lysine ou HNE-histidine (Uchida, 2003). La formation de la base Schiff avec une amine primaire, par exemple avec une lysine, compétitionne avec la réaction Michael, ce qui facilite au HNE de se lier aux protéines (Schaur, 2003). Le HNE est capable de diminuer les activités enzymatiques, par
exemple il peut se lier au site actif de la lipoxygénase-1 et former ainsi un complexe Michael avec au moins une histidine et ligaturer le site actif de fer (Gardner and Deighton, 2001). Par ailleurs, il peut se lier à d’autres molécules telles que les lipides ou les acides nucléiques et altérer leur fonctionnement normal. En outre, de récentes études ont démontré que le MDA et le HNE sont capables de se lier au Col II au niveau articulaire et par la suite modifier ses propriétés fonctionnelles (Morquette et al., 2006; Tiku et al., 2003; Uchida et al., 1998) (Figure 10).
8- LA MODIFICATION DE LA MATRICE EXTRACELLULAIRE PAR LES PRODUITS OXYDATIFS
Les premiers signes indiquant le développement de l’arthrose sont la détérioration du réseau de collagène, représenté par un gonflement du tissu cartilagineux et la perte des protéoglycans (Bank et al., 2000; Maroudas, 1976). Ces dommages causés au cartilage affectent ses propriétés mécaniques, menant les chondrocytes à augmenter leur synthèse de protéoglycans et de collagène dans une tentative de réparer les dégâts causés (Nelson et al., 1998). Si l’équilibre entre la synthèse et la dégradation n’est pas établi, le dommage continu et aboutira à la dégénérescence du cartilage articulaire. Une des causes majeures contribuant au changement au niveau du cartilage articulaire est l’accumulation des produits de la glycation avancée (AGEs, advanced glycation end products) et de la peroxydation lipidique au niveau de ce tissu. Récemment, certaines études ont suggéré que l’accumulation des produits de la peroxydation lipidique au niveau de l’articulation pourrait contribuer énormément à la pathogenèse de l’arthrose, vu la capacité de ces molécules
a)
b)
Figure 10: La complexation du 4-Hydroxynonénal (HNE) avec d’autres molécules. Ce sont deux réactions où le HNE se lie avec des amines (a) ou des thiols (b) (Schaur, 2003).
inorganiques et oxydantes à modifier les composantes de la matrice et en conséquence accélérer la dégradation du tissu (Morquette et al., 2006; Shah et al., 2005). De plus, l’implication des produits de la peroxydation lipidique dans le développement de l’arthrose a été mise en évidence par plusieurs études indiquant leur capacité à activer les MMPs par la formation des adduits avec cette enzyme au niveau du cartilage humain et leur pouvoir à oxyder le collagène articulaire chez le lapin (Morquette et al., 2006; Tiku et al., 2000). Il a été proposé que l’oxydation du collagène par les produits de la peroxydation lipidique in
vivo affecte les propriétés biophysiques et biochimiques des fibres de collagène les rendant
plus susceptible à la dégradation et contribuant ainsi au développement de l’arthrose. Donc, l’accumulation de ces produits oxydatifs au niveau articulaire promouvoit la libération des protéoglycans, l’expression des MMPs et la production des cytokines pro-inflammatoires. Au niveau osseux, les études se consacrent plus à l’accumulation des AGEs. Cette accumulation se répercute négativement dans la différentiation des ostéoblastes et dans la production des protéines de la matrice telles que le collagène et l’ostéocalcine (Fong et al., 1993; McCarthy et al., 2001). Il a été suggéré que l’accumulation des AGEs stimule l’apoptose des cellules souches mésenchymateuses humaines et par la suite limite la formation des tissus adipeux ainsi que la formation osseuse et cartilagineuse. De plus ces produits peuvent affecter la différentiation et la prolifération cellulaire (Kume et al., 2005; McCarthy et al., 2001). La modification de la matrice osseuse par les AGEs induit le recrutement des ostéoclastes et attire les monocytes via la sécrétion de cytokines comme l’IL-1β, IL-6 et la TNF-α in vitro et in vivo. Ceci pourrait établir le lien entre l’accumulation des AGEs et la résorption osseuse (Miyata et al., 1996; Miyata et al., 1994).
9- HNE ET VOIES DE SIGNALISATIONS
On a longtemps cru que l’effet oxydatif du HNE se percute sur la modification des protéines et des composantes cellulaires, mais plus récemment on a mis en évidence que le HNE est capable non seulement d’altérer les structures et les fonctions des molécules mais d’affecter la voie de signalisation intracellulaire (Barrera et al., 1996; Esterbauer et al., 1991). Le HNE à des doses non toxiques, est capable d’augmenter la phosphorylation de la tyrosine, qui est accompagné d’une activation de la JNK et de la p38 MAPK (Parola et al., 1998; Uchida et al., 1999). L’activation du JNK promouvoit sa translocation au noyau où elle va activer plusieurs facteurs de transcriptions de la famille jun et fos. Une fois activés, ils vont activer la transcription de plusieurs gènes (Ruef et al., 1998; Uchida et al., 1999). Cette voie de signalisation joue un rôle très important dans la transduction du signal extracellulaire vers l’intérieur de la cellule tout en entrainant une cascade de phosphorylation. En effet, le HNE est capable de moduler l’expression de multiples gènes tels que le procollagène type I, le c-myc et le TGF-β1 indépendamment de la voie des MAPKs, tels que la voie de la PKC (Chiarpotto et al., 1999), (Poli and Schaur, 2000). En outre, le HNE module la voie de la NF-κB p65, qui joue un rôle très important dans la régulation des réponses immunes et inflammatoires. Le HNE empêche l’activation du NF-κB p65 via l’inhibition de la phosphorylation de l’INF-κB (Page et al., 1999). Minekura et al. ont démontré que la réduction de l’activité du NF-κB p65 est associé à l’inhibition de l’expression des molécules d’adhésion, comme l’ICAM-1 et la VCAM-1 dans les cellules endothéliales aortiques (Minekura et al., 2001). Récemment, notre groupe de recherche a
rapporté que le HNE empêche la stimulation de l’iNOS par l’IL-1β via l’inactivation du NF-κB p65 par la formation des adduits HNE/IκB kinase (Vaillancourt et al. 2007).
10- LES CHELATEURS DES PRODUITS DE LA PEROXYDATION LIPIDIQUE
Les composés carbonylés endogènes formés lors de la peroxydation lipidique et de la glycoxydation des hydrocarbures sont les précurseurs des produits finaux de ces réactions. Le taux de formation d’adduits avec les aldéhydes est faible dans des conditions physiologiques normales mais par contre augmente au cours du vieillissement et dans le cas d’une maladie chronique où le système antioxydant est inefficace (Dalle-Donne et al., 2003; Voss and Siems, 2006). En conséquence, on assiste à un dysfonctionnement progressive des protéines et à des dommages tissulaires, menant par la suite au développement de certaines pathologies dû entre autre à l’inflammation et l’apoptose (Dalle-Donne et al., 2003; Petersen and Doorn, 2004). D’où l’inhibition des modifications chimiques affligées aux protéines pourrait prévenir le développement des différentes pathologies et servira d’une stratégie thérapeutique aux patients. Plusieurs approches sont utilisées afin d’inhiber la génération des radicaux libres et en conséquence la formation des produits de la peroxydation lipidique tels que l’utilisation d’antioxydants et de chélateurs de métaux. De plus, l’utilisation des désactivateurs de carbonyle qui interagissent spécifiquement avec les aldéhydes et neutralisent la formation d’adduits a suscité un intérêt particulier. Negre-Salvayre et al. (Negre-Salvayre et al., 2008) ont revu les principaux agents pharmacologiques utilisés afin de neutraliser les produits de la peroxydation
lipidique. L’hydrazine est une molécule largement utilisée dans la synthèse de produits chimiques puisqu’ils se condensent rapidement avec les groupements carbonyles des cétones ou aldéhydes afin de former des groupements méthylène ou méthyle. Un autre exemple, est l’utilisation du DNPH (2,4-Dinitrophénylhydrazine) qui est un dérivé d’hydrazine, utilisé pour la détection du HNE dans les tissus et les fluides biologiques lors de l’application des techniques HPLC, immunohistochimies, spectrophotométries et Western Blot à l’aide d’un anticorps anti-DNPH marqué (Esterbauer et al., 1991; Waeg et al., 1996). Le DNPH réagit avec les aldéhydes en milieu acide ce qui facilite la rupture des liaisons covalentes et par la suite leur liaison avec l’hydrazine pour former le dinitrophénylhydrazone (Esterbauer et al., 1991). Dans les études in vitro le DNPH prévient la formation et l’accumulation des adduits avec l’acroléine et le HNE dans des cultures de cellules vasculaires (Escargueil-Blanc et al., 2001). Par contre, in vivo, l’effet de cette molécule est limité à cause de ses propriétés mutagéniques et toxiques (Brook et al., 1997). Plusieurs autres molécules sont utilisées comme l’aminoguanidine et la pyridoxamine…, certaines sont parvenues au stade des études cliniques mais ont échoués comme le OPB-9195 ((+/-)-2-isopropilidenehydrazono-4-oxo-thiazolidin-5-yla cetanilide), un dérivé de l’hydrazine, dû aux effets secondaires de ce composé en réduisant le niveau de la vitamine B6 (Peyroux and Sternberg, 2006). Notre projet c’est concentré sur l’étude de la carnosine qui semble être prometteuse, vue son effet bénéfique dans le dans le traitement de vieillissement et la maladie d’Alzheimer (Guiotto et al., 2005).