THESE en vue de l’obtention du
DOCTORAT DE L’UNIVERSITE DE TOULOUSE
délivré par l’Université Toulouse III – Paul Sabatier
Ecole Doctorale : C.L.E.S.C.O.
Discipline : Neurosciences Cognitives
Présentée et soutenue publiquement le 13 décembre 2007 par
Julie
BENARD
« Apprentissages visuels chez l’abeille
Apis mellifera : de la généralisation à
l’extraction de règles »
Directeur de thèse : Pr Martin GIURFA
JURY
Dr Fabre-Thorpe Michèle (CERCO, UPS Toulouse III) Présidente Pr Chittka Lars (School of Biological & Chemical Sciences, Univ. of London) Rapporteur Pr Vauclair Jacques (Centre PsyCLE, Univ. de Provence, Aix-en-Provence) Rapporteur Pr Giurfa Martin (CRCA, UPS Toulouse III) Directeur de thèse
Centre de Recherches sur la Cognition Animale (CRCA) UMR 5169 - Université Paul Sabatier Toulouse III - CNRS
Remerciements... 5
Travaux scientifiques ... 7
Introduction ... 9
Généralisation visuelle chez l’animal ... 12
Catégorisation visuelle chez l’animal ... 15
Apprentissage de règles chez l’animal ... 18
Le modèle Apis mellifera... 21
Le système visuel de l’abeille ... 23
Vision des couleurs chez l’abeille... 24
Visions des formes chez l’abeille... 29
Apprentissage de règles chez l’abeille ... 34
Objectifs... 37
Références... 38
Article I : The cognitive implications of asymmetric color generalization in
honeybees ... 51
Article II : Color Categories in an Insect: Studies on Honeybees ... 81
Article III : Local-feature assembling in visual pattern recognition and
generalization in honeybees... 109
Article IV : A Test of transitive inferences in free flying honeybees:
unsuccessful performance due to memory constraints... 125
Discussion ... 153
Généralisation de couleurs ... 154
Catégorisation de stimuli visuels ... 155
Catégorisation de couleurs ... 156
Hypothèse de représentation configurale des stimuli... 157
Substrats neuronaux de la categorisation ... 161
Apprentissage de règles ... 163
Processus attentionnels et expérience préalable... 164
Limite du modèle abeille en libre vol ... 167
Références... 170
Annexes... 175
Résumé en anglais………...………203
35
Remerciements
Je remercie évidemment, en premier lieu, le Pr. Martin Giurfa de m’avoir accueilli dans son équipe et d’avoir fait tout son possible afin que je puisse bénéficier d’un financement lors de ma thèse. Je le remercie également de m’avoir donné l’opportunité de découvrir l’Argentine, notamment Buenos-Aires, qui aujourd’hui occupe une place toute particulière dans mon cœur. Je remercie enfin Martin d’avoir mis toute son énergie à me communiquer sa rigueur scientifique qui, sans aucun doute, influencera ma vie future.
Je remercie bien sûr tous ceux qui étaient présents dans l’équipe « Giurfa » à mon arrivée, Silke Stach, Fernando « Mordi » Guerrieri et Marco Schubert. Je remercie évidemment Silke, qui m’a tout appris quant à la façon de dresser des abeilles dans des labyrinthes, pour ses judicieux conseils et tous les bons moments passés ensembles dans les champs de Pechbusque à Buenos-Aires. Je remercie tout également « Mordi » pour son soutient tant à Toulouse qu’à Buenos-Aires, les grandes discussions théologiques, philosophiques et bien sûr scientifiques, les bons vins partagés (Cahors ou Bianchi ?), et les milliers de fous rires….. Merci aussi à Marco pour sa patience, sa gentillesse et tous les délires partagés au bureau. Aujourd’hui je suis la seule « rescapée » de cette équipe, donc un peu de nostalgie pour tous les bons moments partagés avec eux.
Maintenant, au tour de la nouvelle équipe Fabienne Dupuy, Geoffrey Portelli, Edith Roussel, Claire Eschbach… Là aussi, beaucoup de délires partagés, allant musicalement de Dighiskan à Marie Myriam en passant par les Golds…. Vive « You tube » et toutes les vidéos collectors qu’on a pu y consulter ! Même si Fabienne et Geoffrey sont aujourd’hui dans d’autres labos, ils ont, quand ils étaient présents, participé au bon déroulement de ma thèse. Un grand merci à Fabienne pour son agréable compagnie lors de notre séjour à Buenos-Aires et tous les bons moments passés ensembles. Un grand merci également à Geoffrey, un de mes premiers stagiaires que j’ai formé à entraîner les abeilles, pour bien sûr, sa patience, son bricolage (ordi et autres), les journées de manips avec « Rires et Chansons » et les attaques de moustiques argentins, les « you take the apero ? » aussi argentins et biens d’autres délires… Je remercie évidemment Edith pour sa complicité et son écoute, les échanges « incroyables mais vrai » avec nos amis intégristes religieux, les blocages addictifs et arrachage de cheveux « d’Ouverture Facile », les glaçons du Mc Donald pour boire la cachaça sur le pont de Karlov et bien d’autres moments partagés….
Bien sûr, je remercie également tous les membres de l’équipe « Abeille » : Jean-Christophe Sandoz, Nina Deisig, Jean-Marc Devaud, Monique Gauthier, Cathy Armengaud, Michel Lambin, Valérie Raymond, Gabriela De Brito Sanchez, Mathieu Dacher, Guillaume Barbara, Icham Kacimi, Emmanuel Périsse, Benoit Hourcade, Elodie Urlacher, Claire Eschbar, Aurore Avargues, pour leur soutient et leurs idées pertinentes échangées lors des réunions « abeille ».
Un grand merci à toute l’équipe du Dr. Walter Farina, « Grupo de Estudio de Insectos Sociales » de l’Université de Buenos Aires, pour leur accueil chaleureux lors de mes 4 voyages de 2 mois en Argentine. Un énorme merci aussi à Bettina et toute sa famille pour m’avoir accueilli chez eux avec autant de gentillesse, d’écoute, et d’amitié.
Je remercie également toute le rucher école de Ramonville (Pechbusque) ainsi que Mr Gauffre, pour avoir mis à ma disposition leurs ruches et donc leurs abeilles afin que je puisse réaliser mes expériences pendant ces 4 années.
Enfin, un grand merci à tout le laboratoire du CRCA….
Bien évidemment un énorme merci à toute ma famille : ma mère, mon père, mes frères, ma sœur et bien sûr Stéphane, pour leur patience et leur soutient, tant moral que financier, ainsi qu’à mes amies Marianne et Fanny….
Travaux scientifiques
Les articles précédés d’un astérisque (*) constituent directement ce travail de thèse. Articles publiés
* Benard J. & Giurfa M. 2004. A test of transitive inferences in free-flying honeybees: Unsuccessful performance due to memory constraints. Learning & Memory 11:328-336. * Stach S., Benard J. & Giurfa M. 2004. Local-feature assembling in visual pattern
recognition and generalization in honeybees. Nature 429, 758-761.
Benard J., Stach S. & Giurfa M. 2006. Categorization of Visual Stimuli in the Honeybee Apis mellifera. Animal Cognition 9, 257-270.
Giurfa M. & Benard J. 2006. Prospective and retrospective learning in honeybees.
International Journal of Comparative Psychology 19, 358-367.
* Benard J. & Giurfa M. 2007. The cognitive implications of asymmetric color generalization in honeybees. Animal Cognition (sous presse).
Articles en préparations
* Benard J. & Giurfa M. 2007. Color categories in an insect: Studies on honeybees. (prêt pour soumission à Proceedings of the National Academy of Sciences)
Portelli G., Benard J. & Giurfa M. Categorization of face-like stimuli in honeybees. Conférences internationales
Benard J. & Giurfa M. A test of transitive inferences in free-flying honeybees: unsuccessful performance due to memory constraints. 7ème congrès de la Société Internationale de Neuroéthologie (ISN), Nyborg – Danemark, 8-13 Août 2004. (Poster)
Benard J., Avargues A., Portelli G. and Giurfa M. A study on color categorization in honeybees. 30ème conférence de Neurobiologie de Göttingen – Allemagne (réunion de la Société de Neurosciences Allemande), 17-20 Février 2005. (Poster).
Benard J., Portelli G. & Giurfa M. Categorization of visual stimuli in the honeybee Apis
mellifera. Seconde conférence européenne d’apidologie EURBEE. Prague – République
Tchèque, 10-14 Septembre 2006 (communication orale). 7
Introduction
Nos systèmes sensoriels sont constamment exposés à des informations sensorielles dont la pertinence est variable. Il est donc nécessaire que ces informations soient traitées et organisées de façon cohérente afin de permettre leur utilisation ultérieure par le système nerveux. Nos systèmes sensoriels doivent donc permettre non seulement de détecter et mémoriser des stimuli biologiquement importants mais aussi de les organiser et classifier en fonction de critères divers.
Dans ce contexte, reconnaître un objet rencontré précédemment malgré de possibles distorsions dues à des interférences environnementales ou extrinsèques (par ex. changement d’orientation de l’objet dans l’espace) ou intrinsèques à l’individu (par ex. changements physiologiques dus à la maturation) est crucial pour un organisme qui a appris que cet objet est lié à une conséquence. Par ailleurs, en l’absence de l’objet appris, il est aussi adapté de répondre à des objets qui par leur similarité perceptive rappellent l’objet recherché. Dans ce cas-ci, l’individu transfère sa réponse à des objets qui peuvent être inconnus mais qui sont évalués comme étant similaires à l’objet d’origine. Cette capacité n’est pas due à un manque de discrimination mais relève d’une capacité de généralisation du choix de l’individu en fonction de son expérience (Spence 1937; Shepard 1958; Ghirlanda & Enquist 2003). Cette capacité qui a été largement étudiée chez les vertébrés (Ghirlanda & Enquist 2003) implique une réponse maximale à l’objet cible et une diminution graduelle de la réponse le long d’une échelle perceptive au fur et à mesure qu’on s’éloigne de l’objet cible. Ainsi la généralisation repose sur l’évaluation de relations de similarité entre objets, évaluation qui peut se faire dans une ou plusieurs dimensions. Le résultat de cette évaluation est que les stimuli qui sont proches les uns des autres sur une échelle perceptive, ou dans un espace perceptif, sont traités comme équivalents (Spence 1937; Shepard 1958; Ghirlanda & Enquist 2003).
Une autre stratégie de réponse à des objets nouveaux est la catégorisation. Tout comme la généralisation, la catégorisation permet de répondre de façon adaptative à de nouveaux stimuli sur la base d’un critère de classification. La catégorisation peut être définie comme la capacité à regrouper des objets ou des évènements discriminables sur la base de caractéristiques communes, et de donc de répondre à ces différents objets de façon similaire. Le processus de catégorisation repose donc sur l’extraction de ces caractéristiques spécifiques à partir des objets présents dans l’environnement de l’animal. Quelles sont donc les différences entre généralisation et catégorisation ? Bien que la généralisation et la
Introduction
catégorisation soient deux processus différents, ils sont souvent profondément imbriqués et une distinction nette est souvent difficile (Estes 1994; Zentall et al. 2002). Cependant, alors que la généralisation implique une diminution graduelle des réponses en fonction de la distance perceptive entre objet nouveau et objet cible, la catégorisation implique des limites plus abruptes entre classes de stimuli (Pastore 1987 ; Miller et al. 2003). Ainsi, un individu ciblé sur une fleur rouge (Fig. 1a) pourra généraliser son choix à des fleurs rougeâtres, différentes de la fleur cible, dans la mesure où son système de vision chromatique évalue ces fleurs nouvelles comme similaire à la fleur cible. Par contre, le même individu peut apprendre à classifier les fleurs en fonction de leur couleur en deux classes, rouge (positif) et bleu (négatif). La réponse fournie aux fleurs rougeâtres sera alors différente de celle correspondant à une réponse de généralisation (Fig. 1b). En effet l’individu qui catégorise répondra de façon équivalente à toutes les fleurs rouges car il les reconnaîtra en tant que membres de la catégorie rouge positive.
a) Généralisation b) Catégorisation
a) Généralisation b) Catégorisation
Cet exemple montre jusqu’à quel point la catégorisation est différente de la généralisation même si dans les deux cas la réponse mesurée est celle d’un transfert positif de réponse envers un stimulus nouveau (Robertson 2001). Le processus de catégorisation comprend une tâche discriminative, qui nécessite l’existence non pas d’une seule mais d’au moins deux représentations catégorielles. Keller et Schönfeld (1950) ont défini la catégorisation comme généralisation au sein d’une même classe et discrimination entre classes différentes. Dans cette définition, cependant, parler de généralisation au sein d’une
Respo nse Respo nse Respo nse R esp o nse R esp o nse Répo ns e Respo nse Respo nse Respo nse R esp o nse R esp o nse Répo ns e
Figure 1 : Schématisation simple des processus de Généralisation (a) et Catégorisation (b). La généralisation se traduit par une diminution graduelle de la réponse le long d’une échelle perceptive, c'est-à-dire que plus la fleur rencontrée diffère perceptivement de celle recherchée, moins le sujet répond. D’un autre côté, la catégorisation se traduit par un niveau de réponse identique à toutes les fleurs appartenant à la catégorie de la fleur recherchée (Fleurs rouges), et une absence de réponse à toutes autres fleurs appartenant à une autre catégorie (Fleurs bleues).
classe ne parait pas approprié car tous les membres de la catégorie devraient être traités de façon plus ou moins équivalente sans qu’on observe une diminution graduelle de la réponse au sein de la catégorie.
Un transfert positif de réponse envers de nouveaux stimuli peut être mis en évidence dans des situations expérimentales ou la généralisation et/ou la catégorisation ne seront pas les stratégies déterminant le choix de l’individu. En effet, si l’individu est capable d’apprendre non pas les caractéristiques d’un objet cible (ce qui lui permet de généraliser sa réponse vers des stimuli similaires ou de regrouper cet objet avec d’autres en fonction de critères d’appartenance à une catégorie), mais une règle abstraite qui lie des objets variés entre eux, on doit pouvoir aussi observer un transfert positif de réponse à chaque fois que la relation entre objets nouveaux est préservée. Ainsi, dans un apprentissage de règles, l’individu apprend des relations entre objets et non les objets eux-mêmes. Plusieurs règles peuvent être apprises en fonction de critères relationnels entre objet. Un exemple couramment étudié est celui de l’identité relationnelle avec deux possibilités principales, la relation d’équivalence (« sameness ») et celle de différence. Celles-ci sont étudiées à partir des protocoles d’appariement retardé à la cible (« delayed matching to sample », DMTS) ou de non appariement, respectivement (« delayed non matching to sample », DNMTS). D’autres exemples concernent des relations spatiales (« en dessous de », « en dessus de », « dedans », « dehors ») ou de taille (« plus grand que », « plus petit que »). La capacité à apprendre des règles abstraites peut faire appel à la similarité perceptive et donc à la généralisation. Cependant la différence fondamentale est le fait que l’animal doit extraire un critère de relation qu’il sera en mesure de transférer à des stimuli nouveaux indépendamment de leur modalité sensorielle.
Ces trois axes de discussion, généralisation, catégorisation et extraction de règles, constituent les trois niveaux sur lesquels s’articule cette thèse. Nous avons exploré certains aspects de ces phénomènes dans la modalité visuelle, à partir d’une approche comportementale, inspirée d’études de psychologie expérimentale et de neurobiologie.
Nous nous sommes intéressés à ces phénomènes car de généralisation à apprentissage de règles on peut concevoir un gradient de complexité allant de l’apprentissage élémentaire à l’apprentissage non-élémentaire. Dans un apprentissage élémentaire un individu apprend à établir un lien spécifique entre deux stimuli (dans le cas du conditionnement classique, où la contingence apprise lie un stimulus conditionnel et un stimulus inconditionnel) ou entre une action et sa conséquence (dans le cas du conditionnement opérant, où la contingence apprise lie un comportement et un renforcement qui s’en suit). Ce lien est valable exclusivement pour
Introduction
les éléments de l’association. Ce qui est appris pour une couleur ne vaut que pour cette couleur. Ce qui est appris pour une action ne vaut que pour cette action. Le processus de généralisation peut être perçu comme une flexibilisation de ce type d’apprentissage : ce qui est appris sur un objet peut être transféré, dans certaines limites perceptives et de similarité, vers d’autres objets. Dans un niveau suivant, catégoriser une blatte et un papillon inconnu comme des membres de la même catégorie (« insecte ») peut être perçu comme un apprentissage de type non-élémentaire puisque la réponse fournie envers le stimulus inconnu (le papillon) ne peut pas dériver directement des expériences préalables avec les blattes. Elle dérive, certes, d’expériences préalables avec d’autres papillons, ceux-ci connus, qui permettent d’effectuer les regroupements catégoriels. Finalement, dans le cas d’apprentissages de règles, l’animal transfère ses réponses à des stimuli qui peuvent être absolument inconnus dans la mesure où la règle de relation est maintenue. On est donc loin de simples liens élémentaires entre deux stimuli spécifiques ou entre une action et sa conséquence.
Afin de mieux situer notre travail, les sections suivantes récapitulent de façon sommaire certaines des études faites sur ces trois grands axes chez l’animal dans la modalité qui nous occupe, celle de la perception visuelle. Ces études ont été essentiellement réalisées sur le vertébré de sorte que nos études ont un mérite concret qui est celui d’avoir posé des questions liées à ces thématiques à un modèle invertébré. La valeur de ce questionnement sera discutée dans les sections qui suivent.
Généralisation visuelle chez l’animal
Les processus de généralisation ont été étudiés dans divers modèles animaux et différentes modalités sensorielles. Une conclusion obtenue à partir de ces travaux est que les caractéristiques de la généralisation semblent être relativement indépendantes du modèle animal (insectes, poissons, reptiles, oiseaux, mammifères), du contexte comportemental (manger, boire, faire la cour..), de la modalité sensorielle considérée (vision, audition..) et du fait que les réactions mises en jeu soient apprises ou génétiquement héritées (Ghirlanda & Enquist 2003). Ceci suggère donc que les processus de généralisation émergent de propriétés générales des systèmes nerveux.
Dans ces expériences, des animaux sont typiquement entraînés à répondre à un stimulus, appelé stimulus positif (S+) et à ne pas répondre à un second stimulus négatif (S-). Le stimulus négatif S- peut être l’absence de S+ (dans ce cas-ci on se situe dans un cadre d’un
conditionnement absolu) ou un stimulus différent du S+ (dans ce cas-ci on se situe dans un cadre d’un conditionnement différentiel). Après entraînement, les réponses de l’animal à un set de stimuli tests sont enregistrées. Les stimuli varient généralement dans une dimension perceptive à partir de la modification d’un paramètre physique du stimulus d’origine (par exemple en variant la longueur d’onde de la lumière présentée). Les résultats peuvent être alors présentés sous forme d’un gradient de réponse en fonction de la dimension choisie.
Plusieurs études ont été menées chez l’animal dans le domaine visuel allant de l’étude de la généralisation de lumières monochromatiques chez le pigeon (Hanson 1959), le poisson rouge (Ames & Yarczower 1965; Kitschmann & Neumeyer 2005; Poralla & Neumeyer 2006) à l’orientation de patterns chez le pigeon (Bloomfield 1967), le poisson (Heiligenberg et al. 1972) et les abeilles (Wehner 1967, 1972b). Les principales conclusions de ces études montrent que les gradients de généralisation suivent une forme Gaussienne plutôt qu’exponentielle et que lorsque les paradigmes expérimentaux n’impliquent qu’un stimulus S+, les gradients sont plutôt symétriques avec une réponse maximale pour le S+. Cependant certaines asymétries peuvent exister comme celles observées chez les pigeons envers les rotations dans le sens des aiguilles d’une montre (Hearst et al. 1964), ou encore envers les longueurs d’ondes supérieures à 550 nm (Friedman 1963). Enfin, lorsque ces expériences incluent un stimulus S-, le phénomène de « peak shift » est observable. Dans ce cas-ci l’interaction entre un gradient de réponses excitateur généré par le S+ et un gradient inhibiteur généré par le S- déterminent un gradient de généralisation dont le maximum de réponses est éloigné du S- (Hanson 1959, Ghirlanda & Enquist 2003, Lynn et al. 2005, Baddeley et al. 2007).
La généralisation de couleurs est particulièrement intéressante parce qu’elle permet à l’expérimentateur de varier de façon contrôlée des stimuli tout au long de dimensions définies et continues (par exemple, longueur d’onde ou saturation). Hanson (1959) a étudié la généralisation de couleurs chez les pigeons en employant un paradigme de conditionnement opérant. Les pigeons étaient entraînés à répondre à une lumière monochromatique d’une longueur d’onde de 550 nm. Un groupe contrôle était entraîné de façon absolue (un seul S+ à 550 nm), et 4 autres groupes était entraînés de façon différentielle (un S+ à 550 nm et un S- variable selon le groupe considéré), de façon à faire varier progressivement la distance entre S+ et S- entre les groupes (S- à 555, 560, 570 et 590). Après l’entraînement, les pigeons ont été testés avec des stimuli de différentes longueurs d’ondes allant de 480 à 620 nm. Ainsi, Hanson a obtenu les gradients de généralisation des différents groupes. Celui du groupe contrôle présentait une forme de gaussienne centrée autour du S+ (maximum de réponses
Introduction
pour les longueurs d’ondes proches de celle du S+), alors que celui des autres groupes montrait un déplacement du maximum de réponses s’éloignant du S- et se rapprochant du S+ (phénomène de « peak shift », voir ci-dessus). Diverses analyses ont été réalisées afin de montrer que ce déplacement était du à l’interaction entre gradient excitateur du S+ et gradient inhibiteur du S-.
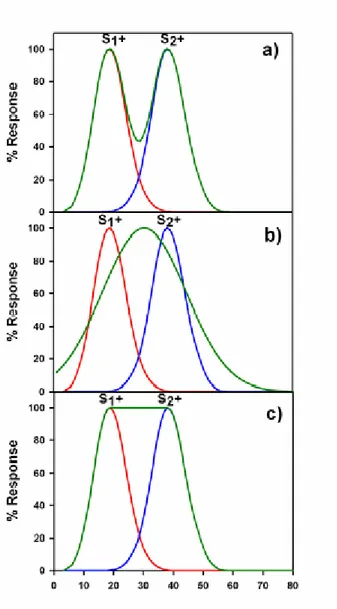
Un certains nombres d’études ont été menées de façon à caractériser comment se combinent des gradients excitateurs et inhibiteurs afin de déterminer une réponse de généralisation (Hanson 1959, Hearst 1968, Ohinata 1978, Baron 1973, Cheng et al. 1997). Mais que se passe-t-il lorsque l’animal est confronté à plusieurs stimuli positifs ? Dans des situations naturelles un animal peut expérimenter non pas un seul mais plusieurs S+. De quelle façon se combinent alors différents gradients excitateurs afin de fournir une réponse de généralisation résultante ? Cette situation n’a pas fait l’objet d’études systématiques. Cependant quelques études ont posé cette question (Kalish & Guttman 1959; Guttman 1965; Blough 1969 ; Jones et al. 2001; Poralla & Neumeyer 2006). Par exemple, Blough (1969) à montré qu’un entraînement avec 2 S+ pouvait générer des gradients à 1 pic (réponse aux stimuli intermédiaires entre les 2 S+) ou des gradients à 2 pics (pas de réponse aux stimuli intermédiaires entre les 2 S+) en fonction de la distance entre les 2 S+. Un gradient à 1 pic signifie que les sujets interpolent, c'est-à-dire qu’ils répondent aux stimuli intermédiaires entre les 2 S+, alors qu’un gradient à 2 pics, ceux-ci correspondant à la réponse maximale fournie aux S+ entraînés, signifie qu’ils n’interpolent pas. Différents modèles ont été proposés concernant l’interaction de deux gradients de généralisation correspondant à des stimuli présents le long d’un continuum sensoriel. Ces différents modèles (Jones et al. 2001) varient dans leurs prédictions concernant les processus d’interpolation et d’extrapolation (réponse au-delà des stimuli S1+ et S2+) résultant de différents type de combinaison de gradient de généralisation. Quatre possibilités principales sont reconnues (cf. figure 1 Benard & Giurfa 2007) suite à un entraînement comprenant deux stimuli récompensés S1+ et S2+ :
• 1) interaction ne supposant ni interpolation entre S1+ et S2+, ni extrapolation au-delà de ces deux stimuli (Spence 1937; Enquist & Johnstone 1997 ; cf. fig. 1a Benard & Giurfa 2007).
• 2) interaction supposant à la fois une interpolation (réponse supérieure aux stimuli interpolés par rapport à celles fournies aux stimuli entraînés S1+ et S2+) et extrapolations (Fried & Holyoak 1984 ; cf. fig. 1b Benard & Giurfa 2007).
• 3) interaction supposant une interpolation uniforme entre S1+ et S2+ (même niveau de réponse entre stimuli interpolés et stimuli entraînés) et peu ou pas d’extrapolation (Tenenbaum & Griffiths 2001 ; cf. fig. 1c Benard & Giurfa 2007).
• 4) une variante du modèle proposé en 3) qui prédit cette fois-ci une interpolation supérieure et toujours pas ou peu d’extrapolation.
Dans notre travail nous nous sommes tout d’abord intéressés à cette problématique dans le cas de la généralisation de couleurs. Les abeilles ont une vision chromatique (voir ci-dessous) et peuvent, dans des situations naturelles, être confrontées à des fleurs présentant des patrons de couleurs différentes. L’association de ces couleurs différentes à une récompense de nectar correspondrait à une situation expérimentale où l’animal est entraîné avec deux (ou plusieurs) S+. C’est cette situation d’une relative importance biologique pour l’animal, qui nous a intéressés dans notre travail. Nous avons cherché à étudier comment les gradients de généralisation produits par des S+ vont interagir afin de déterminer une réponse résultante (Benard & Giurfa 2007, article I).
Catégorisation visuelle chez l’animal
L’étude des processus de catégorisation d’objet chez l’animal reconnait un précédent important dans les travaux pionniers de Herrnstein et Loveland (1964) sur les pigeons. Ils montrèrent pour la première fois qu’un animal pouvait, suite à un entraînement, catégoriser des photographies en fonction de la présence ou absence d’être(s) humain(s) dans la photographie. Les pigeons ainsi entraînés pouvaient alors transférer leurs réponses à des nouvelles photographies qu’ils n’avaient jamais rencontrées auparavant en fonction de la présence ou absence d’êtres humains. De nombreuses études ont confirmé les capacités des pigeons à catégoriser des stimuli visuels (Greene 1983; Troje et al. 1999; voir Huber 2001 pour révision). Par exemple, ils peuvent catégoriser des photographies en fonction de la présence ou l’absence d’arbres (Herrnstein et al. 1976), ou encore catégoriser des photographies selon 4 catégories distinctes : « chats », « fleurs », « voitures » et « chaises » (Bhatt et al. 1988). Ces différentes études montrent donc que les pigeons peuvent, à partir des stimuli visuels utilisés lors de l’entraînement, extraire des informations leur permettant de déterminer l’appartenance d’un ou plusieurs stimuli à une catégorie particulière. Dans certains cas, cependant, la nature de l’information extraite reste mal définie de sorte que l’on démontre que l’animal catégorise mais non pas les critères qu’il utilise dans ce but.
Introduction
Au contraire, certaines études montrant des capacités de catégorisation chez l’animal (Schrier et al. 1984; Morgan et al. 1976; D’Amato et van Sant 1988) ont pu mettre en évidence la ou les caractéristiques physiques des stimuli utilisées par l’animal dans la tâche de catégorisation. Par exemple, D’Amato et van Sant (1988) ont montré que dans une catégorisation de photographies en fonction de la présence ou absence d’homme, des singes capucins entraînés en utilisant une tâche de « go/nogo » utilisaient la présence de taches rouges qui étaient en fait plus souvent associées à la présence d’homme. D’autres études ont montré (Lea & Ryan 1990; von Fersen & Lea 1990; voir Huber 2001 pour révision sur les pigeons) que des animaux peuvent catégoriser des stimuli en fonction de caractéristiques physiques (une seule ou une combinaison) qui co-varient avec l’organisation catégorielle. Ainsi Troje et al. (1999) montrent aussi que dans la catégorisation de visages humains Homme vs. Femmes, des indices de bas niveaux comme la forme des visages et notamment la texture (en particulier l’intensité lumineuse) interviennent dans la classification des images.
Lors d’une tâche de catégorisation plus le niveau d’abstraction nécessaire pour résoudre la tâche augmente, plus la ressemblance physique entre stimuli d’une même classe ne suffit plus à prédire l’appartenance à telle ou telle catégorie (Herrnstein 1990). C’est le cas par exemple des catégories « super-ordinées » comme: vêtements, animaux, moyens de transports…, qui regroupent des stimuli physiquement très différents à partir d’une relation fonctionnelle. Les niveaux de catégorisation peuvent donc aller d’une « catégorisation perceptive », basée sur la ressemblance physique entre membres d’une même classe, vers une « catégorisation conceptuelle » plutôt basée sur des attributs fonctionnels ou relationnels (Urcuioli 2001; Zayan & Vauclair 1998). Un grand nombre d’exemples de « catégorisation perceptive » existe dans la littérature, essentiellement chez les pigeons (voir pour review Watanabe et al. 1993; Huber 2001) et les singes (Schrier et al. 1984; D’Amato & van Sant 1988; Roberts & Mazmanian 1988; Vauclair & Fagot 1996; voir pour review Zayan & Vauclair 1998). La catégorisation de type conceptuel est cependant difficile à mettre en évidence en utilisant des stimuli naturels car ceux-ci sont polymorphes ce qui rend difficile la vérification de l’intervention de dimensions perceptives éventuellement associées à chaque catégorie (Huber 2001).
La catégorisation conceptuelle a été mise en évidence chez l’animal, particulièrement chez les singes. Ainsi, par exemple, les singes sont capables de réaliser des tâches de catégorisation rapide d’images naturelles en fonction des critères « animal vs. non-animal » et « aliment vs. non-aliment » (Fabre-Thorpe et al. 1998; Fabre-Thorpe 2003). Les mécanismes impliqués semblent être du même type que ceux impliqués chez l’homme mais la
dynamique de classification est plus rapide chez le primate que chez l’homme. Même si ces études ne permettent pas de déduire directement les informations visuelles appréhendées dans chaque cas afin de faire la classification des images, elles ont pu rejeter l’utilisation de certains indices de bas niveaux tels que la couleur, le contraste et la luminosité dans cette tâche (Delorme et al. 2000; Fabre-Thorpe et al. 2001).
Certaines théories sur les stratégies de reconnaissance visuelles des objets, développées essentiellement grâce à des études réalisées chez les vertébrés, impliquent que le traitement de l’information visuelle soit fait de façon configurale (Biedermann 1987; Gauthier
et al. 1998; Maurer et al. 2002; Altmann et al. 2003). Par l’utilisation du mot « configural »,
dans ce travail, nous entendons une propriété topographique spécifique résultante des relations spatiales entre les éléments constitutifs de l’image qui sont intégrés dans une représentation globale (c'est-à-dire une configuration) sans faire référence à des théories sur l’apprentissage de stimuli composés (« théorie configurale » Pearce 1987, 1994). Ainsi, l’appartenance ou non à une catégorie serait déterminée par la présence de cette configuration de base commune à différents stimuli membres de la catégorie. Nous nous sommes penchés sur cette hypothèse et nous avons voulu savoir si les abeilles étaient capables de catégoriser des patterns visuels à partir de leur configuration d’éléments constitutifs (Stach, Benard & Giurfa 2004, article III).
Un volet à part dans les études de catégorisation visuelle est celui de la catégorisation de couleurs. Nous nous sommes aussi intéressés à cette thématique à partir des études réalisées sur la généralisation de couleurs qui suggéraient qu’une telle catégorisation chromatique existerait chez l’abeille. La présence de catégories chromatiques est un sujet d’intenses débats. Bien qu’il soit évident que l’homme divise le continuum du spectre visuel en différentes régions contenant différentes longueurs d’onde, générant ainsi des catégories de couleurs, tel que « bleu », « vert », « rouge », etc., deux postures se sont affrontées historiquement quant à l’interprétation de ces résultats. En effet, « universalistes » et « relativistes » se sont opposés pendant des années, les premiers soutenant que la catégorisation de couleurs reposait sur des processus innés ou universels (Berlin & Kay 1969; Heider 1972), alors que les deuxièmes soutenaient que la catégorisation de couleurs reposait essentiellement sur la structuration de notre langage (Whorf 1956 ; Roberson et al. 2000, 2005). Après de longues années de débats et de recherches, il semble aujourd’hui plus ou moins accepté que les catégories de couleurs soient organisées autour de points focaux universels (Kay & Regier 2003), et que la présence d’un langage pourrait toutefois influencer
Introduction
la façon dont sont cognitivement traitées les couleurs (Kay & Regier 2006). Il apparaît donc que la présence d’un langage rend encore plus complexe la compréhension des processus de la catégorisation des couleurs. Mener des expériences de catégorisation des couleurs chez l’animal permettrait alors de s’abstraire de la présence d’un quelconque langage qui pourrait interférer dans les résultats, afin de caractériser les processus basiques d’une telle catégorisation.
La capacité à catégoriser les couleurs a été étudiée chez l’animal, en particulier chez les pigeons (Wright & Cumming 1971; Wright 1972), les poulets (Jones et al. 2001), les poissons (Kitschmann & Neumeyer 2005; Poralla & Neumeyer 2006) et le singe (Sandell et
al. 1979; Matsuzawa 1985; Fagot et al. 2006). Ces études, mis à part la dernière, tendent à
montrer que ces espèces possèderaient des catégories de couleurs organisées autour de points focaux. En effet, quand des poissons sont entraînés avec des lumières monochromatiques, soit avec une seule longueur d’onde récompensée (Kitschmann & Neumeyer 2005), 2 longueurs d’ondes récompensées ou 6 longueurs d’ondes récompensées (Poralla & Neumeyer 2006), les différents tests de transfert et de généralisation ont mis en évidence des gradients de généralisation asymétriques suggérant l’existence de catégories de couleurs. Ces catégories seraient très proches de celles de l’homme et dépendraient des propriétés et contraintes physiologiques du système visuel (sensibilité des photorécepteurs, neurones antagonistes de couleur ; Poralla & Neumeyer 2006). Cela pourrait sous-entendre que la catégorisation de couleurs serait un processus relativement moins cognitif que celui de la catégorisation d’objets (patterns) visuels car les catégories chromatiques surgiraient surtout de la machinerie visuelle. Au vu des débats générés chez l’homme quant à la dépendance du langage ou, au contraire, de l’organisation du système visuel, il nous a paru important d’étudier si nos abeilles possédaient également des catégories de couleurs (Benard et al., en préparation, article II). Ce travail a été motivé directement par notre étude sur la généralisation de couleurs qui suggérait l’existence de telles catégories (Benard & Giurfa 2007).
Apprentissage de règles chez l’animal
Dans la classification que nous utilisons ici, l’apprentissage de règles fait appel à l’extraction de critères relationnels liant des objets ou évènements dans l’environnement de l’animal. De ce fait certains des exemples cités ici sont considérés comme des capacités de catégorisation conceptuelle (Fagot et al. 2004 ; Zayan & Vauclair 1998). Tel que nous l’avons mentionné précédemment, dans un apprentissage de règle, c’est la relation entre stimuli qui
est importante et non les stimuli eux-mêmes. Divers types d’apprentissage de règle ont été mis en évidence chez l’animal, mettant en jeu les concepts de « dedans/dehors » (pigeon, Herrnstein et al. 1989), de « dessus/dessous » (babouins, Dépy et al. 1999), de symétrie (singes, Rensch 1957; pigeon, Delius & Nowak 1982; dauphins, von Fersen et al. 1992). Cependant, le concept relationnel le plus étudié est celui « d’identité relationnelle ».
En effet, la détection de l’équivalence (« sameness ») et de la différence est l’une des discriminations psychologiques les plus anciennes et fondamentales (Cook 2002). Il a même été suggéré (James 1910) que la reconnaissance et l’intégration du sens d’ « identique » serait l’un des piliers de la conscience. En effet, ces notions sont centrales dans bon nombre de fonctions intellectuelles ou de comportements, et jouent un rôle important dans les processus de perception, discrimination, choix, comportements séquentiels… Les notions d’« identique » et « différent » sont généralement mises en évidence via des protocoles « d’appariement retardé à la cible (ou à l’échantillon)» (en anglais «
Delay-matching-to-sample » ou DMTS), et de « non appariement à la cible » (en anglais « Delay-non-matching-to-sample » ou DNMTS). Dans ce type de procédure, on présente un premier stimulus
(stimulus cible) au sujet, suivi de 2 ou plusieurs stimuli parmi lesquels il doit faire son choix, suivi ou non d’un renforcement dépendant du choix réalisé. Dans un DMTS, le sujet doit choisir le stimulus qui est identique au stimulus cible. Dans un DNMTS, au contraire, il doit apprendre à choisir le stimulus qui est différent du stimulus cible.
Ces protocoles ont été appliqués à de nombreuses espèces de vertébrés, mettant en jeu les modalités visuelles ou auditives (singes : D’Amato et al. 1985; dauphin : Herman & Gordon 1974; pigeons : Roberts 1972; Zentall & Hogan 1976 ; Wright et al. 1988). Ces études montrent que les animaux sont capables d’apprendre les règles de DMTS et DNMTS avec des stimuli visuels (patterns, couleurs, photographies) et que dans certains cas ils peuvent transférer la règle apprise à de nouveaux stimuli. Par exemple, Wright et al. (1988) ont entraîné des pigeons selon un paradigme de DMTS en utilisant des images présentées sur un écran. Deux groupes de pigeons ont été entraînés, un pour lequel l’entraînement mettait en jeu seulement 2 stimuli cibles différents, et un autre groupe pour lequel l’entraînement mettait en jeu 152 stimuli cibles différents. Les deux groupes parvenaient à apprendre la tâche, même si la période d’entraînement nécessaire à l’acquisition était relativement supérieure pour le groupe entraîné avec les 152 stimuli cibles. Pour ce qui était des performances de transfert à de nouveaux sets de stimuli, le groupe entraîné avec seulement 2 stimuli cibles ne parvenait pas à transférer correctement ses réponses, alors que le groupe entraîné avec les 152 stimuli cibles y parvenait très bien. Ceci montrait donc que le groupe ayant eu une expérience
Introduction
supérieure et donc une possibilité accrue d’extraire la règle d’identité relationnelle était parvenu à résoudre le problème, alors que l’autre groupe n’ayant eu que deux cibles n’avait appris aucune règle abstraite mais plutôt des relations spécifiques entre certains stimuli.
Dans notre étude nous nous sommes intéressés à un type d’apprentissage relationnel, celui sous-tendant la capacité à établir des relations transitives. Nous avons étudié cette problématique dans le domaine visuel, en utilisant des patterns à contingence variable (c’est-a-dire relation avec la récompense). La capacité à établir des inférences transitives peut être considérée comme un apprentissage abstrait ou d’ordre supérieur vu qu’il peut faire intervenir un raisonnement de type déductif et logique des sujets. Dans ce problème, un sujet entraîné à discriminer A > B (c'est-à-dire A récompensé et B non récompensé) et B > C doit être en mesure d’extraire la relation transitive et donc préférer A à C alors que ceux-ci n’ont jamais été vus simultanément lors de l’entraînement. Bien qu’une interprétation cognitive de cette capacité met l‘accent sur le raisonnement déductif sous-jacent et sur la construction et manipulation d’une représentation linéaire et unifiée de la hiérarchie implicite A > B > C (von Fersen et al. 1991 ; Acuna et al. 2002), une explication purement associative, et donc élémentaire, peut être aussi fournie. Ainsi, par exemple, A est toujours récompensé alors que C ne l’est pas ; B est autant de fois récompensé que non récompensé. Il est donc possible de répondre aux stimuli A, B et C à partir de cette information sans qu’il y ait de hiérarchie sous-jacente (A+ ; B+/– ; C–, où les signes + et – représentent respectivement la présence et l’absence de récompense). Expérimentalement on tranche entre ces 2 interprétations en entraînant les sujets avec 5 stimuli différents : A, B, C, D et E, sous la forme d’un conditionnement différentiel réalisé avec 4 paires de stimuli. Le sujet va être ainsi entraîné avec les paires : A+B-, B+C-, C+D-, D+E-. Ces 4 paires adjacentes constituent les prémisses du raisonnement transitif. En effet, sans l’acquisition préalable de ces discriminations le sujet ne peut pas établir d’inférences transitives. A partir des acquisitions successives: A>B, B>C, C>D, D>E, le sujet doit déduire la hiérarchie linéaire existante entre les stimuli: A > B > C > D > E. Afin, de révéler si le sujet a pu établir une telle relation de transitivité, on procède suite à la phase d’apprentissage, à un test présentant B vs. D. Ces deux stimuli qui ne sont pas apparus ensemble pendant l’entraînement ont, théoriquement, la même force associative du fait qu’ils ont été tous les deux autant de fois récompensés que non récompensés. Si le sujet a effectivement inféré la hiérarchie sous-jacente entre stimuli, il devrait préférer B à D (B>D). En revanche, si aucune transitivité n’a été établie, et que c’est la force associative qui guide l’animal, il devrait choisir aléatoirement entre les stimuli B et D (B = D). Le raisonnement transitif a été étudié chez différents animaux, en utilisant le paradigme précédemment décrit.
Il a été montré que les pigeons (von Fersen et al. 1991; Wynne et al. 1992; Siemann & Delius 1994; Wynne 1997), les geais (Bond et al. 2002), les rats (Davis 1992; Dusek & Eichenbaum 1997), les singes écureuils (McGonigle & Chalmers 1977, 1992), les macaques (Treichler & van Tilburg 1996) et les chimpanzés (Gillan 1981; Boysen et al. 1993) peuvent établir des relations transitives entre stimuli. Cette capacité à été mise en évidence dans la modalité olfactive chez les rats (Davis 1992), dans la modalité visuelle chez les singes (utilisation d’objets : Treichler & van Tilburg 1996, ou de boites de différentes couleurs : Gillan 1981), les geais (couleurs) et les pigeons (patterns achromatiques). Dans notre travail nous avons étudié la capacité des abeilles à établir de telles relations transitives dans le domaine du visuel (Benard & Giurfa 2004, article IV).
Ayant présenté un résumé des recherches les plus importantes pour notre travail réalisées chez l’animal, nous présenterons à la suite le modèle avec lequel nous avons travaillé, l’abeille Apis mellifera. Poser des questions sur des phénomènes cognitifs à un insecte pouvait apparaître déplacé il y a quelques années. Cependant de nombreuses études récentes ont dévoilé le pouvoir cognitif impressionnant du mini-cerveau des insectes qui, au delà d’apprentissages élémentaires (voir ci-dessus) sont aussi capables de résolution de problèmes d’ordre supérieur (Giurfa 2003, 2007).
Le modèle Apis mellifera
L’abeille Apis mellifera constitue un bon modèle pour étudier la résolution de tâches visuelles complexes du fait de ses capacités d’apprentissage et de mémorisation visuelle remarquables (Menzel 1999, 2001 ; Menzel & Giurfa 2001 ; Giurfa 2003, 2007). De plus, l’abeille offre de grandes opportunités pour étudier les bases neurales des apprentissages, puisqu’elle possède un système nerveux relativement simple et de surcroît aisément accessible par l’expérimentateur grâce à plusieurs techniques invasives (Giurfa 2003, 2007). Avec ces 950 000 neurones, le cerveau de l’abeille est à la base de performances cognitives qui, dans le cas d’apprentissage olfactifs, peuvent être réduites au niveau cellulaire, voire moléculaire (Menzel & Giurfa 2001; Giurfa 2003, 2007). Il a par exemple été suggéré que certaines formes complexes d’apprentissage olfactif pourraient être sous-tendues par les corps pédonculés, neuropiles centraux et proéminents du cerveau de l’abeille (Figure 2), qui jouent le rôle de centres d’intégration multi-sensorielle (Menzel & Giurfa 2001; Giurfa 2003, 2007).
Introduction
Ainsi, l’étude de la résolution de problèmes complexes chez l’abeille permet de coupler éventuellement réponses comportementales et substrats neuronaux sous-tendant ces réponses.
Malgré son système nerveux de taille réduite, l’abeille possède un répertoire comportemental extrêmement riche. La vie en société est nécessaire à la survie d’une abeille qui ne peut pas vivre longtemps indépendamment de sa colonie. Après chaque sortie de fourragement, les abeilles ouvrières doivent retourner à la ruche afin d’y déposer le pollen et/ou le nectar récoltés. Elles doivent donc parcourir des distances allant jusqu’à plusieurs kilomètres en s’orientant grâce à des repères visuels locaux et des informations célestes (Menzel 1996), comme la position azimutale du soleil et la lumière polarisée (Wehner & Rossel 1985). Les abeilles visitent successivement des centaines de fleurs de la même espèce de façon rapide et efficace afin de récolter pollen et/ou nectar (Grant 1951 ; Chittka 1999). Elles mémorisent des repères locaux caractérisant des sites d’intérêt tels que les ressources florales exploitées et la ruche et ses alentours. Elles communiquent la localisation des sources de nourriture profitables à leurs congénères via des mouvements stéréotypés de leur corps appelés « danse » qui code des informations de distance et direction (von Frisch 1967). Les abeilles voient le monde en couleurs car elles sont douées de vision trichromatique (von Frisch 1914 ; Daumer 1956 ; von Helversen 1972 ; Menzel & Backhaus 1991), elles perçoivent les formes et les configurations d’objets visuels, fleurs ou objets artificiels (Wehner 1981 ; Srinivasan et al. 1994), et possèdent également une haute résolution temporelle des mouvements (Srinivasan & Lehrer 1984). De plus, leur système olfactif leur permet de distinguer une large gamme d’odeurs (Guerrieri et al. 2005) et leur perception mécano-sensorielle est également très riche (Dacher et al. 2004). Les abeilles possèdent donc
Lobes optiques: Medulla Lobula Calices Lobes α Lobes β Corps pédonculés: Lobes antennaires Lobes optiques: Medulla Lobula Calices Lobes α Lobes β Corps pédonculés: Lobes antennaires Lobes optiques: Medulla Lobula Calices Lobes α Lobes β Corps pédonculés: Lobes antennaires
Figure 2 : Représentation en 3 dimensions du cerveau de l’abeille. En jaune : les lobes optiques (rétine, lamina, medulla et lobula), en rouge : les corps pédonculés (centres intégrateurs), en bleu : les lobes antennaires (système olfactif). A droite des neurones du circuit olfactif allant des lobes antennaires aux corps pédonculés et corne latérale (structure diffuse adjacente aux lobes optiques) (Haddad et al. 2004 Menzel et al. 2006; )
des systèmes sensoriels performants associés à un répertoire comportemental relativement riche.
Le système visuel de l’abeille
Afin de butiner efficacement, l’abeille doit collecter pollen et/ou nectar à des distances relativement importantes de sa ruche en se basant sur des repères visuels pour s’orienter dans son environnement. Par conséquent, tant pour assurer son retour à la ruche que pour la sélection des fleurs à butiner, la vision est un sens extrêmement important. La vision assure par ailleurs des manœuvres de vol efficaces dans un environnement complexe (Srinivasan & Zhang 2004). Les abeilles ont des capacités de rotation de la tête relativement limitées. En compensation, les yeux composés s’étalent sur pratiquement toute la surface de là tête de l’abeille et permettent une vue partiellement panoramique de l’environnement au niveau de la rétine. Les yeux composés sont formés par la juxtaposition de milliers de lentilles hexagonales (5000 à 6000 chez l’ouvrière). Chacune de ces petites lentilles (Figure 3), correspond à une unité fonctionnelle appelée ommatidie. C’est l’ensemble de ces ommatidies qui constitue l’œil composé. En dessous de chaque lentille se trouve une seconde structure, conique et transparente : le cône cristallin, celui-ci sert à collecter et concentrer les faisceaux de lumière sur les cellules photoréceptrices présentes en dessous. Au sein de chaque ommatidie, des cellules pigmentées entourent le cône cristallin et les photorécepteurs, empêchant ainsi que la lumière en provenance d’autres sites que celui de leur propre lentille ne les atteignent. Au sein de chaque ommatidie, nous trouvons chez l’abeille 9 photorécepteurs disposés de façon concentrique. La partie interne, convergente, constitue le rhabdome ou région excitable de l’ommatidie. Le rhabdome est fait des microvillosités de chaque cellule photoreceptrice (rhabdomère) qui s’alignent au centre de l’ommatidie. Il s’étend tout au long de l’ommatidie mais subit une torsion en profondeur, liée à la propre torsion des photorecepteurs. Seule la région purement dorsale des yeux composés ne montre pas cette torsion ce qui permet une analyse de la lumière polarisée du ciel. Dans les microvillosités on trouve les photopigments qui sont excités par des photons de longueurs d’onde différentes. En fait, le rhabdome agit comme un guide pour la lumière, de sorte que la lumière atteignant le haut du rhabdome est diffusée sur toute sa longueur, permettant ainsi aux pigments visuels de réagir à la lumière. Cette réaction entre lumière et pigment visuel de la membrane entraîne des changements réversibles de la conformation membranaire qui permettent indirectement l’ouverture de canaux ioniques. Les mouvements d’ions résultant
Introduction
entraînent alors une dépolarisation de la cellule, qui se propagera le long de l’axone causant la libération d’histamine, le neurotransmetteur de la voie visuelle périphérique chez l’insecte (Bornhauser & Meyer 1997), qui ira stimuler la prochaine cellule de la voie visuelle. L’information sera alors acheminée dans les lobes optiques, responsables du traitement visuel dans le cerveau. Ceux-ci sont au nombre de trois, disposés consécutivement de la périphérie (rétine) vers les niveaux centraux: lamina, medulla et lobula.
Les cellules d’une ommatidie agissent ensemble comme une unité réceptrice captant une petite partie de la scène visuelle au travers de sa lentille. En fait, une image « complète » du monde extérieur est alors construite par la juxtaposition des informations lumineuses captées par les milliers d’ommatidies. Les yeux composés des abeilles ont une résolution spatiale relativement faible en comparaison avec celle de l’Homme (environ 100 fois plus faible), mais en revanche, ils possèdent une résolution temporelle beaucoup plus fine (environ 100 Hz pour la vision de couleurs (Srinivasan & Lehrer 1985), et environ 200 Hz pour des patterns achromatiques en mouvement (Srinivasan & Lehrer 1984)).
Figure 3: schéma d’une ommatidie : unité de l’œil composé de l’abeille.
Vision des couleurs chez l’abeille
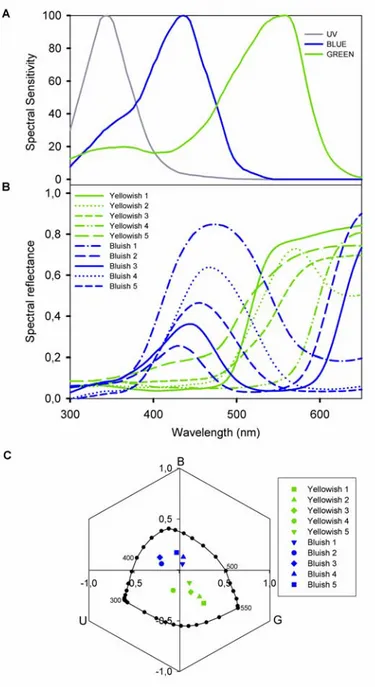
La capacité de vision chromatique fut démontrée par Karl von Frisch (1914) qui par un simple protocole expérimental démontra pour la première fois que des abeilles en libre vol ayant reçu une récompense de solution sucrée sur un carton de couleur étaient capables de reconnaître et donc de choisir cette couleur parmi des cartons achromatiques dont l’intensité (variable achromatique) était la même que celle du carton de couleur récompensé. A partir de cette expérience de base, von Frisch a pu caractériser le spectre visuel de l’abeille qui va de 300 nm (ultraviolet ou UV) à 650 nm (orange – rouge). Ainsi ce spectre est déplacé vers les
longueurs d’onde inférieures par rapport au notre (Fig 4). En effet, la perception des couleurs est décalée pour l’Homme vers les longueurs d’ondes rouges alors que pour l’abeille elle est décalée vers les longueurs d’ondes UV.
400 500 600 700
Figure 4
Dans la rétine de l’abeille se trouvent 3 types de photorécepteurs maximalement sensibles à l’UV (longueurs d’ondes courtes, aussi appelé Récepteur S ; sensibilité maximale, à 344), Bleu (longueurs d’ondes moyennes, aussi appelé Récepteur M ; sensibilité maximale à 436 nm) et Vert (longueurs d’ondes longues, aussi appelé récepteur L ; sensibilité maximale, à 544) (Menzel & Backhaus 1991) (Fig 5). Après les études de Daumer (1956) qui démontra l’existence de trichromatisme chez l’abeille, von Helversen (1972) a étudié la discrimination spectrale chez l’abeille. Grâce à des expériences de discrimination, il a pu établir la courbe de sensibilité spectrale des abeilles. Celle-ci comportait 3 maxima dans ces études : un autour de 345 nm, un second autour de 440 nm et un troisième autour de 550 nm, ce qui correspondait respectivement aux sensibilités maximales des photorécepteurs UV, bleu et vert présents chez l’abeille (voir ci-dessous). De plus, von Helversen (1972) a déterminé les capacités des abeilles à discriminer les couleurs en fonction de leur longueur d’onde. La courbe de discrimination spectrale obtenue présentait 2 maxima, un autour de 400 nm et l’autre autour de 500 nm, valeurs correspondant respectivement à l’intersection des courbes de sensibilités spectrales des récepteurs UV et Bleu et Bleu et Vert (cf. Fig. 5). Ces résultats montrent donc que les capacités de discrimination de couleurs des abeilles sont accrues dans les régions correspondant à l’intersection des courbes de sensibilité spectrale des récepteurs UV et Bleu et Bleu et Vert. Des études plus récentes ont montré que c’est justement au niveau de ces intersections que se situent les variations importantes des courbes spectrales d’un grand
: le spectre visuel de l’homme et de l’abeille.
300 400 500 600
Homme
Longueur d’onde (nm)
Abeille
Introduction
nombre d’espèces florales (Chittka & Menzel 1992), ce qui favorise leur discrimination et reconnaissance dans le contexte de la pollinisation.
A bsorban ces re lativ es d es r éc ept eurs Longueur d’onde (nm) UV Bleu Vert A bsorban ces re lativ es d es r éc ept eurs Longueur d’onde (nm) A bsorban ces re lativ es d es r éc ept eurs Longueur d’onde (nm)
UV Bleu Vert Figure 5: Sensibilité spectrale des 3 types de
torécepteurs présents chez l’abeille A
pho pis
ifera. Ces courbes ont été déterminées grâce à des enregistrements intracellulaires de l’excitation dans des récepteurs isolés. Chaque courbe a été isées avec des intervalles de 4 nm et correspondent à la moyenne de plusieurs cellules (Menzel & Backhaus 1991).
mell
réal
Nous avons déjà abordé la structure des yeux composés de l’abeille et nous avons vu que chaque ommatidie contient 9 photorécepteurs. En fait, il existe 3 types différents d’ommatidies en fonction de leur composition en classes de photorécepteurs (Wakakuwa et
al. 2005). Les 3 types d’ommatidies, apparemment localisées de façon aléatoire dans la rétine
de l’abeille, contiennent chacun 6 cellules photoréceptrices « Vert ou L» et une cellule basale, plus petite, encore difficilement caractérisée (il ne semble cependant pas qu’elle soit sensible à l’UV). Les 2 cellules restantes sont, soit un photorécepteur UV et un photorécepteur Bleu pour le type I, 2 photorécepteurs UV pour le type II et 2 photorécepteurs Bleu pour le type III (Wakakuwa et al. 2005). On observe quand même une tendance à avoir plus de récepteurs UV dans la région dorsale de l’œil composé (Type II) et plus de récepteurs Bleu (Type III) dans la région ventrale.
La couleur perçue par l’abeille va dépendre de l’excitation relative des 3 types de photorécepteurs et du traitement antagoniste de ces informations au niveau central. Chacun des 9 photorécepteurs envoie une terminaison nerveuse vers les différents lobes optiques. La longueur de ces terminaisons nerveuses (fibres) et leur destination variant en fonction du type de photorécepteurs considéré (UV, Bleu, Vert). Les photorécepteurs Bleu et Vert atteignent la lamina par des fibres visuelles courtes, alors que le photorécepteur UV atteint la medulla par des fibres visuelles longues.
Les photorécepteurs sont connectés à des neurones qui amplifient leur signal, à leur tour connectés à des neurones antagonistes de couleur. Au niveau périphérique, la
transmission de l’information visuelle (photorécepteurs-cellules de la lamina) semble reposer essentiellement sur l’histamine comme neurotransmetteur (Bornhauser & Meyer 1997), alors qu’au niveau central (medulla, lobula) la transmission de l’information serait plutôt cholinergique (Kreissl & Bicker 1989).
Au niveau central, la caractéristique principale de la vision de couleurs est le traitement de type antagoniste (‘color opponent coding’) des informations en provenance des différents types de photorécepteurs. Ce traitement de type ‘soustractif’ permet de coder la couleur alors que des traitements de type additif codent pour la variable achromatique d’intensité. Chez l’abeille plusieurs modèles théoriques ont montré que l’antagonisme de couleurs est à la base des performances de vision de couleurs caractérisées comportementalement (Chittka 1992 ; Backhaus 1991) et des espaces perceptuels antagonistes ont été proposés (Chittka 1992 ; Backhaus 1991).
Des enregistrements électrophysiologiques intracellulaires ont montré dans les années 70 que les signaux en provenance des 3 types de photorécepteurs étaient traités par des neurones de type « additif » et des neurones de type antagoniste dans les lobes optiques de l’abeille (Kien & Menzel 1977), notamment dans la medulla et la lobula. On distingue les neurones à large spectre de réponse (‘broad band’) et ceux à spectre étroit (short band). Les neurones à réponses « larges » reçoivent des entrées de même signe des 3 types de photorécepteurs. Ils peuvent être excités ou inhibés par des lumières constituées d’une large partie du spectre (par ex : UV+/B+/G+ = neurone excité par toutes les longueurs d’onde, ou encore B-/G- = neurone inhibé par des longueurs d’onde bleu et verte). Il semble que ces neurones reçoivent donc des informations en provenance de 2 ou 3 types de photorécepteurs et que leur caractéristique principale est l’absence d’antagonisme. Il a été donc suggéré que ces neurones ne participeraient pas directement à la perception des couleurs mais seraient plutôt sensibles à l’intensité lumineuse de l’environnement (Menzel 1979,1985). Cependant une étude récente (Yang et al. 2004) suggère que ces neurones pourraient également constituer une partie des informations afférentes aux neurones d’un niveau supérieur mettant en jeu l’antagonisme de couleur. Les neurones à réponse « étroite » répondent à des stimuli lumineux dans un rang relativement restreint du spectre, et leur sensibilité spectrale est très proche de celle d’un type de photorécepteur (Menzel 1979). Ils montreraient donc un antagonisme de couleur du fait que la réponse à des informations en provenance des deux autres récepteurs serait inhibée. Par ailleurs, Kien et Menzel (1977) ont montré l’existence de deux types de neurones clairement antagonistes. Ces deux types de neurones antagonistes, enregistrés au niveau de la medulla, font intervenir les antagonismes UV vs. Bleu/Vert et Bleu
Introduction
vs. UV/Vert. C'est-à-dire que le type UV vs. Bleu/Vert va mettre en opposition les entrées en provenance du photorécepteur UV par rapport à celles des photorécepteurs Bleu et Vert ; il va donc être excité (ou inhibé) par des longueurs d’onde UV et inhibé (ou excité) par des longueurs d’onde Bleu et/ou Verte (UV+/B-/G- et UV-/B+/G+). Il en est de même pour le type Bleu vs. UV/Vert qui réagira de façon antagoniste à ces 2 types de longueurs d’ondes (UV-/B+/G- et UV+/B-/G+). Pendant les 30 dernières années, les connaissances physiologiques sur le traitement central des informations chromatiques ont été limitées à ces travaux. Cependant, des études récentes (Yang et al. 2004) contestent cette vision et décrivent plusieurs types de neurones antagonistes présents au niveau de la lobula. Cette étude suggère qu’il y existerait en fait 12 types de neurones antagonistes mettant en jeu des mécanismes de simple ou double antagonisme (par ex : UV-/B+ ; UV+/B-/G- ; UV-/B+/G-…). A l’heure actuelle l’existence d’antagonisme de couleurs dans le système nerveux central de l’abeille ne fait aucun doute. La nature de cet antagonisme reste cependant à éclaircir.
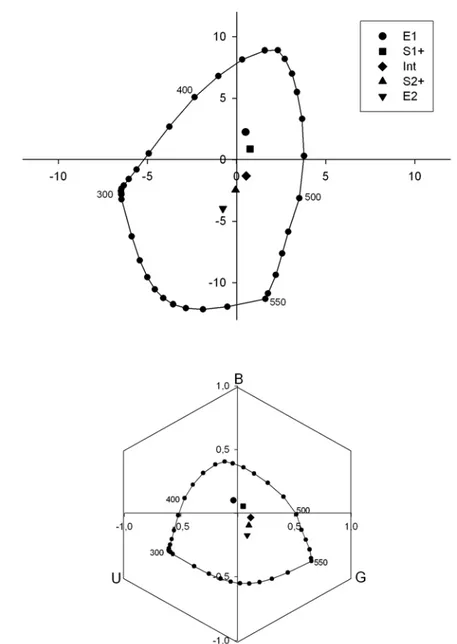
A ce propos, deux modèles différents ont été développés afin de représenter, dans un espace perceptif, la façon dont sont codées les couleurs par le cerveau de l’abeille. En fait, le premier de ces modèles, « Color Opponent Coding (COC) space » (Backhaus 1991) a été spécialement développé pour les abeilles et se base sur l’existence des neurones antagonistes spécifiques décrits par Menzel et Kien (1977). L’autre modèle, « l’hexagone de couleurs » (Chittka 1992) est moins spécifique car il est applicable à une grande variété d’espèces d’hyménoptères et repose aussi sur un traitement antagoniste de l’information chromatique dans lequel le type d’antagonisme mis en jeu n’est pas spécifié. Dans ce travail, nous ne souhaitons pas entrer dans le débat « COC » vs. « Hexagone » qui a occupé plusieurs publications scientifiques (voir, par ex. Vorobyev et al. 1999). Chacun a ses avantages et ses limites de sorte que nous présenterons donc, dans la plupart des cas, les stimuli dans les 2 espaces perceptifs afin de ne pas entrer dans une polémique non pertinente pour notre travail.
Dans le premier papier présenté ici nous avons réalisés des expériences sur les processus impliqués dans la généralisation de couleurs chez l’abeille. Plus particulièrement, nous avons comparé les performances de généralisation des abeilles en fonction qu’elles soient entraînées avec un ou deux stimuli récompensés, afin de voir comment interagissaient deux gradients de généralisation de type excitateurs. Cette étude nous a permis de mettre en évidence que la généralisation ne dépendait pas seulement de la distance perceptive entre stimuli suggérant ainsi l’existence de « catégories » de couleurs chez l’abeille.
Dans le deuxième papier présenté dans cette thèse, nous avons donc voulu savoir si les abeilles pouvaient catégoriser des couleurs et donc découper le continuum de longueurs
d’ondes, au moins en 2 catégories assez larges « jaunâtre » et « bleuâtre » à l’œil humain, correspondant respectivement à des catégories « moyenne longueur d’ondes » et « longue longueur d’ondes » pour l’abeille. Dans une première série d’expériences, nous avons voulu vérifier que les abeilles étaient parfaitement capables de discriminer entre les différentes couleurs utilisées appartenant à une même catégorie. En effet, parler de catégorisation n’aurait pas de sens si les abeilles ne sont pas capables de discriminer les différents membres d’une même catégorie (Zayan & Vauclair 1998). Dans une seconde série d’expériences, nous avons donc entraîné les abeilles à catégoriser les couleurs « jaunes » vs. « bleus » et testé leurs performances de transfert vers de nouveaux stimuli. Dans une troisième expérience, nous avons comparé une tâche de discrimination impliquant 2 couleurs d’une même catégorie (2 jaunes) avec une tâche de discrimination impliquant 2 couleurs de catégories différentes (1 jaune vs. 1 bleu), afin de voir si la discrimination était facilitée lorsque les 2 couleurs appartenaient à des catégories différentes.
Visions des formes chez l’abeille
Les abeilles sont capables de voir et reconnaître les formes des objets qui les entourent, même si la résolution spatiale des yeux composés est assez faible (Srinivasan & Lehrer 1988). Le premier à avoir mis en évidence cette capacité a été Karl von Frisch qui, comme pour les couleurs, a été capable d’entraîner des abeilles à voler vers une forme ou « pattern » récompensé par une solution sucrée (von Frisch 1914). Afin d’éviter les interférences de la vision chromatique ces études ont historiquement employé des stimuli achromatiques (par ex. des formes noires sur un fond blanc). Dans un tel contexte, des associations sont formées entre stimuli visuels et récompense, mais aussi entre la réponse comportementale de l’animal (ex. atterrissage) et la récompense ; les abeilles apprennent que le pattern est associé à une récompense de solution sucrée et qu’elles doivent se poser sur ce stimulus afin d’obtenir la récompense. Ce conditionnement est donc de type opérant mais présente aussi des composantes pavloviennes (association pattern-sucre).
Les premières études sur la reconnaissance visuelle de formes chez l’abeille ont utilisé des stimuli relativement simples (von Frisch 1914 ; Hertz 1933; Wehner 1972b ; Gould 1985), notamment des formes « fermées » comme des triangles, cercles ou rectangles. Les premières idées sur comment les abeilles percevaient ces formes mettaient l’accent sur la détection de caractéristiques simples qui pouvaient être évaluées séparément les unes des autres sans tenir compte du motif lui-même. Avant 1940, les travaux de Mathilde Hertz
Introduction
concluaient que les abeilles détectaient et discriminaient des motifs seulement en se basant sur des caractéristiques simples comme la disruption du motif (lié à sa fréquence spatiale) et la quantité de surface noire (Hertz 1933, 1935). Un traitement périphérique plutôt que central était supposé sous-tendre ces performances (Hertz 1933, 1935). De ce fait, des formes « fermées » présentant des degrés de disruption similaires étaient, en principe, mal discriminées.
Ces études étaient réalisées en présentant les formes à apprendre et discriminer sur un plan horizontal, généralement sur une table d’expérimentation à laquelle les abeilles étaient entraînées à venir régulièrement. Cette méthode présentait un problème fondamental pour la reconnaissance de formes, à savoir que l’angle d’approche d’une abeille en libre vol pouvait influencer de façon dramatique son choix. En effet, celui-ci se baserait sur des informations visuelles partielles, correspondant à ce que l’abeille voit d’abord en se rapprochant des figures. De ce fait, Wehner (1967) introduisit la présentation verticale des figures à discriminer afin d’éviter ce problème. L’abeille n’a plus de degrés de liberté en se rapprochant des figures entraînées car elle les voit frontalement. Les travaux de Wehner ont étudié (1967) les capacités des abeilles à discriminer entre des rayures achromatiques en fonction de leur orientation, utilisant une simple barre noire sur fond blanc, des patterns rayés ou des croix (deux barres formant un angle de 90°), présentés donc dans un plan vertical. Ces travaux ont montrés que les abeilles possédaient un mécanisme leur permettant de déterminer l’orientation d’une simple barre ou de patterns rayés présentés verticalement. Notamment, les abeilles pouvaient parfaitement discriminer un pattern ayant une inclinaison différent d’au moins 30° du pattern préalablement entraîné.
A partir de ces travaux et d’autres réalisés par la suite (Wehner 1972a,b 1974, 1981; Gould 1985), il a été postulé que les abeilles apprenaient et reconnaissaient des motifs visuels sous la forme d’image rétinotopique (« template »). Cette théorie postule que les motifs sont perçus comme des images fixées rétinotopiquement et mémorisées en tant que telles (« pixel based memory ». Les termes « instantané photographique » (« snapshot ») (Cartwright & Collett 1983) et « image eidétique » (Wehner & Lindauer 1966; Wehner 1972a,b, 1981) ont souvent été utilisés pour faire référence à cette forme détaillée et pixélisée de représentation d’un motif. La reconnaissance d’une forme ou d’un motif dépendrait alors du niveau de recouvrement entre l’image mémorisée et celle actuellement perçue (Wehner 1972a, 1974, 1981; Gould 1985). Cette théorie du « template » implique une représentation holistique qui n’apparaît cependant pas très flexible concernant les processus de généralisation et de transfert à de nouveaux stimuli (Dill et al. 1993). En effet, un faible déplacement de l’image