Université Toulouse III - Paul Sabatier Ecole doctorale Sciences Ecologiques, UFR Sciences de la Vie et de la Terre Vétérinaires, Agronomiques et Bioingénieries
THESE
pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE Délivré par l’Université Toulouse III – Paul Sabatier
Spécialité : Ecologie
Présentée par
Fabien LEPRIEUR
Les introductions d’espèces de poissons d’eau douce : distribution
spatiale, déterminants et impacts sur les espèces natives
Soutenue le 7 décembre 2007
Devant le jury composé de :
D. MOUILLOT, Professeur, Université Montpellier 2 Rapporteur
D. SIMBERLOFF Professeur, University of Tennessee (USA) Rapporteur E. GARCIA-BERTHOU Professeur, Universitat de Girona (Spain) Examinateur
S. LEK Professeur, Université Paul Sabatier (Toulouse) Président T. OBERDORFF Directeur de recherche, IRD (Paris) Examinateur
Université Toulouse III - Paul Sabatier Ecole doctorale Sciences Ecologiques, UFR Sciences de la Vie et de la Terre Vétérinaires, Agronomiques et Bioingénieries
THESE
pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE Délivré par l’Université Toulouse III – Paul Sabatier
Spécialité : Ecologie
Présentée par
Fabien LEPRIEUR
Les introductions d’espèces de poissons d’eau douce : distribution
spatiale, déterminants et impacts sur les espèces natives
Soutenue le 7 décembre 2007
Devant le jury composé de :
D. MOUILLOT, Professeur, Université Montpellier 2 Rapporteur
D. SIMBERLOFF Professeur, University of Tennessee (USA) Rapporteur E. GARCIA-BERTHOU Professeur, Universitat de Girona (Spain) Examinateur
S. LEK Professeur, Université Paul Sabatier (Toulouse) Président T. OBERDORFF Directeur de recherche, IRD (Paris) Examinateur
« Plus je sais, moins je sais. L'essentiel est de ne jamais cesser de chercher. » (Albert Einstein)
Auteur : Fabien LEPRIEUR
Titre : Les introductions d’espèces de poissons d’eau douce : distribution spatiale,
déterminants et impacts sur les espèces natives
Directeur de thèse : Sébastien BROSSE
Lieu et date de soutenance : Toulouse, le 7 décembre 2007 Résumé :
Bien que les espèces non natives de poissons d’eau douce soient bien identifiées, les facteurs déterminant leur distribution spatiale ainsi que leurs impacts sur la biodiversité sont encore peu connus, en particulier à de larges échelles spatiales. Dans ce contexte, cette thèse vise : (i) à une meilleure compréhension de l’impact des espèces non natives de poissons d’eau douce sur les espèces natives ; et (ii) à identifier les facteurs qui contrôlent la distribution spatiale des espèces non natives. Pour cela, différents niveaux de perception du processus d’introduction d’espèces et différentes échelles spatiales ont été considérés.
Les résultats obtenus à l’échelle locale (135 stations au sein d’un bassin hydrographique de Nouvelle Zélande) ont permis de mettre en évidence que l’impact d’une espèce invasive (la truite, Salmo trutta L.) sur une espèce native (Galaxias anomalus Stockell) peut varier spatialement en fonction des caractéristiques abiotiques locales. En particulier, les perturbations anthropiques, telles que la modification des habitats résultant des variations de débit, ne favorisent pas forcément les espèces invasives. Ainsi, la conservation d’une espèce native menacée nécessite des mesures de gestion adaptées au contexte environnemental local. Enfin, une étude expérimentale souligne le fait qu’une espèce considérée à priori comme invasive et nuisible (le poisson chat, Ameiurus melas Raff.) doit faire l’objet d’études quant à son impact réel sur les espèces natives ; ceci afin de mettre en place des mesures de gestion adaptées aux caractéristiques comportementales et écologiques de l’espèce impactée.
Les résultats obtenus à l’échelle régionale (bassin hydrographique) montrent que les introductions d’espèces de poissons d’eau douce en Europe ont conduit à une augmentation de la diversité alpha des bassins hydrographiques (c'est-à-dire une augmentation du pool régional d’espèces), mais ont provoqué une diminution de la diversité beta (homogénéisation taxonomique). L’augmentation du pool régional de poissons d’eau douce en Europe ne doit pas forcément être interprétée comme bénéfique pour la biodiversité, car les extinctions d’espèces se déroulent généralement à des échelles de temps plus grandes que le phénomène d’introduction d’espèces. Ensuite, il semblerait que la distribution actuelle des poissons d’eau douce exotiques en Europe (c.-à-d. les espèces non européennes) soit le résultat combiné d’une limitation de leur dispersion liée aux activités humaines et d’un contrôle environnemental associé aux contraintes climatiques. Enfin, il est montré que le niveau d’anthropisation d’un bassin hydrographique, et plus particulièrement sa richesse économique, est le principal déterminant de la richesse régional en espèces non natives de poissons d’eau douce.
Mots clés : espèces non natives, poissons d’eau douce, assemblages d’espèces,
macroécologie, homogénéisation biotique, modèles nuls, filtres environnementaux, hotspots d’invasion.
Discipline : Ecologie
Adresse du laboratoire de rattachement : Laboratoire Evolution & Diversité Biologique
Bâtiment 4R3 Université Paul Sabatier, 118 route de Narbonne, 31062 Toulouse cedex 4, France
Remerciements
Je tiens tout d’abord à remercier Sébastien Brosse, mon directeur de thèse. Sébastien, tu as toujours été à mon écoute durant cette thèse. Tes conseils pertinents et ta vue globale de l’écologie ont été un atout majeur pour la finalisation de cette thèse. D’un point de vue humain, ta confiance en moi et tes encouragements m’ont été également très précieux, surtout durant ma première année de thèse qui a été un peu mouvementée au niveau personnel.
Je remercie également Sovan Lek qui m’a fait confiance depuis le début. Sovan, il y a quelques années, je suis venu à Toulouse pour te demander des conseils sur le déroulement d’une thèse en écologie. Tes conseils m’ont été très utiles et c’est grâce à toi que je suis parti en Nouvelle Zélande pour commencer ma thèse.
Je remercie vivement Colin Townsend de m’avoir accueilli dans son laboratoire à l’université d’Otago en Nouvelle Zélande au début de ma thèse. Colin, vous m’avez beaucoup apporté tant d’un point de vue scientifique qu’humain. Mon expérience en Nouvelle Zélande reste un souvenir inoubliable et c’est principalement grâce à vous.
Je remercie David Mouillot et Daniel Simberloff d’avoir accepté d’être rapporteur de cette thèse. En effet, c’est un grand honneur pour moi que vous puissiez juger cette thèse étant donné votre expérience et la qualité de vos travaux en écologie.
Je remercie Emili-García Berthou et Thierry Oberdorff d’avoir accepté d’être membre de ce jury. Thierry, un grand merci pour ton soutien et tes encouragements. Tu m’as permis de prendre conscience d’une autre facette de la problématique des invasions biologiques. J’espère sincèrement continuer à travailler avec toi.
Je remercie Bernard Hugueny qui m’a donné de nombreux conseils lors de notre rencontre à Lyon. Bernard, tu m’as éclairé sur la partie « macroécologie » de cette thèse. Nos discussions sur l’intérêt et la philosophie des modèles nuls m’ont été très utiles. Mes neurones ont souffert mais le concept est bien passé.
Je remercie vivement tous mes collègues ami(es) de l’équipe « structure des communautés et macroécologie »: Bobby, Charly, Micky, Ronny, Wendy, Cindy, Sandy Rosy, Domy, Fonzy……. enfin, la bande des « Y ». J’oubliais « Gala » aussi! Votre bonne humeur, gentillesse et votre soutien moral m’ont été indispensable pour réaliser cette thèse. Flamby vous sera toujours fidèle ! Je voudrais particulièrement remercier : Gaël Grenouillet pour sa disponibilité et ses commentaires pertinents sur mes travaux de thèse ; Géraldine Loot pour ses nombreux encouragements ; Simon Blanchet pour ses conseils judicieux (et notre passion commune pour Match Point !) et Laetitia Buisson pour sa bonne humeur et pour m’avoir donné des bonbons nounours.
Je tiens particulièrement à remercier Olivier Beauchard dont le travail impressionnant (de fourmi) a donné naissance à une base de données mondiale sur la biodiversité des poissons d’eau douce et Karl Kreutzenberger pour l’excellent travail fourni lors de son DESUPS.
Je tiens enfin à remercier toute ma famille (et d’ailleurs l’ensemble de mon arbre généalogique!). En particulier, je remercie mes parents pour leur soutien depuis toujours et leur amour. Un grand merci à mon frère, Frédéric, qui a toujours été un modèle pour moi. Il m’a convaincu de poursuivre mes études… alors que j’étais décidé à suivre des études courtes! Je lui en serais toujours reconnaissant.
Je remercie également mes beaux parents, André et Claudine, et Claude mon « beauf-ami » pour leur soutien formidable et leur affection. André, vous ne m’avez jamais laissé avoir soif… (sauf à la Gacholle).
Enfin, Magali (la perle), mon épouse, je ne sais pas comment te remercier. Tu m’as tellement soutenu durant cette thèse. Mes remerciements vont bien au-delà du seul cadre de cette thèse. Tu m’as ouvert les yeux…
Partie 1 : Synthèse
11. Introduction générale………...
21-1. Problématique………. 2
1-2. Echelles spatiales et niveaux de perception du processus d’introduction d’espèces………….. 4
1-3. Organisation du mémoire……… 9
2. Les introductions d’espèces à l’échelle locale……….
152-1. Le cas de la truite commune (Salmo trutta L.) introduite en Nouvelle Zélande (P1)………… 15
2-2. Le cas du poisson-chat (Ameiurus melas Raff.) introduit en Europe (P2)………. 22
2-3. Conclusion et perspectives………. 25
3. Les introductions d’espèces à l’échelle régionale………...
273-1. Processus d’homogénéisation biotique des assemblages régionaux : le cas des poissons d’eau douce européens (P3)……….. 28
3-2. Rôle des facteurs environnementaux et géographiques dans la structuration des assemblages régionaux : une comparaison entre les espèces natives et exotiques de poissons d’eau douce européens (P4)……… 31
3-3. Déterminants et répartition géographique mondiale de la richesse en espèces non natives de poisson d’eau douce (P5)………. 35
3-4. Conclusion et perspectives………... 39
4. Conclusion générale………...
43Partie 2: Publications
54P1
Hydrological disturbance benefits a native fish at the expense of an exotic fish Leprieur F., Hickey M.A., Arbuckle C.J., Closs G.P., Brosse, S. & Townsend
C.R. (2006) Journal of Applied Ecology, 43: 930-939.
P2
Impact of the invasive black bullhead (Ameiurus melas Raff.) on the predatory efficiency of northern pike (Esox lucius L.)
Kreutzenberger K., Leprieur F., & Brosse, S.
Journal of Fish Biology
(en révision mineure)
P3
Null model of biotic homogenization: a test with the European freshwater fish fauna
Leprieur F., Beauchard O., Hugueny B., Grenouillet G. & Brosse S. (2007)
Diversity and Distributions
(sous presse)
P4
Patterns and mechanisms of the distance decay of similarity in the European freshwater fish fauna: contrasting native and exotic species
Leprieur F., Olden, J.D. Lek, S. & Brosse S. (en préparation)
P5
Fish invasions in the world’s river systems: when natural processes are blurred by human activities
Leprieur F., Beauchard O., Blanchet S., Oberdorff T. & Brosse S.
PLoS Biology
1. Introduction générale
1.1. Problématique
Les introductions d’espèces par l’homme se sont développées dès le néolithique. Le développement du pastoralisme et de l’agriculture a ainsi entrainé le transport volontaire (p.ex. les céréales, les animaux domestiques) et/ou involontaire (p.ex. les parasites et les commensaux des espèces domestiquées) de nombreux organismes animaux et végétaux (Crosby 1986). Néanmoins, les introductions d’espèces ont considérablement augmenté au 20ème siècle avec le développement du commerce international et des transports humains (Mack & Londsale 2001 ; Levine & D’Antonio 2003 ; Perrings et al. 2005 ; Meyerson & Mooney 2007). Cette globalisation du commerce et de l’économie tend ainsi à supprimer les barrières géographiques limitant la distribution naturelle des espèces et donc à favoriser leur expansion géographique (Perrings et al. 2005 ; Meyerson & Mooney 2007).
Les espèces non natives en s’établissant dans le milieu d’accueil, peuvent devenir invasives et par conséquent provoquer des perturbations à différents niveaux d’organisation écologique : de individu à l’écosystème (Lodge 1993 ; Simberloff 1996 ; Parker et al. 1999 ; Sakai et al. 2001 ; Simon & Townsend 2003 ; Lockwood et al. 2007). A ces impacts écologiques s’ajoutent des impacts plus difficiles à quantifier, tels que des changements évolutifs chez les espèces natives qui peuvent apparaître très rapidement suite à de nouvelles pressions de sélection imposées par l’introduction d’espèces non natives (Mooney & Cleland 2001 ; Stockwell et al. 2003 ; Strauss et al. 2006). Bien que les invasions biologiques soient considérées comme la deuxième cause d’extinction d’espèces, après la destruction et la fragmentation des habitats (Miller et al. 1989 ; Wilcove 1998 ; Woodruff 2001 ; Clavero & García-Berthou 2005 ; Millenium Ecosystem Assessment 2005), l’impact des introductions d’espèces est actuellement peu étudié par rapport aux autres types de perturbations anthropiques (Lawler et al. 2006).
D’un point de vue pratique, les sociétés humaines tirent de nombreux bénéfices du fonctionnement des écosystèmes (ressources animales et végétales, énergie,…) et la diversité génétique, taxonomique et écosystémique (c.-à-d. la biodiversité) joue un rôle important dans le fonctionnement, la résilience et la résistance des écosystèmes (Loreau et al. 2002 ; Hooper
et al. 2005). Les invasions biologiques peuvent ainsi provoquer des pertes importantes de
services écologiques de part leur effet négatif sur la biodiversité (Vitousek et al. 1997 ; Sala et al. 2000 ; Loreau et al. 2001 ; Hooper et al. 2005), et par conséquent avoir des impacts
économiques non négligeables (Sakai et al. 2001 ; Hooper et al. 2005 ; Pimentel et al. 2005).
Les études portant sur la conservation des écosystèmes aquatiques (marins et d’eau douce) sont peu nombreuses (Lawler et al. 2006), alors que ces derniers sont les plus menacées par les activités humaines : surexploitation, pollution, destruction d’habitats, invasions biologiques (Moyle 1999 ; Millenium Ecosystem Assessment 2005 ; Dudgeon et al. 2005). Les écosystèmes aquatiques continentaux (rivières, lacs et estuaires) font partie des écosystèmes les plus envahis dans le monde (Moyle 1999 ; Cohen 2002). Les poissons d’eau
douce, plus particulièrement, ont fait l’objet de nombreuses introductions depuis le moyen
âge, de par leur intérêt alimentaire, récréatif ou ornemental (Welcomme 1988 ; Lever 1996). Comme pour les organismes terrestres, les introductions de poissons d’eau douce ont parfois été bénéfiques d’un point de vue socio-économique (Lever 1996), mais une grande partie d’entre elles ont eu des conséquences négatives sur les espèces natives (Ross 1991 ; Miller et
al. 1989 ; Lever 1996 ; Townsend 2003 ; Light & Marchetti 2007). Plusieurs mécanismes sont
à l’origine de l’impact des espèces non natives de poissons d’eau douce. D’abord, la
prédation sur les espèces natives peut entrainer des extinctions locales (Ross 1991 ; Bianco
1995; Fuller 1999 ; Elvira 2001; McDowall 2006 ; Fattini & Petrere 2007), voire des extinctions globales d’espèces (Barlow et al. 1987 ; Witte et al. 1992 ; Crivelli 1995 ; McDowall 2006 ; Kirchner & Soubeyran 2007). Ensuite, la compétition interspécifique pour
la ressource trophique ou l’espace peut entrainer des modifications comportementales (Blanchet et al. 2007 ; Baxter et al. 2007) et altérer la dynamique des populations (p.ex. la croissance, la survie, la fécondité,…) (Ríncon et al. 2002; Townsend 2003 ; Baxter et al. 2007 ; Blanchet et al. 2007). Enfin, l’hybridation entre espèces natives et non natives (Perry
et al. 2002) et l’introduction de parasites et pathogènes associés aux espèces non natives
(Gozlan 2005) sont susceptibles de mettre en péril les espèces natives. L’ensemble de ces impacts aux échelles individuelles et populationelles peuvent modifier la structure des
communautés, le fonctionnement des écosystèmes (Vander Zanden et al. 1999 ; Simon &
Townsend 2003 ; Baxter et al. 2005 ; Eby et al. 2006), et avoir des conséquences évolutives (Strauss et al. 2006).
Bien que les espèces non natives (et invasives) de poissons d’eau douce soient bien identifiées (Welcomme 1988 ; Elvira, 2001), les facteurs déterminant leur distribution spatiale ainsi que leurs impacts sur la biodiversité sont encore très peu connus, en particulier à de larges échelles spatiales. Dans ce contexte, cette thèse vise : (i) à une meilleure compréhension de l’impact des espèces non natives de poissons d’eau douce sur les espèces natives ; et (ii) à identifier les facteurs qui contrôlent leur distribution spatiale ; ceci à différents niveaux de perception du processus d’introduction d’espèces et à différentes échelles spatiales.
1.2. Echelles spatiales et niveaux de perception du processus d’introduction
d’espèces
Un des grands défis de l'écologie des communautés est de comprendre les interactions entre les échelles d’observations des phénomènes naturels et les mécanismes écologiques (Levin 1992; O’Neill & King 1998; Willis & Whittaker 2001). Il est aujourd’hui largement reconnu que les mécanismes écologiques agissant à l’échelle locale sont dépendant
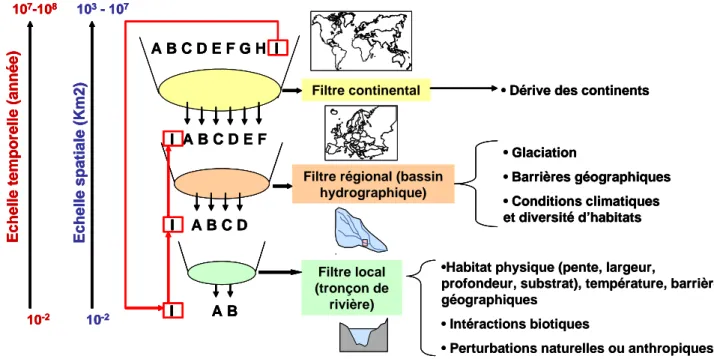
des mécanismes s’exerçant à des échelles spatiales supérieures (Ricklefs 1987; Levin 1992, Ricklefs & Schulter 1993; Huston 1999). Ceci a été conceptualisé en écologie des communautés par la notion de « filtres hiérarchiques » conditionnant la composition des assemblages d’espèces à différentes échelles spatiales (de l’échelle globale à l’échelle locale) (Simpson 1953; Smith & Powell 1971 ; Tonn 1990 ; Keddy 1992 ; Poff 1997). Ce cadre conceptuel trouve de nombreuses applications dans l’étude des assemblages de poissons d’eau douce à différentes échelles spatiales (p.ex. Jackson et al. 2001 ; Quist et al. 2005). Selon cette approche hiérarchique, chaque filtre serait associé à des processus agissant à des échelles spatio-temporelles différentes et les assemblages locaux seraient un sous ensemble des assemblages rencontrés aux échelles supérieures (Figure 1).
•Habitat physique (pente, largeur,
profondeur, substrat), température, barrières géographiques
• Intéractions biotiques
• Perturbations naturelles ou anthropiques
A B C D E F G H I
I A B C D E F
I A B C D
Filtre continental
Filtre régional (bassin hydrographique)
Filtre local (tronçon de
rivière)
• Dérive des continents
• Glaciation • Barrières géographiques • Conditions climatiques et diversité d’habitats I A B Ech e lle spati a le (Km2) Echell e tempo rell e (année) 10-2 10-2 103- 107 107-108
•Habitat physique (pente, largeur,
profondeur, substrat), température, barrières géographiques
• Intéractions biotiques
• Perturbations naturelles ou anthropiques
A B C D E F G H I
I A B C D E F
I A B C D
Filtre continental
Filtre régional (bassin hydrographique)
Filtre local (tronçon de
rivière)
• Dérive des continents
• Glaciation • Barrières géographiques • Conditions climatiques et diversité d’habitats I A B Ech e lle spati a le (Km2) Echell e tempo rell e (année) 10-2 10-2 103- 107 107-108 A B C D E F G H I I A B C D E F I A B C D Filtre continental
Filtre régional (bassin hydrographique)
Filtre local (tronçon de
rivière)
• Dérive des continents
• Glaciation • Barrières géographiques • Conditions climatiques et diversité d’habitats I A B Ech e lle spati a le (Km2) Echell e tempo rell e (année) 10-2 10-2 103- 107 107-108
Figure 1 : Cadre conceptuel des filtres hiérarchiques pour l’étude des assemblages de
poissons d’eau douce à différentes échelles spatiales et temporelles (d’après Smith & Powell 1991 ; Tonn et al. 1990 ; Poff 1997). Les flèches rouges correspondent au processus d’introduction d’une espèce (I) d’un continent vers un autre. Une fois que l’espèce I a réussi à s’établir localement, elle intègre le pool régional d’espèces ainsi que le pool continental.
Tout d’abord, le pool continental d’espèces (p.ex. en Europe) est un sous-ensemble du pool mondial d’espèces de poissons d’eau douce, sélectionné suite aux événements tectoniques (filtre biogéographique, Figure 1). Ensuite, le pool régional d’espèces (c.-à-d. l’ensemble des espèces d’un bassin hydrographique comme la Garonne) est un sous ensemble du pool continental d’espèces, dont la composition en espèces est déterminée par des événements historiques (glaciations, formation de barrières géographiques délimitant les bassins hydrographiques, transgressions et régressions marines, Figure 1). Ces événements ont conduit à des taux de spéciation, d’extinction et de colonisation différentiels entre bassins hydrographiques (voir Tedesco et al. 2006 ; Reyjol et al. 2006). A l’échelle régionale, les conditions environnementales (c.-à-d. le climat et la diversité d’habitats d’un bassin hydrographique) limitent également la répartition géographique des espèces (filtre abiotique régional). Enfin, une succession de filtres réduirait le pool régional d’espèces en un sous-ensemble d'espèces présentes à l’échelle locale (du micro-habitat au tronçon de rivière d’un réseau hydrographique, Figure 1). Un assemblage local est ainsi composé d’espèces (i) ayant eu la capacité de coloniser un habitat local (filtre géographique), (ii) qui sont physiologiquement adaptées aux conditions abiotiques locales (filtre abiotique) et (iii) dont les caractéristiques écologiques leur permettent de cohabiter entre elles (filtre biotique).
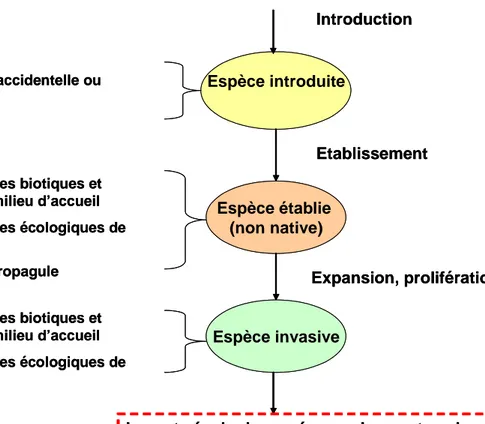
Dans le cadre du processus d’introductions d’espèces (Figures 1 et 2), l’homme tend à supprimer les filtres géographiques (Rahel 2007) en introduisant des espèces d’un continent vers un autre (espèce exotique) ou bien d’une région à une autre dans la même zone biogéographique (espèce transloquée). Ces introductions peuvent être accidentelles (p.ex. suite à la construction de canaux reliant deux bassins hydrographiques, Rahel 2002) ou bien intentionnelles (p.ex. les introductions espèces ornementales ou d’intérêt halieutique, Lever 1996). Après introduction, une espèce non-native s’établira dans le milieu d’accueil (espèce établie, Figure 2), si elle arrive à se reproduire avec succès et à se maintenir à long terme
(Richardson, 2000 ; Colautti & MacIsaac 2004 ; Lockwood et al. 2007). Le succès d’établissement d’une espèce dépend de plusieurs facteurs (Kolar & Lodge 2002 ; Moyle & Marchetti 2006 ; Lockwood et al. 2007) : (i) la pression de propagules (c.-à-d. le nombre d’individus introduits) ; (ii) les caractéristiques écologiques de l’espèce introduite (p.ex. la capacité de dispersion et la tolérance environnementale) ; (iii) les conditions abiotiques locales (p.ex. l’intensité et la fréquence des perturbations naturelles et anthropiques) et régionales (p.ex. les conditions climatiques) ; (iiii) les caractéristiques biotiques locales (p.ex. la présence ou non de prédateurs, l’intensité des interactions biotiques). Une espèce introduite qui réussit à s’établir avec succès à l’échelle locale, intègre alors le pool régional d’espèces, voire le pool continental si l’espèce introduite est originaire d’un autre continent (Figure 1). Espèce introduite Espèce établie (non native) Espèce invasive Etablissement Expansion, prolifération Introduction
Impacts écologiques, économiques et sociaux
• Caractéristiques biotiques et
abiotiques du milieu d’accueil
• Caractéristiques écologiques de
l’espèce
• Pression de propagule • Caractéristiques biotiques et
abiotiques du milieu d’accueil
• Caractéristiques écologiques de l’espèce • Introduction accidentelle ou intentionnelle Espèce introduite Espèce établie (non native) Espèce invasive Etablissement Expansion, prolifération Introduction
Impacts écologiques, économiques et sociaux
• Caractéristiques biotiques et
abiotiques du milieu d’accueil
• Caractéristiques écologiques de
l’espèce
• Pression de propagule • Caractéristiques biotiques et
abiotiques du milieu d’accueil
• Caractéristiques écologiques de
l’espèce
• Introduction accidentelle ou
intentionnelle
Figure 2 : Les différents niveaux de perception du processus d’introduction
d’espèces (introduction, établissement et prolifération) et les facteurs contrôlant le succès ou l’échec de chaque étape du processus d’invasion (d’après Williamson 1996 ; Richardson 2000 ; Lockwood et al. 2007).
Enfin, certaines espèces non natives peuvent dans certaines conditions environnementales (biotiques et abiotiques) devenir invasives (c.-à-d. proliférer et étendre leur aire de répartition ; Richardson 2000) et par conséquent avoir des conséquences négatives sur la biodiversité (Figure 2). D’après Williamson (1996), une espèce introduite sur dix réussirait à s’établir, et une espèce établie sur dix deviendrait invasive (« la règle des 10% »). Ceci impliquerait que peu d’espèces introduites deviennent invasives. Cependant, des études récentes (García-Berthou et al. 2005 ; Jeschke & Strayer 2005) ont montré que cette règle est loin d’être généralisable. Jeschke & Strayer (2005) ont en effet montré qu’en moyenne, 25% des vertébrés introduits en Amérique du Nord et en Europe (dont les poissons d’eau douce) devenaient invasifs.
En résumé, une espèce introduite ne peut s’établir (et devenir invasive) que si ses caractéristiques écologiques lui permettent de franchir les différents filtres biotiques et abiotiques du milieu d’accueil (Rahel 2002). Le cadre conceptuel des filtres hiérarchiques en écologie des communautés est donc tout à fait adapté à l’étude des introductions d’espèces. Dans le cadre de cette thèse, j’ai tenté d’identifier les filtres locaux (à l’échelle de la station et du tronçon de rivière) et régionaux (à l’échelle du bassin hydrographique), qui peuvent limiter la distribution spatiale des espèces non-natives de poissons d’eau douce. L’étude du processus dynamique des introductions d’espèces à plusieurs échelles spatiales peut également contribuer à une meilleure compréhension de ses effets sur la biodiversité et nous aider à identifier des stratégies de contrôle plus efficaces (Lodge et al. 1998 ; Mack et al. 2000; Pauchard & Shea al. 2006).
1-3. Organisation du mémoire
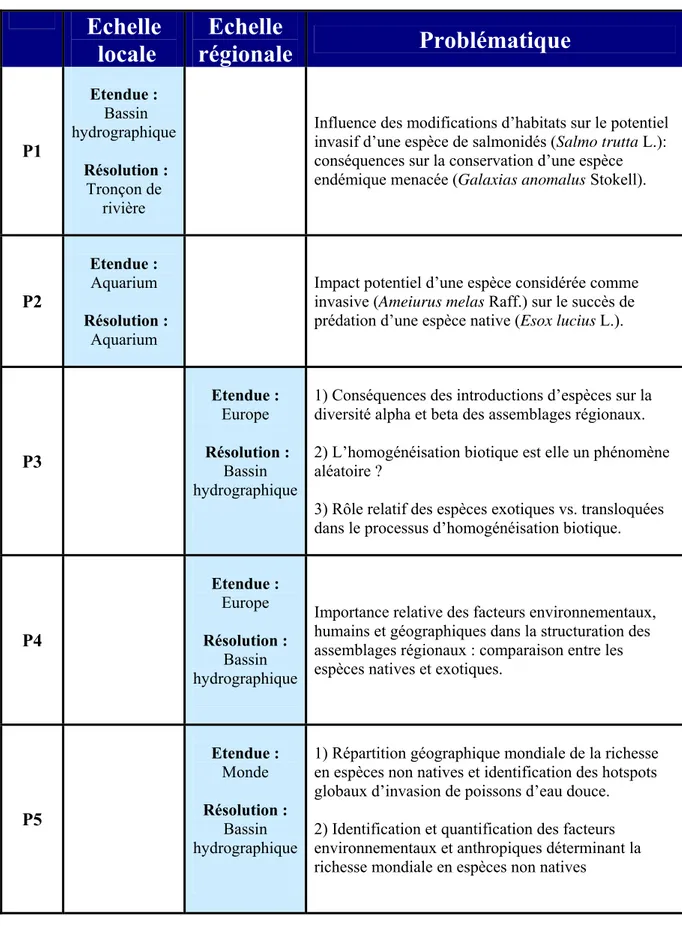
Cette thèse est composée de cinq publications dont les problématiques s’adressent aux échelles locales et régionales (Tableau 1). Une échelle spatiale en écologie fait référence à deux composantes : la résolution spatiale (ou unité spatiale) à laquelle les mesures ou expérimentations sont effectuées et l’étendue spatiale à laquelle une espèce, un assemblage ou un écosystème est étudié (Schneider 2001). Dans le cadre de cette thèse, l’échelle spatiale est synonyme de résolution spatiale.
A l’échelle locale (P1, P2), je me suis intéressé à deux espèces invasives de poissons
d’eau douce. J’ai d’abord exploré la distribution spatiale d’une espèce de salmonidés invasive (la truite commune Salmo trutta L.) au sein d’un bassin hydrographique de Nouvelle Zélande, et déterminé son impact sur une espèce endémique menacée (Galaxias anomalus Stokell) (P1). Je me suis plus particulièrement intéressé au rôle des modifications locales d’habitats (de type hydrologique) dans le processus d’invasion. En effet, les modifications d’habitats d’origine anthropique pourraient favoriser l’établissement des espèces introduites et leur prolifération (voir Moyle & Light 1996 ; Lockwood et al. 2007). J’ai ensuite tenté de mettre en évidence l’impact potentiel d’une espèce introduite, le poisson-chat (Ameiurus melas Raff.), sur une espèce native (Esox lucius L.), en utilisant une approche expérimentale en microcosmes (P2). Le poisson-chat est originaire d’Amérique du Nord et a été introduit avec succès en Europe à la fin du 19ème siècle. Bien que cette espèce invasive soit considérée comme nuisible en Europe (Lever 1996 ; Elvira 2001), aucune étude n’a jusqu’à présent démontré un impact négatif du poisson-chat sur les espèces européennes.
Tableau 1 : Problématiques et échelles spatiales abordées dans les différentes publications
constituant cette thèse.
Echelle
locale
régionale
Echelle
Problématique
P1 Etendue : Bassin hydrographique Résolution : Tronçon de rivière
Influence des modifications d’habitats sur le potentiel invasif d’une espèce de salmonidés (Salmo trutta L.): conséquences sur la conservation d’une espèce endémique menacée (Galaxias anomalusStokell).
P2
Etendue : Aquarium Résolution :
Aquarium
Impact potentiel d’une espèce considérée comme invasive (Ameiurus melas Raff.) sur le succès de prédation d’une espèce native (Esox lucius L.).
P3 Etendue : Europe Résolution : Bassin hydrographique
1) Conséquences des introductions d’espèces sur la diversité alpha et beta des assemblages régionaux. 2) L’homogénéisation biotique est elle un phénomène aléatoire ?
3) Rôle relatif des espèces exotiques vs. transloquées dans le processus d’homogénéisation biotique.
P4 Etendue : Europe Résolution : Bassin hydrographique
Importance relative des facteurs environnementaux, humains et géographiques dans la structuration des assemblages régionaux : comparaison entre les espèces natives et exotiques.
P5 Etendue : Monde Résolution : Bassin hydrographique
1) Répartition géographique mondiale de la richesse en espèces non natives et identification des hotspots globaux d’invasion de poissons d’eau douce. 2) Identification et quantification des facteurs environnementaux et anthropiques déterminant la richesse mondiale en espèces non natives
A l’échelle régionale (P3, P4, P5), je me suis intéressé à la richesse et à la
composition des assemblages régionaux d’espèces non natives (c.-à-d. le pool d’espèces non natives d’un bassin hydrographique, lesquelles peuvent potentiellement s’établir à l’échelle locale). J’ai d’abord évalué les conséquences des introductions d’espèces de poissons d’eau douce sur la richesse en espèces (diversité alpha) et la similarité taxonomique (diversité beta) des bassins hydrographiques européens (P3). En particulier, j’ai testé l’hypothèse que l’homogénéisation biotique (augmentation de la similarité en espèces entre deux localités suite à des introductions et des extinctions d’espèces, Olden & Poff 2003, 2004) était le résultat de processus non aléatoires (Duncan et al. 2001 ; Olden et al. 2004). J’ai ensuite étudié la structuration spatiale des assemblages régionaux d’espèces exotiques en Europe (c.-à-d. les espèces de poissons d’eau douce qui ne sont pas natives d’Europe) (P4). Le but in fine était d’identifier les facteurs régionaux contrôlant la distribution spatiale des espèces exotiques à large échelle spatiale. Ces résultats ont été comparés à ceux obtenus avec les espèces natives. J’ai enfin déterminé la répartition géographique de la richesse en espèces non natives de poissons d’eau douce à l’échelle mondiale (P5). Ce travail se base sur des informations récoltées sur 1055 bassins hydrographiques recouvrant 80% de la surface continentale. J’ai ainsi identifié les principaux hotspots globaux d’invasion de poissons d’eau douce, c'est-à-dire les bassins hydrographiques comportant une forte proportion d’espèces non natives. Ensuite, j’ai testé, pour la première fois à l’échelle mondiale, les hypothèses les plus couramment émises dans la littérature pour expliquer la répartition géographique de la richesse en espèces non natives (p.ex. Stohlgren et al. 1999 ; Taylor & Irwine 2004 ; Fridley et al. 2007). J’ai ainsi tenté de caractériser la susceptibilité d’un bassin hydrographique à accueillir un grand nombre d’espèces non natives.
En macroécologie, qui se définit comme l’étude statistique des patrons d’abondance, de distribution et de diversité des espèces à des échelles larges (Brown 1989), l'approche expérimentale n’est pas concevable, ce qui entraîne l’absence d’une situation témoin. Néanmoins, on peut remédier à ce problème à l'aide de deux types d’approche quantitative. La première est l’approche comparative que j’ai utilisé dans P1, P4 et P5. Elle implique l’utilisation de techniques d'analyse de données ou de statistiques traditionnelles pour identifier des structures ou tester des hypothèses à partir de la variabilité observée entre situations (Diamond 1983). La deuxième approche est celle des « modèles nuls » (Connor & Simberloff 1979 ; Gotelli & Graves 1996) que j’ai utilisé dans P3, en simulant des assemblages d’espèces attendues sous l’hypothèse nulle que le facteur testé n'intervient pas. Le but est de remplacer par des simulations de « Monte Carlo », le « témoin » d’une approche expérimentale irréalisable dans la majorité des cas en écologie des communautés et en biogéographie.
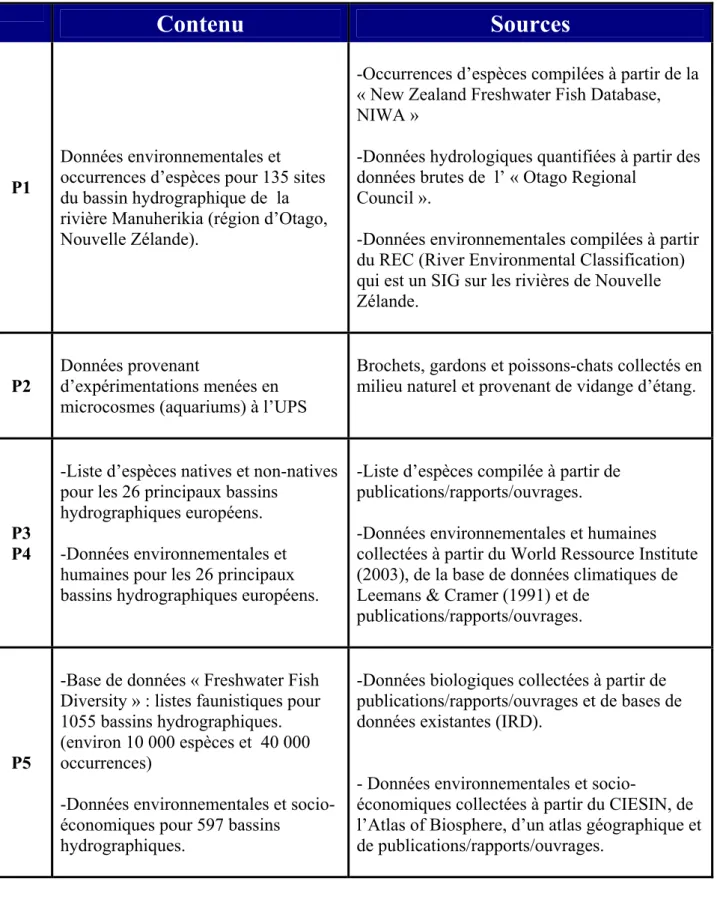
Ce mémoire présente une synthèse des résultats que j’ai obtenus grâce à de nombreuses collaborations :
Dans P1, P3 et P4, j’ai compilé les données biologiques et environnementales à partir
de nombreuses sources bibliographiques et de bases de données existantes (Tableau 2). En particulier, P1 présente les travaux que j’ai menés en Nouvelle Zélande, à l’université d’Otago, dans le groupe de recherche du Professeur Colin Townsend (Octobre 2004-Février 2005).
Dans P2, Karl Kreutzenberger (étudiant en DESUPS que j’ai encadré en co-direction
avec Sébastien Brosse) était responsable de la partie expérimentale de l’étude. J’ai participé à l’échantillonnage des individus (Tableau 2), à la mise en place du plan expérimental, à l’analyse des données et à la rédaction de la publication.
La base de données que j’ai explorée dans P5 (Tableau 2), à été initiée au début de cette thèse par l’équipe « structure des communautés & macroécologie » de l’UMR 5174 « Evolution et Diversité Biologique » (EDB, université Paul Sabatier, Toulouse). L’exploitation de cette base de données fait actuellement l’objet d’une collaboration entre l’UMR EDB (Toulouse), l’IRD (Paris) et le CEMAGREF (Aix-en-Provence) dans le cadre d’un projet de recherche financé par l’Agence Nationale pour la Recherche (ANR biodiversité (2007-2010) « Freshwater Fish Diversity », ANR-06-BDIV-010). Une grande partie des données a été récoltée par Olivier Beauchard (ancien membre de l’équipe « structure des communautés & macroécologie » et actuellement étudiant en thèse à l’université d’Anvers en Belgique). Ces données proviennent d’une recherche bibliographique intensive (publications, rapports et documents internet, atlas de poissons d’eau douce nationaux). L’Institut de Recherche pour le Développement (IRD) a fourni les listes faunistiques des bassins hydrographiques d’Afrique de l’Ouest et d’Amérique Central et du Sud. J’ai également participé durant ces 3 années de thèse à la récolte des données. J’ai en particulier été responsable de vérifier les statuts des espèces (espèces natives vs. non-natives) des 1055 bassins hydrographiques.
Tableau 2 : Données utilisées dans chaque publication.
Contenu
Sources
P1
Données environnementales et occurrences d’espèces pour 135 sites du bassin hydrographique de la rivière Manuherikia (région d’Otago, Nouvelle Zélande).
-Occurrences d’espèces compilées à partir de la « New Zealand Freshwater Fish Database, NIWA »
-Données hydrologiques quantifiées à partir des données brutes de l’ « Otago Regional
Council ».
-Données environnementales compilées à partir du REC (River Environmental Classification) qui est un SIG sur les rivières de Nouvelle Zélande.
P2
Données provenant
d’expérimentations menées en microcosmes (aquariums) à l’UPS
Brochets, gardons et poissons-chats collectés en milieu naturel et provenant de vidange d’étang.
P3 P4
-Liste d’espèces natives et non-natives pour les 26 principaux bassins
hydrographiques européens. -Données environnementales et humaines pour les 26 principaux bassins hydrographiques européens.
-Liste d’espèces compilée à partir de publications/rapports/ouvrages.
-Données environnementales et humaines collectées à partir du World Ressource Institute (2003), de la base de données climatiques de Leemans & Cramer (1991) et de
publications/rapports/ouvrages.
P5
-Base de données « Freshwater Fish Diversity » : listes faunistiques pour 1055 bassins hydrographiques. (environ 10 000 espèces et 40 000 occurrences)
-Données environnementales et socio-économiques pour 597 bassins hydrographiques.
-Données biologiques collectées à partir de publications/rapports/ouvrages et de bases de données existantes (IRD).
- Données environnementales et
socio-économiques collectées à partir du CIESIN, de l’Atlas of Biosphere, d’un atlas géographique et de publications/rapports/ouvrages.
1. Les introductions d’espèces à l’échelle locale
Cette thématique à fait l’objet de deux publications :P1 Leprieur F., Hickey M.A., Arbuckle C.J., Closs G.P., Brosse, S. & Townsend C.R.
(2006) Hydrological disturbance benefits a native fish at the expense of an exotic fish. Journal of Applied Ecology, 43, 930-939.
P2 Kreutzenberger K., Leprieur F., & Brosse, S. Impact of the invasive black bullhead
(Ameiurus melas Raff.) on the predatory efficiency of northern pike (Esox lucius L.)
Journal of Fish Biology (en révision)
2.1. Le cas de la truite commune (Salmo trutta L.) introduite en Nouvelle
Zélande (P1)
Dès lors qu’une espèce introduite s’établit avec succès dans un milieu d’accueil (espèce non native), son aire géographique peut considérablement augmenter si elle devient invasive (Lockwood et al. 2007). Néanmoins, plusieurs mécanismes peuvent limiter la prolifération d’une espèce invasive : (i) la présence de prédateurs et de compétiteurs (hypothèse de résistance biotique : Elton 1958 ; Levine 2000 ; Kennedy et al. 2002) et (ii) des conditions abiotiques défavorables pour l’espèce invasive (hypothèse de résistance
abiotique : Elton 1958 ; Simberloff 1986,1989 ; Moyle & Light 1996). Ainsi, l’impact des
espèces invasives sur les espèces natives peut varier localement (c'est-à-dire d’un site à un autre) au sein de son aire d’introduction (Palmer & Ricciardi 2004).
En Nouvelle Zélande, la truite commune (Salmo trutta L.) a été introduite avec succès en 1867 pour la pêche sportive (Townsend 1996). Aujourd’hui, la truite a colonisé l’ensemble des bassins hydrographiques de Nouvelle Zélande (Figure 3). Le succès de son établissement et de sa prolifération peut s’expliquer par trois principaux facteurs (Townsend 1996): (i) une très forte pression de propagules par les sociétés de pêche de Nouvelle Zélande (la pêche sportive est l’une des principales ressources financières en Nouvelle Zélande) ; (ii) des conditions abiotiques similaires à celles trouvées dans l’aire native de la truite (Europe); (iii)
une très faible résistance biotique. En effet, les rivières de Nouvelle Zélande sont pauvres en espèces de poissons d’eau douce (comme la plupart des rivières des milieux insulaires). De plus, les poissons d’eau douce de Nouvelle Zélande ont évolué sans prédateurs naturels, jusqu’à l’introduction de la truite qui est une espèce piscivore et territoriale, dont le comportement agressif est largement reconnu.
A
B
A
B
Figure 3 : A) Distribution spatiale de la truite commune (Salmo trutta L.) en Nouvelle
Zélande (en rouge foncé) ; B) Distribution spatiale de Galaxias anomalus (Stockell) en Nouvelle Zélande (en rouge foncé). Cette espèce est endémique des rivières Taieri et Clutha (dont l’un des principaux affluents est la rivière Manuherikia).
L’introduction de la truite en Nouvelle Zélande a eu des conséquences négatives sur les différents niveaux d’organisation écologiques des écosystèmes aquatiques (Townsend 2003). Cette espèce est en particulier responsable du déclin des populations non-migratrices de galaxidae du genre Galaxias (McDowall 2006). La prédation et la compétition interspécifique sont les principaux mécanismes responsables de ce déclin (Townsend & Crowl 1991 ; Townsend 2003). Aujourd’hui, la plupart des espèces non-migratrices de galaxidae de Nouvelle Zélande sont au bord de l’extinction (McDowall 2006).
L’impact de la truite sur les populations de Galaxias en Nouvelle Zélande est connu depuis l’étude menée par Townsend & Crowl (1991) sur le bassin hydrographique de la rivière Taieri (région d’Otago, île du sud). Ces auteurs ont montré que les populations de
Galaxias sont fragmentées à l’échelle du bassin. En effet, la distribution des Galaxias est
réduite à l’amont de cascades naturelles (hautes de plus de 3 m), c'est-à-dire aux zones non accessibles par les truites. En aval des cascades, la truite a provoqué la disparition totale des
Galaxias. La très forte pression de prédation exercée par la truite sur les Galaxias explique
que ces espèces n’occurrent pratiquement jamais ensemble (distribution spatiale disjointe) dans le bassin de la rivière Taieri (Townsend 2003).
De manière à tester si les résultats obtenus par Townsend & Crowl (1991) étaient transposable à un bassin hydrographique comportant très peu de cascades naturelles, nous
avons analysé la distribution spatiale de la truite et d’une espèce endémique de galaxidae (Galaxias anomalus Stockell) au sein du bassin de la rivière Manuherikia (rivière voisine de la rivière Taieri). De plus, contrairement à la rivière Taieri, la rivière
Manuherikia fait l’objet de nombreux prélèvements d’eau pour l’irrigation. Ces prélèvements d’eau destinés à l’irrigation des cultures tendent à aggraver les sécheresses naturelles des rivières de la région d’Otago. Ainsi, certains tronçons de rivière présentent des étiages très sévères durant une grande partie de l’année. Seules des mouilles (parties profondes des rivières avec un courant lent, aussi appelées vasques ou pools) persistent, mais présentent des conditions abiotiques extrêmes en période d’étiage. Des températures de l’eau supérieures à 28°C ont été reportées, ainsi que des taux d’oxygène dissous très faibles.
Dans ce contexte, nous avons voulu déterminer les conséquences de ces perturbations hydrologiques sur la distribution spatiale de la truite et de G. anomalus au sein du bassin de la rivière Manuherikia. En effet, d’après de nombreuses études (Moyle
d’habitats d’origine anthropique entraineraient le déclin des populations natives et favoriseraient l’établissement et la prolifération d’espèces non-natives. Ces dernières seraient de part leur forte tolérance environnementale mieux adaptées aux nouvelles conditions abiotiques crées par les perturbations anthropiques (Stromberg et al. 2007 ; Lockwood et al. 2007).
Pour analyser la distribution spatiale de la truite et de G. anomalus, nous avons compilé des données d’occurrence de ces espèces dans 135 sites distribués dans l’ensemble du bassin de la rivière Manuherikia. Pour chaque site, nous avons collecté des données relatives à différents descripteurs environnementaux (à l’échelle du site et du tronçon de rivière). Par exemple, nous avons quantifié, pour chaque site, le risque d’étiage du aux prélèvements d’eau pour l’irrigation en amont de chaque site (c.-à-d. le risque que la rivière ait un débit très faible voir quasiment nul). Nous avons d’abord cherché à déterminer si les sites comportant des truites et G. anomalus en sympatrie et en allopatrie étaient différents d’un point de vue de leurs caractéristiques environnementales. Ensuite, nous avons cherché à prédire l‘occurrence de la truite et de G. anomalus dans les 135 sites. Enfin, la quantification de la contribution de chaque variable environnementale dans le modèle prédictif de type réseau de neurones artificiels (ANN) a permis d’identifier les variables responsables de la distribution spatiale de la truite et de G. anomalus dans la rivière Manuherikia.
D’abord, nous montrons que la truite et G. anomalus ont une distribution disjointe, confirmant ainsi les études menées sur d’autres rivières de Nouvelle Zélande (dont la rivière Taieri), d’Australie et de Tasmanie (Crowl & Townsend 1992; McIntosh 2000 ; McDowall 2006). Dans le bassin de la Manuherikia, 75% des sites étudiés sont habités uniquement par la truite, confirmant ainsi son caractère invasif. De plus, l’absence de G. anomalus dans ces sites a conforté l’idée que la truite est le principal responsable du déclin des populations de G.
Ensuite, les sites où la truite est absente (15%) sont ceux où l’on observe uniquement
G. anomalus. Ces sites sont caractérisés par un risque d’étiage maximal. De plus, les faciès
d’écoulement de l’eau (radier, plat, rapide), caractéristiques des milieux lotiques, sont très peu représentés dans ces sites, qui sont composés essentiellement de mouilles (signe d’un étiage sévère). Ainsi, il semblerait que les conditions environnementales crées par les étiages
(aggravés dans l’espace et dans le temps par les prélèvements d’eau) aient à la fois limité l’invasion de la truite et protégé les populations de G. anomalus. En effet, les espèces non
migratrices du genre Galaxias sont capables de s’enfouir dans le substrat lors de conditions de très faibles débits (Dunn 2003 ; Davey et al. 2006). Ces poissons sont également capables de supporter les températures élevées rencontrées dans les mouilles durant les périodes d’étiage (voir par exemple Closs & Lake 1996). Au contraire, il est largement reconnu que la truite (espèce d’eau froide) ne supporte pas les températures d’eau élevées (et en règle générale les conditions environnementales crées par les étiages, Matthews & Berg 1997). En réponse à ces perturbations, la truite a tendance à migrer vers des zones non impactées ayant des eaux plus fraîches et plus oxygénées (Gowan & Fausch 1996).
Ces résultats ont deux implications principales, l’une fondamentale et l’autre en relation avec la conservation de G. anomalus :
Les perturbations hydrologiques d’origine anthropique (c.-à-d. des étiages aggravés par les prélèvements d’eau pour l’irrigation) limitent la prolifération de la truite et permettent aux populations de G. anomalus de se maintenir (Figure 4). Ce résultat va à l’encontre de beaucoup d’études montrant l’influence positive des perturbations anthropiques sur le succès d’invasion (voir Lockwood et al. 2007 pour une synthèse). En fait, une
perturbation, qu’elle soit naturelle ou anthropique, peut favoriser une espèce invasive (ou native) si les nouvelles conditions environnementales (filtre abiotique) sont en adéquation avec les caractéristiques écologiques et l’histoire évolutive de
l’espèce considérée (Townsend 2003). Dans le cas présent, les espèces non migratrices
du genre Galaxias sont adaptées aux conditions climatiques de la région d’Otago (tolérance aux fortes températures, capacité à s’enfouir dans le substrat et de survivre dans des mouilles résiduelles en cas d’assèchement temporaire du cours d’eau). Au contraire, la truite est incapable de faire face à de telles conditions environnementales. Lors des périodes d’étiages sévères, le maintien de la truite dans le bassin de la rivière Manuherikia est probablement du à sa forte capacité de dispersion, qui lui permet de migrer dans des zones plus stables d’un point de vue hydrologique. Récemment, le mécanisme de résistance environnementale à l’invasion de la truite a également été reporté dans des rivières de la côté ouest de l’île du sud de Nouvelle Zélande (Olsson et al. 2006). Dans cette étude, il est montré que l’acidité naturelle de certaines rivières empêche l’invasion de la truite et permet ainsi à des populations de Galaxias de persister.
Ce travail a confirmé le mécanisme initialement détecté sur la rivière Taieri (Townsend & Crowl 1991), c'est-à-dire un contrôle biotique et abiotique de la distribution spatiale
des espèces non-migratrices de galaxidae dans la région d’Otago. La truite aurait
limité tout d’abord la distribution des Galaxias (contrôle biotique : prédation et compétition) et les facteurs abiotiques de certains sites auraient permis ensuite aux
Galaxias d’y survivre en empêchant la colonisation de la truite (c.-à-d. les cascades de
plus de 3 m pour la rivière Taieri et les sites impactés par les prélèvements d’eau pour la rivière Manuherikia). Ainsi, au regard de la conservation de G. anomalus (qui est l’une des espèces non-migratrices de galaxidae les plus menacées d’extinction en Nouvelle Zélande), nous avons préconisé (i) la mise en place de cascades artificielles
supérieures à 3 mètres dans certaines rivières tests et (iii) l’éradication de la truite en amont de ces cascades. Nous avons également préconisé une gestion contrôlée de la
zones refuge pour G. anomalus, leurs conditions abiotiques peuvent avoir des effets négatifs à long terme sur la reproduction des Galaxias (Allibone 2000). Au vu de nos résultats, il est très important que la restauration des débits ne soit pas conduite avant la création de cascades permettant aux Galaxias de maintenir une population viable en amont. En effet, un retour à la normale des débits entrainerait la disparition des sites refuges pour G. anomalus. La colonisation de ces sites par la truite mettrait alors en péril les dernières populations de G. anomalus en Nouvelle Zélande.
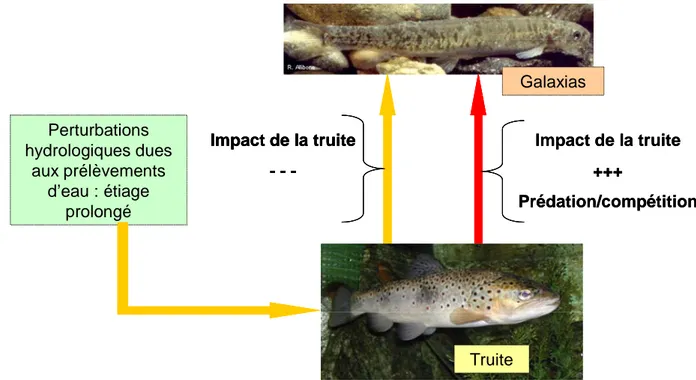
Figure 4 : Schéma synthétique montrant l’impact négatif de la truite sur les Galaxias dans des
sites non impactés par les prélèvements d’eau (flèche rouge). Au contraire, dans les sites impactés par les prélèvements d’eau (flèche orange), la truite ne peut pas survivre et donc n’interagit pas avec les Galaxias.
Impact de la truite +++ Prédation/compétition Truite Galaxias Perturbations hydrologiques dues aux prélèvements d’eau : étiage prolongé Impact de la truite -Impact de la truite +++ Prédation/compétition Truite Galaxias Perturbations hydrologiques dues aux prélèvements d’eau : étiage prolongé Impact de la truite -Truite Galaxias Perturbations hydrologiques dues aux prélèvements d’eau : étiage prolongé Impact de la truite
-2.2. Le cas du poisson-chat (Ameiurus melas Raff.) introduit en
Europe (P2)
Bien que les espèces invasives de poissons d’eau douce soient bien identifiées à travers le monde (Welcomme 1988 ; Lever 1996 ; Elvira 2001), beaucoup d’entre elles n’ont jamais fait l’objet d’études quant à leur impact sur la biodiversité native. Pourtant, la connaissance de l’impact réel d’une espèce invasive est un pré-requis indispensable pour la gestion de ces espèces ainsi que pour la mise en place de mesures de conservation des espèces impactées (Lodge et al. 1998).
Le poisson-chat (Ameiurus melas Raff.) est originaire d’Amérique du Nord et a été introduit en Europe (et plus particulièrement en France) à la fin du 19ième siècle. Cette espèce a ensuite rapidement colonisé une grande partie des bassins hydrographiques européens, de la péninsule ibérique jusqu’au sud du Danemark (Elvira 2001). Bien que le poisson-chat soit considéré comme nuisible et invasif (Elvira 2001; Keith & Allardi 2001 ; Cucherousset et al. 2006), aucune étude n’a jusqu’à présent mis en évidence l’impact du poisson-chat sur les espèces natives européennes.
Nous avons ici tenté de quantifier l’impact du poisson-chat sur le brochet (Esox lucius L.) une espèce prédatrice européenne, considérée comme vulnérable (Keith & Allardi 2001). Nous avons en particulier mis en place une approche expérimentale permettant de quantifier l’impact du poisson chat sur l’efficacité de prédation du brochet (P2). Le poisson-chat et le brochet cohabitent dans différents types de milieux
aquatiques : réservoirs, étangs, marais, partie basse des rivières et fleuves (Cucherousset et al. 2006), et le poisson chat est susceptible d’affecter la prédation du brochet car son régime alimentaire comprend une proportion non négligeable de poissons (Boët 1980). De plus, de part sa forte densité dans les milieux qu’il envahit (Cucherousset et al. 2006), le poisson-chat peut perturber le comportement de prédation du brochet et/ou le comportement anti-prédateur des proies. Enfin, le poisson-chat peut générer une importante turbidité de l’eau (Braig &
Johnson 2003), susceptible d’affecter l’efficacité de prédation du brochet qui est un prédateur visuel. Nous avons donc ici testé (i) un effet direct du poisson-chat sur l’efficacité de prédation du brochet (par compétition pour la ressource trophique et/ou par interférences comportementales avec la proie et/ou le prédateur), et (ii) un effet de la turbidité générée par le poisson-chat sur l’efficacité de prédation du brochet.
Nous avons donc utilisé un protocole expérimental de type « multi-prédateur » (Tableau 3), qui consiste à comparer la prédation de chaque espèce séparément à la prédation générée par les deux espèces (brochet + poisson-chat) (Griffen 2006). Les expérimentations ont été conduites dans des aquariums de 200 litres à deux niveaux de turbidité (eau turbide (TW) et eau non turbide (CW). En fin d’expérience (après 72 h) le nombre de poissons restants ainsi que le nombre de poissons ingérés par chaque prédateur a été compté.
Tableau 3 : protocole expérimental. Chaque traitement a été répliqué 8 fois. Entre 2 répliques,
les poissons et l’eau des aquariums ont été renouvelés de manière à éviter des biais potentiels du à des substances chimiques émises par les poissons ou à une pseudoreplication.
Nombre de poissons introduits Bac expérimental TW1 CW1 1 -TW2 TW3 CW2 CW3
Brochet Poisson-chat Gardon
3 10 10 10 10 10 3 -10 1 1 -- 3 1 3
TW, eau turbide ; CW, eau non turbide Turbidité moyenne (NTU) 70.1±2.5 72.5±2.5 73.2±3.0 1.5±0.3 1.5±0.3 1.6±0.3
Nombre de poissons introduits Bac expérimental TW1 CW1 1 -TW2 TW3 CW2 CW3
Brochet Poisson-chat Gardon
3 10 10 10 10 10 3 -10 1 1 -- 3 1 3
TW, eau turbide ; CW, eau non turbide Turbidité moyenne (NTU) 70.1±2.5 72.5±2.5 73.2±3.0 1.5±0.3 1.5±0.3 1.6±0.3
Les résultats montrent qu’une turbidité élevée (70 NTU) n’influence pas l’efficacité de prédation du brochet, ce qui est inattendu étant donné l’abondance des études montrant un effet négatif de la turbidité sur l’efficacité de prédation des prédateurs visuels (p.ex. Reid et al. 1999 ; Pekcan-Hekim & Lappalainen 2006). Ceci peut s’expliquer par le fait que la turbidité peut également influencer le comportement de la proie (en particulier son comportement anti-prédateur). En effet, une proie peut moins bien discerner un prédateur en milieu turbide et ainsi être plus vulnérable à la prédation (Gregory 1993), annulant donc l’impact négatif de la turbidité sur le prédateur.
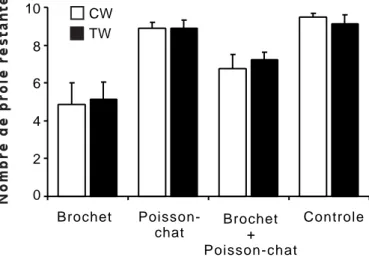
Indépendamment du niveau de turbidité, nos résultats révèlent une diminution significative du nombre de proies ingérées par le brochet en présence du poisson-chat (Figure 5). Ceci semble dû à une forte interférence comportementale entre le brochet et les poissons-chats, puisque ceux-ci ont eu un comportement agressif envers le brochet (traitement CW3, poisson-chat et brochet en sympatrie). Ces agressions ont sûrement affecté le bon déroulement des séquences comportementales de prédation du brochet (Eklöv & Diehl 1994), entraînant ainsi une diminution significative de l’efficacité de sa prédation.
Brochet Poisson-chat Brochet + Poisson-chat Controle 0 2 4 6 8 10 CW TW
Figure 5: Nombre de proies restantes (± SE, n = 8) dans chaque traitement : eau non turbide
(CW) et eau turbide (TW). Le contrôle correspond à un traitement où il y 10 gardons et aucun prédateur.
Ces résultats obtenus en milieu expérimental montrent pour la première fois que le poisson-chat peut avoir un effet négatif sur une espèce native européenne. En effet, la diminution de l’efficacité de prédation du brochet peut entraîner une diminution de sa croissance ou/et affecter la survie individuelle. Elle peut également influencer la sélection des proies disponibles, et par conséquent modifier la structure locale de la communauté (Eklöv & Hamrin 1989). Cependant, la variabilité environnementale (disponibilité des ressources, structures de l’habitat, …) étant difficile à reproduire en laboratoire, nos résultats doivent être confirmés en milieu naturel ou semi-naturel.
2.3. Conclusion et perspectives
Les résultats obtenus dans P1 et P2 à l’échelle locale ont permis de mettre évidence que : L’impact d’une espèce invasive sur une espèce native peut varier spatialement en fonction des caractéristiques abiotiques locales (P1)
Les perturbations anthropiques telles que la modification des habitats ne favorisent pas forcément les espèces invasives (P1)
La conservation d’une espèce native menacée nécessite des mesures de gestion adaptées au contexte environnemental local (P1)
Une espèce considérée à priori comme invasive et nuisible doit faire l’objet d’études quant à son impact réel sur les espèces natives ; ceci afin de mettre en place des mesures de gestion adaptées aux caractéristiques comportementales et écologiques de l’espèce impactée. (P2)
Les perspectives associées à P1 et P2 sont nombreuses :
Il serait intéressant de comparer le taux de croissance et de survie (« fitness ») de populations de G. anomalus dans des sites non perturbés d’un point de vue
hydrologique et non colonisés par la truite (sites situés en amont de cascades) à ceux observés dans les sites impactés d’un point de vue hydrologique. En effet, bien que les sites impactés par les prélèvements d’eau servent de zone refuge pour G. anomalus, les conditions hydrologiques rencontrées dans ces sites sont susceptibles de perturber à long terme la dynamique des populations de Galaxias en termes de succès reproducteur, croissance et survie individuelle (Allibone 2000). Il serait également utile de comparer la diversité génétique (p.ex. le niveau de consanguinité) des populations de G. anomalus occupant des milieux impactés ou non impactés par les prélèvements d’eau. Ceci permettrait d’évaluer si les conditions abiotiques provoquées par les prélèvements d’eau accentuent le risque à long terme d’extinction des populations de G. anomalus.
Il est prévu d’étendre l’étude menée sur le bassin hydrographique de la rivière Manuherikia à l’ensemble des bassins de la région d’Otago qui sont également impactées par des prélèvements d’eau et qui comportent pour certains des cascades naturelles (projet en cours avec Chris Arbuckle « Southland Regional Council » et Colin Townsend « University of Otago, Dunedin »). Ceci permettrait de cartographier les zones refuges pour les populations de différentes espèces de Galaxias et ainsi d’identifier les zones prioritaires de conservation.
Enfin, il est nécessaire de mettre en place des études en milieux semi-naturels, tels que des enclos expérimentaux installés dans des étangs, afin de vérifier et d’étendre les résultats obtenus en laboratoire sur l’impact du poisson chat (P2). Ce type d’expérimentations permettrait de tester différentes conditions environnementales afin d’obtenir des résultats directement transposables au milieu naturel (voir Lodge et al. 1998 ; White & Harvey 2001). Par exemple, il serait utile de manipuler la densité des proies et prédateurs natifs (gardon et brochet) ainsi que la densité de l’espèce invasive
(le poisson-chat). De plus, le poisson chat colonisant des milieux fréquemment affectés par des perturbations physiques, la prise en compte des modifications d’habitats dans les expérimentations semble nécessaire (cf. P1) à la prédiction de l’impact réel du poisson chat sur les assemblages de poissons Européens.
3. Les introductions d’espèces à l’échelle régionale
Cette thématique à fait l’objet de trois publications :P3 Leprieur F., Beauchard O., Hugueny B., Grenouillet G. & Brosse S. (2007) Null
model of biotic homogenization: a test with the European freshwater fish fauna.
Diversity and Distributions (sous presse).
P4 Leprieur F., Olden, J.D. Lek, S. & Brosse S. Patterns and mechanisms of the
distance decay of similarity in the European freshwater fish fauna: contrasting native and exotic species. (en préparation).
P5 Leprieur F., Beauchard O., Blanchet S., Oberdorff T. & Brosse S. Fish invasions in
the world’s river systems: when natural processes are blurred by human activities. (en révision dans PLoS Biology)
Les publications P3, P4 et P5 portent sur les introductions d’espèces de poissons d’eau douce à l’échelle régionale, c’est à dire à l’échelle du basin hydrographique (unité spatiale). L’ensemble des espèces de poissons d’eau douce d’un bassin hydrographique constitue un pool régional d’espèces distinct de celui des autres bassins. En effet, les zones terrestres et les océans constituent des barrières géographiques infranchissables pour les poissons d’eau douce, et chaque bassin hydrographique peut par conséquent être considéré comme une île biogéographique (Hugueny 1989 ; Oberdorff 1995 ; Reyjol et al. 2006). En replaçant l’étude des introductions d’espèces dans le cadre de la théorie de la biogéographique insulaire (McArthur & Wilson 1967 ; Whittaker & Palacios 2007), il est alors possible d’évaluer leur impact sur la richesse et la composition du pool régional d’espèces (P3). De plus, l’identification des déterminants de la composition (P4) et de la richesse (P5) en espèces non natives à l’échelle régionale semble être un pré-requis indispensable à une meilleure
prédiction des assemblages d’espèces non natives à l’échelle locale. En effet, il est aujourd’hui largement reconnu que la richesse et la composition des espèces à l’échelle locale sont fortement dépendantes des facteurs agissant à l’échelle régionale (Ricklefs 1987 Hugueny & Paugy 1995 ; Angermeir & Winston 1998).
3.1 . Processus d’homogénéisation biotique des assemblages régionaux : le cas
des poissons d’eau douce européens (P3)
Ces dernières années, de nombreuses études se sont intéressées à l’impact des introductions d'espèces sur la diversité alpha (richesse en espèces) et beta (différence de composition d’espèces entre localités) (voir la revue de Sax & Gaines 2003). En effet, certaines régions faunistiques ou floristiques sont devenues de plus en plus similaires d’un point de vue taxonomique (diminution de la diversité beta) suite à des introductions et/ou des extinctions d’espèces, un processus appelé « homogénéisation biotique » (Rahel 2002 ; Olden & Poff 2002; Qian & Ricklefs 2006 ; Cassey et al. 2007).
Dans P3, un modèle nul d’homogénéisation biotique a été développé et appliqué aux assemblages régionaux de poissons d’eau douce européens. En utilisant un modèle nul, nous avons voulu tester si l’homogénéisation biotique est un phénomène non aléatoire (c'est-à-dire le résultat d’une distribution géographique non aléatoire des espèces non natives, Duncan et al. 2001 ; Olden et al. 2004). Ce modèle nul consiste à simuler un grand nombre de fois une distribution aléatoire des espèces non natives entre les principaux bassins hydrographiques européens (Figure 6), puis à calculer les changements de similarité taxonomique entre bassins causés par les introductions d’espèces exotiques. Les résultats observés en milieu naturel sont ensuite comparés aux résultats obtenus avec le modèle nul (10 000 simulations).
Nous avons ensuite détaillé cette approche en considérant séparément les espèces exotiques (espèces non natives d’origine non européenne) et les espèces transloquées (espèces
non natives d’origine européenne). Nous avons testé l’hypothèse que contrairement aux espèces exotiques, les espèces transloquées tendent à augmenter la similarité taxonomique entre localités (McKinney 2005 ; La Sorte & McKinney 2006).
B
1000 Km ND
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25A
[ -6 ; -4 [ [ -4 ; -2 [ [ -2 ; 0 [ [ 0 ; 2 [ [ 2 ; 4 [ [ 4 ; 6 [ [ 6 ; 8 [ [ 8 ; 10 [ [ 10 ; 13 [C
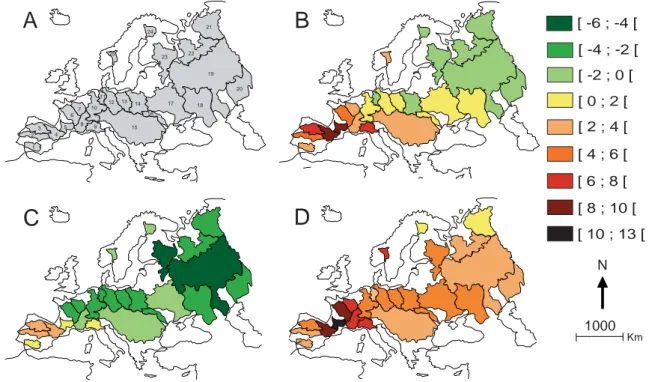
Figure 6: Distribution géographique du taux d’homogénéisation/différentiation par bassin hydrographique (Basin ΔCS %) (a) Carte des 25 principaux basins hydrographiques
européens ; 1: Guadalquivir; 2: Tagus; 3: Douro; 4: Ebro; 5: Garonne; 6: Loire; 7: Seine; 8: Rhône; 9: Pô; 10: Rhine; 11: Weser; 12: Elbe; 13: Oder; 14: Wisla; 15: Danube; 16: Dniestr; 17: Dniepr; 18: Don; 19: Volga; 20: Ural; 21: Petchora; 22: Dniva; 23: Neva; 24: Kemijoki; 25: Glomma). (b) Basin ΔCS (%) calculé en prenant en compte à la fois les espèces exotiques et transloquées. (c) Basin ΔCS (%) calculé en prenant en compte que les espèces exotiques. (d) Basin ΔCS (%) calculé en prenant en compte que les espèces transloquées. Le dégradé de vert indique une différentiation taxonomique et le dégradé de rouge indique une homogénéisation taxonomique.
Dans P3, nous montrons que :
L’homogénéisation biotique n’est pas un phénomène écologique induit par des processus aléatoires, confirmant ainsi pour la première fois les hypothèses émises dans de nombreuses études. Ceci peut s’expliquer par de nombreux facteurs tels