© Iris Dussault-Chouinard, 2019
Amélioration des performances fromagères des
concentrés laitiers d'osmose inverse : phase de
coagulation par la présure
Mémoire
Iris Dussault-Chouinard
Maîtrise en sciences des aliments - avec mémoire
Maître ès sciences (M. Sc.)
Amélioration des performances fromagères des
concentrés laitiers d’osmose inverse : phase de
coagulation par la présure
Mémoire
Iris Dussault-Chouinard
Sous la direction de :
Yves Pouliot, directeur de recherche
Michel Britten, codirecteur de recherche
iii
Résumé
La pré-concentration du lait par osmose inverse (OI) avant la fabrication fromagère présente plusieurs avantages en termes d’éco-efficience, dont l’obtention d’un perméat à faible charge polluante réutilisable comme eau de procédé et la réduction des coûts et gaz à effet de serre (GES) liés au transport du lait. Les fortes teneurs en lactose et minéraux des concentrés OI diminuent toutefois leur aptitude à la transformation fromagère, ce qui nécessite une correction des propriétés physicochimiques avant la coagulation.
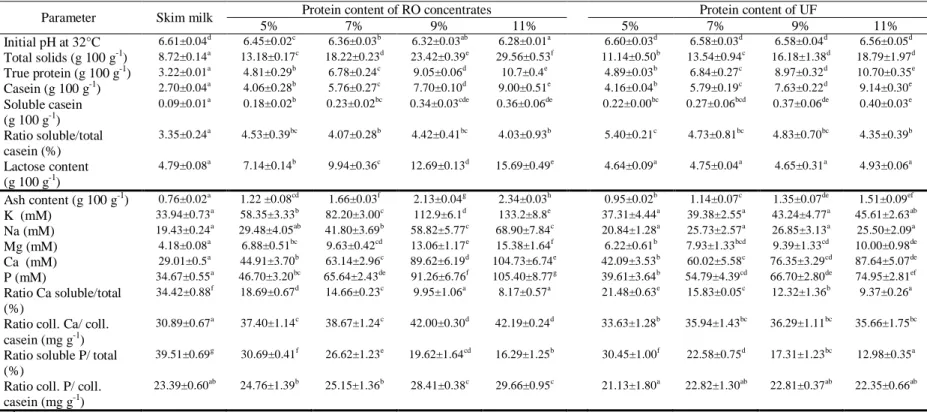
L’objectif du projet était d’optimiser l’utilisation des concentrés d’OI à différentes concentrations (5% à 11% de protéines) par l’ajustement du pH d’emprésurage. La cinétique de coagulation par la présure, la répartition des protéines et minéraux entre les phases soluble et colloïdale et la fabrication fromagère ont été étudiées sur des concentrés OI en comparaison à des concentrés d’ultrafiltration (UF).
Les résultats ont montré qu’une augmentation de la concentration par OI induisait un ralentissement du mécanisme de coagulation, caractérisé par l’augmentation du temps de coagulation et de la vitesse de raffermissement du gel, laquelle plafonnait à des teneurs protéiques supérieures à 9%. La concentration par OI favorisait l’augmentation du calcium micellaire en comparaison avec les témoins d’UF. En fabrication fromagère, une hausse de la concentration par OI était associée à une augmentation du rendement, de l’humidité et de la composition en lactose des fromages. La diminution du pH d’emprésurage s’est avérée un important levier pour corriger les concentrés OI en favorisant une déminéralisation partielle des micelles de caséine et un meilleur égouttage des fromages, ainsi qu’en accélérant la coagulation. Les résultats obtenus ont démontré que les altérations physicochimiques augmentaient avec la concentration par OI et que l’acidification avant emprésurage s’avérait une étape essentielle. Des combinaisons pH-concentration qui facilitent l’utilisation des concentrés OI en fromagerie ont été ciblées après comparaison avec les concentrés UF.
iv
Abstract
Pre-concentration of cheese milk by reverse osmosis (RO) has several advantages, including obtaining a low-pollutant permeate reusable as process water and reducing costs as well as greenhouse gas (GHG) emissions related to milk transportation. However, high levels of lactose and salts content in RO concentrates impair their cheesemaking abilities. A correction of their physicochemical properties before coagulation is therefore needed.
The objective of this work was to optimize the use of RO concentrates at different concentrations (5% to 11% protein content) for cheesemaking by renneting pH adjustment. Rennet-induced coagulation kinetics, salt partitioning and cheesemaking properties were compared to ultrafiltration (UF) concentrates.
Results showed that concentration by RO induced an increase regarding the coagulation time and the maximal firming rate of the gel that reached a plateau at 9% protein content. Significant increases of micellar calcium as well as in yield, moisture and lactose content of cheese were also observed. Lowering the renneting pH was found to improve the cheesemaking properties of RO concentrates by promoting partial demineralisation of casein micelles, accelerating the coagulation kinetics and increasing curd drainage. The results obtained in this study demonstrated that physicochemical alterations increased with RO concentration and that acidification before renneting was an essential step. The data obtained makes it possible to target the concentration-pH combinations that improve the use of RO concentrates in cheesemaking in comparison to UF concentrates.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ...ix
Liste des abréviations ... x
Remerciements ...xii
Avant-propos ... xiv
Introduction ... 1
Chapitre 1 : Revue de littérature ... 3
1.1 Le lait et ses constituants ... 3
1.1.1 L’eau ... 3
1.1.2 La matière grasse ... 4
1.1.3 Les glucides ... 4
1.1.4 Les protéines ... 5
1.1.4.1 Les micelles de caséines ... 5
1.1.4.2 Les protéines du sérum ... 6
1.1.5 Les minéraux ... 6
1.1.6 Les facteurs influençant les équilibres protéiques et minéraux ... 7
1.1.6.1 Le pH ... 8
1.1.6.2 L’addition de sels ... 8
1.1.6.3 La température ... 9
1.1.7 Les méthodes de séparation des phases soluble et colloïdale ... 9
1.2 La transformation du lait en fromage ... 10
1.2.1 La coagulation du lait ... 11
1.2.1.1 Les phases de la coagulation enzymatique ... 12
1.2.1.1.1 Phase d’hydrolyse ... 12
1.2.1.1.2 Phase d’agrégation ... 13
1.2.1.2 Les conditions physicochimiques influençant la coagulation ... 13
1.2.1.2.1 Le pH ... 13
1.2.1.2.2 La concentration en calcium, en caséine et en présure ... 14
1.2.1.2.3 La force ionique ... 14
1.2.1.2.4 La température ... 15
1.2.1.3 Les propriétés rhéologiques des gels de type présure ... 15
vi
1.2.2.1 Le décaillage et la cuisson ... 17
1.2.2.2 Le soutirage et le pressage ... 18
1.2.3 L’affinage ... 18
1.2.4 Rendement et bilans fromagers ... 18
1.2.5 Les propriétés rhéologiques des fromages ... 19
1.2.6 Les facteurs de composition qui influencent la qualité des fromages ... 20
1.3 Les procédés baromembranaires en industrie laitière ... 20
1.3.1 Principes généraux... 21
1.3.2 L’osmose inverse ... 22
1.3.3 La nanofiltration ... 23
1.3.4 L’ultrafiltration ... 24
1.3.5 La microfiltration ... 24
1.4 Utilisation de concentrés et éco-efficience en transformation laitière ... 25
1.5 La pré-concentration du lait de fromagerie par procédés baromembranaires ... 26
1.5.1 L’ultrafiltration en fromagerie ... 26
1.5.1.1 Standardisation protéique du lait ... 26
1.5.1.2 Rétentat à concentration intermédiaire... 27
1.5.1.2.1 Composition des rétentats ... 27
1.5.1.2.2 Impact sur la coagulation enzymatique ... 27
1.5.1.2.3 Caractéristiques des fromages ... 28
1.5.1.3 Pré-fromage liquide ... 29
1.5.2 L’osmose inverse pour la pré-concentration du lait de fromagerie ... 29
1.5.2.1 Composition des rétentats ... 29
1.5.2.2 Impact sur la coagulation enzymatique ... 30
1.5.2.3 Caractéristiques des fromages ... 31
Chapitre 2 : Contexte du projet ... 33
2.1 Problématique ... 33
2.2 Hypothèse de recherche ... 33
2.3 Objectifs ... 33
Chapitre 3 : Amélioration des propriétés de coagulation par la présure et des aptitudes fromagères des concentrés laitiers d’osmose inverse par l’ajustement du pH d’emprésurage ... 35
3.1 Résumé... 35
3.2 Avant-propos ... 36
3.2.1 Publication et communications associées à ce chapitre ... 36
3.3 Abstract ... 37
3.4 Introduction ... 38
3.5 Materials and methods ... 40
3.5.1 Skim milk supply... 40
vii
3.5.3 pH adjustment ... 41
3.5.4 Soluble-colloidal equilibrium and composition of retentates ... 41
3.5.5 Rennet coagulation kinetics ... 42
3.5.6 Model cheese production ... 43
3.5.7 Cheese composition and rheological analysis ... 44
3.5.8 Statistical analysis ... 45
3.6 Results and discussion ... 46
3.6.1 Milk composition as a function of the concentration ... 46
3.6.2 Casein mineralisation as a function of the pH ... 48
3.6.3 Rennet coagulation kinetics as a function of the concentration ... 49
3.6.4 Rennet coagulation of acidified RO concentrates ... 53
3.6.5 Model cheese production ... 55
3.6.6 Cheese rheology ... 58
3.7 Conclusion ... 60
3.8 Acknowledgements ... 60
Conclusion générale... 61
Synthèse des résultats obtenus ... 61
Retour sur la méthodologie préconisée ... 65
Perspectives ... 67
viii
Liste des tableaux
Tableau 1: Composition générale du lait de vache et taille moyenne des constituants (adapté de [5, 12, 13]). ... 3 Tableau 2: Composition minérale du lait de vache (adapté de [19]). ... 7 Tableau 3 : Caractéristiques et champs de fractionnement des principaux procédés
baromembranaires (source : [15, 54]). ... 22 Tableau 4 : Comparaison de la composition et des propriétés du lait écrémé, d’un rétentat d’UF (FCV : 2.5X) et d’un rétentat d’OI (FCV : 2.5X) (source : [11]). ... 30 Table 5: Effect of RO and UF concentration (expressed in terms of protein content) on mean1
composition and salt partitioning of concentrated skim milk adjusted to pH 6.50. ... 47 Table 6: Cheese composition1 as affected by concentration, renneting pH and type of concentrate. 56 Table 7: Mean1 yield, moisture-adjusted yield and protein retention of model cheeses as influenced by concentration, renneting pH and type of concentrate. ... 58 Tableau 8: Résumé de l’effet de la concentration par UF et OI et de l’effet du pH sur la composition des rétentats, sur la coagulation et la composition des fromages finaux. ... 64
ix
Liste des figures
Figure 1 : Représentation schématique d’une micelle de caséine. Les nanoclusters de phosphate de calcium (gris) sont liés aux caséines s1- et s2- (orange). Les -caséines (vert) sont présentes à la
surface de la micelle. La -caséine (bleu) est liée aux caséines par des liaisons hydrophobes
(source : [16]). ... 6 Figure 2: Les équilibres salins du lait entre les phases soluble et colloïdale (adapté de [22]). ... 8 Figure 3 : Les étapes de fabrication du fromage cheddar (adapté de [14]). ... 11 Figure 4 : Les phases de la coagulation enzymatique du lait et la formation du réseau (adapté de [14]). ... 12 Figure 5: Schéma d’un procédé baromembranaire simple (source : [54, 55]). ... 21
Figure 6 : Sélectivité des différents procédés membranaires (adapté de [54])... 22
Figure 7: Impact of pH on colloidal calcium/colloidal casein ratio regarding RO concentrated skim milk at 5%, 7%, 9% and 11% protein content in comparison to UF concentrates. Error bars
correspond to the standard deviation (n = 3). ... 49 Figure 8: Effect of protein concentration (regarding UF and RO concentrates) on the following parameters: (a) the rennet coagulation time; (b) the maximal firming rate; and (c) the storage
modulus at 60 min. Error bars correspond to the standard deviation (n = 3). ... 52 Figure 9: Effect of renneting pH and RO concentration on the following parameters: (a) the rennet coagulation time; (b) the maximal firming rate; and (c) the storage modulus at 60 min. Error bars correspond to the standard deviation (n = 3). ... 54 Figure 10: Effect of concentration and renneting pH on the complex modulus of cheese measured at 1 Hz (G*1). Error bars correspond to the standard deviation (n = 3). ... 59
x
Liste des abréviations
ACV Analyse de cycle de vie
CCP Phosphate de calcium colloïdal CMP Caséinomacropeptide
FCV Facteur de concentration volumique G’ Module d’élasticité (storage modulus) G’’ Module visqueux (loss modulus) G* Module complexe (complex modulus) GES Gaz à effet de serre
GHG Greenhouse gas
HPLC High-performance liquid chromatography
ICP-OES Inductively coupled plasma optical emission spectroscopy IMCU International milk-clotting units
LCR Low-concentrated retentate LPC Liquid pre-cheese
MCR Medium-concentrated retentate
MF Microfiltration
MFR Maximal firming rate
NCN Azote non caséique (non-casein nitrogen) NF Nanofiltration
NPN Azote non protéique (non-protein nitrogen) NT Azote total (total nitrogen)
OI Osmose inverse
Q10 Coefficient de température RCT Rennet coagulation time RO Reverse osmosis
TCA Trichloroacetic acid
xi
« Si vos rêves ne vous font pas peur, c’est qu’ils ne sont pas assez grands »
xii
Remerciements
Réaliser une maîtrise en sciences des aliments aura été pour moi un défi ambitieux et extrêmement valorisant. Plusieurs personnes ont fait de mon parcours une expérience enrichissante. Je souhaite d’abord adresser ma reconnaissance à mon directeur de recherche, Yves Pouliot, qui m’a encouragé à poursuivre mes études à la maîtrise alors que j’effectuais un stage dans son équipe à l’été 2016. Merci Yves de m’avoir transmis ta passion pour le secteur laitier et d’avoir aiguisé mon esprit critique et ma rigueur scientifique tout au long de mon parcours. Je te remercie également de m’avoir permis de participer à trois congrès pour présenter mes travaux. Ta confiance et ta disponibilité ont largement contribué au succès de ce projet.
Mon parcours à la maîtrise n’aurait certainement pas été aussi enrichissant sans le soutien de mon codirecteur, Michel Britten. Michel, ton aide et tes conseils sont tout simplement inestimables. Merci également pour ta patience, ton attitude positive et tes nombreux encouragements qui m’ont motivé à plusieurs reprises. Grâce à ton expertise, chaque problème rencontré s’est transformé en occasion unique d’apprendre et de découvrir.
Un merci spécial à Diane Gagnon, pour son aide indispensable en laboratoire et sa bonne humeur contagieuse. Merci à Mélanie Martineau et Pascal Lavoie pour leur assistance et leurs conseils durant la phase expérimentale de mon projet. Je remercie mes collègues étudiants de la Chaire industrielle : Marie-Pier, Julien, Scott, Agathe, Virginie, Isabelle et Amandine qui m’ont appuyé, mais aussi diverti plus d’une fois. Un merci tout spécial à Agathe Lauzin et Isabelle Fournier pour leur grande contribution à mon projet.
Je souhaite exprimer ma reconnaissance envers les organismes subventionnaires pour leur soutien financier. Merci au CRSNG et au FRQNT pour mes bourses de recherche ainsi qu’à Novalait sans qui mon projet n’aurait pu être réalisé. Merci également au personnel du Département de sciences des aliments de m’avoir fait confiance dans mes nombreux contrats d’auxiliaire de recherche et d’enseignement tout au long de ma maîtrise. Enfin, je
xiii
remercie les évaluateurs de mon mémoire qui ont pris le temps de m’offrir de pertinents conseils.
Un énorme merci à mes amis(es) et particulièrement à mon copain Thomas, qui m’encourage toujours à me surpasser. En terminant, je souhaite remercier trois personnes passionnées et inspirantes: mon père Jean-Guy, ma mère Joanne et ma sœur Émilie. Je vous suis reconnaissante de m’avoir éveillé à la science et de m’encourager dans tous mes projets.
xiv
Avant-propos
Ce projet de maîtrise a été réalisé dans le cadre de la programmation de la Chaire de recherche industrielle CRSNG-Novalait en efficience des procédés de transformation du lait, dirigée par Yves Pouliot. Le projet vise à identifier des leviers d’amélioration de la performance fromagère des concentrés laitiers d’osmose inverse. Il s’inscrit dans l’axe 1 de la programmation, soit l’amélioration de l’éco-efficience par une meilleure utilisation des constituants naturels du lait.
Le mémoire est divisé en 3 chapitres, précédés par une introduction générale du projet, mettant en contexte la problématique associée au projet de recherche. Le chapitre 1 présente une revue de littérature faisant état des connaissances scientifiques en lien avec le projet et des principaux concepts qui permettent d’expliquer les résultats des expérimentations. Les différents constituants du lait sont d’abord présentés ainsi que leur rôle à travers les étapes de la fabrication fromagère. Par la suite, le concept d’éco-efficience des procédés et les progrès récents dans l’utilisation des procédés baromembranaires pour la pré-concentration du lait de fromagerie complètent finalement ce chapitre. Dans le chapitre 2 sont formulés la problématique, l’hypothèse de recherche et les objectifs de travail.
Le chapitre 3 présente les travaux de recherche entrepris dans le cadre de cette maîtrise. Ils sont présentés sous la forme d’un article scientifique, en anglais, intitulé : « Improving
rennet coagulation and cheesemaking properties of reverse osmosis skim milk concentrates by pH adjustment ». L’article est accepté pour publication sous forme semblable dans International Dairy Journal. L’auteure de ce mémoire est aussi l’auteure principale de
l’article et a été entièrement responsable de la planification et de la réalisation de la phase expérimentale. Le Dr Yves Pouliot et le Dr Michel Britten, respectivement directeur et codirecteur du projet ont supervisé la planification des expériences et l’interprétation des résultats, puis ont révisé le manuscrit. Ils sont les coauteurs de cet article. Les résultats contenus dans cet article ont été présentés sous forme d’affiche scientifique au Symposium
xv
des étudiants de l’INAF (24 avril 2018), au Forum Novalait 2018 (16 juin 2018) et au congrès Green Food Tech (2-3 octobre 2018).
Enfin, une conclusion générale, mettant en évidence les principales réalisations du projet en lien avec l’hypothèse de départ et les objectifs de travail termine le mémoire. L’apport de ces travaux aux connaissances sur l’optimisation de l’utilisation de l’osmose inverse pour la pré-concentration du lait de fromagerie est discuté, de même que la méthodologie employée, les limites de l’étude et les perspectives pour de futurs projets. Finalement, toutes les références bibliographiques contenues dans ce mémoire sont regroupées dans la bibliographie.
1
Introduction
L’industrie laitière constitue un important secteur de l’économie canadienne, avec des livraisons manufacturières d’une valeur de 14.3 milliards de dollars en 2017 [1]. Au Québec, en 2013, le secteur des produits laitiers transformés représentait 25% des livraisons alimentaires totales, ce qui en fait le premier secteur bioalimentaire en importance de la province [2]. Des 3.3 milliards de litres de lait produits annuellement au Québec, 46% sont destinés à la fabrication fromagère [3].
L’industrie laitière exerce une empreinte écologique notable en raison notamment des gaz à effet de serre générés par la production du lait, de la charge polluante des sous-produits de la transformation et des besoins en eau et en énergie [4]. La protection de l’environnement étant devenue une priorité mondiale, l’industrie laitière s’adapte à cette préoccupation en développant des procédés plus éco-efficients.
Les procédés de séparation par membranes en industrie laitière s’inscrivent dans une approche de développement durable et sont de plus en plus utilisés pour optimiser l’utilisation des différents constituants du lait [5]. En industrie fromagère, ces procédés peuvent être utilisés pour pré-concentrer le lait de fromagerie. Cela permet d’augmenter les rendements fromagers et la qualité nutritionnelle des fromages, de diminuer le volume de lactosérum produit et de diminuer la pollution et les coûts reliés au transport du lait [6, 7]. Jusqu’à aujourd’hui, les recherches portant sur l’utilisation des procédés membranaires pour la pré-concentration du lait de fromagerie ont surtout porté sur l’ultrafiltration. Cette méthode est largement utilisée en industrie puisqu’elle présente l’avantage d’enrichir les fromages en protéines et de diminuer de 13 à 14% la quantité de lait nécessaire à la production d’une même quantité de fromage par les procédés traditionnels [7]. Cependant, le perméat généré par UF possède une charge polluante en raison de la présence de lactose, de minéraux solubles, de composés azotés et de vitamines solubles [8] et doit donc être valorisé.
2
Dans cette optique, l’utilisation de l’osmose inverse devient particulièrement intéressante. En OI, tous les constituants du lait (protéines, minéraux, lactose) sont retenus par la membrane et sont alors concentrés dans le rétentat. Le perméat généré est essentiellement de l’eau contenant des solides à l’état de trace. La charge polluante du perméat est donc très faible, voire nulle [9]. De plus, l’eau retirée du lait peut être réutilisée au sein de l’usine de transformation laitière pour les opérations de chauffage, de refroidissement ou de nettoyage [10]. Très peu d’études ont été publiées à ce jour sur l’utilisation de ce procédé pour la pré-concentration du lait de fromagerie et son impact sur le procédé de fabrication fromagère. En industrie laitière, l’OI est davantage utilisée pour la pré-concentration du lactosérum.
La concentration de l’ensemble des minéraux du lait et du lactose dans le rétentat d’OI est susceptible de modifier ses caractéristiques physicochimiques de même que ses propriétés de coagulation. En système concentré par OI, il est attendu que la micelle de caséine soit plus minéralisée en calcium que dans le lait. De plus, la concentration du rétentat a un impact négatif sur la cinétique de coagulation en augmentant le temps de coagulation, en diminuant la vitesse de raffermissement maximale du gel et en augmentant la viscosité [11].
Face à cette problématique, il est nécessaire de s’intéresser aux ajustements à apporter au procédé de fabrication fromagère afin de générer un fromage produit à partir de rétentat d’OI similaire à un fromage élaboré selon un procédé traditionnel. Ainsi, il convient d’abord de développer une approche visant à déminéraliser la micelle avant l’emprésurage par l’ajustement du pH, et ce, à différents facteurs de concentration. Ces deux paramètres sont susceptibles d’avoir un impact sur les équilibres salins et micellaires. La cinétique de coagulation par la présure est étudiée dans ces conditions par rhéologie, ainsi que les caractéristiques des fromages fabriqués en système modèle. L’objectif de cette étude est donc de développer une méthode de fabrication fromagère adaptée à la pré-concentration du lait par OI. Dans cette étude, tous les concentrés d’OI sont comparés à des témoins de lait écrémé et des concentrés témoins d’UF aux mêmes teneurs en protéines que ceux d’OI.
3
Chapitre 1 : Revue de littérature
1.1 Le lait et ses constituants
Le lait est un système complexe renfermant entre autres de la matière grasse, des protéines, des glucides et des minéraux. Le tableau 1 présente les différents constituants du lait, leur proportion moyenne ainsi que leur poids moléculaire. La composition du lait varie en fonction de facteurs liés à l’animal, dont la race, l’alimentation, la période de lactation et l’âge, ainsi que de facteurs extrinsèques comme la saison et le climat. Le lait frais a un pH se situant entre 6.6 et 6.8 [12].
Tableau 1: Composition générale du lait de vache et taille moyenne des constituants (adapté de [5, 12, 13]).
Constituant Proportion moyenne (%)
Poids moléculaire (Da) ou diamètre (µm/nm)
Eau 87.1
Globule de gras 3.7 0.1-15m (3.4 m) Protéines des micelles de
caséine 2.6 100-200 nm -s1 1.04 22-24 kDa -s2 0.26 25 kDa 0.91 24 kDa 0.39 19 kDa Protéines sériques 0.7 3-6 nm -lactalbumine 0.12 14 kDa -lactoglobuline 0.32 18 kDa
Sérum albumine bovine 0.04 66 kDa
Lactose 4.6 0.35 kDa
Minéraux 0.7 0.1-1 nm
1.1.1 L’eau
Le caractère polaire de l’eau, conféré par la présence d’un dipôle et d’un doublet d’électrons sur l’atome d’oxygène, lui permet de former dans le lait une solution vraie avec les substances polaires solubilisées, soit les glucides et les minéraux. La matière grasse forme une émulsion de type huile dans eau. Comme les micelles de caséine sont solides et
4
non-solubilisées, elles sont présentes dans l’eau sous forme de suspension colloïdale. Les protéines du sérum, qui ont une plus grande affinité pour l’eau, sont quant à elles en solution [12].
1.1.2 La matière grasse
Les lipides du lait sont formés en majeure partie de triglycérides (98%) et en plus faible proportion de phospholipides et d’une fraction insaponifiable (cholestérol et -carotène). Les matières grasses sont présentes dans le lait sous forme de globules gras, qui sont formés de couches de triglycérides recouverts d’une enveloppe de phospholipides. Des protéines de membranes (lipoprotéines, enzymes et agglutinines) complètent la couche externe du globule. La présence de charges négatives sur la structure des protéines de membranes empêche les globules gras de s’agglomérer. La membrane du globule gras peut toutefois être brisée par l’agitation excessive et des traitements mécaniques comme l’homogénéisation [12].
1.1.3 Les glucides
Le lactose est le glucide le plus important du lait et représente 40% des solides totaux. D’autres glucides peuvent également être présents dans le lait en faible quantité, soit le glucose et le galactose qui proviennent de l’hydrolyse du lactose [12]. Le lactose est sujet à différentes transformations chimiques, soit l’hydrolyse, la fermentation et la réaction de Maillard, responsable du brunissement non enzymatique. Le lactose est un disaccharide formé de D-glucose et de D-galactose.
En fabrication fromagère employant des ferments lactiques, le lactose du lait est d’abord fermenté par les bactéries lactiques en acide lactique, ce qui diminue le pH du lait [12]. Cette baisse du pH favorise la coagulation du lait, force la déminéralisation des micelles de caséines, favorise la synérèse du caillé et inhibe la croissance de microorganismes indésirables [14]. Lors de l’affinage des fromages, une quantité de lactose résiduelle trop
5
élevée conduit à une reprise de la fermentation lactique pendant plusieurs jours dans la salle d’affinage. Cela conduit souvent à des défauts dans la qualité sensorielle des fromages [15].
1.1.4 Les protéines
Les protéines du lait se divisent en 2 catégories : les caséines (80%) et les protéines du sérum (20%). 95% de la matière azotée du lait se trouve sous la forme de protéines. Les composés azotés non protéiques du lait sont des protéoses, des peptones et de l’urée.
1.1.4.1 Les micelles de caséines
Les caséines sont un groupe de phosphoprotéines présentes sous forme de 4 fractions : s1-,
s2-, - et -caséines dans les proportions respectives de 4 :1 :3.5 :1.5. Les caséines ont la
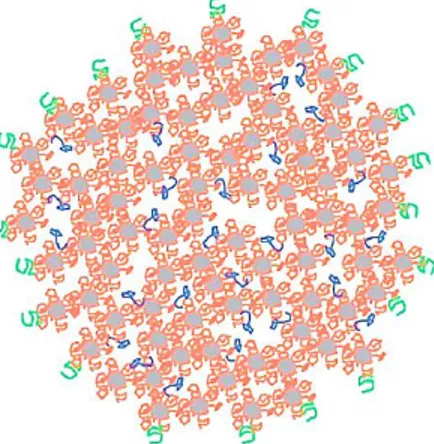
particularité de se regrouper sous forme de micelles d’un diamètre moyen de 180 nm, qui sont formées à 92% de protéines et à 8% de minéraux. De plus, elles contiennent 3-4 kg d’eau par kg de protéine [16]. La partie externe des micelles de caséine est riche en -caséines. Plusieurs modèles existent pour expliquer la structure des micelles de -caséines. Parmi ceux-ci, le plus récent est le modèle des nanoclusters, ou nanogroupes, de protéine et de phosphate de calcium. Selon ce modèle, la micelle de caséine est une matrice homogène de caséines dans laquelle sont dispersés les nanogroupes de phosphate de calcium. Les protéines s’associent entre elles par des interactions faibles, soit des interactions hydrophobes, des ponts hydrogènes ou encore de faibles attractions de Van der Waals [17]. La figure 1 présente le schéma du modèle le plus récent de la micelle de caséine du lait. La charge nette des micelles est négative, ce qui leur permet de se repousser entre elles. Dans leur état natif, les micelles de caséines sont très stables. Elles peuvent être chauffées à 100°C et pressurisées à 100 MPa sans perdre leur intégrité [16]. Elles précipitent toutefois sous l’effet de la présure ou de l’acidité à pH 4.6. Le gel formé par la coagulation des caséines, qui retient plus ou moins selon le cas la matière grasse, les minéraux, l’eau et les éléments solubles, est la base de produits tels le fromage et le yogourt [14].
6
Figure 1 : Représentation schématique d’une micelle de caséine. Les nanoclusters de phosphate de calcium (gris) sont liés aux caséines s1- et s2- (orange). Les -caséines (vert)
sont présentes à la surface de la micelle. La -caséine (bleu) est liée aux caséines par des liaisons hydrophobes (source : [16]).
1.1.4.2 Les protéines du sérum
Les deux principales protéines du sérum sont la -lactoglobuline (55%) et l’-lactalbumine (22%). Ces protéines ont des points isoélectriques respectifs de 5.1 et 4.8 [12]. Les autres protéines du sérum, en proportion moins importante, sont les immunoglobulines (13%), la sérum albumine bovine (7%) et la lactoferrine (4%). Les protéines du sérum sont davantage sensibles à la chaleur que les caséines. À des températures supérieures à 65°C, ces protéines sont dénaturées, puis s’agrègent et précipitent [18]. Les protéines du lactosérum, contrairement aux caséines, demeurent solubles sous l’action de la présure. En fabrication fromagère, les protéines sériques se retrouvent en bonne partie éliminées dans le lactosérum lors de l’égouttage [14].
1.1.5 Les minéraux
La fraction minérale du lait (8-9 g/L) est en interaction forte et dynamique avec la fraction protéique du lait. Pour cette raison, les minéraux jouent un rôle important dans la structure et la stabilité des micelles de caséines. Les minéraux du lait sont composés de cations (calcium, magnésium, sodium et potassium) et d’anions (phosphate inorganique, chlore et
7
citrate) [19]. Le tableau 2 présente les minéraux les plus importants ainsi que leur concentration massique et molaire dans le lait.
Tableau 2: Composition minérale du lait de vache (adapté de [19]). Minéraux Concentration massique
(mg/kg) Concentration molaire (mmol/kg) Calcium 1043-1283 26-32 Magnésium 97-146 4-6 Phosphore 930-992 30-32 Sodium 391-644 17-28 Potassium 1212-1681 31-43 Chlore 772-1207 22-34 Citrate 1323-2079 7-11
Le phosphate de calcium micellaire joue un rôle clé dans le maintien de la structure des micelles de caséine. Il est présent dans les micelles sous forme de clusters de 2 nm de diamètre [17]. 33% du calcium, 50% du phosphate inorganique, 66% du magnésium et 90% du citrate se trouvent dans la fraction aqueuse ou diffusible du lait, c’est-à-dire qu’ils se retrouveraient dans le perméat d’une membrane semi-perméable avec un seuil de coupure supérieur à 10 kDa [19, 20]. Les ions monovalents tels le sodium, le potassium et le chlorure sont présents en quasi-totalité dans la phase aqueuse du lait, car environ 8% de la teneur totale en ions sodium et potassium est associée à la micelle de caséines au pH du lait [21].
1.1.6 Les facteurs influençant les équilibres protéiques et minéraux
La répartition minérale entre les phases colloïdale et soluble est très importante, car elle a un impact direct sur les propriétés de coagulation du lait et sur la fabrication fromagère. L’équilibre salin est fortement dépendant des conditions physicochimiques et des traitements technologiques du lait [21], qui seront passés en revue dans les prochains paragraphes. La figure 2 présente les équilibres salins du lait.
8
Figure 2: Les équilibres salins du lait entre les phases soluble et colloïdale (adapté de [22]).
1.1.6.1 Le pH
L’abaissement du pH du lait entraine une solubilisation des minéraux micellaires (calcium, magnésium, phosphate inorganique et citrate). Les ions H+, qui peuvent être produits par les bactéries lactiques ou par ajout d’acide, protonnent le phosphate inorganique et les formes de citrates dans la phase soluble. L’ionisation du CaHPO4 est favorisée, ce qui augmente
l’activité de l’ion calcium (Ca+2
), puis induit un transfert de calcium et de phosphate de la phase colloïdale vers la phase soluble. Dans le lait, le phosphate micellaire et le calcium qui lui est associé sont complètement solubilisés à un pH de 5.2. Sous cette valeur de pH, le calcium et le magnésium colloïdal restant sont en interaction directe avec les résidus phosphosérines des caséines [21]. La concentration en caséine micellaire a un impact sur la solubilisation des minéraux micellaires. Plus le lait est concentré en caséines micellaires, plus il est nécessaire de descendre à des pH acides pour avoir une solubilisation totale des minéraux [21].
1.1.6.2 L’addition de sels
L’ajout de sels, comme le chlorure de sodium, augmente la force ionique, ce qui réduit le coefficient d’activité et augmente la solubilité des minéraux micellaires (phosphate et citrate de calcium). Les liaisons sont plus labiles et la dissociation des paires d’ions
9
augmente lorsque la force ionique augmente [21]. L’ajout de complexants du calcium, comme le citrate, l’oxalate et l’EDTA entrainent également une solubilisation du calcium et du phosphate inorganique micellaire [21].
1.1.6.3 La température
Le refroidissement du lait à basse température favorise la solubilité du phosphate de calcium. Par exemple, un lait entreposé pendant 48 h à 4°C présente une augmentation de 10% du calcium et du phosphate inorganique soluble et de 20% du calcium ionisé par rapport aux teneurs du lait à 20°C [21]. Au contraire, un traitement par la chaleur du lait induit une diminution de la solubilité des minéraux. Ces changements de phase sont toutefois réversibles. L’organisation des protéines est également affectée par le changement de température. Un abaissement de la température du lait est associé à un transfert de la -caséine de la micelle vers la phase aqueuse en raison notamment de l’affaiblissement des interactions hydrophobes [21].
1.1.7 Les méthodes de séparation des phases soluble et colloïdale
Dans le but de quantifier la répartition des minéraux entre les phases soluble et colloïdale, il est possible de déterminer la concentration totale du minéral dans le lait et la concentration du minéral dans la phase aqueuse. La concentration de minéraux associée à la micelle de caséines peut ensuite être calculée par différence. Il existe quatre principales méthodes pour isoler la phase aqueuse, ou soluble du lait écrémé, soit la dialyse avec récupération du dialysat, l’ultrafiltration avec récupération de l’ultrafiltrat, l’ultracentrifugation avec récupération du surnagent et la coagulation présure avec récupération du lactosérum doux.
Pour l’ultracentrifugation, des valeurs de 80 000 x g pendant 2h ou de 100 000 x g pendant 1h sont généralement employées. Pour la dialyse et l’ultrafiltration, des membranes à seuil de coupures inférieures à 10 – 15 kDa doivent être utilisées de manière à empêcher les molécules capables de lier les minéraux d’atteindre le dialysat ou le perméat. Pour la coagulation présure, le lait est coagulé par la présure et le gel est coupé avant d’être
10
centrifugé pour récupérer le lactosérum [19]. Un contrôle rigoureux de la température et du pH est nécessaire lors de ces méthodes, car la séparation des phases est fortement dépendante de ces caractéristiques physicochimiques. Parmi ces méthodes, l’ultracentrifugation semble être une méthode favorable en ce qui concerne la rapidité et la précision des mesures [23, 24].
1.2 La transformation du lait en fromage
La transformation du lait en fromage s’effectue en trois étapes principales : la coagulation, l’égouttage et l’affinage. L’étape de coagulation est toutefois généralement précédée d’une étape de prétraitement du lait au cours de laquelle le lait peut être standardisé, homogénéisé, traité thermiquement, maturé à chaud ou à froid ou encore ensemencé de ferments [14, 25]. La standardisation du lait permet d’ajuster la teneur en matières grasses et en protéines pour pallier aux variations de composition ou encore pour l’enrichir dans le but d’augmenter les rendements fromagers [14].
Les principales étapes de la fabrication d’un fromage de type cheddar sont présentées à la figure 3.
11
Figure 3 : Les étapes de fabrication du fromage cheddar (adapté de [14]).
1.2.1 La coagulation du lait
La coagulation du lait correspond à une étape de déstabilisation des micelles de caséines qui floculent puis se soudent pour former un gel qui emprisonne les constituants solubles du lait [14]. La coagulation peut s’effectuer de trois principales manières. Premièrement, la coagulation peut résulter de l’action d’une enzyme protéolytique. La présure d’origine animale, constituée de chymosine et de pepsine est le coagulant le plus utilisé. D’autres enzymes protéolytiques d’origine animale, végétale ou microbienne ont aussi la capacité de faire coaguler le lait [14]. Deuxièmement, le lait peut coaguler sous l’effet du pH. En abaissant son pH en dessous du point isoélectrique des caséines (4.6), ces dernières s’agrègent. Finalement, la coagulation peut avoir lieu lorsque le lait est chauffé à 90°C à un pH d’environ 5.2 [25]. Parmi ces méthodes, la coagulation enzymatique est la plus fréquemment employée et sera plus spécifiquement étudiée dans ce mémoire. La
12
coagulation enzymatique se déroule en deux phases, la phase primaire, ou d’hydrolyse, et la phase secondaire, ou d’agglomération.
1.2.1.1 Les phases de la coagulation enzymatique
Les deux phases de la coagulation enzymatique du lait sont représentées schématiquement à la figure 4.
Figure 4 : Les phases de la coagulation enzymatique du lait et la formation du réseau (adapté de [14]).
1.2.1.1.1 Phase d’hydrolyse
L’hydrolyse enzymatique, soit la première phase de la coagulation, correspond à la protéolyse de la caséine-, la composante qui stabilise la micelle en solution. L’hydrolyse sélective de la présure s’effectue au niveau de la liaison Phe105-Met106 de la caséine-. La chaine peptidique se retrouve scindée en deux segments : la paracaséine- (segment 1-105) et le caséinomacropeptide (CMP) (segment 106-169) [14]. La paracaséine- reste liée aux caséines et dans la micelle hydrophobe. Lorsque le CMP est libéré de la surface des caséines et passe dans le lactosérum, il se produit une diminution importante de la charge électrique et de l’hydratation des micelles. Les micelles sont donc déstabilisées, ce qui conduit à leur agrégation. Cette première phase de la coagulation peut être décrite par le modèle de Michaelis-Menten pour les réactions enzymatiques [26].
13 1.2.1.1.2 Phase d’agrégation
Dans le lait, lorsque de 85 à 90% de la caséine- est hydrolysée, les micelles sont suffisamment déstabilisées pour qu’elles puissent commencer à s’agréger [14, 25, 26]. Lors de la phase d’agrégation, les micelles déstabilisées se rapprochent et se lient par des liaisons hydrophobes pour former un réseau protéique lâche qui retient les globules de gras, l’eau et les constituants solubles. Les ions calcium s’uniraient à la partie chargée négativement des micelles, diminuant ainsi les répulsions électrostatiques et favorisant l’agrégation. La vitesse de la phase d’agrégation est déterminée par la fréquence et l’efficacité des collisions qui mènent à la formation de liaisons entre les micelles [27]. Le gel présure est formé à un pH élevé donc il est très minéralisé [14]. Il est stable pour une longue durée s’il n’est pas dérangé et se contracte par synérèse s’il est coupé [28].
1.2.1.2 Les conditions physicochimiques influençant la coagulation
Plusieurs conditions physicochimiques influencent l’une ou les deux phases de la coagulation du lait, dont la température, la concentration en calcium, la concentration en caséine, la concentration et l’activité de la présure, la force ionique et le pH du lait. Les différents mécanismes d’action seront présentés dans les prochains paragraphes.
1.2.1.2.1 Le pH
Un changement dans le pH du lait influence fortement la coagulation par la présure. La phase enzymatique de la coagulation est très dépendante du pH. Le pH optimal pour l’activité enzymatique de la présure se situe entre 5.3 et 5.5, pH auxquels le taux d’hydrolyse est maximal [29]. Il est connu que le temps de coagulation du lait par la présure diminue avec une diminution de pH et que la vitesse de raffermissement du gel augmente [30]. De plus, à plus faible pH, un plus faible degré d’hydrolyse de la -caséine est nécessaire pour initier l’agrégation. À des pH de 6.8-6.6, l’agrégation des micelles est très lente et elle tend à augmenter significativement à des pH sous 6.6 [31]. La phase secondaire (agglomération) est quatre fois plus sensible à une baisse du pH que la phase enzymatique. L’augmentation du taux d’agrégation conséquente à une acidification du lait
14
jusqu’à un pH de 6.0 est causée par l’augmentation du calcium ionisé [14]. Dans le lait, une diminution du pH sous 6.0 conduit toutefois à une diminution de la fermeté du gel en raison d’une perte excessive de phosphate de calcium colloïdal [27].
1.2.1.2.2 La concentration en calcium, en caséine et en présure
La formation du gel lors de la phase d’agrégation est fortement dépendante du contenu en calcium du lait. La coagulation des micelles hydrolysées par la présure est dépendante d’une concentration critique de Ca+2
qui agit comme lien entre les micelles ou encore comme neutralisateur de charge [32]. Du calcium sous forme de CaCl2 est souvent ajouté
au lait avant la coagulation pour augmenter la vitesse de la phase d’agrégation et la fermeté du gel. Le principal effet d’un ajout d’ions calcium est de réduire la charge des caséines en s’y liant, tout en favorisant les liaisons hydrophobes, ce qui accélère l’agrégation. De plus, l’ajout de CaCl2 diminue le pH, ce qui favorise également l’action de l’enzyme [27]. À des
concentrations en CaCl2 supérieures à 0.01 M, l’effet opposé est toutefois observé [14].
Comme la fréquence des collisions est fortement dépendante de la concentration en particules, le taux d’agrégation des micelles varie en fonction de la concentration en caséines. La vitesse d’agrégation est proportionnelle au carré de la concentration en caséine [27]. Parmi les autres facteurs influençant la coagulation, une augmentation de la quantité de présure ajoutée augmente de façon proportionnelle la vitesse d’hydrolyse de la -caséine [27]. Comme la phase d’agrégation chevauche la phase enzymatique et qu’elle en dépend, une augmentation de la concentration en présure peut aussi augmenter le taux de raffermissement et la fermeté du gel [14].
1.2.1.2.3 La force ionique
Il a été rapporté dans la littérature qu’une augmentation de la force ionique du lait a pour effet de diminuer la vitesse d’agrégation des micelles déstabilisées à des températures supérieures à 25°C [33, 34]. En effet, l’ajout de Na+ entraîne une solubilisation du phosphate de calcium colloïdal, ce qui peut exposer les résidus phosphosérines chargés
15
négativement et ainsi augmenter la répulsion électrostatique [27]. À basse température, la force ionique du lait n’a qu’un faible impact sur la phase d’agrégation des micelles de caséine [31].
1.2.1.2.4 La température
La température exerce une influence sur les deux phases de la coagulation, mais de manière différente. Le coefficient de température (Q10), c’est-à-dire le nombre de fois dont la vitesse
est augmentée avec une augmentation de la température de 10°C, pour la phase enzymatique de la coagulation est de 2-4, alors qu’il est de 13-16 pour la phase d’agrégation des micelles. Ainsi, la phase d’agrégation est la plus affectée par la température [28]. À basse température, il peut y avoir une séparation entre la phase primaire enzymatique de la coagulation qui se produit malgré la basse température (en dessous de 10°C) et la phase d’agrégation secondaire qui ne se produit qu'avec une élévation de la température. Ainsi, à des températures en dessous de 10°C, l’hydrolyse enzymatique se produit, mais les micelles de caséines ne montrent aucun signe d’agrégation. Entre 10°C et 20°C, la coagulation est lente et devient progressive à des températures entre 30 et 42°C [14].
1.2.1.3 Les propriétés rhéologiques des gels de type présure
La cinétique de coagulation par la présure peut être étudiée en fonction du temps à l’aide des mesures de rhéologie dynamique. La rhéologie est l’étude de la déformation et de l’écoulement de la matière, lorsque soumise à des forces extérieures [35]. Les matériaux solides élastiques emmagasinent l’énergie durant une déformation, puis retournent à leur forme originale lorsque la force extérieure est enlevée. Les liquides visqueux dissipent plutôt cette énergie [36]. Les gels de lait sont viscoélastiques, c’est-à-dire que leurs propriétés rhéologiques sont intermédiaires et peuvent être caractérisées en étudiant à la fois la composante visqueuse et la composante élastique [37]. Les mesures de rhéologie dynamique sont effectuées sous cisaillement oscillatoire de faible amplitude avec une géométrie de mesure à cylindres concentriques pour étudier les propriétés viscoélastiques des laits emprésurés en fonction du temps [32]. Le module d’élasticité ou de stockage (G’)
16
est une mesure de l’énergie emmagasinée par cycle d’oscillation alors que le module visqueux, ou de perte (G’’) est une mesure de l’énergie dissipée sous forme de chaleur par cycle. Pour sa part, le facteur de perte (tan ) représente le ratio des propriétés visqueuse sur élastique. Ces paramètres peuvent être définis avec les équations 1 à 3 suivantes :
𝐺′ = (0
0) cos (1)
𝐺′′ = (0
0) sin (2)
tan= 𝐺′′𝐺′ (3)
Où 0 est l’amplitude de la contrainte et 0 est l’amplitude de déformation.
Durant la coagulation du lait, il y a d’abord une période de latence, durant laquelle a lieu l’hydrolyse de la -caséine, avant d’obtenir une valeur de G’ mesurable. Les modules visqueux et élastiques augmentent ensuite rapidement, puis atteignent lentement un plateau [38]. Une lente augmentation de ces modules signifie l’augmentation de l’aire de contact entre les micelles agrégées résultant de leur fusion ainsi que l’incorporation de particules dans le réseau protéique. Pour sa part, la tan diminue au point de gélation et se stabilise à une valeur d’environ 0.3 (pour une fréquence de 0.1 Hz) [37].
Plusieurs paramètres de coagulation peuvent être extraits après modélisation de la courbe du G’ en fonction du temps. Le temps de prise, ou temps de coagulation, correspond au temps requis pour que G’ atteigne une valeur arbitrairement fixée à 1 Pa. Le taux maximum de raffermissement du gel, défini comme la pente maximale du graphique de G’ en fonction du temps, et la fermeté du gel à un temps donné, fixé arbitrairement à 60 minutes peuvent aussi être extraits [39].
17 1.2.2 L’égouttage
L’égouttage est l’étape durant laquelle il y a synérèse du caillé, c’est-à-dire qu’il se contracte et qu’il expulse spontanément le lactosérum [14]. Lors de cette déshydratation partielle du caillé, une grande partie des éléments solubles sont éliminés dans le lactosérum par des phénomènes actifs (synérèse) et passifs (porosité et perméabilité). Dans le caillé, les vides occupés par la phase liquide correspondent à la porosité alors que la libre circulation du lactosérum à l’intérieur correspond à la perméabilité. De nombreux facteurs ont une influence sur l’égouttage du gel, dont la composition du lait de départ (gras, protéine, calcium), la pression appliquée, la température et le pH, notamment [40].
1.2.2.1 Le décaillage et la cuisson
Le caillé est coupé et cuit pour favoriser la synérèse. Le décaillage consiste à couper le gel en cubes de 0.5 à 2.5 cm de côté [14]. La coupe du caillé doit être effectuée à un temps précis. Si le gel est coupé trop tôt, ou à trop faible fermeté, une partie des solides du lait sera perdue dans le lactosérum. Au contraire une coupe tardive ou à haute fermeté conduit à une plus grande rétention de l’eau et à des rendements fromagers supérieurs [25, 41]. Le brassage lors de la cuisson permet d’éviter l’agglomération et la sédimentation des grains de caillé au fond du bassin. Lors de la cuisson, la température est graduellement montée de 30°C jusqu’à une température située entre 37°C et 55°C selon le type de fabrication fromagère [14]. L’augmentation de la température lors du chauffage doit être graduelle pour éviter la formation d’une croute (coiffe) à la surface des grains qui pourrait nuire à leur égouttage [14]. La température de cuisson du caillé a un effet sur le contrôle de l’humidité, du contenu en matière grasse et sur le contrôle de la vitesse d’acidification des ferments lactiques. De manière générale, une haute température de cuisson est associée à des fromages plus secs en raison de la contraction du gel [42]. Durant l’acidification du caillé, les minéraux micellaires sont transférés dans la phase aqueuse du fromage. L’égouttage permet d’éliminer ces minéraux dans le lactosérum plutôt que de les garder dans le caillé, ce qui pourrait causer une augmentation de la force ionique et de la capacité tampon des caillés [21].
18
1.2.2.2 Le soutirage et le pressage
Le soutirage consiste à retirer le lactosérum après la cuisson par drainage à même la cuve de fabrication [40]. Dans la fabrication du fromage cheddar, la soudure des grains est favorisée par une série d’empilements et de retournements. Cette étape, appelée la cheddarisation, s’échelonne sur 60 à 90 minutes [14, 40]. Le pressage permet ensuite de donner la forme finale au fromage. Une pression de 1.3 à 41 kPa est généralement appliquée aux fromages dans les moules pendant une période variant de 2 à 24 heures [14]. Du sel peut être ajouté au fromage pour compléter l’égouttage du lactosérum sous l’effet de la pression osmotique, pour arrêter l’acidification du caillé et pour contrôler le développement des bactéries nuisibles [14]. L’ajout de sel affecte la teneur finale en humidité et en sel des fromages [43].
1.2.3 L’affinage
L’affinage est l’étape qui permet au caillé égoutté de développer une texture et une saveur caractéristiques. Les enzymes, qui proviennent du lait, de l’agent coagulant et des microorganismes, digèrent les constituants du caillé. Lors de l’affinage, il y a fermentation du lactose, hydrolyse des protéines et dégradation de la matière grasse [14]. Le lactose résiduel se transforme en acide lactique sous l’action de la flore homofermentaire, provocant dans certains cas une post-acidification non souhaitée [14]. Dans la fabrication de fromage cheddar, l’affinage est une étape facultative.
1.2.4 Rendement et bilans fromagers
La notion de rendement fromager, soit la quantité de fromage qu’il est possible de produire à partir d’une certaine quantité de lait est d’une importance primordiale d’un point de vue économique pour l’industrie fromagère. Le rendement fromager est calculé à partir de la formule suivante :
19
Plusieurs facteurs peuvent affecter le rendement fromager, dont la composition en gras et en protéines du lait. Les conditions de fabrication fromagère comme l’ajout de protéines du lactosérum, l’homogénéisation du lait, le type de coagulant et de ferment utilisé, la fermeté du gel et le type de cuve ont aussi un impact sur le rendement fromager [44].
Le rendement peut aussi être exprimé en fonction de la récupération des ingrédients laitiers, soit les protéines, la matière grasse ou les solides non gras, obtenu par bilan de masse. Par exemple, la formule suivante est utilisée pour calculer le rendement en protéine [14]:
𝑅𝑒𝑛𝑑𝑒𝑚𝑒𝑛𝑡 𝑒𝑛 𝑝𝑟𝑜𝑡é𝑖𝑛𝑒𝑠: 𝑀𝑎𝑠𝑠𝑒 𝑖𝑛𝑖𝑡𝑖𝑎𝑙𝑒 𝑑𝑒 𝑝𝑟𝑜𝑡é𝑖𝑛𝑒𝑠 𝑑𝑢 𝑙𝑎𝑖𝑡 𝑠𝑡𝑎𝑛𝑑𝑎𝑟𝑑𝑖𝑠é (𝑘𝑔)𝑀𝑎𝑠𝑠𝑒 𝑑𝑒 𝑝𝑟𝑜𝑡é𝑖𝑛𝑒𝑠 𝑑𝑎𝑛𝑠 𝑙𝑒 𝑓𝑟𝑜𝑚𝑎𝑔𝑒 (𝑘𝑔) ∗ 100 (5)
1.2.5 Les propriétés rhéologiques des fromages
Pour connaître les propriétés structurales et les propriétés mécaniques du fromage final, des mesures rhéologiques en mode dynamique peuvent être utilisées [36]. Le balayage de fréquence est la méthode rhéologique la plus versatile pour caractériser le comportement viscoélastique des matériaux. Durant ce test, une déformation sinusoïdale d’amplitude fixe est imposée au fromage et les modules dynamiques sont déterminés sur un éventail de fréquence (généralement entre 0.01 et 100 Hz) [45]. Une géométrie de mesure constituée de deux plaques parallèles est employée entre lesquelles est placé un disque de fromage. Les mesures de rhéologie dynamique sur des fromages donnent de l’information sur la conformation et la structure des particules de caséines. Le module complexe (G*) est un indicateur du nombre et de la force des liaisons qui forment la matrice fromagère [46]. Sa relation avec les autres paramètres de rhéologie dynamique est donnée par l’équation suivante [47] :
20
1.2.6 Les facteurs de composition qui influencent la qualité des fromages
La teneur en minéraux, en lactose, en humidité et en matière grasse des fromages finaux influence grandement leur structure, leur fermeté et leurs propriétés de fonte. Le calcium et le phosphore participent au réseau protéique qui forme la matrice des fromages. Les fromages qui contiennent une plus haute teneur en calcium total tendent à être plus fermes et à avoir des propriétés de fonte diminuées [48]. Au contraire, des fromages qui contiennent une trop petite quantité de calcium et de phosphore ont une structure relâchée [49]. La portion de lactose résiduel qui demeure dans la phase aqueuse du fromage à la suite de l’égouttage influence la saveur et le pH du fromage, car le lactose est transformé en acide organique durant l’affinage [48]. De manière générale, l’augmentation de l’humidité des fromages contribue à une diminution de la fermeté des fromages et à de meilleures propriétés de fonte [42]. Le ratio sel/humidité des fromages est aussi un paramètre à considérer, car il affecte l’hydratation des protéines et le taux de fermentation du lactose. Comme les sels réduisent l’activité de l’eau des fromages, l’activité des bactéries lactiques se trouve aussi diminuée en présence d’une plus grande concentration de sels [48, 50]. La teneur en matière grasse influence la texture des fromages. Une faible concentration en matière grasse résulte en une matrice fromagère de structure plus ferme et élastique avec des propriétés de fonte diminuées [51]. Enfin, le pH affecte profondément les propriétés fonctionnelles des fromages [42]. Dans les fromages faits de lait non concentré, une baisse de pH de 5.4 à 4.9 entraine la solubilisation d’une grande partie du CCP, altère la microstructure des fromages par une réduction de la taille des agrégats protéiques et diminue les liaisons dans la matrice protéique [42].
1.3 Les procédés baromembranaires en industrie laitière
De manière générale, la séparation membranaire du lait en différentes fractions permet une utilisation plus optimale des constituants laitiers et de leurs propriétés fonctionnelles. Il existe quatre principaux procédés baromembranaires avec des domaines de fractionnement différents, soit la microfiltration (MF), l’ultrafiltration (UF), la nanofiltration (NF) et l’osmose inverse (OI). Alors que certaines applications des procédés membranaires ont été
21
largement étudiées et sont appliquées à l’échelle industrielle, comme l’isolation des protéines sériques du lactosérum [52] ou la réduction des bactéries et des spores du lait écrémé par microfiltration [53], d’autres applications demeurent moins étudiées, dont l’utilisation de l’osmose inverse pour la pré-concentration du lait de fromagerie. Le domaine de fractionnement de chacun des procédés baromembranaires est d’abord expliqué. La concentration du lait n’est pas sans conséquence sur les équilibres minéraux, c’est pourquoi les propriétés physicochimiques des rétentats seront également présentées dans la section suivante.
1.3.1 Principes généraux
Les procédés baromembranaires sont des méthodes de séparation des différents constituants d’un fluide basées sur un différentiel de pression de part et d’autre d’une membrane semi-perméable. La figure 5 présente le schéma d’un système baromembranaire simple. À partir du bassin d’alimentation, le lait est pompé de façon tangentielle ou frontale jusqu’à la membrane. Sous l’effet de la pression p1, une partie du solvant et des solutés arrivent à
traverser la membrane pour former le perméat. La fraction du lait qui a été retenu par la membrane forme le rétentat et est recirculée vers le bassin d’alimentation [54]. Ce dernier est muni d’une double paroi permettant de contrôler la température du fluide tout au long de l’opération.
Figure 5: Schéma d’un procédé baromembranaire simple (source : [54, 55]).
P1 P2
22
La séparation du lait en fractions définies permet l’optimisation de l’utilisation des différents constituants du lait. Les quatre principaux procédés membranaires permettent de concentrer sélectivement les constituants du lait. La sélectivité des ces procédés membranaires est présentée à la figure 6, puis les pressions d’opération et les seuils de coupures sont présentés au tableau 3.
Figure 6 : Sélectivité des différents procédés membranaires (adapté de [54]).
Tableau 3 : Caractéristiques et champs de fractionnement des principaux procédés baromembranaires (source : [15, 54]).
Procédé baromembranaire
Seuil de coupure (Da) Pression d’opération (bar) Microfiltration 200 000 Da 0.1-2 Ultrafiltration 1 000 – 200 000 Da 1-10 Nanofiltration 200 – 1 000 Da 15-30 Osmose inverse 150 Da 30-50 1.3.2 L’osmose inverse
L’osmose inverse permet de concentrer le lait par élimination d’eau. Par définition, le phénomène d’osmose correspond à une migration différentielle de l’eau de la solution la
23
moins concentrée vers la plus concentrée. Le phénomène d’osmose inverse repose donc sur l’application d’une pression supérieure à la pression osmotique du lait afin de provoquer la migration de l’eau dans le sens inverse [21]. Il s’agit du procédé baromembranaire qui utilise les plus hautes pressions d’opération, soit de 5 à 10 fois plus élevées que celles utilisées en UF [15]. Dans l’industrie laitière, l’osmose inverse peut être utilisée pour concentrer le lait et le lactosérum avant des procédés d’évaporation et de séchage. Le lait peut aussi être concentré en enlevant 70% de son contenu en eau, sans faire appel à des procédés thermiques comme l’évaporation [56].
L’osmose inverse permet de concentrer tous les constituants du lait dans le rétentat (protéine, lactose, minéraux solubles et colloïdaux) et de générer un perméat constitué d’eau et de solides dissouts à l’état de trace. Dû à la présence de ces traces de solides dissous, le perméat généré doit généralement subir une autre étape de filtration d’osmose inverse (étape de polissage) avant d’être réutilisé comme eau de procédé, car il ne correspond pas aux standards de qualité de l’eau purifiée [57]. Les cibles de qualité dépendent du type de réutilisation de l’eau prévu, soit pour les nettoyages en place, l’alimentation des refroidisseurs ou des bouilloires ou encore pour générer de l’eau potable [57, 58]. Par exemple, pour l’eau potable, les valeurs de carbone organique total doivent être inférieures à 2 mg/L. Pour l’alimentation des bouilloires, la conductivité doit être inférieure à 40 µS/cm [57].
1.3.3 La nanofiltration
La nanofiltration couvre un domaine de séparation intermédiaire entre l’ultrafiltration et l’osmose inverse. Les applications de la nanofiltration sont le dessalement du lactosérum ou le recyclage des solutions de lavage [59]. Cette technique a un impact particulier sur les minéraux, car le transfert d’ions à travers les pores de la membrane est basé sur la taille et sur la charge des ions. Alors que les cations et anions divalents (Ca+2, Mg+2, HPO4-2) sont
retenus à plus de 95% par répulsions électrostatiques, les ions Cl-, OH-, Na+ et K+ passent dans le perméat. Conséquemment à cette déminéralisation, la force ionique des rétentats est réduite, mais un transfert de calcium et phosphate de la phase soluble à micellaire est
24
observée [21]. La concentration par nanofiltration du lait est susceptible de modifier les aptitudes fromagères en raison de la concentration presque totale du lactose et du calcium.
1.3.4 L’ultrafiltration
L’ultrafiltration de lait écrémé permet de concentrer autant les caséines que les protéines sériques, de même que les minéraux colloïdaux dans le rétentat. Le perméat généré contient de l’eau, du lactose, des minéraux solubles, de l’azote non protéique et des vitamines solubles. L’ultrafiltration est actuellement le procédé membranaire le plus utilisé dans l’industrie laitière [60] que ce soit pour la standardisation ou la concentration de produits et de coproduits comme le lactosérum [21]. Les avantages de l’ultrafiltration incluent une forte rétention des protéines, la possibilité d’obtenir une haute concentration en solide, et ce, avec une faible demande énergétique ainsi que l’absence d’exposition prolongée à la chaleur [13].
1.3.5 La microfiltration
La microfiltration utilise de faibles pressions d’opérations. Les applications de la microfiltration sont majoritairement l’épuration bactérienne et le fractionnement des protéines laitières qui permet de retenir sélectivement les caséines micellaires [21]. Dépendamment de la taille des pores de la membrane, différents constituants du lait peuvent être séparés, dont les cellules somatiques, les globules de gras, les bactéries, les micelles de caséines, la -caséine et la -lactoglobuline [15]. La microfiltration peut être utilisée pour la pré-concentration du lait de fromagerie dans le but de standardiser la teneur en protéine ou le ratio caséines : protéines totales du lait [61].
25
1.4 Utilisation de concentrés et éco-efficience en transformation laitière
Étant donné que l’utilisation des procédés baromembranaires pour la pré-concentration du lait de fromagerie relève d’une volonté des usines de transformation fromagère de diminuer leur impact environnemental, il est d’abord essentiel de définir le terme d’éco-efficience.L’évaluation de l’éco-efficience est un outil quantitatif qui permet de calculer le rapport entre la valeur économique d’un produit ou service et la somme des impacts environnementaux tout au long de son cycle de vie [62, 63].
Éco-efficience = 𝑆𝑜𝑚𝑚𝑒 𝑑𝑒𝑠 𝑖𝑚𝑝𝑎𝑐𝑡𝑠 𝑒𝑛𝑣𝑖𝑟𝑜𝑛𝑛𝑒𝑚𝑒𝑛𝑡𝑎𝑢𝑥𝑉𝑎𝑙𝑒𝑢𝑟 𝑑𝑢 𝑝𝑟𝑜𝑑𝑢𝑖𝑡 𝑜𝑢 𝑠𝑒𝑟𝑣𝑖𝑐𝑒
Pour améliorer l’éco-efficience d’un produit ou d’un service, il est possible d’une part d’augmenter sa valeur économique en conservant son impact environnemental constant. D’autre part, il est possible de garder la valeur du produit constante tout en diminuant la somme de ses impacts environnementaux.
En industrie laitière et fromagère, une augmentation de la valeur d’éco-efficience peut se traduire par une meilleure utilisation des constituants laitiers, par une diminution des rejets (perméat, lactosérum) et par une diminution des GES liés au transport du lait. Au Canada, les deux plus grands contributeurs aux GES dans l’industrie laitière sont la production du lait à la ferme et la consommation d’énergie reliée à la transformation du lait [64]. Les procédés thermiques comme la pasteurisation et l’évaporation sont les procédés les plus énergivores de l’industrie alimentaire [64]. Ainsi, la concentration du lait par osmose inverse présente plusieurs avantages qui sont susceptibles de diminuer l’impact environnemental, dont une consommation énergétique réduite de 60% en comparaison avec l’évaporation [65] et une diminution du volume de lait transporté.
![Tableau 1: Composition générale du lait de vache et taille moyenne des constituants (adapté de [5, 12, 13])](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/18.918.123.778.494.843/tableau-composition-générale-vache-taille-moyenne-constituants-adapté.webp)
![Tableau 2: Composition minérale du lait de vache (adapté de [19]).](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/22.918.127.795.226.416/tableau-composition-minérale-lait-vache-adapté.webp)
![Figure 2: Les équilibres salins du lait entre les phases soluble et colloïdale (adapté de [22])](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/23.918.147.715.117.402/figure-équilibres-salins-lait-phases-soluble-colloïdale-adapté.webp)
![Figure 3 : Les étapes de fabrication du fromage cheddar (adapté de [14]).](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/26.918.345.575.118.544/figure-étapes-fabrication-fromage-cheddar-adapté.webp)
![Figure 4 : Les phases de la coagulation enzymatique du lait et la formation du réseau (adapté de [14])](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/27.918.133.790.318.568/figure-phases-coagulation-enzymatique-lait-formation-réseau-adapté.webp)
![Figure 5: Schéma d’un procédé baromembranaire simple (source : [54, 55]).](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/36.918.231.698.763.1032/figure-schéma-procédé-baromembranaire-simple-source.webp)
![Tableau 3 : Caractéristiques et champs de fractionnement des principaux procédés baromembranaires (source : [15, 54])](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/37.918.145.779.741.935/tableau-caractéristiques-champs-fractionnement-principaux-procédés-baromembranaires-source.webp)
![Tableau 4 : Comparaison de la composition et des propriétés du lait écrémé, d’un rétentat d’UF (FCV : 2.5X) et d’un rétentat d’OI (FCV : 2.5X) (source : [11])](https://thumb-eu.123doks.com/thumbv2/123doknet/3464484.101210/45.918.126.778.451.702/tableau-comparaison-composition-propriétés-écrémé-rétentat-rétentat-source.webp)