HAL Id: hal-02604817
https://hal.inrae.fr/hal-02604817
Submitted on 16 May 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Programme de recherche et de conservation de
l’esturgeon européen Acipenser sturio : Bilan scientifique
et technique 2015
Philippe Jatteau, Philippe Jatteau
To cite this version:
Philippe Jatteau, Philippe Jatteau. Programme de recherche et de conservation de l’esturgeon eu-ropéen Acipenser sturio : Bilan scientifique et technique 2015. [Rapport de recherche] irstea. 2016, pp.61. �hal-02604817�
0
UR ECOSYSTEMES AQUATIQUES ET CHANGEMENTS GLOBAUX
Programme de recherche et de
conservation de l’esturgeon
européen Acipenser sturio
BILAN SCIENTIFIQUE ET TECHNIQUE 2015
30 Juin 2016
Philippe JATTEAU (coordination) IRSTEA GROUPEMENT DE BORDEAUX ETUDE N°191
EQUIPE POISSONS MIGRATEURS AMPHIHALINS 50 avenue de Verdun 33612 Cestas Cedex © Irstea R. Le Barh © Irstea Ph. Jatteau © IRSTEA/ML Acolas © IRSTEA/P. Jatteau © IRSTEA/P. Jatteau © IRSTEA/P. Jatteau
1
Ce projet a été cofinancé par l’agence de l’Eau Adour Garonne et le Conseil
Général de la Gironde, avec le soutien de la DREAL Aquitaine. Il s’inscrit dans
le cadre du Plan National d’Actions en faveur de l’esturgeon européen.
Référence à mentionner :
Pour l’ensemble du document :
Jatteau Ph. Coord., 2016. Programme de recherche et de conservation de l’esturgeon européen Acipenser sturio - Bilan scientifique et technique 2015. Irstea Bordeaux, Etude N° 191, 61p.
Pour les citations partielles :
Jatteau Ph., 2016. Faits marquants de l’année 2015, p.7-12. In Jatteau Ph. Coord. Programme de recherche et de conservation de l’esturgeon européen Acipenser sturio - Bilan scientifique et technique 2015. Irstea Bordeaux, Etude N° 191.
Chèvre P., Jacobs L., Gesset C., Polèse F., Bons S., Tillaut R., Gauthier J., 2016. Bilan des reproductions assistées réalisées en 2014 à partir du stock captif d’esturgeon européen, p.13-31. In Jatteau Ph. Coord. Programme de recherche et de conservation de l’esturgeon européen Acipenser sturio - Bilan scientifique et technique 2015. Irstea Bordeaux, Etude N° 191.
Bons S., Chèvre P., 2016. Qualité des semences en 2015, p.32-40. In Jatteau Ph. Coord. Programme de recherche et de conservation de l’esturgeon européen Acipenser sturio - Bilan scientifique et technique 2015. Irstea Bordeaux, Etude N° 191.
Acolas M.L., Le Barh R., Roques S., Gazeau C., Jatteau P., Mas L., Michelet N., Bigot J.F., Ballion B., 2015. Suivi de la population d’esturgeons européens en milieu naturel en 2015, p.41-52. In Jatteau Ph. Coord. Programme de recherche et de conservation de l’esturgeon européen Acipenser sturio - Bilan scientifique et technique 2015. Irstea Bordeaux, Etude N° 191.
Gardes C., Jatteau Ph., 2016. Action de communication en 2015 dans le cadre du Plan National d’Actions, p.53-59. In Jatteau Ph. Coord. Programme de recherche et de conservation de l’esturgeon européen Acipenser sturio - Bilan scientifique et technique 2015. Irstea Bordeaux, Etude N° 191.
2
Résumé
Ce rapport présente le bilan scientifique et technique des actions de recherche et de conservation menées par Irstea dans le cadre du Plan National d’Actions en faveur de l’esturgeon européen. Ces travaux ont été financés par l’Agence de l’Eau Adour Garonne et le Conseil Général de la Gironde avec le soutien de la DREAL Aquitaine. Ce document présente les résultats des essais de reproductions assistées ; une synthèse sur la qualité des gamètes mâles ; le suivi de la population en milieu naturel via les campagnes d’échantillonnage « Sturat » en estuaire ; une synthèse des actions de communication. De nouveaux aménagements ont été réalisés en 2015. Les plus importants ont concernés le bâtiment Sturio 1, avec la fin de l’aménagement des bacs destinés à la reproduction.
La saison de reproduction a débutée le 11 mai avec les pré-sélections des géniteurs. Les tentatives de reproduction assistée se sont déroulées du 17 juin au 22 juillet. Malgré tous les efforts déployés, aucune ovulation n’a été obtenue.
Abstract
This report presents the assessment of scientific and technical research and conservation actions by Irstea in the framework of the National Action Plan for the European sturgeon. These works were funded by the Adour Garonne Water Agency and the General Council of the Gironde with the support of Dreal Aquitaine. This document presents the results of the assisted reproductions; a synthesis on the quality of the male gametes; the monitoring of the population in the wild via «Sturat» sampling campaigns in the estuary; a summary of the communication actions.
New developments have been made in 2015. The most important concerned the Sturio 1 building, with the setting up of the tanks dedicated to the reproduction purposes.
The reproduction season began on 11 May with pre-selections of spawners. Reproduction attempts were realized from 17 June to 22 July, but all efforts remained unsuccessful.
3
Sommaire
Résumé ... 2
Abstract ... 2
Introduction ... 5
Chapitre I : Faits marquants de l’année 2014 ... 7
I.1 Bilan des reproductions... 7
I.2 Aménagements - Equipements ... 7
Chapitre II : Réalisation des reproductions assistées en 2015 à partir du stock captif d’esturgeon européen (Action 15) ... 13
II.1 Introduction ... 13
II.3 Matériel et méthodes... 14
II.3.1 Présélection ... 14
II.3.2 Procédure de suivi de la maturation ... 16
II.4 Résultats ... 18
II.4.1 Biométrie ... 18
II.4.2 Présélection des géniteurs ... 20
II.4.3 Résultats de la première biopsie de contrôle ... 22
II.4.4 Résultats de la deuxième biopsie de contrôle ... 22
II.4.5 Résultats des troisième et quatrième biopsies de contrôle ... 27
II.4.6 Résultats de la cinquième biopsie de contrôle ... 29
II.5 Bilan de la saison de reproduction 2015 ... 29
Chapitre III : Qualité des semences en 2015 (Action 23) ... 32
III.1 Introduction ... 32
III.2 Matériels et méthodes ... 32
III.3 Résultats et Discussion ... 35
III.3.1 Prélèvement du 18/06/15 ... 35
III.3.2 Prélèvement du 23/07/15 ... 37
III.4 Conclusions ... 39
III.5 Congélation de semences ... 40
Chapitre IV : Suivi de la population d’esturgeons européens en milieu naturel en 2015 ... 41
IV.1 Campagne d’échantillonnage « Sturat » dans l’estuaire de la Gironde ... 41
IV.2 Suivi des captures accidentelles ... 48
Chapitre V : Actions de communication en 2015 dans le cadre du Plan National d’Actions .. 53
V.1 Actions de communication grand public – présence dans les médias ... 53
V.1.1 Presse format papier... 53
V.1.2 Actualités WEB ... 53
V.1.3 Actualités radio ... 54
V.1.4 Actualités télévision ... 54
V.1.5 Conférence - exposition grand public ... 54
V.1.6 Partenariat ... 55
V.2 Visites de la station ... 55
V.3 Actions de communications scientifiques ... 57
V.3.1 Colloque ... 57
V.3.2 Publications ... 57
V.3.3 Séminaire Irstea - IGB ... 58
5
Introduction
L’esturgeon européen, espèce emblématique de grands bassins européens comme la Gironde, l’Elbe ou le Guadalquivir, est classé en danger critique d’extinction selon les critères de l’IUCN, et un plan d’actions pour la protection et la restauration de l’espèce a été rédigé sous l’égide de la Convention de Berne (Rosenthal et al., 2010). Les principales directives ont été reprises et déclinées dans 2 plan nationaux d’actions, en France (Dreal, 2011) et en Allemagne (Gessner et al., 2010). La dernière population est issue du bassin de la Gironde et la dernière reproduction naturelle date de 1994. Depuis cette date un stock ex situ a été constitué afin de préserver des spécimens dans l’optique de soutenir la population naturelle (Williot et al., 1997). Grace aux reproductions assistées réalisées à partir du stock de géniteurs captifs des alevinages réguliers ont été réalisés depuis 2007. (Rouault et al., 2008; Rochard, 2009; 2011; Acolas, 2012; 2013; Jatteau, 2014; 2015). Au total plus de 1 790 000 individus, larves ou juvéniles, ont été relâchés entre 1995 et 2014 dans le bassin de la Gironde pour soutenir la population.
Depuis 2012, l’association Migado (Migrateurs Garonne Dordogne) a en charge la gestion du stock captif et les opérations de lâcher. Les reproductions, la production de larves pour le repeuplement, la réalisation des expérimentations et les suivis en milieu naturel sont sous la responsabilité d’Irstea.
Les actions présentées dans ce rapport sont pour partie numérotées selon les actions proposées pour contribuer au plan international de restauration de l’esturgeon européen par Rochard et Williot (2006). Ce rapport présente (1) une synthèse des faits marquants de l’année 2015, (2) les résultats des reproductions assistées, (3) la sélection des semences, (4) le suivi de la population en milieu naturel via les campagnes d’échantillonnage « Sturat » et l’analyse des déclarations de captures accidentelles, et (5) une synthèse des actions de communication.
7
Chapitre I : Faits marquants de l’année 2014
Jatteau Ph.
I.1 Bilan des reproductions
La saison 2015 est la seconde, après 2010, où les essais de reproduction contrôlée n’ont pas abouti. Sur les 5 femelles présélectionnées, une seule présentait véritablement des indicateurs positifs. Par contre les 5 femelles présentaient un faible taux de croissance, voire négatif pour 3 d’entre elles.
La relation prise de poids / taux de croissance et capacité des femelles à se reproduire, est une fois de plus mise en évidence. L’objectif pour l’avenir est de déterminer un niveau minimum de croissance nécessaire pour la réussite de la reproduction. Les premières analyses montrent que la moyenne des taux de croissance (SGR) des femelles qui se sont reproduites depuis 2007 est de 0,042, alors que celui des femelles présélectionnées mais sans reproduction est de 0,020. Mais ces valeurs moyennes cachent de fortes disparités entre les femelles et même pour une femelle au cours des différentes saisons. Une analyse plus poussée est donc nécessaire pour utiliser cet indicateur.
Seize mâles ont été présélectionnés. La qualité des spermes a été plutôt mauvaise hormis pour l’un d’entre eux. Seulement 3 mâles avaient un taux de croissance positif, dont un seul supérieur à 0,04. Comme pour les femelles, les mâles présélectionnés en 2015 n’étaient pas dans des conditions favorables pour la reproduction.
I.2 Aménagements - Equipements
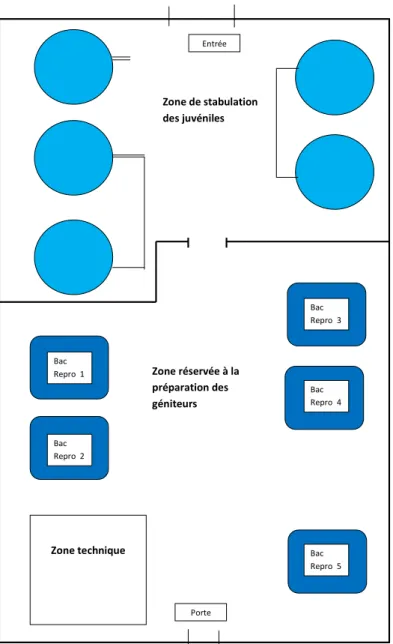
Après la réfection du bâtiment Sturio 1 terminée en 2014, les aménagements intérieurs ont été réalisés en 2015. Pour rappel, la vocation du bâtiment sera double, avec une partie dédiée à la stabulation des juvéniles et une seconde réservée à la stabulation et au conditionnement final des géniteurs avant la reproduction (Figure 1).
Les « bacs reproduction » (BR) 3, 4 et 5 ont entièrement été refaits. Une dalle béton a été faite pour accueillir les BR 1 et 2 (Figure 2).
Les circuits fermés ont été installés. Les 5 bacs étaient opérationnels en fin d’année 2015 (Figure 3).
8
Figure 1: Schéma du projet d’aménagement final du bâtiment Sturio 1
Figure 2 : Le Bac 1 en cours de réfection (Août 2015) - (© Irstea, Ph. Jatteau)
Zone de stabulation des juvéniles Entrée Bac Repro 2 Bac Repro 5 Bac Repro 4 Zone technique Porte Bac Repro 1 Bac Repro 3 Zone réservée à la préparation des géniteurs
9
Figure 3 : Le circuit fermé du BR1 en place. - (© Irstea, Ph. Jatteau)
Les systèmes de thermorégulation ont été complétés, ainsi tous les bacs sont équipés de systèmes indépendants (Figure 4).
10 Les circuits fermés ont été équipés de débimètres pour contrôler le débit transitant dans les biofiltres (Figure 5).
Figure 5 : Un débimètre en place - (© Irstea, Ph. Jatteau)
La zone technique a été entièrement aménagée en 2015. Cet espace situé à proximité immédiate des bacs accueillants les géniteurs en phase finale de maturation, permet de réduire au minimum les déplacements des géniteurs et offre un confort de travail en toute sécurité pour les poissons.
La zone technique (Figure 6) est équipée de tables inox fixes et roulantes et de la table d’opération (pendant la période de reproduction).
11
Figure 6 : Deux vues de la zone technique - (© Irstea, Ph. Jatteau)
Une lampe de chirurgie complète l’équipement de cette espace (Figure 7).
12 Les autres investissements marquants réalisés en 2015 concernent l’achat d’un groupe froid mobile, pour la thermorégulation de petites unités d’élevage (Figure 8), et l’acquisition d’une mallette permettant la réalisation de mesures de paramètres physicochimiques pour le suivi de la qualité d’eau (Figure 9). Enfin, le suivi d’un nouvel indicateur sanguin,
l’hématocrite, a été préconisé par Sylvie Dufour (MNHN) lors de la réunion bilan de la saison 2014 (Libourne, 24-26 novembre 2014). Une centrifugeuse dédiée à cette analyse a donc été achetée en 2015 (Figure 9).
Figure 8 : Le groupe froid Teco TK 600 - (© Irstea, Ph. Jatteau)
Figure 9 : La mallette multiparamètres et la centrifugeuse pour hématocrite - (© Irstea, Ph.
13
Chapitre II : Réalisation des reproductions assistées en 2015
à partir du stock captif d’esturgeon européen (Action 15)
Chèvre P., Jacob L., Gesset C., Polèse F., Bons S., Tillaut R., Gauthier J.
II.1 Introduction
Dans les années 1990, un stock captif d’esturgeon européen a été constitué par Irstea. Il s’agit du seul stock existant en capacité de se reproduire. Il a été hébergé dans un bâtiment dédié (Sturio 1) de la station d’expérimentation de Saint Seurin jusqu’en 2012. Ce stock a été ensuite transféré dans un nouveau bâtiment (Sturio 2) permettant de disposer notamment de plus d’espace pour les animaux pour faire face à l’accroissement en poids, l’augmentation des effectifs par l’arrivée de nouvelles cohortes. La gestion de la partie élevage est confiée depuis 2012 à l’association MIGADO. Irstea intervient sur les adultes uniquement au printemps pour la mise au point des reproductions artificielles. Une partie du bâtiment Sturio 1 a été modifiée, rénovée et adaptée pour la gestion des reproductions. Au printemps, les géniteurs y sont transférés après présélection pour la réalisation des reproductions artificielles.
Le faible nombre et la valeur de géniteurs, le nombre réduit de séquences de pontes induisent une gestion précautionneuse des géniteurs et rendent délicat l’obtention de maturations.
Les procédures utilisées s’appuient sur celles décrites dans la littérature (Doroshov et al., 1983; Conte et al., 1988; Dettlaff et al., 1993; Williot, 1997; Williot et al., 2007; Rouault et
al., 2008). Elles sont progressivement adaptées en fonction des spécificités de l’espèce et
plus particulièrement de l’historique des animaux et des modalités spécifiques de conservation.
Les femelles montrent une diversité d’états de maturation qui obligent à une gestion au cas par cas des modalités de reproduction. La faiblesse des effectifs ne permet pas comme en élevage classique de sélectionner les individus présentant les meilleures chances de succès. Différents stimulations environnementales et hormonales doivent être appliquées pour l’obtention des gamètes. Leur efficacité est dépendante des méthodologies employées, de l’état de maturation des animaux, et de leur sensibilité aux traitements.
Des indicateurs morphométriques et physiologiques sont utilisés chez les femelles pour le choix des dates de stimulation. Les travaux menés visent à déterminer les meilleurs critères pour l’optimisation de la production des gamètes.
L’obtention et la qualité des gamètes sont étroitement dépendantes de la gestion des conditions environnementales annuelles, du taux d’engraissement des animaux et de leur état de santé. Malheureusement l’état du cheptel s’est fortement dégradé ces deux dernières années (perte de la moitié du cheptel, diminution de poids).
On a ainsi observé un manque de sensibilité des femelles aux traitements pour induire l’ovulation, la déclaration de pathologies, des retards de maturation (particulièrement renforcés en 2015).
14
II.3 Matériel et méthodes
II.3.1 Présélection
II.3.1.1 Justification de l’étape de présélection
Les modalités de gestion du stock captif hors période de reproduction, en particulier l’alimentation et la gestion thermique interviennent de façon déterminante dans le développement sexuel et la qualité des gamètes. Les géniteurs mâles semblent avoir la capacité de se reproduire chaque année alors que le rythme est plutôt biennal chez les femelles.
Il n’est pas possible de détecter les poissons pouvant se reproduire par simple observation visuelle. Ils ne peuvent pas se reproduire seuls dans les bassins. La captivité entraine un arrêt de la maturation au cours des derniers stades précédant l’émission des gamètes.
II.3.1.2 Procédure de présélection
L’étape de pré sélection consiste à rechercher dans le stock captif les poissons aptes à se reproduire.
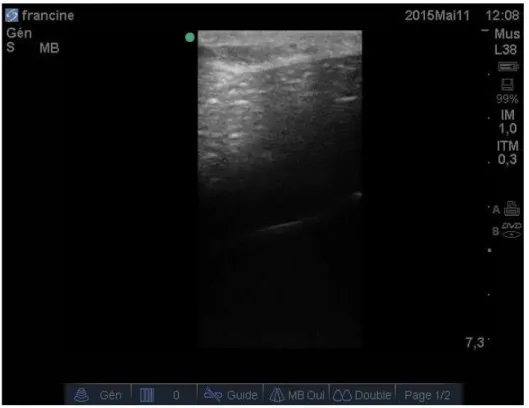
Les présélections ont été réalisées les 11 et 12 mai 2015 dans le bâtiment Sturio 2. Les poissons sont pêchés un par un, puis endormis. Ils sont d’abord identifiés (par lecture de la marque magnétique) et pesés. Ils sont ensuite placés en position dorsale sur une table de chirurgie. Leur respiration est assurée par une injection d’eau dans la bouche qui ressort par les branchies. Les poissons sont alors d’abord observés (description de l’état physique, pathologies externes), puis mesurés et échographiés (Figure 10). Les échographies permettent de révéler la présence d’ovocytes chez les femelles (Figure 11), ainsi que les gonades mâles suffisamment développées.
15
Figure 11 : Exemple d’une image obtenue lors de l’échographie de Francine le 11 mai 2015.
Ils sont également soumis à un prélèvement sanguin (Figure 12). Les poissons identifiés comme apte à se reproduire dans la saison sont transférés les bassins du bâtiment Sturio 1, dans la partie spécialement dédiés aux reproductions.
16 Pour les femelles ayant été sélectionnées en 2014 (Julie, Léonce, 212, Martine, Jeanne) il a été décidé de ne pas les sélectionner, quel que soit le résultat de l’échographie, afin de respecter un délai de 2 années entre 2 périodes de reproduction.
II.3.2 Procédure de suivi de la maturation
Le suivi de l’état de maturation des femelles est nécessaire pour vérifier leur aptitude à la reproduction, identifier le meilleur stade pour provoquer l’ovulation, orienter les modalités de gestion des facteurs déclenchants (salinité, température, injections hormonales).
L’évolution favorable des indicateurs dans le temps renseigne sur la bonne capacité des animaux à maturer. Il est donc nécessaire de multiplier les contrôles (de 2 à 3, voire 4) pour s’en assurer.
Ces suivis sont réalisés grâce à des biopsies. Elles permettent de prélever des ovocytes qui sont utilisés directement pour déterminer des critères morphométriques, ou mis en culture pour évaluer la dynamique de maturation. Des prises de sang sont également réalisées lors des biopsies pour analyser 2 indicateurs plasmatiques.
Le suivi d’un nouvel indicateur concernant les mâles a débuté en 2015. Il s’agit du pH de l’urine et/ou du sperme.
II.3.3.1 Biopsies de contrôle
La captivité entraine un blocage du développement des gamètes avant la fin de maturation. Le recours à une double stimulation environnementale et hormonale est nécessaire pour l’obtention des gamètes. Il faut toutefois que les follicules ovocytaires soient capables de répondre au traitement. Cette capacité est évaluée à partir du suivi d’indicateurs de maturation des ovocytes. Ils sont de différents types :
- morphométriques (taille et position du noyau dans les ovocytes) et - physiologiques (capacité à la maturation in vitro des ovocytes).
L’obtention des critères morphométriques, diamètre des ovocytes et position du noyau dans l’ovocyte (Oocyte Polarization Index -OPI) a été décrite précédemment (Chèvre et al., 2015). En élevage classique, les indicateurs morphométriques sont souvent privilégiés car rapides à mettre en œuvre. Les effectifs importants de géniteurs permettent de sélectionner ceux présentant les critères de maturation les plus favorables. Cela n’est pas réalisable pour le stock captif d A. sturio, compte tenu de la faiblesse des effectifs. Ces indicateurs manquent de fiabilité et les critères de référence ne sont pas forcément adaptés au stock d’esturgeon européen conservé dans des conditions spécifiques.
Goncharov et al. (2009) indique que le critère de dynamique de maturation in vitro est plus informatif pour le choix des femelles en sélection finale que l’OPI. La maturation in vitro consiste à placer des ovocytes dans un milieu de culture contenant de la progestérone. Ce test permet de déterminer le pourcentage d’ovocytes ayant maturé et d’estimer la dynamique de maturation.
Ces indicateurs n’ont pas la même capacité de prédiction et aucun n’est complètement fiable. L’information apportée par les cultures in vitro semble la plus fiable.
17 L’évolution favorable des indicateurs dans le temps renseigne sur la bonne capacité des animaux à maturer. Toutefois les contrôles réalisés par biopsie doivent être limités car invasifs. Ils peuvent intervenir défavorablement dans le développement de la maturation et présenter des risques sanitaires pour les poissons.
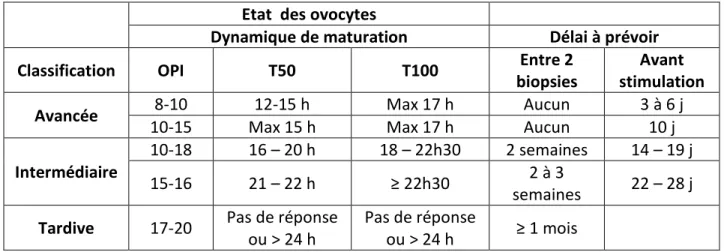
Les travaux de recherche menés par Irstea sur la reproduction artificielle chez A. sturio portent sur la détermination des critères de maturation et le contrôle de la reproduction. Un premier guide d’aide à la décision pour le suivi des maturations et l’induction des pontes (Tableau 1) a été proposé (Chèvre et al., 2015). Il associe les données issues des indicateurs morphométriques, mais également dynamiques. Les effectifs de femelle en maturation avancée étant réduits (de 4 à 8 par an) la validation des critères proposés ne pourra intervenir qu’après répétition des essais de reproduction sur plusieurs années.
Tableau 1: Détermination des groupes de maturité des femelles en fonction des critères
morphométriques et dynamiques, et calendrier associé des biopsies et des stimulations
Etat des ovocytes
Dynamique de maturation Délai à prévoir Classification OPI T50 T100 Entre 2
biopsies
Avant stimulation Avancée 8-10 12-15 h Max 17 h Aucun 3 à 6 j
10-15 Max 15 h Max 17 h Aucun 10 j
Intermédiaire
10-18 16 – 20 h 18 – 22h30 2 semaines 14 – 19 j 15-16 21 – 22 h ≥ 22h30 2 à 3
semaines 22 – 28 j
Tardive 17-20 Pas de réponse ou > 24 h
Pas de réponse
ou > 24 h ≥ 1 mois
II.3.3.2 Suivi des indicateurs plasmatiques chez les femelles
L’évolution des concentrations en œstradiol (augmentation durant les phases de la vitellogénèse, et diminution durant les derniers stades de maturation) a été observée chez l’esturgeon par de nombreux auteurs (Amiri et al., 1996; Doroshov et al., 1997; Webb et al., 1999; Linares-Casenave et al., 2003).
L’œstradiol (E2) produit par les cellules folliculaires des ovocytes intervient dans la production de vitellogénine par le foie. Les concentrations augmentent fortement en stade 2 et 3 de la vitellogénèse, puis décroissent en fin de stade 4. C’est à cette période (maturation finale) que les poissons sont les plus sensibles aux traitements permettant de provoquer l’ovulation.
La mesure régulière des concentrations d’E2 et de calcium total (associé à la vitellogénine pour la constitution du vitellus) permet de suivre le développement hormonal des femelles. Il est ainsi possible de détecter les femelles entrées en vitellogénèse et de ne commencer les biopsies pour le suivi des maturations qu’au stade le plus informatif (ovocytes au stade 4).
Il y aurait un grand intérêt à vérifier si les indicateurs sanguins peuvent également apporter des éléments sur la capacité des femelles à ovuler. Cela demande de réaliser un travail préalable de comparaison de ces indicateurs avec ceux déjà éprouvés (indicateurs biométriques et cultures in vitro).
18
II.4 Résultats
II.4.1 Biométrie
Seulement 29 poissons ont été pesés sur un total de 37 géniteurs. Pour 8 poissons l’échographie a été réalisée dans le bac.
Taux de croissance journalier (TCJ %) = [((Wn-Wn-1)/Wn-1)*100]/365 Taux de croissance spécifique (SGR %) = (ln(Wn)-ln(Wn-1)*100)/365
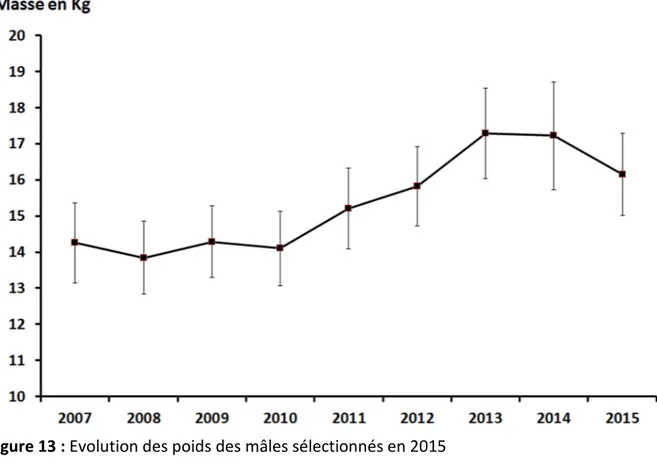
L’évolution des poids depuis 2007, des mâles sélectionnés en 2015, montre une diminution après une stagnation en 2014 (Figure 13).
Figure 13 : Evolution des poids des mâles sélectionnés en 2015
Un seul mâle présente un SGR significativement positif (0,04) et 6 autres un taux de croissance nul ou légèrement négatif. Les autres (9 poissons) ont un taux de croissance négatif.
19
Figure 14 : Evolution des poids des femelles sélectionnées en 2015
Les taux de croissance des femelles sont plutôt homogènes, entre -0,01 et +0,02.
Il apparait donc que les poissons sélectionnés en 2015 ne présentent pas un bon taux d’engraissement, ce qui n’est pas un facteur favorable pour la réussite des reproductions. Ceci est plus marqué chez les mâles. Ils sont pour la plupart utilisés chaque année pour les reproductions entrainant un arrêt prolongé de l’alimentation.
20
II.4.2 Présélection des géniteurs
Au final 16 mâles (Tableau 2) et 5 femelles (Tableau 3) ont été présélectionnés et transférés dans le bâtiment Sturio 1 pour les reproductions.
Tableau 2 : Caractéristiques des mâles présélectionnés
Nom Cohorte Poids 2015 SGR % Observations échographe
Hervé 1995 25 800 -0,02 gonade hétérogène - précoce Mariette 1987-88 16 800 -0,04 Belle gonade - précoce
Justin 1984-85 25 300 -0,03 gonade hétérogène - précoce Carol 1994 11 720 -0,02 Belle gonade, précoce Isabeau 1994 9 860 0,01 Grosse gonade - précoce Delphine 1992 15 160 0 Grosse gonade - précoce
365 1995 12 760 -0,03 Gonade assez homogène – milieu
de saison
163 1995 13 980 -0,01
Pascal 1994 16 520 -0,02
364 1995 11 860 0,04 Petite gonade - tardif Martinien 1995 20 100 -0,01 Peu précoce - milieu saison Ascension 1988 13 060 -0,04 Gonade hétérogène
Bleu 1988 16 720 0,01 Grosse gonade – stade avancé -
précoce
Emeline 1988 15 360 -0,01 Très précoce Gilles 1995 17 900 -0,01 Précoce
21
Tableau 3 : Caractéristiques des femelles présélectionnées
Nom Cohorte Poids 2015 SGR % Observations échographe
DN 1988 21 600 -0,01 Belle gonade – ovocytes moyens Francine 1994 13 300 0,01 Grosse gonade – beaucoup de gros
ovocytes
Fulbert 1995 25 260 0,01 Ovocytes de taille moyenne Jules 1994 26 320 -0,02 Ovocytes moyens
Lucette 1994 14 060 -0,01 Grosse gonade – beaucoup de gros
ovocytes
Chez les femelles, Francine apparait la plus avancée au vue de l’échographie. Ceci est confirmé avec les résultats des analyses de sang. (Tableau 4). Les femelles Fulbert, Jules et Lucette, apparaissent très en retard. Dn est intermédiaire.
Tableau 4 : Résultats des analyses de sang – prélèvements des 11 et 12 mai 2015 E2 en pg/ml Ca en mg/l DN 35 785 193 Francine 20 378 167 Fulbert 41 267 198 Jules > 45 000 199 Lucette 40 074 199
22
II.4.3 Résultats de la première biopsie de contrôle
La première biopsie de contrôle a été réalisée le 25 mai 2015 sur les 5 femelles conservées dans le bâtiment Sturio 1. Des prises de sang ont également été réalisées.
Une seule femelle Francine, montre des critères de maturation intéressants, à l’exception de l’OPI qui est élevé (Tableau 5).
On constate une maturation très peu avancée pour 4 des 5 femelles. Pour ces poissons les taux d’E2 sont supérieurs à 30 000 pg/ml, les ovocytes sont de petite taille (inférieure ou égale à 2,5 mm, pour une taille optimale proche de 3 mm). Les OPI sont élevés (supérieurs à 20) et aucune réponse n’est obtenue en culture in vitro (absence de maturation des ovocytes in vitro durant 24h).
Les ovocytes de la femelle Jule sont les moins avancés. Les ovocytes de très petite taille (inférieure à 2 mm), et la valeur de l’OPI > 20 %, traduisent une impossibilité à atteindre l’ovulation dans la saison. La femelle n’a donc pas été conservée pour les reproductions, mais re-transférée dans le bâtiment Sturio 2 pour y poursuivre son grossissement.
Dans nos conditions d’élevage, les génitrices avec maturation retardée représentent en moyenne 30 % de l’effectif. Le taux de 80 % observé cette saison est donc anormalement élevé. Il est probablement lié à la faiblesse des croissances décrite précédemment.
Au vu de ces premiers résultats, il a été décidé d’attendre un mois pour les trois femelles les plus tardives.
Francine a été transférée le 29 mai dans le BR4 (seule) avec une augmentation de la température passant progressivement de 14 à 15,5°C (Figure 2x6). Il a été décidé de vérifier assez rapidement l’évolution de la maturation chez Francine.
Tableau 5 : Résultats de la première biopsie de contrôle (25 mai 2015) Caractéristiques des ovocytes
Indicateurs Plasmatiques Maturation in vitro Taux max Nom Diamètre mm OPI T50 % Durée E2 pg/ml Ca mg/ml Francine 2,7 16,9 16h 100 18h 15 513 139 Lucette 2,4 22,6 >45 000 165 Fulbert 2,5 21,7 36 102 168 DN 2,2 22,3 >45 000 156 Jules 1,9 28,5 >60 000 184
II.4.4 Résultats de la deuxième biopsie de contrôle
II.4.4.1 Biopsie
23 On constate une évolution significative de l’OPI qui, passe de 16,9 à 13,8 ce qui est encore un peu élevé (7 à 10 recherché). Les résultats issus des cultures restent stables et ne s’améliorent pas (optimum recherché T50 à 14h et T100 à 16h).
Tableau 6 : Résultats de la deuxième biospie de contrôle (7 juin 2015) Caractéristiques des ovocytes
Indicateurs Plasmatiques Maturation in vitro Taux max Nom Diamètre mm OPI T50 % Durée E2 pg/ml Ca mg/ml Francine 2,7 13,8 15h30 100 17h30 4 556 101
Les indicateurs de maturation n’étant pas optimaux, il a été décidé d’attendre une dizaine de jours avant stimulation et d’augmenter la température pendant cette période (Figure 15). Un délai d’attente plus important pouvait poser problème pour les mâles conservés en eau douce, compte tenu de leur mauvais état de forme.
24
II.4.4.2 Choix des géniteurs – Séquence 1
Seule Francine a donc été retenue pour une première tentative de reproduction.
Un groupe de 7 mâles sur les 16 conservés a été passé en eau douce (BR3). Justin, Norman, Delphine, Carol le 22 mai et 163, Pascal Mariette le 29 mai. Il a été constitué tenant compte de l’état de forme des poissons, leur intérêt génétique pour un croisement avec Francine, l’état de maturation des gonades observé à l’échographie, ainsi que leur potentiel reproducteur fondé sur les résultats des collectes des années précédentes.
II.4.4.3 Préparation finale des géniteurs et stimulation hormonale
Le déclenchement de l’ovulation est provoqué par une double stimulation thermique et hormonale.
Pour les mâles, une montée progressive a été effectuée en 2 semaines passant de 14 à 16°C (Figure 16). Afin de provoquer un choc plus important la température a été redescendue à 15°C juste avant l’injection et portée à 18°C au moment de l’injection.
Figure 16 : Profil thermique des mâles retenus pour la séquence 1.
Une moyenne de température de 15,8°c a été maintenue du 8 au 15 juin, avec une montée jusqu’à 17, 4 °C le 12 juin. L’objectif était d’accélérer le développement de la maturation de
25 Francine. Une montée finale en température de 4,6°C a ensuite été réalisée du mardi 16 juin au jeudi matin 18 juin passant de 14,8 à 19,4°C.
Francine a reçu une double injection d’hormone LHRHa le 17 juin (40 et 80 µg/kg) à 12 heures d’intervalle. Francine a conservé le comportement qu’elle avait depuis son arrivée dans Sturio 1, c'est-à-dire une nage active.
Les mâles ont été injectés à la LHRHa en une seule fois le 17 juin à la concentration de 30 µg/kg.
II.4.4.4 Reproduction – Séquence 1
L’ovulation n’a pas été obtenue dans les délais voulus (environ 33h après première injection). Un contrôle de l’ovulation par palpation a été réalisé le 18 juin à 17h30 sans succès. La femelle a mal supporté la manipulation (forte accélération de la fréquence des battements operculaires). Le suivi d’ovulation spontanée dans le bac s’est poursuivi visuellement (observation au travers d’une vitre d’observation) jusqu'à minuit.
Un contrôle par biopsie réalisé le 19 juin a montré que le processus d’ovulation était engagé mais pour une quantité très limitée d’ovocytes (OPI de 5,9).
La femelle a ovulé spontanément dans le bac et de façon très partielle et retardée dans la nuit du 20 juin. Une petite partie des ovocytes entrés en atrésie a été récupérée par massage abdominal.
Le 23 juin Francine a montré un comportement apathique. Il était prévu de lui faire une échographie le soir même pour vérifier l’état des gamètes. Lors du contrôle des traces d’inflammation ont été décelées à proximité des écussons ventraux et de l’orifice urogénital faisant suspecter une infection bactérienne. Un double traitement corticoïde et antibiotique lui a été administré.
Son état est resté préoccupant jusqu’au 27 juin, puis s’est clairement amélioré du 29 au 30 juin ou elle a retrouvée toute sa vivacité.
L’échec de l’ovulation peut s’expliquer par une injection trop précoce (de quelques jours). Il est également possible que les traitements hormonaux et thermiques aient été moins efficaces en raison de son mauvais état de santé. Son manque de sensibilité aux traitements a pu être augmenté par la multiplication des sources de stress (lors des différentes biopsies et traitements). L’absence d’évolution positive du délai nécessaire à l’obtention de la maturation des ovocytes in vitro observé entre les 2 biopsies du 25 mai et du 7 juin, renforce cette hypothèse.
Un seul mâle Delphine sur les 7 injectés a donné de la semence de qualité.
On peut noter : une absence de production de semence pour Pascal et Norman, une production de semence inactive pour Mariette, une durée de vie très faible après activation de la semence pour Carol 163 et Justin (Voir chapitre III).
La faiblesse des réponses après stimulation hormonale et la mauvaise qualité générale des semences récoltées, ne sont pas normales. La période a pu intervenir (début de saison de reproduction) mais la cause principale est très probablement la perte de poids importante des animaux avant reproduction.
A contrario, le bon résultat de Delphine n’est pas lié à une bonne croissance. Le poids de ce mâle est resté stable entre 2014 et 2015.
26 Lors de la manipulation des mâles pour les suivis et la récolte des semences, Justin et Ascension ont montré des traces d’irritation de la peau sous le ventre et un flanc. Ces symptômes ont, par le passé, souvent été observés après passage en eau douce, avec une intensité variable suivant le temps de séjour. Il a donc été décidé de re-transférer Justin en eau salée (11‰) ce qui classiquement intervenait favorablement pour la désinfection des lésions et la prévention d’autres pathologies plus lourdes. Malheureusement son état de santé s’est très rapidement dégradé, et il a été retrouvé mort le 22 juin au matin.
L’autopsie a montré une très forte infection bactérienne interne (possiblement Serratia
liquefaciens). Justin avait perdu 2,6 kg depuis sa dernière pesée la saison précédente. Il est
probable que cela l’ait fragilisé, le rendant plus sensible aux pathologies.
II.4.4.5 Suivi du pH de l’urine et de la semence
Une expérience préliminaire a été réalisée sur un petit groupe de poissons pour vérifier la possibilité de sélection des mâles en fonction du pH de l’urine et des semences. Il est en effet établi que le pH des semences augmente en fonction de l’avancée de la maturation. Les références sont :
Absence de maturation : pH de proche 6,5, Poisson en maturation : pH= 7
Poisson en maturation finale : pH>= 7,5 et plus
Aucune concordance n’a été trouvée entre le pH de l’urine et le pH des semences. Cela reste à vérifier à nouveau dans de meilleures conditions. En effet, l’effectif testé était petit (5 sujets) et en mauvais état de forme. De plus, il y a eu des difficultés pour le prélèvement d’urine (volumes très faibles récoltés).
Pour 3 mâles sur 4 ayant donné de la semence, on trouve une corrélation entre pH élevés et maturation avancée. C’est le cas pour Delphine, Carol et 163 (pH compris entre 7,7 et 8). Par contre cela n’est pas le cas pour le male Justin avec un pH de 6,88. Il est toutefois possible que Justin ne se soit pas trouvé dans un stade de maturation encore très avancé.
Il ne semble pas y avoir de corrélation entre pH élevé et qualité des semences.
On trouve bien un pH bas (compris entre 6 et 7,1) chez les poissons n’ayant pas donné de semence : Pascal Mariette et Norman.
La vérification du PH dans l’urine des mâles peut être une voie intéressante pour le choix des mâles en sélection finale. Toutefois cela impose une manipulation supplémentaire stressante pour les animaux, déjà soumis à différents traitements (passage en eau douce, réchauffement, injection d’hormone, récolte de semence). Elle doit donc être réservée à des animaux en bon état, ce qui n’était pas le cas cette année.
Ce premier test a donc été réalisé à minima et demande à être renouvelé dans de meilleures conditions.
27
II.4.5 Résultats des troisième et quatrième biopsies de contrôle
II.4.5.1 Biopsie
Une deuxième série de biopsies de contrôle a été réalisée les 21 juin, et 9 juillet, pour vérifier l’état d’avancement de la maturation des femelles Fulbert et Lucette et DN (Tableau
7, Tableau 8).
Tableau 7 : Résultats de la troisième biopsie de contrôle (21 juin 2015) Caractéristiques des ovocytes
Indicateurs Plasmatiques Maturation in vitro Taux max Nom Diamètre mm OPI T50 % Durée E2 pg/ml Ca mg/ml Lucette 2,5 15,6 0 19 506 158 Fulbert 2,6 14,6 >24h 83 24-33h 6 678 130 DN 2,3 18 0 23 817 149
Tableau 8 : Résultats de la quatrième biopsie de contrôle (9 juillet 2015) Caractéristiques des ovocytes
Indicateurs Plasmatiques Maturation in vitro Taux max Nom Diamètre mm OPI T50 % Durée E2 pg/ml Ca mg/ml Lucette 2,5 12,9 10 45h 6 501 113 Fulbert 2,6 14,5 43 65 45h 1 503 94
A aucun moment les indicateurs ne sont apparus favorables. On constate une amélioration des indices de polarité des ovocytes pour Lucette et DN dans le temps. Ils restent toutefois encore élevés. Il n’y a pas d’évolution favorable pour Fulbert (stabilité des indices).
Les taux de maturation des ovocytes in vitro sont faibles pour les 3 femelles et les temps de maturation très élevés (optimum recherché de 100 % en moins de 14 heures). On constate même une dégradation de la capacité des ovocytes à maturer in vitro pour Fulbert dans le temps. Au 9 juillet les données sanguines révèlent que l’on se rapproche de la fin de période de reproduction. Dans le même temps, les résultats des biotest montrent des ovocytes encore peu sensibles à la stimulation par la progestérone.
On observe donc une maturation des ovocytes particulièrement retardée avec pour Fulbert un possible début de dégradation.
II.4.5.2 Choix des géniteurs – Séquence 2
Une tentative de reproduction a tout de même été décidée le 22 juillet avec Lucette et Fulbert, mais avec très peu d’espoir de succès.
Les 7 males restant (364, Emeline, gilles, Hervé, Bleu, Martinien et Isabeau) ont été sélectionnés, ainsi que Delphine qui avait donné un bon résultat à la première tentative de reproduction.
28
II.4.5.3 Préparation finale des géniteurs et stimulation hormonale
Les femelles concernées (Fulbert et Lucette) ont été conservées dans le bassin BR5 depuis la fin mai. Les températures y ont été maintenues proches de 16°C tout au long du mois de juin. Un souci de thermorégulation a provoqué une brusque montée à 20°C le 29 juin. Une double montée successive de température a ensuite été réalisée pour tenter de faire progresser la maturation. La température a d’abord été montée à 17°C mi-juillet puis redescendue et remontée jusqu’à 19°C le 23 juillet, jour prévu pour le déclenchement de l’ovulation (Figure 17). Les 2 femelles ont bien supporté ce double choc thermique, en conservant leur comportement depuis l’arrivée dans Sturio 1. Fulbert avait un comportement assez statique, tandis que Lucette avait une nage active.
L’amplitude du dernier réchauffement, réalisée du mardi 21 au jeudi 23 juillet est proche de 5°C.
La montée en température pour les mâles a été réalisée dans les mêmes conditions que lors de la première tentative de reproduction, soit une montée rapide à 18°C, à partir d’une stabulation à 15-15,5°C.
Les modalités de stimulation hormonales ont été modifiées. Les femelles ont reçu 2 injections d’hypophyse de carpe à 0,5 et 5 mg/kg le 23 juillet, à 6h00 et 18h00.
Pour les mâles, la stimulation classique a été opérée, soit une seule injection à la concentration de 30 µg/kg.
29
II.4.5.4 Reproduction – Séquence 2
Les femelles n’ont pas ovulé.
Cinq des 7 nouveaux mâles sélectionnés ont donné de la semence, mais aucune de très bonne qualité. Deux mâles n’ont pas donné de semence, mais on ne retrouve pas de semence inactive. La survie des spermatozoïdes ne dépasse pas le plus souvent 1 mn après activation.
On est très loin de semences de qualité qui peuvent rester actives jusqu’à 4 mn, voire plus. Toutefois les résultats obtenus en termes de moyenne des survies après activation sont supérieurs à ceux obtenus lors de la collecte précédente.
II.4.6 Résultats de la cinquième biopsie de contrôle
Un dernier contrôle a été effectué sur DN, afin d’évaluer l’effet de la montée en température que DN a subi dans le BR5 avec Lucette et Fulbert, entre le 11 et le 17 juillet (premier choc thermique de mi-juillet pour les 2 femelles).
Les résultats montrent que DN a évolué en termes d’OPI depuis la dernière biopsie (21 juin), mais qu’il n’y a toujours pas de maturation in vitro.
Tableau 9 : Résultats de la cinquième biopsie de contrôle (27 juillet 2015) Caractéristiques des ovocytes
Indicateurs Plasmatiques Maturation in vitro Taux max Nom Diamètre mm OPI T50 % Durée E2 pg/ml Ca mg/ml DN 2,4 13,9 0 36h
II.5 Bilan de la saison de reproduction 2015
Les différents circuits fermés dédiés aux reproductions étaient pleinement opérationnels cette saison. L’entrée des géniteurs présélectionnés n’a pas eu d’effet notable sur la qualité de l’eau. Cela est lié au maintien en activité des filtres biologiques durant l’intersaison. Le raccordement en autonomie des filtres a permis un fonctionnement y compris en période de travaux importants (changement de la toiture du bâtiment en 2014).
Les biométries réalisées à l’occasion des transferts ont montré des pertes de poids significatives pour une majorité de poissons, les mâles paraissant plus touchés encore que les femelles. Cela intervient alors qu’une stagnation des croissances avait déjà été observée l’année précédente.
Deux poissons ont montré un état de santé déficient en cours de saison : une femelle Francine et un mâle Justin. La précocité et le choix des traitements administrés à Francine ont permis de la sauver. Cela constitue une véritable satisfaction, compte tenu de la forte réduction des effectifs ces dernières années. Par contre l’absence de symptômes extérieurs visibles, n’a pas permis d’intervenir sur le mâle Justin qui est mort.
30 Les reproductions assistées demandent la réalisation de nombreuses opérations (manipulations, changements d’hébergement et d’environnement, biopsies, anesthésies, traitements hormonaux et thermiques, chirurgie..) stressantes pour les poissons.
Dans le contexte de forte dégradation de l’état de santé des animaux ces deux dernières années, le risque de voir se développer des pathologies durant les reproductions est donc important.
La prévention du risque doit conduire à être plus restrictif encore sur l’utilisation des animaux, tenant compte de l’historique de leur état de santé, engraissement annuel et valeur génétique. Il convient d’écarter tout animal ayant subi une perte de poids conséquente, indépendamment de tout autre critère (bonne apparence extérieure…).
Des traitements préventifs peuvent également être mis en place pour renforcer l’état de santé des animaux avant participation aux reproductions (traitements immunostimulants, utilisation de vitamine C).
Quatre des 5 femelles présélectionnées ont montré un fort retard de maturation, sortant du cadre général de ce qui a été observé ces dernières années (30 % de l’effectif). Seule la femelle Francine, considérée comme ayant un comportement « plastique » a maturé dans la période classique. Il n’a toutefois pas été possible de la faire ovuler dans les délais voulus. Cela peut être lié à une stimulation hormonale trop précoce. Un manque de sensibilité aux traitements a pu également intervenir en raison de la pathologie dont elle était atteinte. Chez les mâles, dans les deux séquences de reproduction, des semences de mauvaise qualité ont été obtenues. Une tendance générale à la baisse de qualité des semences est observée ces dernières années, mais pas de cette intensité. Cela est très probablement à mettre en relation avec la perte de poids des animaux avant reproduction.
De nombreux facteurs interviennent pour un bon développement de la gamétogénèse : niveau d’engraissement, période de constitution des réserves, état de santé des animaux, qualité des paramètres environnementaux ...
Chez les femelles esturgeon, l’accumulation des réserves pour la formation d’ovocytes en vitellogénèse demande généralement deux ans (cycle plutôt biennal de reproduction). L’effort pour l’alimentation doit donc se faire« dans la durée ». Les mâles peuvent paraitre potentiellement moins pénalisés par une alimentation réduite à court ou moyen terme. Il n’en ait rien, car l’utilisation annuelle des mâles pour les reproductions (compte tenu de leur faible effectif) conduit à réduire de facto leur période d’alimentation de deux à 3 mois. Une alimentation insuffisante conduit à une fragilité des animaux, une qualité médiocre des gamètes (production de petits ovocytes, réduction des nombre, variabilité des développements…) et un décalage de la période de maturation pour les femelles.
Bromley et al. (2000) constate chez le turbot qu’un déficit d’alimentation 4 à 8 mois avant la période de reproduction a des effets très négatifs sur la qualité des ovocytes.
Tous les poissons ne sont pas forcément affectés de la même façon. Les plus adaptés aux conditions d’élevage, généralement dominants, continuent à s’alimenter convenablement, au détriment des autres poissons.
Il est donc important de nourrir les géniteurs au niveau requis (Rochard, 2011) et garantir leur bon état de santé pour espérer renouer avec le succès en matière de reproduction. De l’aliment (crevette) a été distribué aux poissons à partir de début juin dans les bassins de reproduction. L’alimentation dans les structures de reproduction est toutefois difficile à réaliser et ne peut être optimisée. Comme cela a été dit, les poissons y sont soumis à de nombreux stress limitant les quantités ingérées. De plus ils doivent disposer des réserves nécessaires, avant entrée en période de reproduction. Il est donc important qu’ils aient
31 achevé leur pleine croissance dans les bassins de grossissement avant transfert en structure de reproduction.
La gestion de l’élevage générant le moins de stress doit être recherchée, que ce soit en période de grossissement ou de reproduction. Il est préférable que le déplacement des animaux pour les reproductions s’effectue après atteinte par les femelles du stade 4 de la vitellogénèse. Ainsi les biopsies peuvent être limitées en nombre et sont réellement informatives.
La saison 2015 a donc été marquée par l’impossibilité de faire ovuler les femelles.
Ceci implique que les femelles doivent résorber leurs ovocytes durant les mois à venir. Ce « travail physiologique et métabolique » semble délicat à gérer pour les femelles depuis quelques années.
Ceci amène une question importante sur la gestion de ces poissons. Doit-on essayer à tout prix de les leur faire évacuer les ovocytes ? Doit-on accompagner la femelle durant sa résorption et l’atrésie ? Doit-on maintenir la femelle dans des conditions qui puissent l’amener à maturer pour la saison suivante ? Doit-on envisager de réaliser des reproductions décalées ?
La gestion particulière de quelques géniteurs est possible dans Sturio 1, dans le cadre d’une stabulation à température basse pour amener le poisson jusqu’à la saison suivante. Ce type de stratégie est développée dans les élevages russes.
Cet aspect de la gestion des géniteurs post-reproduction est crucial dans le cas d’un stock à effectif réduit comme le nôtre. Le traitement de ces questions nécessite le recours à des compétences extérieures spécialistes de la reproduction des poissons, et idéalement des esturgeons.
32
Chapitre III : Qualité des semences en 2015 (Action 23)
Bons S., Chèvre P.
III.1 Introduction
Objectifs
La vérification de la qualité des semences fraîches pour tous les mâles d’esturgeon européen a pour objectif de sélectionner les mâles qui participeront à la fécondation des femelles. Il s’agit également de déterminer les critères pour obtenir une semence de bonne qualité dans le but de constituer une banque de sperme.
Intérêts
Il s’agit d’optimiser la survie des croisements en utilisant une bonne qualité de semences pour produire des œufs et des larves destinés au repeuplement et à la conservation d’un stock captif.
III.2 Matériels et méthodes
La pré-sélection des géniteurs a été réalisée le 11 et 12 mai 2015, environ un mois avant la période de reproduction, généralement de mai à juillet (Williot et al., 1997). Le choix des mâles se fait par échographie. L’échographie permet de déterminer le stade de maturation.
Les résultats de l’échographie ont permis de sélectionner 16 mâles qui ont été transférés dans le bâtiment Sturio 1, pour la préparation à la phase finale de maturation (montée en température, passage en eau douce – Voir Chapitre II).
La veille du prélèvement, les poissons reçoivent une injection d’hormone, la LHRH éthylamide acétate hydrate (Luteinising Hormone-Releasing Hormone), à une dose de 30 µg/kg, dans le but de déclencher la spermiation. L’injection est faite dorsalement juste en arrière de la tête dans les muscles pour que l’hormone agisse plus rapidement au niveau du cerveau. Cette hormone stimule l’activité de frai chez les poissons.
Vingt-quatre heures après l’injection, la semence est collectée à l’aide d’un tube en silicone (5 mm de diamètre) désinfecté et sec pour éviter d’activer la semence, que l’on a inséré dans l’orifice urogénital (Figure 18). La semence est récoltée par gravité ou par un léger massage abdominal dans un bécher gradué, sec et propre pour les mêmes raisons que précédemment.
33
Figure 18 : Prélèvement de sperme chez A. sturio et observation de la qualité des semences
(© Ph Jatteau - ML. Acolas, Irstea)
Une fois la semence prélevée, il faut juger de sa qualité selon deux critères : la motilité selon l’échelle de motilité de Sanchez- Rodriguez et Billard (1977) établie pour la truite arc-en-ciel (Tableau 10) et la survie en pourcentage pendant 3 minutes 30. Pour cela, la semence a été activée avec un activateur permettant d’optimiser la motilité en gardant une méthode simple, rapide et peu coûteuse et présentant un risque d’erreur la plus faible. C’est pour ces raisons que l’eau a été utilisée.
Tableau 10 : Echelle de motilité d’après Sanchez-Rodriguez & Billard (1977) 0 Spermatozoïdes tous immobiles
1 Agitation sur place de nombreux spermatozoïdes
1+ Agitation sur place de nombreux spermatozoïdes. Quelques uns se déplacent
rapidement
2 Quelques uns se déplacent rapidement (20%).La plupart présentent soit des
mouvements progressifs lents soit une agitation sur place.
2+ Plus de 20% des spermatozoïdes se déplacent activement
3 Spermatozoïdes à mouvements progressifs rapides ou lents (50%) et des
mouvements oscillatoires sans déplacement (50%)
3+ Spermatozoïdes à mouvements progressifs rapides ou lents supérieurs à 50% 4 Déplacements progressifs de la plupart des spermatozoïdes (80%).Certains
restent visibles car déplacements lents
4+ Seuls quelques spermatozoïdes présentent des déplacements lents
5 Tous les spermatozoïdes se déplacent vigoureusement. Impossible de fixer la vue
34 Matériel nécessaire à l’observation de la semence fraîche :
- pipette 0-10µL + embouts - pipette 20-200µL + embouts - Lames - Lamelles - Microscope optique Méthode d’observation :
- Mélanger la semence et prélever 1 µL. Déposer sur une lamelle et vérifier la motilité spontanée.
- Ajouter 50µL eau de forage (activateur) en déclenchant le chronomètre (homogénéiser avec l’embout de la pipette. Mettre une lamelle et observer à un grossissement X400.
- Relever la survie et la motilité toutes les 30 secondes et pendant 4 min.
- Ajuster s’il le faut les quantités et l’objectif pour observer environ 100 spermatozoïdes (si trop concentré utiliser 0,5µL de semence, si pas assez concentré regarder avec un objectif plus petit). Ne pas diminuer la quantité d’activateur pour ne pas sous estimé la motilité.
Changer les embouts des pipettes entre chaque prélèvement
Les paramètres de motilité et de survie permettent de classer les semences fraîches en 4 catégories (Tableau 11).
Tableau 11 : Critères pour le classement des semences en 4 catégories Motilité initiale Taux de Survie initial (%) Motilité 60s Taux de Survie 60s (%) Temps survie 5% (s) Qualité de la semence 5 95-100 5 80 > 210 Très Bonne 5 90-100 3-4 <80 ≥ 180 Bonne 4-5 90-100 3-4 50-60 150-180 Moyenne ≤ 5 ≤95-100 ≤ 3 ≤ 60 ≤ 150 Mauvaise à très Mauvaise
35
III.3 Résultats et Discussion
Pour l’année 2015, aucune série de reproduction assistée n’a eu lieu sur la station d’expérimentation de Saint Seurin sur l’Isle en raison d’un manque d’ovocytes matures des femelles. Cependant des prélèvements de sperme ont eu lieu dans l’attente d’ovocytes. La maturation finale de tous les mâles s’est effectuée en eau douce. Plusieurs mâles ont été sélectionnés pour chacune des éventuelles reproductions (Tableau 12).
Tableau 12: Sélection des différents mâles en 2015
Date Nom des mâles
18 juin Delphine, Mariette, Carol, 163, Justin, Pascal et Norman
23 juillet Emeline, Martinien, Isabeau, Hervé, Bleu, Delphine, 364 et Gilles
III.3.1 Prélèvement du 18/06/15
Au cours de la matinée du 18/06/15, 6 mâles ont été prélevés : Delphine, Justin, Mariette, 163, Carol et Norman (Tableau 13).
Ces prélèvements doivent permettre de sélectionner les mâles qui seront utilisés lors de la fécondation des ovocytes des femelles.
Tableau 13: Données du sperme collecté pour chaque mâle le 18/06/15 Nom mâle Volume de
sperme collecté Aspect
pH Sperme Motilité spontanée
Delphine 500 normal 0
Justin 500 clair 0
Mariette 400 Clair, jaunatre 0
163 100 concentré 0
Carol 250 normal 0
Pascal 0
36 Les résultats des observations microscopiques sont les suivants (Figure 19):
Figure 19 : Résultats des motilités et des taux de survie des spermatozoïdes des mâles
Delphine, Justin et 163 le 18 juin 2015. La motilité est indiquée en bleu et la survie en rose.
0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 0 20 40 60 80 100 120 140 160 180 200 S u rv ie e n % M o ti li é Titre 163 Motilité % survie 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 0 20 40 60 80 100 120 140 160 180 200 s u rv ie e n % m o ti li té Temps(s) Justin motilité % de survie 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 6 0 20 40 60 80 100 120 140 160 180 200 s u rv ie e n % m o ti li té Temps (s) Delphine motilité % de survie
37 Les résultats d’évaluation de la qualité des semences de ces 6 mâles sont synthétisés dans le
Tableau 14.
Tableau 14 : Evaluation de la qualité des semences du 18 juin 2015 A T0 A 60 s Final
Nom Motilité Survie Motilité Survie Motilité Survie Temps Qualité
Delphine 5 100 5 80 1 2 180 Bonne
Justin 4 80 1 10 1 10 60 Très mauvaise
Mariette 0 0 0 0 0 0 0
163 3 30 1 2 1 2 30 Très Mauvaise
Carol 0 0 0 0 0 0 0
On peut donc en conclure que la meilleure semence pour ces 6 mâles est Delphine avec une semence de bonne qualité.
Pour les autres mâles nous avons une semence de très mauvaise qualité pour Justin et 163 et pour Mariette et Carol la semence était déjà inactive dès le début.
Il n’y a pas eu de reproduction le 18 juin, et la semence de Delphine n’a pas été utilisée pour féconder les ovocytes des femelles.
On a conservé la semence de Delphine grâce à un dilueur de conservation d’après la méthode Park and Chapman (Park and Chapman 2005) en vue d’une éventuelle utilisation dans les jours qui suivent mais elle ne sera finalement jamais utilisée.
III.3.2 Prélèvement du 23/07/15
Au cours de la matinée du 23/07/15, 8 mâles ont été prélevés Emeline, Martinien, Isabeau, Hervé, Bleu, Delphine, 364 et Gilles (Tableau 15).
Ces prélèvements doivent permettre de sélectionner les mâles qui seront utilisés lors de la fécondation des ovocytes des femelles.
Tableau 15 : Données du sperme collecté pour chaque mâle le 23/07/15 mâle Volume de
sperme collecté Aspect
pH Sperme Motilité spontanée Emeline 430 normal 0 Martinien 530 normal + Isabeau 350 normal 0 Hervé 450 concentré + Bleu 200 concentré 0 Delphine 0 364 0 Gilles 0
38 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 0 20 40 60 80 100 120 140 160 180 200 s u rv ie e n % m o ti li té Temps(s) Martinien motilité % de survie 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 0 20 40 60 80 100 120 140 160 180 200 s ur v ie e n % M ot il it é Temps (s) Isabeau motilité % de survie 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 0 20 40 60 80 100 120 140 160 180 200 s u rv ie e n % M o ti li té Temps(s) Hervé motilité % survie
Les résultats des observations microscopiques sont les suivants (Figure 20):
Figure 20 : Résultats des motilités et des taux de survie des spermatozoïdes des mâles
Emeline, Martinien, Isabeau, Hervé et Bleu le 23 juillet 2015. La motilité est indiquée en bleu et la survie en rose. 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 0 20 40 60 80 100 120 140 160 180 200 S u rv ie e n % M o ti li té Titre Bleu Motilité % survie 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 0 20 40 60 80 100 120 140 160 180 200 s u rv ie e n % m o ti li té Temps (s) Emeline motilité % de survie
39 Les résultats d’estimation de la qualité des semences sont regroupés dans le Tableau 16
Tableau 16 : Evaluation de la qualité des semences du 23 juillet A T0 A 60 s Final
Nom Motilité Survie Motilité Survie Motilité Survie Temps Qualité
Emeline 5 100 4 80 2 10 120 moyenne Martinien 4 90 2 50 2 50 60 Très mauvaise Isabeau 5 100 2 10 2 10 60 Très mauvaise Hervé 5 100 3 50 2 5 90 mauvaise Bleu 5 100 2 10 2 10 60 Très mauvaise Delphine 0 0 0 0 0 0 0 364 0 0 0 0 0 0 0 Gilles 0 0 0 0 0 0 0
On peut donc dire qu’Emeline a une semence de qualité moyenne tandis que les autres mâles ont une semence de mauvaise voire très mauvaises qualité.
Il n’y a pas eu de reproduction le 23 juillet. La semence de Emeline n’a donc pas été utilisée. Au final aucunes de ces semences ne sera utilisées en l’absence d’ovulation des femelles.
III.4 Conclusions
Lors de ces deux prélèvements de semences au cours de la saison 2015, nous avons pu constater une très faible qualité des semences (Tableau 17).
En effet lors des 13 prélèvements du 18 juin et du 23 juillet 2015 on a observé 7,7% de semence de bonne qualité, 7,7% de moyenne qualité, 46,1% de mauvaise voire très mauvaise qualité et 38,5% de semences inactives.
Tableau 17 : Tableau récapitulatif des prélèvements de semences au cours de la saison 2015
Qualité 18 juin 23 juillet
Très Bonne
Bonne Delphine
Moyenne Emeline
Mauvaise Justin, 163 Martinien, Isabeau, Hervé, Bleu