Impact des caractéristiques des hôpitaux québécois sur
le taux d’incidence d’infection à Clostridium difficile
Mémoire
Andréanne Savard
Maîtrise en épidémiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Andréanne Savard, 2017
Impact des caractéristiques des hôpitaux québécois sur
le taux d’incidence d’infection à Clostridium difficile
Mémoire
Andréanne Savard
Sous la direction de :
Résumé
Introduction: Les infections nosocomiales à Clostridium difficile (C. difficile) représentent un problème majeur de santé publique. La surveillance provinciale québécoise a identifié des facteurs de risque non-modifiables de l’infection(ex.: mission de l’hôpital, nombre de lits), ne permettant toutefois pas de cibler une intervention.
Objectifs: Cette étude a pour but: 1)d’identifier les facteurs de risque et/ou protecteurs modifiables associés au taux d’incidence d’infection à C. difficile dans les hôpitaux québécois; 2)d’évaluer si les facteurs sont les mêmes selon le type de mission de l’hôpital (universitaire ou non-universitaire); 3)d’expliquer l’association entre le type de mission et le taux d’incidence de l’infection.
Méthodologie: Les facteurs de risque et/ou protecteurs ont été recueillis à l’aide d’un questionnaire sur les mesures de prévention et contrôle des infections à C. difficile dans les hôpitaux(INSPQ 2009-2010). La mesure de résultat est le taux d’incidence de l’infection(2009-2010). Nous avons utilisé des modèles de Poisson multivariés prédictifs pour répondre aux deux premiers objectifs et un modèle explicatif ajusté pour différents facteurs confondants pour répondre au troisième objectif.
Résultats: Les facteurs associés à un taux d’incidence plus élevé dans le modèle prédictif pour tous les hôpitaux sont: hôpitaux des grands centres vs régions éloignées(Québec:RTI=2,06, valeur-p=0,0001; Montréal:RTI=1,38, valeur-p=0,005); héberger <100% des patients symptomatiques d’infection à C. difficile en chambre privée vs 100%(80%-99%: RTI=1,33, valeur-p=0,01; <80%:RTI=1,84, valeur-p<0,0001); désinfecter la salle de bain des patients non-infectés 2fois/jour vs 1fois/jour(RTI=1,52, valeur-p=0,02); avoir un plan d’action lors d’éclosion n’incluant pas la surveillance des antibiotiques vs avoir un plan incluant la surveillance(RTI=1,36, valeur-p=0,004). L’hébergement des patients symptomatiques en chambre privée est le seul facteur commun qui ressort dans les modèles spécifiques aux hôpitaux universitaires et non-universitaires.
Conclusion: Nous avons identifié des facteurs associés à l’infection sur lesquels il est possible d’intervenir, tant au niveau de la configuration de l’hôpital que des mesures qui y sont appliquées.
Abstract
Background: Nosocomial Clostridium difficile (C. difficile) infection is a major public health concern. Quebec’s
C. difficile provincial surveillance identified risk factors of the infection, such as teaching vocation and number of beds, which are unmodifiable. Thus these factors do not help targeting interventions to reduce the incidence of C. difficile infection.
Objectives: This study aims to: 1)identify modifiable risk and/or protective factors associated with the incidence rate of C. difficile infection in Quebec hospitals; 2)evaluate if the risk and/or protective factors are the same according to hospital mission(teaching or non-teaching); 3)explain the association between teaching vocation and higher incidence rate of C. difficile infection.
Method: Risk and/or protective factors were collected using a survey on preventive and control measures of
C. difficile infection(INSPQ 2009-2010). The outcome is the incidence rate of the infection in Quebec hospitals(2009-2010). We used predictive multivariate Poisson models to answer the first two objectives and an explanatory model adjusted for various confounding factors to answer the third objective.
Findings: Factors associated with a higher incidence rate in the multivariate predictive model for all hospitals were: hospitals in large urban centers vs remote regions(Quebec: IRR= 2.06, p-value=0.0001; Montreal: IRR=1.38, p-value=0.005); accommodate <100% of symptomatic patients with C. difficile infection in private room vs 100%(80%-99%: IRR=1.33, p-value=0.01; <80%: IRR=1.84, p-value<0.0001); disinfect washroom of uninfected patients 2 times/day vs 1 time/day(IRR=1.52, p-value=0.02); have an action plan during an outbreak that doesn’t include antibiotic stewardship vs have an action plan during an outbreak that includes antibiotic stewardship(IRR=1.36, p-value=0.004). Accommodation of all symptomatic patients with C. difficile infection in private rooms is the only common risk factor between the models for teaching and non-teaching hospitals.
Conclusion: We identified factors associated to the infection on which it is possible to act, whether it is on hospital setting or measures applied in hospitals.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations et des sigles ... ix
Remerciements ... xi
Introduction ... 1
Objectifs ... 3
Chapitre 1 – Revue de la littérature ... 4
1.1 Clostridium difficile – Le pathogène ... 4
1.2 Histoire naturelle du C. difficile ... 4
1.2.1 Ingestion des spores (Transmission fécale-orale) ... 4
1.2.2 Colonisation ... 5
1.2.3 Infection à C. difficile ... 7
1.2.4 Restauration de la résistance à la colonisation ... 8
1.2.5 Récidive ... 9
1.3 Épidémiologie de l’infection à C. difficile... 11
1.3.1 Taux d’incidence de l’infection dans les hôpitaux et fardeau ... 11
1.3.2 Saisonnalité ... 12
1.3.3 Colonisation asymptomatique ... 13
1.4 Facteurs de risque et protecteurs ... 14
1.4.1 Facteurs de risque et protecteurs au niveau individuel ... 14
1.4.2 Facteurs de risque et protecteurs au niveau de l’hôpital ... 18
Chapitre 2 – Méthodologie ... 22
2.1 Cadre conceptuel ... 22
2.2 Devis et Population ... 23
2.3 Collecte des données ... 24
2.4 Mesure de résultat (Issue de santé) ... 25
2.5 Catégorisation des variables ... 25
2.6 Analyses statistiques ... 26
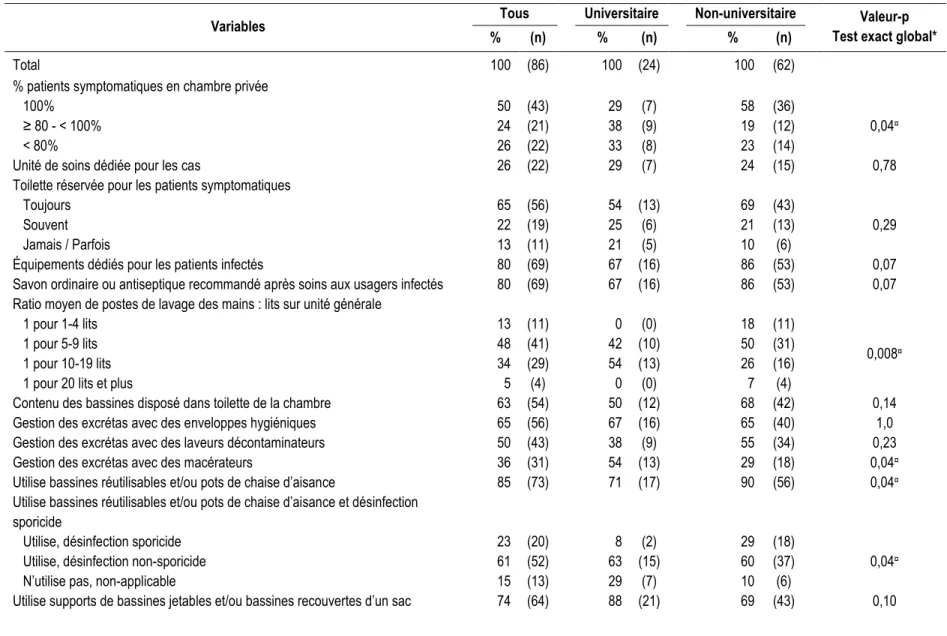
3.1 Caractéristiques des hôpitaux inclus dans l’étude ... 30
3.2 Association entre les facteurs de risque et/ou protecteurs et le taux d’incidence d’infection à C. difficile ... 40
3.3 Association entre la mission des hôpitaux et le taux d’incidence d’infection à C. difficile ... 55
Chapitre 4 – Discussion ... 60
4.1 Résumé des résultats principaux ... 60
4.2 Interprétation et comparaison avec la littérature ... 60
4.2.1 Profil des installations ... 60
4.2.2 Mesures de prévention de la transmission ... 61
4.2.3 Mesures diminuant la vulnérabilité aux infections ... 63
4.2.4 Différence entre les hôpitaux à mission universitaire et non-universitaire ... 64
4.2.5 Robustesse des résultats ... 64
4.3 Limites ... 65 4.4 Forces ... 67 4.5 Généralisation ... 68 Conclusion ... 69 Bibliographie ... 70 Annexes ... 78
Annexe I : Questionnaire sur les mesures de prévention et de contrôle des infections à C. difficile ... 79
Annexe II : Modèles de Poisson univariés pour tous les hôpitaux ... 102
Annexe III : Modèles de Poisson univariés pour les hôpitaux universitaires ... 107
Annexe IV : Modèles de Poisson univariés pour les hôpitaux non-universitaires ... 112
Annexe V : Analyse de sensibilité pour tous les hôpitaux ... 117
Annexe VI : Analyse de sensibilité pour les hôpitaux universitaires ... 118
Liste des tableaux
Tableau 1. Facteurs de risque et protecteurs au niveau individuel pour la colonisation ou l’infection à C.
difficile. ... 16
Tableau 2. Facteurs de risque et protecteurs au niveau de l’hôpital (mesures implantées) pour l’infection ou la colonisation à C. difficile. ... 21
Tableau 3. Caractéristiques des hôpitaux pour le Profil des installations. ... 31
Tableau 4. Caractéristiques des hôpitaux pour les Mesures de prévention de la transmission. ... 34
Tableau 5. Caractéristiques des hôpitaux pour les Mesures diminuant la vulnérabilité aux infections. ... 38
Tableau 6. Modèles univariés et multivariés pour tous les hôpitaux. ... 42
Tableau 7. Modèles univariés et multivariés pour les hôpitaux universitaires. ... 48
Tableau 8. Modèles univariés et multivariés pour les hôpitaux non-universitaires. ... 51
Tableau 9. Association entre la mission des hôpitaux et le taux d’incidence d’infection à C. difficile (Modèle explicatif ajusté pour les variables potentiellement confondantes). ... 56
Annexe II : Modèles de Poisson univariés pour tous les hôpitaux ... 102
Annexe III : Modèles de Poisson univariés pour les hôpitaux universitaires ... 107
Annexe IV : Modèles de Poisson univariés pour les hôpitaux non-universitaires ... 112
Annexe V : Analyse de sensibilité pour tous les hôpitaux ... 117
Annexe VI : Analyse de sensibilité pour les hôpitaux universitaires ... 118
Liste des figures
Figure 1. Histoire naturelle de l’infection à C. difficile. ... 10
Figure 2. Schématisation de l’endroit où agissent les Mesures de prévention de la transmission et les Mesures diminuant la vulnérabilité aux infections dans l’histoire naturelle de l’infection à C. difficile. ... 20
Figure 3. Cadre conceptuel du modèle prédictif. ... 22
Figure 4. Cadre conceptuel du modèle explicatif. ... 23
Liste des abréviations et des sigles
ATP : Adénosine triphosphate
C. difficile : Clostridium difficile CDT : Clostridium difficile transférase
CINQ : Comité sur les infections nosocomiales du Québec
DQD : Dose quotidienne définie (DDD : Defined daily dose)
GEE : Generalized estimating equations
IC 95% : Intervalle de confiance à 95%
IRR : Incidence rate ratio
INSPQ : Institut national de santé publique du Québec
NAP1 : North American pulsed-field gel electrophoresis type 1
PCI : Prévention et contrôle des infections
PCR : Polymerase chain reaction
RR : Rapport de risque
RC : Rapport de cote
RTI : Rapport de taux d’incidence
SARM : Staphlylococcus aureus résistant à la méthicilline
SGS : Soins généraux et spécialisés
SPIN-CD : Surveillance provinciale des infections nosocomiales – Clostridium difficile
«Les portes de l’avenir sont ouvertes à
ceux qui savent les pousser.»
Remerciements
Je veux remercier sincèrement Marc Brisson, mon directeur de recherche, de m’avoir intégrée dans son équipe de recherche pour me permettre de collaborer à un nouveau projet passionnant.
Un merci particulier à Mélanie Drolet, pour son écoute, ses rétroactions lors de la présentation de mes travaux et ses critiques constructives. Elle m’a encouragée aux moments opportuns et m’a incitée à me dépasser.
Je souhaite remercier Myrto Mondor, statisticienne, qui a su répondre à mes questions, résoudre des problématiques d’ordre statistique apparues lors de mes analyses et m’expliquer certaines notions avec doigté.
Merci également à Marie-Hélène Guertin qui a su m’apporter son soutien tout au long de mon parcours.
Je suis particulièrement fière d’avoir fait partie d’une équipe composée de personnes aussi talentueuses.
Introduction
Le Clostridium difficile (C. difficile) est une bactérie faisant partie des 5 pathogènes causant le plus de décès et des 10 pathogènes causant le fardeau le plus important selon des données recueillies en Ontario (1). De plus, l’infection à C. difficile est responsable de 25% à 30% des cas de diarrhées associées aux antibiotiques (2, 3). L’infection à C. difficile est un problème majeur de santé publique dans les hôpitaux du Canada puisqu’environ 15 000 nouveaux cas d’infections et 1 500 décès par an sont répertoriés (4). Quant aux données les plus récentes sur la situation au Québec, entre le 1er avril 2014 et le 31 mars 2015, 3 453 cas
d’infections à C. difficile d’origine nosocomiale et 543 décès reliés à cette infection ont été rapportés (5). Au fil des ans, la situation au Québec a beaucoup évolué. De 1991 à 2003, il y a eu une importante hausse de l’incidence de l’infection à C. difficile. En effet, le taux d’incidence de l’infection est passé de 36 cas/100 000 habitants en 1991 à 156 cas/100 000 habitants en 2003 (6). C’est en 2004, à la suite de cette augmentation, que la surveillance provinciale des infections à C. difficile a été mise en place par l’Institut national de santé publique du Québec (INSPQ) dans 95 installations du Québec (7). À la suite de la mise en place de la surveillance provinciale, une baisse du taux d’incidence de l’infection a été constatée de 2005 à 2010 (8). Le taux d’incidence d’infection à C. difficile est alors passé de 13 cas/10 000 présence à 7 cas/10 000 jours-présence (8). Cependant, à la suite de cette baisse, le taux d’incidence de l’infection a cessé de diminuer. En effet, de 2010 à 2015, il y a eu une stagnation du taux d'incidence de l’infection (5). Malgré la baisse du taux d’incidence de 2005 à 2010, les taux observés de 2010 à 2015 sont tout de même élevés. Il s’agit donc toujours d’un problème important et, en 2012, le Québec était la province canadienne avec le plus grand nombre d’infections à C. difficile (9). De plus, les taux annuels d’incidence de l’infection sont très variables d’un hôpital à l’autre. En effet, ils peuvent varier de 0 à environ 20 cas/10 000 jours-présence selon les hôpitaux (5).
Différents facteurs de risque des infections à C. difficile ont été identifiés grâce à la surveillance, les plus importants sont : la mission universitaire, un nombre élevé de lits et un pourcentage élevé de gens de plus de 65 ans présents à l’hôpital (5, 7, 8, 10). Il s’agit de caractéristiques qui pourraient être classifiées comme faisant partie du profil des installations. Ces facteurs de risque, qui représentent des caractéristiques générales des hôpitaux, apportent des informations importantes, mais demeurent des facteurs de risque non-modifiables.
Il serait donc important d’identifier, à l’intérieur des hôpitaux, les facteurs de risque qui sont modifiables et sur lesquels il serait possible d’intervenir afin de faire diminuer le taux d’incidence d’infection à C. difficile dans les
hôpitaux québécois. Ces facteurs de risque modifiables peuvent être classés en deux catégories selon le niveau sur lequel ils agissent pour diminuer le taux d’infection : 1) les Mesures de prévention de la transmission (ex. : le pourcentage de patients infectés séjournant en chambre privée et la présence de toilettes réservées pour les cas) et 2) les Mesures diminuant la vulnérabilité aux infections (ex. : la surveillance de l’utilisation des antibiotiques et l’usage de probiotiques). Peu de données sont disponibles sur l’utilisation de telles mesures dans les hôpitaux du Québec. Cependant, en 2011, une enquête a été réalisée par l’INSPQ afin d’évaluer l’utilisation de diverses mesures de prévention des infections à C. difficile dans les hôpitaux québécois. Pour ce faire, un questionnaire a été distribué aux installations faisant partie de la surveillance des infections à C. difficile. Le questionnaire portait entre autres sur : les mesures de prévention et de contrôle auprès des patients infectés, la gestion des cas d’infection, les mesures d’hygiène et de salubrité, la présence d’un plan d’action lors d’éclosion, la surveillance des infections nosocomiales, la formation du personnel soignant, le contrôle de l’utilisation des antibiotiques et l’usage des probiotiques.
Les données de surveillance indiquent que les taux d’incidence sont plus élevés dans les hôpitaux universitaires en comparaison avec les hôpitaux non-universitaires (environ 1,3 fois plus élevé, IC 95% : 1,2-1,5) pour 2007-2008 à 2014-2015 (7, 8). Cependant, cette association s’est inversée en 2015-2016 alors que le rapport de taux d’incidence de l’infection était de 0,9 (IC 95% : 0,8-1,0, valeur-p < 0,05) pour les hôpitaux universitaires comparativement aux hôpitaux non-universitaires (11). Il serait important de déterminer quelles caractéristiques des hôpitaux se cachent derrière l’association entre la mission universitaire et le taux d’incidence d’infection à C. difficile. Jusqu’à maintenant, aucune étude n’a évalué les différentes caractéristiques ou les pratiques qui pourraient expliquer cet écart. Il serait donc important de vérifier s’il existe une différence majeure entre les hôpitaux universitaires et non-universitaires sur laquelle il serait possible d’agir afin de diminuer les taux d’incidence de l’infection.
Ainsi, puisqu’il y a stagnation des taux d’incidence d’infection à C. difficile dans les dernières années et qu’il y a une importante inégalité dans les taux d’incidence selon les hôpitaux, il serait important d’identifier les mesures mises en place qui sont les plus associées au taux d’incidence d’infection à C. difficile afin de fournir des pistes sur lesquelles investiguer afin de minimiser le risque de contracter cette infection lors d’un séjour hospitalier.
Objectifs
L’objectif principal de cette étude est d’identifier les facteurs de risque et/ou protecteurs des hôpitaux qui sont associés au taux d’incidence d’infection à C. difficile dans les hôpitaux québécois, pour la période s’étalant d’août 2009 à août 2010.
De façon plus spécifique, les objectifs de cette étude sont :
1) Identifier les facteurs de risque et/ou protecteurs associés au taux d’incidence d’infection à C. difficile dans les hôpitaux québécois, excluant les hôpitaux de réadaptation et pédiatriques, selon trois catégories :
a. Mesures de prévention de la transmission
b. Mesures diminuant la vulnérabilité aux infections
c. En tenant compte du Profil des installations
La catégorie Mesures de prévention de la transmission regroupe des caractéristiques portant sur la gestion des cas d’infection et des pratiques en hygiène et salubrité. Le thème Mesures diminuant la vulnérabilité aux infections regroupe des caractéristiques sur l’utilisation des antibiotiques et des probiotiques. Le thème du Profil des installations regroupe des caractéristiques sur le profil des patients fréquentant les hôpitaux ainsi que des caractéristiques physiques des hôpitaux.
2) Évaluer si les facteurs de risque et protecteurs associés au taux d’incidence d’infection à C. difficile sont les mêmes selon la mission universitaire et non-universitaire.
3) Déterminer si certaines caractéristiques et/ou pratiques dans les hôpitaux pourraient expliquer l’association entre la mission de l’hôpital et le taux d’incidence d’infection à C. difficile.
Chapitre 1 – Revue de la littérature
1.1 Clostridium difficile – Le pathogène
Le C. difficile est une bactérie sporulante en forme de bâtonnet et Gram positive (12). Cette bactérie peut exister sous deux formes : la forme végétative et la forme de spore (12). La forme végétative de la bactérie ne peut survivre en présence d’oxygène (12). Cette forme de la bactérie est celle qui permet sa croissance et sa multiplication (12). C’est aussi sous cette forme que la bactérie peut produire des toxines et induire l’infection (13-15). Les spores de la bactérie, quant à elles, permettent au microorganisme de survivre dans des conditions difficiles telles que des températures élevées, la présence de certains désinfectants et elles permettent la survie en présence d’oxygène (12, 16). Les spores de C. difficile sont métaboliquement en dormance, ce qui leur permet de résister aux antibiotiques, aux assauts du système immunitaire de l’hôte ainsi qu’aux désinfectants ne contenant pas de javellisant (16). De plus, elles peuvent persister jusqu’à 5 mois sur les surfaces comme le plancher (17). Divers changements s’opèrent dans la morphologie de la bactérie afin passer de la forme végétative à la forme de spore (16). La bactérie peut aussi repasser de la forme de spore à la forme végétative. Pour ce faire, d’autres changements morphologiques auront lieu; il y aura réhydratation de la bactérie et remise en marche du métabolisme (16, 18).
Il existe des souches toxinogènes et non-toxinogènes de C. difficile (14). Chez les souches toxinogènes de C. difficile, soit celles causant l’infection, on retrouve un locus de pathogénicité responsable de la production de toxines (19). Deux toxines d’intérêt peuvent principalement être excrétées par les souches toxinogènes, soit la toxine A codée par le gène tcdA et la toxine B codée par le gène tcdB (19). Certaines souches peuvent également produire une troisième toxine. C’est le cas de la souche NAP1 (pulsotype 1 nord-américain) qui produit la toxine binaire (CDT) en plus de produire 16 fois et 23 fois plus de toxines A et B que les autres souches (12, 20, 21).
1.2 Histoire naturelle du C. difficile
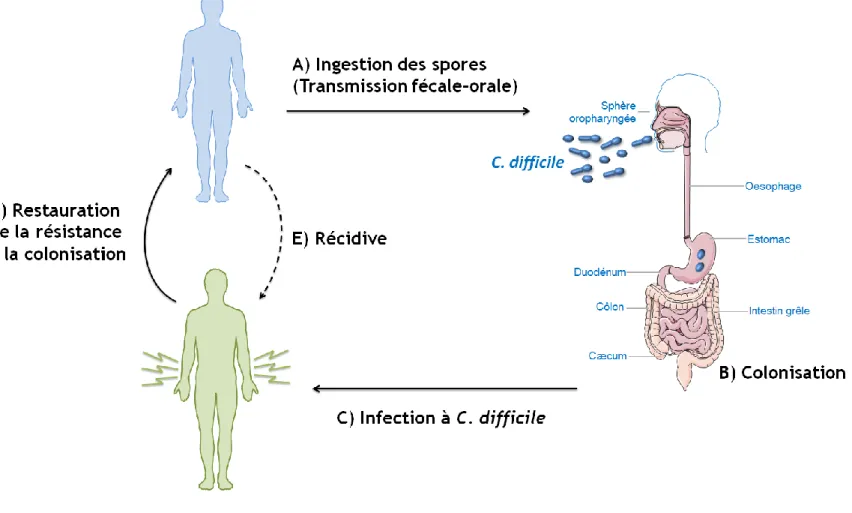
1.2.1 Ingestion des spores (Transmission fécale-orale)
La transmission du C. difficile se fait par voie fécale-orale (Figure 1A) (2, 22, 23). Les patients ingèrent le C. difficile surtout sous forme de spore à la suite de la contamination de l’environnement par des matières fécales contenant la bactérie (2, 22, 23). Cette contamination peut se faire via les mains du personnel soignant, les surfaces inanimées, les appareils médicaux ainsi que les aérosols (14, 22).
Les mains du personnel soignant sont une source importante de contamination par le C. difficile. En effet, de 14% à 59% du personnel testé pour la présence de C. difficile sur les mains était positif après un contact avec un patient atteint d’infection à C. difficile (24, 25). La bactérie a aussi été isolée dans environ 15% des selles du personnel soignant asymptomatique travaillant dans des unités où se trouvaient des patients colonisés ou infectés (17, 26). Les surfaces sèches et inanimées (ex. : siège de toilette, sonnette, comptoir) sont une autre source de contamination par le C. difficile, car les spores de la bactérie peuvent y survivre pendant de longues périodes si un nettoyage approprié n’est pas effectué (17, 25-27). La contamination par le C. difficile peut aussi être présente dans les chambres et les endroits où il n’y a pas de patients isolés pour le C. difficile (28). Les zones de travail des médecins et des infirmières peuvent être contaminées par le C. difficile, telles que des téléphones et des claviers d’ordinateur, en plus des équipements portatifs, tels que des chariots de médicaments et des ordinateurs portables (28). Les appareils médicaux tels que les sphygmomanomètres, les oxymètres et les thermomètres électroniques peuvent aussi être contaminés (25, 26, 29). Les bioaérosols, particules biologiques en suspension dans l’air, peuvent être une source de contamination pour les maladies infectieuses transmises par les fèces (30). En effet, il a été démontré qu’une fois la chasse d’eau tirée, sur une toilette sans couvercle, des aérosols contenant le C. difficile peuvent être retrouvés dans l’air jusqu’à 90 minutes suivant l’action de la chasse d’eau et que ces aérosols peuvent atteindre 25 cm au-dessus du siège de la toilette (31). La bactérie s’est aussi déposée sur le plancher, le réservoir et le siège de la toilette lorsque le couvercle n’était pas fermé (31). Il est aussi possible de retrouver sporadiquement des aérosols contenant des spores de C. difficile dans des chambres hébergeant ou ayant déjà hébergé des patients (32, 33). La libération des spores dans l’air correspond à des moments où il y a de l’activité autour des patients, par exemple refaire le lit ou changer la literie (32, 33).
1.2.2 Colonisation
Après être ingérées, les spores de C. difficile atteignent l’estomac, mais ne sont pas affectées par l’acidité de celui-ci puisque les spores y sont résistantes (Figure 1B) (15). Des cellules végétatives de C. difficile peuvent aussi être ingérées, mais en quantité moins importante que la forme de spore, puisqu’elles ne peuvent survivre longtemps en présence d’oxygène et que c’est surtout la forme de spore qui est excrétée (34). Contrairement à la forme de spore, les cellules végétatives sont tuées par l’acidité gastrique (34). Les spores cheminent ensuite jusqu’au petit intestin où elles peuvent y germiner, à la suite de l’exposition à différents facteurs de germination, pour retourner à l’état de cellule végétative (15, 23, 35). Ces cellules végétatives poursuivent leur trajet jusqu’à une portion anaérobie du tractus intestinal, soit le cæcum ou le colon (15). Les bactéries peuvent ensuite se multiplier et coloniser la muqueuse intestinale (Figure 1B) (15, 36, 37).
La majorité du temps, la flore intestinale normale peut contrer la colonisation de l’intestin par des bactéries entériques pathogènes (résistance à la colonisation) à l’aide de trois mécanismes : l’inhibition directe (ex. : production de bactériocines ainsi que sous-produits métaboliques inhibant la croissance des pathogènes et barrière empêchant l’adhésion des bactéries pathogènes à l’épithélium du tractus intestinal), la compétition pour les ressources nutritionnelles, et la stimulation du système immunitaire (38-41). Toutefois, il arrive qu’un débalancement de la flore permette la colonisation (35, 42). La colonisation correspond à un état où la bactérie est présente dans l’intestin, mais dont la croissance est contenue (43). Lorsque la flore est débalancée et que la diversité des microorganismes est réduite, il y a moins de compétition pour les ressources, permettant alors au C. difficile d’occuper une niche écologique qui n’était pas disponible auparavant (35). Ainsi, en présence d’une flore microbienne perturbée, le C. difficile peut coloniser les intestins, puisqu’il n’y a plus l’effet de barrière que procurait la flore intestinale saine (12, 40, 44).
Divers facteurs peuvent déséquilibrer la flore intestinale et permettre la colonisation. Les plus couramment cités dans la littérature sont : les traitements de chimiothérapie, l’utilisation d’inhibiteurs de pompe à proton ainsi que l’alimentation par sonde (45, 46). Les traitements de chimiothérapie peuvent entraîner une diminution de la diversité de certains genres bactériens ainsi qu’une diminution du nombre absolu de bactéries (45, 47). De plus, la chimiothérapie peut entraîner une desquamation de la muqueuse intestinale (47). Quant aux inhibiteurs de pompe à proton et aux antagonistes des récepteurs H2, ils augmentent le pH du contenu
gastrique ce qui entraîne une survie plus importante des cellules végétatives passant dans l’estomac et par la suite dans le tractus intestinal (46, 48, 49). En temps normal, les cellules végétatives ingérées sont éliminées par l’acide gastrique, mais les spores y sont résistantes (46, 48). Les inhibiteurs de pompe à proton peuvent également entraîner une altération dans la composition de la flore intestinale (49). L’alimentation à l’aide d’une diète élémentaire administrée par une sonde diminue les sécrétions pancréato-biliaires contrairement à une diète complexe (50). Les sécrétions pancréato-biliaires ont normalement pour effet d’inhiber la croissance des bactéries (50). L’alimentation par sonde a aussi pour effet de réduire la motilité des intestins qui, en temps normal, permet de limiter l’adhésion des bactéries aux parois du tube digestif (50).
Certains individus seront colonisés par le C. difficile, mais ne développeront pas l’infection; ils deviendront alors des personnes colonisées asymptomatiques (37, 43). Dans le cas de la colonisation asymptomatique, le C. difficile est présent dans le côlon et se retrouve dans les selles, mais il n’y a pas de production de toxines (2, 51). Ainsi, la culture d’échantillon de selles sera positive pour le C. difficile, mais le patient ne présentera pas de symptôme (2, 37, 51). De 40% à 90% des patients colonisés demeureront colonisés asymptomatiques alors que les 10% à 60% restant développeront une infection à C. difficile (3, 43). Cette variation des différents pourcentages peut être expliquée par la différence de réponse du système immunitaire contre la toxine A et la souche de C. difficile présente chez le patient (51, 52). En effet, les patients présentant une concentration plus
faible d’un certain anticorps contre la toxine A ont un risque plus élevé de développer l’infection (52). Par ailleurs, certaines souches mènent davantage à l’infection; ce serait le cas de la souche NAP1 (51). L’ingestion de spores de C. difficile ne mènera pas obligatoirement à la colonisation dans tous les cas (23, 35, 43). Tel que mentionné précédemment, une flore intestinale saine pourra empêcher la colonisation par le C. difficile (38). Dans ce cas, les spores qui auront été ingérées seront éliminées dans les fèces (43).
1.2.3 Infection à C. difficile
À la suite de la colonisation de l’intestin par le C. difficile, un débalancement de la flore intestinale peut entraîner la prolifération du C. difficile due à l’absence d’inhibition compétitive et donc mener à l’infection (Figure 1C) (53). Certains facteurs augmentent le risque de développer une infection, les principaux sont : la prise d’antibiotiques, la prise d’inhibiteurs de pompe à proton, la diète élémentaire par sonde et l’âge. L’utilisation d’antibiotiques peut perturber l’équilibre écologique de la flore intestinale et favoriser la prolifération de certaines espèces bactériennes opportunistes pouvant être pathogènes, comme par exemple le C. difficile (39, 41, 53, 54). En effet, les antibiotiques altèrent la composition de la flore intestinale, réduisent la diversité des microorganismes et réduisent aussi la quantité de bactéries commensales normalement présentes (35, 53). De façon similaire, un débalancement de la flore intestinale pourrait aussi être entraîné par l’utilisation d’inhibiteurs de pompe à proton (49). La diète élémentaire, administrée par une sonde, favorise quant à elle la croissance du C. difficile ainsi que la production de toxine par la bactérie (55). Le mécanisme par lequel cela est possible n’a pas encore été élucidé, mais des hypothèses ont été avancées à l’effet que ce puisse être dû au manque d’acide gras à chaîne courte et au manque de fibres fermentescibles limitant habituellement la croissance et la production de toxine par le C. difficile (55). Finalement, la sénescence immunologique causée par un âge avancé pourrait entraîner une réponse immunitaire altérée ou inadéquate pour contenir la prolifération du C. difficile (56, 57).
C’est à la suite de l’adhésion du C. difficile aux cellules épithéliales intestinales et à sa prolifération qu’il y a production de toxines par la bactérie (36). Cependant, ce ne sont pas toutes les souches qui peuvent produire des toxines (34, 58). Chez les souches toxinogènes, la production de toxines est influencée par l’environnement entourant la bactérie ainsi que par son état métabolique (34). La toxine B et la toxine binaire entraînent la nécrose des cellules touchées (12, 44, 59, 60). La toxine A rend l’épithélium intestinal plus perméable, entraînant une réponse inflammatoire et une accumulation de liquide au niveau de l’intestin (12, 61-63). Ces modifications au niveau de l’intestin auront pour effet de provoquer de la diarrhée chez la personne infectée (12). Dans le cas où il y a production de toxines par le C. difficile et donc présence de symptômes, il est question d’infection (58, 63).
Le tableau clinique de l’infection à C. difficile peut varier d’une personne à une autre (64, 65). Cependant, le symptôme le plus commun de l’infection à C. difficile est la diarrhée (2, 65-67). Dans le cas de la forme légère de l’infection, il peut y avoir présence de crampes abdominales en plus de la diarrhée (3, 36, 60, 62, 66). Dans le cas de la forme modérée de l’infection, il y a une diarrhée profuse avec possibilité de sang dans les selles (3, 37). De plus, des signes et symptômes systémiques comme la fièvre, la nausée, l’anorexie et la leucocytose peuvent être présents pour les formes modérée et sévère de l’infection (3, 37). Dans le cas de la forme sévère de l’infection, il y a habituellement une diarrhée profuse, mais elle peut être absente dans le cas d’une occlusion intestinale (3, 37, 59, 65). Les manifestations cliniques de la forme sévère de l’infection sont la colite pseudomembraneuse et la colite fulminante (3, 68). La colite fulminante se développe chez 1 à 3% des patients infectés par le C. difficile et entraîne les complications les plus graves : occlusion intestinale, perforation, mégacôlon toxique et mort (2, 68, 69).
À la suite de la croissance des cellules végétatives de C. difficile, il y a sporulation des cellules au niveau du cæcum et du côlon (34). Des spores, de façon majoritaire, et des cellules végétatives de C. difficile sont excrétées dans les fèces (34). C’est à la suite de l’excrétion des spores qu’il y a contamination de l’environnement et possiblement, transmission à d’autres patients par la voie fécale-orale (2, 34).
1.2.4 Restauration de la résistance à la colonisation
Idéalement, pour traiter les infections à C. difficile, il faut d’abord cesser d’administrer l’agent ayant contribué à déclencher l’infection; la plupart du temps, il s’agit de la prise d’antibiotiques (Figure 1D) (62, 67). Cette action peut être suffisante pour régler les formes légères de l’infection (59, 62). Dans les autres cas, un traitement sera requis. Les traitements les plus courants sont : l’administration d’antibiotiques, la chirurgie, l’administration de probiotiques et le transplant fécal (62, 70-72).
Selon la sévérité de l’infection, pour un premier épisode ou une première récidive, un traitement antibiotique avec le métronidazole, la fidaxomycine ou la vancomycine sera administré (22, 62, 70, 73). Pour le traitement de plus d’une récidive, l’antibiotique à utiliser est la vancomycine administrée de façon pulsée, car cela permettrait de tuer le C. difficile de façon plus efficace en laissant les spores germiner entre deux séries d’administration de l’antibiotique (22, 74). L’utilisation de probiotiques en complément du traitement antibiotique n’est pas recommandée faute de preuves suffisantes montrant son efficacité dans le traitement des infections à C. difficile, selon une revue Cochrane (71). Cependant, selon une méta-analyse, les probiotiques (S. boulardii) pourraient être utiles, en complément du traitement habituel, pour la réduction des récidives (75). La chirurgie, qui consiste en une résection de la portion atteinte du côlon en plus d’une
iléostomie, peut être requise pour traiter la colite fulminante, lorsqu’un patient ne répond pas bien aux traitements antibiotiques ou qu’il montre des signes de septicémie (2, 58, 70, 76). Le transplant fécal pourrait être un traitement alternatif de l’infection à C. difficile. Il consiste à transférer les fèces d’une personne saine (le donneur) au patient infecté afin de restaurer la flore intestinale du patient (42). Il faut cependant souligner la possibilité de transmission d’agents infectieux du donneur au receveur (72). Il est donc important de tester les fèces du donneur afin de diminuer le plus possible le risque de maladie transmissible (72). Les recommandations quant à l’utilisation du transplant fécal sont d’envisager cette option s’il y a une troisième récidive de l’infection suite au traitement antibiotique pulsé avec la vancomycine (70). Les résultats d’une méta-analyse indiquent que pour 89% des patients traités à l’aide du transplant fécal pour une récidive d’infection à C. difficile, il y a eu résolution de l’infection (77).
Afin qu’il y ait guérison, il doit y avoir restauration de la résistance à la colonisation, qui passe par la restauration de la flore intestinale saine (Figure 1D) (35, 78). Cette restauration de la flore permettra de rétablir la barrière protective contre le C. difficile et d’empêcher une récidive de l’infection (42).
1.2.5 Récidive
Bien que la plupart des patients vont bien répondre au traitement antibiotique, de 5 à 30% des patients développent une infection récurrente après la prise du traitement initial d’antibiotiques (23, 40, 62, 69) (Figure 1E). Il se peut qu’il y ait récurrence de l’infection puisque l’antibiotique n’est efficace que contre la forme végétative du C. difficile (78, 79). Ainsi, les spores ne sont pas affectées par l‘antibiotique et à la suite de l’arrêt du traitement, il pourra y avoir récidive de l’infection à la suite de la germination des spores (58, 78, 79). Il peut aussi y avoir récidive dans le cas où il y a une réponse immunitaire inefficace contre les toxines de C. difficile (34). Les patients ayant une première récidive d’infection sont plus à risque de subir d’autres récidives (23, 69). En effet, à la suite d’une première récidive de l’infection, le risque de récidive est de 40 à 60% (40). Une récidive correspond à une deuxième infection à C. difficile dans les 60 jours suivants la fin de la première (51, 78). Les infections récurrentes nécessitent des traitements répétés aux antibiotiques entraînant un débalancement persistant de la flore intestinale, pouvant induire un cycle de récidive (40, 69).
Figure 1. Histoire naturelle de l’infection à C. difficile. (Images provenant de Servier Medical Art www.servier.fr, sans droit d’auteur, et inspiré de Britton, Gastroenterology, 2014.)
1.3 Épidémiologie de l’infection à C. difficile
1.3.1 Taux d’incidence de l’infection dans les hôpitaux et fardeau
Le risque de développer une infection à C. difficile acquise à l’hôpital est estimé à 1 sur 100 admissions lors d’un séjour à l’hôpital, selon une étude menée à l’Hôpital d’Ottawa de 2002 à 2009 (80). Dans cet article, une infection à C. difficile est considérée comme ayant été acquise à l’hôpital si les symptômes de l’infection apparaissent après 72 heures suivant l’admission à l’hôpital (80). Cependant, les critères définissant l’infection à C. difficile comme étant nosocomiale peuvent différer selon les articles (2, 51, 81).
Dans les hôpitaux canadiens, environ 15 000 nouveaux cas d’infection à C. difficile associés à l’hospitalisation sont rapportés chaque année (4). De plus, le taux de létalité à 30 jours au Canada est d’environ 5% (4). Chez les gens âgés de 65 ans et plus, le taux de létalité est environ 3,5 fois plus élevé comparativement aux gens âgés de 18 à 64 ans; soit des taux respectifs de 7% et 2% (82). Cette statistique peut augmenter jusqu’à 50% dans le cas de patients ayant développé une colite pseudomembraneuse résultant de l’infection, tandis qu’elle sera de 24% à 38% dans les cas de mégacôlon toxique (62, 64).
Au Québec, une augmentation de l’incidence d’infection à C. difficile et de la létalité a été observée de 1991 à 2003 (6). Le taux d’incidence est passé de 36 cas/100 000 habitants en 1991 à 156 cas/100 000 habitants en 2003 et le taux de létalité à 30 jours suivant le diagnostic d’infection à C. difficile est passée de 4,7% à 13,8% (6). Pour les gens âgés de 65 ans et plus, le taux d’incidence a lui aussi augmenté durant cette même période, passant d’environ 100 cas/100 000 habitants à 866 cas/100 000 habitants en 2003 (6). La proportion de cas présentant des complications a aussi augmenté; passant de 7,1% en 1991 et 1992 à 18,2% en 2003 (6). L’augmentation du taux d’incidence d’infection à C. difficile a été associée à l’émergence de la souche épidémique NAP1/027 (20, 83, 84). En effet, le ribotype 027 était présent en forte proportion parmi les souches détectées en 2003 et 2004 alors qu’il était absent en 2000 et 2001 (85). Cependant, cette augmentation ne s’est pas généralisée dans toutes les provinces. En effet, l’incidence de l’infection au Québec était environ deux fois plus élevée que celle des autres régions du pays en 2004 (11,9 vs 5,7 cas/10 000 jours-présence; Québec vs Autres provinces) et l’incidence est restée stable au Canada de 1997 à 2004-2005 (86).
À la suite des éclosions rapportées dans plusieurs hôpitaux de la province de Québec de 2003 à 2004, la surveillance provinciale des infections à C. difficile a été mise en place en 2004 par l’INSPQ (7). Par la suite, une diminution de l’incidence de l’infection a été observée de 2005 à 2010, passant de 13 cas/10 000 jours-présence en 2005 à 7 cas/10 000 jours-jours-présence en 2010 (8). Les taux d’incidence ont ensuite stagné de 2010 à 2015 (5). À noter que la façon de calculer les taux d’incidence d’infection à C. difficile à la suite de l’implantation de la surveillance diffère de celle présente auparavant dans la littérature afin de mieux
représenter le taux d’incidence au niveau de l’hôpital au lieu de la population en général. En effet, avant l’implantation de la surveillance, les taux d’incidence d’infection à C. difficile étaient calculés en «nombre de cas / 100 000 habitants» alors qu’à partir de l’implantation de la surveillance, les taux d’incidence de l’infection sont calculés en «nombre de cas / 10 000 jours-présence».
Au Canada, le coût total des infections à C. difficile, était estimé à 281 millions de dollars en 2012 ; 92% de ce montant étant attribuable aux coûts à l’hôpital, 4% aux coûts médicaux dans la communauté et 4% aux coûts pour la perte de productivité (9). Parmi l’ensemble des coûts reliés aux infections à C. difficile, 23% étaient reliés à la gestion des récidives de l’infection (9).
Les infections à C. difficile causent un fardeau pour les patients et les hôpitaux en augmentant la durée de séjour et le risque de décès, et en causant des récidives qui entraînent des réadmissions (80, 87-89). En effet, le risque absolu de décès augmente d’environ 10% à la suite de l’acquisition d’une infection à C. difficile à l’hôpital par rapport au risque de base lors d’un séjour à l’hôpital et la durée médiane de séjour augmente de 6 jours par rapport aux patients n’ayant pas acquis l’infection (80, 88, 89). Dans le cas de la forme sévère ou fulminante de l’infection, l’augmentation de la durée de séjour à l’hôpital est de 6 à 14 jours par rapport aux patients non-infectés par le C. difficile (89). Quant au portrait au Québec en 2003-2004 lors de l’épidémie de NAP1, la durée de séjour était augmentée en moyenne de 6,7 jours lors d’une première admission pour les patients ayant acquis une infection à C. difficile comparativement aux patients n’ayant pas acquis l’infection et présentant les mêmes caractéristiques que les patients infectés (témoins appariés) (90). En considérant aussi les hospitalisations multiples, l’augmentation moyenne de la durée de séjour était de 10,7 jours (90). Les infections à C. difficile augmentent aussi le nombre de réadmissions. Chaque année, pour un hôpital canadien moyen, il y a environ 7% des cas d’infection à C. difficile d’origine nosocomiale dont les symptômes se déclarent après le congé de l’hôpital et qui nécessite une réadmission (91). De plus, le coût minimal par réadmission est d’environ 12 800$ (91).
1.3.2 Saisonnalité
Une tendance saisonnière dans les taux d’incidence d’infection à C. difficile est observée pour l’hémisphère nord et l’hémisphère sud (92). Dans l’hémisphère nord, les taux d’incidence de l’infection atteignent leur sommet durant les mois de mars et avril alors qu’ils sont les plus faibles à l’été et à l’automne (92). Pour l’hémisphère sud, les taux d’incidence d’infection à C. difficile augmentent durant la deuxième moitié de l’année et atteignent leur sommet durant les mois d’octobre et novembre (92).
Divers facteurs ont été étudiés afin de pouvoir expliquer cette tendance saisonnière. Comme la prise d’antibiotique est associée au développement de l’infection à C. difficile, il se pourrait qu’un changement dans sa consommation puisse faire varier les taux d’incidence de l’infection. De ce fait, la consommation des antibiotiques suit aussi une tendance saisonnière (93). En Amérique du Nord, l’utilisation d’antibiotique est la plus élevée en janvier et février (93). En comparant les deux tendances, il y aurait un retard de 2 à 3 mois entre le pic d’utilisation d’antibiotiques et celui du taux d’incidence de l’infection (92). Il se pourrait donc qu’il y ait un décalage entre l’exposition aux antibiotiques et sa répercussion sur la courbe du taux d’incidence de l’infection (92). Quelques études ont montré une association entre l’infection à C. difficile et les infections respiratoires, qui elles aussi semblent avoir une tendance saisonnière (94-96). En effet, le nombre de cas d’infection à C. difficile a tendance à suivre le nombre de cas d’influenza d’un mois (94, 95). Ce serait aussi le cas pour le nombre de pneumonies (95). Il est cependant suggéré que l’influenza ou la pneumonie n’agirait pas directement sur l’infection à C. difficile; l’augmentation saisonnière du nombre de cas d’influenza augmenterait la prescription d’antibiotiques qui ferait augmenter à son tour le nombre de cas d’infection à C. difficile (94, 95). Selon une étude menée au Québec, l’impact des infections au virus respiratoire syncytial et de l’influenza sur les taux d’incidence d’infection à C. difficile est moins important dans les modèles contrôlant pour la prescription des antibiotiques, indiquant que l’effet de ces virus pourrait être en partie expliqué par l’utilisation des antibiotiques (96). Toutefois, cette même étude a montré que les séries chronologiques du nombre de cas d’influenza et de cas d’infection au virus respiratoire syncytial étaient associées à celle de l’infection à C. difficile indépendamment de la prescription des antibiotiques respiratoires (fluoroquinolones et macrolides) (96). Il est alors aussi suggéré que la saisonnalité de l’infection à C. difficile pourrait être due à une combinaison d’autres facteurs tels que l’augmentation du taux d’occupation dans les hôpitaux, les transferts inter-hospitaliers, un nombre personnel soignant insuffisant en période de haute occupation ou la difficulté à appliquer les mesures de prévention et contrôle des infections durant l’hiver (95, 96).
1.3.3 Colonisation asymptomatique
Dans la population générale, entre 0% à 15% des adultes en santé sont colonisés asymptomatiques par le C. difficile (97). La prévalence varie selon la population étudiée, la localisation et l’âge. Le scénario est différent chez les nourrissons et les enfants, car la bactérie est couramment retrouvée dans les fèces de ceux-ci (34). En effet, chez les nouveau-nés et les enfants en bas âge en santé, de 18% à 90% sont colonisés asymptomatiques (97).
La prévalence de patients colonisés asymptomatiques à l’admission à l’hôpital rapportée varie de 1,4% à 21,0% (98). Au Québec et en Ontario, 4,4% des patients adultes étaient colonisés asymptomatiques lors de
leur admission à l’hôpital en 2006-2007 (51). Par ailleurs, il y a eu une augmentation dans la prévalence des patients colonisés asymptomatiques colonisés par une souche toxinogène de C. difficile lors de leur admission à l’hôpital, de 1980 à 2013 (99). La proportion de patients devenant colonisés asymptomatiques à l’hôpital peut varier. En effet, il a été rapporté que de 4% à 29% des patients sont devenus colonisés asymptomatiques lors de leur séjour à l’hôpital, tout dépendant de l’hôpital et des facteurs de risque présents chez les patients (ex. : comorbidités) (97). Par exemple, chez les patients atteints de fibrose kystique, la proportion de colonisés asymptomatiques est de 18% à 47% tandis qu’elle est de 11% pour les patients atteints de maladie inflammatoire de l’intestin et de 8% pour les patients atteints de cancers hématologiques (97). De plus, le personnel soignant peut lui aussi être colonisé asymptomatique en proportions variant de 0% à 13% (97).
Plusieurs études ont suggéré que les personnes colonisées asymptomatiques participent de façon non négligeable à la transmission du C. difficile dans les hôpitaux (100-102). Une étude menée dans un hôpital de Cleveland a montré que, bien que les personnes colonisées asymptomatiques aient une contamination de la peau et de leur environnement par le C. difficile moins importante que les patients infectés (symptomatiques), ils étaient cependant trois fois plus importants en nombre que les patients infectés (100). Une autre étude, menée dans un hôpital de Minneapolis, vient appuyer cette suggestion; dans 84% des cas d’acquisition nosocomiale du C. difficile, la souche en cause avait été introduite sur l’unité étudiée par un patient colonisé asymptomatique (101). De plus, bien que les patients admis à l’hôpital provenant de la maison et n’ayant pas été hospitalisés dans les 30 jours précédant leur admission présentaient le plus faible taux de colonisation, ils étaient les deuxième en importance à contribuer à l’introduction du C. difficile et ce, grâce à leur importance en nombre (101). Finalement, une étude utilisant une technique de typage moléculaire a été utilisée afin de déterminer les voies de transmission du C. difficile a montré que les patients colonisés asymptomatiques étaient la source de 29% des infections à C. difficile acquises à l’hôpital (102).
1.4 Facteurs de risque et protecteurs
Les facteurs de risque et protecteurs qui agissent directement sur les personnes sont classés en tant que facteurs de risque et protecteur au niveau individuel. Ceux faisant partie d’interventions mises en place dans les hôpitaux sont classés en tant que facteurs de risque et protecteur au niveau de l’hôpital.
1.4.1 Facteurs de risque et protecteurs au niveau individuel
Les facteurs de risque et protecteurs au niveau individuel peuvent être classés en deux catégories, soit les facteurs influençant la transmission et les facteurs influençant la vulnérabilité pour l’infection à C. difficile. Les facteurs influençant la transmission agissent au niveau de la personne exempte de C. difficile et influence le
fait qu’elle sera colonisée ou non. Les facteurs influençant la vulnérabilité à l’infection agissent au niveau de la personne colonisée par le C. difficile et influence le développement de l’infection ou non. Les différents facteurs de risque au niveau individuel sont présentés au Tableau 1.
Pour la Transmission
Les facteurs de risque pour la transmission les plus souvent mentionnés dans la littérature sont une hospitalisation dans les 2 mois précédents (RC = 2,2), la prise de chimiothérapie (RC = 2,4), d’inhibiteurs de pompe à proton (RC = 1,7), d’antagonistes des récepteurs H2 (RC = 2,1) et la présence d’anticorps contre la
toxine B (RC = 1,8) (Tableau 1) (51).
Pour la vulnérabilité à l’infection
Les facteurs de risque pour la vulnérabilité à l’infection les plus mentionnés dans la littérature sont l’âge (RC = 1,01-1,04 pour chaque augmentation d’un an), la prise d’antibiotiques (RC = 1,6) et la prise d’inhibiteurs de pompe à proton (RC = 1,4-10,1) (Tableau 1) (51, 103-110). Les facteurs de risque pour la vulnérabilité à l’infection ayant les plus grandes associations sont la colonisation par le Staphylococcus aureus résistant à la méthicilline (SARM) (RC = 7,8), l’hospitalisation aux soins intensifs (RC = 39,2) et le fait de subir une procédure gastro-intestinale durant l’hospitalisation (RC = 23,2) (Tableau 1) (111, 112).
Il faut aussi souligner que le risque de mortalité diffère selon l’âge. En effet, le risque de mortalité à 30 jours parmi les patients ayant atteints d’infection à C. difficile est plus élevée chez les patients âgés de 65 à 74 ans (RC = 3,6, IC 95% : 1,2-10,5) et chez les patients âgés de 75 ans et plus (RC = 3,2, IC 95% : 1,3-8,3) comparativement aux patients âgés de 20 à 64 ans (113).
Tableau 1. Facteurs de risque et protecteurs au niveau individuel pour la colonisation ou l’infection à C. difficile.
Facteurs de risque et/ou protecteur Mesure
d’association Signification statistique Références
Colonisation à l’admission (transmission)
Comorbidités
Insuffisance rénale RC = 6,7 IC : 2,2-20,9 (114)
Antécédent de cytomégalovirus RC = 4,2 IC : 1,3-13,9 (115)
Transplantation d’organe solide RR = 4,7 IC : 1,2-18,7 (116)
Hospitalisation
Hospitalisation dans les 3 mois précédents RR = 1,6 IC : 1,1-2,3 (99)
Traitements
Antibiotiques dans les 30 jours précédents RP = 2,2 p = 0,04 (117)
Dialyse chronique RC = 8,1 IC : 1,8-36,7 (118)
Utilisation de corticostéroïdes RC = 3,1 IC : 1,2-7,7 (118)
Colonisation durant l’hospitalisation (transmission)
Caractéristiques des patients
Présence d’anticorps contre la toxine B RC = 1,8 IC : 1,2-2,7 (51)
Comorbidités
Maladie sous-jacente extrême‡ RR = 12,5 IC : 1,7-92,3 (119)
Hospitalisation
Hospitalisation dans les 2 mois précédents RC = 2,2 IC : 1,3-3,6 (51)
Traitements
Thérapie antibiotiques systémique ≤3 mois avant admission RC = 4,6 IC : 1,1-18,7 (120)
Utilisation antérieure de Céfépime (≤1 mois) RC = 5,3 IC : 2,1-13,2 (120)
Utilisation de glycopeptides (unique classe durant hospitalisation) RC = 3,6 IC : 1,1-12,5 (120)
Prise de chimiothérapie RC = 2,4 IC : 1,1-5,1 (51)
Prise d’inhibiteurs de pompe à proton (jusqu’à 8 sem. avant
l’admission et/ou durant l’hospitalisation) RC = 1,7 IC : 1,2-2,5 (51)
Prise d’antagonistes des récepteurs H2 (jusqu’à 8 sem. avant
l’admission et/ou durant l’hospitalisation) RC = 2,1 IC : 1,2-3,7 (51)
Antiacide (utilisation pendant plus d’une semaine) RR = 1,8 IC : 1,02-3,2 (119)
Émollient fécal RR = 2,0 IC : 1,1-3,7 (119)
Infection durant l’hospitalisation (vulnérabilité à l’infection)
Caractéristiques des patients
Âge (par augmentation d’un an) RC = 1,01 – 1,04 IC : [1,01-1,01]-[1,03-1,05] (51, 103-105)
Niveau faible d’albumine (2.5-3.5 g/dL vs >3.5g/dL) RC = 1,4 IC : 1,1-1,8 (121)
Comorbidités
Insuffisance rénale RC = 1,6 – 4,0 IC : [1,3-1,9]-[1,1-14,2] (103, 122)
Problème de coagulation RC = 1,8 IC : 1,3-2,4 (103)
Troubles électrolytiques et de fluides RC = 1,5 IC : 1,3-1,8 (103)
Colonisation par le SARM† RC = 7,8 IC : 2,3-26,0 (111)
Infection à C. difficile dans les 3 mois précédents RR = 2,0 IC : 1,2-3,3 (104)
Hospitalisation
Hospitalisation dans les 3 mois précédents RR = 2,9 – 5,0 p <0,05 - <0,003 (111, 123)
Hospitalisation aux soins intensifs RC = 39,2 IC : 2,2-713,0 (112)
Hospitalisation dans une chambre de ≥3 lits RC = 1,6 p = 0,05 (123)
Facteurs de risque et/ou protecteur Mesure
d’association Signification statistique Références
Durée de séjour à l’hôpital (par jour additionnel) RC = 1,04 IC : 1,0-1,1 (87)
Patient alité RC = 1,7 p = 0,01 (123)
Traitements
Prise d’antibiotiques (tous) RC = 1,6 IC : 1,3-1,9 (106)
Prise de céphalosporines RC = 2,0 IC : 1,2-3,2 (106)
Prise de sulfonamides, trimethoprime RC = 1,8 IC : 1,04-3,1 (106)
Prise de quinolones RC = 1,7 IC : 1,2-2,4 (106)
Prise de clindamycine RC = 2,9 IC : 2,0-4,0 (106)
Prise de carbapénèmes RC = 1,8 IC : 1,3-2,7 (106)
Prise de métronidazole RC = 0,5 – 0,7 IC : [0,08-2,5]-[0,5-0,9] (121, 124-126)
Prise de probiotiques lors de la prise d’antibiotiques RR = 0,4 IC : 0,3-0,6 (127)
Prise d’inhibiteurs de pompe à proton RC = 1,4 – 10,1 IC : [1,3-1,6]-[1,2-87,4] (107-110)
Prise d’antagonistes des récepteurs H2 RC = 0,98 – 2,1 IC : [0,6-1,0]-[0,9-5,3] (46, 51, 103, 121, 122)
Prise d’agent antimotilité RC = 1,3 IC : 1,1-1,7 (121)
Procédure gastro-intestinale durant l’hospitalisation RC = 23,2 IC : 2,1-255,0 (112)
Tube nasogastrique RC = 1,0 – 3,6 IC : [0,2-6,5]-[1,0-14,3] (51, 87, 107)
Ventilation mécanique RC = 1,9 IC : 1,4-2,6 (121)
*RC : Rapport de cote, RR : Rapport de risque, IC : Intervalle de confiance à 95%, p : valeur-p. † SARM : Staphylococcus aureus résistant à la méthicilline.
1.4.2 Facteurs de risque et protecteurs au niveau de l’hôpital
Les facteurs de risque et protecteurs au niveau de l’hôpital peuvent être classés en deux catégories, soit les Mesures de prévention de la transmission et les Mesures diminuant la vulnérabilité aux infections. Les Mesures de prévention de la transmission agissent au niveau des patients exempts de C. difficile et visent à empêcher l’ingestion de spores (Figure 2). Les Mesures diminuant la vulnérabilité aux infections agissent au niveau des patients déjà colonisés par le C. difficile et visent à empêcher le développement de l’infection chez ces personnes (Figure 2). Les différents facteurs de risque au niveau de l’hôpital sont présentés au Tableau 2.
Surveillance
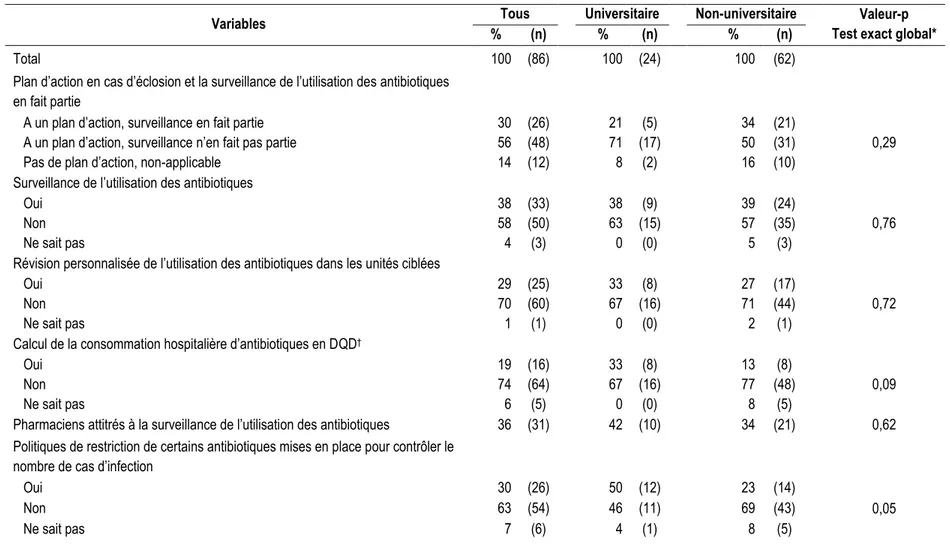
Les facteurs de risque les plus importants au niveau de l’hôpital identifiés grâce à la surveillance provinciale des infections à C. difficile sont la mission de l’hôpital, le nombre de lits et l’âge des patients fréquentant l’hôpital (Tableau 2). Le rapport de taux d’incidence d’infection à C. difficile pour les hôpitaux à mission universitaire varie, pour les années 2007-2008 à 2014-2015, de 1,2 (IC 95% : 1,1-1,2) à 1,7 (IC 95% : 1,6-1,8) comparativement aux hôpitaux à mission non-universitaire (5, 7, 128-131). Cependant, cette association s’est inversée en 2015-2016, alors que le rapport de taux d’incidence est de 0,90 (IC 95% : 0,8-1,0, valeur-p < 0,05) pour les hôpitaux universitaires comparativement aux non-universitaires (11). Le rapport de taux d’incidence d’infection à C. difficile pour les hôpitaux de 250 lits et plus varie de 1,40 à 1,68 comparativement aux hôpitaux de moins de 100 lits (7, 128, 129). Le rapport de taux d’incidence d’infection à C. difficile pour les hôpitaux dont la clientèle comprend 35% ou plus de gens âgés de plus de 65% varie de 1,10 à 1,54 comparativement aux hôpitaux dont la clientèle en comprend moins de 35% (7, 128, 129).
Mesures de prévention de la transmission
Les mesures de prévention de la transmission les plus discutées dans la littérature et ayant les associations les plus importantes sont l’utilisation de thermomètres jetables et l’utilisation de gants lors de contacts avec des substances corporelles (Tableau 2). En effet, le remplacement des thermomètres électroniques par des thermomètres jetables entraîne une réduction de l’incidence d’infection à C. difficile de 35% à 56% lorsque cette mesure est appliquée (29, 132). De plus, l’utilisation de gants de vinyle pour tous les contacts avec des substances corporelles, permettant de réduire la contamination des mains du personnel soignant, entraîne une réduction de l’incidence d’infection à C. difficile de 81% (133).
Par ailleurs, une mesure de prévention de la transmission nouvellement étudiée est la détection et l’isolement des patients colonisés asymptomatiques par le C. difficile dès leur entrée à l’hôpital. Pour ce faire, lors de l’admission de patients par le département d’urgence, ceux-ci sont testés afin de déterminer s’ils sont colonisés par le C. difficile et s’ils sont positifs pour la bactérie, ils sont isolés afin d’en réduire la transmission.
La détection des patients colonisés asymptomatiques à leur admission à l’hôpital par le département d’urgence et l’isolement des patients positifs a permis de réduire l’incidence de l’infection de 57% (134).
Mesures diminuant la vulnérabilité aux infections
Au niveau de l’hôpital, les mesures diminuant la vulnérabilité aux infections à C. difficile sont la rationalisation de l’usage des antibiotiques et l’administration de probiotiques lors de l’administration d’antibiotiques (Tableau 2). La rationalisation de l’usage des antibiotiques entraîne une réduction du risque de contracter l’infection de 52% lorsque mise en place (135). L’efficacité de l’usage de probiotiques pour réduire le risque d’infection par C. difficile demeure controversée. Une méta-analyse indique que l’administration de probiotiques simultanée à l’administration d’antibiotiques entraîne une réduction de l’incidence de récidive de l’infection de 41% (Tableau 2) (71). Toutefois, les résultats plus récents d’une étude multicentrique, randomisée, en double-aveugle indiquent que l’utilisation de probiotiques afin de prévenir une première infection à C. difficile, et non une récidive de l’infection, ne serait pas efficace (136).
Figure 2. Schématisation de l’endroit où agissent les Mesures de prévention de la transmission et les Mesures diminuant la vulnérabilité aux infections dans l’histoire naturelle de l’infection à C. difficile. (Images provenant de Servier Medical Art www.servier.fr, sans droit d’auteur, et inspiré de Britton,
Tableau 2. Facteurs de risque et protecteurs au niveau de l’hôpital (mesures implantées) pour l’infection ou la colonisation à C. difficile.
Facteurs de risque et/ou protecteurs Mesure d’association Signification
statistique Références
Facteurs identifiés grâce à la surveillance (Profil des hôpitaux)
Mission universitaire RTI = 1,30 – 1,44 IC : [1,2-1,5]-[1,3-1,6] (7, 128, 129)
Nombre élevé de lits (≥250 lits vs <100 lits) RTI = 1,40 – 1,68 IC : [1,2-1,6]-[1,4-2,0] (7, 128, 129)
Pourcentage de la clientèle âgée de >65 ans (≥35% vs <35%) RTI = 1,10 – 1,54 IC : [1,0-1,2]-[1,4-1,7] (7, 128, 129)
Mesures de prévention de la transmission
Décontamination des chambres des patients avec infection à C. difficile avec de la vapeur de peroxyde d’hydrogène après leur départ
RTI = 0,56 – 0,65 p = 0,047 – 0,09 (137-140)
Ajout de la désinfection à la lumière ultraviolette à la suite du nettoyage terminal après départ des patients avec infection à C. difficile
RTI = 0,47 – 0,78 p = 0,01 – 0,06 (141, 142)
Utilisation d’eau de javel (hypochlorite) au lieu du détergent
habituel pour désinfection RTI = 0,15 – 0,52 p < 0,001 - <0,0001 (143-145)
Remplacement des thermomètres électroniques par des
thermomètres jetables RTI = 0,44 – 0,65 p = 0,03 - <0,01 (29, 132)
Utilisation de gants en vinyle pour tous les contacts avec des
substances corporelles RTI = 0,19 p = 0,02 (133)
Détection des patients colonisés asymptomatiques lors de leur entrée par le département d’urgence et précautions d’isolement de contact pour les patients positifs
RTI = 0,43 p < 0,01 (134)
Inspection de la désinfection à l’aide d’ultraviolet suivie d’audits
et de rétroaction sur les audits RTI = 0,78 p = 0,05 (146)
Mesures diminuant la vulnérabilité aux infections
Rationalisation de l’usage des antibiotiques RR = 0,32 – 0,62 IC : 0,38-0,62 (135)
Administration de probiotiques lors de la prise d’antibiotiques
(pour empêcher une première infection) RR = 0,71 IC : 0,34-1,47 (136)
Administration de probiotiques lors de la prise d’antibiotiques
(pour empêcher les récidives d’infection) RTI = 0,41 – 0,85 IC : 0,35-0,98 (71)
Chapitre 2 – Méthodologie
2.1 Cadre conceptuel
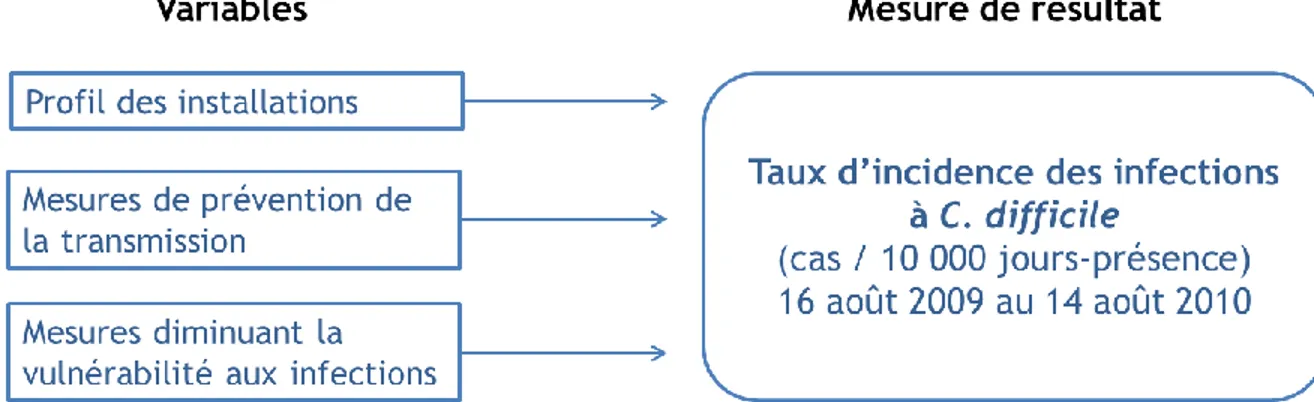
Afin de répondre aux objectifs #1 et 2, un cadre conceptuel du modèle prédictif a été développé (Figure 3). Ce cadre conceptuel montre l’association possible entre les différents facteurs de risque et/ou protecteurs (variables potentiellement prédictives) contenus dans les différentes catégories (Profil des installations, Mesures de prévention de la transmission, Mesures diminuant la vulnérabilité aux infections) et le taux d’incidence d’infection à C. difficile (Figure 3).
Ce cadre conceptuel a été développé à partir des informations connues sur l’histoire naturelle de l’infection à C. difficile, à partir d’études portant sur les facteurs de risque et/ou protecteurs de l’infection et à partir des rapports de la surveillance provinciale des infections à C. difficile (Tableau 1 et Tableau 2). Nous avons regroupé les différentes mesures mises en place dans les hôpitaux en deux catégories, soit les Mesures de prévention de la transmission et les Mesures diminuant la vulnérabilité aux infections. Les différentes mesures appliquées ont été classées dans ces deux catégories, puisqu’elles font référence aux deux endroits dans le cycle de l’histoire naturelle où il est possible d’intervenir afin d’éviter l’infection à C. difficile (Figure 2). Nous avons ajouté la catégorie Profil des installations, malgré qu’elle ne fasse pas partie de l’histoire naturelle, afin de prendre en compte les facteurs de risque (caractéristiques) inhérents et non-modifiables qui font partie de l’hôpital et de sa structure. De plus, plusieurs études portent sur ce type de caractéristiques; il était donc important de les inclure dans les analyses (Tableau 1 et Tableau 2).
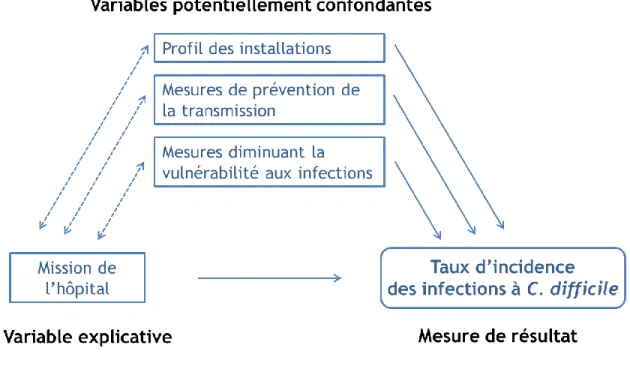
Afin de répondre à l’objectif #3, un cadre conceptuel de modèle explicatif a été développé (Figure 4). Les flèches pointillées indiquent des associations potentielles (facteurs potentiellement confondants), tandis que les flèches pleines indiquent des associations connues. Suite à la surveillance des infections à C. difficile, un facteur de risque majeur qui en est ressorti est la mission universitaire (7, 83). Il nous était difficile de comprendre l’association entre la mission et le taux d’incidence d’infection à C. difficile. Ainsi, nous nous sommes questionnés à savoir si cette association était bien réelle ou s’il s’agissait d’un proxy pour une ou d’autres variables. Nous avons donc voulu examiné s’il existait des variables pouvant confondre l’association entre la mission et le taux d’incidence de l’infection qui est observée. Ce cadre conceptuel permet donc d’évaluer si certaines variables du Profil des installations, des Mesures de prévention de la transmission ou des Mesures diminuant la vulnérabilité aux infections pourraient confondre l’association entre la mission de l’hôpital (universitaire ou non-universitaire) et le taux d’incidence d’infection à C. difficile (Figure 4).
Figure 4. Cadre conceptuel du modèle explicatif.
2.2 Devis et Population
La présente étude est une étude descriptive transversale portant sur 86 hôpitaux québécois faisant partie de la surveillance provinciale des infections à C. difficile, appartenant à un centre hospitalier de soins généraux et spécialisés, et ayant plus de 1 000 admissions en soins de courte durée par année (excluant la psychiatrie, la néonatalogie et la pouponnière).