En vue de l'obtention du
DOCTORAT DE L'UNIVERSITÉ DE TOULOUSE
Délivré par :Institut National Polytechnique de Toulouse (Toulouse INP)
Discipline ou spécialité :
Pathologie, Toxicologie, Génétique et Nutrition
Présentée et soutenue par :
M. ELIAS SALEM le mercredi 24 octobre 2018
Titre :
Unité de recherche : Ecole doctorale :
Bronchopneumonies infectieuses des jeunes bovins: de la complexité du
microbiome aux particularités évolutives et cliniques de virus respiratoires
encore méconnus.
Sciences Ecologiques, Vétérinaires, Agronomiques et Bioingénieries (SEVAB)
Interactions Hôtes - Agents Pathogènes (IHAP)
Directeur(s) de Thèse : M. GILLES MEYER MME MARIETTE DUCATEZ
Rapporteurs :
M. ETIENNE THIRY, UNIVERSITE DE LIEGE Mme CAROLINE LEROUX, INRA LYON
Membre(s) du jury :
Mme CAROLINE LEROUX, UNIVERSITE LYON 1, Président
M. GILLES MEYER, ECOLE NATIONALE VETERINAIRE DE TOULOUSE, Membre Mme CECILE MALNOU, UNIVERSITE TOULOUSE 3, Membre
Mme GAELLE SIMON, ANSES, Membre
Mme MARIETTE DUCATEZ, ECOLE NATIONALE VETERINAIRE DE TOULOUSE, Membre
T
ABLE DES MATIERES
Table des matières ... i
Liste des figures ... iv
Liste des tableaux ... iv
Liste des abréviations ... v
ETUDE BIBLIOGRAPHIQUE ... 1
Les bronchopneumonies infectieuses chez les bovins : définition et I. importance 2 1. Définition ... 2
2. Importance des BPI ... 4
Les agents pathogènes respiratoires bovins ... 8
II. 1. Fréquence des agents infectieux ... 8
2. Pouvoir pathogène des principales bactéries ... 13
3. Pouvoir pathogène des principaux virus ... 17
4. Interactions entre agents pathogènes respiratoires ... 23
Identification de nouveaux agents pathogènes respiratoires ... 29
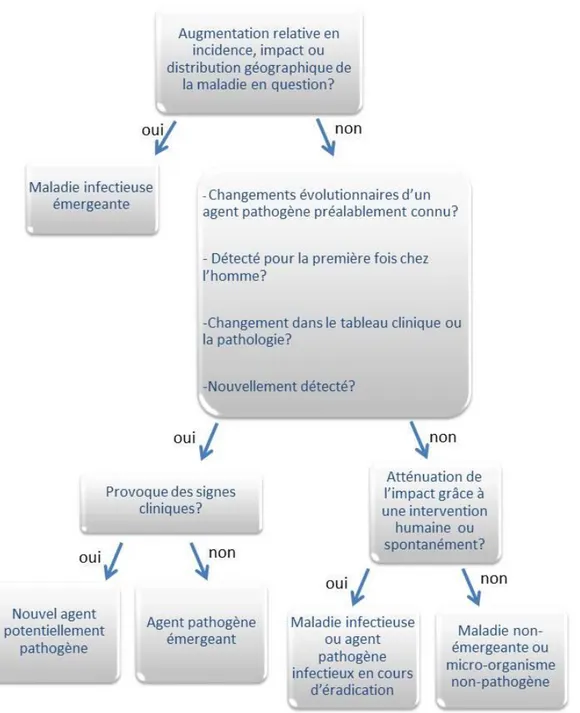
III. 1. Notions sur les maladies émergentes chez l’homme ... 29
2. Les nouvelles méthodes pour identifier de « nouveaux » agents pathogènes 33 IV. de type D Les « nouveaux » virus respiratoires bovins : cas de l’influenzavirus 38 1. Historique des infections à virus influenza A (IAV) chez les bovins ... 38
2. Découverte d’un nouveau virus influenza de type D chez les bovins 41 3. Propriétés générales des virus Influenza D ... 42
4. Réservoir, spectre d’hôte et pouvoir pathogène ... 46
Environnement microbien et pathologie respiratoire ... 52 V.
1. La notion de microbiote ... 52
2. Le microbiote respiratoire de l’homme ... 57
3. Interactions microbiome et agents pathogènes : le pathobiome ... 64
4. Microbiome et pathobiome respiratoire bovin ... 66
DESCRIPTION DES TRAVAUX DE RECHERCHE ... 77
Chapitre I : Identification des virus respiratoires bovins ... 78
Introduction et connaissances actuelles ... 78
I. II. Détection des virus respiratoires par approche NGS chez des veaux affectés par la bronchopneumonie infectieuse ... 81
1. Matériel et Méthodes ... 81
2. Résultats ... 86
III. Caractérisation génétique des coronavirus bovins : évolution et épidémiologie moléculaire ... 96
Article : « Global transmission, spatial segregation and recombination determine the long-term evolution and epidemiology of Bovine Coronaviruses » . 97 Chapitre 2 : Identification et caractérisation du bactériote respiratoire bovin ... 132
Introduction ... 132
I. II. Article : « Microbial ecology of the upper and lower respiratory tract in calves: interactions and dysbiosis during acute bronchopneumonia » ... 136
Chapitre 3 : l’influenzavirus de type D : répartition géographique et pouvoir pathogène ... 176
Introduction ... 176
I. II. Article : « Serologic evidence for influenza C and D virus among ruminants and Camelids, Africa, 1991-2015 » ... 178
III. Article : « Pathogenesis, host innate immune response and aerosol transmission of influenza D virus in cattle » ... 184
DISCUSSION GENERALE ET PERSPECTIVES ... 229
ANNEXES ... 293 Résultats détaillés du virome respiratoire ... 293 I.
L
ISTE DES FIGURES
Figure 1 : Arbre de décision sur l'émergence des maladies et agents
pathogènes. ... 32
Figure 2 : Représentation schématique d’un virus de type influenza D ... 43
Figure 3 : Virus influenza D (C/OK) en microscopie électronique ... 43
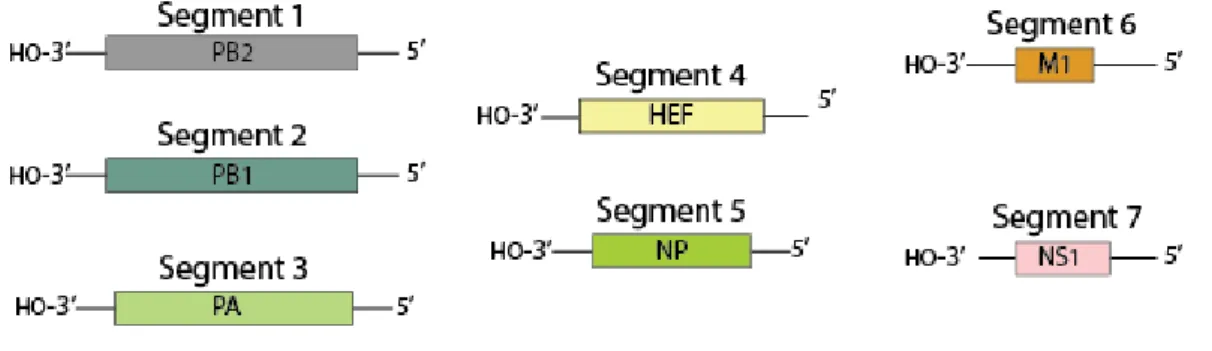
Figure 4 : Le génome du virus influenza D ... 44
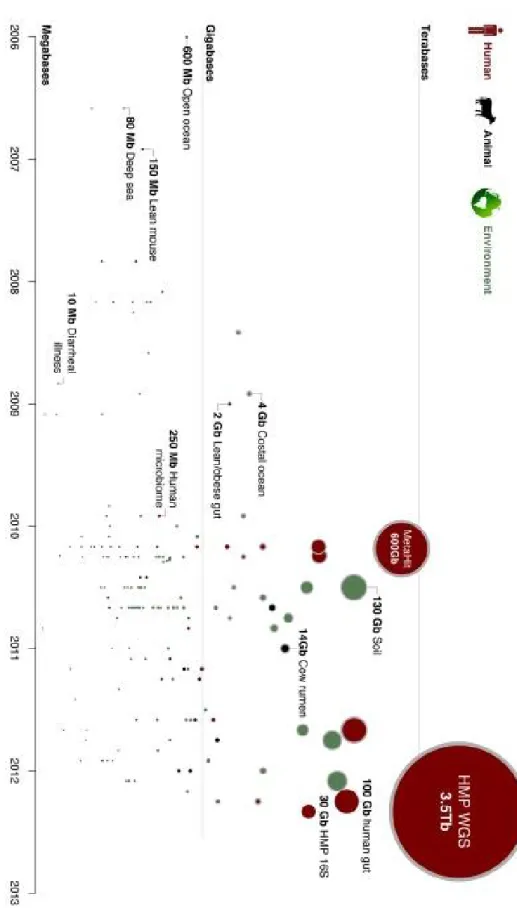
Figure 5 : Chronologie des études sur les communautés microbiennes ... 58
Figure 6 : Evolution du nombre d’études sur le microbiome respiratoire ... 59
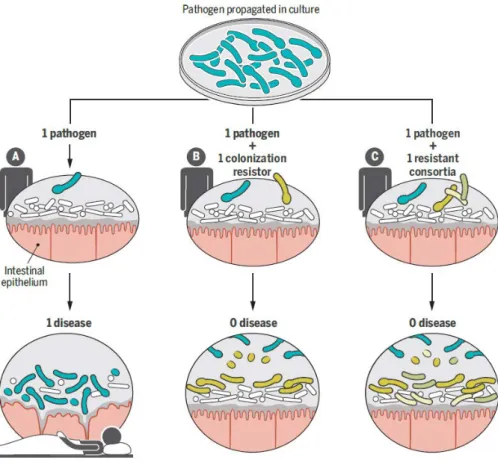
Figure 7 : Résistance de colonisation ... 66
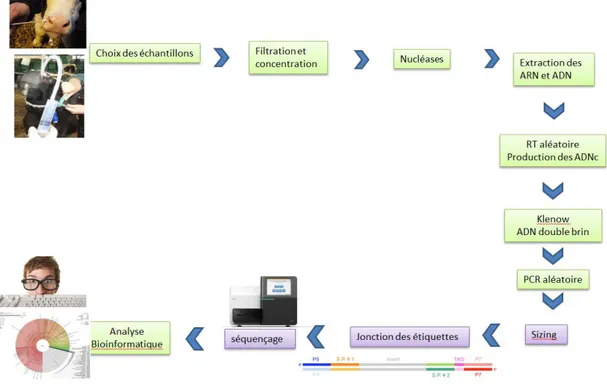
Figure 8 : Représentation du processus de préparation des échantillons pour le séquençage NGS métagénomique du virome respiratoire. ... 85
L
ISTE DES TABLEAUX
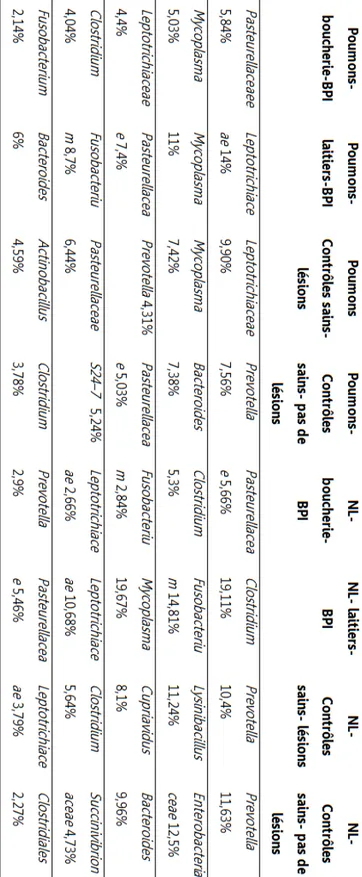
Tableau 1 : Pouvoir pathogène des différents agents respiratoires bovins démontré lors d’infections expérimentales. ... 13Tableau 2 : Abondances relatives trouvées dans les poumons et les nœuds lymphatiques (NL) ... 71
Tableau 3 : Résultats de détection des 7 agents pathogènes respiratoires dans les prélèvements respiratoires avec le LSI vetmax screening kit. ... 88
Tableau 4 : Détection des principaux virus par NGS ... 89
Tableau 5 : Correspondance entre la détection par RT-qPCR et le séquençage NGS. ... 89
L
ISTE DES ABREVIATIONS
ADN : acide désoxyribonucléique
ADNc : acide désoxyribonucléique complémentaire ARN : acide ribonucléique
ARNr : acide ribonucléique ribosomique ATT : aspiration trans-trachéale
BAAV : bovine associated adenovirus BAD3 : bovine adenovirus type 3
BAT2 : bovine alveolar type 2 epithelial cells BAV : bovine astrovirus
BRV : bovine rhinitis virus BCOV : bovine coronavirus
BLAST : Basic Local Alignment Search Tool BOHV1: bovine herpesvirus type 1
BoNV : bovine nidovirus
BPI : bronchopneumonie infectieuse BPI3 : bovine parainfluenza virus type 3 BPV : bovine parvovirus
BRAV : bovine rhinitis virus type A BRBV : bovine rhinitis virus type B BRSV : bovine respiratory synctial virus BVDV : bovine viral diarrhea virus BWA : burrows-wheeler aligner
CAR : Cilia-associated respiratory bacterium CFU : colony forming unit
cp : cytopathogène
Cq : cycle de quantification ECP : effet cytopathique
ENP : écouvillon nasal profond
FISH : fluorescence in situ hybridization
GAAS : genome relative abundance and average size Gb : gigabase
H. s : Histphilus somni HCoV : human coronavirus
HEF : hemagglutinine ésterase fusion HRT 18G : human rectal tumor
IAV : influenza A virus
IbpA : immunoglobulin binding protein type A IBR : infectious bovine rhinotracheatis
IBV : influenza B virus ICV : influenza C virus IDV : influenza D virus
IFHI1 : interferon induced with helicase C domain 1 IFNγ : interferon gamma
IGV : integrative genomics viewer IHA : l’inhibition de l’hémagglutination IL-10 : interleukine 10
IL-12 : interleukine 12 IL-1β : interleukine 1 beta IL-4 : interleukine 4
ISG15 : Interferon-stimulated gene 15
LBA : lavage broncho-alvéolaire
LDA : laboratoire départemental d’analyse LPS : lipopolysaccharide
M : protéine de matrice M. b : Mycoplasma bovis
M. h : Mannheimia haemolytica ME : microscopie électronique
MERS : middle-east respiratory syndrome mmp1 et mmp3 : métalloprotéases matricielles NCBI : national center for biotechnology information ncp : non cythopathogènes
NGS : nouvelles générations de séquençage NL : nœud lymphatique
NP : nucléoprotéine
Npro : non functional protein
NS1 : protéine non-structurale nt : nucléotide
ONT : Oxford nanopore technologies P. m : pasteurella multocida
PA : protéine acide pb : paire de bases
PB1 : polymérase basique 1 PB2 : polymérase basique 2 PCR : polymerase chain reaction pH : potentiel hydrogène
qPCR : quantitative PCR
RT-qPCR : real-time quantitative PCR
SARM : Staphylococcus aureus résistant à la méticilline SARS : severe acute respiratory syndrome
SBV : Shmallenberg virus ST : swine testis
TCID: tissue culture infectious dose TGS : third generation sequencing TNFα : tumor necrosis factor alpha VIP : virus identification pipeline
1
2
Les bronchopneumonies infectieuses chez les
I.
bovins : définition et importance
1. Définition
Le terme « bronchopneumonie infectieuse » (BPI) désigne une affection de l’appareil respiratoire profond des bovins, à caractère contagieux, qui survient essentiellement chez les jeunes bovins. Ces affections se traduisent cliniquement par l’apparition brutale de fièvre, d’une baisse de l’état général, d’une perte d’appétit plus ou moins marquée, d’un jetage séro-muqueux, d’une toux forte et sèche, de tachypnée et de dyspnée.
Les principales catégories d’animaux touchés sont d’une part les veaux durant les premiers mois de vie dans les élevages naisseurs, et d’autre part les jeunes bovins dans les ateliers d’engraissement suite à l’allotissement d’animaux provenant de différentes exploitations. Les génisses laitières peuvent également être touchées durant leurs premières années de vie.
L’étiologie des BPI est souvent multifactorielle, elle met en cause des agents infectieux comme des bactéries, virus ou parasites, et également des facteurs de risques liés à la conduite d’élevage et à l’environnement.
Des facteurs anatomiques, propres au bovin, le rendent plus sensible aux affections respiratoires (1). La faible surface des échanges gazeux et l’absence de ventilation collatérale, entraînent un coût énergétique élevé de leur respiration et une réserve ventilatoire restreinte. Ces phénomènes sont aggravés chez les races à viande du fait de leur masse musculaire plus importante.
A ceci s’ajoutent le plus souvent des facteurs de risque propres à chaque élevage. Souvent, les conditions d’ambiance lors de la mise en stabulation favorisent le développement des maladies respiratoires. En effet, une densité trop importante, une mauvaise ventilation, une mauvaise régulation de la température comme de l’hygrométrie, sont des facteurs prédisposant aux BPI (1). La conduite d’élevage peut également être un facteur déclenchant ou aggravant : le mélange des âges, les vêlages groupés, l’alimentation non adaptée, un statut immunitaire
3 défavorable, la circulation du virus immunomodulateur de la BVD (Bovine Viral Diarrhea), sont des exemples. Dans les systèmes d’engraissement les plus industrialisés (broutards et veaux de boucherie), les facteurs de stress et le rassemblement d’animaux de statuts et de provenances différents sont des éléments favorisants les BPI. Le sevrage, le transport, la transition alimentaire, ainsi que l’allotissement sont bien souvent en lien avec l’apparition de nombreuses pathologies dont les BPI (1–3).
A la naissance le veau naît agammaglobulinémique. Son système immunitaire est encore non totalement fonctionnel. Le complément est opérationnel à 20% le premier jour après le vêlage, l’activité des neutrophiles et des cellules NK (natural killer) est totalement fonctionnel entre 2 et 5 mois (4,5). Les lymphocytes B, quant à eux, sont très réduits à la naissance et augmentent en fraction pour atteindre les 20% de la composition des lymphocytes totaux à l’âge de 6 à 8 semaines. Les taux des immunoglobulines IgA, IgG1 et IgG2 n’atteignent
des concentrations protectrices qu’entre 16 à 32 jours d’âge (4,5). Pendant les premières semaines de vie l’immunité du veau est donc essentiellement apportée par l’immunité maternelle colostrale. On comprend alors aisément l’importance du transfert colostral pour assurer une protection des jeunes veaux contre les infections respiratoires.
Dans un élevage les BPI peuvent évoluer sous différentes formes épidémiologiques : épizootique, enzootique ou sporadique. Le plus souvent, la maladie débute dans un cheptel par une phase épizootique avec une morbidité élevée et une mortalité allant de 5 à 10%. Cette phase peut être consécutive à un changement de la conduite d’élevage, à des conditions climatiques défavorables, ou à un rassemblement de bovins d’origines différentes au sein d’une exploitation. Suite à cette phase, la maladie peut prendre une allure enzootique avec une faible morbidité et une faible mortalité, d’autant plus que les conditions d’élevage ne sont pas maîtrisées. L’incidence progresse alors lorsque la densité d’animaux dans un atelier augmente. Si les conditions environnementales sont peu favorables au développement d’infections respiratoires (bâtiment et conduite d’élevage maîtrisées), la maladie, lorsqu’elle survient, peut ne revêtir qu’un caractère sporadique.
4 2. Importance des BPI
Importance Médicale a.
Les BPI, avec les entérites infectieuses, sont responsables de la grande majorité des mortalités observées chez le veau. Chez les jeunes bovins à l’engraissement elles représentent le principal handicap économique dans ces filières. L’importance médicale est avant tout liée à l’impact possible de la mortalité (jusqu’à 20% dans certains lots) mais aussi aux signes cliniques (dyspnée, inappétence, abattement) à l’origine de retards de croissance.
Dans le système naisseur des Pays de la Loire, le taux d’incidence des BPI a été estimé à 2,5 cas /veaux-jours à risque, soit environ 24 animaux traités pour 100 veaux (6). Les taux de létalité et de retard de croissance étaient respectivement de 6% et de 2,7% chez les animaux traités (6). Les BPI sont des pathologies majeures en engraissement de jeunes bovins. En 2008, dans les systèmes naisseur-engraisseur et engraisseur spécialisés du Pays de la Loire, le taux de morbidité pour les troubles respiratoires était de 18,1% sur les jeunes bovins mis en lot et 22% des lots avaient au moins 4 jeunes bovins atteints (7). Une autre étude a montré que 2,81% des jeunes bovins saisis à l’abattoir (saisie partielle ou totale) l’étaient pour motif de BPI (8). Enfin, chez les génisses laitières de renouvellement, les pathologies respiratoires représenteraient 20 à 30% des mortalités, le plus souvent vers l’âge de 6 semaines.
L’impact médical est en partie lié au fait que les bovins sont anatomiquement et physiologiquement mal équipés pour répondre à un processus pathologique respiratoire. Les bovins ont des poumons de faible volume (environ 12 litres/500 kg) comparé au volume d'un cheval (42 L). Leurs poumons sont en outre fortement compartimentés et leur surface d'échanges gazeux est faible par rapport à la masse musculaire de l'animal. Cette compartimentation pulmonaire prédispose à l’hypoxie voire à l’anoxie périphérique lorsque les conduits aérifères sont obstrués. Il en résulte dans la région lésée une accumulation et une multiplication d’éventuels agents infectieux.
5 La trachée des bovins est de faible diamètre (environ 3 cm pour un bovin de 400 kg) comparé à d’autres espèces du même gabarit. Cela impose une vitesse de l’air plus élevée qui contribue à l’imprégnation de l’épithélium trachéal par les éléments contaminants de l’air mais aussi une respiration plus profonde qui augmente la pénétration de particules.
En ce qui concerne l’appareil respiratoire profond, les bovins possèdent peu de macrophages dans la lumière alvéolaire. De plus, les lobes crâniaux étant moins bien irrigués, ils seraient également moins bien oxygénés, ce qui entraînerait une baisse de l’activité phagocytaire des macrophages alvéolaires et un ralentissement du pouvoir d’élimination des agents infectieux dans ces zones.
Les bovins présentent donc un certain nombre de particularités anatomiques qui les rendent particulièrement sensibles aux infections respiratoires, notamment les jeunes animaux de moins de 6 mois.
Importance Economique b.
Les BPI ont un impact économique considérable. La filière viande bovine est handicapée par les pertes économiques résultant des mortalités, des baisses de performance des animaux atteints, du coût des traitements et de la non-valeur économique de certains animaux. Une pathologie respiratoire durant la période néonatale entraîne un poids au sevrage inférieur de 16.5 kg comparé aux animaux sains (9). En France, les BPI sont la principale cause de mortalité des veaux après le premier mois de vie dans les élevages de bovins allaitants (10).
Dans les ateliers d’engraissement, les BPI constituent une préoccupation majeure pour l’état de santé et la performance économique globale du troupeau. En effet, le taux de létalité sur des animaux atteints de BPI peut aller jusqu’à 9,5% (11). Cette mortalité due aux BPI représente jusqu’à 60% de la mortalité en atelier d’engraissement. L’une des conséquences de la maladie est la diminution du gain moyen quotidien associé à une diminution du poids de carcasse et à un allongement de la durée de l’engraissement, ce qui entraîne des pertes économiques. Pour exemple dans les ateliers d’engraissement des Pays de Loire,
6 le coût des BPI varie entre 8 et 83 euros/animal selon les taux de mortalité et de morbidité (12).
En élevage laitier, l’impact négatif des BPI sur la croissance des génisses conduit à des baisses de performance de reproduction, des baisses de production laitière en première lactation et à une diminution de la longévité des animaux (13).
Impact Sanitaire c.
Les BPI ont une importance sanitaire car le traitement de ces affections fait appel à l’utilisation d’antibiotiques de façon plus ou moins systématique. En effet, lorsque des jeunes bovins sont atteints de troubles respiratoires, un antibiotique est le plus souvent utilisé pour lutter contre l’infection bactérienne ou pour la prévenir lors d’infections virales. De plus, en fonction de la gravité et du nombre d’animaux touchés, c’est souvent l’ensemble d’un lot qui est mis sous traitement et pas seulement les animaux qui présentent des signes cliniques. Cette pratique, appelée métaphylaxie, a pour objectif de traiter les malades et de prévenir la maladie chez les animaux encore non affectés, surtout quand la détection est difficile. Autrefois les antibiotiques pouvaient aussi être utilisés à titre préventif lors des périodes à risque telles que les rassemblements de jeunes bovins. Ce genre de pratiques, susceptible de favoriser l’émergence d’antibiorésistance (14,15), est aujourd’hui interdit.
Outre l’utilisation importante d’antibiotiques, le problème se posait aussi jusqu’il y a deux ans en terme de qualité, notamment de familles d’antibiotiques utilisés. Jusqu’en 2015 étaient en effet principalement utilisés des macrolides, des fluoroquinolones de 3e génération et des céphalosporines de 3e génération. Les
deux dernières familles appartiennent à des familles d’antibiotiques dits « critiques », antibiotiques à utiliser préférentiellement chez l’homme. Ces molécules de dernière génération montrent une grande efficacité pour lutter contre les surinfections bactériennes, mais leur utilisation est depuis peu très règlementée en médecine vétérinaire pour limiter l’apparition de résistances. Elles ne sont maintenant autorisées qu’en seconde intention lorsque la bactérie responsable de BPI a été clairement identifiée et qu’elle présente des résistances aux autres antibiotiques. Selon l’Agence nationale de sécurité du médicament et
7 des produits de santé (ANSM), la définition des antibiotiques critiques repose sur la notion de pression de sélection et sur l’intérêt en dernier recours (16). Donc les antibiotiques « critiques » sont catégorisé soit 1- comme étant particulièrement générateurs de résistances : les associations amoxicilline-acide clavulanique, les céphalosporines, les fluoroquinolones, et la témocilline, soit 2- étant de dernier recours (la daptomycine, les glycopeptides, la linézolide, la tédizolide, la colistine injectable, les pénèmes, les phénicolés, la tigécycline, et la fosfomycine injectable). Ce contexte de réduction de l’utilisation des antibiotiques (plan Ecoantibio) et les législations récentes qui s’y réfèrent, ont incité les décideurs à développer des projets de recherche et des modalités nouvelles de gestion autour des agents infectieux responsables de BPI. L’objectif est d’une part de développer des mesures préventives (vaccination, augmentation de la robustesse des animaux, aménagement des bâtiments, changement des pratiques d’élevage…) et d’autre part de choisir le meilleur protocole thérapeutique en cas de maladie (choix de la molécule, de la dose, de la voie d’inoculation…).
8
Les agents pathogènes respiratoires bovins
II.
Même si les BPI font intervenir des facteurs liés à l’élevage et l’hôte, il n’en reste pas moins que se sont les agents infectieux qui sont responsables du déclenchement et de la sévérité de la maladie. Là encore la situation est complexe car seulement dans un tiers des cas environ la maladie est due à un seul agent (bactérie, virus ou parasite) alors que dans 2/3 des cas, il s’agit d’une association virus/bactérie ou virus/virus, voir même bactérie/bactérie. De plus les techniques récentes d’identification de virus et bactéries permettent de découvrir de nouveaux agents potentiels. Dans ce paragraphe nous aborderons les principaux pathogènes connus puis nous traiterons des connaissances actuelles sur les co-infections lors de BPI et nous terminerons par les données actuelles sur les nouveaux agents infectieux potentiellement impliqués dans les BPI.
1. Fréquence des agents infectieux
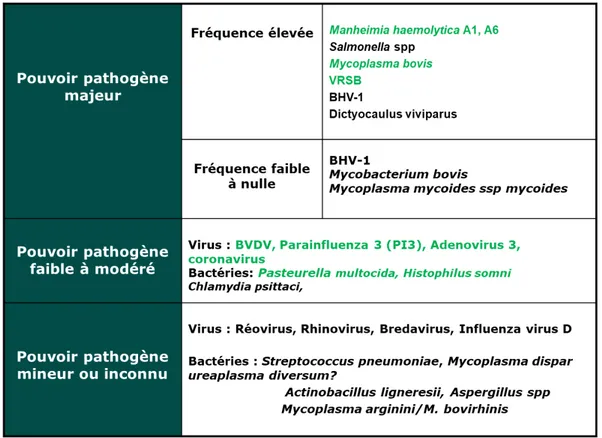
Les principaux agents pathogènes impliqués dans BPI sont décrits dans le tableau 1. Leurs implications reposent sur les données d’études épidémiologiques et de reproduction expérimentale de la maladie.
Quatre bactéries sont plus communément impliquées dans les BPI, il s’agit de Mannheimia haemolytica, Pasteurella multocida, Histophilus somni et
Mycoplasma bovis (Tableau 2). Les trois premières appartiennent à la famille des Pasteurellaceae. La prévalence de M. haemolytica et P. multocida en France est
importante. La relation causale avec les BPI est plus complexe à établir car ces bactéries sont présentes dans le nasopharynx des jeunes bovins sains. La présence de M. haemolytica est probablement importante dans le système « jeunes bovins en lot » (17). En France, en 2011, un suivi régulier de 112 jeunes bovins charolais provenant de 43 fermes a permis d’étudier l’impact de M.
haemolytica lors des épisodes de bronchopneumonie pendant la première phase
d’engraissement. Au total, 75 jeunes bovins présentaient au moins une aspiration transtrachéale (ATT) positive pour M. haemolytica durant toute période d’étude. Quasiment tous les épisodes de pneumonie étaient associés à la présence de la
9 pasteurelle (14/16) avec toutefois une prévalence individuelle très variable (0-89%) (18).
Les pasteurelloses sont également importantes chez les animaux non sevrés. Une étude réalisée sur 133 veaux provenant de plusieurs départements français met en évidence une prévalence de 28% pour M. haemolytica contre une prévalence de plus de 60% pour P. multocida (19). Si P. multocida est la plus fréquemment détectée, elle l’est en grande majorité en association avec d’autres pathogènes (74% des prélèvements possédant plusieurs agents pathogènes). En Europe ces deux bactéries sont ubiquistes. Dans une étude finlandaise, 34% des veaux laitiers mis en lot entre 5 jours et 1 mois d’âge, et affichant des signes cliniques respiratoires, étaient positifs à P. multocida sur des lavages trachéaux. La bactérie a été isolée dans environ 70 % des lots présentant un à plusieurs animaux malades (20). Son rôle dans les BPI reste discuté car elle n’est significativement associée à des signes cliniques que lorsque le prélèvement est poly-infecté.
En Ecosse, 17% des veaux (n= 616 veaux) possèdent M. haemolytica dans les cavités nasales avec une prévalence nettement plus élevée dans les cheptels laitiers, 26%, contre 9% dans les cheptels allaitants (21). Dans une étude danoise réalisée chez des veaux laitiers de moins de 4 mois pendant un épisode de BPI, P. multocida, H. somni et M. haemolytica ont été trouvées respectivement chez 48%, 20% et 23% des veaux sains alors que quasiment tous les veaux malades présentaient une culture ou une PCR positive pour deux agents pathogènes ou plus (97% avec 2 espèces bactériennes ou plus ; 3% avec une seule espèce bactérienne), avec une fréquence d’isolement de 82%, 41% et 29 % respectivement pour P. multocida, H. somni et M. haemolytica (22). Lorsqu’on s’intéresse au système « veaux de boucherie », l’étude réalisée par Pardon en 2010 recense 24 épisodes de pneumonie (240 veaux) avec des prévalences quasi-similaires pour les deux types de pasteurelles : 21,3% pour M. haemolytica et 22,1% pour P. multocida (23). L’ensemble de ces études suggère que la présence de P. multocida et M. haemolytica semble être un facteur de risque supplémentaire de BPI puisqu’elles sont fréquemment isolées lors d’épisodes cliniques, que ce soit seules ou en association (19,20,22).
10 En ce qui concerne H. somni, sa prévalence a surtout été étudiée en Amérique du Nord. En Ontario, Gagea (2006) a mis en évidence H. somni dans 16 % (14/86) des poumons de bovins présentant des lésions pulmonaires (86/99), avec une association avec P. multocida et/ou M. haemolytica dans plus de 50% des cas (24). En Europe H. somni a été détectée au Danemark par culture ou PCR sur ATT chez 20% des animaux sains et 41% des animaux malades (22) et en Finlande chez 0,5% des veaux (396 veaux laitiers) dans 5% des cheptels (20). En France, Tessier révèle une prévalence apparente globale de 30% par analyse PCR (133 veaux non sevrés). Entre 2006 et 2010, le laboratoire départemental d’analyse de Haute-Saône (LDA 71) a réalisé une large enquête et estime la prévalence d’H. somni dans les pathologies respiratoires (tous prélèvements confondus) à environ 2,5% par méthode classique de bactériologie et à 18% par PCR (25).
Pour les mycoplasmes, le réseau d’épidémio-surveillance (VIGIMYC) a montré que M. bovis est le mycoplasme le plus fréquemment isolé avec plus de 55% des isolats mycoplasmiques reçus (541/902) sur des prélèvements le plus souvent respiratoires (83%) (26). Une autre enquête sérologique réalisée à l’échelle nationale sur 824 cheptels choisis au hasard (32 197 animaux de plus d’un an) met en évidence pour M. bovis une prévalence cheptel de 28 à 30 % et une prévalence individuelle de 2 à 13% (27). Ces résultats sont conformes à ceux obtenus en Angleterre entre 1990 et 2000 avec une séroprévalence de 22%. M.
bovis est fréquemment associé à d’autres mycoplasmes ou à d’autres agents
bactériens lors d’épisodes de BPI : il est isolé dans 57% des poumons positifs pour P. multocida ou M. haemolytica contre 10% des poumons positifs au virus respiratoire syncytial bovin BRSV (pour Bovine Respiratory Syncytial virus) (28) ; il est associé à d’autres bactéries dans 81% des lavages broncho-alvéolaires (LBA) positifs à M. bovis (29). Enfin, les pneumonies à M. bovis se rencontrent majoritairement dans les élevages en lots (jeunes bovins et veaux de boucherie), où les animaux proviennent de cheptels différents. Des études montrent l’importance de ce mycoplasme lors de mise en lots de veaux non sevrés puisqu’il est le pathogène le plus fréquemment isolé avec plus de 70% des échantillons positifs (23,29).
11 Quant aux virus, les plus connus sont l’herpès virus bovin de type 1 (BoHV-1 pour Bovine Herpesvirus 1), le virus respiratoire syncytial bovin (BRSV), le virus parainfluenza 3 bovin (BPI3 pour Bovine Parainfluenza Virus type 3) mais depuis quelques années d’autres virus ont été incriminés tels que le coronavirus bovin (BCoV pour Bovine Coronavirus) et les adénovirus bovins (BAV pour Bovine Adenovirus). Globalement, les infections à virus respiratoires sont fréquentes chez les jeunes bovins, au moins pour le BRSV et le BPI3, comme en témoigne la forte séroprévalence des troupeaux en Europe. En 2010, la prévalence des infections à BRSV en Suède dans le cheptel bovin viande variait, selon la densité des animaux et les régions, entre 8 et 70%. La prévalence du BCoV était plus faible mais variait parallèlement à celle du BRSV (30). En élevage laitier, sur 59 élevages testés en Italie, au moins une vache séropositive au BRSV était présente dans tous les élevages (31). Dans 25% des élevages, tous les individus testés étaient séropositifs. En Norvège, la prévalence chez les veaux de plus de 5 mois dans les élevages laitiers a été estimée en 2009 à 50.2%, 39.3% et 31.2%, pour les virus BPI3, BCoV et BRSV, respectivement (32). En France toujours, les infections à BRSV et BPI3 sont considérées comme fréquentes, les séroprévalences étant estimées entre 60 et 70% avant 3 ans. En France la prévalence nationale moyenne d’ateliers infectés par la rhinotrachéite infectieuse bovine (IBR pour Infectious Bovine Rhinotracheitis) avoisine les 10-11% selon les années avec une prévalence plus importante en atelier allaitant qu’en atelier laitier. Toutefois des variations importantes existent entre les départements, la prévalence des ateliers infectés variant de 0,06 % à 85,2 %.
Les données de prévalence des virus lors d’affections respiratoires cliniques diffèrent selon les études, qui soulignent l’impact des techniques analytiques sur les résultats et une probable diversité attribuable, a minima, aux facteurs géographiques. Le BRSV est l’agent viral le plus fréquemment isolé à partir du poumon de veaux morts de troubles respiratoires. En élevage laitier, le BRSV serait associé aux troubles respiratoires dans 60 % à 70% des élevages au Danemark, aux Etats-Unis, en Suède et aux Pays Bas. En élevage allaitant ou en production de viande, le BRSV semble responsable de 16 à 71 % des troubles respiratoires selon les études. Plus le nombre de cheptels impliqués est élevé,
12 plus le risque relatif est important. En France, une étude menée à la fin des années 1990 a permis d’identifier une cause infectieuse dans 65,4% des cas de BPI chez des veaux (33). Un virus était présent, seul ou en association avec une bactérie dans 52,4 % des cas et parmi les virus, l’infection par le BRSV était dominante. En élevage de veaux de boucherie en lots, une enquête a été réalisée dans l’Est de la France en 2007 qui suggère que parmi les virus, l’infection par le PI3 était prédominante sans que les auteurs précisent le statut clinique des veaux infectés. La majorité des veaux testés avait reçu une injection de Rispoval RS BVD® lors de la mise en lots (environ 8 à 13 jours avant le prélèvement).
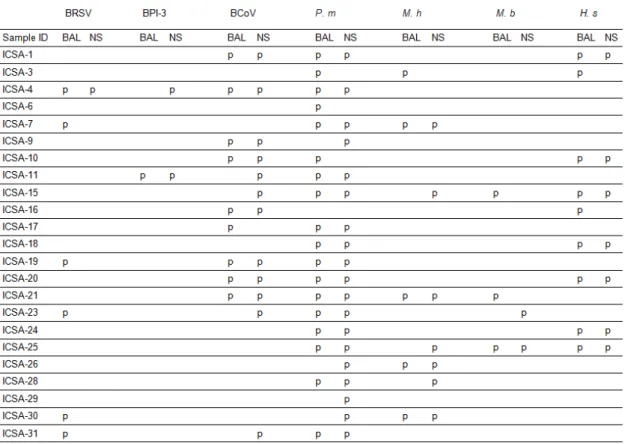
L’interprétation de ces résultats doit aussi tenir compte des limites liées aux prélèvements et aux techniques analytiques. Dans les études précédemment citées les techniques de détection utilisées étaient différentes selon l’agent infectieux recherché, avec chacune des caractéristiques propres de sensibilité et spécificité. Pour limiter, à défaut d’éliminer, les variabilités liées aux méthodes analytiques, des techniques d’amplification génique en temps réel (qPCR) ont été récemment mises au point, qui permettent de détecter rapidement le BRSV, le BPI3, le BCoV et les bactéries M. bovis, M. haemolytica, P. multocida et H. somni. Cette détection peut être couplée à la recherche du BVDV ou du BoHV-1, là aussi par PCR. Cet outil a été utilisé pour analyser 602 prélèvements respiratoires obtenus sur trois années consécutives par le LDA 71 dans le cadre du diagnostic vétérinaire (34). Les prélèvements respiratoires étaient un écouvillonnage nasal (EN), une ATT ou un prélèvement de poumon, principalement d’élevages naisseurs. Globalement les résultats montrent que dans 80% des cas il a été possible d’identifier un des sept agents respiratoires recherchés. Par comparaison avec des techniques conventionnelles, la technique PCR améliore la sensibilité de détection notamment des bactéries respiratoires, et plus particulièrement de P. multocida. Les fréquences de détection étaient respectivement de 22, 18, 7, 20, 51, 22 et 9% pour le BRSV, BCoV, BPI3, M.
haemolytica, P. multocida, H. somni et M. bovis. La prévalence du BCoV en
France sur des animaux cliniquement atteints est importante, de l’ordre de 20%. Par ailleurs les co-infections sont apparues très fréquentes dans plus de 40% des cas sans qu’il ne ressorte d’association préférentielle. Cette fréquence de
co-13 infections a aussi été observée dans une étude irlandaise où un virus était identifié dans 35% des troubles respiratoires et où 40% des veaux infectés avaient plus de 2 virus présents (35). Cette étude a aussi montré une grande fréquence de détection du BCoV, y compris dans les prélèvements de l’appareil respiratoire profond, et une fréquence relativement importante de H. somni, bactérie probablement sous-détectée auparavant dans la mesure où son isolement nécessite des conditions particulières de culture. L’ensemble des données de prévalence doit être interprété en tenant compte des limites liées aux modes opératoires (absence de critères stricts d’inclusion, systèmes d’élevage spécifiques, nombre d’échantillons...).
Tableau 1 : Pouvoir pathogène des différents agents respiratoires bovins démontré lors d’infections expérimentales.
2. Pouvoir pathogène des principales bactéries
Les principales bactéries impliquées dans les BPI bovines appartiennent à deux principaux groupes : les mycoplasmes (Mycoplasma bovis), associés le plus
14 souvent à des BPI de forme chronique, et les pasteurelles (Manheimia
haemolytica, Pasteurella multocida, Histophilus somni) plutôt à l’origine
d’affections aiguës. Plus rarement, on peut isoler les genres Salmonella et
Coxiella, voire l’espèce Trueperella pyogenes.
Les Mycoplasmes a.
Les mycoplasmes appartiennent à la classe des Molliculites. Cette dernière comprend la famille des Mycoplasmataceae, se divisant elle-même en 4 genres : Mycoplasma, Ureaplasma, Eperythrozoon et Haemobartonella. Le genre
Mycoplasma comporte environ 100 espèces dont 40 isolées chez les ruminants.
Les espèces pathogènes majeures chez les bovins sont : M. mycoides subsp.
mycoides responsable de la péripneumonie contagieuse bovine (PPCB), et Mycoplasma bovis, agent de BPI.
Les pneumonies à M. bovis se rencontrent majoritairement dans les élevages en lots (jeunes bovins et veaux de boucherie), où les animaux proviennent de cheptels différents. Des études montrent l’importance de ce mycoplasme lors de mise en lot de veaux non sevrés puisqu’il est le pathogène le plus fréquemment isolé avec plus de 70% des échantillons positifs (23,29). La présence de M. bovis semble cependant corrélée à l’apparition de pneumonies puisque la bactérie est isolée uniquement dans des poumons d’animaux présentant des signes cliniques respiratoires chroniques et aigus (0% des animaux sains, 35,5% des animaux à pneumonie chronique et 50% des animaux à pneumonie aiguë) (28).
La contamination d’un élevage se fait souvent par l’introduction de porteurs sains ou malades. La transmission horizontale se fait par contact direct entre animaux via les aérosols, mais aussi via la contamination de l’alimentation et de l’eau de boisson par les sécrétions nasales d’animaux porteurs. Les animaux convalescents peuvent excréter pendant une longue période et les porteurs chroniques sont généralement responsables de la persistance de M. bovis au sein d'un troupeau. Un stress (conditions climatiques, ventilation insuffisante, surpopulation, allotissement) permet à la maladie de resurgir. En occasionnant des lésions inflammatoires chroniques, M. bovis fragilise le terrain pulmonaire, le
15 prédisposant ainsi à l’infection par d’autres agents pathogènes. Si les mycoplasmes sont généralement peu résistants dans le milieu extérieur, M. bovis peut persister plusieurs semaines sur du matériel humide ou dans l’eau, et jusqu'à 230 jours dans le fumier (36). L'environnement constitue donc la seconde source importante d'infection.
Mycoplasma bovis possède un double statut initiateur/ubiquiste puisqu’il
est responsable à lui tout seul de lésions cellulaires importantes et d’une persistance de l’infection pendant plusieurs semaines. M. bovis possède 13 gènes codant pour des protéines de surface variables impliquées dans la variabilité antigénique, lui permettant d’échapper à la réponse immunitaire (37).
Plus rarement Mycoplasma dispar et Mycoplasma bovirhinis ont été cités pour leur rôle dans les BPI sans qu’il n’existe actuellement de preuves de leur pouvoir pathogène (38–40).
Les Pasteurelles b.
Les pasteurelles font partie de la flore commensale des muqueuses des vertébrés supérieurs et tout particulièrement des mammifères et des oiseaux domestiques. Chez les bovins, elles sont commensales dans le nasopharynx et le portage asymptomatique concerne plus de 30 % des sujets adultes. Il résulte d'un équilibre entre la réceptivité de l'animal hôte et la virulence des pasteurelles (41). Les pasteurelles prennent ainsi une grande importance dans le cadre de surinfections bactériennes consécutives à des infections respiratoires amorcées par des virus (BoHV1, BRSV, BVD) ou par des mycoplasmes.
Les trois principales pasteurelles pathogènes chez les bovins sont
Mannheimia haemolytica, Pasteurella multocida et Histophilus somni.
M. haemolytica est la pasteurelle réputée la plus pathogène chez les
bovins. Elle agit en tant que pathogène unique, notamment lors d’une diminution des défenses de l’hôte ou secondairement à une infection virale ou mycoplasmique (17). L’expression du pouvoir pathogène de M. haemolytica est conditionnée par une première multiplication locale dans le nasopharynx, concomitante à une altération des mécanismes de défense de l’appareil
16 respiratoire. La bactérie adhère alors à l’épithélium grâce à des facteurs d’attachement (pili, capsule), et ce d’autant plus facilement qu’un agent pathogène primaire a lésé préalablement la muqueuse. La contamination de l’appareil respiratoire profond se fait via l’inhalation d’exsudats virulents stagnants dans les régions postérieures des cavités nasales où la concentration en bactéries est très élevée en début de maladie (17). Une infection virale, classiquement par le virus BPI3 ou BoHV-1 facilite la colonisation en altérant la clairance muco-ciliaire des poumons et donc en altérant l’évacuation des bactéries envahissantes (17,42).
Mannheimia haemolytica possède de nombreux facteurs de virulence : une
adhésine, un polysaccharide capsulaire, un fimbriae, une sialoglycoprotéase, un lipopolysaccharide (LPS), une neuraminidase, une lipoprotéine OMPs, et une leucotoxine (Lkt). Les cinq premiers facteurs assurent l’adhésion à la cellule cible et la colonisation cellulaire. La neuraminidase participe au disfonctionnement de l’appareil muco-ciliaire et la sialoglycoprotéine clive les anticorps IgG1 bovins produits lors de la réponse humorale. Le LPS possède une action pro-coagulante et pro-inflammatoire entrainant un afflux de cellules inflammatoires ainsi que des lésions vasculaires (17). La leucotoxine Lkt est un facteur de virulence majeur de la bactérie. Cette protéine secrétée induit l’apoptose des neutrophiles et la libération consécutive de facteurs pro-inflammatoires et toxiques participant à la genèse des lésions typiques de bronchopneumonie alvéolaire (43).
Pasteurella multocida est, elle, la pasteurelle la plus fréquemment isolée
ces dernières années en France à partir de prélèvements respiratoires. Il existe cinq sérogroupes parmi lesquels le sérogroupe A3 est le plus fréquemment isolé sur les bovins atteints de BPI (44,45). Plusieurs études tendent à montrer que P.
multocida est une bactérie opportuniste des cavités respiratoires superficielles des
bovins (46) dont la pathogénicité semble limitée (45). A contrario, d’autres études mettent en évidence une corrélation entre la présence de la bactérie et la présence de signes cliniques respiratoires (47) et une augmentation accrue des protéines inflammatoires (48). Elle possède globalement des facteurs de virulence identiques à M. haemolytica sauf la leucotoxine.
Enfin, H. somni a été identifiée pour la première fois chez les bovins en 1956. Pendant longtemps, sa seule manifestation clinique semblait être la
17 méningo-encéphalite thromboembolique mais H. somni provoque également d’autres affections, notamment respiratoires. Cette bactérie est responsable de plusieurs affections chez les bovins et les ovins : bronchopneumonie, infertilité, avortement, septicémie, myocardite, arthrite, méningoencéphalite (49). Six variants sont décrits à ce jour mais seules les souches 1, 2 et 3 sont isolées chez le bovin (50). H. somni provoque une pneumonie voire une pleurésie fibrineuse dans sa forme respiratoire. De plus, il semble que de nombreux facteurs de virulence soient exprimés uniquement chez des souches isolées sur des poumons présentant des lésions (51).
3. Pouvoir pathogène des principaux virus
Comme cité précédemment, les principaux virus respiratoires impliqués dans les BPI sont le BRSV (pour bovine respiratory syncytial virus), le BoHV-1 (pour bovine herpes virus 1), le coronavirus bovin BCoV (pour bovine coronavirus), le BPI3 (pour bovine parainfluenza virus 3), l’adénovirus bovin de type 3 (BAD3 pour bovine adenovirus type 3), et le BVDV (pour bovine viral diarrhea virus). L’importance relative de ces différents virus repose sur leur prévalence et leur pouvoir pathogène principalement étudié lors d’infections expérimentales (Tableau 1).
Le virus respiratoire syncytial bovin a.
Les enquêtes viro-épidémiologiques dans différents systèmes d’élevage bovin indiquent qu’actuellement le BRSV est l’agent pathogène responsable, seul ou en association, d’une grande partie des BPI (52). Il a été isolé pour la première fois en 1967 chez un bovin atteint de troubles respiratoires (53) et appartient à la famille des Paramyxoviridae, sous-famille des Pneumovirinae, et genre
Pneumovirus. C’est un virus enveloppé à ARN simple brin de polarité négative
contenant 10 gènes viraux qui codent pour 11 protéines dont 2 protéines de surface qui sont des déterminants antigéniques du virus (52). La glycoprotéine de fusion F permet la fusion de l’enveloppe virale avec la membrane cellulaire de la cellule cible, mais aussi la fusion des cellules infectées avec d’autres cellules non infectées, à l’origine de la formation de syncytia. Elle est la cible majeure des
18 anticorps neutralisants et est aussi impliquée dans l’induction de la réponse cellulaire spécifique. La glycoprotéine G permet, elle, l’attachement du virus à la cellule cible.
Le virus colonise l’épithélium des bronchioles puis les cellules des alvéoles pulmonaires (pneumocytes de type II) où il exerce son effet pathogène, conduisant à une bronchiolite obstructive fonctionnelle puis restrictive. Son pouvoir pathogène s’exerce à la fois par un effet cytopathique direct mais aussi par l’initiation d’une réponse immunitaire pathologique, notamment lors de forme clinique sévère. La nature de la réponse innée inflammatoire influencerait la nature de la réponse immunitaire spécifique des lymphocytes auxiliaires vers une voie dite de type Th1 ou Th2. La réponse Th1 est associée à la production d’anticorps neutralisants et l’induction d’une réponse cellulaire cytotoxique qui assure l’élimination du virus et la protection. La réponse de type Th2 serait associée à la libération de médiateurs pro-inflammatoires et au recrutement de polynucléaires neutrophiles et éosinophiles à l’origine d’une broncho-constriction sévère.
Sur le terrain, dans la majorité des cas le BRSV infecte un grand nombre de veaux (morbidité de 20 à 50%) et est responsable de signes cliniques respiratoires modérés avec une faible létalité (0,5 à 1%). Toutefois le BRSV peut aussi induire à lui tout seul des bronchopneumonies sévères avec un taux de mortalité non négligeable pouvant aller jusqu’à 20-30% (54).
Le virus de la rhinotrachéite infectieuse bovine b.
L’herpès virus bovin de type 1 (BoHV-1 pour bovine herpesvirus type 1) ou virus de l’IBR (Infectious Bovine Rhinotracheitis) appartient à la famille des
Herpesviridae, sous famille des Alphaherpesvirinae. Il s’agit d’un virus de 150 à
200 nm de diamètre à ADN double brin d’environ 150 kbases. Le BoHV-1 a un tropisme pour les cellules épithéliales, les cellules mononucléées sanguines et les neurones (55). Il existe des différences nettes de pouvoir pathogène selon les souches virales. La latence virale et les périodes dites de réactivation-réexcrétion représentent la clé de voûte de l’épidémiologie de l’IBR (55). Le pouvoir pathogène du BoHV-1 est démontré depuis longtemps sur des bases
19 épidémiologiques et expérimentales. La rhinotrachéite infectieuse bovine est la forme respiratoire de l’infection par le BoHV-1. Suivant sa voie d’entrée dans l’organisme et le sous-type viral, le virus est également responsable d’encéphalite, de conjonctivite, d’avortement, d’une forme systémique mortelle en période néonatale et d’une forme génitale : la vulvo-vaginite pustuleuse infectieuse. Dans sa forme respiratoire le BoHV-1 n’est pas directement responsable de BPI, son tropisme étant limité au rhinopharynx et à la trachée. Par contre son rôle en tant qu’agent initiateur des BPI est étudié depuis longtemps, notamment dans le cadre de co-infections expérimentales avec Mannheimia haemolytica (55). De ces études, il ressort que le BoHV-1 favoriserait l’apparition de BPI par 3 actions, une cytolyse directe des cellules épithéliales respiratoires, la production de cytokines pro-inflammatoires et un effet suppresseur sur la réponse immune cellulaire.
Sur le terrain, la maladie atteint des animaux de tout âge mais les jeunes bovins sont les plus sensibles et la plupart des infections respiratoires sont asymptomatiques. Sinon la maladie se traduit par une rhinotrachéite (jetage séro-muqueux, hyperthermie, toux, épiphora), voire des troubles fonctionnels (râles, cornage) pour les souches pathogènes.
Le virus parainfluenza de type 3 (BPI3) c.
Le virus Parainfluenza de type 3 bovin (BPI3 pour bovine parainfluenza virus type 3) appartient à la famille des Paramyxoviridae, et au genre Respirovirus. Il s’agit d’un gros virus (150 à 300 nm) enveloppé à symétrie hélicoïdale dont le génome est constitué d’une molécule d’ARN simple brin linéaire de polarité négative. Principalement étudié dans les années 1990, le BPI3 fait actuellement l’objet de recherches peu nombreuses et essentiellement focalisées depuis 2000 sur la variabilité génétique et la possibilité de contamination croisée entre les différents virus parainfluenza. Le BPI3 est capable d’infecter un grand nombre de types cellulaires de l’appareil respiratoire car il reconnait comme premier récepteur l’acide sialique des cellules (56). Il induit une hyperplasie et une nécrose de la muqueuse, une perte des cellules ciliées et finalement une pneumonie interstitielle. Notamment, le BPi3, contrairement au BRSV, se multiplie dans les macrophages du poumon. Il en résulte une altération des fonctions
20 macrophagiques (baisse de la phagocytose, de la cytotoxicité des cellules infectées, secrétions de prostaglandines proinflammatoires…). Par ailleurs, et contrairement au BRSV, l’infection par le BPI3 entraîne chez le veau une perte de la ciliature des cellules ciliées trachéales, la présence d’inclusions cytoplasmiques et la desquamation et destruction des cellules épithéliales respiratoires. L’effet cytopathique observé, et potentiellement l’altération de la réponse immunitaire, expliquerait ainsi le rôle du BPi3 comme agent initiateur des BPI. Malgré ces observations, le pouvoir pathogène direct du virus n’est pas encore clairement établi. La plupart des infections expérimentales n’induisent pas à peu de signes cliniques et sur le terrain le virus est souvent détecté en présence d’autres pathogènes. Comme pour la plupart des autres virus respiratoires infectant les bovins, le virus BPI3 est fragile et ne se transmet que par contact direct « de mufle à mufle », ou bien via l’inhalation d’aérosols et de gouttelettes émises par un bovin infecté qui tousse ou éternue.
Le coronavirus bovin (BCoV) d.
Le BCoV (pour bovine coronavirus) appartient à la famille des
Coronaviridae, elle-même subdivisée en quatre genres (Alphacoronavirus, Betacoronavirus, Gammacoronavirus et Deltacoronavirus) (57). Il fait partie du
genre Betacoronavirus auquel appartient aussi le virus du Syndrome Respiratoire Aigu Sévère qui a sévi en Asie au printemps 2003 (SRAS-CoV), le coronavirus du syndrome respiratoire du Moyen-Orient (MERS-CoV) ainsi que le coronavirus respiratoire humain (HCoV OC43) (58). Il s’agit d’un virus sphérique enveloppé et pourvu de spicules, d’un diamètre de 120 à 160 nm, très fragile, sensible à la chaleur, aux détergents et aux solvants. Il est doté d’un ARN simple brin positif. A sa surface figurent deux protéines responsables de l’attachement du virus à la cellule hôte : l’hémagglutinine estérase (HE) et la protéine de la spicule (S), Leurs actions combinées permettent l’adhésion aux cellules cibles et l’entrée du virion dans le cytoplasme. De plus, les protéines HE et S provoquent une production d’anticorps neutralisants protecteurs (59). Toutes les souches de BCoV sont actuellement regroupées dans le même sérotype.
21 Le BCoV a un tropisme respiratoire et digestif. Il est bien connu en tant qu’agent de diarrhée chez les veaux mais son rôle dans les affections respiratoires est resté longtemps mal défini. Bien que détecté en 1986 dans deux cas de pneumonies à coronavirus chez les bovins, il a fallu attendre 2003 (pandémie de SRAS en Asie) pour que survienne un regain d’intérêt pour le coronavirus à tropisme respiratoire tant dans l’espèce humaine que chez les bovins. Dans les élevages, il pourrait jouer un rôle dans l’apparition de bronchopneumonie chez les jeunes animaux et chez les bovins engraissés en lot. Le BCoV peut ainsi être retrouvé tant dans les voies respiratoires inférieures que supérieures. Les veaux, les jeunes adultes ou les adultes infectés de manière subclinique ou clinique constituent le réservoir du virus. La reproduction expérimentale de la maladie est difficile mais permet d’induire un jetage nasal et de la toux, signe d’une infection du tractus respiratoire supérieur. Son implication en pathologie respiratoire repose alors principalement sur des études cas-témoins réalisées dans des feedlots nord-américains suggérant une association entre portage nasal de BCoV et BPI, une association entre présence de BCoV et lésions respiratoires à l’abattage, et une association inverse avec la présence d’anticorps neutralisant le BCoV et l’apparition de BPI (60–63). Les données en Europe sont moins nombreuses mais montrent aussi une corrélation avec la pathologie respiratoire (64–69).
Sur le terrain, Les affections à BCoV du jeune veau peuvent être cliniquement bénignes (toux, rhinite) ou se compliquer de pneumonie notamment lors de stress ou de surinfections bactériennes. Dans ce dernier cas le virus agirait comme agent initiateur. Lors de formes sévères les lésions traduisent une bronchopneumonie interstitielle (24,60,62,70–73).
L’Adénovirus bovin de type 3 e.
Les adénovirus responsables de troubles respiratoires chez les bovins appartiennent à la famille des Adenoviridae, et au genre Mastadenovirus. L’Adénovirus bovin de type 3 (BAD3) a été isolé pour la première fois en 1965 chez une vache saine. Ce sont des virus nus qui mesurent 70 à 110 nm de diamètre, à ADN double brin et à géométrie icosaédrique. Ils sont très stables
22 dans le milieu extérieur (74). L’implication de ce virus dans la maladie respiratoire chez les bovins est très peu connue, quelques études évoquent sa détection dans les prélèvements respiratoires ou la détection des anticorps anti-BAD3 (20,23,48,74,75). L’infection semble causer des troubles pulmonaires et gastro-intestinaux mais il est aussi fréquent d’isoler le virus chez des animaux sains, la majorité des infections étant subcliniques. Récemment Ng et al (2015) ont montré que le BAD3 est significativement associé avec la BPI (P<0.0001) (76).
Le Virus de la diarrhée virale bovine (BVDV) f.
Le virus de la diarrhée virale bovine (BVDV pour bovine viral diarrhea virus) est un agent infectieux majeur des bovins qui appartient à la famille des
Flaviviridae, et au genre Pestivirus. Il s’agit d’un petit virus enveloppé dont le
matériel génétique se compose d’un ARN simple brin de polarité positive. Comme la plupart des virus à ARN, il fait preuve d’une grande variabilité génétique. Le virus BVD peut se présenter sous deux biotypes appelés cytopathogène (cp) qui induit une lyse en cultures cellulaires et non cytopathogène (ncp). Il semblerait que le biotype cytopathogène dérive du biotype non cytopathogène par mutation, chez les bovins infectés permanents immunotolérants (IPI) (77). Seules les souches ncp sont isolées à partir de poumons et ce sont les biotypes ncp qui circulent principalement sur le terrain (78). Les troubles respiratoires sont consécutifs à une infection transitoire avec une souche ncp. Toutefois les essais d’inoculation ayant pour but de produire une affection respiratoire due au seul virus BVD n’ont abouti qu’à des lésions mineures (78). Il semblerait que le virus BVD soit peu pneumopathogène par lui-même, même si une réplication dans la muqueuse respiratoire est possible (79) Son pouvoir pathogène dans les BPI s’expliquerait principalement par son effet immunosuppresseur. L’effet potentialisateur peut s’expliquer par l’action du virus sur les cellules lymphoïdes : altération fonctionnelle des granulocytes neutrophiles, des lymphocytes B et T, et quelquefois des thrombocytes ce qui induit une neutropénie et une lymphopénie, une trombocytopénie persistant 10 à 15 jours après l’infection. La durée et l’intensité de l’immunodépression dépendent de la souche virale. L’immunodépression induite par le BVDV (80) peut ainsi faciliter l’infection du
23 poumon par d’autres virus et par des bactéries (78,81–90). L’implication du BVDV dans les affections respiratoires bovines est donc complexe. Même s’il semble jouer un rôle plutôt indirect, il existe suffisamment de preuves pour le considérer comme un agent du complexe des affections respiratoires bovines.
4. Interactions entre agents pathogènes respiratoires
Les infections d’un même individu malade par plusieurs agents pathogènes impliqués dans le processus morbide ont été bien décrites chez l’homme dès les épidémies d’influenza de type A au XIXe et XXe siècle où les
personnes atteintes décédaient de complications bactériennes respiratoires à staphylocoques, haemophilus et/ou streptocoques. Ces notions de co-infections sont très étudiées en Santé Humaine pour comprendre les processus morbides et trouver des moyens communs de prévention et de lutte. En pathologie respiratoire bovine, même si les recherches sur les co-infections respiratoires datent des années 1950 (91), il n’existe finalement que peu d’études dans ce domaine, qui reposent soit sur des données épidémiologiques visant à associer plusieurs pathogènes à un processus morbide soit sur des reproductions expérimentales. Pour ces dernières, l’objectif est de comparer la pathogénicité d’une co-infection à deux agents pathogènes le plus souvent par rapport à des mono-infections avec les mêmes agents étudiés. Cela contraste avec les études de prévalence qui suggèrent toutes une association fréquente entre pathogènes lors de BPI. Ainsi Tessier révèle que 74% de ses prélèvements sont poly-infectés alors que seulement 19,5% des prélèvements permettent d’isoler un seul agent (19). Dix-neuf pour cent des veaux sont poly-infectés dans l’étude de Valarcher (1). En Suède, une étude menée par Hagglund révèle que 35% des veaux sont infectés par une combinaison de 2 virus, 26% par une combinaison de 3 virus et 6% par une combinaison de 4 virus (92). Les combinaisons d’agents sont multiples et différentes selon les études et selon les types de prélèvements écouvillons nasaux profonds (ENP), ATT ou LBA. Dans l’étude de Valarcher, l’association la plus souvent rencontrée est BRSV/BCoV (1). Dans une autre étude française les couples de pathogènes les plus fréquents sont P. multocida/H.somni (28%), P.
24 (4,3%), et BRSV/BPi3 (4,3%) (25). En l’état et en l’absence de données exhaustives, il ne se dégage pas d’associations privilégiées entre certains agents pathogènes.
Interactions entre bactéries respiratoires a.
Les études sur les relations synergétiques et antagonistes entre bactéries dans les pneumonies sont diverses. Chez l’homme ces interactions sont décrites entre les bactéries commensales qui colonisent le tractus respiratoires et celles considérées comme pathogènes ou entre bactéries pathogènes (93,94). Les associations positives existent quand un micro-organisme favorise la présence et la survie d’un autre par des mécanismes de mutualisme, de commensalisme ou de symbiose ou par des moyens qui aident à échapper au système immunitaire de l’hôte. Les associations négatives sont dues aux interactions d’amensalisme (antagonisme) ou de prédation entre les espèces bactériennes en compétition dans le même habitat ou quand le système immunitaire favorise indirectement la présence d’une espèce. Ces mécanismes comprennent entre autres la production par certaines bactéries tolérantes du peroxyde d’hydrogène (H2O2) toxique pour les espèces compétitrices (95), les réactions biochimiques qui mènent à la destruction des protéines de surfaces nécessaires pour l’adhésion à l’épithélium des bactéries compétitrices (96), et la modulation du système immunitaire pour entraîner la clairance des espèces en compétition (97).
Les co-infections bactéries-bactéries sont très peu étudiées en pathologie respiratoire bovine. Corbeil et al. (1985) ont suggéré que la flore respiratoire résidente pouvait améliorer ou inhiber la croissance de M. haemolytica, P.
multocida, et H. somni in vitro (98). La plupart des isolats de la flore respiratoire
étaient bénéfiques à la croissance des pasteurelles, notamment les genres
Micrococcus, Corynebacterium et Staphylococcus. A l’inverse tous les isolats du
genre Bacillus, sauf un, ont montré un pouvoir inhibiteur sur les pasteurelles. En termes de diversité, il y avait 4 fois plus d’isolats améliorateurs de croissance que des bacilles inhibiteurs.
La bactérie Bibersteinia trehalosi précédemment connue comme
25 respiratoire chez les petits ruminants. En plus de B. trehalosi, M. haemolytica et P.
multocida sont impliqués dans les BPI chez les mouflons canadiens.
Curieusement, B. trehalosi et P. multocida sont souvent détectés simultanément dans les prélèvements de poumons des mouflons atteints, une association qui n’implique pas M. haemolytica. L’hypothèse que B. trehalosi et P. multocida peuvent inhiber la croissance de M. haemolytica a été vérifiée in vitro dans deux études. Dans la première étude, la charge en CFU (colony forming unit) de M.
haemolytica était entre 6 et 9 log10 fois inférieure lors de co-culture avec B.
trehalosi par rapport à la monoculture en l’absence de B. trehalosi (99). La
deuxième étude (100) a montré, par des méthodes similaires, l’effet inhibiteur de
P. multocida sur la croissance de M. haemolytica. Cultivées individuellement, les
deux souches P. multocida et M. haemolytica ont montré des caractéristiques de croissance similaires, ce qui n’est pas le cas lorsque les deux pasteurelles sont misent en culture ensembles. Quantitativement, à 24h après mise en co-culture, la charge de M. haemolytica était inférieure de 4 ordres de grandeur comparée à celle de la monoculture. Dans les deux études, l’inhibition n’était pas observée quand les cultures du couple en question étaient séparées par une membrane de 8 µm empêchant le contact direct entre les deux cultures, ce qui suggère un mécanisme dépendant du contact et non pas par sécrétion de composés antimicrobiens. Les auteurs suggèrent que ce phénomène d’inhibition entre les pasteurelles est à l’origine des observations dans les données de diagnostic du terrain durant les épisodes de BPI chez les mouflons canadiens.
Une étude récente (101) a utilisé les résultats de Corbeil et al sur le potentiel des Bacilles respiratoires à inhiber la croissance et la colonisation des bactéries pathogènes comme les pasteurelles. Dans cette étude in vitro, les souches suivantes : Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus
helveticus, Lactobacillus plantarum, Lactobacillus rhamnosus, Lactococcus lactis
ainsi que Streptococcus thermophilus et Paenibacillus polymyxa ont été évaluées pour leur effet inhibiteur contre le serotype 1 de M. haemolytica, notamment sa capacité d’adhésion sur les cellules épithéliales bronchiques bovines (BBE). Les souches P. polymyxa, Lactobacillus rhamnosus, Lactobacillus planterum,
26 de M. haemolytica sur le milieu de culture. Le mécanisme proposé serait la sécrétion de substances antimicrobiennes, car l’effet peut être reproduit en utilisant le surnageant de culture des souches à effet inhibiteur. Par la suite, les deux souches P. polymyxa et L. acidophilus ont montré le meilleur potentiel pour réduire la colonisation des cellules bronchiques bovines par M. haemolytica A1. Les souches bactériennes appartenant au genre Lactobacillus font partie du microbiote respiratoire normal des bovins (102) et une perturbation de leur abondance pourrait être à la base d’une dominance des bactéries pathogènes. Dans une application similaire en médecine humaine, la bactérie Streptococcus
salivarius a montré un grand potentiel dans la protection contre la colonisation par
des bactéries pathogènes dans les cavités respiratoires superficielles (103,104). Interactions entre virus et bactéries
b.
Les interactions virus-bactéries dans la pathogenèse des infections respiratoires chez l’homme font principalement intervenir deux mécanismes, la destruction de l’épithélium respiratoire par un virus qui expose la membrane basale aux infections bactériennes secondaires et le dysfonctionnement du système immunitaire favorisant ainsi la prolifération bactérienne (94). Tout atteinte de l’épithélium respiratoire, par exemple lors d’infection à BoHV-1, va entrainer une facilitation de la translocation bactérienne ce qui mène à une migration des bactéries résidentes dans les voies respiratoires superficielles vers les voies respiratoires profondes. Ce mécanisme est commun lors d’infection à pasteurelles (M. haemolytica, P. multocida et H. somni) qui peuvent être des germes commensaux du tractus respiratoire supérieur. Ces bactéries sont bien souvent isolées dans des prélèvements nasopharyngés de bovins ne présentant aucune pathologie respiratoire apparente. Par contre leur présence dans les poumons est un critère d’imputabilité pour les BPI.
Le mécanisme le plus souvent cité pour expliquer les co-infections virus-bactéries est la capacité des virus respiratoires à modifier/inhiber la réponse immunitaire, et notamment la réponse lymphocytaire, favorisant ainsi la prolifération bactérienne. Les principaux mécanismes connus sont le blocage de l’expression de certain récepteurs CMH (BoHV1) (55) , une diminution de la
27 phagocytose (BPI3) (56), et quelquefois un emballement sévère de la réponse immunitaire (BRSV) lymphocytaire vers une voie Th2, délétère pour l’animal (105).
L’exemple le plus cité dans la littérature est le virus BVD, connu comme cofacteur potentialisateur des maladies respiratoires lorsqu’il est associé à une pasteurelle ou un autre virus respiratoire. Le risque de BPI est ainsi significativement augmenté lorsque le lot est exposé au BVDV (12,106), et les traitements sont significativement plus longs (107). Le passage du virus de la BVD par les poumons aurait un impact sur les macrophages alvéolaires en diminuant leurs capacités de phagocytose et en diminuant la sécrétion des cytokines et chimiokines produites, notamment le TNFa et l’IL-1 (87). De même le BVDV diminuerait les capacités microbicides et de cytotoxicité dépendantes des anticorps associées aux neutrophiles (108). Par ailleurs, après infection par le BVDV on observe une lymphopénie et une thrombocytopénie transitoires (3 à 6 jours) sévères selon les souches. Toutes les classes de lymphocytes sont impactées (B, T, γd) et l’expression des molécules de CMHII est perturbée (109). Une étude a montré que lors de co-infections par le BVDV et M. haemolytica, les signes cliniques étaient plus sévères dans le groupe co-infecté. Les auteurs ont détecté dans le groupe co-infecté des concentrations élevées de protéines de la phase aiguë de l’inflammation (acute phase proteins APP) et une durée prolongée de l’infection virale. Par ailleurs la souche de M. haemolytica utilisée était faiblement pathogène (effet sur le groupe mono-infecté) suggérant la nécessité d’une co-infection par le BVDV pour induire une infection respiratoire sévère (90). Deux études ont aussi souligné l’importance du BVDV lors de co-infection avec M.
bovis (86,110).
L’ordre de passage des pathogènes pourrait jouer un rôle. Pour exemple chez les bovins, la durée de l’infection était plus longue et les signes cliniques et les lésions pulmonaires plus sévères lors d’une infection par le BRSV suivie par une infection par H. somni, comparé à des infections uniques (111). Dans ce cas les IgE produites par l’infection virale seraient responsable d’une augmentation de la perméabilité vasculaire, des œdèmes et de l’inflammation observés (111). Ce synergisme entre le BRSV et H. somni a aussi été démontré in vitro, une pré-infection de cellules alvéolaires bovines par le BRSV induit une augmentation