THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées Ecologie et biologie des interactions - EBI (Poitiers)
(Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac
Secteur de recherche : Biologie des organismes ; Biotechnologies animales, végétales et microbiennes
Présentée par : Dany Mainson
Étude du transport des sucres dans les racines d'Arabidopsis thaliana au cours de son cycle
de développement et en réponse à un stress osmotique Directeur(s) de Thèse :
Rémi Lemoine, Nathalie Pourtau Soutenue le 11 janvier 2013 devant le jury Jury :
Président Soulaïman Sakr Professeur des Universités, Université de Angers Rapporteur Soulaïman Sakr Professeur des Universités, Université de Angers Rapporteur Alain Bouchereau Professeur des Universités, Université de Rennes 1 Membre Rémi Lemoine Directeur de recherche, CNRS, Université de Poitiers Membre Nathalie Pourtau Maître de conférences, Université de Poitiers
Membre Jean-Louis Durand Chargé de recherche, INRA de Lusignan Membre Patrick Armengaud Assistant de recherche, INRA de Versailles
Pour citer cette thèse :
Dany Mainson. Étude du transport des sucres dans les racines d'Arabidopsis thaliana au cours de son cycle de développement et en réponse à un stress osmotique [En ligne]. Thèse Biologie des organismes ; Biotechnologies animales, végétales et microbiennes. Poitiers : Université de Poitiers, 2013. Disponible sur Internet
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté des Sciences Fondamentales et Appliquées)
(Diplôme national – Arrêté du 7 août 2006)
Ecole doctorale : Sciences pour l’Environnement Gay Lussac
Secteur de recherche : Biologie des organismes ; Biotechnologies Animales, Végétales et Microbiennes
Présentée par :
Dany MAINSON
**********************
Etude du transport des sucres dans les racines
d’
Arabidopsis thaliana au cours de son cycle de
développement et en réponse à un stress osmotique
**********************
Travaux dirigés par Rémi LEMOINE et Nathalie POURTAU
Soutenance prévue le 11 janvier 2013 à Poitiers devant la commission d’examen JURY
Alain BOUCHEREAU Professeur de l’Université de Rennes Rapporteur Soulaiman SAKR Professeur de l’Université d’Angers Rapporteur Jean-Louis DURAND Chargé de recherche INRA, Lusignan Examinateur Patrick ARMENGAUD Assistant de recherche INRA, Versailles Examinateur Rémi LEMOINE Directeur de recherche de l’Université de Poitiers Examinateur Nathalie POURTAU Maître de conférence de l’Université de Poitiers Examinateur
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (Faculté des Sciences Fondamentales et Appliquées)
(Diplôme national – Arrêté du 7 août 2006)
Ecole doctorale : Sciences pour l’Environnement Gay Lussac
Secteur de recherche : Biologie des organismes ; Biotechnologies Animales, Végétales et Microbiennes
Présentée par :
Dany MAINSON
**********************
Etude du transport des sucres dans les racines
d’
Arabidopsis thaliana au cours de son cycle de
développement et en réponse à un stress osmotique
**********************
Travaux dirigés par Rémi LEMOINE et Nathalie POURTAU
Soutenance prévue le 11 janvier 2013 à Poitiers devant la commission d’examen JURY
Alain BOUCHEREAU Professeur de l’Université de Rennes Rapporteur Soulaiman SAKR Professeur de l’Université d’Angers Rapporteur Jean-Louis DURAND Chargé de recherche INRA, Lusignan Examinateur Patrick ARMENGAUD Assistant de recherche INRA, Versailles Examinateur Rémi LEMOINE Directeur de recherche de l’Université de Poitiers Examinateur Nathalie POURTAU Maître de conférence de l’Université de Poitiers Examinateur
REMERCIEMENTS
Je tiens tout d’abord à remercier la Région Poitou-Charentes pour m’avoir accordé la confiance nécessaire en finançant ces travaux.
Je tiens à remercier Rossitza Atanasova pour m’avoir permis de rédiger ce manuscrit dans de bonnes conditions.
J’adresse mes remerciements à Alain Bouchereau et Soulaiman Sakr pour m’avoir fait l’honneur de juger ce travail en qualité de rapporteurs. Je remercie également Jean-Louis Durand et Patrick Armengaud pour leur participation à mes comités de suivi de thèse, ainsi que pour avoir accepté de faire partie de mon jury de thèse.
Je présente aussi mes remerciements à Marie-Pascale Prud’Homme et Nathalie Noiraud pour avoir accepté de discuter de mon travail au cours de mes différents comités de thèse.
Je remercie Rémi Lemoine pour m’avoir chaleureusement accueilli dans son laboratoire et pour m’avoir guidé dans mes travaux de thèse. Je remercie également Nathalie Pourtau pour m’avoir encadré pendant ces trois ans de thèse. Je garderai de très bon souvenir de notre cohabitation dans le bureau et de nos récoltes nocturnes ! Je tiens aussi à les remercier tous les deux pour la patience et la grande disponibilité dont ils ont fait preuve lors de la rédaction de ce manuscrit.
Merci aussi à Laurence Maurousset pour ta gentillesse et pour tes conseils avisés sur l’interprétation de certains résultats, lors de l’écriture de ce manuscrit.
Je remercie bien sur Benoît Porcheron et Cécile Gaillard pour leur aide précieuse pendant ces trois années de laboratoire. Beaucoup de mes manips auraient été très laborieuse sans votre participation ! Je remercie aussi Vincent Lebeure et Bruno Faure pour avoir porté un œil attentif sur mes plantes.
Un merci à Maryse Laloi et Sylvain La Camera pour m’avoir initié aux techniques de macroarray et RT-qPCR.
Mes remerciements s’adressent aussi à Christelle Roudaut pour tout le travail qu’elle a fourni derrière son spectromètre de flamme.
Je remercie tous mes collègues thésards et ex-thésards du laboratoire (Damien, Anna, Audrey, Cyril, Pauline, Jonathan et Mickael). Je remercie tout particulièrement Pauline, pour tous les bons moments partagés ensemble dans le bureau, et pour toutes tes petites manies irrésistibles. Un très grand merci aussi à Jo et Lydia pour leur soutien infaillible et pour m’avoir fait profiter de leurs excellents dons de cuisiniers.
Je remercie aussi tous mes autres collègues du laboratoire (chercheurs, techniciens et secrétaires) pour leur gentillesse et leur soutien au cours de mes 3 années de thèse. Une pensée particulière pour Andrée Bourbouloux, avec qui j’ai partagé le grand labo et de longues discussions …
Merci aussi à Manuel Vaury, Arnaud Traineau et Florian Veillet, pour leur précieuse participation à mes travaux de recherche au cours de leur stage.
Enfin, un énorme merci à ma famille et mes amis pour leur soutien indéfectible. Je remercie très affectueusement mes parents et Agnès, qui m’ont toujours encouragé et soutenus tout au long de ces trois ans de thèse.
ABREVIATIONS
ABA Acide Abscissique
Act Actine
ADN Acide désoxyribonucléique (c : complémentaire)
AOS Active Oxygen Species
ARN Acide Ribonucléique
ATP Adénosine Triphosphate
BET Bromure d’Ethidium BSA Bovine Serum Albumin
CNRS Centre National de la Recherche Scientifique
Col-0 Accession Colombia 0
Ct Cycle Threshold
dATP Deoxyadenosine triphosphate
dCTP Deoxycytidine triphosphate dGTP Deoxyguanosine triphosphate DNase Désoxyribonucléase dNTP Desoxyribonucléotide dTTP Desoxythymidine triphosphate DO Densité Optique DST DiSaccharide Transporter
EDTA Acide Ethylène Tétra Acétique
EF1α Elongation Factor 1 alpha
ERD Early Responsive to Dehydratation
FAO Food and Agriculture Organization
GAPDH Glyceraldéhyde 3-Phosphate Déhydrogenase
His Histone
INRA Institut National de la Recherche Agronomique
INT Inositol Transporter
LEA Late Embryogenesis Abundant
Ler Accession Landsberg erecta
MES Acide 2-(n-Morpholino Ethanesulfonique
MF Masse Fraiche
MI Masse Imbibée
MPa Méga Pascal
MS Murashigue et Skoog
MST Major Facilitator Superfamily
NADP Nicotinamide adénine dinucléotide phosphate
Oligo (dT) Oligo-desoxythymine
Osm Osmolarité
PAR Photosynthetically Active Radiation
pb Paire de bases
PCR Polymerase Chain Reaction
PEG Polyéthylène Glycol
pGlcT Plastidic Glucose Transporter
pH Potentiel Hydrogène
RD Responsive Dehydratation
REB RNA Extraction Buffer
PLT Polyol Transporter
PVPP Polyvinylpolypyrrolidone
R/S Rapport Root/Shoot
RT Reverse Transcription
RT-qPCR Real-Time quantitative PCR
SDS Sodium dodécylsulfate
SIC Signal, Image et Communication
SSC Standard Sodium Citrate
STP Sugar Transporter Protein
SUC Sucrose Carrier
TM Température d’hybridation
TMT Tonoplast Monosaccharide Transporter
Tris Tri-(hydroxyméthyl)-amino méthane
UMR Unité Mixte de Recherche
UTR Untanslated Terminal Region
UV Ultraviolet
TABLE DES MATIERES
1. INTRODUCTION 1
1.1 Le transport des sucres chez les végétaux supérieurs ... 2
1.1.1 Production des sucres ... 2
1.1.2 Chargement dans le phloème ... 3
1.1.3 Déchargement du phloème dans les organes puits ... 4
1.2 Distribution des ressources carbonées dans la plante ... 4
1.3 Les transporteurs de sucre chez Arabidopsis thaliana ... 5
1.3.1 Les gènes de transporteurs de disaccharides (DSTs) : ... 5
1.3.2 Les gènes de transporteurs de monosaccharides (MSTs) : ... 6
1.4 Le déficit hydrique ... 8
1.4.1 Stratégies adaptative des plantes en réponse au stress hydrique ... 9
1.4.2 Mécanismes de tolérance des plantes au déficit hydrique ... 10
1.4.3 Réponse des racines au déficit hydrique ... 13
1.4.4 Modification du transcriptome lors d’un stress hydrique ... 14
1.5 Objectifs de l’étude ... 15
2 MATERIEL ET METHODES ... 17
2.1 Matériel végétal ... 18
2.2 Méthodes ... 18
2.2.1 Mise en place du système de culture des plantes en hydroponie ... 18
2.2.2 Contrôle du développement des plantes cultivées en hydroponie ... 20
2.2.3 Etude du cycle complet de développement d’Arabidopsis thaliana (Col-0) cultivée en hydroponie et mesure de quelques paramètres reflétant son métabolisme carboné ... 21
2.2.4 Etude quelques paramètres reflétant le métabolisme carboné d’Arabidopsis thaliana au cours du cycle nycthémère ... 21
2.2.5 Mise en place du stress osmotique sur Arabidopsis thaliana cultivée en hydroponie ... 22
2.2.6 Mise en place du système de culture d’Arabidopsis thaliana en rhizobox ... 23
2.2.7 Suivi physiologique des plantes ... 26
2.2.8 Méthodes d’analyse de l’expression des gènes ... 31
2.2.9 Méthodes d’analyse biochimique ... 35
2.2.11 Analyses statistiques ... 38
3 RESULTATS ET DISCUSSION ... 39
3.1 Mise en place de la culture en hydroponie ... 40
3.1.1 Mesure de paramètres physiques de la chambre de culture et du milieu de culture - 3 - ... 40
3.1.2 Etude du développement végétatif d’Arabidopsis thaliana (C24) en culture hydroponique ... 46
3.2 Etude du cycle complet de développement d’Arabidopsis thaliana (Col-0) cultivée en hydroponie et mesure de quelques paramètres reflétant son métabolisme carboné ... 56
3.2.1 Observation du phénotype ... 57
3.2.2 Répartition de la biomasse ... 57
3.2.3 Etude de la teneur en chlorophylles. ... 60
3.2.4 Discussion ... 61
3.2.5 Etude de l’expression des gènes de transporteurs de sucre ... 67
3.2.6 Etude de la teneur en sucres solubles : saccharose, glucose et fructose ... 79
3.2.7 Etude de la teneur en amidon au cours du développement. ... 89
3.2.8 Etude du flux de saccharose radiomarqué : ... 92
3.2.9 Bilan ... 96
3.3 Etude de quelques paramètres liés au métabolisme et au transport du carbone au cours d’une période de 24h. ... 98
3.3.1 Etude de l’expression des gènes de transporteurs de sucre par macroarray ... 98
3.3.2 Etude du contenu en sucre solubles (saccharose, glucose, fructose)... 100
3.3.3 Etude de la teneur en amidon ... 101
3.3.4 Discussion ... 101
3.3.5 Bilan ... 105
3.4 Mise en place d’un protocole de stress osmotique en hydroponie ... 106
3.4.1 Mise en place du stress osmotique sur l’écotype Col-0 (Essai stress Col-0) ... 106
3.4.2 Discussion : ... 109
3.5 Etude d’une cinétique de stress osmotique (« Campagne stress ») ... 113
3.5.1 Observation phénotypique des plantes ... 114
3.5.2 Etude de l’état hydrique des plantes ... 114
3.5.3 Détermination des masses sèches et du rapport Root/Shoot (rapport R/S) ... 115
3.5.4 Teneurs en chlorophylles au cours du stress ... 116
3.5.6 Etude de l’expression des gènes de transporteurs de sucre au cours d’une
cinétique de stress osmotique ... 117
3.5.7 Etude de la teneur en sucres solubles au cours d’une cinétique de stress osmotique ... 119
3.5.8 Etude de la teneur en amidon au cours d’une cinétique de stress osmotique ... 120
3.5.9 Discussion ... 120
3.6 Mise en place du stress osmotique suivi d’une réhydratation sur l’écotype Col-0 (« Essai réhydratation ») ... 125
3.6.1 Observation phénotypique des plantes ... 126
3.6.2 Etude de l’état hydrique des plantes : ... 127
3.6.3 Etude de l’expression des gènes de transporteurs de sucre par qRT-PCR ... 129
3.6.4 Discussion ... 131
3.7 Etude d’un stress hydrique suivi d’une réhydratation (Campagne réhydratation) .. 133
3.7.1 Observation phénotypique des plantes ... 134
3.7.2 Suivi de la croissance des plantes ... 134
3.7.3 Suivi de la conductance stomatique au cours du stress hydrique ... 135
3.7.4 Etude de l’état hydrique des plantes ... 136
3.7.5 Evolution de la biomasse ... 136
3.7.6 Suivi du contenu en chlorophylles ... 138
3.7.7 Suivi du contenu en quelques élément constitutif de la plante... 138
3.7.8 Etude de l’expression des gènes de transporteurs de sucre ... 139
3.7.9 Etude de la teneur en sucres solubles ... 139
3.7.10 Etude de la teneur en amidon ... 140
3.7.11 Etude du flux de saccharose radiomarqué ... 141
3.7.12 Discussion ... 142
3.8 Etude du stress hydrique en culture rhizobox ... 148
3.8.1 Suivi du phénotype des plantes ... 148
3.8.2 Suivi de la croissance du réseau racinaire ... 149
3.8.3 Suivi de l’état hydrique des plantes ... 151
3.8.4 Etude de l’expression des gènes de transporteurs de sucres ... 152
3.8.5 Discussion ... 152
5 CONCLUSION ... 156
5.1 La culture en hydroponie ... 157
5.3 Transporteurs de sucre et transport de saccharose ... 164 5.4 Les sucres ... 166 6 PERSPECTIVES ... 168 7 BIBLIOGRAPHIE ... 171
1
2
1.1 Le transport des sucres chez les végétaux supérieurs
Chez les végétaux supérieurs, les organes qui composent la plante peuvent être divisés en deux catégories selon leur bilan carboné. D’un côté les organes sources, lieu de photosynthèse, où la quantité de sucres produite est supérieure à ce qui est nécessaire pour la croissance et développement. Ce sont essentiellement les feuilles matures des plantes qui entrent dans cette catégorie. De l’autre côté, les organes puits sont incapables d’effectuer la photosynthèse et, par conséquent, sont nourris par les organes sources. Les sucres représentent la principale source d’énergie des plantes mais sont aussi indispensables comme élément de base dans la formation des réserves (amidon), des parois (cellulose), comme squelette carboné dans la synthèse de métabolites (acides aminés ou métabolites secondaires), voire comme molécule signal (Lalonde et al. 2003). Ainsi, une partie des glucides produits par la photosynthèse est directement utilisée pour la croissance des organes sources, une partie y est stockée temporairement (amidon, saccharose vacuolaire) et le reste est exporté vers les organes puits. Parmi les organes puits on peut trouver les racines, mais aussi les tiges, fleurs, graines ou les feuilles en développement. Afin d’alimenter les organes puits en molécules carbonées, un transport constant des photoassimilats des feuilles sources vers ces derniers, via le phloème, est donc nécessaire tout au long du développement de la plante (Ho 1988). Ce transport peut être décomposé en 3 principales étapes : le transport latéral du lieu de synthèse des sucres jusqu’au phloème, le transport longitudinal dans les tissus conducteurs du phloème et enfin le transport latéral au niveau de l’organe puits receveur.
1.1.1 Production des sucres
La photosynthèse a lieu majoritairement dans les cellules du mésophylle des feuilles matures (organes sources), et les produits de ce processus sont les trioses phosphate. Ces molécules sont soit directement utilisées pour la synthèse d’amidon dans les chloroplastes où ils ont été synthétisés, soit exportés vers le cytosol pour être convertis en saccharose (Frommer and Sonnewald 1995). Le saccharose constitue le sucre majoritairement transporté chez les végétaux supérieurs (Lemoine 2000). En effet, c’est un sucre assez inerte puisque non réducteur et relativement insensible au métabolisme (seules deux enzymes sont capables de dégrader le saccharose : les invertases et la saccharose synthase). Une fois synthétisé, le saccharose peut être transporté dans la vacuole, où il est stocké temporairement (Lemoine 2000).
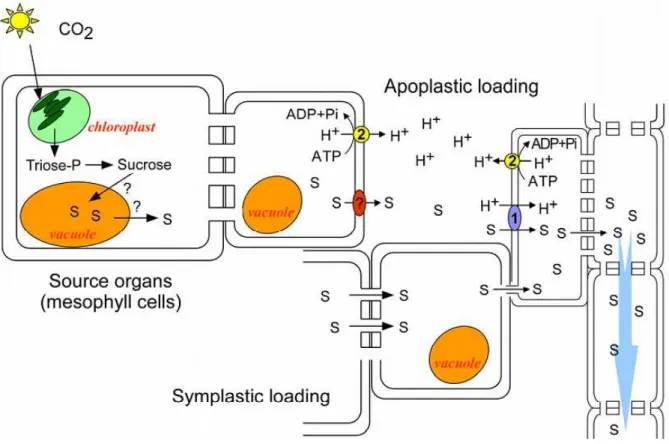
Figure 1 : Chargement du saccharose dans le phloème (Conde et al. 2007). Le saccharose (S) produit dans les cellules du mésophylle peut être chargé dans le phloème par la voie symplastique ou par la voie apoplastique. Dans la voie symplastique le saccharose diffuse à travers les plasmodesmes jusqu’au complexe cellule compagne/tube criblé. Dans le chargement apoplastique, le saccharose relâché dans l’apoplaste des cellules du mésophylle est importé dans les cellules compagnes par transport actif. (1) Symport Saccharose/H+ (source) ; (2) ATPase H+ de la membrane plasmique.
3 1.1.2 Chargement dans le phloème
A partir des cellules du mésophylle où il est synthétisé, le saccharose va dans un premier temps circuler par la voie symplastique vers les cellules parenchymateuses du phloème (Figure 1). Ce transport se fait via les plasmodesmes des cellules en suivant le gradient de concentration du saccharose (Lalonde et al. 2003). Le saccharose doit ensuite être chargé des cellules parenchymateuses dans le complexe conducteur (tube criblé-cellule compagne). Deux mécanismes peuvent intervenir dans le chargement du phloème : une voie symplastique et une voie apoplastique (Kühn et al. 1999, Truernit 2001). Dans le cas du chargement symplastique, le saccharose est transporté par le biais de plasmodesmes élargis entre les cellules du parenchyme et le complexe conducteur (cellules compagnes puis tubes criblés).
Dans le cas d’un chargement apoplastique, le saccharose doit dans un premier temps être transféré des cellules parenchymateuses vers l’apoplaste. Ce transport à travers la membrane des cellules est facilité par la présence de protéines transmembranaires : les transporteurs d’efflux du saccharose. Chez Arabidopsis thaliana, deux transporteurs seraient impliqués : les protéines AtSWEET11 et AtSWEET12 (Chen et al. 2012). Ces deux transporteurs n’utilisent pas d’énergie pour transporter le saccharose et leur fonctionnement s’apparenterait plus à celui des canaux. Une fois dans l’apoplaste, le saccharose doit être chargé dans les cellules compagnes du phloème. La concentration en saccharose du phloème étant beaucoup plus importante que celle des cellules de l’apoplaste, un transport actif du saccharose est nécessaire. Ce transport est assuré par des protéines spécialisées présentes sur la membrane plasmique de ces cellules, les transporteurs de sucre. Ces protéines transportent le saccharose en utilisant la force protomotrice, permettant ainsi l’import du saccharose contre son gradient de concentration (Sauer 2007). Cette force protomotrice est fournie par une ATPase pompe à proton située sur la membrane plasmique et exportant les protons vers l’apoplaste (Poole 1978). Ce transport actif du saccharose contre son gradient de concentration permet ainsi d’accumuler de façon importante ce sucre dans les cellules compagnes. Le saccharose diffusera ensuite dans les tubes criblés via les nombreux plasmodesmes les reliant aux cellules compagnes. Le saccharose est alors transporté des organes sources aux organes puits dans les tubes criblés, selon la théorie du flux de masse proposée par Münch (1930).
Figure 2 : Déchargement du saccharose dans le phloème (Conde et al. 2007). Au niveau des organes puits, le saccharose peut diffuser à travers les plasmodesmes jusqu’aux cellules receveuses. Alternativement, le saccharose est relâché dans l’apoplaste et importé dans les cellules puits par transport actif. Le saccharose peut aussi être clivé par l’action des invertases pariétales, et les hexoses produits sont transportés activement dans les cellules receveuses. Le transport dans la vacuole serait possible grâce à des antiports Hexose/H+ et Saccharose/H+). Le gradient de pression de turgescence, déterminé par le chargement et le déchargement du phloème, permet le mouvement de la sève des organes source aux organes puits. (3) ATPase H+ vacuolaire ; (4) Pyrophosphatase ; (5) antiport saccharose/H+ ; (6) antiport hexose/H+ ; Symport Saccharose/H+ (puits) ; symport hexose/H+ ; invertase.
4
1.1.3 Déchargement du phloème dans les organes puits
Au niveau de l’organe puits, le déchargement du phloème peut se faire par la voie apoplastique et/ou symplastique en fonction de l’organe receveur (Figure 2). Au niveau des racines par exemple, le déchargement symplastique est la voie principale (Patrick 1997). Le saccharose est alors transporté via les plasmodesmes selon son gradient de concentration. Il existe également un déchargement par voie apoplastique du saccharose. Il va alors devoir franchir les membranes plasmiques du complexe conducteur, ainsi que celles des cellules puits, impliquant la présence de transporteurs de saccharose spécifiques. Toutefois, arrivé dans l’apoplaste, le saccharose peut également être hydrolysé en hexoses (glucose + fructose) grâce à l’activité d’invertases pariétales (Tymowska-Lalanne and Kreis 1998). Le transport des hexoses produits s’effectue alors via des transporteurs d’hexose membranaires présents sur les cellules puits. Les sucres ainsi transportés sont directement utilisés dans le métabolisme de l’organe puits (croissance et développement des racines par exemple), stockés (canne à sucre, betterave à sucre) ou bien utilisés pour l’osmorégulation des tissus (Lemoine 2000).
1.2 Distribution des ressources carbonées dans la plante
Le transport des sucres à longue distance permet une répartition du carbone dans tous les organes de la plante. Cette répartition est fortement dépendante de l’activité des organes puits de la plante (Ho 1988). En effet, une compétition vis-à-vis du prélèvement de saccharose dans le phloème va s’installer entre les différents organes puits de la plante. La capacité d’un organe puits à accumuler les assimilats carbonés est fonction de sa force de puits. La force de puits peut être déterminée par le produit de la taille du puits et de l’activité de ce dernier (Wolswinkel 1984). L'activité d'un puits se mesure par sa capacité à prélever les photoassimilats en provenance du phloème mais aussi à métaboliser ces derniers.
De nombreux paramètres vont influencer la force de puits des organes comme le stade de développement ou bien les facteurs environnementaux auxquels la plante peut être soumise (Wardlaw 1990). La régulation de cette force de puits est un processus très complexe faisant intervenir les différentes voies hormonales et les teneurs en sucres des organes (Patrick 1997). Il est possible d’imaginer que cette régulation implique en partie les différents transporteurs de sucre présents. En effet, ces protéines vont réguler la quantité de sucres disponible dans le phloème au niveau des organes sources, mais aussi la capacité des organes puits à importer les photoassimilats (Kuhn and Grof 2010, Roitsch 1999).
5
1.3 Les transporteurs de sucre chez Arabidopsis thaliana
Le séquençage complet du génome de la plante modèle A. thaliana a permis de révéler l’existence de nombreux gènes de transporteurs de sucre. Ceux-ci sont classés en deux grandes familles : les gènes de transporteurs de disaccharides (DSTs) et les gènes de transporteurs de monosaccharides (MSTs) (Buttner 2007, Williams et al. 2000).
1.3.1 Les gènes de transporteurs de disaccharides (DSTs) :
Les DSTs sont représentés chez A. thaliana par les transporteurs de saccharose appelés SUC pour SUcrose Carrier dont 9 gènes ont été identifiés, notés de AtSUC1 à AtSUC9 (Sauer 2007). Ces transporteurs, comme chez les autres espèces, sont capables de transporter le saccharose contre son gradient de concentration, en utilisant l’énergie de la force proton-motrice générée par une H+/ATPase membranaire. L’expression de ces gènes de transporteurs de saccharose peut être très variable entre les différents membres de cette famille.
Le gène AtSUC1 est principalement exprimé dans le grain de pollen et dans le style où il serait impliqué dans la croissance du tube pollinique et dans la déhiscence des anthères (Stadler et al. 1999). Une expression forte de ce gène a aussi été montrée dans les racines par Sivitz et collaborateurs (2008), ainsi que dans les trichomes des feuilles (Stadler et al. 1999). Une répression importante de l’expression de ce gène a été mesurée en présence d’une forte concentration de saccharose et d’ABA (Hoth et al. 2010).
Le gène AtSUC2 est principalement exprimé dans les cellules compagnes des fines nervures des feuilles, où il aurait un rôle majeur dans le chargement apoplastique du phloème (Chandran et al. 2003, Truernit and Sauer 1995). Ceci a été confirmé par le fait que chez les mutants n’exprimant pas AtSUC2, la croissance est très fortement réduite, avec parfois un phénotype létal chez les homozygotes (Gottwald et al. 2000, Srivastava et al. 2008). Ce gène est exprimé au niveau du complexe conducteur de tous les organes, y compris les racines.
Le gène AtSUC3 semble fortement exprimé dans de nombreux tissus puits tels que la cellule de garde, la pointe racinaire ou encore le grain de pollen où il pourrait jouer un rôle dans l’approvisionnement en saccharose (Meyer et al. 2004b). Le gène AtSUC4, quant à lui, est le seul gène de transporteurs de saccharose localisé sur le tonoplaste (Endler et al. 2006). Il serait impliqué dans l’export de saccharose du compartiment vacuolaire vers le cytoplasme (Neuhaus 2007).
L’expression du gène AtSUC5 a été mise en évidence par Baud et collaborateurs (2005) dans l’albumen, où il jouerait un rôle dans le développement des graines d’A. thaliana. Ces
Figure 3 : Arbre phylogénétique des transporteurs de monosaccharides identifiés chez
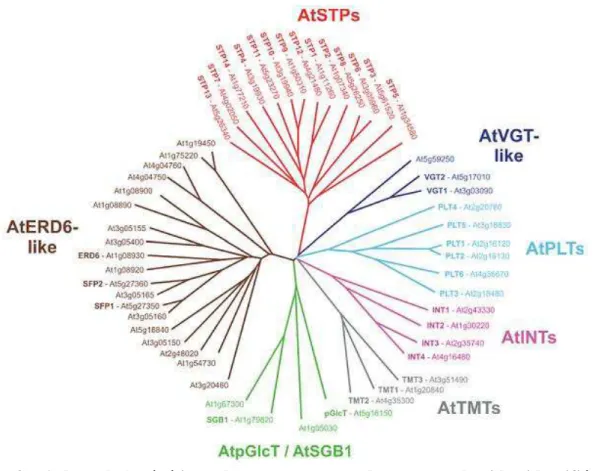
Arabidopsis thaliana (Büttner, 2007). Les 53 séquences protéiques sont regroupées en 7 sous-familles : les AtSTPs (Sugar Transport Proteins), les AtVGT-like (Vacuolar Glucose Transporters), les AtPLT (Polyols Transporters), les AtINTs (Inositol Transporters), les AtTMTs (Tonoplast Monosaccharide Transporters), les AtpGlcT/AtSGB1 (Plastidic Glucose Transporter/Suppressor of G protein B1) et les AtERD6-like (Early Responsive to Dehydratation).
Figure 4 : Schéma de la distribution subcellulaire des monosaccharides et de la localisation des différentes sous-familles de transporteurs de la famille des MST (Büttner, 2007).
6
études ont aussi pu montrer une faible expression de ce gène de transporteur de sucre dans les racines. Les gènes AtSUC6, AtSUC7 et AtSUC8 sont des gènes présentant une très forte homologie de séquence. Cependant, seul le gène AtSUC8 semble coder une protéine fonctionnelle (Sauer et al. 2004). Les études réalisées par Sauer et collaborateurs (2004) montrent que le gène AtSUC8 est co-exprimé avec le gène AtSUC9 dans les tissus floraux. Le gène AtSUC9est aussi exprimé dans l’embryon, ainsi que dans les feuilles (Sivitz et al. 2007). Ce transporteur de sucre aurait un rôle à jouer dans la période de floraison des plantes. En effet, les travaux de Sivitz et collaborateurs (2007) ont montré que les plantes présentant une mutation sur le gène AtSUC9 présentent des phénotypes de floraison accélérée.
1.3.2 Les gènes de transporteurs de monosaccharides (MSTs) :
Dans la famille des MSTs, une cinquantaine de gènes ont été identifiés chez A. thaliana
(Figure 3). Ces transporteurs, catalysant le transport des hexoses mais aussi le transport de certains polyols, sont classés en 7 sous-familles : AtSTP (Sugar Transporter Protein), AtPLT (Polyol Transporter), AtVGT (Vacuolar Glucose Transporter), AtTMT (Tonoplast Monosaccharide Transporter), AtERD6-like (Early Responsive to Dehydratation), AtINT (Inositol Transporter) et AtpGlcT/AtSGB1 (Plastidic Glucose Transporter/Suppressor of G protein B1) (Buttner 2007). La localisation subcellulaire des différents transporteurs de monosaccharides est indiquée sur la Figure 4.
1.3.2.1 Sous-famille des AtSTPs (Sugar Transporter Protein)
La famille des AtSTPs est la famille la plus étudiée et comprend 14 gènes notés d’AtSTP1
à AtSTP14. Ces transporteurs catalyseraient le transport des monosaccharides de l’apoplaste
vers la cellule en symport avec un proton, comme les transporteurs de saccharose. Les études de spécificité indiquent que la plupart des transporteurs caractérisés transportent plus efficacement le glucose que le fructose. La plupart des AtSTPs sont exprimés exclusivement dans les organes puits comme le pollen, la graine ou les racines.
Certains de ces gènes sont très spécifiques d’un organe donné. Par exemple, les gènes
AtSTP2, 6, 9, 10 et 11 ne sont exprimés que dans les grains de pollen et le tube pollinique (Johnson et al. 2006, Schneidereit et al. 2003, Schneidereit et al. 2005, Scholz-Starke et al.
2003, Truernit et al. 1999). De même, l’expression des gènes AtSTP5, 8 et 12n’a été montrée
7
D’autres gènes comme AtSTP4, 7 et 13 peuvent être exprimés dans plusieurs organes puits en même temps. En effet, AtSTP4 est par exemple exprimé dans les racines et dans les grains de pollen (Fotopoulos et al. 2003, Truernit et al. 1996), AtSTP7 est exprimé dans les racines mais aussi dans les graines (Buttner 2010) et l’expression de AtSTP13 a été observée dans les racines et dans les fleurs (Norholm et al. 2006).
Certains AtSTPs, exprimés dans des organes puits sont aussi exprimés dans les feuilles. C’est le cas de AtSTP1par exemple dont l’expression est retrouvée dans les fleurs, les racines,
les cellules de garde mais aussi dans les feuilles matures (Sherson et al. 2000, Stadler et al.
2003). De même, Poschet et collaborateurs (2010) ont montré une expression de AtSTP14
dans les fleurs, les siliques, les tiges et les graines, mais aussi dans les feuilles matures. En revanche, un seul gène d’AtSTPs a été retrouvé exclusivement exprimé dans les feuilles d’A. thaliana, le gène AtSTP3 où il serait impliqué dans la collecte des hexoses de l’apoplaste
(Buttner et al. 2000).
1.3.2.2 Sous-famille des AtPLTs (Polyol Transporter)
Les polyols sont des formes réduites d’aldoses et de cétose pouvant avoir une structure linéaire ou cyclique. Ces dérivés de sucres peuvent être utilisés pour le transport de carbone à longue distance bien que cette fonction n’ait pas été montrée chez A. thaliana (Klepek et al.
2005). Certains polyols peuvent aussi s’accumuler en réponse à des stress environnementaux, comme le stress salin (Noiraud et al. 2001b).
Chez A. thaliana, 6 gènes de transporteurs de polyols ont été identifiés et sont notés d’AtPLT1 à AtPLT6. Ces transporteurs semblent avoir une spécificité de substrat assez large car ils transportent non seulement des polyols (mannitol, sorbitol, xylitol) mais aussi des hexoses. Leur rôle exact chez A. thaliana est donc loin d’être clair.
Seuls les gènes AtPLT1, 2 et 5 ont été caractérisés. Les gènes AtPLT1 et AtPLT2 sont deux gènes présentant une forte homologie de séquence, qui sont co-exprimés dans les grains de pollen et les cellules jeunes du xylème (Klepek et al. 2010). Le gène AtPLT5 quant à lui montre une forte expression dans les pointes racinaires, dans les vaisseaux conducteurs des feuilles, ainsi que dans certains organes floraux (Klepek et al. 2005). L’expression des gènes AtPLT3, 4 et 6 n’a pas été étudiée à l’heure actuelle, cependant ces gènes sembleraient plus
exprimés dans les organes puits (pollen, graines et racines) d’après les données Genenvestigator.
8
1.3.2.3 Autres gènes de transporteurs de monosaccharides
Les autres sous-familles de MSTs sont beaucoup moins étudiées que les AtSTP ou AtPLT. Trois de ces sous-familles de MSTs regroupent des gènes de transporteurs qui semblent être localisés sur le tonoplaste : les AtVGT (Vacuolar Glucose Transporter), les AtTMT (Tonoplaste Monosaccharide Transporter) et les AtERD6-like (Early-Responsive to Dehydratation) (Buttner 2007). Les AtVGTs regroupent 3 gènes, dont le gène AtVGT1 qui est fortement exprimé dans les grains de pollen et un peu moins dans les feuilles et les tiges (Aluri and Buttner 2007). Les 2 autres gènes AtVGT1 et AtVGT2 n’ont à l’heure actuelle pas
été caractérisés. Dans la sous-classe des AtTMT, trois gènes ont pu être identifiés chez A. thaliana. Wormit et collaborateurs (2006) ont montré une expression de AtTMT1 dans les feuilles ainsi que dans les fleurs et une expression de AtTMT2 principalement dans les racines et la tige. Ces études ont aussi mis en évidence que ces deux AtTMTs jouent un rôle majeur dans la réponse à certains stress environnementaux (stress hydrique, froid ou salin). Le gène
AtTMT3quant à lui n’a pas pu être étudié en raison d’un très faible niveau d’expression.
Les gènes de la sous-famille AtERD6-like sont au nombre de 19 chez A. thaliana. Le gène
AtSFP2 est exprimé dans tous les organes testés (source et puits) et associé aux tissus conducteurs, alors que le gène AtSFP1 est exprimé dans la graine et induit lors de la sénescence foliaire (Quirino et al. 2001). Un troisième gène de cette sous-famille est le gène
AtESL1, principalement exprimé dans le péricycle et les cellules du parenchyme xylémien, et induit en condition de stress hydrique et salin, ainsi qu’à l’application exogène d’acide abscissique (Yamada et al. 2009).
Une autre sous-famille de MSTs regroupe les transporteurs d’inositol (AtINT). Ces gènes de MSTs semblent exprimés dans les grains de pollen et les tissus vasculaires des feuilles (Schneider et al. 2006, Schneider et al. 2007). Le rôle de ces transporteurs reste encore mal connu. La dernière sous-famille des MSTs regroupe les gènes de transporteurs plastidiaux (AtpGlcT). Ces transporteurs, au nombre de 3 chez A. thaliana seraient impliqués dans l’exportation du glucose des plastes vers le cytoplasme (Weber et al. 2000).
1.4 Le déficit hydrique
Au cours du dernier siècle, l’utilisation mondiale de l’eau douce a augmenté deux fois plus vite que le taux de croissance démographique (FAO 2007). De ce fait, l’eau douce est devenue une ressource de plus en plus convoitée. Ce phénomène est accentué par le
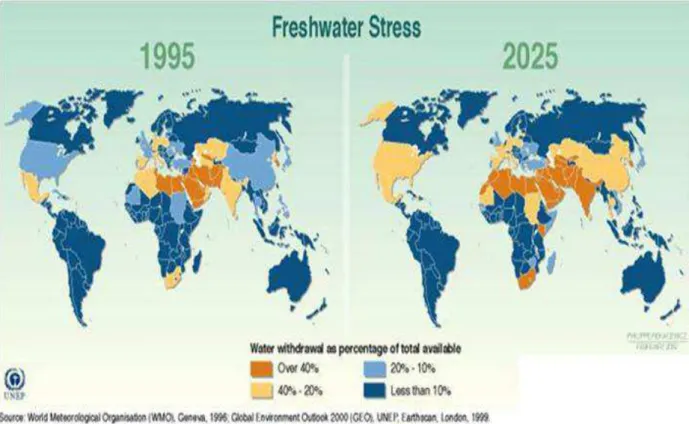
Figure 5 : Augmentation de la sécheresse mondiale (Philippe Rekacewicz (Le Monde diplomatique), Février 2006). La diminution de la disponibilité en eau potable est la plus marquée dans les zones colorées en orange foncé.
9
réchauffement climatique qui exacerbe la pénurie d’eau douce dans certaines régions de la planète (Figure 5).
Le secteur agricole est le premier consommateur d’eau douce de la planète et la sécheresse constitue à l’heure actuelle l’un des principaux facteurs de la diminution des rendements de grandes cultures. Un nouveau challenge de la recherche actuelle en biologie végétale est de produire des variétés de plantes à intérêt agronomique présentant une tolérance vis-à-vis du stress hydrique. L’élaboration de telles variétés implique une bonne connaissance des mécanismes biologiques intervenant dans la signalisation et la réponse à la contrainte hydrique (Harb et al. 2010).
Au niveau physiologique, le stress hydrique peut être généré par le manque d’eau au niveau des racines mais également par de fortes concentrations en sel dans le sol et les basses températures (Verslues et al. 2006). Ces trois stress ont en commun d’engendrer un stress osmotique qui va rompre l’homéostasie de l’eau de la plante. L’état hydrique des plantes est étroitement lié à celui du sol dans lequel leur système racinaire est installé. L’état hydrique du sol et de la plante peut être caractérisé par son potentiel hydrique. Le potentiel hydrique d’un compartiment est l’énergie qu’il faut appliquer à ce compartiment pour libérer 1g d’eau. Ce potentiel exprimé sous forme de pression est toujours négatif (potentiel hydrique de l’eau pure égal à 0) et est d’autant plus bas que la liaison entre l’eau et le compartiment est forte. Le mouvement de l’eau va du compartiment ayant le potentiel hydrique le moins négatif vers le compartiment avec le potentiel hydrique le plus négatif, et donc de la zone retenant le moins l’eau (la plus hydratée), à la zone retenant le plus l’eau (la moins hydratée). En condition de sécheresse, une diminution du potentiel hydrique du sol est donc constatée. Cette diminution du potentiel hydrique du sol est perçue au niveau de la plante par le compartiment racinaire. A partir de cette perception, la plante va mettre en place des modifications et réponses aux niveaux morphologique, physiologique, biochimique et moléculaire qui vont lui permettre de s’acclimater à la contrainte hydrique (Casal 2002, Davies and Zhang 1991).
1.4.1 Stratégies adaptative des plantes en réponse au stress hydrique
On distingue classiquement deux principales stratégies en réponse au déficit hydrique : l’évitement et la tolérance. Néanmoins, ces deux stratégies ne sont pas mutuellement exclusives et en pratique, les plantes vont combiner toute une série de réponses vis-à-vis du stress (Chaves et al. 2003).
10
L’évitement est la stratégie conduisant les plantes à effectuer leur cycle de vie très rapidement avant une période de sécheresse importante et régulière. C’est typiquement la stratégie d’adaptation utilisé par les plantes désertiques. Ces plantes vont combiner un cycle de vie très court, une vitesse de croissance très élevée et une utilisation des ressources optimisée lorsque les conditions d’humidité de l’environnement sont bonnes. C’est l’une des stratégies d’adaptation les plus efficaces vis-à-vis du stress hydrique, cependant le rendement potentiel des plantes s’en trouve très diminué.
La tolérance des plantes se traduit par le maintien des fonctions de la plante malgré le stress hydrique. Classiquement, la plante va mettre en place plusieurs mécanismes lui permettant de limiter ses pertes d’eau et d’augmenter son approvisionnement en eau, réduisant ainsi l’impact du stress hydrique sur sa physiologie. Pour ce faire, un ensemble de réponses au niveau morphologique, physiologique et moléculaire vont se mettre en place pour tenter de maintenir une certaine homéostasie de l’eau chez les plantes stressées (Bray 2004, Chaves et al. 2002). Nous ne prendrons pas en compte les adaptations morphologiques retrouvées chez de nombreuses espèces xérophytes.
1.4.2 Mécanismes de tolérance des plantes au déficit hydrique
1.4.2.1 Limitation des pertes d’eau Fermeture des stomates
Les stomates, situés sur l’épiderme des feuilles, ont pour rôle de permettre l’entrée dans les tissus du CO2, indispensable à la photosynthèse, et de laisser sortir l’eau sous forme de
vapeur (transpiration) et l’O2 produit par la photosynthèse. L’ouverture et la fermeture des
stomates doivent être très finement régulées afin d’assurer un approvisionnement suffisant en CO2 tout en s’adaptant à la disponibilité en eau de la plante. Ainsi, très rapidement après
l’application d’une contrainte hydrique, une fermeture des stomates va être observée (Chaves 1991, Schulze 1986). Elle va permettre de diminuer les pertes d’eau de la plante par transpiration, qui pourraient entrainer une déshydratation des cellules et des phénomènes de cavitation xylémienne. L’ouverture ou la fermeture des stomates résultent des changements de turgescence des cellules de garde par rapport aux cellules de l’épiderme. Cette réponse des plantes peut être déclenchée après une déshydratation perçue au niveau des feuilles ou des racines. Plusieurs auteurs ont en effet montré qu’un signal hormonal (acide abscissique) provenant des racines et transporté à longue distance jusqu’aux feuilles permettait la fermeture
11
des stomates (Davies and Zhang 1991, Gollan et al. 1992, Gowing et al. 1990) lors du déficit hydrique.
Limitation de la croissance des organes
La limitation de la croissance foliaire est un mécanisme adaptatif qui permet de réduire la surface de transpiration de la plante (Boyer 1970). La réduction de la vitesse de croissance fait intervenir plusieurs mécanismes : la division cellulaire va fortement décroitre (Tardieu et al.
2000), les parois cellulaires deviennent plus rigides, empêchant l’élongation cellulaire (Cosgrove 2005) et la turgescence cellulaire décroit (Bouchabké et al. 2006). Chacun de ces mécanismes met en jeu plusieurs familles de gènes dont la régulation est encore mal connue. Par conséquent, la compréhension de la signalétique des modifications de la croissance est complexe. Il est tout de même admis que la diminution de la croissance foliaire n’est pas que la conséquence d’un manque d’eau au niveau cellulaire, mais aussi la résultante de l’inhibition d’un certain nombre de gênes. Cette réponse rapide des plantes va permettre à plus ou moins long terme le maintien d’une certaine turgescence cellulaire (Tardieu et al.
2000).
1.4.2.2 Ralentissement de la photosynthèse et détoxication des AOS (Active Oxygen species)
L’un des résultats de la fermeture des stomates est la réduction de la disponibilité en CO2
pour la photosynthèse (Cornic 2000), conduisant à une diminution de la production d’assimilats. En fonction de l’intensité du stress hydrique, la production de sucres pourra ainsi être maintenue ou fortement diminuée. Parallèlement, l’arrêt de la croissance foliaire va, de facto, engendrer un arrêt de la consommation de ces derniers (Muller et al. 2011). Ces sucres vont alors s’accumuler dans les tissus où ils sont très probablement stockés dans les vacuoles ou sous forme d’amidon. L’accumulation de ces sucres solubles pourrait par ailleurs participer à l’ajustement osmotique des cellules (Clifford et al. 1998).
Le ralentissement de la photosynthèse va tout de même entrainer un déséquilibre entre la capture de l’énergie lumineuse et son utilisation et induire la production et l’accumulation d’espèces actives de l’oxygène (AOS), conduisant ainsi à un stress oxydatif. Dans le but de limiter le stress oxydatif plusieurs mécanismes de détoxication enzymatique et non-enzymatique des AOS vont être mis en place. Ainsi chez A. thaliana une induction de l’expression d’enzymes de détoxication des AOS comme la péroxidase, la superoxide dismutase, la catalase ou bien la glutathion réductase, a été mise en évidence en réponse à un
12
stress hydrique (Jung 2004). En parallèle, l’accumulation de pigments antioxydants tels que les anthocyanes va être observée (Chalker-Scott 1999).
1.4.2.3 Ajustement osmotique
L’ajustement osmotique est considéré comme l’un des processus cruciaux lors de l’acclimatation des plantes à la sécheresse (Morgan 1984). Il permet, lors d’un stress hydrique de faible intensité, de maintenir le potentiel hydrique des feuilles grâce à l’accumulation de solutés compatibles (sucres, acides aminés, ions). Cette accumulation va alors augmenter le potentiel osmotique des cellules afin de créer un influx d’eau, ou tout du moins éviter un efflux. Ceci permet un certain maintien de la quantité d’eau dans les cellules. Il semblerait aussi que l’accumulation d’osmolites permet la protection de l’intégrité des protéines et des membranes (Crowe et al. 1983, Rathinasabapathi 2000). Parmi les molécules organiques pour lesquelles il a clairement été établi un rôle d’osmoprotection en condition de stress hydrique, on peut citer la proline, la glycine-bétaïne et certains sucres comme les polyols, le saccharose et certains hexoses (Chaves et al. 2003 ; Taji et al. 2002).
De nombreuses études ont en effet mis en évidence l’implication des sucres comme osmoprotectants, la nature des sucres pouvant varier selon les espèces étudiées. Les travaux de Garcia et collaborateurs (1997) ont par exemple montré une accumulation de tréhalose en réponse à un stress salin chez le riz. D’autres études ont montré une accumulation de polyols comme le galactinol chez A. thaliana en réponse au déficit hydrique (Taji et al. 2002) ou bien le mannitol chez le céleri en réponse à un stress salin (Noiraud et al. 2001a). En ce qui concerne le saccharose, une forte accumulation de ce sucre a été mesurée chez Craterostigma plantagineum en réponse à un déficit hydrique (Bianchi et al. 1991). Cette accumulation serait d’ailleurs stimulée au niveau transcriptionnel par l’induction d’un gène codant une sucrose synthase (Kleines et al. 1999). La surexpression d’une sucrose synthase a aussi été montrée chez A. thaliana en réponse au déficit hydrique par Déjardin et collaborateurs (1999).Toujours chez A. thaliana, les travaux d’Hummel et collaborateurs (2010) ont montré l’accumulation de saccharose mais aussi d’hexoses dans les feuilles d’A. thaliana (écotype Col-0) en réponse à la contrainte hydrique. Ceci a également été confirmé par les travaux de Sperdouli et Moustakas (2012) qui montrent également une augmentation de proline.
Figure 6 : Vitesse d’élongation de la racine principale (ronds pleins) et des feuilles (triangles vides) sur des plantules de quatre espèces cultivées à plusieurs potentiels hydriques (Sharp et al. 2004).
13
1.4.2.4 Augmentation de l’approvisionnement en eau
En condition de stress hydrique, une des premières réponses des plantes est, comme nous avons pu le voir, de diminuer les pertes d’eau et de limiter les dommages engendrés au niveau cellulaire. Sur une longue période, d’autres mécanismes d’acclimatation vont permettre de maintenir l’approvisionnement de la plante en eau. Ces mécanismes vont être mis en place dans les racines. Dans un premier temps, un ajustement osmotique permettra de diminuer le potentiel hydrique des cellules, et ainsi d’attirer plus d’eau dans les tissus. Ce processus d’acclimatation a été mis en évidence dans les racines d’olivier par les travaux de Dichio et collaborateurs (2006). Leur étude a montré une diminution du potentiel osmotique de l’ordre de 0,54 MPa dans les racines des plantes soumises à un faible stress hydrique et une diminution de 1,67 MPa dans les racines des plantes soumises à un stress hydrique drastique. Cet ajustement osmotique serait en grande partie dû à l’accumulation de sucres solubles comme le sorbitol, le glucose ou le fructose (Ranney et al. 1991).
1.4.3 Réponse des racines au déficit hydrique
L’optimisation de l’absorption d’eau par les racines lors de la contrainte hydrique serait un paramètre majeur de la tolérance des plantes à la contrainte hydrique. De nombreuses plantes adaptées aux zones arides possèdent d’ailleurs un enracinement très profond leur permettant de prospecter les couches les plus profondes du sol.
Il est souvent admis qu’au cours d’un déficit hydrique, la croissance racinaire est beaucoup moins affectée que celle des parties aériennes (Saab et al. 1990, Sharp and Davies 1979). La Figure 6 montre en effet que la croissance de la racine principale de plusieurs espèce à intérêt agronomique continue à des potentiels hydriques du sol inférieurs à -1,5 MPa, alors que la croissance des feuilles est déjà complétement inhibée. Les études réalisées par Van de Weele et collaborateurs (2000) montrent même une stimulation de la croissance de la racine principale d’A. thaliana en réponse à un stress osmotique appliquée avec le PEG. Le maintien de la croissance racinaire permet l’absorption de l’eau dans de nouvelles zones du sol alors même que la transpiration au niveau des feuilles est stoppée. Ce phénomène permettrait de rétablir une certaine turgescence au niveau des cellules des racines et des feuilles permettant la conservation de leur fonction (Spollen and Sharp 1991).
Il semblerait toutefois que le déficit hydrique n’affecte pas toutes les zones de la racine de la même façon. Chez le maïs, dans de bonnes conditions d’irrigation, les cellules se divisent au niveau du méristème, et la zone d’’expansion maximale se situe vers 4,5 mm de l’apex et s’étend ensuite jusqu’à 12 mm de l’apex. En conditions de stress hydrique, la zone d’élongation
14
des cellules est limitée aux premiers mm au-dessus de l’apex (Sharp et al. 1988). De plus, la croissance radiale de ces cellules est également diminuée, conduisant à des racines plus fines en cas de stress hydrique. L’inhibition de la croissance au niveau de la zone d’élongation de la racine serait due à l’augmentation de la lignification des parois cellulaires diminuant ainsi l’extensibilité de ces dernières (Fan et al. 2006). Le développement de la racine principale n’est pas le seul impacté par la contrainte hydrique. Une étude réalisée par Deak et Malamy (2005) sur les racines d’A. thaliana a mis en évidence une réduction du nombre de racines latérales sur des plantules soumises à un stress osmotique. Leurs travaux ont permis de montrer que le stress osmotique réprime de façon très importante le développement des racines latérales à partir des primordiaux racinaires, pourtant bien présents sur la racine principale. Ces observations laissent penser que les plantules vont optimiser le développement de leur système racinaire en inhibant la prolifération des racines dans les régions du substrat ou la disponibilité est limitée. En revanche, le développement des primordium racinaires est maintenu permettant aux plantes de mettre en place rapidement de nouvelles racines latérales si l’eau redevient disponible.
Ces éléments indiquent donc que les plantes possèdent une grande capacité adaptative via l’architecture de leur système racinaire. Ce caractère est d’ailleurs un critère de sélection de choix en vue d’améliorer la productivité des plantes en conditions d’approvisionnement limité en eau ou en éléments minéraux, et certains n’hésitant pas à y voir la possibilité d’une seconde révolution verte (Gewin 2010).
1.4.4 Modification du transcriptome lors d’un stress hydrique
Le déficit hydrique va déclencher de nombreuses modifications dans l’expression des gènes contrôlant la mise en place des réponses adaptatives en partie décrites précédemment. L’étude de l’expression de ces gènes est nécessaire non seulement pour comprendre les voies de régulation de ces gènes, mais aussi pour mettre en évidence la fonction de ces gènes et les mécanismes de tolérance dans lesquelles ils peuvent être impliqués. Les études transcriptomiques réalisées par les techniques de microarray ont permis de classer les gènes dont l’expression est augmentée en deux catégories : ceux qui codent des protéines permettant de lutter contre les effets du stress (mise en place de l’ajustement osmotique, protection des protéines et structures cellulaires, détoxification) et ceux codant des protéines impliquées dans la régulation (Yamaguchi-Shinozaki and Shinozaki 2006).
15
Parmi les gènes permettant de limiter les dommages engendrés par le stress hydrique il est possible de trouver ceux codant des LEA (Late Embryogenesis Abundant). Ces protéines sont normalement exprimées dans les graines pendant les derniers stades de développement de ces dernières et permettant la tolérance à la dessiccation. Elles sont généralement de faible poids moléculaire et hydrophiles (Hundertmark and Hincha 2008). Bien que leurs fonctions physiologiques et biochimiques soient largement inconnues, il est couramment admis que ces protéines jouent un rôle crucial dans la tolérance des cellules à la déshydratation.
Une autre famille de gènes dont l’expression est très modifiée en condition de stress hydrique est celle codant des aquaporines. Ces protéines sont des canaux que l’on retrouve dans les membranes plasmiques des cellules et qui permettent de faire varier la perméabilité hydraulique de cette dernière (Kjellbom et al. 1999). Ces protéines ont sans aucun doute un rôle important dans l’homéostasie de l’eau dans la plante en condition de stress, (Alexandersson et al. 2005).
1.5 Objectifs de l’étude
Afin de mieux comprendre les flux de sucres chez A. thaliana, le laboratoire s’intéresse au
rôle des transporteurs de sucre dans les transferts de sucre entre organes de la plante, notamment lors de la contrainte hydrique. Des travaux préliminaires se sont principalement orientés sur l’expression des gènes de transporteurs de sucre dans les feuilles par la modification de leur expression lors d’un stress hydrique effectué par arrêt d’arrosage. Afin d’intégrer ces résultats au niveau de la plante entière, l’objectif de mes travaux de thèse est d’identifier les gènes de transporteurs de sucre exprimés dans la racine d’A. thaliana et de déterminer si leur expression est modifiée en réponse à la contrainte hydrique.
Le compartiment racinaire est par nature difficile à étudier. C’est pourtant un compartiment essentiel de la plante assurant l’approvisionnement en eau et en sels minéraux. Ces deux ressources sont d’ailleurs souvent les facteurs limitant de la productivité des plantes. Afin de pallier ces carences, l’agriculture fait aujourd’hui appel à l’utilisation massive d’intrants et une irrigation importante des plantes. Pourtant il est possible d’imaginer qu’une partie de ces carences pourrait être limitée en optimisant l’absorption de ces deux ressources par le système racinaire.
16
Les analyses de biochimie ou biologie moléculaire effectuées sur le compartiment racinaire nécessitent l’obtention de matériel végétal propre, complet (tous les types de racines doivent être présents) et, si possible, exempt de blessures liées à la récolte. La culture des plantes en terre ne répond pas à ces différents critères. Dans le but d’étudier les racines d’A. thaliana au laboratoire, il a été décidé de travailler sur des plantes cultivées en hydroponie. En effet, ce système de culture permet de s’affranchir de la terre : les racines récoltées sont propres et nécessitent un nombre minimal de manipulations pour leur récolte en vue d’analyses biochimique et moléculaire. Le matériel végétal peut être récolté en quantités relativement larges, contrairement à la culture en boite de Pétri sur milieu gélosé.
La première partie de mon travail de thèse a été de mettre en place un système de culture hydroponique. Une première analyse de l’expression des gènes de transporteurs de sucre dans les racines dans nos conditions de culture sera alors effectuée tout au long du développement de plantes et au cours d’un cycle de 24h. Le fait d’avoir accès à tous les organes de la plante nous a aussi permis d’effectuer une étude du transport à longue distance de saccharose radiomarqué des feuilles sources où il est produit vers les autres organes de la plante.
Dans un second temps, un protocole d’étude de la contrainte hydrique a été élaboré. Afin de mimer un stress hydrique en culture hydroponique, il est nécessaire d’utiliser un agent osmotique. Plusieurs agents osmotiques sont classiquement utilisés dans la littérature comme le mannitol, le sorbitol ou le polyéthylène glycol. Le PEG de haut poids moléculaire présente l’avantage de ne pas être absorbé par les tissus de la plante contrairement au mannitol et au sorbitol. De plus ces deux derniers agents osmotiques étant des sucres, ils peuvent influencer le métabolisme carboné de la plante et ainsi biaiser les études de transport de sucres à longue distance ainsi que les études d’expression des gènes de transporteurs de sucre. De plus, le stress osmotique induit par le PEG serait plus proche d’un stress hydrique obtenu par arrêt d’arrosage dans la terre (Verslues et al. 2006). Ces arguments nous ont donc conduit à utiliser le PEG 6000 dans nos expériences. La mise au point de ce protocole l’application du stress a été réalisée en vue de déterminer l’impact d’une contrainte osmotique sur la croissance des racines et des feuilles, sur l’expression des gènes de transporteurs de sucre, la répartition des sucres entre les feuilles et les racines et aussi sur le transport du saccharose dans la plante. Le but est de mieux comprendre comment la plante redistribue les sucres en cas de stress osmotique et d’identifier certains des acteurs moléculaires impliqués.
17
Figure 7 : Photographies du système de culture de plantes en hydroponie : (A) : photographie du système de culture en hydroponie composé d’un bloc et d’un bac-réservoir ; (B) : Photographie d’un bloc composé de 4 bacs Araponics reliés entre eux en série et notés I, II, III et IV.
18 2.1 Matériel végétal
L’ensemble des expérimentations a été réalisé sur la plante modèle Arabidopsis thaliana
(L.) Heynh (Brassicacées, Dicotylédone). Deux écotypes d’A. thaliana ont été utilisés, les écotypes Col-0 et C24.
Deux expérimentations ont été réalisées sur l’écotype C24. Cependant ces études devaient à l’origine être menées sur l’écotype Col-0. Une mauvaise annotation des tubes de graines stock a entraîné une inversion entre l’utilisation des graines de l’écotype Col-0 et les graines de l’écotype C24. Ces premières expérimentations ont tout de même permis la mise en place du système de culture des plantes en hydroponie (« Campagne mise en place hydroponie») ainsi qu’un premier essai d’application du stress osmotique sur cet écotype (« Essai stress C24 »). Par la suite, toutes les expérimentations portant sur l’étude de l’expression des gènes de transporteurs de sucre dans les racines d’A. thaliana, ont été réalisées sur l’écotype Col-0.
Les graines de l’écotype C24, Col-0 ont été fournies par le centre de ressources biologiques de l’INRA de Versailles.
2.2 Méthodes
L’étude du réseau racinaire et notamment les approches de physiologie moléculaire nécessitent de pouvoir travailler sur du matériel végétal non contaminé par la terre. Nous avons testé deux systèmes de cultures qui permettent de récolter les racines propres et intègres en grosse quantité : la culture hydroponique et la culture en rhizobox. La culture en hydroponie présente l’avantage de pouvoir obtenir une grande quantité de matériel végétal non souillé par la terre. La culture en rhizobox que nous avons mis en place au laboratoire, permet quant à elle, de cultiver les plantes en terre, de suivre le développement des racines sur 3 semaines, mais la production de matériel végétal (feuilles et racines) est plus limitée que pour la culture en hydroponie.
2.2.1 Mise en place du système de culture des plantes en hydroponie
Afin de mettre en place la culture hydroponique au laboratoire, nous avons choisi le système Araponics (Gardena micro-drie-system AP620A) développé par la société Araponics (Araponics SA, Liège). Nous disposons de 4 systèmes d’hydroponie, chacun étant composé d’un bloc relié à un bac-réservoir. Un bloc est composé de 4 bacs Araponics reliés entre eux en série. Les blocs sont reliés à des bac-réservoir contenant 15 litres de milieu de culture (Figure 7).
Figure 8 : Schéma représentant le circuit du milieu de culture réalisé dans le système d’hydroponie (bloc composé de 4 bacs hydroponie).
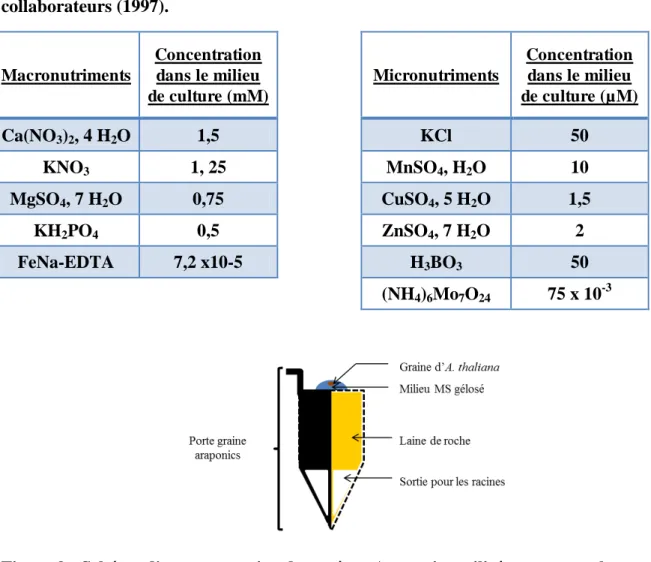
Tableau 1 : Composition du milieu de culture hydroponique utilisé, d’après Gibeaut et collaborateurs (1997). Macronutriments Concentration dans le milieu de culture (mM) Micronutriments Concentration dans le milieu de culture (µM) Ca(NO3)2, 4 H2O 1,5 KCl 50 KNO3 1, 25 MnSO4, H2O 10 MgSO4, 7 H2O 0,75 CuSO4, 5 H2O 1,5 KH2PO4 0,5 ZnSO4, 7 H2O 2 FeNa-EDTA 7,2 x10-5 H3BO3 50 (NH4)6Mo7O24 75 x 10-3
Figure 9 : Schéma d'un porte graine du système Araponics utilisé pour semer les graines d'Arabidopsis thaliana dans le système de culture en hydroponie.
19
Chaque bac Araponics contient environ 1,8 L de milieu de culture. Le milieu de culture est propulsé depuis le bac réservoir de 15 litres vers les 4 bacs Araponics (= 1 bloc) grâce à un système de pompe électrique (New-Jet 400 l/h, jusqu’à 70 cm de hauteur). La pompe d’aquarium propulse le milieu de culture contenu dans le bac réservoir posé au sol vers le premier bac (I) disposé sur une étagère du phytotron à une hauteur de 76 cm au-dessus du bac réservoir. Le milieu de culture s’écoule ensuite dans les trois autres bacs dans l’ordre II, III et IV puis il est, à la sortie du bac IV, à nouveau déversé dans le bac-réservoir (Figure 8). La circulation du milieu de culture dans le système de culture en hydroponie (bac-réservoir + bacs Araponics) permet une oxygénation de ce milieu. Certains auteurs ont montré que cette oxygénation pouvait être suffisante (Artéca et Artéca 2000). D’autres considèrent que pour éviter une trop grande hypoxie au niveau des racines, il est préférable de renforcer cette oxygénation du milieu de culture en ajoutant un bulleur d’aquarium dans le bac-réservoir (Gibeault, 1997). De plus, cette recommandation nous a été suggérée lors du premier comité de thèse aussi, pour l’expérimentation « Campagne réhydratation », nous avons ajouté dans les bac-réservoirs des bulleurs (Rena Air 100, 120 L/heure). Les systèmes de culture hydroponie ont été disposés dans un phytotron (PLASTEUROP SERRE.S-S.00.01).
Le milieu nutritif utilisé pour la culture des plantes est le milieu de culture utilisé par pour la culture d’A. thaliana par Gibeaut et collaborateurs (1997). La composition en macroélément et microéléments de ce milieu est reporté sur le Tableau 1. Le changement de milieu nutritif dans les bacs réservoirs est réalisé une fois par semaine afin d’éviter le développement de micro-organismes et l’épuisement de certains éléments du milieu, qui pourrait entrainer des carences. Les plantes sont placées dans le phytotron dans lequel les conditions de cultures sont contrôlées (photopériode 10h de jour/14h de nuit ; température de 23°C le jour et 18°C la nuit ; humidité relative de 50% le jour et 70% la nuit).
Chaque système d’hydroponie permet la culture de 72 plantes dont les graines sont semées individuellement (18 plantes x 4 bacs). Les graines sont déposées dans une goutte de milieu MS 1X (Murashige and Skoog 1962) gélosé (Agar 0,65%), elle-même déposée sur le porte graine rempli de laine de roche stérile (Figure 9).
Après deux semaines de culture, les racines des plantes placées les unes à côté des autres ont atteint une taille de 3 à 4 cm et peuvent commencer à se mêler. Afin de pouvoir récolter chaque plante individuellement, les racines sont séparées les unes des autres tous les jours dès qu’elles commencent à s’entremêler, en soulevant délicatement chaque plateau d’un bac
Figure 10 : Schéma du protocole expérimental appliqué pour la culture des plantes au cours de l’expérimentation « Campagne mise en place hydroponie ». Les 288 plantes de l’écotype C24 sont cultivées dans 4 systèmes d’hydroponie contenant du milieu nutritif pendant 39 jours. Une première récolte des plantes au stade jeune est réalisée après 20 jours de culture. Une seconde récolte est réalisée à la fin de l’expérimentation.