Modélisation des communautés benthiques dans la
région marine du Kitikmeot, Archipel Canadien
Mémoire
Philippe-Olivier Dumais
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Résumé
Les impacts des changements climatiques en Arctique sont de plus en plus présents et affectent davantage les écosystèmes marins. De plus, la fonte des glaces ouvre de nouvelles routes maritimes telles que le passage du Nord-Ouest dans la région marine du Kitikmeot. Ces problématiques croissantes soulèvent des préoccupations quant à l’état des organismes benthiques vivant dans cette région où peu d’études ont été menées. Les invertébrés benthiques sont primordiaux dans le recyclage des nutriments, l’oxygénation et la décomposition dans les sédiments et sont de très bons indicateurs de changement. Ce projet a comme objectif d’explorer et d’évaluer quels sont les paramètres environnementaux influents et de modéliser les assemblages d’espèces benthiques dans la région du Kitikmeot et le chenal de Parry dans l’Arctique canadien. Pour ce faire, plusieurs échantillons provenant d’un chalut Agassiz (épibenthos) et d’un carottier à boîte (endobenthos) ont été récoltés à bord du NGCC Amundsen de 2010 à 2018. En outre, 19 variables environnementales ont été considérées lors des analyses statistiques. Nous avons observé que l’endofaune est dominée par les annélides (principalement les polychètes) tandis que l’épifaune par les arthropodes. Les résultats démontrent aussi que les différents types de communautés benthiques se succèdent un après l’autre formant ainsi une zone de transition (écotone) entre la mer de Beaufort et la baie de Baffin. Les eaux qui ont comme origine l’océan Pacifique ont une influence majeure sur la distribution et la composition des communautés. Il en est de même pour les apports d’eaux douces d’origine terrestre. Ce sont deux paramètres qui sont actuellement de plus en plus présents en Arctique, ce qui laisse présager d’importants changements dans la distribution des communautés dans l’Archipel canadien central pour les années à venir. De plus, deux autres facteurs explicatifs de la composition taxonomique sont la profondeur et la concentration de pigments associés à la production primaire locale. Cette étude a aussi démontré que la profondeur, l’oxygène ainsi que le ratio N/P sont les paramètres ayant le plus d’influence sur le nombre de taxons retrouvé. Elle a aussi permis de modéliser la répartition de la diversité benthique pour la première fois dans l’Archipel canadien. De tels modèles peuvent ensuite servir dans une optique de gestion d’aires marines.
Mots clés : Communautés benthiques, Kitikmeot, Modélisation spatiale, Chenal de Parry, Facteurs environnementaux, Diversité
Abstract
The impacts of climate change in the Arctic are increasingly present and affect marine ecosystems. In addition, the associated sea ice melt opens up new shipping routes such as the Northwest Passage in the Kitikmeot marine region. These growing issues raise concerns about the state of benthic organisms living in this region where few studies have been carried out. Benthic invertebrates are essential in nutrient recycling, oxygenation and decomposition in sediments and are very good indicators of change. The objective of this project is to explore and assess the influential environmental parameters and model benthic species assemblage distributions in the Kitikmeot region and Parry Channel in the Canadian Arctic. For this, a number of samples from an Agassiz trawl (epifauna) and a box corer (infauna) were collected on board the CCGS Amundsen between 2010 and 2018. In addition, 19 environmental variables were considered for the statistical analyses. It was observed that infauna is dominated by annelids (mainly polychaetes) and epifauna by arthropods. The results also show that the different types of benthic communities succeed one another, thus forming a transition zone (ecotone) between the Beaufort Sea and Baffin Bay. Waters originating from the Pacific Ocean have a major influence on the distribution and composition of communities, as do freshwater inputs from land. These are two parameters whose volumes are currently increasing in the Arctic, which suggests significant changes in the distribution of communities in the central Canadian Archipelago for years to come. Moreover, two other significant factors explaining the taxonomic composition are the depth and the pigment concentrations associated with local primary production. This study also demonstrated that depth, oxygen and N/P ratio are the parameters having the most influence on the number of taxa found. Moreover, it is the first time the distribution of benthic diversity is modeled in the Canadian Archipelago. The models developed here can be used by decision makers for spatial marine management purposes.
Keywords: Benthic communities, Kitikmeot, Spatial modeling, Parry Channel, Environmental drivers, Diversity
Table des matières
Résumé ... ii
Abstract ... iii
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations ... ix
Remerciements ... x
Avant-propos ... xii
Introduction générale ... 1
1.1 L’étude du benthos en Arctique ... 1
1.1.1 Importance d’étudier la faune benthique Arctique ... 1
1.1.2 Relations entre l’environnement et la diversité benthique ... 2
1.2 Effet des changements climatiques sur les communautés benthiques arctiques ... 3
1.3 Impacts de la fonte des glaces sur le benthos via la production primaire ... 3
1.4 Augmentation des apports terrestres ... 5
1.5 Routes maritimes et espèces envahissantes ... 6
1.6 Problématique ... 7
1.6.1 Combler les lacunes ... 7
1.7 Ce que nous savons du Kitikmeot et du chenal de Parry ... 8
1.7.1 Océanographie ... 8
1.7.2 Benthos ... 10
1.8 Objectifs et hypothèses ... 11
Chapter 1 : Spatial modelling of benthic communities in the Kitikmeot sea region, Canadian Archipelago ... 12 Résumé ... 13 Abstract ... 14 Introduction ... 15 Methods ... 20 2.1 Study area ... 20 2.2 Sampling procedures ... 21 2.2.1 Infauna sampling ... 21 2.2.2 Epifauna sampling ... 21 2.2.3 Laboratory identification ... 22 2.3 Environmental parameters ... 22
Results ... 27
3.1 Infauna ... 27
3.1.1 Taxon richness and composition ... 27
3.1.2 Communities description and distribution ... 29
3.2 Epifauna ... 37
3.2.1 Taxon richness and composition ... 37
3.2.2 Communities description and distribution ... 39
3.3 Environmentally influenced diversity ... 45
3.3.1 Infauna ... 45
3.3.2 Epifauna ... 48
Discussion ... 51
4.1 Taxonomical observations ... 51
4.2 Environmental influence on assemblages ... 53
4.3 Diversity models ... 58
4.4 Model validity ... 59
Summary and Conclusion ... 60
Acknowledgements ... 61
Conclusion générale ... 62
Perspectives ... 65
Liste des tableaux
Table 1. Environmental parameters considered for the statistical analysis.
Table 2. Indicator species (5 first if available) of each benthic infauna community in the
Kitikmeot sea region and Parry Channel based on the IndVal Index.
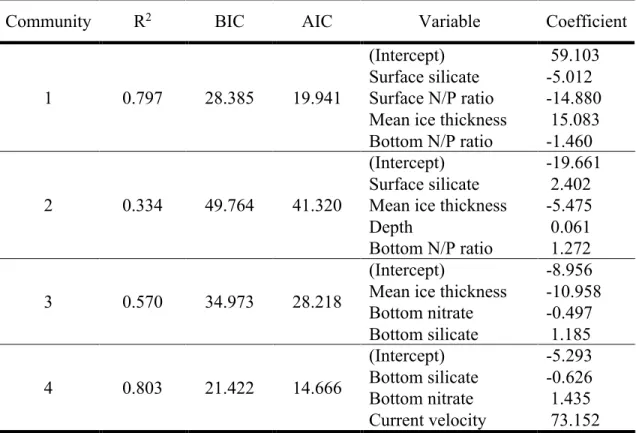
Table 3. Statistics of GLMs (R2, BIC, AIC, Coefficient of each variable) used to predict the
occurrence of infauna communities depending on environmental parameters selected by permutations to best fit.
Table 4. Indicator species (5 first if available) of each benthic epifauna community in the
Kitikmeot marine region and Parry Channel based on the IndVal Index.
Table 5. Statistics of GLMs (R2, BIC, AIC, Coefficient of each variable) used to predict the
occurrence of epifauna communities depending on environmental parameters selected by permutations to best fit.
Table 6. Statistics of GLMs (R2, BIC, AIC, Coefficient of each variable) used to predict
number of taxa of epifauna depending on environmental parameters selected by permutations to best fit.
Table 7. Statistics of GLMs (R2, BIC, AIC, Coefficient of each variable) used to predict
number of taxa of epifauna depending on environmental parameters selected by permutations to best fit.
Liste des figures
Figure 1. Carte de l’archipel canadien en Arctique, l’aire d’étude est illustrée en rouge.
Figure 2. Locations of epifauna, infauna and environmental variables sampling stations
from Parry Channel and Kitikmeot sea region.
Figure 3. Species accumulation curve of the number of infauna taxa identified against the
number of stations sampled (± Standard Deviation)
Figure 4. Infauna taxonomic composition : a) complete studied area, b) Parry Channel and
c) Kitikmeot sea region.
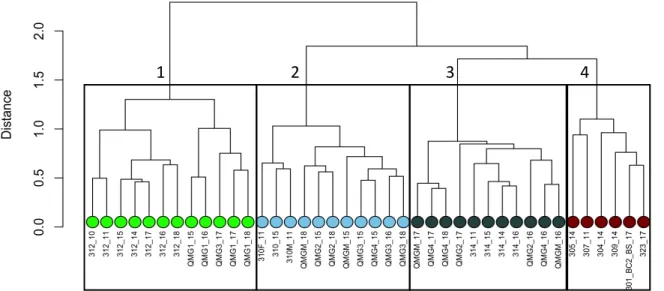
Figure 5. Infauna cluster tree (Bray-Curtis Distance) based on Bray-Curtis dissimilarity
matrix with transformed species biomass data. Green dots are the stations from the first community, pale blue dots are community 2, darkgray dots are community 3 and red dots are community 4.
Figure 6. Location of the 4 infauna communities across the Kitikmeot and Parry Channel.
Colors represent the communities determined at figure 5.
Figure 7. Redundancy analysis plot of the biomass Hellinger transformed 40 infaunal
stations sampled between 2010 and 2018 (p-value = 0.0001). Significant environmental variables were obtained using a two-step forward selection. Colors represent the community determined with a Bray-Curtis distance-based cluster analysis. Green dots are the stations from the first community, pale blues are community 2, darkgrays are community 3 and reds are community 4.
Figure 8. Habitat suitability of 4 infauna groups in the Kitikmeot and Parry Channel regions
obtained with GLMs. The scale from 0 to 1 represents the probability of occurrence of the community. The arrows show the proposed gradient of species assemblage from Dease Strait to Lancaster Sound.
Figure 9. Species accumulation curve of the number of epifauna taxa identified against the
number the of stations sampled (± standard deviation)
Figure 10. Epifauna taxonomic composition : a) complete studied area, b) Parry Channel
and c) Kitikmeot sea region.
Figure 11. Epifauna cluster tree based on Bray-Curtis dissimilarity matrix with transformed
species biomass data. Red dots are the stations from group 1, blue dots are group 2 and grey dots are group 3.
Figure 12. Location of the 3 epifauna communities across the Kitikmeot and Parry
Figure 13. Redundancy analysis plot of the biomass Hellinger transformed 50 epifaunal
stations sampled between 2010 and 2018 (p-value = 0.0001). Significant
environmental variables were obtained using a two-step forward selection. Colors represent the community determined with a Bray-Curtis distance-based cluster analysis. Red dots are the stations from community 1, pale blues are community 2 and darkgrays are community 3.
Figure 14. Habitat suitability of the 3 epifauna groups in the Kitikmeot and Parry Channel
regions obtained with GLMs. The scale from 0 to 1 represents the probability of occurrence of the community. The arrows show the proposed gradient of species assemblage from Dease Strait to Lancaster Sound.
Figure 15. Prediction of the number of infaunal taxa in Kitikmeot and Parry Channel
obtained with GLMs. The scale represents the number of infauna taxa predicted.
Figure 16. Regression plots of taxonomic richness of infauna against significant
environmental parameters in Kitikmeot and Parry Channel. Dot colors correspond to the community type.
Figure 17. Prediction of the number of epifaunal taxa in Kitikmeot and Parry Channel
obtained with GLMs. The scale represents the number of epifauna taxa predicted.
Figure 18. Regression plots of taxonomic richness of epifauna against significant
environmental parameters in Kitikmeot and Parry Channel. Dot colors correspond to the community type.
Liste des abréviations
GLM: Generalized Linear Model RDA: Redundancy Analysis
BIC: Bayesian Information Criterion AIC: Akaike Information Criterion QMG: Queen-Maud Gulf
Remerciements
Dans un premier temps, je tiens à remercier mon directeur de recherche Philippe
Archambault. Un immense merci Phil de m’avoir permis de réaliser mon rêve d’enfance de
devenir biologiste marin et de m’avoir confié un projet que je n’aurais jamais pu rêver de pouvoir mener un jour dans ma vie. De plus, tu as toujours été présent et disponible lorsque j’avais des questions ou des incompréhensions et ce, même si je ne pensais qu’à prendre 5 minutes de ton temps pour finalement discuter pendant plus de 45 minutes. Special thanks to my co-director Bodil Bluhm. Thank you Bodil for accepting to supervise my project despite we are not even living on the same continent. Your comments were more than welcome every time and your virtual presence really appreciated. Merci également à Frédéric Maps pour avoir accepté de faire partie de mon comité de mémoire et pour les commentaires lors de mes présentations.
Un merci immense à Laure de Montety et Lisa Treau de Coeli pour votre aide au laboratoire en identification. Sans vous, je n’aurais jamais été en mesure de réaliser tout ce travail. Votre bonne humeur me faisait apprécier davantage mes journées au laboratoire. Un merci spécial aussi à Marie-Hélène Picard pour avoir identifié quelques-uns de mes échantillons à l’été 2019. Mention spéciale à Cindy Grant pour m’avoir accompagné et montré comment travailler sur l’Amundsen. D’ailleurs, remerciements à tout l’équipage de
l’Amundsen pour ces deux voyages extraordinaires au beau milieu de l’Arctique et votre
bonne humeur même après six semaines avec peu d’heures de sommeil. Merci à tous les membres du laboratoire d’écologie benthique pour tous les moments passés ensemble à bien rigoler mais aussi pour l’aide, particulièrement concernant les statistiques (Valérie, Marie (pour m’avoir, entre autres, partagé ses scripts qui m’ont permis de mieux comprendre comment modéliser), Elliot, David, Charlotte, Gustavo, Fanny, Jési, Matthieu (pour avoir relu mon mémoire) et Laurie)!
Mention très spéciale à Lydia qui m’a supporté tout au long de mon baccalauréat et ma maitrise en plus de m’avoir accompagné en Norvège. Merci immense à mes boys (Karlo,
plus mémorables. Finalement, probablement le plus important des remerciements, un énorme merci à mes parents (Suzie et André) qui m’ont toujours supporté dans la voie de la science et ont cru en moi. Mention spéciale aussi à ma sœur (Laurence) qui, malgré la distance, me supportait via FaceTime.
J’aimerais aussi, par la présente, remercier Jean-Éric Tremblay et surtout Jonathan
Gagnon pour m’avoir fourni les données de Silicate, Nitrate, Nitrite et Phosphate ainsi que
de m’avoir fourni les renseignements sur l’obtention de ceux-ci. Ces données ont été un atout majeur pour répondre à mes hypothèses.
Merci à Flavienne Bruyant de Takuvik pour l’aide et avoir fourni le matériel pour les analyses de chlorophyll a.
Merci également à Donald Cayer pour tout le temps accordé afin de nous prêter, expliquer ou nous déboguer le granulomètre laser.
Merci à Marie-Claude Martin de nous avoir prêté son matériel et son local pour les analyses de matière organique.
Merci aussi à Pêches et Océans Canada pour m’avoir fourni les données de vélocité de courant au fond.
Merci également à Mariève Bouchard Marmen pour m’avoir fourni les images du fond marin prise dans Lancaster Sound, ce qui m’a permis de les utiliser pour valider (en partie) mes modèles de communautés.
Avant-propos
Ce projet de recherche fut tout d’abord une initiation à la recherche pour être ensuite converti en maitrise. Au départ, un projet portant sur la région marine du Kitikmeot et financé par la W. Garfield Weston Foundation et il est ensuite élargi en prenant en compte le chenal de Parry jusqu’à Lancaster Sound. Cette poursuite à la maitrise fut possible grâce au financement de ArcticNet, le Fonds de Recherche du Québec en Nature et Technologies (Bourse de maîtrise), le Conseil de Recherches en Sciences Naturelles et en Génie du Canada, Québec Océan et Takuvik. Il est aussi important de mentionner Institut Environnement, Développement et Société et le fond Marthe-et-Robert-Ménard pour l’octroi de bourses de recherche à la maitrise. Cette étude sera également soumise à des revues scientifiques afin d’être publiée au courant de l’hiver 2021. Je (Philippe-Olivier Dumais) suis le premier auteur et les co-auteurs de cette étude sont Philippe Archambault (directeur de recherche), Bodil Bluhm (Co-directrice), Lisa Treau de Coeli, Laure de Montety ainsi que Cindy Grant. Elle est composée d’un seul chapitre : « Chapter 1 : Modelling benthic communities in the Kitikmeot sea region, Canadian Archipelago, Arctic ».
Les données utilisées furent échantillonnées dans le cadre de divers projets de 2010 à 2019 à du Navire de la Garde Côtière Canadienne Amundsen. La plupart des données furent échantillonnées par l’équipe du laboratoire d’écologie benthique de Philippe Archambault et quelques données environnementales par l’équipe du laboratoire de Jean-Éric Tremblay de l’Université Laval.
Ce projet a été présenté 9 fois dans diverses conférences au Canada de 2018 à 2020. La plupart de ces conférences sont celles normalement fréquentées par les membres de Québec-Océan et ArcticNet.
• Dumais, P.-O., Archambault, P., Bluhm, B., Grant, C., de Montety, L., Treau de Coeli, L., (2020) Modelling benthic communities in the Kitikmeot area, Canadian Archipelago, Arctic, ArcticChange, Virtual Edition, Canada, December 7-10, 2020.
Oral Presentation
Archipelago, Arctic, Québec Océan Annual Meeting, Mont-Ste-Anne, Québec, Canada, March 9-11, 2020. Poster
• Dumais, P.-O., Archambault, P., Bluhm, B., Grant, C., de Montety, L., Treau de Coeli, L., (2019) Modelling benthic communities in the Kitikmeot area, Canadian Archipelago, Arctic, ArcticNet Meeting, Halifax, Nova Scotia, Canada, December 2-5, 2019. Poster
• Dumais, P.-O., Archambault, P., Grant, C., de Montety, L., Treau de Coeli, L., (2019) Modelling benthic communities in the Kitikmeot area, Canadian
Archipelago, Arctic, Forum Québécois des Sciences de la Mer, Rimouski, Québec, Canada, November 11-13, 2019. Poster
• Dumais, P.-O., Archambault, P., Grant, C., de Montety, L., Treau de Coeli, L., (2019) Modelling benthic communities based on environmental drivers in the Kitikmeot area, Canadian Archipelago, Arctic, Journée de la recherche en Sciences et Génie, Québec, Qc, Canada, October 4, 2019. Poster
• Dumais, P.-O., Archambault, P., Grant, C., de Montety, L., Treau de Coeli, L., (2018) Evaluation of river water influence on the Kitikmeot megabenthos
communities and spatio-temporal modelization based on environmental drivers in the Canadian Arctic, ArcticNet Meeting, Ottawa, Ontario, Canada, December 10-14, 2018. Poster
• Dumais, P.-O., Archambault, P., Grant, C., de Montety, L., Treau de Coeli, L., (2018) Évaluation et modélisation de la biodiversité mégabenthique dans la région de Kitikmeot (Archipel Canadien) en fonction de paramètres environnementaux, Québec-Océan Annual Meeting, Rivière-du-Loup, Québec, Canada, November 5-6, 2018. Poster
• Dumais, P.-O., Archambault, P., Grant, C., de Montety, L., Treau de Coeli, L., (2018) Évaluation de la biodiversité mégabenthique dans la région de Kitikmeot (Archipel Canadien) en fonction de paramètres environnementaux, Journée de la recherche en Science et Génie, Université Laval, Québec, Canada, September 21, 2018. Poster
• Dumais, P.-O., Archambault, P., Grant, C., de Montety, L., Treau de Coeli, L., (2018) Benthic communities and their influential environmental parameters in the Kitikmeot area, Canadian Archipelago, Arctic, World Conference on Marine Biodiversity, Montréal, Canada, May 13-16, 2018. Poster
Introduction générale
1.1 L’étude du benthos en Arctique
1.1.1 Importance d’étudier la faune benthique Arctique
Les invertébrés marins forment le taxon le plus représenté en Arctique avec plus de 5000 espèces recensées (Payer et al. 2013). De ces 5000 espèces, 90% sont considérées comme étant benthiques (Meltofte et al. 2013). Les espèces benthiques constituent donc la majorité des invertébrés présents en Arctique et, par conséquent, une composante importante du réseau trophique et de la diversité. Elles sont des maillons essentiels pour les niveaux trophiques supérieurs comme les mammifères qui se nourrissent près de la surface des sédiments, tel les phoques et les morses (Bluhm et Gradinger 2008, Darnis et al. 2012). Les espèces benthiques contribuent aux cycles biogéochimiques et particulièrement le cycle du carbone (Klages et al. 2004). Elles sont impliquées dans la pompe biologique, ce qui inclus l’anti-pompe à carbonate de calcium ainsi que la pompe à carbone organique. La première fait référence aux activités de calcification (séquestration du carbone) des organismes tels que les gastéropodes, les bivalves et les anthozoaires. La seconde correspond plutôt au recyclage de la matière organique via la reminéralisation du carbone. Les organismes benthiques reminéralisent la matière organique et relâchent ensuite des nutriments inorganiques. Ceci affecte chaque cycle biogéochimiques et les flux d’oxygène (Link et al. 2013a).
Certaines espèces endofauniques sont des espèces dites ingénieures de par leurs activités bioturbatrices. Cela implique qu’ils modifient l’accessibilité aux ressources pour les autres espèces (Lawton et Jones 1995). En fait, elles oxygènent et mélangent la matière organique dans les couches de sédiments plus profondes. Cette activité biologique et physique peut alors affecter les communautés de substrat meuble, spécialement dans les régions côtières (Petrowski et al. 2016).
Finalement, les espèces benthiques peuvent être utilisées comme indicatrices de changement dans un environnement où des modifications majeures sont attendues dans les prochaines années. La composition des communautés benthiques peut être utilisée comme indicatrice de perturbations spécifiques ou cumulatives, comme Borja et al (2000) ont démontré avec l’indice marin biotique. La variabilité de la distribution des espèces peut aussi révéler des impacts passées ou à venir dans un environnement marin, en plus d’indiquer si l’état écologique actuel tend à progresser ou décliner (Niemi et McDonald 2004). De plus, cela peut mettre de l’avant un problème inconnu ou sous-estimé. Par exemple, la substitution d’espèces plus grandes par des espèces de plus petite taille peut être un signe de dégradation de l’habitat (Levin et al. 2009). Considérant les prédictions de réchauffement du milieu polaire, les espèces arctiques peuvent être d’excellentes indicatrices de ce changement. En effet, la majorité de ces espèces sont sténothermes, c’est-à-dire qu’elles ne tolèrent que de faibles fluctuations de température (Burgass et al. 2018).
1.1.2 Relations entre l’environnement et la diversité benthique
Plusieurs études ont été menées concernant les effets des facteurs environnementaux sur la composition et la diversité des communautés benthiques marines. Globalement, le gradient de biodiversité terrestre et marine est négatif vers les latitudes plus élevées (Hillebrand 2004). Toutefois, lorsque certaines régions sont comparées les unes aux autres, cette tendance ne s’applique pas nécessairement. Par exemple, la mer de Barents est plus diversifiée, d’un point de vue benthique, que certaines régions dans l’océan Atlantique (Gray et Elliott 2009). Ceci peut être expliqué par les variations environnementales régionales. Un seul paramètre environnemental peut parfois expliquer la diversité benthique mais, la plupart de temps, il y a co-dépendance entre plus d’un paramètre. C’est d’ailleurs le cas de la profondeur qui fait varier la salinité, le type de sédiment (Thomson 1982) et d’autres paramètres.
Les producteurs primaires, surtout les algues de glaces, constituent la source principale de nourriture pour les organismes benthiques (Horner et Schrader 1982) bien que leur production ne soit pas constante tout a long de l’année; une plus grande production mène à une diversité plus élevée en Arctique (Link 2012, Roy et al. 2014). Par conséquent, il est plausible d’affirmer que ce paramètre environnemental est l’un des plus influents pour la
composition des communautés benthiques. Néanmoins, Makela et al. (2017) proposent que le benthos tende simplement à se nourrir de ce qui est disponible et que les taxons dominants sont ceux qui démontrent le plus de souplesse dans leur alimentation. De plus, la production primaire peut être co-dépendante du couvert de glace estival dans les régions polaires (Ardyna et al. 2011). Au final, c’est l’intégration de plusieurs facteurs environnementaux qui influence la distribution, la composition des communautés et la diversité de la faune benthique marine.
1.2 Effet des changements climatiques sur les communautés benthiques arctiques
Les écosystèmes arctiques font face à des perturbations grandissantes pour la plupart anthropogéniques (Piepenburg 2005, Gill et al. 2011, Frederiksen 2017). Une de celles-ci est le changement climatique qui affecte substantiellement la température de surface et du fond des eaux marines à un taux deux fois plus élevé qu’observé ailleurs autour du globe (AMAP 2017). Une conséquence majeure est que le couvert de glace estival diminue chaque année (National Snow and Ice Data Center 2020). Cette diminution de la glace a des impacts directs et indirects sur le biote marin (Wassmann et al. 2011, Post et al. 2013). En outre, le GIEC estime que les pires répercussions de la hausse de température globale de 1,5˚C se feront sentir sur les écosystèmes arctiques (Intergovernmental Panel on Climate Change 2018). Des changements drastiques de températures peuvent avoir des impacts négatifs sur les espèces benthiques indigènes qui ne peuvent pas s’adapter rapidement (Clarke 1990, Jørgensen et al. 2019).
1.3 Impacts de la fonte des glaces sur le benthos via la production primaire
Un des effets majeurs de la diminution du couvert de glace est la modification du cycle de la productivité primaire. En Arctique, la plupart de la production primaire est attribuable aux algues de glaces et au phytoplancton (Horner et Schrader 1982). Plus précisément, la glace marine est un habitat pour les algues de glace ainsi que le sous-phytoplancton qui contribuent pour 57% de la production primaire dans l’ensemble de l’Arctique (Gosselin et al. 1997, Post et al. 2013). Les algues de glace peuvent nourrir une grande variété d’organismes durant
elles constituent une source majeure de nourriture exportée vers le fond au bénéfice des communautés benthiques (Gosselin et al. 1997).
La diminution de la surface du couvert de glace favorise la pénétration de la lumière à travers la colonne d’eau et bénéficie à la prolifération du phytoplancton au lieu des algues de glaces (Arrigo et al. 2008, Ardyna et al. 2011). La quantité de nourriture reçue par les communautés benthiques est alors plus petite et de moindre qualité nutritionnelle (Wassmann et Reigstad 2011). Les modèles de Carroll et Carroll (2003) et Wassmann et Reigstad (2011) prédisent une altération du couplage pélago-benthique où les interactions phytoplancton-zooplancton vont augmenter au dépend des interactions algues de glace-benthos. L’amincissement de la glace allonge la période de production primaire et donne plus de temps aux brouteurs pour consommer le phytoplancton et les algues de glaces. Ainsi, parce que la matière organique est maintenue en circulation dans la colonne d’eau, moins de matières photosynthétiques serait exportées jusqu’aux sédiments pour les communautés benthiques. Toutefois, le modèle de Rysgaard et Glud (2007) spécifie qu’il y a un délai dans la réponse des brouteurs et donc qu’une petite partie des microalgues aurait le temps d’être exportée. De plus, de telles modifications dans le couplage pélago-benthique seraient attribuables à des changements à l’échelle locale du couvert et de l’épaisseur de la glace (Olivier et al. 2020). Ultimement, la périodicité et l’épaisseur du couvert de glace sont les forces majeures qui régulent la productivité primaire (Wassmann et al. 2004, Grebmeier et al. 2006), laquelle est une composante fondamentale du réseau trophique Arctique, et elles sont en changements. Néanmoins, il y a certaines régions où le couvert de glace est peu présent même en hiver. C’est le cas des polynies. Selon les modèles expliqués précédemment, il est attendu que les communautés benthiques ne seront pas nécessairement influencées positivement par l’augmentation de la production primaire en surface en raison de l’excès de zooplancton brouteur. Certaines polynies telles que la Polynie des Eaux du Nord ne témoignent pas du même phénomène. Dans cette polynie, la concentration de zooplancton est relativement faible et la biomasse benthique y est plus élevée (Ardyna et al. 2011, Roy et al. 2014), probablement en raison de l’exportation importante de matière organique.
Au final, l’impact de la diminution du couvert de glace sur la production primaire semble différer selon les régions, mais les modèles proposés peuvent servir de référentiel pour interpréter nos observations benthiques.
1.4 Augmentation des apports terrestres
L’Arctique reçoit plus de 10% des apports fluviaux mondiaux (Opsahl et al. 1999). Le réchauffement de l’Arctique affecte la géologie et les écosystèmes terrestres. Plusieurs rivières se déversent dans l’océan Arctique et certains cours d’eau partent de latitudes relativement basses telles que 46˚ Nord en Russie. Considérant l’apport énorme d’eau douce dans l’océan Arctique, la variabilité temporelle de celui-ci est une préoccupation importante pour le bilan en eau douce. À long terme, cette variabilité peut même affecter le climat planétaire (Lewis et al. 2012) et potentiellement les communautés benthiques. Les ruissellements d’eau terrigènes contribuent significativement au bilan d’eau douce (Carmack 2000) et ont augmenté dans les années passées dans l’Arctique canadien (Déry et al. 2009, Holmes et al. 2012, AMAP 2017). Les experts pensent que la cause principale de ces changements est le résultat de l’intensification des précipitations induite par le réchauffement global (Stuefer et al. 2017). Cette tendance n’est pas unique à l’Arctique Nord-Américain. Elle est aussi observée du côté eurasien (McClelland et al. 2006, Déry et al. 2009). Toutefois, cette réponse aux changements climatiques du côté canadien est assez récente comparativement au côté eurasien (McClelland et al. 2006, Zhang et al. 2021) et influence la formation des eaux profondes dans l’Atlantique Nord (Rennermalm et al. 2006). Lorsque l’on s’intéresse à l’accroissement des apports fluviaux sur les côtes canadiennes, il est aussi possible d’observer que c’est dans la région du Kitikmeot (principalement le golfe Queen-Maud) que l’augmentation prédite est la plus élevée (Bring et al. 2017).
L’eau riveraine qui se décharge en excès dans l’environnement marin arctique peut contenir des composants terrigènes tels que de la matière organique terrigène, de nutriments et des ions. Certains de ces éléments sont introduits dans les rivières en raison de la fonte du pergélisol.
Les matières organiques terrigène et marine ont toutes deux des propriétés différentes qui permettent aux scientifiques de les distinguer. Bell et al. (2016) ont démontré que dans la mer de Beaufort près de la rivière Mackenzie où il y a un apport élevé en matière organique terrigène, le réseau trophique y est plus long et le couplage pélago-benthique est réduit. Ce résultat contredit alors l’idée que cette source de matière organique a une qualité nutritive inférieure pour les organismes marins (Schell 1983, Dunton et al. 2012).
Évidemment, davantage d’apports riverains veulent dire plus d’eau douce dans le milieu marin. Cela influence la salinité de l’environnement et a un impact direct sur la diversité benthique marine, surtout aux endroits où la contribution en eau douce est important (Cusson et al. 2007, Witman et al. 2008). Ces endroits avec une salinité intermédiaire sont souvent non viables pour certaines espèces d’invertébrés marins qui ne peuvent s’y adapter (Remane et Schlieper 1971).
1.5 Routes maritimes et espèces envahissantes
La fonte du couvert de glace peut aussi contribuer à ouvrir de nouvelles routes maritimes. En se basant sur le taux de fonte de la glace, certaines simulations prédisent que le passage du Nord-Ouest (passant au milieu de la région à l’étude) et d’autres routes à travers l’archipel canadien seront complètement accessibles au mois de septembre pour la plupart des classes de navires d’ici le milieu du siècle (Smith et Stephenson 2013, Haas et Howell 2015). Les navires peuvent transporter des espèces exotiques originaires du port de départ. Elles peuvent être attachées à la coque ou n’importe quelle autre partie du navire ou bien encore dans les eaux de ballasts. L’encrassement biologique de la coque est considéré comme le vecteur principal d’introduction d’espèces exotiques à travers le monde (Chan et al. 2012) et pour lequel les risques sont peu connus (Drake et Lodge 2007). Au final, les espèces envahissantes sont la perturbation anthropique la moins réversible (Mooney et Cleland 2001, Lassuy et al. 2013).
L’achalandage maritime grandissant et les changements climatiques favorisent donc l’introduction d’espèces envahissantes en Arctique dans les années à venir (Goldsmit et al.
2018, Goldsmit et al. 2019, Goldsmit et al. 2020). La propagation des espèces non-indigènes est l’une des menaces écologiques les plus graves (IMO 2004). Non seulement ces espèces peuvent être problématiques pour les écosystèmes mais aussi pour l’économie. En fait, plus de 5% de l’économie mondiale annuelle est perdue à cause des impacts négatifs occasionnés par les espèces exotiques introduites par l’humain (Pimentel 2014).
1.6 Problématique
Les changements actuels et prédits dans l’environnement arctique soulèvent le problème qu’il y a un manque de données et de compréhension de ces écosystèmes. Malgré les diverses expéditions menées au courant des dernières années, il y a encore des lacunes de connaissances. En effet, le nombre d’espèces est sous-estimé (Wassmann et al. 2004, Archambault et al. 2010, Piepenburg et al. 2011, Roy et al. 2015b, Wei et al. 2020). Plusieurs études ont démontré que le nombre de taxons découverts est en relation positive avec le nombre de stations échantillonnées (Jones et al. 2007, Gray et Elliott 2009, Bluhm et al. 2011, Piepenburg et al. 2011, Roy et al. 2014).
1.6.1 Combler les lacunes
Afin de combler le manque de données entre deux stations échantillonnées, nous pouvons soit augmenter l’effort d’échantillonnage ou prédire la distribution des communautés. Une façon de prédire la présence d’une communauté à un endroit est d’utiliser la modélisation spatiale basée sur les paramètres environnementaux. Puisque ces paramètres peuvent être observés par imageries satellites, il est possible de modéliser les assemblages de communautés sur de larges territoires et des endroits difficiles d’accès. Normalement, les gradients environnementaux contrôlent la distribution des espèces à l’échelle régionale (100 – 1000 m2) tandis qu’à l’échelle locale (1-10 m2) ce sont principalement la compétition, la
prédation et les perturbations physiques (Levin et al. 2001). Dans le cas présent, nous sommes intéressés à la variabilité régionale. C’est alors que de comprendre comment les paramètres abiotiques influencent la distribution des espèces peut être utile pour combler les lacunes spatiales dans des régions où il est possible de retrouver des points chauds de biodiversité ou même des zones menacées (McArthur et al. 2010, McHenry et al. 2017, Saeedi et al. 2017).
Par la suite, ces modèles spatiaux peuvent être utilisés à des fins de conservation. Ils peuvent donc servir à mieux informer afin de mieux protéger les écosystèmes arctiques face aux risques grandissants pour la biodiversité qui ont été décrits plus haut. Dans une optique de conservation, il est mieux de cibler et protéger les endroits où la diversité y est plus élevée (Soulé et Sanjayan 1998, Myers et al. 2000). Bien que de tels modèles soient souvent utilisés dans la création d’aires marines protégées, ils s’avèrent aussi fort utiles pour tout autre types de gestion du territoire (Selig et al. 2014).
1.7 Ce que nous savons du Kitikmeot et du chenal de Parry
1.7.1 Océanographie
Tout d’abord, la région marine du Kitikmeot se trouve au centre de l’archipel canadien. L’ensemble des côtes l’entourant appartiennent au territoire du Nunavut au Canada. Par la suite, l’aire d’étude se poursuit au nord du Kitikmeot jusqu’au détroit de Lancaster à l’entrée de la baie de Baffin (Figure 1). Dans l’ensemble l’archipel canadien est assez peu profond. En effet, 70% de l’archipel fait moins de 500 mètres de profond (McLaughlin et al. 2006). C’est alors que l’ensemble des stations échantillonnées font partie de la zone mésopélagique et se trouve sur le plateau continental. Toutefois, le golfe Queen-Maud, où près de la moitié des échantillons ont été recueillis, ne fait que 20 à 75 mètres de profondeur et reçoit l’eau de plusieurs rivières telles que les rivières Simpson, Perry, Pitok et Armack (Carmack et McLaughlin 2011).
Figure 1. Carte de l’archipel canadien en Arctique, l’aire d’étude est illustrée en rouge.
L’archipel canadien dans l’ensemble reçoit d’importantes quantités d’eau de l’océan Pacifique par le détroit de Béring et se rend jusqu’au nord de l’océan Atlantique (Carmack et al. 1997, Kliem et Greenberg 2003). Ce mouvement des eaux de l’Ouest vers l’Est est expliqué par le fait que le niveau du Pacifique est plus élevé de 0,15 mètre par rapport à l’Atlantique (Stigebrandt 1984). Les eaux du Pacifique sont moins salées que celles de l’océan Arctique ou Atlantique. De façon générale, les eaux moins denses du Pacifique se trouvent donc plus en surface tandis que celles plus denses de l’Atlantique sont en profondeur. L’influence du Pacifique est si forte qu’au détroit de Lancaster (à l’est de l’aire d’étude), la majorité de l’eau qui y passe est d’origine Pacifique (Jones et al. 2003). Néanmoins ces eaux se retrouvent surtout en surface et due à son emplacement à l’entrée de la mer de Baffin, c’est un des endroits les plus influencés par l’Atlantique (McLaughlin et al. 2006). En plus de la salinité, l’eau du Pacifique qui arrive dans l’archipel canadien a des propriétés différentes de l’eau retrouvée en Arctique marin ou encore dans l’océan Atlantique. L’eau du Pacifique est dépourvue de nitrate. Lorsqu’on y compare la concentration de phosphate, il y est possible d’observer un ratio N/P plus faible que dans
retracer les eaux Pacifique à travers l’archipel canadien (Yamamoto-Kawai et al. 2006, McLaughlin et al. 2009, Tremblay 2016). En raison de la hausse des températures de la surface des océans et la fonte de glaces, l’apport du Pacifique dans l’Arctique est en augmentation (Shimada et al. 2006, Woodgate et al. 2010) et risque de s’accentuer dans les années à venir (Woodgate 2018). De plus, globalement, l’archipel canadien est un système oligotrophe (Ardyna et al. 2011).
Un phénomène observé dans l’aire d’étude est le brassage par les marées. Les endroits fortement touchés par ce type de brassage sont souvent dénudés de glace en hiver et forment donc des polynies (Polyakov et Martin 2000) en plus d’avoir une distribution modifiée de la salinité (Holloway et Proshutinsky 2007). D’un point de vu benthique, il est possible d’y observer davantage d’algues de glace en profondeur en raison du mélange vertical (Dalman et al. 2019) et des communautés différentes qu’ailleurs. Par exemple, on y retrouve plus d’espèces suspensivores en raison de la présence de courants plus forts (Fredriksen 2018). Évidemment ces polynies ont des répercussions notables sur la production biologique locale. Bien que les brassages par les marées peuvent être observés un peu partout dans l’archipel canadien (Michel et al. 2015), il semble particulièrement présent dans la région du Kitikmeot. En effet, cette région est peu profonde et comporte plusieurs détroits et autres passages étroits (Williams et al. 2019).
1.7.2 Benthos
Bien que peu d’études furent menées concernant les communautés benthiques infratidales, quelques informations sont disponibles à propos des communautés benthiques du Kitikmeot et du chenal de Perry. Tout d’abord, Roy et al. (2015) ont trouvé que les échantillons recueillis dans la partie ouest de l’archipel canadien (essentiellement Kitikmeot) ont en moyenne un indice de diversité de Shannon-Wiener supérieur aux autres régions de l’Arctique canadien. D’autres analyses menées par Grant et al. (en préparation) ont également démontré les mêmes résultats. Par la suite, d’autres résultats obtenus avec des échantillons du détroit de Dease, du golfe Queen-Maud et du détroit de Victoria proposent qu’il y ait un gradient ouest-est dans la composition des communautés possiblement influencé par les eaux de l’océan Pacifique (Dumais et al. 2018).
1.8 Objectifs et hypothèses
L’objectif de cette étude est d’évaluer la composition benthique et de développer des modèles de distributions spatiales des communautés benthiques dans le Passage du Nord-Ouest, soit la région de Kitikmeot et du chenal de Parry dans l’archipel canadien. Dans un premier temps, il s’agit d’évaluer la composition benthique (macrofaune endobenthique et épibenthique) et comment elle varie en fonction des paramètres environnementaux influents. Par la suite, il s’agit de créer des modèles visant à prédire spatialement l’emplacement des communautés benthiques à travers l’aire d’étude.
Les hypothèses sont les suivantes :
H1. La distribution spatiale et la composition taxonomique de la faune benthique suivent un gradient de l’Ouest vers l’Est et forment un écotone entre la baie de Baffin et la mer de Beaufort.
H2. L’influence des eaux de l’océan Pacifique à travers l’archipel canadien explique en partie ce gradient ouest-est.
H3. La matière terrigène explique significativement la composition des communautés benthiques dans la région du Kitikmeot.
Chapter 1 : Spatial modelling of benthic communities in the
Kitikmeot sea region, Canadian Archipelago
Chapitre 1 : Modélisation spatiale des communautés benthiques dans la région
marine de Kitikmeot, Archipel canadien
Résumé
En Arctique, la diminution du couvert de glace a déjà transformé les sources dominantes et la périodicité de la production primaire à quelques endroits. Cela soulève donc des préoccupations quant à l’effet des changements climatiques sur les communautés benthiques. Les invertébrés benthiques jouent un rôle important dans le recyclage des nutriments, l’oxygénation et la décomposition dans les sédiments et sont de très bons indicateurs de changement. Toutefois, la faune benthique de l’Archipel canadien est très peu étudiée comparativement aux autres régions de l’Arctique. Ce projet a comme objectif d’évaluer la composition benthique en se basant sur les paramètres environnementaux influents et d’ensuite développer des modèles spatiaux prédictifs des communautés pour étendre la couverture spatiale entre les stations échantillonnées à travers la région marine du Kitikmeot et du chenal de Parry. Les résultats obtenus à partir d’échantillons précédemment récoltés proposent que la diversité y soit plus élevée comparativement à la baie de Baffin et la mer de Beaufort, les deux régions adjacentes respectivement à l’Est et à l’Ouest. Cela nous mène à l’hypothèse principale que (1) la distribution spatiale et la composition des communautés benthiques diffèrent en suivant un gradient de l’Ouest vers l’Est formant ainsi un écotone entre la mer de Beaufort et la baie de Baffin. L’hypothèse suivante est que (2) l’influence des eaux de l’océan Pacifique à travers l’Archipel canadien peut expliquer, en partie, ce gradient. La troisième hypothèse est que (3) la matière terrigène affecte la distribution des espèces. Les résultats démontrent que les trois hypothèses sont confirmées. Les modèles GLMs (avec
des R2 allant jusqu’à 0,80) démontrent clairement un patron de distribution des communautés
partant du golfe Queen-Maud jusqu’à Lancaster Sound. De tels modèles peuvent s’avérer utiles pour cibler de potentiels hotspots de diversité et aussi pour d’éventuels plans de gestion d’aire marines. De plus, des analyses de redondances démontrent que les eaux de l’océan Pacifique (retracées avec les proportions de nitrate par rapport au phosphate) ainsi que la matière terrigène (retracée avec les concentrations en silicate) ont une influence sur la distribution des assemblages benthiques. Il est suggéré que ces deux facteurs influant tendent à augmenter de plus en plus en Arctique. Par conséquent, leurs impacts risquent d’être encore plus important dans les années à venir.
Abstract
In the Arctic, sea ice loss has already transformed the dominant sources and periodicity of primary production in some areas, raising concerns over impacts of climate change on benthic communities. Benthic invertebrates play important roles in nutrient cycling, sediment oxygenation and decomposition and are very good indicators of changes. Nevertheless, the Canadian Archipelago is poorly studied compared to other Arctic regions. This project aims to evaluate benthic composition and its relationship to significant environmental drivers and then develop spatial predictive explanatory models of benthic communities to expand coverage between sampled stations across the Kitikmeot sea region and Parry Channel. Results from previously collected samples suggest that diversity is higher in that area compared to the Beaufort and Baffin Seas, the two adjacent regions on the West and East respectively. That finding leads to the main hypothesis that (1) spatial distribution and community composition of benthic fauna differ spatially following a West-East gradient forming an ecotone (transition area) between the Beaufort Sea and the Baffin Sea. Other hypotheses are that (2) Pacific Ocean water influence through the Canadian Archipelago can explain part of this gradient, and that (3) terrigenous matter affects the distribution of species. Results showed that all hypotheses are confirmed. Generalized Linear Models (GLMs) (with
R2 up to 0.80) clearly displayed a pattern of community distribution from Queen-Maud Gulf
in the southwest to Lancaster Sound in the northeast. Such models can be useful to target potential biodiversity hotspots and as a baseline for eventual marine spatial planning purposes. Moreover, Redundancy Analysis (RDA) demonstrated that Pacific Origin water (traced with concentrations of nitrate relative to phosphate) and terrigenous matter (traced with silicate concentrations) have an influence on the species and communities distribution. It is proven that these two influencing factors tend to be increasingly present in the Canadian Arctic. Hence, they might have even more impact on benthic communities in the upcoming years.
Introduction
Marine invertebrates are, quantitatively, the most represented taxa of the animal kingdom in the Arctic (Payer et al. 2013) and 90% of those are benthic species (Meltofte et al. 2013). Because of their abundance, they are an important component or Arctic food web and biodiversity. Moreover, they are linked to higher trophic levels that feed at the seafloor (Bluhm and Gradinger 2008, Darnis et al. 2012). Benthic species are also contributing to biogeochemical cycles and mainly the carbon cycle (Klages et al. 2004). Benthic species contribute to remineralizing organic matter and then releasing inorganic nutrients. This affects every biogeochemical cycle and oxygen fluxes (Link et al. 2013a, Bourgeois et al. 2017). Some infauna species are bioturbators. Hence, they contribute to the oxygenation of deeper sediment layers and promote a higher diversity (Lawton and Jones 1995, Petrowski et al. 2016). Benthic species can often be used as indicators of changes in an environment. The species’ distribution variability can inform about previous impacts in the marine environment and whether current ecological states tend to improve or decline (Borja et al. 2000, Niemi and McDonald 2004).
Arctic ecosystems are facing growing anthropogenic disturbances (Piepenburg 2005, Gill et al. 2011). Climate change is one of them and affects sea temperature at twice the rate observed around the globe (AMAP 2017, Pörtner et al. 2019). The summer sea ice cover has been decreasing since at least 1979 (National Snow and Ice Data Center 2020) and this decline has direct and indirect impacts on marine organisms (Wassmann et al. 2011, Post et al. 2013). Such temperature changes can have negative impacts on indigenous species and has created potential habitat for exotic species (Clarke 1990, Goldsmit et al. 2018, Goldsmit et al. 2020). Higher temperature also causes ice thinning that increases light penetration, which favors phytoplankton proliferation over ice algae (Arrigo et al. 2008, Ardyna et al. 2011). Ice algae can feed a wide variety of pelagic and benthic organisms during the ice-covered season when food is limited (Gosselin et al. 1997, Bluhm et al. 2016, Kohlbach et al. 2016). Carroll & Carroll (2003) and Piepenburg et al (1997) predicted a shift from tight pelagic-benthic coupling to strong phytoplankton-zooplankton interactions. Hence, in a changing Arctic, benthic organisms would receive food of lower nutritional quality and in
smaller quantity. However, Olivier et al (2020) propose that this change is not always observed everywhere and depends on smaller and local scale processes.
Sea ice melting also opens new navigational routes. Based on melting rate, some simulations predict the North West Passage and other routes through the Canadian Archipelago, to be fully accessible in September for any class of ships by mid-century (Smith and Stephenson 2013, Haas and Howell 2015, Melia et al. 2016). Shipping expansion can contribute in facilitating transportation and adaptation of hull biofouling species (Chan et al. 2012) and even increase the risk of introducing invasive species by more national vessels (Goldsmit et al. 2019). In the end, invasive species introduction ranks among the most irreversible of anthropogenic disturbances (Mooney and Cleland 2001, Lassuy et al. 2013).
Moreover, the Arctic Ocean receives more than 10% of global river discharges (Opsahl et al. 1999). River runoff contributes significantly to the freshwater budget (Carmack 2000, Prowse et al. 2015) and has increased in the past decades (Déry et al. 2009, Holmes et al. 2012, AMAP 2017). River water flowing into the Arctic marine environment may contain terrigenous components such as terrestrial organic matter, nutrients and ions. Some of those elements introduced into rivers are due to permafrost thaw. Subsequently, ion concentrations such as silicate and phosphate will increase in Arctic rivers. It is also important to mark that those ion concentrations differ spatially and depending on permafrost degrading rate (Frey and McClelland 2009).
The current and predicted undergoing changes in the Arctic environment are raising the problem that there is a lack of data and understanding of certain regions and ecosystems. This knowledge gap is rather large in the Kitikmeot sea region, and for benthic biodiversity in general (Wassmann et al. 2004, Archambault et al. 2010, Piepenburg et al. 2011, Roy et al. 2015b) which still increases logarithmically related to the number of sampled stations (Jones et al. 2007, Gray and Elliott 2009, Bluhm et al. 2011, Piepenburg et al. 2011, Roy et al. 2014). To fill spatial gaps, we can increase sampling effort and try to predict community distributions. One way of predicting community distribution is spatial modelling based on environmental drivers. Since some of these drivers (e.g. temperature, salinity, ice cover) can be observed by satellite imagery, it is possible to model community assemblages on large
spatial scales and difficult to access locations. Environmental gradients tend to control communities on regional scales (≳1 km2), while on a local scale (~1-10 m2) it is mainly
competition, predation and physical disturbances that tend to control communities (Levin et al. 2001). In our case, we are interested on regional variability. Hence, understanding how abiotic drivers influence species distributions may be useful for filling spatial gaps of biodiversity hotspots and valuable habitat (McArthur et al. 2010, McHenry et al. 2017, Saeedi et al. 2017). In addition, we need to consider the codependence and interaction of certain drivers.
The results from those spatial models can be used for conservation purposes and thus contribute to coping with increasing risks for biodiversity described previously. In a conservation perspective, it is better to target and protect areas where diversity is higher (Soulé and Sanjayan 1998, Myers et al. 2000). The combination of models revealing biodiversity hotspots and highly impacted by anthropogenic activities areas makes it easier to target potential conservation areas or simply useful for any other spatial planning applications (Selig et al. 2014).
Although there is a lack of biodiversity data in the Canadian Arctic Archipelago, we do have environmental data that could support prediction in the area. The Canadian Arctic is quite shallow in much of the area of interest, e.g. Queen-Maud Gulf (QMG) is no deeper than 75 meters and surrounded by many rivers (Carmack and McLaughlin 2011). Moreover, the Canadian Arctic receives substantial quantities of Pacific Ocean origin water that enters through Bering Strait and flows toward Baffin Bay (Carmack et al. 1997, Kliem and Greenberg 2003). Pacific Ocean origin water has lower salinity than found in the Atlantic Ocean. Generally, less dense Pacific Water is found in the upper layer while Atlantic Water is below (Granger et al. 2018). Pacific Ocean influence is so strong in the Canadian Archipelago that even in Lancaster Sound, most of the surface water is of Pacific origin (Jones et al. 2003). Because of its location at the entry of Baffin Bay, this area is, however, the most influenced by the Atlantic Ocean (McLaughlin et al. 2006). In addition to its low salinity, Pacific Water that enters the Canadian Arctic is nitrate depleted, resulting in lower nitrate:phosphate ratios than Atlantic Ocean water (Yamamoto-Kawai et al. 2006,
ice cover decrease, Pacific water inputs are currently increasing (Shimada et al. 2006, Woodgate et al. 2010) and are projected to increase substantially more in the upcoming years (Woodgate 2018).
Tidal currents are also present in the studied area. Locations that are mostly affected by the resulting mixing are often depleted of ice cover and form polynyas (Polyakov and Martin 2000). From a benthic point of view, it is possible to observe more ice algae on the sea bottom because of vertical mixing (Dalman et al. 2019), as well as different benthic community types. For instance, there are more filter feeders species due to the presence of stronger currents (Fredriksen 2018). Inferring from other well studied polynyas, the presence of these tidally-driven polynyas likely has repercussions on local biological production. Tidal currents can be observed at many locations across the Canadian Archipelago (Hannah et al. 2009, Michel et al. 2015), but are particularly strong in parts of the Kitikmeot sea region. Indeed, this region is quite shallow and has many narrow straits (Williams et al. 2019). Few research projects have been conducted on the subtidal benthic communities, but some information about benthic communities of Kitikmeot and Parry Channel is still available. Foremost, Roy et al. (2015) and Balsom et al (2003) found out that epifauna samples collected in the West portion of the Archipelago (essentially Kitikmeot) have a higher Shannon-Wiener diversity index compared to neighboring areas. Further analysis was performed by Grant et al. (In redaction) and suggested the same pattern.
The main objective of this study is to evaluate benthic infauna and epifauna composition and predict their distribution in the Kitikmeot sea region and Parry Channel. Specifically, we first evaluated benthic composition and its relationship to relevant environmental factors. Secondly, the goal is to create models to predict spatially different benthic communities across the studied area. The first research hypothesis tested is that spatial distribution and community composition of benthic fauna differ following a West-East gradient, forming a transitional area (ecotone) between Baffin Bay and Beaufort Sea where diversity is higher. The second hypothesis is that the decreasing Pacific Ocean water influence through the Canadian Archipelago can explain part of this gradient. The third hypothesis is that
terrigenous matter transported into the region by numerous rivers also plays an important role in the Kitikmeot benthic community composition.
Methods
2.1 Study area
The studied area can be divided into two main parts, the first one is Parry Channel which is located in the middle of the Canadian Archipelago. The considered portion extends from Lancaster Sound to Viscount Melville Sound. The second part is the Kitikmeot marine region which is located in the Northern part of Nunavut and in the Southern part of the Canadian Archipelago. Compared to Kitikmeot, Parry Channel is quite deep (from 500 m to 700 m) except around Barrow Strait which is near to Resolute Bay and is a bit shallower (200 m to 400 m). The Kitikmeot region includes the Queen-Maud Gulf as well as the M’Clintock Channel and Peel Sound northward. Our area of interest for this study is especially Queen-Maud Gulf (where most of our samples were taken), Victoria Strait, M’Clintock Channel and part of Parry Channel towards Lancaster Sound. Queen-Maud Gulf is 20-75 meters deep. It is connected to Coronation Gulf by the shallow Dease Strait (~40 meters deep) (Carmack and McLaughlin 2011) and many rivers are discharging in it. Queen-Maud Gulf receives inflows from the Simpson, Perry and Pitok rivers and a few others (Brown et al. 2020).
Figure 2. Locations of epifauna, infauna and environmental variable sampling stations
from Parry Channel and Kitikmeot sea region.
Victoria Island Nunavut Baffin Island Parry Channel Kitikmeot Prince-of-Wales Island Lancaster Sound Viscount Melville Sound Dease Strait Canada Queen-Maud Gulf Peel Sound M ’Cl into ck Ch anne l Victoria Strait Perry river Pitok river Simpson river Barrow Strait
In total 55 different locations were sampled across this area. Generally, infauna and epifauna were sampled at the same location. However, there are few stations where only infauna was sampled and others where only epifauna was sampled (Fig. 2). For each station, benthic organisms and environmental data were sampled.
2.2 Sampling procedures
Infauna and epifauna are treated separately. Infauna are the organisms found inside the sediment and epifauna are the ones living on the sediment surface. They were collected between August and September from 2009 to 2018 onboard the Canadian research ice breaker CCGS Amundsen. Moreover, this study focuses only on subtidal species and more precisely on communities living deeper than 30 meters. Only the macrobenthic (> 500μm) invertebrates were studied.
2.2.1 Infauna sampling
Infauna was sampled with a Reineck box corer (50 cm x 50 cm). Sediments from half of the box surface (25 cm x 50 cm) and contained within the upper 10 cm were collected. Sediments were sieved on a 0.5 cm mesh size. Remaining sediments and organisms were conserved in a seawater and formaldehyde solution (4%) buffered with sodium tetraethylborate. Samples were sieved and sorted in the lab after each mission.
2.2.2 Epifauna sampling
Epifauna was sampled using a single haul per station of an Agassiz trawl, measuring 1.5 m wide, with a 1.5 cm net mesh size and 5 mm cod end. Once at the bottom of the sea, the trawl was dragged for 3 minutes at a speed of approximately 1.5 knots. Trawl contents were thereafter sieved on a 2 cm mesh size and then sorted to keep only the organisms. Trawl content was subsampled if the number of individuals was judged excessive. The fraction depended on the size of the sample but was duly noted to adjust abundance and biomass measures. Larger specimens were identified on the ship and the others preserved as the infauna.
2.2.3 Laboratory identification
Infauna and epifauna samples were washed of the formaldehyde solution. Then infauna samples were sieved on a 500 μm sieve and epifauna samples were sieved on a 2 mm sieve. Washed and sieved organisms were then sorted under a dissecting microscope. Specimens are identified to the lowest possible taxonomic level based on morphological criteria. Experienced taxonomists validated the identifications of less common specimens. However, nematodes were not identified to the species and identification were kept at phylum level, and foraminifera were not considered. Afterward, their biomass was measured on a ± 0.0001g precision scale. Taxonomic identifications were verified on the database World Register of Marine Species (WORMS).
2.3 Environmental parameters
Temperature, salinity, depth and oxygen were obtained with a CTD Seabird Scientific profiler (SBE911 Plus). For the nitrate, nitrite, phosphate and silicate values, water samples were collected by the shipboard Seabird Scientific SBE-32 Niskin bottles and filtered through filter paper (GF 0.7 µm). Professionals onboard used the method of Grasshoff (2009) to measure concentrations of NO2-, NO3- + NO2-, PO43- and Si(OH)4 (Martin et al. 2010) by
colorimetric determination., using a Bran and Luebbe Autoanalyzer 3.
The bottom water velocity was obtained using the updated version of Ocean-Navigator (Hernandez 2007) and mean ice thickness was extracted from Bio-Oracle and estimated from 2000 to 2016 (Tyberghein et al. 2012, Assis et al. 2018). For the last 7 parameters, the box core-collected sediments were analyzed in the laboratory. The grain size proportions were determined by laser diffraction (Horiba LA-960 particle size analyzer) in a specialized laboratory at the Faculté de foresterie, de géographie et de géomatique, at Université Laval, Québec, QC. The grain dimensions were classified using the Gradistat classification (Blott and Pye 2001). As for the organic matter, we burned the sediment at 450°C to obtain the dry mass proportion of organic content (Byers et al. 1978). Pigment concentrations in sediment were retrieved using acetone extraction followed by fluorometric analysis (Riaux-Gobin and Klein 1993). The N/P ratio used to trace back Pacific origin water that is nitrate depleted (Yamamoto-Kawai et al. 2006, McLaughlin et al. 2009, Tremblay 2016) is simply the result
of nitrate concentration against phosphate concentration. Our samples were collected during the summer and because of higher primary production during that period nitrate values tend to be very low or null so the N* index can be used as a complement. The latter is calculated using the following equation:
N*=[DIN]-(16 x [phosphate]), where [DIN] = (nitrite + nitrate + ammonium)
This equation is an adaptation of the method used by Gruber and Sarmiento (1997). The phosphate is multiplied by 16 because of the Redfield ratio where there is normally 16 times more nitrogen than phosphate in a marine environment (Redfield 1963).
Table 1. Environmental parameters considered for the statistical analysis.
Environmental parameter Unit
Bottom water temperature °C
Bottom water salinity PSU
Water Depth m
Bottom water Oxygen concentration mL×L-1
Bottom and Surface water N/P ratio -
Bottom and Surface water N* index -
Bottom and Surface Nitrate (NO3-) µmol×L-1
Bottom and Surface Nitrite (NO2-) µmol×L-1
Bottom and Surface Phosphate (PO4-) µmol×L-1
Bottom and Surface Silicate (SiO2-) µmol×L-1
Bottom water velocity m×s-1
Mean Ice Thickness m
Gravel % Sand % Mud % Organic Matter % Chlorophyll a µg×g-1 Phaeopigments µg×g-1 Total pigments µg×g-1
2.4 Statistical analysis
Statistical analysis presented below was performed on infaunal and epifaunal data separately. All statistical analyses were performed on the free access software R, version 3.6. (R Core Team 2020). Except for the functions from the base package, most of the important statistical functions are from the Vegan package (Oksanen et al. 2018).
To observe how much taxa are still to be discovered in the study area, we created an accumulation curve (Magurran 1988, Ugland et al. 2003) by plotting the number of taxa against the number of sampled stations using Kindt’s method (Kindt et al. 2008). A steep slope on the curve means that there are still species left to discover. Then, we used Chao and Lee (1992)’s method by analyzing the frequency of frequencies to estimate the number of species in the study area. We sorted how many taxa were observed 1 time, 2 times, etc. Then applied the Chao and Lee’s equation of taxa richness.
A cluster tree analysis based on a Bray-Curtis dissimilarity matrix was performed on biomass data which were transformed using the Hellinger method (Legendre and Gallagher 2001) before creating the matrix. Afterwards, species that are the most representative of each community were described, considering the grouping communities. This was achieved by performing the indicator value index (IndVal) (Dufrêne and Legendre 1997). Values of IndVal are ranged between 0 to 100%. A value of 100% means that the species is encountered exclusively in that group and at every stations.
To answer the second and third hypotheses, a redundancy analysis (RDA) was performed to determine which environmental parameters have a significant influence on the differences between communities. Faunal biomass data was transformed using the Hellinger method and environmental data were transformed with the standardize method of the vegan package (Oksanen et al. 2018). Such transformations are used to reduce the effect of outlier values. Selected environmental variables that are significantly related to the biomass was performed via a two-step process with a forward selection. P-value was set at 0.05. Only significantly influential variables were used to build a scaling “1” graphical representation where the distance between each community represents the Euclidian distance and the arrow represents the influential drivers. The length of the arrow is related to the influence strength. Because