© Carolane Audette, 2019
Interaction entre le nématode à kyste (Heterodera
glycines) et Phytophthora sojae chez le soya
Mémoire
Carolane Audette
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Interaction entre le nématode à kyste (Heterodera
glycines) et Phytophthora sojae chez le soya.
Mémoire
Carolane Audette
Sous la direction de :
Richard Bélanger, directeur de recherche
et
iii
RÉSUMÉ
Le nématode à kyste du soya (NKS), Heterodera glycines, est la principale
cause de pertes économiques chez le soya aux États-Unis. Au Canada, on
le retrouve en Ontario depuis 1988 et il continue à gagner du terrain
chaque année. Il a été répertorié pour la première fois au Québec en 2013,
et les producteurs de soya québécois ont déjà commencé à déployer des
outils pour sa répression. La méthode de lutte la plus utilisée contre cet
organisme est l’utilisation de gènes de résistance quantitative combiné à la
rotation des cultures. Par contre, l’organisme causant le plus de
dommages chez le soya à l’heure actuelle au Québec est la pourriture
phytophthoréenne, causée par l’oomycète, Phytophthora sojae. Cette
maladie racinaire peut, elle aussi, être réprimée grâce à des cultivars
génétiquement résistants (résistance qualitative à gènes Rps). Sachant que
le NKS se retrouve déjà dans certaines régions du Québec où sévit
également P. sojae, il devient urgent de déterminer si les cultivars de soya
présentement utilisés exprimeront une résistance satisfaisante contre ces
agents pathogènes majeurs. Dans ce contexte, l’objectif principal de ce
projet était d’évaluer l’interaction entre ces deux agents pathogènes du
soya en fonction de la résistance (qualitative à gènes Rps / résistance
quantitative au NKS) des cultivars utilisés. L’étude, réalisée en système
hydroponique, a permis de démontrer qu’en présence
d’un cultivar sensible
aux deux organismes, P. sojae a un impact négatif sur la capacité du NKS
à produire des kystes. Cela suggère que P. sojae pourrait influencer le
développement du NKS. La présence du nématode, quant à elle, n’a pas
influencé l’efficacité de la résistance qualitative à gènes Rps contre
P. sojae. En conséquence, les cultivars résistants aux deux agents
pathogènes représentent une bonne option pour prévenir et lutter contre
ces affections.
iv
ABSTRACT
The soybean cyst nematode (SCN), Heterodera glycines, is the leading cause of economic losses in soybean in the United States. In Canada, it has been found in Ontario in 1988 and continues to spread every year. It was identified for the first time in Quebec in 2013 and soybean growers have already begun to deploy management tools. The most commonly used control method against SCN is the use of quantitative resistance genes and crop rotation. However, the most damaging organism in soybean in Quebec currently is Phytophthora root rot, caused by Phytophthora sojae. This root disease can also be controlled by genetically resistant cultivars (qualitative resistance with Rps genes). Because SCN is now present in regions struggling with P. sojae, it is important to determine if the cultivars will express sufficient resistance against these two major pathogens. In this context, the main objective of this project was to evaluate the interaction between these two organisms on soybean, according to the resistance (qualitative Rps genes/ or quantitative resistance to SCN) of the cultivars used. This study, in a hydroponic system, demonstrated that P. sojae has a negative impact on SCN capacity to produce cysts produced. This suggests that P. sojae might influence SCN development. On the other hand, resistant cultivars were not affected by the presence of both pathogens and the presence of the nematode did not influence the efficacy of qualitative Rps resistance gene against P. sojae. As a result, cultivars resistant to both pathogens are a good option for preventing and controlling these diseases.
v
TABLE DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... iv
LISTE DES TABLEAUX ... vii
LISTE DES FIGURES ... viii
REMERCIEMENTS ... ix
AVANT-PROPOS ... xi
INTRODUCTION ... 1
CHAPITRE 1 : REVUE DE LITTÉRATURE ... 4
1.1 La plante hôte : Glycine max L. Merr. ... 4
1.2 Organismes phytopathogènes du soya en Amérique du Nord ... 5
1.2.1 La pourriture Phytophthoréenne causée par Phytophthora sojae
... 5Cycle d’infection ... 6
Symptômes et méthodes de lutte ... 7
1.2.2 Le nématode à kyste du soya
... 8Cycle d’infection ... 9
Symptômes et méthodes de lutte ... 10
1.3 La relation hôte-parasite ... 11
1.3.1 Mécanismes de défense des plantes
... 121.3.2 La résistance
... 12Défense du soya contre le nématode à kyste du soya (NKS) ... 13
Défense du soya contre la pourriture phytophthoréenne ... 15
1.4 Complexes pathogènes ... 16
1.4.1 Interactions en présence du nématode à kyste du soya
... 161.4.2 Interaction NKS et P. sojae
... 17HYPOTHÈSE ET OBJECTIFS ... 18
CHAPITRE 2: MANUSCRIT ... 19
Résumé
... 21Abstract
... 22Introduction
... 23vi
Materials and Methods
... 24Plant Material ... 24
Nematode culture ... 25
P. sojae culture ... 25
Hydroponic system ... 26
Experimental design, observed data and statistical analysis ... 26
Results ... 27
P. sojae and SCN virulence profile validation ... 27
P. sojae virulence in presence of SCN. ... 28
SCN virulence in presence of P. sojae. ... 29
Discussion ... 31
Acknowledgements
... 33Literature cited ... 34
CHAPITRE 3 : CONCLUSIONS GÉNÉRALES ... 37
vii
LISTE DES TABLEAUX
CHAPITRE 1
Tableau 1 : Lignées parentales pour la classification des HG Type des diverses populations
génétiques d'Heterodera glycines. (Niblack et al. 2002) ... 13
Tableau 2: Table de classification des pathotypes (races) de Phytophthora sojae ainsi que leur
profil de virulences (pathotypes de virulence associés) ... 15
CHAPITRE 2
Table 1. Virulence profiles of the soybean cyst nematode and Phytophthora sojae isolates selected
for this study. ... 28
viii
LISTE DES FIGURES
CHAPITRE 1
Figure 1 : Superficies ensemencées en soya et en maïs grain au Québec de 1986 à 2017
(Institut de la statistique du Québec 2017). ... 5
Figure 2 : Cycle d'infection de Phytophthora sojae. ... 7
Figure 3 : Cycle d’infection du nématode à kyste du soya, Heterodera glycines. ... 9
CHAPITRE 2
Figure 1. Phenotypic response of soybean plants at 10 dpi following Phytophthora sojae
inoculation on 10-days-old plants on A) the resistant cultivar L89-1581 (HARO6272)
and B) the susceptible cultivar P90Y90. ... 28
Figure 2. Mortality incidence (percentage of dead plants) of soybean plants at 10 dpi following
Phytophthora sojae inoculation on 5-day-old plants on different cultivars infected or not
with soybean cyst nematode (SCN). S: Susceptible check (P90Y90), RP.s.: resistant to
P. sojae (HARO6272), RH.g. resistant to Heterodera glycines (P19T01R), RP.s&H.g.
resistant to P. sojae and H. glycines (S10S1). ... 29
Figure 3. Female index of soybean cyst nematode (SCN) in presence or absence of
Phytophthora sojae when inoculated at two different phenological stages, A) 5-day-old,
and B) 10-day-old plants on four cultivars with different resistance genes; S: Susceptible
check (P90Y90), RP.s.: resistant to P. sojae (HARO6272), RH.g. resistant to Heterodera
glycines (P19T01R), RP.s&H.g. resistant to P. sojae and H. glycines (S10S1). Bars represent
standard error from the mean and asterix (*) significant differences based on Tukey test
at α = 0.01. ... 30
ix
REMERCIEMENTS
D’abord, je tiens à remercier Benjamin Mimee, mon co-directeur, de
m’avoir tranquillement convaincue de faire la maîtrise. Malgré ma
réticence, tu avais raison; le sentiment d’accomplissement que je ressens
aujourd’hui me le prouve pleinement. Merci aussi pour le soutien, les bons
conseils et pour la confiance que tu m’as accordée.
Pour Richard Bélanger, merci de nous avoir dirigés vers l’essentiel
Benjamin et moi qui, parfois, tentions de faire trois maîtrises à la fois!
Merci pour les conseils, la limpidité des explications et pour tout le temps
accordé malgré la distance et l’agenda chargé. Merci aussi à Amandine et
Caroline de l’équipe de Richard qui ont si bien répondu à mes milliers de
questions et qui ont aidé dans le projet.
Éléonore, merci d’avoir cogité avec moi lorsque j’étais dans le doute, pour
le soutien et l’écoute que tu sais si bien apporter et pour tout ce que tu as
eu la patience de me m’apprendre.
À mes fidèles compagnons de labo : Guillaume, Sandra, Anne-Fred, Lydia,
Mona, P-Y, Nathalie et Michael, merci d’avoir partagé vos connaissances et
aussi d’avoir lâché votre fou avec moi, le plaisir est une si belle façon de se
motiver et de garder le moral!
Un merci spécial aussi à l’équipe du CÉROM qui m’a tant appris et fait
confiance : Geneviève, Alexis et Jennifer, ainsi que Sylvie Rioux pour le
support et l’apport au projet. Sans oublier Annie-Ève qui est la
responsable d’une grosse partie de l’avancement de ma carrière, merci!
Travailler pour toi est tellement enrichissant.
Je remercie aussi les partenaires du projet : SoyaGen, Génome Canada et
Génome Québec, Agriculture et Agroalimentaire Canada et l’Université
Laval, tous grandement responsables de la réalisation de mon projet.
x
Finalement, une infinité de mercis à mon partenaire de vie. Kevin, merci de
toujours
m’encourager,
me
réconforter
et
me
soutenir
inconditionnellement. Depuis si longtemps tu es là pour moi, attentif et Oh
combien patient. Merci, sans toi, ce n’aurait pas été possible.
xi
AVANT-PROPOS
Ce mémoire débute par une revue de littérature représentant les
connaissances actuelles sur les deux organismes à l’étude, soit le
nématode à kyste du soya (Heterodera glycines) et l’Oomycota
Phytophthora sojae, ainsi que leur hôte principal, le soya, et les
mécanismes impliqués entre l’hôte et son parasite. De plus, elle met à jour
les méthodes de lutte employées contre ces micro-organismes. Plus
précisément, elle insiste sur la lutte par l’utilisation de cultivars de soya
résistants à ces organismes, qui est la méthode considérée comme la plus
efficace à ce jour, d’autant plus lorsque conjuguée avec la rotation de
cultures. Finalement, elle démontre aussi certaines interactions entre
nématodes et champignons ou pseudo-champignons qui ont été étudiées
et qui ont eu un impact sur la résistance de l’hôte.
La deuxième partie du mémoire est composée d’un article scientifique
intitulé «
Interaction between Phytophthora root rot (P. sojae) and soybean cyst nematode (SCN) on susceptible and resistant soybean cultivars» soumis à la
revue Plant Disease en date du 21 septembre 2018, dont je suis l’auteure
principale. J’ai élaboré le protocole, réalisé toutes les expériences puis
analysé et interprété les données. Ce projet a pu être accompli grâce à mes
directeurs et co-auteurs : Richard Bélanger et Benjamin Mimee qui ont
collaboré à établir un protocole efficace et concret, à la correction du
mémoire et de l’article et apporté leurs suggestions tout au long de la
réalisation de mon projet.
Pour conclure, la troisième partie propose diverses perspectives suite aux
résultats du projet.
Cette étude a été réalisée dans le cadre du projet SoyaGen financé par
Génome Canada, Génome Québec, Agriculture et Agroalimentaire Canada,
le Ministère de l’Économie, Science et Innovation du Québec, Semences
xii
Prograin Inc., Syngenta Canada Inc., Sevita Genetics, La Coop Fédérée,
Grain Farmers of Ontario, Saskatchewan Pulse Growers, Manitoba Pulse &
Soybean Growers, the Canadian Field Crop Research Alliance et Les
Producteurs de grains du Québec.
1
INTRODUCTION
Le soya cultivé, Glycine max (L.) Merr., est une plante exploitée pour ses graines riches en protéines et en huile. Appartenant à la famille des Fabacées et originaire d’Asie de l’Est, cette plante annuelle a été introduite pour la première fois aux États-Unis vers les années 1800. Grâce au développement de cultivars hâtifs, cette légumineuse a fait son introduction au Canada dans les années 1940 (Dorff 2007). Depuis, la culture du soya couvre près de 3 millions d’hectares au Canada et produit près de 7 millions de tonnes de graines annuellement. Cultivé au Québec depuis les années 1980 seulement, le soya représente désormais la plus grande superficie québécoise cultivée pour ses graines, suivant de près le maïs. Il est intéressant de souligner qu’en 2015, le Québec a atteint la production record d’un million de tonnes de soya (FAOSTAT. 2018; Institut de la statistique du Québec 2017).
La croissance de la demande internationale en soya, notamment grâce à ses graines à haute teneur en protéines et en huile qui sont utilisées aussi bien en alimentation animale qu’humaine, en fait l’une des cultures les plus rentables et donc les plus étudiées actuellement. Ainsi, les scientifiques tentent, entre autres, de développer de nouvelles variétés mieux adaptées à certains climats moins propices à la culture (saison de croissance plus courte et plus froide, photopériode plus longue) et plus résistantes aux différents agents pathogènes affectant le soya (Dorff 2007).
En Amérique du nord, les stress biotiques les plus problématiques sont le puceron du soya (Aphis glycines), certains champignons (e.g. Sclerotinia), oomycètes (e.g. Phytophthora) et quelques nématodes phytoparasites (e.g.
Heterodera). La présence de ces organismes peut grandement influencer la
croissance des plants et le rendement en graines. Tout comme leur plante hôte, ces agents pathogènes ont besoin de conditions environnementales adéquates pour survivre et ainsi pouvoir infecter le soya. C’est par la présence de leur hôte principal, et parfois grâce au réchauffement climatique (St-Marseille, 2013), que certains agents pathogènes du soya ont pu ou pourront s’établir au Québec et causer des problèmes. Ainsi les producteurs n’ont d’autres choix que de se
2
tourner vers des méthodes de lutte et de prévention qui soient à la fois efficaces et persistantes (Mimee et al. 2014a).
Parmi les méthodes de lutte utilisées, on compte la lutte chimique, la lutte biologique, la rotation de cultures, mais surtout l’utilisation de cultivars résistants à certains organismes phytopathogènes. En effet, la découverte de gènes de résistance a permis aux généticiens de développer de nouvelles variétés de soya qui résistent à plusieurs organismes pathogènes. Par contre, comme il arrive souvent qu’il y ait plus d’un agent pathogène sur un même hôte, il est possible que cette résistance soit influencée voire inhibée ou augmentée en présence du complexe pathogène. De plus, de par le principe évolutif, avec le temps, les organismes confrontés aux résistances utilisées finissent par s’adapter et ainsi contourner cette résistance. Il y a donc beaucoup de travail à faire pour être à jour en fonction des agents pathogènes présents qui évoluent rapidement.
Au Canada, l’une des maladies les plus dommageables chez le soya est la pourriture phytophthoréenne, causée par l’oomycota Phytophthora sojae Kaufmann & Gerdemann. Cette maladie est présente dans toutes les régions où le soya est cultivé et constitue un problème majeur en Amérique du nord en raison des énormes pertes économiques qu’elle engendre (Allen et al. 2017). Pour faire face à cette maladie, plusieurs études ont été menées sur P. sojae afin d’en apprendre davantage sur son cycle d’infection et trouver des méthodes de lutte adéquates. L’utilisation de la résistance variétale, basée sur des gènes nommés
Rps (Resistance to Phytophthora sojae), est désormais possible.
Aux États-Unis, le nématode à kyste du soya (NKS), Heterodera glycines Ichinohe (Tylenchida : Heteroderidae), est un microscopique ver rond, qui cause le plus de pertes économiques annuellement (Wrather et al. 2010). Ce nématode a été détecté pour la première fois en 1987 au Canada, plus précisément en Ontario où il y cause déjà des pertes annuelles de plusieurs dizaines de millions de dollars (Anderson et al. 1988b; Winter et al. 2006). Au Québec, il a été détecté pour la première fois en Montérégie Ouest en 2013 (Mimee et al. 2014b). À l’heure actuelle, les rotations de cultures ainsi que l’utilisation de cultivars résistants ajoutée d’une rotation de gènes de résistance sont les approches les plus efficace pour lutter contre ce nématode destructeur. Les gènes de résistance contre le
3
NKS sont nommés Rhg (Resistance to Heterodera glycines) et plusieurs gènes sont nécessaires pour obtenir un niveau de résistance intéressant. À ce jour, plusieurs
Rhg attribués à des gènes spécifiques ont été découverts (Cook et al. 2012).
Le NKS gagnant rapidement du terrain, les producteurs Québécois, déjà aux prises avec d’autres organismes pathogènes, doivent se préparer à son arrivée. Il convient d’envisager dès maintenant le développement de méthodes de lutte et de prévention qui soient efficaces et durables contre ces parasites.
Étant donné que la présence d’un agent pathogène sur son hôte peut affecter le développement d’un autre parasite et voire affecter la résistance induite chez la plante hôte, il est important de déterminer si la présence, dans un futur rapproché, du NKS au Québec aura un impact sur le développement de P. sojae sur son hôte et si le complexe NKS/P. sojae pourrait influencer les niveaux de résistance de l’hôte. Ces informations trouvent leur intérêt dans le contexte de prévenir la prolifération du NKS tout en suggérant des outils adéquats aux producteurs de soya.
4
CHAPITRE 1 : REVUE DE LITTÉRATURE
1.1
L
A PLANTE HÔTE
:
G
LYCINE MAX
L.
M
ERR
.
Originaire d’Asie, le soya cultivé, Glycine max L. Merr., est une plante annuelle exploitée pour ses graines riches en protéines (40%) et en huile (20%) qui lui donnent une excellente valeur nutritive. Ses gousses sont ainsi récoltées pour être transformées en nourriture animale et humaine (lait de soya, tofu, margarine etc.) mais aussi à des fins industrielles (production de biocarburant, de plastique et autres fibres et textiles). Le soya est une plante de régions chaudes, et c’est donc ainsi qu’il a pu faire son entrée sur le continent américain vers les années 1800. Ce n’est qu’au cours des années 1940, que de nouveaux cultivars hâtifs sont permis de cultiver le soya de façon rentable en climat canadien (Dorff 2007).
Au Québec, les superficies de soya sont en croissance constante depuis les années 1980. En 2015, le Québec a d’ailleurs atteint une production record d’un million de tonnes de soya, ce qui représente une augmentation fulgurante depuis les 10 dernières années. Le soya occupe désormais le premier rang pour la superficie cultivée pour la production de graines au Québec, dépassant pour la première fois le maïs grain (Figure 1)(Institut de la statistique du Québec 2017).
Le soya est en très grande demande mondialement et constitue une grande valeur économique pour l’agriculture canadienne. Environ 82% du soya cultivé dans le monde est génétiquement modifié afin de lui conférer une résistance accrue aux maladies et même parfois aux herbicides (Wong and Chang 2016). Pour cette raison, les recherches se poursuivent activement afin d’améliorer encore la protection de cette culture contre divers agents phytopathogènes susceptibles de mettre en danger les récoltes, et afin de continuer à développer des variétés pouvant s’établir plus facilement dans nos régions froides.
5
Figure 1 : Superficies ensemencées en soya et en maïs grain au Québec de 1986
à 2017 (Institut de la statistique du Québec 2017).
1.2
O
RGANISMES PHYTOPATHOGÈNES DU SOYA EN
A
MÉRIQUE
DU
N
ORD
Un organisme phytopathogène est, par définition, un organisme qui cause, en s’y nourrissant, une maladie chez une plante hôte. Ces maladies sont responsables de pertes de rendement significatives et sont donc un problème majeur en agriculture. De plus, il arrive souvent qu’une plante soit simultanément infectée par plus d’un agent pathogène (Lepoivre 2003).
1.2.1 La pourriture Phytophthoréenne causée par
Phytophthora sojae
La pourriture phytophthoréenne, causée par Phytophthora sojae, est l’une des maladies du soya les plus destructrices en Amérique. Pour la première fois identifiée en 1948 aux États-Unis et dans les années 1970 au Canada, elle sévit dans toutes les régions agricoles (Buzzell et al. 1977; Schmitthenner 1985).
Malgré plusieurs ressemblances morphologiques et fonctionnelles avec les vrais champignons (Eumycota), P. sojae est un oomycota de par la composition de sa paroi cellulaire, différente de celle des Eumycota. Composée principalement de
6
cellulose, la paroi des oomycètes est dite cellulosique alors que celle des vrais champignons, composée de chitine, est une paroi chitineuse. Ce protiste fongiforme de l’ordre des Pythiales possède un petit spectre d’hôtes qui inclut le soya et quelques légumineuses (Tyler 2007).
P. sojae se retrouve dans le sol ou dans les débris de culture et infecte les parties
sous-terraines de son hôte (graine, germe, racines et tige) tout comme le genre
Pythium, qui cause des dommages similaires. Il arrive donc souvent que ces deux
oomycota soient confondus lors de l’analyse de dommages au champ, malgré que les Phytophthora soient hémibiotrophes alors que les Pythium soient nécrotrophes (Tyler 2007; Fawke et al. 2015).
Comme la majorité des Phytophthora, P. sojae est un organisme qui peut se développer de façon nécrotrophe et biotrophe, ce qui le qualifie donc d’hémibiotrophe. Lors de l’infection, il se nourrit au départ des tissus vivants de son hôte et ce sans causer de symptômes apparents (phase biotrophe), puis très rapidement il passe il passe à la phase nécrotrophe et donc se nourrit des tissus morts de l’hôte. C’est ce dernier mode d’alimentation qui entraine l’apparition des symptômes par épuisement de la plante hôte (Jiang and Tyler 2012).
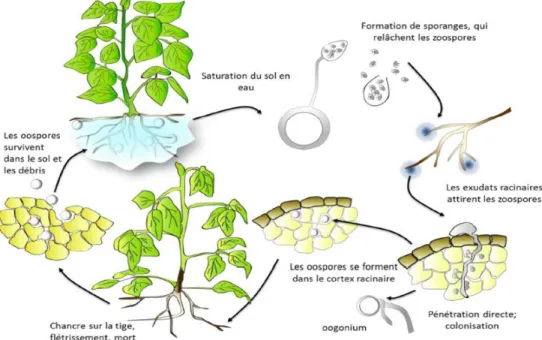
Cycle d’infection
Le cycle d’infection de P. sojae se décompose en deux parties, soit une phase sexuée (formation des oospores) et une phase asexuée permettant la formation de mycélium, sporangiophores, sporanges et de zoospore. Les oospores sont des cellules rigides permettent la conservation de l’espèce dans le sol, en attente d’une future infection, et ce pour plusieurs années (Dorrance et al. 2007; Tyler 2007).
Le cycle (Figure 2) débute donc sous la forme d’oospores en dormance dans le sol ou dans les débris de culture. La dormance est levée lorsque les conditions requises sont atteintes, soit lorsque le milieu devient aqueux suite à une accumulation d’eau, et que la température se situe entre 15 et 20°C. L’oospore germe et forme des sporanges qui pourront relâcher des zoospores mobiles et infectieuses. Lorsqu’un hôte est à proximité, celui-ci relâche des exsudats racinaires, contenant des isoflavones (composés phénoliques), pouvant être
7
détectés par les zoospores. Comme celles-ci sont mobiles dans l’eau grâce à leurs flagelles, elles sont tranquillement guidées vers leur cible. Les zoospores se fixe ensuite à la racine en formant une enveloppe (kyste) avant que débutent l’infection (Hua et al. 2008). Le kyste va ensuite produire un tube germinatif formant un appressorium à son extrémité. Lorsque l’infection est possible, relation compatible avec l’hôte, les hyphes se formes à l’extérieur du cortex racinaire et dans les racines (intracellulaire et intercellulaire). Celles-ci pourront former des haustoria dans les cellules végétales, qui sont les structures responsables de l’apport en nutriments de la plante vers l’oomycota, durant la phase biotrophe (Morris and Ward 1992; Tyler 2007).
Figure 2 : Cycle d'infection de Phytophthora sojae.
Lorsque les nutriments viennent à manquer ou que l’environnement devient inadéquat à la croissance de P. sojae, celui-ci forme des oogones et anthéridies, respectivement les structures femelles et mâles, qui vont former l’oospore pouvant initier sa dormance et ainsi se conserver pendant plusieurs années (Tyler 2007).
Symptômes et méthodes de lutte
Phytophthora sojae est un problème majeur dans les sols qui sont peu drainés et
donc où l’eau s’accumule, ce qui est très favorable à la levée de la dormance des (Lebreton 2015)
8
oospores présentes et à la dispersion des zoospores qui y nagent. Les plants peuvent être infectés à n’importe quel stade de développement. En début de saison, les symptômes débutent souvent par la pourriture des graines ce qui influence la levée (fonte des semis). Il peut aussi y avoir un retard de croissance, une chlorose des jeunes feuilles et un déclin rapide des jeunes pousses qui peuvent flétrir et mourir. Un plant atteint plus tardivement manifestera des symptômes différents d’une variété à l’autre. Lorsque le cultivar est sensible les feuilles peuvent devenir jaunes, se faner et mourir tout en restant attachées à la tige. Les variétés étant moins sensibles vont survivre mais seront rabougries. Le symptôme le plus caractéristique associé à l’infection par P. sojae est une lésion (chancre) au bas de la tige principale de couleur brun - foncé qui peut même monter plusieurs nœuds plus haut (Mueller et al. 2010).
Il existe différentes méthodes de lutte et de prévention au développement de
P. sojae. Entre autres, la réduction du travail au champ, le traitement de
semences avec du metalaxyl (un fongicide systémique), et désormais avec de l’éthaboxam et de l’oxathiapiproline. Par contre ces techniques sont souvent insuffisantes puisqu’elles ne sont pas très efficaces. Pour l’instant, les méthodes les plus recommandées comprennent l’amélioration du drainage au champ, pour éviter l’accumulation d’eau, la rotation avec des cultures non-hôtes et l’utilisation de cultivars possédant des gènes de résistance appelés Rps (Résistance à P. sojae) et à forte résistance partielle (Dorrance et al. 2018; Mueller et al. 2010). Les mécanismes impliqués sont définis plus en détails en section 1.3.2.
1.2.2 Le nématode à kyste du soya
Le nématode à kyste du soya (NKS), Heterodera glycines, est un ver rond microscopique provenant de l’Asie et causant des pertes économiques majeures à travers le monde (Wang et al. 2003). La présence du NKS dans le soya peut occasionner une baisse de rendement de 15 à 85% ((CABI) 2013). Depuis son introduction au Canada en 1987 (Anderson et al. 1988), le NKS s’est propagé le long du Fleuve St-Laurent pour atteindre le Québec en Montérégie ouest en 2013 (Mimee et al. 2014b). Depuis, il a été répertorié dans toutes les régions du Québec mais avec des densités de population très faibles (Mimee et al. 2016).
9
Cycle d’infection
Le NKS est un organisme biotrophe obligatoire qui infecte les racines de son hôte. C’est d’abord sous la forme d’un kyste, contenant les œufs que le cycle débute (Figure 3). Au printemps, lorsque les conditions sont favorables (présence de l’hôte, milieu humide, température de plus de 10°C) les œufs éclosent pour relâcher les larves du deuxième stade juvénile (J2). L’éclosion sera encore plus intense en présence d’exsudats racinaires produits par les jeunes plantules de soya. Les larves pénètrent ensuite les racines grâce à leur stylet, puis migrent vers le cylindre vasculaire (péricycle / tissu primaire vivant avec cytoplasme). C’est pendant cette étape que le sexe est déterminé et que les nématodes atteignent le stade J3.
Figure 3 : Cycle d’infection du nématode à kyste du soya, Heterodera glycines.
Dans le cylindre vasculaire, les larves forment des cellules nourricières spécialisées, aussi appelées syncytium, grâce à une dissolution cellulaire de la paroi. Cette cellule devient une source de nourriture pour le nématode, ce qui cause une perte de nutriments pour la plante hôte et peut donc l’affecter si la plante est lourdement infectée. Les femelles vont ensuite grossir et muer pour passer au stade J4. L’élargissement de la femelle se fait jusqu’à ce que la paroi racinaire rompe et que la femelle soit exposée à la surface. Les mâles vont aussi
10
atteindre la maturité sexuelle, mais arrêtent de se nourrir à la fin du stade J3, occasionnant ainsi la dégradation de leur syncytium. Ils quittent ensuite la racine pour aller se reproduire avec les femelles désormais exposées en surface. Les œufs se développent à l’intérieur de la femelle qui en expulsera une partie, lesquels pourront éclore les jours suivants. Lorsque la femelle meurt, son enveloppe corporelle séchée formera le kyste qui contiendra de 200 à 300 œufs. C’est dans ce kyste que les œufs pourront persister dans le sol durant plus de 10 ans et éclore lorsque les conditions seront propices. C’est aussi sous cette forme que le nématode sera dispersé à l’intérieur du même champ et sur de plus grandes distances par divers moyens de dissémination : le vent, les animaux, le ruissellement ou la machinerie agricole (Bohlmann 2015; Niblack et al. 2006; Niblack et al. 2004).
Symptômes et méthodes de lutte
Lorsqu’un champ de soya est infecté par le nématode à kyste, il est difficile de le constater au premier abord puisque les symptômes sont rarement présents ou souvent confondus avec les symptômes d’une autre affection. Lors de fortes infestations, le NKS entraine un retard de croissance, de la chlorose au niveau des feuilles, un rabougrissement ou un flétrissement des plants. Il peut aussi causer une réduction du nombre de nodules formés par les bactéries fixatrices d’azote (Bradyrhizobium sp.) sur les racines, ce qui réduit la disponibilité de l’azote pour la plante. De plus, les blessures causées par le nématode rendent le plant plus vulnérable à d’autres agents pathogènes. Ainsi, quoique souvent difficiles à repérer, les atteintes du nématode à kyste du soya sont néfastes pour son hôte et mènent à une réduction de rendement pouvant causer des pertes économiques considérables (Niblack 2005).
Pour lutter contre le NKS, il existe des traitements au champ comme la fumigation et les nématicides. Par contre, ces méthodes sont néfastes pour l’environnement en plus d’être coûteuses et de pas offrir de protection à long terme (Mimee et al. 2016; Niblack 2005). Au cours des dernières années, plusieurs traitements de semences incluant des biopesticides ont fait leur apparition sur le marché mais leur efficacité n’a pas encore été démontrée de façon probante.
11
Pour le moment, la méthode la plus efficace et la plus utilisée pour lutter contre le NKS ou pour prévenir son établissement est la rotation de cultivars de source de résistance différente avec des cultures non-hôtes comme le maïs et les céréales. La méthode «Rotate-Rotate-Rotate» est ce qui semble le plus préventif et efficace selon Niblack et al., 2005. Cette méthode est élaborée en tenant compte de l’évolution rapide des races de NKS dans les champs en présence d’un cultivar résistant. Ainsi le premier «Rotate» fait référence à la rotation entre cultures non-hôtes dans le champ. Le second indique que cette rotation des cultures doit inclure l’utilisation de cultivars de soya résistants au NKS. Finalement, le dernier «Rotate» indique une rotation entre les différentes sources de résistance, pour prévenir l’évolution des races face à une seule source de résistance (Niblack 2005).
1.3
L
A RELATION HÔTE
-
PARASITE
La relation hôte-parasite commence par un contact entre les deux protagonistes. Ce contact peut se produire au niveau des racines, du collet ou de la partie aérienne de la plante. Une fois le contact établi, l’infection peut débuter. La relation peut alors être compatible ou incompatible. Lorsque la relation est dite compatible, le parasite réussit à se multiplier activement et à coloniser son hôte. Le plant qui permet une relation compatible avec l’agent pathogène est dit sensible à celui-ci. Lorsqu’au contraire, la croissance du parasite s’arrête, la relation hôte-parasite est incompatible, et ainsi l’hôte est dit résistant.
La compatibilité d’un organisme phytopathogène pour une plante peut être associée au contournement, au ralentissement ou à la suppression des mécanismes de défense de la plante hôte par l’organisme, ou simplement, par l’absence d’induction de ces mécanismes suite à une non-reconnaissance de l’agent pathogène. Lorsque la relation est incompatible (résistance de l’hôte) c’est que le parasite a pu être reconnu par la plante hôte et que celle-ci a donc mis rapidement en place des stratégies de défense efficaces (Lepoivre 2003).
12
1.3.1 Mécanismes de défense des plantes
Les plantes utilisent divers mécanismes de défense contre les microorganismes pathogènes ou les herbivores. D’abord, elle se protège grâce à des barrières physiques telles que la cuticule ou les parois cellulaires, puis des molécules de défenses peuvent être impliquées dans des mécanismes de reconnaissance permettant d’enclencher la réponse de défense appropriée. Ainsi, les cellules des plantes sont toutes dotées d’un système de reconnaissance composé de récepteurs transmembranaires qui s’activent en présence de structures moléculaires communes à diverses classes d’organismes pathogènes ou non-pathogènes. (Bari and Jones 2009; Henry et al. 2012).
1.3.2 La résistance
La résistance d’une plante est définie comme étant : « l’exclusion totale ou partielle d’un agent pathogène ». Elle est associée à la reconnaissance du parasite, de ses effecteurs ou de la blessure causée par celui-ci (
Ownley and
Trigiano 2017)
.Il existe deux types de résistance chez les plantes, la résistance horizontale et la résistance verticale, concept introduit par Van der Plank en 1963. La résistance horizontale, aussi appelée résistance partielle, est non-spécifique et donc implique plusieurs gènes (polygénique). Ainsi, elle ne reconnaît pas spécifiquement un gène mais reconnait certains effecteurs du parasite se retrouvant sur toutes les souches (reconnaissance non-spécifique) ou les dommages ou dérèglements associés à la présence de l’agent intrusif. Le désavantage majeur de la résistance partielle est qu’elle est incomplète puisqu’elle ne confère pas toujours le même degré de résistance. Ainsi, elle n’empêche pas la propagation de l’agent pathogène. Par contre ce type de résistance est plus durable (
Ownley and Trigiano 2017
; Vanderplank 1984).La résistance verticale, ou résistance totale, est spécifique et n’implique qu’un seul gène (monogénique). Le produit du gène spécifiquement reconnu n’est pas nécessairement présent sur toutes les souches ou races du parasite (reconnaissance spécifique). Il s’agit en fait d’une interaction gène pour gène entre
13
un gène d’avirulence, provenant du parasite, et un gène de résistance, provenant de la plante hôte. Cette résistance est plus complète puisqu’elle n’est pas dépendante du stade de la plante et qu’elle confère toujours une résistance totale contre l’individu porteur du gène d’avirulence. Elle empêche donc totalement la propagation de celui-ci.
Lorsque l’agent pathogène est reconnu, spécifiquement ou non, la plante résistante enclenche une voie de signalisation menant à une réaction systémique acquise (SAR). Cette réponse est induite par l’une des quatre voies possibles de signalisation, toutes conduisant à la production de messagers secondaires différents. Ainsi il y a la voie de production d’espèces réactives de l’oxygène (ROS reactive oxygen species), d’acide salicylique (AS), d’acide jasmonique (AJ) ou d’éthylène (C2H4). Ces messagers secondaires, et certains autres, permettent à la
plante de réagir différemment selon l’agent pathogène impliqué. Certaines voies sont favorisées en fonction de l’agent pathogène présent. En effet, la voie des ROS, impliquée dans la réponse hypersensible de la plante menant à la mort cellulaire programmée des cellules affectées ou environnantes, ainsi que la voie de l’AS sont celles déployées lorsque qu’un agent pathogène biotrophe, ou ayant une phase biotrophe, affecte la plante hôte. Les voies de l’AJ et de l’éthylène sont quant à elle déployées en présence d’un agent pathogène nécrotrophe (Glazebrook, 2005;
Ownley and Trigiano 2017)
.Défense du soya contre le nématode à kyste du soya (NKS)
Comme le nématode à kyste du soya se crée une cellule nourricière, le syncytium, à partir de cellules de la racine pour tirer les ressources nécessaires à sa croissance, il a besoin de la cellule vivante pour survivre. Lorsqu’un nématode infecte
la racine, il libère des protéines effectrices (effecteurs). Formées dans leurs
Tableau 1 : Lignées parentales pour la
classification des HG Type des diverses populations génétiques d'Heterodera glycines. (Niblack et al. 2002)
14
glandes œsophagiennes et transmises par le stylet, ces molécules aident le nématode à former le syncytium et à déjouer le système immunitaire des plantes sensibles au NKS. En effet, ces effecteurs peuvent modifier la paroi cellulaire et permettent le déplacement du nématode dans les tissus végétaux. Certains sont des homologues de protéines végétales impliquées dans la réponse de défense de la plante hôte, ce qui leur permet de passer inaperçus (Haegeman et al. 2012; Hewezi and Baum 2013; Liu et al. 2012).
Les populations de NKS sont catégorisées selon le système des HG Type (Heterodera glycines type) plutôt que par le terme race. Cet HG Type est déterminé en fonction du phénotype de la population. Plus précisément, en fonction de sa compatibilité avec certaines lignées de soya portant différents gènes de résistance (Tableau 1). Ainsi une population est nommée par HG Type suivi des chiffres correspondants aux lignées qu’elle peut infecter. Par exemple : HG 2.6.7 est une population pouvant infecter les lignées PI88788 (2), PI89772 (6) et PI548316 (7) (Niblack et al. 2002).
Comme on ne connaît pas les bases génétiques ou biochimiques qui permettent au nématode de contourner certains gènes de résistance, ce système de classification par phénotype est pour le moment le plus informatif sur la virulence d’une population. Pour qu’une population soit dite compatible à l’infection d’une lignée, elle est soumise à la règle du 10%, aussi appelée FI pour «female index». Ce test est basé sur le taux de reproduction (noté en nombre moyen de femelles) d’une population sur chacune des sept lignées parentales résistantes (Tableau 1) comparé à celui de la même population sur un cultivar sensible de référence (par exemple, LEE 74), le tout multiplié par 100. Ainsi, si la population testée possède un FI de plus de 10%, elle est considérée compatible avec cette lignée parentale. Si toutefois le FI est inférieur à 10%, la réaction est incompatible et donc la population ne peut infecter cette lignée. Une fois toutes les lignées testées pour une population, on peut déterminer son HG Type (Niblack
et al. 2002).
Les plantes sensibles ne détectent pas la présence du parasite et donc ne se défendent pas contre celui-ci. Néanmoins, certaines plantes sont résistantes aux NKS et peuvent détecter ces effecteurs via les NB-LRR, puis déclencher une
15
réponse immunitaire de type ETI (Hewezi and Baum 2013). Les plantes qui sont résistantes au NKS possèdent donc plusieurs gènes de résistance Rhg appelés loci de résistance quantitative (QTL). À ce jour, plusieurs gènes Rhg ont été découverts (Rhg1, Rhg2, Rhg3, Rhg4, Rhg5), mais les plus documentés et utilisés sont le Rhg1 et Rhg4 (Cook et al. 2012).
Défense du soya contre la pourriture phytophthoréenne
La résistance partielle du soya face à tous les pathotypes de P. sojae est possible grâce à certains QTLs. Par contre, cette résistance est très incomplète à ce jour. C’est pourquoi la résistance verticale est priorisée pour lutter contre la pourriture phytophthoréenne. Cette résistance, monogénique, gène pour gène, fonctionne seulement contre certaines races de l’oomycota. Plusieurs gènes Rps sont connus (Rps1, …, Rps10) et disposés sur différents chromosomes. Plusieurs allèles de chaque gène ont également été décrits (1a, 1b, 1c, etc. …) (Jiang and Tyler 2012).
Tableau 2 : Table de classification des races de Phytophthora sojae ainsi que
leur profil de virulences (pathotypes de virulence associés)
16
Il existe plusieurs races (désormais appelés pathotypes) de P. sojae. Chaque race est composée de pathotypes de virulence représentant les gènes de résistance inefficaces contre cette race. Ainsi comme le démontre la Tableau 2, la race 25 est en fait composée des pathotypes 1a, 1b, 1c, 1k et 7 et est donc capable d’infecter les plants ayant les gènes de résistance correspondant soient Rps1a, Rps1b,
Rps1c, Rps1k et Rps7. C’est donc en analysant les pathotypes retrouvés dans un
champ, que l’on peut choisir un cultivar résistant qui contient les gènes de résistance adaptés (Dorrance et al. 2007).
1.4
C
OMPLEXES PATHOGÈNES
Lorsqu’une plante est affectée par plusieurs microorganismes, de nombreux facteurs peuvent interagir ensemble et influencer le développement des pathologies. Qu’il s’agisse de maladies racinaires ou foliaires, ces affections peuvent s’influencer entre elles ou même influencer leur hôte, le tout dépendant aussi de l’environnement. Il est bien connu que la présence d’un organisme sur une plante hôte peut souvent favoriser l’entrée d’autres agents pathogènes. Par exemple, un prédateur qui blesse la plante pour s’y nourrir crée une porte d’entrée pour les maladies nécessitant une blessure pour infecter la plante. Ainsi les dommages, symptômes ou altérations causés par la présence d’un agent pathogène rendent la plante hôte plus disponible ou sensible à d’autres stress biotiques ou abiotiques. Dans le cas du soya, il a été démontré que la présence de certains parasites pouvait altérer les mécanismes de défenses de la plante contre d’autres agents pathogènes (Westphal et al. 2014; Murillo-Williams and Pedersen 2008).
1.4.1 Interactions en présence du nématode à kyste du
soya
Les agents pathogènes qui occupent la même niche écologique ont plus de chances d’interagir dans un complexe pathogène puisqu’ils infectent souvent les mêmes parties de la plante. Dans le cas des nématodes, il existe beaucoup d’interactions possibles avec les agents fongiques du sol. Selon le complexe, la relation nématode-mycète peut être synergique (augmentation des dommages sur l’hôte), antagoniste (dommages moins importants que lorsque l’organisme est
17
seul) ou neutre (les dommages restent les mêmes). Dans le cas du NKS qui réussit à infecter un plant de soya, il peut, en plus de tirer de l’énergie à son hôte, permettre l’établissement d’autres maladies. On a, par exemple, démontré que la présence de NKS sur le soya permet à Fusarium virguliforme, agent fongique causal du syndrome de la mort subite (SDS), d’avoir plus d’incidence et donc agit de façon synergique avec ce champignon (Westphal et al. 2002; Niblack et al. 2004). Aussi, la présence de NKS sur un cultivar résistant à Cadophora gregata (syn. Phialophora gregata), agent fongique causal de la pourriture brune de la tige, peut altérer cette résistance, la rendant inefficace et donc permettre l’établissement de C. gregata (Tabor et al. 2003).
1.4.2 Interaction NKS et P. sojae
Bien que le complexe P. sojae et NKS a déjà été étudié, l’interaction entre ces deux agents pathogènes n’a pas encore été évaluée dans le but de déterminer leur influence sur la résistance de l’hôte. Par contre, il semble y avoir une prévalence entre ces deux agents pathogènes vivant dans le sol et infectant les racines du soya à se retrouver dans les mêmes champs, (Workneh et al. 1999).
18
HYPOTHÈSE ET OBJECTIFS
L’hypothèse formulée dans le cadre de ce projet est que la présence du nématode à kyste (NKS) influence positivement le développement de P. sojae sur les cultivars sensibles aux deux organismes mais qu’elle influence négativement son développement sur les cultivars résistants aux NKS.
En effet, lorsque le cultivar hôte est sensible aux deux organismes présents, il devrait y avoir une influence positive sur le développement de P. sojae, le NKS permettant un accès plus direct pour ce dernier. En présence d’un cultivar résistant à NKS se défendant déjà contre le nématode, le développement de
P. sojae devrait être influencé négativement, réduisant ainsi sa virulence via des
mécanismes de défense déjà en action. Par contre, les cultivars possédant des gènes de résistance à P. sojae devraient demeurer résistants malgré la présence du NKS.
Afin de valider cette hypothèse, l’objectif principal des travaux était d’évaluer les interactions possibles entre P. sojae et le NKS sur divers cultivars de soya. Plus précisément, les objectifs spécifiques de ce projet étaient d’évaluer le développement de P. sojae et du NKS seuls ou en combinaison et de vérifier l’efficacité des cultivars résistants en présence des deux agents pathogènes.
19
CHAPITRE 2: MANUSCRIT
I
NTERACTION BETWEEN
P
HYTOPHTHORA SOJAE AND THE
SOYBEAN CYST NEMATODE ON SUSCEPTIBLE AND RESISTANT
SOYBEAN LINES
20
I
NTERACTION BETWEEN
P
HYTOPHTHORA SOJAE AND THE
SOYBEAN CYST NEMATODE ON SUSCEPTIBLE AND RESISTANT
SOYBEAN LINES
C
AROLANE AUDETTE1,
R
ICHARDR.
B
ÉLANGER2 ANDB
ENJAMINM
IMEE1*.
1Agriculture and Agri-Food Canada, Saint-Jean-sur-Richelieu Research andDevelopment Centre, 430 Gouin Boulevard, Saint-Jean-sur-Richelieu, QC, Canada, J3B 3E6;
2Département de phytologie, Faculté des Sciences de l'Agriculture et de
l'Alimentation, Université Laval, Québec, QC, Canada, G1V 0A6
*Corresponding author: Benjamin Mimee
21
Résumé
Le nématode à kyste du soya (NKS), Heterodera glycines, et Phytophthora sojae font partie des agents pathogènes les plus dommageables dans le soya. Pour contrôler ces agents pathogènes et les maladies qu’ils provoquent, la meilleure technique est l’utilisation de cultivars possédant des gènes de résistance. Comme il est bien connu que la présence du NKS peut affecter la résistance d’un hôte (p. ex. Cadophora gregata) ou permettre à d’autres agents pathogènes d’être plus virulents (p. ex. Fusarium virguliforme), il est important de vérifier si une activité synergique entre le NKS et P. sojae pourrait exister et affecter leur virulence. Le but de cette étude était de vérifier l’interaction possible entre les deux agents pathogènes. Pour ce faire, quatre cultivars de soya ont été utilisés: un cultivar résistant à P. sojae (Rps6), un cultivar résistant au NKS (type PI88788), un cultivar résistant aux deux agents pathogènes (Rps3a et PI88788), et un cultivar sensible. Un isolat et une population de P. sojae et de NKS incompatibles avec ces gènes de résistance ont été utilisés. Les plants ont été inoculés avec l’un des organismes ou avec les deux, et ce, à deux stades phénologiques (âgés de 5 ou 10 jours) puis, cultivés dans un système hydroponique. Les résultats sur les plants de 5 jours ont démontré que le NKS n’influençait pas le développement de P.
sojae. Le cultivar résistant à P. sojae est aussi demeuré efficace (0% de mortalité)
et le cultivar sensible a démontré un haut taux de mortalité en présence ou absence de NKS. Les expériences sur les plants de 10 jours ont démontré que la résistance au NKS n’était pas affectée par la présence de P. sojae. En revanche, le nombre de kystes de NKS est réduit de plus de 50% (P<0,0001) lorsque P. sojae infecte aussi le cultivar sensible. Cela suggère que P. sojae influence possiblement le développement du NKS. Comme les plants possédant des gènes de résistance n’ont pas été affectés par la présence du complexe pathogène, ils demeurent une option valide pour lutter contre ces deux agents pathogènes.
22
Abstract
The soybean cyst nematode (SCN), Heterodera glycines, and Phytophthora sojae are among the most damaging pathogens of soybean. To manage these pathogens and their diseases, the most efficient tool is the use of resistant cultivars. Since it is known that the presence of SCN can affect host resistance (e.g. Cadophora
gregata) or allow pathogens to be more infective (e.g. Fusarium virguliforme), it is
important to verify if there is synergistic activity between SCN and P. sojae that could affect their virulence. The purpose of this study was to evaluate the possible interaction between the two pathogens. To this end, four soybean cultivars were used: one cultivar resistant to P. sojae (Rps6), one cultivar resistant to SCN (type PI88788), one cultivar resistant to both pathogens (Rps3a and PI88788), and one cultivar susceptible. Isolates and populations of P. sojae and SCN incompatible with these resistance genes were used. The plants were inoculated with one or both organisms at two different phenological stages (5- or 10-days old) and cultivated in a hydroponic system. The results on 5-day-old plants showed that SCN did not influence P. sojae development. The resistant cultivar to P. sojae remained effective (0% mortality) and susceptible cultivars exhibited high mortality in presence or absence of SCN. Experiments on 10-day-old plants showed that SCN resistance was not affected by the presence of
P. sojae. However, the number of SCN cysts was decreased by more than 50%
(P<0.0001) when P. sojae was co-infesting the susceptible cultivar. This suggests that P. sojae might indirectly influence SCN development. Since plants carrying resistance genes were not affected by the presence of both pathogens, they remain a valid option for the management of these pests.
23
Introduction
Soybean (Glycine max Merr.) is one of the most traded crops around the world, making it very valuable economically (Lee et al. 2016). Unfortunately, this plant is affected by a wide spectrum of microorganisms including nematodes, oomycetes, fungi, and bacteria. They can all cause considerable economic losses and have to be managed each year (O’Neal and Johnson 2010). In North America, the soybean cyst nematode (SCN) Heterodera glycines Ichinohe, and Phytophthora root rot (PRR), Phytophthora sojae Kaufmann & Gerdemann are two of the most widespread and damaging diseases (Wrather et al. 2010). Annual economic losses caused by PRR are estimated to be around 1 to 2 billion dollars worldwide (Tyler 2007). This oomycete can survive in soil for many years in the form of oospores until the conditions are suitable for infection and the soil is flooded. Then, swimming zoospores are released from sporangia and germinate after reaching soybean roots where they can affect the plant at any stage. Susceptible plants will show leaf chlorosis, wilting, cankers and root rot and will eventually die (Tyler 2007). SCN is a sedentary root endoparasite that can survive many years in soil inside the cysts. These structures contain the eggs that will hatch when conditions are propitious. At low population density, SCN will not cause any obvious symptoms although it can reduce yield by 30% (Niblack 2005). At high density, yellow patches of dwarf or wilting plants will be observed and can lead to the complete loss of a field. The nematode causes billions of dollars in losses every year (Niblack et al. 2006; Wrather et al. 2010).
There are multiple ways to manage PRR and SCN including fumigation, pesticide applications, biological control approaches and crop rotation with non-host plants (Dorrance 2018; Niblack 2005). However, the gold standard is the rotation of resistant cultivars with non-host crops. This management tool is cheaper, has no environmental or health impact and is labor-free. Also, resistance genes to multiple pathogens can be combined in order to develop soybean varieties that resist many diseases at the same time (Dorrance 2018; Niblack 2005).
Plant resistance can be affected by the simultaneous presence of multiple pathogens. For example, SCN and Fusarium virguliforme interact in a synergetic way to cause the sudden death syndrome. Indeed, the presence of SCN allows the
24
fungus to have an increased virulence on its host (Westphal et al. 2014; Niblack
et al. 2004). The presence of SCN can also facilitate the infection of Cadophora gregata by inactivating a resistance gene against this fungus, the causal agent of
brown stem rot on soybean (Tabor et al. 2003). Surprisingly, there is no interaction documented between SCN and P. sojae regarding host resistance despite the fact that these pathogens are frequently found together in a field. Since they can have a high impact on yield, it is important to evaluate if their co-occurrence on a plant can affect the efficacy of resistant cultivars (Workneh et al. 1999). Also, since the nematode is biotrophe and P. sojae have a biotrophic phase during the infection process, being a hemibiotroph, and that host defense mechanisms against biotrophic pathogens are believed to originate from a common pathway, their activation by one species could affect the development of the other.
The main objective of this study was to evaluate the interactions between
H. glycines and P. sojae on soybean. More precisely, this work aimed at
understanding P. sojae development in presence of SCN and to evaluate the virulence of each pathogen on different soybean cultivars. This should allow to determine if the resistant cultivars used to manage those pests remain effective when both pathogens are on the same host or if one of the pathogens could influence the resistance against the other. This information will take its relevance in guiding growers and breeders to achieve better management of these devastating diseases.
Materials and Methods
Plant Material
Soybean cultivar L89-1581 (HARO6272), resistant to P. sojae was provided by Semences Prograin inc (Saint-Césaire, Canada). This cultivar carries the resistant gene Rps6 effective against race 25 (Pathotype 1a, 1b, 1c, 1k, 7) of P. sojae. The SCN-resistant cultivar P19T01R was obtained from Pioneer Hi-Bred Ltd (Coteau-du-Lac, Canada). This line carries resistance QTLs from the resistant parent line PI 88788. The cultivar S10S1, carrying resistance genes to both pathogens (Rps3a, PI 88788 type) was obtained from Syngenta Canada Inc.
(Saint-25
Hyacinthe, Canada). Finally, the susceptible cultivar to both pathogens, P90Y90, was also acquired from Pioneer Hi-Bred Ltd. This cultivar does not carry any Rps or HG type resistant genes against P. sojae or SCN. None of those cultivars were chemically treated.
Seed germination was done in plug tray containing Promix, obtained from Premier Tech Horticulture (Delson, Canada), humidified with tap water and incubated in a growth chamber set at 14:10 D:N photoperiod, 25°C and 50% RH. These conditions remained the same throughout germination and all the experiments.
Nematode culture
The population of SCN used in this study was originally obtained from a field in Ontario, Canada and multiplied in greenhouse on the susceptible soybean cultivar Essex. Its virulence profile was determined using the standard phenotyping assay for SCN (Niblack et al. 2002). Infective J2 larvae were obtained by exposing SCN cysts to soybean root exudates. To do that, SCN cysts were sealed in nylon mesh bags and then placed in 15x15mm Petri dish (1 bag/petri dish) and covered with 15 ml of tap water and 15 ml of soybean root exudates. Petri dishes were stored for three weeks at 25°C in darkness allowing the J2 larvae to hatch from the eggs. Larvae were then recovered by filtering the content of the petri dish on a 75-µm filter nested on a 25-µm filter. Larvae were recuperated on the 25-µm filter and transferred to a beaker. The inoculum was prepared by adjusting the suspension to 3000 larvae/ml.
P. sojae culture
A P. sojae isolate carrying pathotypes 1a, 1b, 1c, 1k and 7 (also known as race 25), was used in this study and provided by Dr. Allen Xue from Agriculture and Agri-Food Canada. The pathotype was confirmed using a hydroponic phenotyping assay developed by Lebreton et al. (2018). This new inoculation technique was shown to be more reliable and accurate in the determination of the resistant gene effective against P. sojae isolates. Mycelium was maintained on V8-20% agar (200 ml clarified V8 juice, 15 g agar (Sigma), 800 ml distilled water) incubated at 28°C in the dark and aseptically transferred to new plates each week. Zoospores were
26
produced seven days before inoculation by transferring small squares of mycelium on V8-20% medium containing phytagel (200ml clarified V8, 4g phytagel (Sigma), 800ml distilled water) and following the method described by Lebreton et al. (2018). The number of zoospores per plate was observed by pipetting 1 µl of the plate suspension on a glass slide and counting under an inversed microscope at 10X. Three observations per plate were done to determine the concentration of each plate.
For this study, containers were inoculated with 50 ml of zoospore suspension containing about 10 000 zoospores/ml. Four plates were sufficient to inoculate a 10-l container. The 50-ml suspension was added directly into the water of the container.
Hydroponic system
A hydroponic system was developed (Lebreton et al. 2018) to facilitate P. sojae inoculation and disease monitoring. Ten-l plastic containers were filled with tap water and covered with two-inch thick Styrofoam. Holes were dug into the Styrofoam to hold two-inch hydroponic baskets. Root seedlings were washed gently to remove sand and added to each basket by passing the principal root between the bottom branches of the basket, so it reaches water. To support the plant while growing, clay pebbles were added around the seedling.
Experimental design, observed data and statistical analysis
The experimental design was a split-plot with inoculation or not with P. sojae as the principal effect. In each experiment, six containers were used, three were inoculated with P. sojae, and three were not. Six plants of each of the four cultivars were included in each container (n=24). Three plants were inoculated with SCN 48h before transfer to the hydroponic system and three were mock inoculated with water. Inoculation was done with J2 stage larvae of SCN directly on the roots with 1 ml of the inoculum at 3000 larvae/ml. The roots were then covered with pasteurized and well humidified sand. After 48h, the plants were gently soaked in water and transferred to the hydroponic system. The complete experiment was repeated four times with five-day-old seedlings at the time of
27
P. sojae inoculation (D5) and eight times with 10-day-old seedlings (D10) in one
year.
All experiments (blocks) were carried out in the same growth chamber, under the same conditions, and lasted 21 days to allow cysts to be formed. At the end of each experiment, live plants that had been inoculated with SCN were placed in an 800-µm filter nested on a 250-µm filter to be washed with high pressure water spray to detach the cysts from the roots. Cysts were recuperated from the bottom sieve by washing it into a 50-ml falcon tube. Cyst enumeration was done under a stereomicroscope. Then, the female index for each experiment was calculated by dividing the number of cysts found on each plant by the average number of cysts found on the susceptible cultivar without P. sojae for each experiment.
Throughout the experiments, the presence of symptoms associated with P. sojae (canker, brown stem, root necrosis, and leaf chlorosis) was monitored as a way to determine if P. sojae influenced SCN infection.
Data analysis was performed using a split-plot model with block effect in SAS, analysed by the mixed procedure. A Tukey test (α = 0.01) was also performed to detect significant differences in female index between the cultivars and between plants inoculated or not with P. sojae. When mortality was reached, P. sojae infection was represented by the total number of dead plants for each cultivar with SCN inoculation or not, compared to controls.
R
ESULTS
P. sojae and SCN virulence profile validation
The phenotyping of the P. sojae isolate against soybean lines carrying different resistance genes confirmed the pathotype 1a, 1b, 1c, 1k and 7 (race 25). As shown in table 1, this isolate was virulent on Rps1a, 1b, 1c, 1k and 7 but failed to infect soybean lines carrying Rps gene 1d, 3a or 6. For SCN, the population used in this study was found to be avirulent (FI<10%) on all the soybean lines carrying resistance genes against SCN (table 1). Therefore, the resistance genes/sources of the cultivars chosen for this study: PI 88788 for SCN, Rps6 for
28
Table 1. Virulence profiles of the soybean cyst nematode and Phytophthora sojae
isolates selected for this study.
Populations
Indicator lines and phenotypic responses
Phenotype
SCN No. Females on Essexa 1 PI 548402 2 PI 88788 3 PI 90763 4 PI 437654 5 PI 209332 6 PI 589772 7 PI 548316 HG 0 ON1 688 8.1b 4.9 3.2 0.1 4.0 7.0 6.2 0
P. sojae Rps 1a Rps1b Rps1c Rps1d Rps1d Rps1k Rps3a Rps6 Rps7 Pathotype
PS25 Sc S S S R S R R S
1a, 1b, 1c, 1k, 7 (Race 25)
aSusceptible check
bFemale Index value (FI) = (average number of females on indicator line) / (average number on susceptible check) x 100 cS or R indicates susceptibility or resistance response based on mortality
P. sojae virulence in presence of SCN.
Experiments on 5-day-old plants inoculated with P. sojae zoospores revealed a very high level of mortality. Every time the infection with P. sojae was compatible with plants of the host cultivar, mortality was observed. When the relation with the host was incompatible, the plants did not exhibit any symptoms of infection, indicating resistance.
When P. sojae was infecting the roots, symptoms could be observed as early as 7 days after zoospore inoculation. The resistant plants had a well-developed root system
without necrosis (Fig. 1A) while the susceptible plants showed brown stem, necrosis and absence of secondary roots (Fig. 1B). In the experiments with 5-day-old plants, all plants susceptible to P. sojae (resistant to SCN and susceptible to both pathogens) reached mortality whether SCN was present or not (Fig. 2). On
B
A
Figure 1. Phenotypic response of soybean plants at 10 dpi following Phytophthora sojae inoculation on 10-days-old plants on A) the resistant cultivar L89-1581 (HARO6272) and B) the susceptible cultivar P90Y90.