THÈSE
Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS UFR des sciences fondamentales et appliquées Ecologie et biologie des interactions - EBI (Poitiers)
(Diplôme National - Arrêté du 25 mai 2016)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Biologie de l'environnement, écologie, environnement
Présentée par : Elodie Maisonneuve
Interactions amibes libres / micro-organismes : préférence trophique et étude comparative avec les macrophages
Directeur(s) de Thèse : Marie-Hélène Rodier, Estelle Perraud Soutenue le 23 mars 2017 devant le jury
Jury :
Président Hélène Yéra Maître de conférences, PH, Université de Paris Descartes Rapporteur Loïc Favennec Professeur des Universités, PH, Université de Rouen Rapporteur Olivier Lesouhaitier Professeur des Universités, Université de Rouen Membre Marie-Hélène Rodier Professeur des Universités, PH, Université de Poitiers Membre Estelle Perraud Maître de conférences, PH, Université de Poitiers Membre Franck Morel Professeur des Universités, Université de Poitiers
Pour citer cette thèse :
Elodie Maisonneuve. Interactions amibes libres / micro-organismes : préférence trophique et étude comparative
avec les macrophages [En ligne]. Thèse Biologie de l'environnement, écologie, environnement. Poitiers : Université
.
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Faculté des Sciences Fondamentales et Appliquées) (Diplôme National - Arrêté du 25 mai 2016)
Ecole Doctorale : Science pour l’environnement Gay Lussac Secteur de Recherche : Biologie de l’environnement, écologie, environnement
Présentée par :
Elodie Maisonneuve
************************
Interactions amibes libres / micro-organismes :
préférence trophique et étude comparative avec
les macrophages
************************
Directeur de Thèse : Pr Marie-Hélène Rodier Co-directeur de Thèse : Dr Estelle Perraud
************************
Soutenue le 23 Mars 2017 devant la Commission d’Examen ************************
JURY
Présidente : Mme Hélène Yéra, Maître de conférences - Praticien Hospitalier, Université de Paris V
Rapporteurs : M. Loïc Favennec, Professeur - Praticien Hospitalier, Université de Rouen M. Olivier Lesouhaitier, Professeur, Université de Rouen
Examinateurs : M. Franck Morel, Professeur, Université de Poitiers
Mme Marie-Hélène Rodier, Professeur - Praticien Hospitalier, Université de Poitiers
Mme Estelle Perraud, Maître de conférences - Praticien Hospitalier, Université de Poitiers
THESE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS
(Faculté des Sciences Fondamentales et Appliquées) (Diplôme National - Arrêté du 25 mai 2016)
Ecole Doctorale : Science pour l’environnement Gay Lussac
Secteur de Recherche : Biologie de l’environnement, écologie, environnement Présentée par :
Elodie Maisonneuve
************************
Interactions amibes libres / micro-organismes :
préférence trophique et étude comparative avec les
macrophages
************************
Directeur de Thèse : Pr Marie-Hélène Rodier Co-directeur de Thèse : Dr Estelle Perraud
************************
Soutenue le 23 Mars 2017 devant la Commission d’Examen ************************
JURY
Présidente : Mme Hélène Yéra, Maître de conférences - Praticien Hospitalier, Université de Paris V
Rapporteurs : M. Loïc Favennec, Professeur - Praticien hospitalier, Université de Rouen M. Olivier Lesouhaitier, Professeur, Université de Rouen
Examinateurs : M. Franck Morel, Professeur, Université de Poitiers
Mme Marie-Hélène Rodier, Professeur - Praticien Hospitalier, Université de Poitiers
Mme Estelle Perraud, Maître de conférences - Praticien Hospitalier, Université de Poitiers
“La science, qui nourrit l’âme, Vaut le pain, qui nourrit le corps.”
Remerciements
Cette étude a été effectuée dans l’équipe Microbiologie de l’Eau du Laboratoire Ecologie et Biologie des Interactions dirigé par le Professeur Didier Bouchon. Je tiens à lui adresser mes remerciements pour m’avoir permis de réaliser ces travaux au sein de son laboratoire. Je tiens également à remercier le Professeur Yann Héchard et le professeur
Jean-Marc Berjeaud de m’avoir accueillie dans leur équipe.
Je tiens à remercier Monsieur Loïc Favennec, Professeur et Praticien Hospitalier au Service de Parasitologie du CHU de Rouen et Monsieur Olivier Lesouhaitier, Professeur au Laboratoire Microbiologie, Signaux et Microenvironnement à l’Université d’Evreux, de m’avoir fait l’honneur d’être rapporteurs de ce travail.
Je remercie également Madame Hélène Yéra, Maître de Conférences et Praticien Hospitalier au laboratoire de Parasitologie et Mycologie à l’Hôpital Cochin à Paris et Monsieur Franck Morel, Professeur à l’université de Poitiers, d’avoir accepté de participer à ce jury de thèse et d’évaluer ce travail.
Je tiens à remercier tout particulièrement mes directrices Marie-Hélène Rodier et
Estelle Perraud pour m’avoir encadrée et guidée dans mon apprentissage. Je tiens à les
remercier pour la confiance qu’elles m’ont accordée et pour m’avoir permis de réaliser ce projet. Je les remercie pour le temps qu’elles m’ont consacré et pour toutes nos discussions scientifiques et personnelles. Je vous en suis très reconnaissante.
Je remercie également grandement le Professeur Jean-Marc Berjeaud qui m’a donnée ma chance pour mon stage de Master. Je le remercie pour la confiance qu’il m’a accordée mais aussi pour sa disponibilité et ses conseils. Si j’en suis là aujourd’hui, c’est en partie grâce à lui.
Mes remerciements vont également à toutes les personnes avec lesquelles j’ai pu collaborer au cours de ce travail et en particulier au Professeur Nicolas Leveque pour avoir cru en ce projet et de m’avoir permis de travailler au sein de son équipe de virologie ainsi que pour le temps qu’il m’a accordé, sa gentillesse et sa disponibilité, mais aussi au Docteur
Agnès Beby-Defaux pour le temps qu’elle m’a consacré en biologie moléculaire. Je remercie
également Agnès et Martine deux super techniciennes qui m’ont appris les cultures cellulaire et virale, mais aussi pour leur accueil et leur enseignement des bases de la virologie. Un grand merci également aux ingénieurs Nathalie Quellard et Sihem Kaaki pour leur travail sur la MET, pour avoir pris le temps de m’enseigner son fonctionnement et pour leur aide précieuse pour l’analyse des images. Merci également au Professeur Franck Morel pour m’avoir fourni les macrophages et m’avoir donné des conseils pour les cultiver.
Un grand merci également à tous les membres de l’équipe Microbiologie de l’Eau et plus particulièrement certaines personnes. Julien dit juju qui me supporte depuis cinq ans maintenant et qui m’a aidée pour l’HPLC et la spectrométrie de masse. Merci à Camille que je n’ai pas vraiment eu le temps de connaître mais qui m’a été d’une aide précieuse dans la dernière ligne droite pour l’analyse des spectres de MS assez complexes. Merci également à
Nono, Adrienne, Vincent, Damien et Emilie pour leur disponibilité et leurs conseils durant
ces trois ans de thèse et même avant. Merci aussi pour toutes les conversations hautes en couleur que l’on a pu avoir au cours de ces cinq dernières années. Merci aussi à Stéphanie pour toutes nos conversations et les bons moments passés en TP. Je remercie également les techniciennes du Laboratoire de Parasitologie du CHU de Poitiers et plus particulièrement
Laëtitia et Marylène pour leur bonne humeur, leur gentillesse et surtout pour avoir accepté
d’être mes testeuses culinaires.
Un grand merci également aux stagiaires que j’ai encadrés et avec qui j’ai partagé de bons moments : Christophe (le premier et pas des moindres), Jikat, Laurianne, Lucile,
Marion (alias Post-it).
Je remercie également les thésards du labo. Luce, merci à toi pour tous les moments de rigolade et de stress qu’on a partagé ensemble, bon courage Lucette c’est presque fini. Un merci à mes petits loulous Clément et Marie-Hélène. J’ai passé de supers moments avec vous et j’espère qu’ils continueront après. Bon courage les petits jeunes Meg et Steven.
Enfin, je tiens à remercier ma famille, notamment mes parents, mon frère et ma tata qui ont cru en moi tout au long de mes études. Un grand merci à mes amies Ninon et Elodie qui m’ont soutenues pendant ces trois ans. Un grand merci à Louis, mon mari, qui a su me supporter et me motiver pendant ces trois années et plus particulièrement pendant cette période de rédaction. Et surtout un énorme merci à Loïc, mon petit amour et ma plus belle réussite qui illumine ma vie depuis 1 an et demi et qui m’a rendue plus forte et plus combative.
Sommaire
LISTE DES ABREVIATIONS ... 1
LISTE DES FIGURES... 4
LISTE DES TABLEAUX ... 7
CHAPITRE 1 : ETUDE BIBLIOGRAPHIQUE ... 9
1. Les cellules phagocytaires ... 10
1.1. Les amibes libres : exemple d’Acanthamoeba castellanii ... 10
1.1.1. Généralités ... 10
1.1.1.1. Classification ... 11
1.1.1.2. Morphologie ... 12
1.1.2. Ecologie ... 14
1.1.3. Cycle réplicatif et nutrition ... 15
1.1.3.1. Cycle réplicatif ... 15
1.1.3.2. Nutrition ... 18
1.1.4. Pathogénicité ... 18
1.2. Les macrophages ... 20
1.2.1. Généralités ... 20
1.2.2. Cycle réplicatif et mode d’action ... 21
1.2.2.1. Cycle réplicatif ... 21
1.2.2.2. Activation des macrophages ... 24
1.2.2.2.1. Activation classique ... 25
1.2.2.2.2. Activation alternative ... 26
1.2.2.3. Mode d’action ... 27
2. Les micro-organismes étudiés ... 30
2.1. Les bactéries ... 30 2.1.1. Klebsiella pneumoniae ... 30 2.1.1.1. Généralités ... 30 2.1.1.1.1. Classification ... 30 2.1.1.1.2. Morphologie ... 31 2.1.1.2. Ecologie ... 32 2.1.1.3. Pathogénicité ... 33 2.1.1.3.1. Facteurs de pathogénicité ... 33 2.1.1.3.2. Pathogénicité ... 35 2.1.1.3.3. Epidémiologie ... 36 2.1.2. Staphylococcus aureus ... 37
2.1.2.1. Généralités ... 37 2.1.2.1.1. Classification ... 37 2.1.2.1.2. Morphologie ... 38 2.1.2.2. Ecologie ... 39 2.1.2.3. Pathogénicité ... 40 2.1.2.3.1. Facteurs de virulence ... 40 2.1.2.3.2. Pathogénicité ... 43 2.1.2.3.3. Epidémiologie ... 44
2.2. Les champignons : Aspergillus fumigatus ... 45
2.2.1. Généralités ... 45
2.2.1.1. Classification ... 45
2.2.1.2. Morphologie ... 46
2.2.2. Ecologie ... 48
2.2.3. Cycle de vie et cycle infectieux ... 49
2.2.3.1. Cycle de vie ... 49 2.2.3.2. Cycle infectieux ... 50 2.2.4. Pathogénicité ... 51 2.2.4.1. Facteurs de virulence ... 51 2.2.4.2. Pathogénicité ... 53 2.2.4.3. Epidémiologie ... 55 2.3. Les Adénovirus ... 55 2.3.1. Généralités ... 55 2.3.2. Morphologie ... 56 2.3.2.1. Structure de la capside ... 57 2.3.2.2. Structure du génome ... 60 2.3.3. Pathogénicité ... 62 2.3.3.1. Cycle viral ... 62 2.3.3.2. Pathogénicité ... 65 2.3.3.3. Epidémiologie ... 66
3. Interactions avec les micro-organismes et phagocytose ... 67
3.1. Interactions des amibes libres avec les micro-organismes ... 67
3.1.1. Les bactéries ... 68
3.1.2. Les champignons ... 70
3.1.3. Les virus ... 71
3.2. Résistance des micro-organismes à la phagocytose ... 72
3.2.1. Mécanisme de phagocytose ... 72
3.2.1.2. Processus de phagocytose ... 73
3.2.2. Mécanismes d’échappement à la phagocytose ... 76
3.2.2.1. Evitement de contact avec les phagocytes ... 76
3.2.2.2. Inhibition de l’internalisation ... 77
3.2.2.3. Survie dans les phagocytes ... 77
3.2.2.3.1. Inhibition de la maturation des phagosomes ... 78
3.2.2.3.2. Survie dans les phagosomes ... 81
3.2.2.3.3. Echappement du phagosome ... 83
3.2.2.4. Induction de l’apoptose des cellules phagocytaires ... 85
CHAPITRE 2 : OBJECTIFS DE LA THESE ... 87
CHAPITRE 3 : MATERIEL ET METHODES ... 89
1. Cellules et conditions de culture ... 90
1.1. Micro-organismes ... 90 1.2. Lignées Cellulaires ... 91 1.3. Souches amibiennes ... 91 1.4. Conditions de culture ... 91 1.4.1. Micro-organismes ... 91 1.4.1.1. Bactéries ... 91
1.4.1.2. Surnageant de culture bactérienne ... 92
1.4.1.3. Souches fongiques ... 92 1.4.1.4. Virus ... 93 1.4.1.5. Amibes ... 93 1.4.2. Lignées cellulaires ... 94 1.4.2.1. Macrophages ... 94 1.4.2.2. Cellules Hep-2 ... 94 2. Méthodes de microbiologie ... 94
2.1. Tests de préférence trophique ... 94
2.2. Tests de diffusibilité ... 95
2.3. Tests de co-culture ... 96
2.3.1. Co-culture cellules phagocytaires et bactéries ... 96
2.3.2. Co-culture cellules phagocytaires et A. fumigatus ... 97
2.3.3. Co-culture cellules phagocytaires et virus ... 98
2.4. Tests de co-incubation ... 98
2.4.1. Co-incubation de K. pneumoniae avec le surnageant amibien ... 98
2.4.2. Co-incubation d’A. fumigatus avec le surnageant amibien ... 99
2.5. Effet de la gentamicine sur la croissance bactérienne en présence ou non de cellules phagocytaires ... 99
2.6. Dénombrement des micro-organismes ... 100
2.6.1. Par densité optique ... 100
2.6.2. Par numération des unités formant colonies (UFC) ... 100
2.6.3. Par numération sur cellule de comptage ... 101
2.7. Viabilité des cellules ... 101
2.8. Titrage des virus ... 101
2.9. Inhibition de l’adhérence ... 103
2.10. Test d’adhérence et d’internalisation ... 103
3. Méthodes de biologie moléculaire ... 104
3.1. Extraction d’ADN ... 104
3.2. PCR quantitative (qPCR) ... 105
4. Méthodes biochimiques ... 106
4.1. Extraction en phase solide ... 106
4.2. Chromatographie liquide haute performance en phase inverse (HPLC) ... 106
4.3. Spectrométrie de masse ... 107
4.4. Détermination de la nature des molécules d’intérêt ... 108
4.4.1. Détection des sucres ... 108
4.4.2. Détection des lipides ... 108
4.4.3. Détection des peptides ... 109
5. Microscopie ... 109
5.1. Microscopie optique inversée ... 109
5.2. Microscopie électronique à transmission ... 109
5.3. Immunofluorescence ... 111
CHAPITRE 4 : RESULTATS ... 113
1. Préférence trophique des amibes ... 114
1.1. Etude de la préférence trophique ... 114
1.2. Sécrétion de molécules par les pathogènes sélectionnés ... 115
1.3. Etude de la diffusibilité ou non des molécules sécrétées ... 116
1.4. Fractionnement des surnageants de culture ... 117
1.5. Purification des surnageants de culture par HPLC ... 118
1.5.1. Klebsiella pneumoniae ... 118
1.5.2. Staphylococcus aureus ... 120
1.6. Détermination de la nature des molécules actives ... 121
1.7. Analyse par spectrométrie de masse ... 122
1.7.1. Klebsiella pneumoniae ... 122
1.7.1.1. Analyse de la fraction A ... 122
1.7.1.3. Analyse de la fraction C ... 125
1.7.1.4. Analyse de la fraction D ... 126
1.7.1.5. Analyse de la fraction E ... 128
1.7.1.6. Récapitulatif des fractions analysées pour K. pneumoniae ... 129
1.7.2. Staphylococcus aureus ... 131
1.7.2.1. Analyse de la fraction A ... 131
1.7.2.2. Analyse de la fraction B ... 132
1.7.2.3. Analyse de la fraction C ... 133
1.7.2.4. Récapitulatif des fractions analysées pour S. aureus ... 134
2. Interaction des pathogènes avec des amibes libres et des macrophages ... 136
2.1. Etude des interactions entre K. pneumoniae et les cellules phagocytaires ... 136
2.1.1. Article 1 : An observational study of phagocytes and Klebsiella pneumoniae relationships: different behaviors ... 136
2.1.2. Résultats complémentaires ... 148
2.1.2.1. Co-culture K. pneumoniae - V. vermiformis ... 148
2.1.2.2. Effet de la gentamicine sur la croissance de K. pneumoniae en présence de V. vermiformis ... 149
2.1.2.3. Inhibition de l’attachement de K. pneumoniae à V. vermiformis ... 150
2.1.2.4. Fractionnement du surnageant d’A. castellanii ... 151
2.2. Etude des interactions entre S. aureus et les cellules phagocytaires ... 152
2.2.1. Expérience de co-culture ... 152
2.2.1.1. Co-culture S. aureus - A. castellanii ... 153
2.2.1.2. Co-culture S. aureus - V. vermiformis ... 153
2.2.1.3. Co-culture S. aureus - Thp-1 ... 154
2.2.2. Co-culture de S. aureus et des cellules phagocytaires en présence de gentamicine ……….155
2.2.2.1. Co-culture S. aureus - A. castellanii en présence de gentamicine ... 155
2.2.2.2. Co-culture S. aureus – V. vermiformis en présence de gentamicine ... 157
2.2.2.3. Co-culture S. aureus – Thp-1 en présence de gentamicine ... 158
2.2.3. Inhibition de l’attachement aux cellules phagocytaire ... 159
2.2.3.1. Inhibition de l’attachement de S. aureus à A. castellanii ... 159
2.2.3.2. Inhibition de l’attachement de S. aureus à V. vermiformis ... 160
2.2.3.3. Inhibition de l’attachement de S. aureus aux Thp-1 ... 160
2.3. Etudes des interactions entre A. fumigatus et les cellules phagocytaires ... 162
2.3.1. Article 2 : Vermamoeba vermiformis-Aspergillus fumigatus relationships and comparison with other phagocytic cells ... 162
2.4.1. Article 3 : Comparative study of human adenovirus replication in Acanthamoeba
castellanii and Thp-1 macrophagic cells ... 175
CHAPITRE 5 : DISCUSSION ... 197
CHAPITRE 6 : CONCLUSION ET PERSPECTIVES ... 211
CHAPITRE 7 : BIBLIOGRAPHIE... 215
1
Liste des abréviations
ABPA : Aspergillose broncho-pulmonaire allergique ACN : Acétonitrile
ADP : Adenovirus death protein AdV : Adénovirus
agr : accessory gene regulator
ARB : Amoeba-resisting bacteria
CAR : Coxsackie and adenovirus receptor CCM : Chromatographie sur couche mince
CFTR : Cystic fibrosis transmembrane conductance regulator CFU-GM : Granulocyte-Macrophage -Colony stimulating factor CFW : CalcoFluor White
CLP : Progéniteurs communs lymphoïdes
CMH I : Complexe d’histocompatibilité de classe I CMH II : Complexe d’histocompatibilité de classe II CMP : Progéniteurs communs myéloïdes
CSH : Cellules souches hématopoïétiques DBP : DNA Binding protein
DICT/TCID : Tissue Culture Infective Dose DO : Densité optique
ECP : Effet cytopathique
ESI-MS : Spectrométrie de masse en électrospray FcR : Récepteurs de la partie Fc des immunoglobulines GAE : Encéphalite granulomateuse amibienne
2
GILT : γ – inducible lysosomal thiol reductase
GMP : Progéniteurs communs granulocytaires monocytaires HPLC : Chromatographie liquide haute performance
IAC : Infection acquise communautaire IAH : Infection acquise en milieu hospitalier ICE : Eléments d’intégration et de conjugaison IFN-γ : Interféron γ
IL-x : Interleukine x
iNOS : inducible Nitric oxyde synthase ITR : Inverted terminal repeats
LB : Lysogeny Broth LLO : Listeriolysine O LPS : Lipopolysaccharide
M-CSF : Macrophage – Colony stimulating factor
MEP : Progéniteurs communs mégacaryocytaires érythroblastiques MET : Microscopie électronique à transmission
MH : Mueller Hinton
MNGC : Cellules géantes multi-nuclées MOI : Multiplicité d’infection
MS-MS : Spectrométrie de masse couplée à la spectrométrie de masse NNA : Non-nutritive agar
NO : Nitric oxyde
PAMPs : Pathogen-associated molecular patterns PAS : Page’s modified Neff’s amoeba saline PCR : Polymerase chain reaction
PKC : Protéine kinase C
3
PRR : Pattern recognition receptors PTH : Hormone parathyroïdienne
PYG : Proteose peptone, Yeast extract, Glucose
PYNFH : Peptone, Yeast extract, Nucleic acid, Folic acid, Hemin qPCR : PCR quantitative
ROS : Reactive oxygen species SVF : Sérum de veau foetal TCR : T cell receptor
TFA : acide trifluoroacétique TLR : Toll-Like Receptors TNF-α : Tumor necrosis factor α TP : Terminal Protein
TSST-1 : Toxine du syndrome de choc toxique 1 UFC : Unités formant colonies
4
Liste des figures
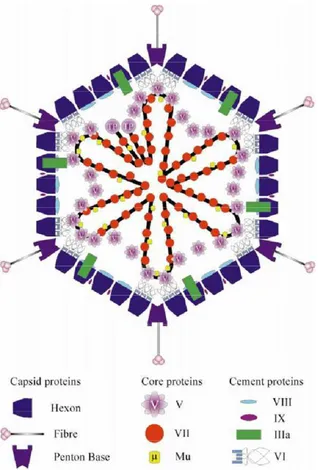
Figure 1 : Classification des principaux genres d’amibes libres ... 12 Figure 2 : Schéma de la structure d'Acanthamoeba ... 13 Figure 3 : Trophozoïte d'A. castellanii en microscopie électronique à balayage ... 13 Figure 4 : Kystes matures d'Acanthamoeba spp. en microscopie électronique à balayage ... 14 Figure 5 : Cycle d’Acanthamoeba ... 16 Figure 6 : Les différentes étapes d'enkystement d'A. castellanii ... 16 Figure 7 : Les différentes étapes du désenkystement d'A. castellanii ... 17 Figure 8 : Schéma de la structure d’un macrophage ... 20 Figure 9 : Schéma de l'hématopoïèse ... 22 Figure 10 : Développement et différenciation des macrophages ... 23 Figure 11 : Activation des macrophages ... 24 Figure 12 : Hétérogénéité fonctionnelle des macrophages ... 28 Figure 13 : Classification du genre Klebsiella pathogène pour l’Homme ... 31 Figure 14 : Klebsiella pneumoniae en microscopie électronique à balayage et en coloration de Gram ... 32 Figure 15 : Représentation des facteurs de pathogénicité de K. pneumoniae ... 33 Figure 16 : Classification du genre Staphylococcus ... 38 Figure 17 : Staphylococcus aureus en microscopie électronique à balayage et en coloration de Gram ... 39 Figure 18 : Classification du genre Aspergillus pathogène pour l’Homme ... 46 Figure 19 : Aspect d’une colonie d’Aspergillus fumigatus sur gélose ... 47 Figure 20 : Morphologie d’A. fumigatus ... 47 Figure 21 : Cycle de vie d’Aspergillus ... 49 Figure 22 : Cycle infectieux d’A. fumigatus ... 50 Figure 23 : Structure d'un adénovirus ... 57 Figure 24 : Structure de la capside des adénovirus ... 58
5
Figure 25 : Organisation du génome des adénovirus ... 61 Figure 26 : Cycle d’infection et de multiplication des adénovirus ... 63 Figure 27 : Schéma de la phagocytose dans les macrophages ... 74 Figure 28 : Stratégies utilisées par différents micro-organismes pour inhiber la maturation des phagosomes ... 78 Figure 29 : Pathogènes persistant dans le phagosome ... 82 Figure 30 : Stratégies utilisées par différents micro-organismes pour échapper aux phagosomes ... 83 Figure 31 : Schéma du test de préférence trophique ... 95 Figure 32 : Schéma du test de diffusibilité ... 96 Figure 33 : Chromatogramme de la fraction éluée à 40 % d’ACN du surnageant de culture de
K. pneumoniae, obtenu par HPLC en phase inverse. ... 119
Figure 34 : Chromatogramme de la fraction éluée à 20 % d’ACN du surnageant culture de S.
aureus obtenu par HPLC en phase inverse. ... 120
Figure 35 : Spectre ESI-MS de faible énergie de la fraction A pour K. pneumoniae. ... 123 Figure 36 : Spectre ESI-MS de faible énergie de la fraction B pour K. pneumoniae. ... 124 Figure 37 : Spectre ESI-MS de faible énergie de la fraction C pour K. pneumoniae. ... 126 Figure 38 : Spectre ESI-MS de faible énergie de la fraction D pour K. pneumoniae. ... 127 Figure 39 : Spectre ESI-MS de faible énergie la fraction E pour K. pneumoniae. ... 128 Figure 40 : Spectre ESI-MS de faible énergie de la fraction A pour S. aureus. ... 131 Figure 41 : Spectre ESI-MS de faible énergie de la fraction B pour S. aureus. ... 133 Figure 42 : Spectre ESI-MS de faible énergie de la fraction C pour S. aureus. ... 134 Figure 43 : Numération des UFC de K. pneumoniae à 3 h, 6 h, 24 h ou 48 h en co-culture avec
V. vermiformis. ... 148
Figure 44 : Numération des UFC de K. pneumoniae en co-culture avec V. vermiformis après ajout de gentamicine à 3h et 24h de co-culture. ... 150 Figure 45 : Numération de K. pneumoniae ayant adhéré à V. vermiformis en présence des sucres ... 151 Figure 46 : Numération des UFC de S. aureus en co-culture avec A. castellanii ... 153 Figure 47 : Numération des UFC de S. aureus en co-culture avec V. vermiformis. ... 154 Figure 48 : Numération des UFC de S. aureus en co-culture avec les cellules Thp-1. ... 155
6
Figure 49 : Numération des UFC de S. aureus en co-culture avec A. castellanii après ajout de gentamicine à 3h et 24h de co-culture. ... 156 Figure 50 : Numération des UFC de S. aureus en co-culture avec V. vermiformis après ajout de gentamicine à 3h et 24h de co-culture. ... 157 Figure 51 : Numération des UFC de S. aureus en co-culture avec les macrophages Thp-1 après ajout de gentamicine à 3h et 24h de co-culture. ... 158 Figure 52 : Numération des S. aureus ayant adhéré à A. castellanii en fonction ou non de la présence de glucose, galactose, mannose, rhamnose ou fructose. ... 159 Figure 53 : Numération des S. aureus ayant adhéré à V. vermiformis en fonction ou non de la présence de glucose, galactose, mannose, rhamnose ou fructose. ... 160 Figure 54 : Numération des S. aureus ayant adhéré aux cellules Thp-1 en fonction ou non de la présence de glucose, galactose, mannose, rhamnose ou fructose. ... 161
7
Liste des tableaux
Tableau 1 : Principales pathologies classées en fonction des sous-groupes d’adénovirus ... 66 Tableau 2 : Souches de micro-organismes utilisés dans l’étude ... 90 Tableau 3 : Exemple de calcul du titre d’une suspension virale ... 102 Tableau 4 : Résultats de la préférence trophique des amibes A. castellanii et V. vermiformis. ... 115 Tableau 5 : Résultats de l’attractivité des bactéries tuées ou de leur surnageant sur A.
castellanii. ... 116
Tableau 6 : Résultats des tests d’attraction d’A. castellanii par les différentes fractions des surnageants de culture. ... 118 Tableau 7 : Résultats de la détermination de la nature des molécules actives ... 122 Tableau 8 : Tableau récapitulatif des masses expérimentales (m/z) des molécules identifiées et de leurs différentes formes pour le surnageant de K. pneumoniae ... 130 Tableau 9 : Tableau récapitulatif des masses expérimentales (m/z) des molécules identifiées et de leurs différentes formes pour le surnageant de S. aureus ... 135 Tableau 10 : Effet des fractions du surnageant d’A. castellanii obtenues par Sep-Pak sur la croissance de K. pneumoniae. ... 152
9
10
1.
Les cellules phagocytaires
Les cellules phagocytaires sont, selon l’étymologie du mot, des cellules “mangeuses”. En effet, elles peuvent absorber et digérer des particules inorganiques (comme les nutriments) ou organiques (comme les micro-organismes). Les cellules phagocytaires les plus connues sont les cellules du système immunitaire et plus particulièrement les macrophages qui possèdent un rôle de défense de l’organisme. Les amibes représentent un autre type de cellules phagocytaires, pouvant être retrouvées dans l’environnement et se nourrissant principalement de micro-organismes. Certaines d’entre elles peuvent être pathogènes pour l’Homme.
1.1. Les amibes libres : exemple d’Acanthamoeba castellanii
1.1.1. Généralités
Les amibes sont des protozoaires appartenant à la classe des Rhizopodes. Elles peuvent être classées en deux grandes catégories :
Les amibes parasites, qui sont à la recherche d’un hôte et se développent peu dans l’environnement, même si elles peuvent y survivre.
Les amibes libres ou telluriques qui se développent de manière autonome dans l’environnement, indépendamment de l’Homme ou des animaux. Certaines de ces amibes peuvent parasiter l’Homme, induisant alors des pathologies souvent graves.
11 1.1.1.1. Classification
La classification des amibes libres a été un processus complexe ayant évolué au cours du temps en fonction des avancées techniques, biologiques et moléculaires. La classification des amibes libres a d’abord été basée sur la morphologie des cellules observées uniquement en microscopie optique (Schaeffer, 1926). Par la suite, la division nucléaire a été prise en compte pour différencier les amibes et donc proposer de nouvelles classifications (Singh, 1952). Ensuite, le mode de locomotion des amibes ainsi que le mouvement de leur cytoplasme ont été pris en compte. Cependant tous ces critères se sont avérés être limitants dans la distinction des espèces (Jahn and Bovee, 1965 ; Jahn et al., 1974).
Dans les années 80, l’utilisation de la microscopie électronique a permis la mise en évidence d’ultrastructures et de particularités du cycle de vie des amibes. Ces nouvelles observations ont conduit à une meilleure description des amibes déjà connues ainsi qu’à celle de nouvelles amibes. En 1987, Page proposa une nouvelle classification se basant ces nouvelles observations : ultra-structurales, biologiques et physiologiques (Page, 1987). Depuis, le développement des outils de biologie moléculaire a permis une révision régulière de cette classification.
Une classification des eucaryotes avec une hiérarchie simplifiée pour chaque rang a été publiée en 2005 par Adl (Adl et al., 2005). Elle a été révisée en 2012 (Adl et al., 2012) puis en 2015 (Cavalier-Smith et al., 2015). La Figure 1 présente la place des principaux genres amibiens à l’intérieur des eucaryotes.
12
Figure 1 : Classification des principaux genres d’amibes libres
(Adl et al., 2012 ; Cavalier-Smith et al., 2015)
D’autre part, avant 2011, le genre Hartmannella comprenait de nombreuses espèces telles que H. cantabrigensis, H. lobifera mais aussi H. vermiformis, fréquemment rencontrée dans l’environnement. Cependant, certains auteurs ont montré que cette dernière espèce n’était pas liée aux autres espèces du genre et ont donc permis sa reclassification dans un nouveau genre appelé Vermamoeba dont elle constitue la seule espèce sous le nom de V.
vermiformis (Smirnov et al., 2011).
1.1.1.2. Morphologie
Les amibes Acanthamoeba castellanii sont des cellules eucaryotes, organisées en structures complexes, comprenant de nombreux types de vacuoles (Bowers and Korn, 1968). On retrouve les organites habituels des cellules eucaryotes : un noyau, un appareil de Golgi, un réticulum endoplasmique et des mitochondries (Figure 2). On décrit en outre :
13
- les vacuoles contractiles, capables d’expulser l’eau en excès de l’amibe afin de réguler l’osmose
- les vacuoles alimentaires ou vacuoles de phagocytose permettant la digestion
- le cytoplasme composé de deux parties : l’ectoplasme représentant la couche superficielle de l’amibe et l’endoplasme qui en est la partie centrale
Figure 2 : Schéma de la structure d'Acanthamoeba (Reverey et al., 2015)
Ces amibes sont retrouvées sous deux formes : une forme végétative appelée trophozoïte et une forme dormante ou forme kystique. Les trophozoïtes (Figure 3) mesurent entre 25 et 40 µm et sont biologiquement actifs. Ils ont la capacité de se déplacer par des mouvements amoeboïdes et d’adhérer à certains substrats (Bowers and Korn, 1968).
Figure 3 : Trophozoïte d'A. castellanii en microscopie électronique à balayage
14
Les kystes (Figure 4) mesurent entre 13 et 20 µm et sont biologiquement inactifs. Ils représentent la forme de résistance des amibes lorsque les conditions de l’environnement deviennent défavorables pour les trophozoïtes. L’activité métabolique des formes kystiques est réduite, leur permettant une survie prolongée (Bowers and Korn, 1969).
Figure 4 : Kystes matures d'Acanthamoeba spp. en microscopie électronique à balayage
(Lorenzo-Morales et al., 2008)
1.1.2. Ecologie
Les Acanthamoeba sont présentes dans tous les types d’environnements, qu’ils soient naturels ou artificiels telles que des constructions humaines.
Ces amibes peuvent être mises en évidence dans le sol, les poussières, les eaux douces comme les lacs, les rivières mais aussi dans les eaux salées (Rivera et al., 1987 ; Rodríguez-Zaragoza, 1994 ; Marciano-Cabral and Cabral, 2003). On les retrouve également dans l’air sous forme kystique permettant ainsi leur dissémination. En effet, Lawande a pu isoler 38 souches d’amibes libres sur des géloses recouvertes d’Escherichia coli exposées à l’harmattan, un vent soufflant du nord vers le sud-ouest africain (Lawande, 1983).
15
Les Acanthamoebae sont également retrouvées dans des environnements artificiels créés par l’Homme. En effet, les conditions de température, d’humidité et de nourriture peuvent y être favorables à leur développement. De nombreuses études ont montré leur présence dans les réseaux d’alimentation en eau des villes, avec une part plus importante pour le genre Acanthamoeba (Jacquemin et al., 1981 ; Delafont et al., 2013). Il est également possible de les retrouver dans les tours aéro-réfrigérantes des centrales nucléaires, les systèmes de climatisation mais aussi les piscines chauffées ou les aquariums (Rivera et al., 1993 ; Barbeau and Buhler, 2001).
Ces amibes ont également été isolées dans des environnements liés à la santé humaine tels que les unités de soins dentaires et les réseaux d’eau des hôpitaux. Elles sont aussi régulièrement retrouvées à la surface de lentilles de contact (Larkin et al., 1990 ; Barbeau and Buhler, 2001).
1.1.3. Cycle réplicatif et nutrition
1.1.3.1. Cycle réplicatif
Nous avons vu que le cycle de vie d’Acanthamoeba ne se déroule que sous deux formes : les kystes et les trophozoïtes (Figure 5). Contrairement à Naegleria fowleri, autre amibe libre, il n’existe pas de stade flagellé. Les trophozoïtes qui sont les formes biologiquement actives de l’amibe se multiplient par mitose. Ils représentent également les formes infectieuses de ces protozoaires, même si les kystes sont eux aussi capables de pénétrer dans le corps humain par voie nasale, oculaire ou cutanée. Certaines espèces du genre Acanthamoeba sont responsables de pathologies comme la kératite chez le sujet
16
immunocompétent ou l’encéphalite amibienne granulomateuse chez le sujet immunodéficient (https://www.cdc.gov/parasites/acanthamoeba/biology.html, consulté le 01/06/2016).
Figure 5 : Cycle d’Acanthamoeba
(https://www.cdc.gov/parasites/acanthamoeba/biology.html, consulté le 01/06/2016)
Les trophozoïtes sont majoritaires dans les conditions optimales de croissances (Khan, 2009). L’enkystement se produit lorsque les conditions environnementales deviennent défavorables (Marciano-Cabral and Cabral, 2003) et s’accompagne de changements morphologiques et d’un ralentissement du cycle cellulaire.
Figure 6 : Les différentes étapes d'enkystement d'A. castellanii
17
L’enkystement se déroule en trois étapes (Figure 6) (Khunkitti et al., 1998):
Pré-enkystement : le trophozoïte perd sa mobilité, s’arrondit et son diamètre diminue. Début de la synthèse de la paroi : la paroi externe appelée ectokyste est synthétisée puis c’est au tour de la paroi interne, l’endokyste.
Phase de dormance
Les kystes, très résistants, peuvent rester viables pendant de nombreuses années (Sriram et al., 2008). Cette forme permet également une meilleure dissémination de l’amibe dans l’environnement. Lorsque les conditions environnementales redeviennent favorables, les amibes se désenkystent pour redevenir des trophozoïtes (Figure 7). La vacuole contractile redevient tout d’abord visible et se déplace vers la paroi, permettant ainsi au trophozoïte de se séparer de l’endokyste puis de la totalité de la paroi du kyste pour reprendre son cycle de division (Murti and Shukla, 1984).
Figure 7 : Les différentes étapes du désenkystement d'A. castellanii
(1) Kyste mature, (2 à 4) Phase de pré-émergence, (5 à 8) Emergence du trophozoïte, (9-10) Trophozoïte libre. (protist.i.hosei.ac.jp/PDB/Images/Sarcodina/acanth/03.html consulté le 05/06/2016)
18 1.1.3.2. Nutrition
Les amibes du genre Acanthamoeba spp. utilisent deux processus de nutrition : la phagocytose et la pinocytose. Elles se nourrissent dans l’environnement de micro-organismes tels que des bactéries, des champignons ou des virus. Le principal mode de nutrition alors retrouvé est la phagocytose qui permet la capture et l’ingestion de particules solides, par l’extension de pseudopodes qui vont entourer la particule puis former un phagosome (Bowers, 1977).
La pinocytose permet l’internalisation de liquides organiques et d’éléments nutritifs (Bowers, 1977) et se fait par invagination de la membrane plasmique. Ce phénomène, permettant la culture des amibes libres dans un milieu nutritif axénique en absence de micro-organismes, est utilisé en laboratoire pour le maintien des souches.
1.1.4. Pathogénicité
A. castellanii peut être responsable de pathologies humaines comme la kératite
amibienne ou l’encéphalite granulomateuse amibienne (GAE). Des atteintes cutanées ont également été rapportées.
La kératite amibienne est une inflammation de la cornée pouvant évoluer vers la cécité (Seal et al., 2003). Elle est généralement retrouvée chez les porteurs de lentilles de contact et associée au mauvais entretien de ces matériels. La pathologie peut également survenir après un contact avec de l’eau contaminée. L’infection est causée par les trophozoïtes d’A.
castellanii qui se développent après avoir adhéré à l’épithélium cornéen. Les trophozoïtes
pénètrent alors l’épithélium, provoquant une inflammation du nerf optique puis une nécrose. L’étape suivante est une invasion du stroma, détruisant ainsi les fibres de collagène et les
19
kératinocytes (Garner, 1993 ; Kim et al., 2006). La symptomatologie de la kératite amibienne associe un œil rouge et une douleur oculaire généralement accompagnée de photophobie. Cependant, ces symptômes ne sont pas spécifiques car semblables à ceux retrouvés lors de kératites bactériennes, fongiques ou virales. La mise en évidence des amibes est donc nécessaire pour établir le diagnostic.
La GAE est une infection du système nerveux central mortelle dans environ 90 % des cas et touchant principalement les patients immunodéprimés (Marciano-Cabral and Cabral, 2003 ; Schuster and Visvesvara, 2004). La contamination se fait par voies respiratoire, cutanée ou oculaire, les amibes se propageant ensuite jusqu’à l’encéphale en traversant la barrière hémato-encéphalique. Les principaux symptômes retrouvés sont une fièvre, des nausées, des vomissements accompagnés d’une raideur de nuque, de céphalées et de troubles du comportement. Après quelques semaines à quelques mois, la pathologie évolue vers le coma et la mort du patient. Le diagnostic de la GAE étant difficile, il se fait souvent lors d’un examen post-mortem, révélant des œdèmes et des zones nécrosées.
Des atteintes cutanées ont été rapportées, à type de lésions nodulaires et d’ulcères, touchant principalement les immunodéprimés (Steinberg et al., 2002). Sans traitement, ces ulcères peuvent évoluer vers des plaques de nécrose. Les infections localisées peuvent également permettre l’entrée d’A. castellanii dans la circulation sanguine, provoquant des lésions à distance et des affections systémiques.
20
1.2. Les macrophages
1.2.1. Généralités
Le nom macrophage vient du grec makros = gros et phagein = manger. Les macrophages sont des cellules phagocytaires participant à l’immunité innée. Ils ont un rôle de défense non-spécifique. Leur fonction principale est de phagocyter les micro-organismes pathogènes mais aussi les débris cellulaires.
Figure 8 : Schéma de la structure d’un macrophage
(http://www.doctorc.net/Labs/Lab5/lab5.htm consulté le 10/06/2016)
Les macrophages peuvent mesurer de 25 à 50 µm de diamètre. Ce sont des cellules eucaryotes organisées en structure complexe possédant de nombreuses vacuoles (endosomes, lysosomes, phagosomes, phagolysosomes…). Le noyau est excentré dans la cellule et peut être réniforme ou arrondi. L’appareil de Golgi est retrouvé à côté du noyau et le réticulum endoplasmique rugueux est dispersé dans le cytoplasme. On observe de nombreuses mitochondries et des lysosomes situés près de la membrane cytoplasmique, pouvant se lier
21
aux phagosomes, formant ainsi des phagolysosomes (Figure 8). Les macrophages sont également des cellules adhérentes qui peuvent se déplacer grâce au cytosquelette formé de microtubules et de filaments d’actine (Auger and Ross, 1992).
1.2.2. Cycle réplicatif et mode d’action
1.2.2.1. Cycle réplicatif
Les macrophages sont formés au cours de l’hématopoïèse, comme toutes les cellules sanguines (leucocytes, érythrocytes, thrombocytes), et ont pour origine la moelle osseuse chez les mammifères adultes (van Furth, 1989).
L’hématopoïèse (Figure 9) commence dans la moelle osseuse par les cellules souches hématopoïétiques (CSH) qui vont donner naissance aux différentes cellules sanguines (Birbrair and Frenette, 2016). Les CSH vont ainsi se différencier en progéniteurs qui subiront trois processus de différenciation :
- l’érythropoïèse, processus permettant la fabrication des globules rouges ou érythrocytes
- la leucopoïèse, processus permettant la fabrication des globules blancs ou leucocytes (polynucléaires, monocytes/macophages et lymphocytes)
- la thrombocytopoïèse, processus permettant la fabrication des plaquettes ou thrombocytes
Il existe deux types de progéniteurs primitifs provenant des CSH : les progéniteurs communs myéloïdes (CMP) et les progéniteurs communs lymphoïdes (CLP). Ces progéniteurs primitifs se différencient ensuite en progéniteurs différenciés. Les CLP aboutissent aux progéniteurs des lymphocytes et des cellules dendritiques. Les CMP sont à
22
l’origine des progéniteurs communs granulocytaires monocytaires (GMP) ainsi qu’à celle des progéniteurs communs mégacaryocytaires érythroblastiques (MEP). Les MEP sont les progéniteurs de l’érythropoïèse et de la thrombopoïèse. Les GMP sont les progéniteurs de la leucopoïèse qui nous intéresse ici. Les progéniteurs différenciés produisent ensuite des progéniteurs tardifs qui évolueront vers des précurseurs, premières cellules morphologiquement identifiables pour chaque lignée cellulaire (Fernández and de Alarcón, 2013 ; http://www.hematocell.fr/index.php/enseignement-de-lhematologie-cellulaire consulté le 10/11/2016).
Figure 9 : Schéma de l'hématopoïèse
(http://www.hematocell.fr/index.php/enseignement-de-lhematologie-cellulaire consulté le 10/11/2016)
Pour la lignée monocytaire, le progéniteur tardif est de type CFU-GM (Colony Forming Unit of Granulocyte - Macrophages), il aboutit aux monoblastes, précurseurs de la lignée, en présence de GCSF (Granulocyte Macrophage-colony stimulating factor), de M-CSF (Macrophage-colony stimulating factor) ainsi que d’IL-3 (Interleukine 3) et d’IL-6 (Interleukine 6) (Auger and Ross, 1992). Le monoblaste évolue ensuite vers les promonocytes
23
qui se diviseront pour donner des monocytes qui quitteront alors la moelle osseuse pour entrer dans la circulation sanguine, où ils circuleront pendant 1 à 3 jours avant de migrer dans les organes où ils se différencieront en macrophages (Bosque et al., 1997).
La dispersion des monocytes à travers l’organisme se déroule au hasard, de façon continue. Lors d’une infection ou d’un traumatisme, un afflux en monocytes est dû à l’expression accrue des adhésines à la surface des cellules endothéliales des vaisseaux (Auger and Ross, 1992). Les monocytes se différencient en macrophages lors de l’infiltration dans les différents organes et, suivant le tissu dans lequel ils se situent, ils prennent différents noms et morphologies (Figure 10). On les retrouve dans le foie (cellules de Kupffer), dans la rate, les tissus lymphoïdes, les poumons (macrophages alvéolaires), les os (ostéoclastes), les tissus conjonctifs (chrondroclastes), le système nerveux central (microglie)… (Bosque et al., 1997 ; Rickard and Young, 2009).
Figure 10 : Développement et différenciation des macrophages
24
Les monocytes en tant que réservoir réactif et les macrophages en tant qu’effecteurs immédiats sont des acteurss-clés de l’inflammation et sont essentiels à la défense innée vis-à-vis des différents pathogènes. Ces cellules constituent ainsi la première ligne de défense de l’organisme contre les infections et font le lien avec l’immunité adaptative.
1.2.2.2. Activation des macrophages
L’inflammation lors des infections entraîne l’activation des macrophages résidents, augmentant la production de cytokines, de chemokines ainsi que le recrutement de monocytes. On distingue l’activation des macrophages M1 qui est une activation dite classique et l’activation des macrophages M2 qui est une activation dite alternative.
Figure 11 :Activation des macrophages
(a) Activation classique par les cytokines de type Th1 et les produits microbiens tel que le
LPS (b) Activation alternative des macrophages par les cytokines de type Th2(Chawla, 2010)
Les macrophages M1 sont induits par les cytokines Th1, IFN-γ et TNF-α alors que les macrophages M2 sont induits par les cytokines Th2, IL-4 et IL-13 (Gordon, 2003; Mosser, 2003; Gordon, 2008). L’activation des différents macrophages varie en fonction du
micro-25
environnement dans lequel ils se trouvent ainsi que des récepteurs exprimés à leur surface (Figure 11).
1.2.2.2.1. Activation classique
L’activation classique des macrophages M1 est une différenciation induite par l’IFN-γ, associée à un stimulus microbien comme le lipopolysaccharide ou des cytokines comme le TNF-α (Mosser, 2003 ; Martinez et al., 2006).
L’interaction entre les pathogènes et les senseurs cellulaires, les PRR (Pattern Recognition Receptors) entraîne la production de chimiokines par les macrophages. Cette production permet le recrutement des cellules de l’immunité innée comme les cellules natural killer (NK) produisant de l’IFN-γ. L’IFN-γ active les macrophages qui vont alors produire de l’IL-12 qui est un signal fort pour obtenir une réponse Th1. Ces cellules Th-1 vont à leur tour produire de l’IFN-γ, dont la production atteint ainsi un niveau plus élevé permettant alors une activation classique des macrophages, totale et de manière plus durable. Il s’agit ici d’une activation des macrophages lors d’une réponse immune à médiation cellulaire. L’activation des macrophages M1 va donc favoriser la phagocytose des pathogènes grâce aux immunoglobulines et au complément. En effet, la présence de l’IFN-γ augmente l’expression des TLR (Toll-Like Receptors) et des FcR (Récepteurs de la partie Fc des immunoglobulines) à la surface des macrophages, facilitant de ce fait les interactions avec les pathogènes (Schroder et al., 2006 ; Mantovani et al., 2007).
L’activation de cette voie permet la production de réactifs intermédiaires de l’oxygène et de l’azote, induisant une activité microbicide efficace. Cette activité est associée à la présentation de l’antigène par les molécules du complexe d’histocompatibilté de classe II (CHM II) dont l’expression est augmentée par l’IFN-γ.
26
L’activation des macrophages M1 permet la résistance contre les pathogènes intracellulaires comme certaines bactéries ou les virus et favorise la résistance contre les tumeurs (Mantovani et al., 2007).
1.2.2.2.2. Activation alternative
Le terme M2 est donné aux macrophages activés autrement que de la manière classique comme les macrophages M1. L’utilisation du terme M2 est justifiée par des propriétés fonctionnelles similaires (comme un faible taux d’IL-12), leur implication dans l’immunorégulation ou encore le remodelage des tissus. Cependant, il existe trois formes de macrophages M2 bien définies :
- M2a (a pour alternative) induite par l’IL-4 et l’IL-13
- M2b induite par des complexes immuns et des agonistes de TLR
- M2c induite par l’IL-10 et par des hormones glucocorticoïdes (Mantovani et al., 2004).
Les macrophages activés diffèrent au niveau de leurs récepteurs, de la production des cytokines mais aussi de leurs fonctions effectrices. Les macrophages M2 possèdent un grand nombre de récepteurs non opsoniques comme le récepteur au mannose. De plus, la voie de l’arginase prédomine dans les macrophages M2a et M2c, entraînant la production d’ornithine et de polyamines, ce qui n’est pas le cas pour les macrophages M2b. L’IL-10 qui induit les macrophages M2c inhibe l’expression de TLR4 et donc la voie de signalisation MyD88 contrairement à l’IFN-γ qui permet l’activation des macrophages M1 (Bosisio et al., 2002 ; Mosser, 2003).
La production de cytokines est différente en fonction de la polymérisation des macrophages. Les macrophages M2 ont un phénotype IL-12 faible et IL-10 haut permettant
27
l’expression du CMH II ainsi que la production de NO (Nitric Oxyde) (Gordon, 2003 ; Verreck et al., 2004). Les macrophages M2 produisent peu de cytokines pro-inflammatoires comme l’IL-1, le TNF ou encore l’IL-6. Cependant, les macrophages M2b sont une exception car ils conservent une production élevée de cytokines inflammatoires tout en favorisant la différenciation des Th2 et la production d’anticorps (Mosser and Karp, 1999 ; Mosser, 2003).
L’activation alternative est définie comme une réponse aux interleukines 4 et IL-13. Ces molécules sont produites par les cellules de l’immunité innée telles que les polynucléaires éosinophiles ou basophiles, mais aussi par les cellules de l’immunité adaptative comme les lymphocytes Th2 (Gordon, 2003). Les macrophages M2 ajustent la réponse inflammatoire et l’immunité adaptative, éliminent les débris et favorisent l’angiogenèse ainsi que le remodelage et la réparation tissulaires. De plus, les variations de phénotype accentuent ces propriétés. L’intégration et la promotion des réponses de type II prédominent chez les macrophage M2a alors que la suppression et la régulation de l’inflammation et de l’immunité prédominent chez les macrophages M2b (Mantovani et al., 2004).
1.2.2.3. Mode d’action
Les macrophages détruisent les corps étrangers comme les pathogènes et informent également le système immunitaire. Ceci se fait en quatre étapes : l’infiltration dans les tissus, la captation des particules étrangères, l’information du système immunitaire et enfin la régulation du système immunitaire (Degos, 1987). Les macrophages se retrouvent donc dans presque tous les tissus et exercent de nombreuses fonctions comme la défense de l’hôte, l’élimination des débris cellulaires, mais aussi le remodelage des tissus ainsi que la régulation de la réponse inflammatoire (Chawla, 2010) (Figure 12).
28
Figure 12 : Hétérogénéité fonctionnelle des macrophages
(Chawla, 2010)
Les macrophages captent par phagocytose des particules étrangères telles que les micro-organismes pathogènes. Ils phagocytent les micro-organismes en les digérant grâce aux peroxydases et aux estérases (Hume et al., 2002 ; Lee et al., 2003). Cette étape sera développée dans le paragraphe 3.2. La digestion n’est pas complète car les macrophages présentent les antigènes aux lymphocytes T, permettant l’information du système immunitaire en cas d’infection. La présentation des antigènes se fait de trois manières :
- présentation de l’antigène exogène grâce aux molécules du CMH II aux lymphocytes T CD4+
- présentation de l’antigène endogène grâce aux molécules du CMH I aux lymphocytes T CD8+
- expression de molécules de co-stimulation permettant à la réponse des lymphocytes T de s’amplifier. Parmi ces molécules, on trouve des médiateurs de la réponse inflammatoire comme l’IL-1 ou les interférons, des molécules de co-stimulation comme les CD40, CD80,
29
mais aussi des cytokines permettant la modulation de fonctions effectrices comme l’IL-4 ou l’IL-12 (Medzhitov and Janeway, 1997).
Un des rôles des macrophages est de phagocyter d’autres cellules ainsi que des tissus endommagés. Cette fonction permet en outre la cicatrisation des plaies. Pour cela, les macrophages sont stimulés par la faible teneur en oxygène dans l’environnement, leur permettant de produire des facteurs induisant et accélérant l’angiogenèse. Ils permettent également la création de tissu cicatriciel. Les macrophages sécrètent ensuite des facteurs de croissance ainsi que des cytokines impliquées dans la prolifération des cellules épithéliales (Mercandetti and Cohen, 2005 ; De la Torre and Sholar, 2006 ; Rosenberg and De la Torre, 2008).
La résorption osseuse est un autre rôle des macrophages et plus particulièrement des ostéoclastes qui sont les macrophages résidents du tissu osseux. La résorption osseuse est le mécanisme par lequel les ostéoclastes décomposent le tissu des os, libérant ainsi les minéraux et entrainant un transfert de calcium de l’os vers le sang (Teitelbaum, 2000). Pour cela, l’ostéoclaste se fixe sur l’ostéone puis sécrète de la collagénase ainsi que d’autres enzymes. Par la suite de fortes quantités de calcium, de magnésium, de phosphate ainsi que des produits de collagène sont libérés dans le milieu extracellulaire au fur et à mesure que les ostéoclastes avancent, formant un tunnel dans l’os. Les ostéoclastes ont un rôle majeur lors de certains troubles rhumatologiques (Mensah et al., 2008). Les récepteurs au calcium dans la parathyroïde en contrôlent la concentration sanguine. Une faible concentration de calcium stimule la libération de la PTH (Hormone ParaThyroïdienne), qui va alors augmenter le nombre et l’activité des ostéoclastes (Teitelbaum, 2000).
30
2.
Les micro-organismes étudiés
2.1. Les bactéries
2.1.1. Klebsiella pneumoniae
2.1.1.1. Généralités
Le genre bactérien Klebsiella a été nommé ainsi en l’honneur des travaux du microbiologiste Edwin Klebs en 1877.
2.1.1.1.1. Classification
La classification du genre bactérien Klebsiella a évolué au cours du temps. L’espèce
Klebsiella pneumoniae auparavant appelée bacille de Friedlander est constituée de trois
sous-espèces : K. pneumoniae ssp. pneumoniae, ozaenae et rhinoscleromatis. Les organismes pathogènes pour l’Homme sont présentés dans la figure 13.
Les espèces K. planticola, K. terrigena et K. ornithinolytica étaient classées dans le genre Klebsiella mais font maintenant partie du genre Raoultella (Drancourt et al., 2001). De plus, K. trevisanii n’est plus reconnue car considérée comme un synonyme de Raoultella
31
Figure 13 : Classification du genre Klebsiella pathogène pour l’Homme
(Euzéby, 1997)
2.1.1.1.2. Morphologie
Les bactéries du genre Klebsiella sont des bacilles à Gram négatif, immobiles et souvent encapsulés (Figure 14). Ce sont des bactéries anaérobies facultatives dont la taille varie de 0,3 à 1 µm de largeur et de 0,6 à 6 µm de longueur, formant souvent des colonies mucoïdes (Abbott, 2011). Le genre comprend 77 antigènes capsulaires appelés antigènes K, soit K1 à K72, K74, K79 à K82, donnant ainsi naissance à différents sérogroupes. Les espèces
K. pneumoniae et K. oxytoca se répartissent dans un grand nombre de sérogroupes de par leur
32
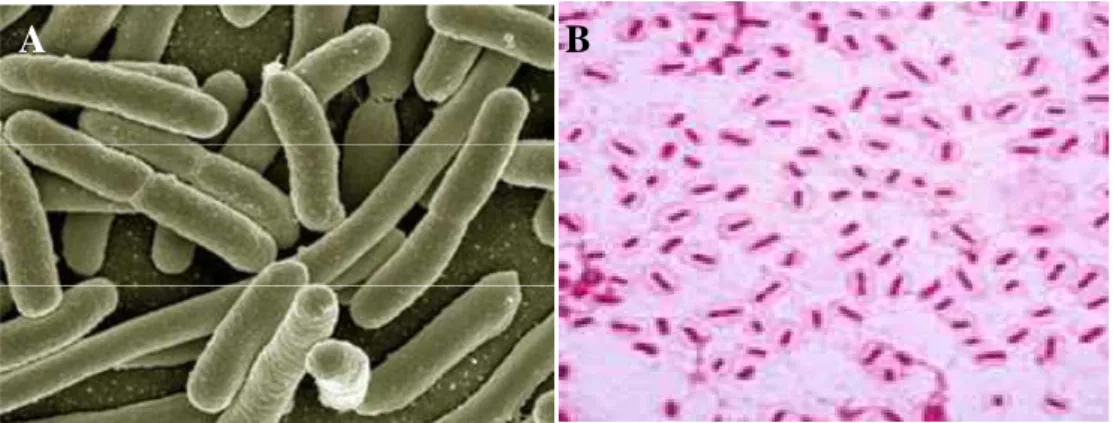
Figure 14 : Klebsiella pneumoniae en (A) microscopie électronique à balayage (klebsiella-pneumoniae.org consulté le 30/08/216)(B) coloration de Gram
(http://www.easynotecards.com/print_list/7661?fs=0&dis=1&pi=on consulté le 30/08/2016)
2.1.1.2. Ecologie
K. pneumoniae est une espèce ubiquitaire. On la retrouve dans des environnements
naturels comme les sols, les eaux de surface et les végétaux ainsi que dans des environnements artificiels tels que les réseaux d’eau et plus principalement les eaux usées. On la retrouve également aussi dans la flore commensale de l’Homme et des animaux (Bagley et al., 1978 ; Cooke et al., 1979).
Elle colonise les individus au niveau des muqueuses digestives mais aussi nasopharyngées. Cependant, la colonisation augmente très fortement chez les patients hospitalisés (Haverkorn and Michel, 1979 ; Joly and Reynaud, 2003). K. pneumoniae est une espèce que l’on peut retrouver sur les mains du personnel et sur différents objets présents dans les services hospitaliers.
33 2.1.1.3. Pathogénicité
2.1.1.3.1. Facteurs de pathogénicité
Le terme pathogénicité définit la capacité de la bactérie à causer une maladie alors que la virulence est la mesure ou le degré de pathogénicité (Podschun and Ullmann, 1992). Cinq types de facteurs de pathogénicité ont fait l’objet d’études : les antigènes de surface, les adhésines, les sidérophores, l’ilot de pathogénicité et enfin l’élément d’intégration et de conjugaison (Figure 15).
Figure 15 : Représentation des facteurs de pathogénicité de K. pneumoniae
(Podschun et al., 1998)
Antigènes de surface : il existe deux types d’antigènes exprimés à la surface de la bactérie. Le premier est l’antigène O, composant du lipopolysaccharide (LPS) et le second l’antigène capsulaire K (Williams et al., 1983).
o Le LPS est composé de deux parties : une partie lipidique (lipide A) et une partie oligosaccharidique (polysaccharide central et chaine latérale O). Il contribue à l’intégrité structurelle de la cellule. Il joue également un rôle dans l’adhérence aux surfaces (formation de biofilms) ainsi que dans l’interaction avec différentes cellules hôtes dont les amibes libres (Shevchuk et al., 2011). Le LPS se lie aux récepteurs
34
TLR4 déclenchant ainsi la cascade de la réponse inflammatoire (Friedman, 2002). Il a également été montré que la présence de LPS de haut poids moléculaire permet l’inhibition de la fusion phagosome-lysosome (Jamilloux et al., 2012).
o La capsule est de nature polysaccharidique (Hennequin and Forestier, 2007). Elle est essentielle à la virulence des bactéries en formant un épais faisceau de structure fibrillaire protégeant la bactérie de la phagocytose et de l’effet bactéricide de facteurs sériques (Highsmith and Jarvis, 1985 ; Simoons-Smit et al., 1986 ; Cryz et al., 1990). Cependant, il existe des différences de virulence importantes en fonction des sérotypes capsulaires, corrélées avec le contenu en mannose de la capsule (Podschun and Ullmann, 1992 ; Kabha et al., 1995).
Adhésines : ces molécules jouent un rôle essentiel dans la première étape du processus infectieux. L’adhérence se fait principalement par les pili ou fimbriae qui sont des structures protéiques non flagellaires et filamenteuses. Les plus rencontrés chez K.
pneumoniae sont les pili de type 1 et 3 (Podschun et al., 1998). Les pili de type 1 ont la plus
grande capacité d’adhérence par liaison aux résidus mannose (Schembri et al., 2005). Ils sont impliqués dans la colonisation des tractus respiratoire et urinaire (Struve et al., 2008), mais favorisent la phagocytose. Les pili de type 3 permettent la liaison à la membrane basale des tissus humains, cependant leur rôle en tant que facteurs de virulence reste hypothétique (van Aartsen et al., 2012).
Sidérophores : ils permettent la captation du fer environnant, essentiel à la croissance et à la réplication des bactéries. Dans les cellules hôtes, le fer n’est pas libre mais associé à des glycoprotéines comme la lactoferrine d’où la nécessité d’un système avec une forte affinité pour le fer afin d’entrer en compétition avec ces glycoprotéines. Les
35
sidérophores sont des chélateurs de bas poids moléculaire se liant au fer Fe3+ en dehors de la cellule, formant ainsi des complexes permettant l’internalisation cellulaire du fer. Il en existe trois types : les entérobactines qui sont les plus souvent rencontrées, les aérobactines présentes dans une faible proportion de souches possédant une affinité plus faible pour le fer (Nassif and Sansonetti, 1986) et les yersiniabactines (Lawlor et al., 2007).
Ilot de pathogénicité : il s’agit d’un grand fragment d’ADN chromosomique (35 à 45 kb) qui porte les gènes de virulence. La présence de cet îlot dans le genre Klebsiella serait due à un transfert horizontal à partir du chromosome de Yersina chez qui il a d’abord été décrit (Koczura and Kaznowski, 2003).
Eléments d’intégration et de conjugaison (ICE) : ils sont associés aux îlots de pathogénicité. Ils contiennent des clusters de gènes associés à la virulence et sont reliés au caractère pathogène d’une souche bactérienne (Lin et al., 2008).
2.1.1.3.2. Pathogénicité
Les bactéries du genre Klebsiella sont des pathogènes opportunistes qui peuvent être transmises par contact cutané avec des objets, des surfaces ou du matériel contaminés (Podschun and Ullmann, 1998 ; Janda and Abbott, 2006). Elles peuvent également être transmises d’une personne à une autre.
Ces bactéries, particulièrement redoutables chez les immunodéprimés, sont à l’origine de pneumonies nosocomiales, de septicémies, d’infections urinaires, d’infections de plaies mais aussi de septicémies néonatales (Bennet et al., 1985 ; Janda and Abbott, 2006).
36
K. pneumoniae est une cause importante de pneumopathies et d’abcès pulmonaires
d’origine communautaire ou nosocomiale. Sa localisation la plus fréquente se situe au niveau des lobes supérieurs. Les symptômes les plus courants en sont la fièvre, les frissons, et il est possible de retrouver des crachats de type “gelée de groseille” (expectoration gélatineuse de teinte rose). Des complications peuvent survenir, comme une évolution de l’infection en nécrose de l’ensemble du lobe pulmonaire (Janda and Abbott, 2006).
K. pneumoniae est également responsable de méningites et d’abcès cérébraux
entraînant céphalées, fièvre, altération de l’état de conscience, crises convulsives avec choc septique.
Cette bactérie est également un agent important d’abcès pyogènes du foie intéressant surtout le lobe droit. On note alors de la fièvre, des douleurs abdominales prédominant au niveau du quadrant supérieur droit, des nausées, des vomissements, ainsi qu’une diarrhée (Peng et al., 1991).
2.1.1.3.3. Epidémiologie
Les bactéries du genre Klebsiella sont cosmopolites et causent principalement des infections nosocomiales. Les espèces du genre Klebsiella sont endémiques dans les services de néonatologie. Les hommes adultes sont plus vulnérables aux infections par Klebsiella que les femmes (Janda and Abbott, 2006). Ces bactéries peuvent persister plusieurs mois chez les nouveau-nés mais seulement quelques jours à quelques semaines chez l’adulte.
Le risque d’infection à Klebsiella augmente avec la durée du séjour à l’hôpital, et l’utilisation inappropriée d’antibiotiques a conduit à l’apparition de bêta-lactamases à large spectre (Janda and Abbott, 2006 ; Podschun and Ullmann, 1998).