HAL Id: dumas-01758832
https://dumas.ccsd.cnrs.fr/dumas-01758832
Submitted on 5 Jun 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Évaluation de l’impact économique de la perte de
reliquat des médicaments onéreux en oncologie
Laura Cornic
To cite this version:
Laura Cornic. Évaluation de l’impact économique de la perte de reliquat des médicaments onéreux en oncologie. Sciences du Vivant [q-bio]. 2016. �dumas-01758832�
THÈSE D'EXERCICE / UNIVERSITÉ DE RENNES 1
sous le sceau de l’Université Bretagne Loire
Thèse en vue du
DIPLÔME D'ÉTAT DE DOCTEUR EN PHARMACIE
présentée par
Laura Cornic
Evaluation de
l’impact
économique de la
perte de reliquat
des médicaments
onéreux en
oncologie
Thèse soutenue à Rennes le 24 octobre 2016
devant le jury composé de :
Pr Pascal LE CORRE
PU-PH Université Rennes 1 / président de thèse
Mme Isabelle BORGET
MCU-PH Université Paris-Sud / directrice de thèse
Mme Agathe DOUTRIAUX
Docteur en pharmacie Université Paris Descartes /
rapporteur
Mme Marie-Antoinette LESTER
PH Université Rennes 1 / rapporteur
Mme Camille TARDIVEL
Remerciements
Au Pr Pascal Le CorrePour m’avoir fait l’honneur d’accepter de présider cette thèse et pour votre aide. A Mme Isabelle Borget,
Pour m’avoir fait découvrir la médico-économie et avoir su me transmettre tout l’intérêt que vous portez pour cette discipline, pour votre soutien durant cette riche année, pour votre implication et votre disponibilité, votre écoute et votre gentillesse.
A Mme Marie-Antoinette Lester
Pour votre participation à ce projet et pour votre aide ainsi que pour votre disponibilité et votre intérêt pour le sujet.
A Mme Camille Tardivel,
Merci d’avoir rendu cette année aussi agréable, par ton accompagnement, ton soutien, et pour tout ce que tu m’as appris. Merci pour ta gentillesse, ta patience et pour notre complicité.
A Mme Agathe Doutriaux,
Pour ta disponibilité, pour ton enthousiasme, pour tes précieux conseils pour ton aide ainsi que pour les agréables moments que nous avons pu passer ensemble à Londres.
A Mme Anne Jarry du Centre Eugène Marquis de Rennes et à Mr Romain Desmaris de l’Institut Gustave Roussy, pour leur investissement dans ce projet, leur confiance et leur aide. A mes parents Claudie et Pascal, à mon frère Alexandre et ma sœur Solène.
Sans qui rien de tout cela n’aurait été possible. Merci d’être toujours là pour moi d’avoir pu et su m’accompagner tout au long de ces études y compris dans les moments difficiles. Merci d’être les meilleurs parents que je puisse avoir.
A Julie, Caro, Maiwenn, Chloé, Laura, Tiphaine, Fanny pour tous les bons moments que nous avons partagé durant ces années d’études de pharmacie.
Table des matières
Remerciements ... 2
Table des matières ... 3
Abréviations ... 5
Liste des tableaux ... 6
Liste des figures ... 7
Liste des annexes ... 8
Introduction ... 9
1 Contexte ... 10
1.1 Le cancer en France ... 10
1.1.1 Définition ... 10
1.1.2 Epidémiologie ... 11
1.1.3 Enjeux de santé publique ... 11
1.1.4 Enjeux économiques ... 13
1.1.5 Innovation : exemple des immunothérapies ... 14
1.1.6 Conclusion ... 17
1.2 Le coût du cancer en France ... 17
1.2.1 Chiffre global ... 17
1.2.2 Coût des anticancéreux ... 18
1.2.3 Autres coûts ... 19
1.3 La régulation des dépenses de santé ... 20
1.3.1 La maîtrise nationale des dépenses de santé ... 20
1.3.2 La maîtrise des dépenses hospitalières ... 22
1.3.3 La maîtrise des dépenses médicamenteuses ... 23
1.4 Conclusion ... 24
2 Gestion des reliquats en milieu hospitalier ... 25
2.1 Introduction... 25
2.1.1 Définition ... 25
2.1.2 Le point de vue de la CEESP ... 26
2.2 Gestion des reliquats en milieu hospitalier ... 27
2.2.1 Techniques de minimisation des pertes ... 28
2.2.2 Recommandations à l’hôpital ... 32
2.2.3 Gestion des reliquats dans les établissements de santé français ... 33
2.3 Revue de la littérature ... 47
2.3.1 Méthodologie... 47
2.3.2 Résultats descriptifs ... 51
2.3.3 Présentation des études ... 53
2.3.4 Présentation des posters et abstracts ... 64
2.3.5 Conclusion de la revue de la littérature ... 66
3 Analyse d’impact budgétaire ... 68
3.1 Introduction... 68 3.1.1 Contexte ... 68 3.1.2 Objectif ... 68 3.2 Choix structurants ... 69 3.2.1 Perspective ... 69 3.2.2 Intervention et comparateurs ... 69
3.2.3 Molécules considérées ... 69
3.2.4 Scénarios analysés ... 70
3.2.5 Hypothèses ... 71
3.3 Collecte et analyse des données ... 71
3.3.1 Période d’étude ... 71
3.3.2 Données recueillies ... 71
3.3.3 Analyse des données par scénario ... 72
3.4 Approche de modélisation ... 73
3.4.1 Configuration du modèle ... 73
3.4.2 Structure du modèle ... 73
3.5 Présentation du modèle et des résultats ... 74
3.5.1 Centre Eugène Marquis ... 74
3.5.2 Institut Gustave Roussy ... 78
3.6 Conclusions... 86
3.7 Discussion et limites ... 88
4 Conclusion générale ... 90
Abréviations
ACE Analyse coût-efficacité ACU Analyse coût-utilitéARS Agence régionale de santé
ASMR Amélioration du Service Médical Rendu CAMin Cancer microenvironnement et innovation CBU Contrat de bon usage
CCSS Commission des comptes de la Sécurité sociale
CEESP Commission évaluation économique et de santé publique CEM Centre Eugène Marquis
CEM Centre Eugène Marquis
CEPS Comité économique des produits de santé CH Centre hospitalier
CHU Centre hospitalo-universitaire CLCC Centre de lutte contre le cancer
CPIM Comité de prospective des innovations médicamenteuses DHOS Direction de l’hospitalisation et de l’organisation des soins ESPIC Etablissement de santé privé d'intérêt collectif
ex-DG Ex-dotation globale
FSV Fond de solidarité vieillesse GHS Groupe homogène de séjour HAS Haute Autorité de Santé HDJ Hospitalisation de jour
HEGP Hôpital Européen Georges Pompidou IGR Institut Gustave Roussy
IV Intraveineuse
LEEM Les entreprises du médicament
LFSS Loi de financement de la Sécurité sociale MCO Médecine chirurgie obstétrique
OMS Organisation Mondiale de la Santé
Ondam Objectif national de dépenses de l'assurance maladie PIB Produit intérieur brut
PMSI Programme de médicalisation des systèmes d’information PUI Pharmacie à usage interne
RCP Résumé des Caractéristiques Produit RG Régime général
T-DM1 Trastuzumab emtansine
UCD Unité Commune de Dispensation URC Unité de Recherche Clinique
Liste des tableaux
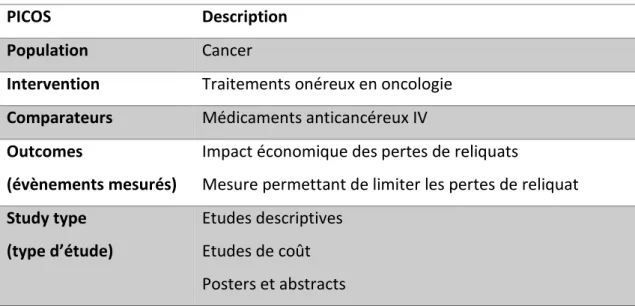
Tableau 1 Les critères PICOS : gestion des reliquats en milieu hospitalier ... 47
Tableau 2 Termes de recherches - Recherche principale ... 48
Tableau 3 Termes de recherche - Recherches additionnelles ... 49
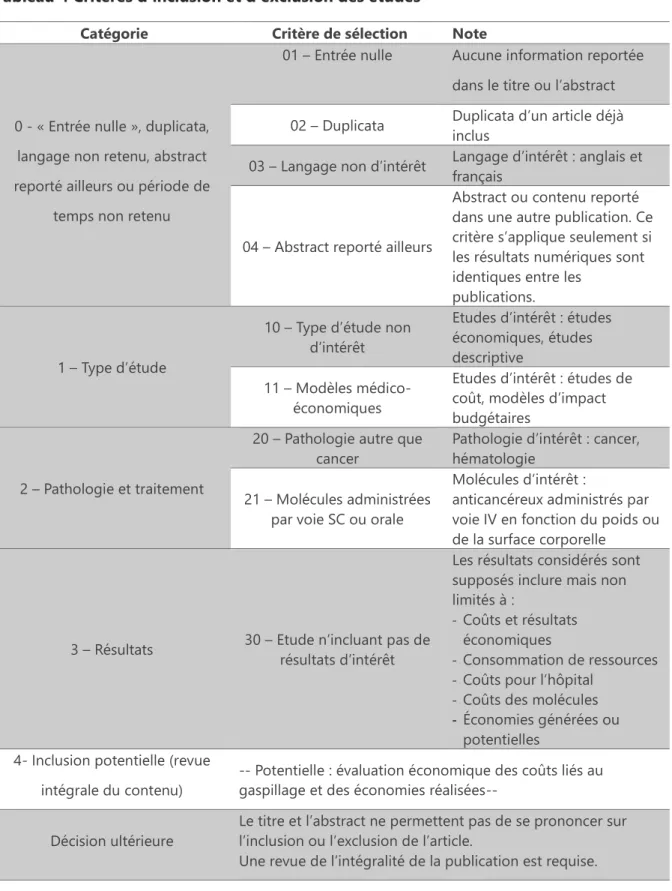
Tableau 4 Critères d'inclusion et d'exclusion des études ... 50
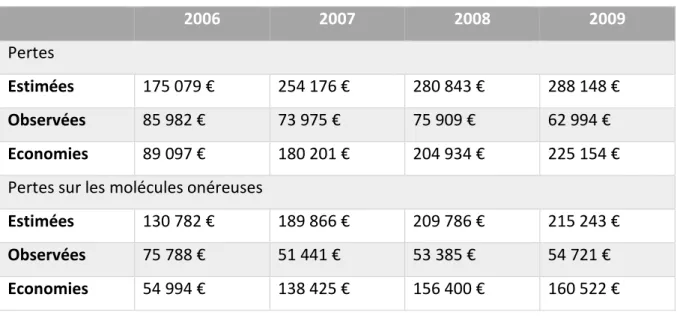
Tableau 5 Coûts enregistrés sur la durée de l'étude ... 55
Tableau 6 Calcul du montant des économies annuelles réalisées ... 55
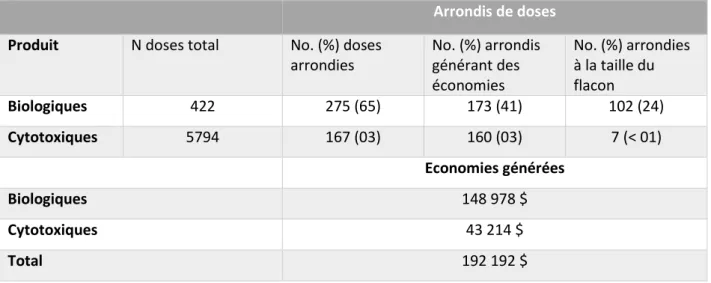
Tableau 7 Economies engendrées par les arrondis de doses automatisés ... 60
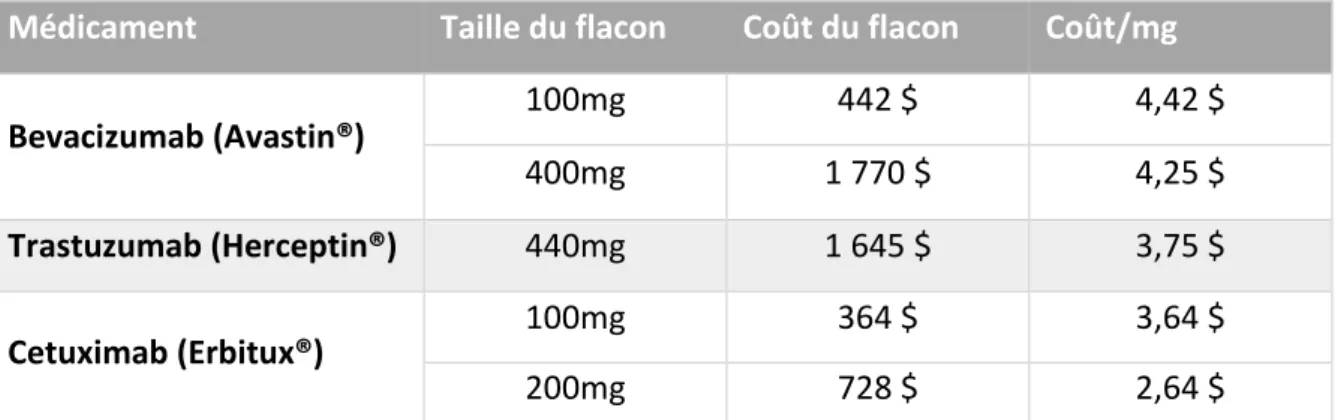
Tableau 8 Volume des flacons et coûts d'acquisition du bevacizumab, trastuzumab et cetuximab... 63
Tableau 9 Projection annuelle des économies réalisées via les arrondis de dose ... 64
Tableau 19 Trastuzumab emtansine - Scénario 1 ... 98
Tableau 20 Trastuzumab emtansine - Scénario 2 ... 98
Tableau 21 Trastuzumab emtansine - Scénario 3 ... 99
Tableau 22 Nivolumab - Scénario 1 ... 100
Tableau 23 Nivolumab - Scénario 2 ... 100
Tableau 24 Nivolumab - Scénario 3 ... 101
Tableau 25 Pembrolizumab - Scénario 1 ... 102
Tableau 26 Pembrolizumab - Scénario 2 ... 102
Tableau 27 Pembrolizumab - Scénario 3 ... 103
Tableau 28 Trastuzumab emtansine - Scénario 1 ... 104
Tableau 29 Trastuzumab emtansine - Scénario 2 ... 104
Liste des figures
Figure 1. Répartition (%) des dépenses des principales molécules anticancéreuses les plus
prescrites de la liste en sus en 2013 [11] ... 19
Figure 2 Les 4 axes du Plan d'action de la filière cancérologie au CHU [32] ... 35
Figure 3 Circuit informatisé du médicament pour les chimiothérapies ... 37
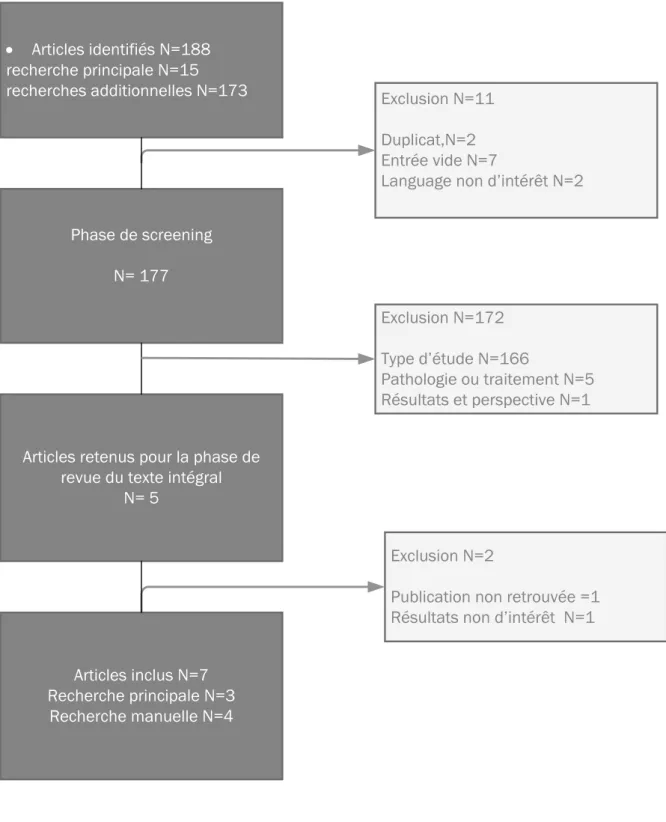
Figure 4 Diagramme PRISMA de la revue de littérature ... 52
Figure 5 Les trois scénarios de l'analyse d'impact budgétaire ... 70
Figure 6 CEM - Proportion des pertes de trastuzumab emtansine dispensé ... 77
Figure 7 CEM - Pourcentage de pertes de reliquats de trastuzumab emtansine ... 78
Figure 8 IGR - Proportion de pertes de nivolumab par rapport à la dose dispensée ... 80
Figure 9 IGR - Pourcentage de reliquats de nivolumab perdus ... 81
Figure 10 IGR - Proportion de pertes de pembrolizumab dispensé ... 83
Figure 11 IGR - Pourcentage de reliquats de pembrolizumab perdus ... 83
Figure 12 IGR - Proportion de pertes de trastuzumab emtansine dispensé ... 85
Liste des annexes
Annexe 1 Courrier de la DHOS ... 92
Annexe 2 Publications incluses dans la revue de la littérature ... 93
Annexe 3 Posters inclus dans la revue de la littérature... 95
Annexe 4 Résumé des caractéristiques des produits ... 96
Annexe 5 BIM - Centre Eugène Marquis – Trastuzumab emtansine ... 98
Annexe 6 BIM – Institut Gustave Roussy – Nivolumab ... 100
Annexe 7 BIM – Institut Gustave Roussy – Pembrolizumab ... 102
Annexe 8 BIM - Institut Gustave Roussy – Trastuzumab emtansine ... 104
Introduction
Ce projet s’inscrit dans un contexte marqué par une forte croissance des dépenses de santé et la recherche d’une pérennisation du financement du système de santé français. Les dernières décennies ont vu apparaître des progrès considérables dans la prise en charge des patients atteints de cancer et notamment des nouveaux traitements tels que les immunothérapies. Ces innovations thérapeutiques s’accompagnent généralement de prix élevés et la recherche de solutions pour financer ces innovations ou limiter les dépenses est essentielle.
L’objectif de ce projet est d’apporter des informations sur les mesures mises en place pour limiter ces pertes des médicaments anticancéreux et d’évaluer l’impact économique de ces pertes pour les établissements hospitaliers.
En effet, lors de l’administration en dose par unité de surface ou de poids corporels d’une molécule, par voie intraveineuse, il est possible qu’une partie du flacon ne soit pas utilisée lorsque le ou les formats de présentation ne permettent pas d’administrer l’intégralité du contenu pour un poids donné. A cela s’ajoute la stabilité parfois courte de ces molécules qui dans certains cas ne laisse pas la possibilité d’administrer ultérieurement le reliquat à un autre patient traité par le même médicament, ainsi que le flux de patients qui d’un établissement à l’autre peut varier et impacter la perte des reliquats.
Lorsque le coût de ces flacons d’anticancéreux est élevé, cette perte de substance peut entraîner un surcoût non négligeable.
C’est la problématique à laquelle cette étude répond : évaluer la gestion des reliquats en pratique, présenter les différentes mesures mises en place pour limiter les pertes et leur faisabilité et dans une seconde partie, évaluer l’impact économique au moyen d’un modèle d’impact budgétaire, pour quantifier le volume et le coût de ces pertes dans deux centres de lutte contre le cancer (CLCC).
1 Contexte
Le cancer est la principale cause de mortalité avec 385 000 nouveaux cas recensés en 2015. La prise en charge des patients atteints de cancers est un enjeu de santé publique majeur, comme en témoigne les Plan cancer quinquennaux. La recherche en oncologie est très dynamique et de nouveaux traitements innovants apparaissent et apporte de nombreux espoirs pour les patients.
La prise en charge des cancers s’accompagne de coût important évoluant avec une dynamique croissante et nécessite donc la recherche de solutions afin de limiter les dépenses et de pérenniser le financement des soins de tous les patients. Il existe notamment des méthodes permettant de réguler les dépenses de santé, en amont ou en aval de la mise sur le marché des technologies de santé et il est également intéressant de s’intéresser à l’utilisation des ressources en pratique, au sein des établissements de santé.
1.1 Le cancer en France
1.1.1 Définition
Le cancer est un terme utilisé pour désigner un ensemble de pathologies pouvant toucher n’importe quelle partie du corps et caractérisé par la prolifération rapide de cellules anormales pouvant envahir des parties adjacentes de l’organisme puis essaimer dans d’autres organes sous forme de métastases.
Le cancer apparaît à partir d’une cellule normale qui se transforme en cellule tumorale par un processus comportant plusieurs étapes. La mutation des cellules résulte d’interactions entre les facteurs génétiques propres au sujet et des agents extérieurs tels que le rayonnement ultraviolet (cancérogène physique), des agents chimiques ou biologiques (infections dues à certains virus, bactéries ou parasites). Le vieillissement est un autre facteur important dans l’apparition des tumeurs, se traduisant par l’augmentation de l’incidence des cancers avec l’âge, très probablement due à une accumulation des risques et des mutations cellulaires tout au long de la vie [1].
1.1.2 Epidémiologie
Les cancers sont reconnus parmi les principales causes de morbidité et mortalité dans le monde avec en 2013, 14,9 millions de nouveaux cas recensés et 8,2 millions de décès liés à la maladie. Les hommes sont plus susceptibles de développer un cancer entre la naissance et l’âge de 79 ans. Environ un homme sur trois et une femme sur cinq développeront un cancer au cours de leur vie [2]. Une augmentation de 70% du nombre de nouveaux cas est envisagée au cours des deux prochaines décennies, selon l’Organisation Mondiale de la Santé (OMS) [1]. En France, le cancer est la première cause de mortalité : le nombre de décès liés à la maladie est estimé à 149 500 (84 100 hommes et 65 400 femmes) et environ 385 000 cas (211 000 hommes et 174 000 femmes) répertoriés sur l’année 2015. De plus, les personnes de 15 ans et plus vivantes en 2008 et ayant eu un cancer au cours de leur vie, est estimé à 3 millions [3]. Parmi les cancers les plus incidents, on trouve au 1er rang chez l’homme le cancer de la
prostate avec 48 763 nouveaux cas estimés en 2012 et chez la femme le cancer du sein avec 53 465 nouveaux cas estimés en 2009. Avec 42 152 nouveaux cas estimés en 2012, le cancer colorectal arrive au 3ème rang des cancers incidents suivi par le cancer du poumon dont le
nombre de nouveaux cas a été estimé à 39 495 [3].
En matière de mortalité, le cancer du poumon se situe au premier rang chez l’homme (21 326 décès) devant le cancer colorectal (9 275 décès) et le cancer de la prostate (8 876 décès) d’après les chiffres estimés pour l’année 2012. Chez la femme, le plus fort taux de mortalité est observé pour le cancer du sein (11 886 décès) devant le cancer du poumon et le cancer colorectal qui enregistrent respectivement 8 623 et 8 447 décès en 2012 [3].
1.1.3 Enjeux de santé publique
La lutte contre le cancer est au cœur des politiques de santé publique et fait l’objet de plans stratégiques quinquennaux définissant les priorités et les objectifs pour répondre à des enjeux médicaux, humains et sociaux, mais aussi économiques.
Le Plan cancer 2014-2019 a pour ambition de guérir plus de personnes malades, de préserver la continuité et la qualité de vie, d’investir dans la prévention et souhaite optimiser le pilotage et les organisations de la lutte contre le cancer. A travers l’ensemble des ambitions et des objectifs du plan, une priorité est donnée à la réduction des inégalités et des pertes de chance
face aux cancers, dans un contexte où les contraintes financières pèsent fortement. En effet, ce Plan stratégique ne peut s’affranchir des problématiques de financement auxquelles notre système de santé doit faire face. La recherche de l’efficience est un enjeu majeur et implique les organisations et la pertinence des soins afin de favoriser l’accès à l’innovation et aux progrès thérapeutiques ainsi que l’amélioration de la qualité des soins [4].
Réduire la morbidité et la mortalité liées au cancer est une priorité mondiale. Lors de l’Assemblée mondiale de la Santé de 2012, la stratégie du « 25 by 25 » a été mise en œuvre pour répondre à la menace mondiale que représentent les maladies non transmissibles telles que les maladies cardiovasculaires, les cancers ou encore le diabète. L’objectif est de réduire de 25 % la mortalité prématurée induite par ces conditions à l’horizon 2025 [5].
1.1.3.1 Prévention des cancers
Selon l’OMS, 30 % des cancers sont dus à des facteurs de risques comportementaux et alimentaires : le surpoids et un manque d’exercice physique, une faible consommation de fruits et légumes, le tabagisme et la consommation d’alcool. Le tabagisme entraînerait environ 20 % de la mortalité par cancer et près de 70 % des décès par cancer [1].
La prévention, le dépistage précoce et la prise en charge des patients permettraient de réduire et d’endiguer le cancer. En effet, la détection précoce permet un traitement plus efficace et a un impact positif sur le pronostic de la maladie.
La prévention est au cœur du Plan cancer 2014-2019 avec pour objectif de favoriser les diagnostics précoces notamment pour le cancer du col de l’utérus, pour lequel il existe un examen de dépistage permettant de repérer les lésions précancéreuses et les cancers à un stade précoce et augmentant les chances de guérison, ainsi qu’un vaccin contre le principal facteur de risque, le papillomavirus [4]. D’une part, le Plan cancer prévoit un programme national de dépistage organisé mobilisant médecins généralistes, gynécologues et sages-femmes avec pour objectif une réduction de l’incidence et du nombre de décès par cancer du col de l’utérus de 30 % à 10 ans. D’autre part, le Plan cancer prévoit le lancement d’un programme national de réduction du tabagisme dont l’objectif est de réduire d’un tiers la prévalence du tabagisme pour atteindre une prévalence de 22 % de fumeurs d’ici 2019, en dissuadant l’entrée dans le tabagisme, facilitant son arrêt, menant une politique tarifaire cohérente avec l’objectif et en associant les buralistes à cette démarche [4]. Parmi les
mesures mises en œuvre pour satisfaire cet objectif, on peut citer l’introduction du paquet neutre par la loi de modernisation du système de santé de 2015.
Le Plan ambitionne également de diminuer les cancers liés à l’alcool, à l’alimentation, au travail ou à l’environnement par des mesures préventives.
1.1.4 Enjeux économiques
1.1.4.1 Fardeau économique mondial
La capacité à délivrer des soins financièrement abordables pour la prise en charge du cancer est arrivé à un tournant. L’évolution démographique couplée au développement rapide de nouvelles technologies (médicamenteuses et chirurgicales) entraînent une forte augmentation des dépenses de santé liées au traitement des cancers. L’enjeu pour les pays développés est alors de délivrer des soins à des prix raisonnables pour l’ensemble des citoyens c’est-à-dire rendre la prise en charge des cancers accessible aux individus et aux sociétés [6].
Parmi les coûts de prise en charge des patients, on distingue les coûts de dépistage et diagnostic, les coûts des traitements et interventions et les coûts des soins de support et les coûts de transport des patients vers les établissements de santé. D’une manière générale, l’augmentation des coûts est principalement liée aux innovations (nouvelles approches de dépistages précoces, nouveaux dispositifs médicaux ou médicaments etc.). Le siècle dernier a vu apparaître de nombreux traitements anticancéreux systémiques dont les thérapies ciblées. Au Royaume Uni dans les années 70, on recensait environ 35 anticancéreux contre une centaine aujourd’hui.
Le coût des cancers peut également augmenter du fait d’une surconsommation de soins. Celle-ci peut être liée à l’utilisation de certaines techniques chez des patients pour lesquels elle ne serait pas adaptée. L’avènement de la médecine personnalisée pourrait permettre de réduire cette surconsommation de soins [6].
1.1.4.2 Enjeux économiques en France
Le financement de la prise en charge des cancers représente un enjeu économique majeur afin de garantir l’accès aux traitements à tous les patients.
L’émergence de progrès considérables dans la prise en charge des cancers via l’étude des tumeurs, de la génomique ou encore avec l’apparition de thérapies ciblées a ouvert la voie vers une médecine de précision, de plus en plus individualisée et dont les coûts augmentent. En 2013, 800 molécules de thérapies ciblées sont en cours de développement ou d’évaluation. En prenant l’hypothèse que 5 % de ces molécules seraient mises sur le marché dans les cinq prochaines années, on peut attendre une profonde évolution de la pratique clinique, des révolutions thérapeutiques mais aussi des impacts économiques qu’il convient d’anticiper.
Le Plan cancer précise la mise en place de mesures pour assurer une optimisation des organisations afin de garantir l’efficience et une adaptation des modes de financement aux défis de la cancérologie.
Afin de pouvoir financer les nouvelles innovations en dépit des contraintes budgétaires croissantes, il convient de savoir dégager des marges de manœuvre notamment grâce à un renforcement de la qualité des pratiques cliniques, au développement de la prise en charge ambulatoire ou encore par le maintien d’un haut niveau d’exigence dans les choix de financement de la recherche.
Les évolutions majeures dans les traitements médicamenteux imposent également de questionner les paradigmes actuels d’évaluation des médicaments, en ajoutant par exemple une dimension économique aux évaluations des technologies et programmes de santé [4].
1.1.5 Innovation : exemple des immunothérapies
1.1.5.1 Définition
L’oncologie est un domaine pour lequel la recherche est particulièrement dynamique et en constante évolution dans le but de trouver des thérapies innovantes et d’améliorer les conditions de prise en charge des patients.
En 1909, le chercheur Paul Ehrlich fait l’hypothèse d’une implication du système immunitaire dans la régulation de la formation des tumeurs. Depuis, les progrès scientifiques ont confirmé cette hypothèse et ont permis la découverte de molécules agissant sur le système immunitaire par diverses voies, offrant de nouvelles possibilités de traitement du cancer [7].
Les immunothérapies ou biothérapies sont des traitements utilisant des molécules du système immunitaire pour combattre des pathologies telles que les cancers, en stimulant les défenses immunitaires ou en apportant des molécules comme des anticorps humains recombinants pour aider le système immunitaire. Il existe différents modes de fonctionnement des immunothérapies selon la voie pharmacologique ciblée :
- les anticorps monoclonaux, qui sont des versions synthétiques des protéines du système immunitaire ;
- les inhibiteurs de points de contrôle, qui lèvent les freins du système immunitaire et augmentent la reconnaissance et l’attaque des cellules cancéreuses ;
- les vaccins anti-cancer, administrés pour permettre à l’organisme de démarrer une réponse immunitaire contre certaines pathologies.
1.1.5.2 Les anticorps monoclonaux
Un anticorps est une molécule qui circule dans l’organisme et se fixe sur une protéine spécifique de l’organisme appelée antigène entraînant le recrutement d’autres molécules de l’organisme et induisant la destruction de la cellule contenant l’élément antigénique [7]. Les anticorps monoclonaux se différencient par leur cible. On retrouve par exemple [8] :
- le trastuzumab (Herceptin®) qui cible l’HER2 et est indiqué dans le traitement du cancer du sein ;
- l’erbitux (cetuximab®), ciblant le récepteur du facteur épidermique de croissance EGFR, utilisé dans le traitement des cancers du côlon et des voies aérodigestives supérieures ;
- le rituximab (MabThera ®) qui cible la protéine CD20 à la surface des lymphocytes B, indiqué dans les hémopathies (lymphomes, leucémies lymphocytaires chroniques) ou en rhumatologie ;
- le bevacizumab (Avastin®), qui cible le facteur de croissance vasculaire (VEGF) et est indiqué dans le traitement des cancers colorectaux, pulmonaires, ovariens ou rénaux. Il existe de nombreuses voies pouvant être régulées par les anticorps monoclonaux [8]. Certains anticorps monoclonaux peuvent être conjugués à des molécules de chimiothérapie ou des particules radioactives. L’anticorps circule au sein de l’organisme et délivre une
substance de chimiothérapie (ou autre) à un endroit précis de l’organisme, ce qui potentialise l’effet antitumoral de la molécule et diminue l’incidence de ses effets indésirables.
Parmi les anticorps conjugués, on retrouve entre autres [9] :
- le brentuximab vedotin (Adcétris®), composé d’un anticorps anti-CD30 couplé à une molécule de chimiothérapie nommée MMAE et utilisé dans le traitement des lymphomes de Hodgkin et des lymphomes anaplasiques à grandes cellules ;
- le trastuzumab emtansine (Kadcyla®, T-DM1), composé d’un anticorps dirigé contre la protéine HER2 et de la molécule DM1 et indiqué dans le traitement des cancers du sein HER2 positifs.
1.1.5.3 Les inhibiteurs de points de contrôle [9]
Une des caractéristiques majeures du système immunitaire est sa capacité à reconnaître les molécules propres à l’organisme (« molécules du soi ») et les molécules étrangères à l’organisme qu’il peut ainsi éliminer. Pour reconnaître ces molécules, le système immunitaire utilise des points de contrôle (« checkpoints ») -- des molécules présentes sur certaines cellules immunitaires nécessitent une activation (ou une inactivation) afin d’initier une réponse immunitaire. Un des points de contrôle est le PD-1, présent sur les lymphocytes T. Lorsque le ligand PD-1 se lie à son récepteur PD-L1, situé sur la cellule tumorale un signal est envoyé au lymphocyte T qui va alors se détacher de la cellule et ne pas l’attaquer. Certaines tumeurs ont une forte concentration de PD-L1 ce qui leur permet d’échapper à l’attaque du système immunitaire.
Parmi les inhibiteurs de PD-1, on retrouve :
- le pembrolizumab (Keytruda®), indiqué dans le traitement des mélanomes avancés ; - le nivolumab (Opdivo®), indiqué dans le traitement des mélanomes métastatiques et
des cancers bronchiques non à petites cellules (stade IIIb ou IV). Parmi les inhibiteurs de PD-L1, on retrouve :
La découverte et le développement des immunothérapies apportent des progrès considérables et ces thérapies sont porteuses de nombreux espoirs dans les stratégies de lutte contre les cancers.
1.1.6 Conclusion
Toutes ces évolutions impliquent une organisation rigoureuse et réactive de l’évaluation de l’innovation afin qu’elle puisse être déployée le plus rapidement possible et être accessible au plus grand nombre de patients. Par ailleurs, pour assurer la durabilité du financement de ces innovations il apparaît primordial d’anticiper les dépenses qui les accompagnent. Anticiper, c’est ce que prévoit l’objectif 5 du Plan cancer : « accélérer l’émergence de l’innovation au bénéfice des patients », notamment par une surveillance de la pertinence des soins et l’anticipation de l’impact économique des innovations par la réalisation d’études médico-économiques [4].
D’autre part, le dernier accord-cadre signé entre le syndicat représentant des industries pharmaceutiques (LEEM) et le Comité économique des produits de santé (CEPS) pour la période 2016-2018 prévoit la création d’un comité de prospective des innovations médicamenteuses (CPIM). Ce Comité est chargé d’effectuer une veille et s’engage à fournir les éléments permettant d’appréhender l’arrivée des innovations thérapeutiques susceptibles d’avoir un impact budgétaire significatif pour les financeurs ou sur l’organisation des soins à horizon 5 ans [10].
1.2 Le coût du cancer en France
1.2.1 Chiffre global
En 2014, 5,349 milliards d’euros de dépenses liées à la prise en charge du cancer dans les établissements de court séjour ont été enregistrés. Les dépenses relatives aux molécules onéreuses, facturées en sus des prestations d’hospitalisation de court séjour se sont élevées à près de 1,597 milliards d’euros, soit une augmentation de ces dépenses de 15,5 % entre 2012 et 2014 [3].
1.2.2 Coût des anticancéreux
Dans le cadre de la tarification à l’activité, les spécialités pharmaceutiques particulièrement onéreuses sont facturées en sus des prestations hospitalières et sont inscrites sur une liste nommée « liste en sus », garantissant un remboursement à un taux de 100 % par l’assurance maladie.
Les dépenses d’anticancéreux représentent près de 50,5 % du coût total des molécules remboursées en sus des groupes homogènes de séjour (GHS) dans le secteur hospitalier public (CLCC et secteur privé non commercial inclus) et 81 % dans le secteur privé commercial. Parmi ces dépenses d’anticancéreux, les thérapies ciblées représentent 45 % des dépenses d’anticancéreux pour le secteur hospitalier public et 72 % pour le secteur hospitalier privé commercial.
En ville, les dépenses liées aux anticancéreux administrés par voie orale s’élèvent à 1,433 milliards d’euros dont 1,224 milliards d’euros en officine et 209 millions d’euros en rétrocession [11].
1.2.2.1 Exemples de molécules et leurs coûts [11]
Les dépenses liées au remboursement des molécules figurant sur la liste en sus des GHS se concentrent sur un faible nombre de molécules. En 2013, pour le secteur public, environ 94 % de ces coûts étaient répartis entre 10 molécules.
Parmi les molécules anticancéreuses de la liste en sus, six molécules représentaient 84 % des dépenses en 2013 comme le représente la Figure 1, ci-dessous.
Figure 1. Répartition (%) des dépenses des principales molécules anticancéreuses les plus prescrites de la liste en sus en 2013 [11]
Avec l’arrivée sur le marché de nouvelles molécules innovantes en oncologie, s’accompagnant généralement de prix élevés, cette tendance à la hausse des dépenses liées à la prise en charge des molécules de la liste en sus risque de s’accentuer.
1.2.3 Autres coûts
1.2.3.1 Coûts d’hospitalisation [3]
La prise en charge des cancers peut s’accompagner d’hospitalisations pour des motifs tels que la surveillance des personnes atteintes de cancers ou ayant des prédispositions au cancer, la prise en charge des complications ou des effets indésirables des traitements, la réalisation de prélèvements ou encore le traitement curatif, palliatif ou prophylactique des cancers.
Avec 48,7 % de séances en hospitalisation de jour, 10 % des hospitalisations ambulatoires et 13,4 % des hospitalisations complètes, l’activité de cancérologie représente près du quart de l’activité hospitalière globale en court séjour. Sur l’année 2014, près de 6,64 millions d’hospitalisations (séances et séjours) liées à la prise en charge du cancer ont été réalisées dans les établissements de Médecine Chirurgie Obstétrique (MCO). 1,147 millions de personnes ont été hospitalisées pour le diagnostic, la surveillance ou le traitement d’un cancer en 2014, ce qui représente une augmentation de 5 % par rapport à l’année 2010.
Bevacizumab 22% Rituximab 20% Trastuzumab 15% Pemetrexed 11% Cetuximab 8% Bortezomib 8% Autres molécules 16%
Dans les établissements MCO publics
Bevacizumab Rituximab Trastuzumab Pemetrexed Cetuximab Bortezomib Autres molécules
Dans les établissements MCO, l’activité de chimiothérapie (en termes de séances et séjours) représente 38,6 % des prises en charge pour cancer, et est assurée à plus de 50 % par les centres hospitaliers (28,5 % CH et 22,2 % CHU-R), à 28,9 % par les établissements privés commerciaux et à 14,3 % par les CLCC.
1.2.3.2 Coûts indirects
La notion de coûts indirects fait référence aux dépenses non médicales liées à une maladie ou un traitement tels que les coûts liés à la perte de productivité, aux arrêts de travail du patient ou des aidants, au coût des aides ménagères etc.
Dans un rapport de l’INCa [12], sur des données de 2004, les pertes de productivité liées aux arrêts maladie ont été estimées à 528 millions d’euros, par la méthode des « coûts de frictions », qui consiste à examiner les pertes de production dues à une maladie du point de vue de l’entreprise [13]. Les pertes de production potentielles du fait de la mortalité par cancer, ont été estimées à 17 milliards d’euros en 2004, par la méthode du « Flux de Revenus Actualisé », une approche considérant les individus comme des biens d’équipement qui fournissent un flux d’activités productrices sur un certain laps de temps.
1.3 La régulation des dépenses de santé
1.3.1 La maîtrise nationale des dépenses de santé
En 2014, la dépense courante de santé s’élève à 256,9 milliards d’euros soit 12,0 % du produit intérieur brut (PIB). La part consacrée aux médicaments est de à 33,9 milliards d’euros et celle consacrée aux soins hospitaliers (secteur public et privé) atteint 88,6 milliards d’euros [14]. En 2013, les dépenses attribuables à la prise en charge des cancers se sont élevées à 15,1 Md€ soit environ 10 % de la dépense totale. La dépense moyenne par an et par patient en 2013 est de 10 893 € au total pour un cancer actif dont 3 685 € de soins de ville et 6 663 € liés aux hospitalisations. Pour les cancers surveillés le montant par an et par patient s’élève à 966 € par an au total. Les dépenses d’hospitalisation représentent 55 % des dépenses attribuables aux cancers [15].
Les dépenses liées aux cancers évoluent dans une fourchette de 4 à 5 % par an et les coûts moyens de prise en charge ont augmenté de 3,6 % entre 2011 et 2013, enregistrant la plus forte hausse devant les maladies psychiatriques (+3,1 % par an) [15].
Dans son rapport d’activité de l’année 2014-2015, le CEPS indique que les anticancéreux sont la classe pharmaco-thérapeutique dont la croissance des ventes est la plus importante avec un chiffre d’affaire de près de 1,3 Md€ [16].
D’autre part, les coûts liés aux mesures de prévention des cancers ont également un impact significatif sur les dépenses de santé. Suite aux Plans cancer 2003-2007 et 2009-2013, les dépenses de dépistage des tumeurs ont doublé passant de 91 millions d’euros en 2003 à 179 millions d’euros en 2014 [17]. Néanmoins, le dépistage et le diagnostic précoce permettent de traiter de manière plus efficace et à des stades moins avancés de la maladie augmentant les chances de guérison ce qui permet in fine de générer des économies en évitant des dépenses.
La maîtrise des dépenses de santé combine les efforts de multiples acteurs qui se mobilisent pour surveiller et limiter l’augmentation des dépenses par le biais de lois, de mesures et d’évaluations des programmes et des technologies de santé.
1.3.1.1 Les lois de financement de la Sécurité sociale
Depuis 1996, le Parlement a un droit de regard sur les dépenses et l’équilibre financier de la Sécurité sociale, au travers le vote chaque année, des lois de financement de la Sécurité sociale (LFSS). Il peut se prononcer sur les grandes orientations des politiques de santé et de Sécurité sociale, sur leur mode de financement et notamment en fixant l’Objectif national de dépenses de l’assurance maladie (Ondam). L’objectif de ces lois est donc de prévoir les recettes et les objectifs de dépenses de la sécurité sociale afin de maîtriser les dépenses dans un contexte marqué par un déficit de 10,8 milliards d’euros pour le régime générale (RG) et le fond de solidarité vieillesse (FSV) de la Sécurité sociale, en 2015 [18].
Pour l’année 2016, un Ondam de 185,2 milliards d’euros a été fixé, soit un taux de progression de 1,75 % par rapport à 2015. Afin de respecter cet objectif, un effort d’économies de 3,4 Md€ est prévu et s’articule autour de quatre axes donc un concernant les produits de santé, à hauteur de 1 Md€ d’économie.
Dans son rapport de Juin 2016, la Commission des comptes de la Sécurité sociale (CCSS) actualise les estimations de dépenses d’assurance maladie sur base des réalisations de l’année 2015. L’arrivée des nouveaux médicaments anticancéreux a entraîné une progression des dépenses dès la fin 2015 significativement supérieure à ce qui avait été retenue lors de la construction de l’Ondam 2016 [19].
Pour atteindre les objectifs d’économies prévus dans la LFSS 2016 plusieurs mesures sont prévues dont l’amélioration de l’efficience de la dépense hospitalière à hauteur de 690 M€ sur les produits de santé et la promotion des génériques représentant un effort d’économie de 1 045 M€ [18].
1.3.2 La maîtrise des dépenses hospitalières
Dans un contexte marqué par la maîtrise des dépenses de santé au sein des établissements hospitaliers, l’augmentation du nombre de patients à traiter et des coûts des traitements de plus en plus élevés, plusieurs stratégies sont explorées pour limiter l’augmentation des dépenses, au niveau des structures hospitalières.
La poursuite du développement de la prise en charge des patients en ambulatoire est un des axes de la LFSS 2016 et représente un enjeu de 465 M€ d’économies pour l’année 2016 [18]. Une étude réalisée en 2008 par Lewden-Bernadal et al. sur la population de la Région Pays de Loire a montré que la prise en charge de la chimiothérapie anticancéreuse injectable à domicile permet de réaliser des économies de l’ordre de 130 € par séance en moyenne [20]. De plus, des mesures sont mises en place au sein des établissements de santé pour réduire les dépenses liées aux médicaments et notamment aux traitements de la liste en sus, qui recense de nombreuses spécialités d’oncologie. En Mars 2016, un nouveau décret relatif aux modalités de prise en charge des médicaments innovants et coûteux est entré en vigueur. Ce décret implique désormais une inscription des spécialités sur la liste pour chacune de leurs indications lorsqu’elles en ont plusieurs et non plus une inscription par molécule pour l’ensemble des indications.
Il existe également des mesures visant à limiter la surconsommation de soins ou le gaspillage. Le respect des recommandations de bonnes pratiques et des contrats de bon usage permet d’éviter une part de dépenses non adaptées et inutiles. Pour certains produits, en oncologie
ou en anesthésiologie par exemple, des pertes de produits peuvent exister et une gestion optimisée représente une opportunité de générer des économies [21].
Ainsi les établissements de santé sont des acteurs majeurs dans la régulation des dépenses de santé tant au niveau des actes réalisés que des médicaments délivrés et administrés.
1.3.3 La maîtrise des dépenses médicamenteuses
1.3.3.1 Le Comité économique des produits de santé (CEPS) [16]
Le Comité économique des produits de santé contribue à l’élaboration de la politique du médicament par la mise en œuvre des orientations ministérielles qu’il reçoit. Le CEPS a pour compétence de négocier et fixer les prix des produits de santé et de procéder à la révision et aux baisses des prix pour contribuer à l’effort d’économie prévu par l’Ondam.
Pour l’année 2014, les mesures d’économies ayant porté sur le périmètre des médicaments de la liste en sus ont permis de réaliser une économie de 80 M€ dont la grande majorité suite à des baisses de tarifs de responsabilité des anticancéreux (à hauteur de 59,5 M€).
Le CEPS joue donc un rôle de régulateur des dépenses liées aux cancers et plus particulièrement des dépenses liées à la prise en charge médicamenteuse de cette pathologie. Ce rôle est clef dans un contexte marqué par l’arrivée de nombreuses innovations s’accompagnant de coûts élevés. Les négociations complexes menées au sein du Comité ont permis l’accès à tous les médicaments innovants arrivés au cours des trois dernières années.
1.3.3.2 La Commission évaluation économique et de santé publique (CEESP)
La Commission évaluation économique et de santé publique (CEESP) a été mise en place par le décret du 2 octobre 2012 relatif aux missions médico-économiques de la Haute Autorité de Santé (HAS) avec pour objectif de contribuer à ce que la mesure de l’intérêt pour la société d’une stratégie ou d’un produit soit prise en compte dans les décisions les concernant. La CEESP s’appuie sur les travaux du Service d’évaluation économique et de santé publique (SEESP). L’évaluation passe par la comparaison des moyens employés avec les résultats obtenus permettant d’apprécier l’efficience [22].
Lorsqu’un produit de santé revendique une amélioration du service attendu ou une amélioration du service médical rendu élevée (de niveau I, II ou III) et est susceptible d’avoir
un impact significatif sur les dépenses de l’assurance maladie, le laboratoire pharmaceutique doit déposer un dossier d’efficience qui sera évalué par la CEESP. La CEESP émet un avis sur l’efficience prévisible ou constatée en se fondant sur une analyse médico-économique telles qu’une analyse coût-efficacité (ACE) ou coût-utilité (ACU) [23].
1.4 Conclusion
L’augmentation de l’incidence des cancers et l’apparition de nouveaux traitements et stratégies de prise en charge innovantes et souvent couteuses font émerger de nouvelles dépenses. Ainsi, il convient de s’intéresser à la régulation des dépenses de santé liées à la prise en charge des cancers pour assurer le traitement de tous les patients et pérenniser le financement de notre système de santé.
La limitation des dépenses passe par des mesures prévisionnelles telles que les lois annuelles de financement de la Sécurité sociale mais également par des mesures de régulation telles que la création de la CEESP pour évaluer les enjeux économiques de la mise sur le marché des traitements innovants. Par ailleurs, des Plans cancers quinquennaux définissent les axes principaux de la lutte contre le cancer et se penchent également sur les questions relatives au financement de l’innovation.
Enfin, les établissements de santé observent également une hausse de leurs frais et le budget consacré aux anticancéreux représente une part importante des dépenses en médicaments. Il devient alors essentiel de mettre en place des mesures visant à réguler ces dépenses et plus particulièrement celles qui pourraient être évitées.
2 Gestion des reliquats en milieu hospitalier
Les reliquats d’anticancéreux peuvent être une source de gaspillage dans les établissements de santé, et entraîner des coûts de pertes considérables. Cette problématique est soulevée dans de nombreux pays et il existe des publications détaillant les bénéfices de la mise en place de techniques visant à limiter les pertes. Parmi ces méthodes, on retrouve notamment les arrondis de dose, le partage de flacon, la gestion du flux de patients dans les établissements de santé ou encore la réalisation d’études de stabilité permettant d’augmenter la durée de conservation de certaines molécules.Limiter les pertes de reliquats est un enjeu qui s’intègre dans l’organisation des pharmacies hospitalières en France et les pertes de reliquats sont limitées par la mise en place de mesures d’optimisation du circuit des chimiothérapies.
2.1 Introduction
2.1.1 Définition
Les anticancéreux ont un mode de prescription particulier dû à un index thérapeutique étroit, c’est-à-dire une proximité de la dose efficace et de la dose toxique. Ainsi les doses prescrites sont individualisées afin de garantir l’administration au patient de la dose efficace mais non toxique. Par conséquent, les posologies des anticancéreux sont fréquemment calculées en dose par unité de poids ou de surface corporelle.
Les anticancéreux ont une durée de stabilité limitée dans le temps dépendante du principe actif, de ses excipients ou de facteurs environnementaux tels que les conditions de conservation (température, exposition à la lumière) [24].
De plus, les anticancéreux sont généralement conditionnés sous un nombre limité de formats de flacons. Il en résulte que lors de la préparation de spécialités anticancéreuses la quantité contenue dans le flacon du produit peut ne pas correspondre à la dose exacte à administrer au patient. Dans ce cas, un reliquat de produit demeure dans le flacon après prélèvement de la dose nécessaire. Ce reliquat ne peut être conservé que pendant la durée de stabilité de la molécule et en l’absence d’administration à un autre patient sur cette période, il sera détruit.
Lorsqu’il s’agit de molécules onéreuses, la perte de ce reliquat peut engendrer des dépenses significatives pour l’hôpital et pour l’assurance maladie. Il apparaît alors essentiel d’essayer de réduire au maximum la perte de ces reliquats pour limiter le gaspillage.
2.1.2 Le point de vue de la CEESP
La question de l’impact économique de la perte de reliquat est une problématique soulevée par la CEESP lors des auditions des laboratoires pharmaceutiques présentant leurs évaluations médico-économiques. En l’absence de données publiées, les laboratoires peuvent rencontrer des difficultés pour estimer l’impact des pertes sur le ratio différentiel coût-résultat (RDCR), qui est un outil d’aide à la décision utilisé pour les négociations de prix. Des analyses de sensibilités accompagnent les études médico-économiques et permettent de tester différents scénarios fondés sur des hypothèses telles que la prise en compte d’une perte de 100 % des reliquats, de 0 % ou une valeur intermédiaire de 50 % de perte.
Cette problématique a notamment été soulevée et explicitée par la CEESP dans l’avis d’efficience de Kadcyla® (trastuzumab emtansine).
2.1.2.1 Avis d’efficience de Kadcyla®
Le laboratoire Roche a déposé en 2014 un avis d’efficience pour la spécialité Kadcyla® (trastuzumab emtansine), pour laquelle il revendiquait une ASMR de niveau II en termes d’efficacité, de tolérance et de qualité de vie, dans la prise en charge du cancer du sein localement avancé ou métastatique HER2 positif préalablement traité par du trastuzumab et un taxane, séparément ou en association [25].
L’étude médico-économique de type coût-utilité a permis de conclure à un ratio différentiel pour le trastuzumab emtansine (T-DM1) par rapport à l’association lapatinib + capecitabine de 191 661 €/QALY au prix revendiqué par l’industriel.
Dans les conclusions de la CEESP sur l’efficience du T-DM1, l’absence de prise en compte des pertes de reliquat est soulignée. En effet, l’industriel n’a pas pris en compte ce paramètre lors de la modélisation, l’hypothèse d’une absence de perte de reliquat est néanmoins jugée peu plausible par la CEESP, malgré une gestion optimisée dans les centres de cancérologie. La prise en compte des pertes augmente le coût du traitement.
Dans son analyse économique, l’industriel a considéré une absence de gaspillage de produit compte tenu de la pratique française, en se référant à des courriers de la Direction de l’Hospitalisation et de l’Organisation des Soins (DHOS) aux directeurs des Agences Régionales de Santé (ARS) (présenté en annexe 1). Ces courriers précisent les modalités d’utilisation des fractions restantes des UCD (Unité Commune de Dispensation*), soit l’utilisation de la
quantité restante pour la réalisation des préparations suivantes. Néanmoins, dans cette hypothèse l’industriel ne tient pas compte de la durée de conservation de 24h du produit, de l’absence d’utilisation dans d’autres indications que celle présentée ni de la taille restreinte de la population cible (2 250 patients par an). En considérant ces éléments il apparaît que le reliquat généré ne peut être systématiquement administré à un autre patient ce qui réfute l’hypothèse du laboratoire.
Un scénario prenant en compte les pertes de reliquat du T-DM1 a été simulé par la HAS. Un poids moyen de 64,8 kg a été considéré (poids moyen des patients atteints de cancer du sein métastatique en France), correspondant à une dose par cycle de traitement de 233,28 mg (3,6 mg/kg x 64,8 kg) soit l’utilisation d’un flacon de 160 mg dans sa totalité et d’un flacon de 100 mg dont le quart (26,72 mg) ne sera pas utilisé. Ce scénario entraîne une augmentation du coût de traitement de 11,5 % sur l’horizon temporel de 10 ans retenu dans l’analyse. Suite à l’échange technique avec la CEESP l’industriel a fourni une analyse tenant compte de la perte de reliquat pour les médicaments utilisés en 3ème ligne et plus. Le coût de l’état
« progression » a été réévalué à 892,50 € par cycle au lieu de 837,80 € sans prendre en compte les pertes.
2.2 Gestion des reliquats en milieu hospitalier
Dans un contexte de recherche d’une maîtrise des dépenses de santé en milieu hospitalier, une gestion optimisée des reliquats est une solution pour limiter la croissance des dépenses. L’impact direct de l’augmentation des dépenses liées à la perte des reliquats pour les hôpitaux est limité puisque les molécules onéreuses sont facturées en sus des GHS garantissant une prise en charge par la sécurité sociale à 100 % lorsqu’elles sont utilisées conformément aux
contrats de bon usage (CBU). Il n’en demeure pas moins que la nécessité de limiter la progression des dépenses conduit les pharmaciens hospitaliers à rechercher des solutions pour réduire les pertes de produit [24].
2.2.1 Techniques de minimisation des pertes
Dans le but de limiter le gaspillage des flacons d’anticancéreux, plusieurs stratégies peuvent être adoptées et mises en œuvre au sein des établissements de santé.
2.2.1.1 Gestion du flux de patient
Une méthode parfois utilisée au sein des établissements de santé pour limiter les pertes de reliquat consiste à planifier les administrations de chimiothérapie de sorte que les patients se présentent dans une fenêtre de temps compatible avec les durées de stabilité des molécules. Ainsi, pour des molécules ayant une stabilité de 24h, les patients se présenteraient sur une même journée afin que le reliquat généré lors d’une préparation pour un patient puisse être utilisé pour la préparation de l’injection du patient suivant.
Cette méthode nécessite une implication des médecins prescripteurs et des infirmières. Elle semble relativement simple à mettre en pratique, lorsque les patients reçoivent leur traitement à l’issue de la consultation avec l’oncologue et que les médecins ont des créneaux de consultation définis dans leurs emplois du temps. Néanmoins, cette technique nécessite une coordination entre les différents acteurs et il se peut que certains patients aient des contraintes de temps ou de locomotion qui pourraient compliquer cette organisation. D’autre part, cette technique est dépendante de la file active de patients des établissements, et peut être plus difficile à mettre en œuvre dans des petites structures ayant un faible flux de patients.
Il n’existe peu de données dans la littérature permettant d’apprécier la facilité de mise en place de cette organisation ni de quantifier les économies engendrées par cette pratique.
2.2.1.2 Arrondis de doses
Le concept d’arrondis de doses ou « dose banding » est originaire du Royaume Uni où il est très répandu. Plumridge [26] définit le concept comme un « système dans lequel, après un accord entre les prescripteurs et les pharmaciens, les doses des médicaments anticancéreux
injectables calculées sur une base individuelle sont arrondies afin de déterminer des « intervalles » standards. Le maximum de variations entre les doses calculées et les « intervalles » standards ne doivent pas excéder plus ou moins 5 % de la dose initialement calculée. Des séries de seringues ou de perfusions sont préparées par la pharmacie ou par des industriels permettant l’administration de ces doses standards ».
La plupart des protocoles de chimiothérapies sont basés sur un dosage en fonction de la surface corporelle bien que de nombreuses études démontrent une variabilité individuelle associée à un dosage en fonction de la surface corporelle. En dépit de cette variabilité, la pratique courante des cliniciens consiste en la prescription de doses calculées au milligramme près, basée sur la surface corporelle et arrondies à deux décimales. Le calcul de doses précises implique une organisation rigoureuse et avec l’arrivée de nouveaux anticancéreux onéreux, une application judicieuse du concept d’arrondis de doses sans effets délétères pour le patient pourrait générer des économies de ressources non négligeables [27].
Par ailleurs, La fabrication de doses standards permet au centre hospitalier de générer des économies non seulement par l’utilisation de l’intégralité des flacons d’anticancéreux mais également par la possibilité de remise en stock des poches non utilisées lors d’éventuelles annulations de cure de chimiothérapie, sous réserve de respect des conditions optimales de conservation [28].
L’étude de Dooley et al. [27], s’est intéressée aux implications cliniques et économiques de la pratique de l’arrondi de dose. La proportion de patients pour qui une dose arrondie à la quantité supérieure disponible dans le flacon crée une variation inférieure à 5 % par rapport à la dose prescrite est de 89.5 % pour le docétaxel, 60.4 % pour la doxorubicine liposomale, 99.4 % pour la gemcitabine, 34 % pour l’oxaliplatine et 56.3 % pour le vinorelbine. D’autre part, cette pratique permet une réduction des coûts de 4 à 14.2 % selon les molécules. L’étude australienne de Field et al. [29], a estimé les économies théoriques réalisées par des arrondis de doses d’oxaliplatine, dans le cancer colorectal et a recueilli les appréciations des cliniciens quant à cette pratique. Les patients pour lesquels une variation de dose égale ou inférieure à 10 % permettait d’aboutir à une dose de 150 mg (correspondant à un flacon de 100 mg et un de 50 mg) ont été inclus. Cela correspondait à une surface corporelle de 1.77-1.92 m² résultant en une dose d’oxaliplatine de 150-65 mg. Un coût de 363.75 AU$ pour un
flacon de 50 mg d’oxaliplatine et de 688.11 AU$ pour un flacon de 100 mg a été considéré. L’étude a permis d’estimer un montant d’économies pour l’hôpital de l’ordre de 51 898 AU$ sur une année, extrapolé à la population australienne, ces économies sont estimées à 2.5 millions d’AU$.
L’étude de Winger et al. [30], réalisée rétrospectivement sur une période de trois mois a permis d’identifier les économies réalisées par des arrondis de doses sur sept molécules de chimiothérapies (aldesleukin, bevacizumab, cetuximab, denileukin diftitox, gemtuzumab, rituximab et trastuzumab). L’application d’un arrondi de doses dans un intervalle de 10 % par rapport à la dose prescrite sur 126 préparations a permis de réduire de 42 % les pertes de reliquat. Néanmoins, les doses de trastuzumab prescrites ne correspondaient pas aux critères définis pour la mise en pratique des arrondis de dose du fait d’agents conservateurs permettant la réutilisation des reliquats de produits. L’étude précise qu’un intervalle de 10 % par rapport à la dose prescrite est généralement retenu pour les agents anticancéreux biologiques et de 5 % pour les agents cytotoxiques car ils sont généralement prescrits à une dose proche de la dose maximale tolérée.
Le « dose banding » permet de réutiliser plus facilement les reliquats de produit et ainsi de réduire le gaspillage et de générer des économies. De plus, il permet de réduire le temps d’attente des patients entre la prescription et l’administration du produit en permettant une préparation à l’avance. En regroupant la préparation des anticancéreux, cette technique permet aux différents acteurs des unités de préparation et reconstitution des chimiothérapies de gagner du temps et de réaliser un contrôle qualité plus minutieux que lors de préparations extemporanées (allongement du temps de mise à disposition, perte de produit).
2.2.1.3 Etudes de stabilité
Les médicaments anticancéreux prêts à l’emploi ou reconstitués subissent des contraintes de fabrication, de conservation ou d’administration. Des paramètres tels que les excipients, la forme chimique du principe actif, le solvant de dilution ou de reconstitution ou encore les conditions de conservation (température, exposition à la lumière) ont une influence sur la durée de stabilité de l’anticancéreux. Ainsi la réalisation hospitalière des préparations injectables nécessite de disposer de données de stabilité fournies par le laboratoire pharmaceutique et renseignées dans le Résumé des Caractéristiques du Produit (RCP) des
molécules concernées. Pour certains anticorps monoclonaux tels que le nivolumab, le pembrolizumab ou le trastuzumab emtansine, la durée de stabilité est fixée à 24h. La préparation de ces traitements dans des conditions aseptiques permet de s’affranchir de toute contamination microbiologique et de nouvelles données de stabilité peuvent être générées pour permettre au pharmacien hospitalier d’organiser et de valider la fabrication des préparations de chimiothérapie dans des conditions optimales tout en limitant les pertes de produit [24].
Bien que les RCP précisent les durées de conservation, en pratique, sur la base d’études de stabilité réalisées en interne ou issues de la littérature, les pharmaciens hospitaliers peuvent augmenter les durées de péremption des médicaments anticancéreux après ouverture ou reconstitution dans leur conditionnement d’origine. En 1994, Walker et al. [31] avaient montré qu’une extension appropriée et justifiée des durées de péremption des anticancéreux après ouverture permettait une réduction des déchets sans affecter l’efficacité et la tolérance des chimiothérapies.
2.2.1.4 Temps consacré à la gestion des reliquats
La gestion des reliquats en milieu hospitalier nécessite une attention particulière des équipes de la pharmacie à usage interne. En effet, la réutilisation des reliquats requiert par exemple la saisie de fiches informatisées, l’étiquetage des produits ouverts pour renseigner la date et l’horaire d’ouverture, la gestion des réfrigérateurs, la vérification fréquente des dates de péremption etc.
Dans une étude réalisée au sein de l’UCBO du CHRU de Tour, Renaud Respaud [24] a estimé à 150h le temps supplémentaire nécessaire à la gestion des reliquats pour les pharmaciens et 194h pour les préparateurs hospitaliers, pour une activité annuelle de 22 555 préparations anticancéreuses injectables ayant générées 6 323 reliquats. Ce volume horaire représente le temps supplémentaire pour la saisie des fiches de fabrication avec des reliquats (87,6h pour les pharmaciens et 131,4h pour les préparateurs) ainsi que temps consacré à diverses tâches liées aux reliquats (63h). Cela représente un coût supplémentaire de 9,5 k€ correspondant à un coût de 1,8 € par reliquat utilisé et donc 1,2 % des économies réalisées sur la période considérée.
2.2.1.5 Conclusions
Au sein des établissements de santé, des mesures telles qu’une gestion du flux de patients, la réalisation d’études de stabilité ou d’arrondis de doses peuvent permettre de réduire les pertes et de diminuer les coûts liés au gaspillage. Toutefois, la mise en place de ces stratégies peut parfois s’avérer difficile et dépend de l’activité des centres et des services de cancérologie ainsi que de l’implication des prescripteurs ou de la taille des établissements.
2.2.2 Recommandations à l’hôpital
2.2.2.1 Circulaire DHOS
Dans un courrier de la DHOS (cf. Annexe 1), daté du 27 février 2007, la question de la gestion hospitalière des reliquats de produit est abordée.
Cette lettre apporte des précisions sur l’utilisation des logiciels FichComp et FichSup que les établissements de santé doivent transmettre aux autorités de santé et rappelle les modalités de renseignement des médicaments de la liste en sus dans le logiciel FichComp pour permettre le remboursement de ces produits.
D’autre part, la lettre soulève la problématique des médicaments onéreux dont le dosage de dispensation ne correspond pas à la dose prescrite devant être administrée. La règle qui s’applique est alors la suivante :
« Ces médicaments sont préparés de façon centralisée à la pharmacie de l'établissement. Il
s'agit le plus souvent de médicaments cytotoxiques préparés en unité centrale. La fraction restante d'une UCD (Unité Commune de Dispensation) après réalisation d'une préparation donnée, est employée pour la préparation suivante. Si ces deux préparations concernent des séjours différents, la quantité portée dans le fichier FichComp est exprimée sous une forme fractionnaire pour chacun des deux séjours concernés. FichSup permet également la saisie de quantités fractionnaires, le cas échéant ».
Une exception à cette règle est néanmoins précisée et concerne les produits pour lesquels les conditions de conservation ne permettent pas une réutilisation pour la deuxième préparation administrée au patient, en raison de la stabilité ou du risque microbiologique. Dans ce cas, le reliquat doit être détruit et la quantité saisie dans le logiciel FichComp correspondant à la
première préparation est celle de la totalité du produit utilisé pour la réalisation de la préparation (exprimée en nombre entier d’UCD). La DHOS précise que cette possibilité n’est acceptable que dans ce cas de figure et que des contrôles peuvent être réalisés.
Par ailleurs, le courrier précise le caractère exceptionnel de cette pratique dans les établissements où des conditions de qualité et de sécurité de réalisation de ces préparations sont réunies et où les flux de patients sont suffisants pour réduire les délais entre les préparations.
La DHOS encourage donc fortement le partage de reliquat notamment par une gestion de la file active de patient au sein des établissements de santé. Néanmoins, à ce jour aucune recommandation ou directive n’est établie en France concernant la mise en place de pratiques hospitalières pour réduire le gaspillage telles que les arrondis de doses, ou la réalisation d’étude de stabilité en interne.
2.2.3 Gestion des reliquats dans les établissements de santé français
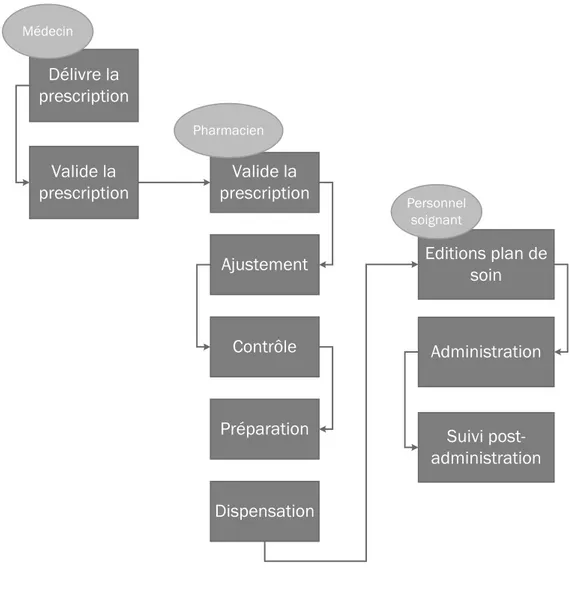
Des entretiens qualitatifs ont été réalisés auprès de pharmaciens hospitaliers de plusieurs établissements de santé en France afin de recueillir des données sur l’organisation interne du département d’oncologie, du circuit des anticancéreux et sur la gestion des reliquats. Pour obtenir une vue d’ensemble, différentes structures ont été contactées : un centre hospitalo-universitaire (CHU de Rennes) et deux centres de lutte contre le cancer (le Centre Eugène Marquis à Rennes et l’institut Gustave Roussy à Villejuif). Des entretiens d’une durée de 1h à 1h30 ont été réalisés auprès des pharmaciens d’unité de préparation des anticancéreux, en charge de la gestion du circuit des anticancéreux. Ces entretiens ont abordé plusieurs thématiques :
- présentation du pôle anticancéreux et de l’activité d’oncologie de l’établissement ; - description du circuit des anticancéreux : de la prescription à la délivrance ;
- présentation de l’activité sur le nivolumab, le pembrolizumab et le trastuzumab emtansine ;
2.2.3.1 CHU de Rennes
Dans le cadre de l’entretien réalisé au centre hospitalier universitaire de Rennes, Mme Marie-Antoinette LESTER a été contactée afin de témoigner de l’activité d’oncologie à Rennes répartie sur les sites de l’hôpital Sud et de Pontchaillou.
◊
Présentation du CHU de RennesLe CHU de Rennes comporte plus de 50 services de médecine, chirurgie, biologie et imagerie et couvre de nombreuses spécialités telles que la chirurgie cardiaque, la neuroradiologie, la neurochirurgie, l’oncologie ou encore les maladies rares.
L’oncologie fait partie des axes stratégiques du projet d’établissement du CHU pour répondre à la progression constante des séjours avec mention d’un diagnostic de cancer (de +5 à 6 % par an). Pour cela, le CHU développe la cancérologie personnalisée et met au cœur de cet enjeu la qualité de prise en charge en oncologie via la réalisation d’audits de programme personnalisé de soins (PPS), des formations à destination du personnel soignant (en collaboration avec le centre Eugène Marquis) et l’amélioration des conditions de réalisation et de la traçabilité des avis rendus lors des réunions de concertation pluridisciplinaire. Par ailleurs, le CHU fait partie de l’Institut Rennais de Cancérologie (regroupant le CLCC Eugène Marquis, le CHU de Rennes et la clinique mutualiste de La Sagesse à Cleunay).
Le CHU de Rennes est également impliqué dans la recherche en cancérologie et est labellisé comme fédération hospitalo-universitaire du projet CAMin (« Cancer Microenvironnement et Innovation »).
Les patients atteints d’un cancer représentent 9 % des patients du CHU en 2014 et 20 963 séjours concernent des patients atteints de cancer [32].
Figure 2 Les 4 axes du Plan d'action de la filière cancérologie au CHU [32]
◊
Présentation du pôle de pharmacie oncologiqueL’activité d’oncologie du CHU de Rennes se répartit entre deux sites : Pontchaillou et l’hôpital Sud.
Activité du CHU de Rennes en oncologie
Le site de Pontchaillou couvre principalement des activités d’hématologie et un peu d’oncologie thoracique, représentant environ 20 000 préparations par an. L’hôpital Sud a une activité plus centrée sur l’oncopédiatrie et prend en charge un peu d’hématologie, pour environ 7 000 préparations par an.
Principaux cancers traités
Les principaux cancers traités sont des affections hématologiques (myélomes, lymphomes) et des cancers du poumon sur le site de Pontchaillou et sur le site de l’hôpital Sud les types de cancers pédiatriques sont plus variables avec une prépondérance de leucémies aigues lymphoïdes et l’activité d’hématologie couvre exclusivement des myélomes.
Personnel des unités de reconstitution des chimiothérapies
Le pôle de pharmacie oncologique du site de Pontchaillou emploie un pharmacien assistant à plein temps, un interne en pharmacie et 4,5 préparateurs en pharmacie. Un pharmacien assistant à mi-temps, un interne en pharmacie et 2 préparateurs sont présents sur le site de
Axe n°1
•Développer la qualité de la prise en charge en oncologie au CHU et la cancérologie personnalisée
Axes n°2
•Développer le groupement de coopération sanitaire "institut rennais de cancérologie" et le travail collaboratif avec le Centre de lutte contre le cancer Eugène Marquis
Axe n°3
•Participer à la structuration des prises en charge au niveau territorial et régional
Axe n°4
![Figure 1. Répartition (%) des dépenses des principales molécules anticancéreuses les plus prescrites de la liste en sus en 2013 [11]](https://thumb-eu.123doks.com/thumbv2/123doknet/7631904.235704/20.892.109.763.153.548/figure-répartition-dépenses-principales-molécules-anticancéreuses-prescrites-liste.webp)