Étude d’association pangénomique du trait SMR
« Suppressed Mite Reproduction » dans des colonies
d’Apis mellifera au Québec
Mémoire
Laurence Auger
Maîtrise en biologie
Maître ès sciences (M. Sc.)
Sous la direction de :
Nicolas Derome, directeur de recherche
Pierre Giovenazzo, codirecteur de recherche
Résumé
La littérature s’accorde généralement pour désigner l’ectoparasite Varroa destructor comme la plus
importante menace pour l’Abeille mellifère (Apis mellifera). Actuellement, la varroase est contrôlée
principalement par l’utilisation de traitements acaricides qui présentent un risque de contamination
des produits de la ruche et de l’environnement. Dans certaines colonies d’A. mellifera, on observe un
comportement hygiénique qui réduit l’infestation des varroas, le VSH Varroa Sensitive Hygiene, et
qui est associé à une baisse de la reproduction des varroas dans le couvain d’abeilles, le Supressed
Mite Reproduction (SMR). L’identification de l’architecture génomique qui régule cette résistance aux
varroas permettrait d’assister à l’accélération de son évolution dans l’ensemble des populations
d’abeilles domestiques et à réduire les dommages causés par le parasite. Ce projet de maîtrise visait
à mettre en lumière la relation entre le génome et ce phénotype quantitatif de résistance par une
étude d’association pangénomique sur un échantillon de colonies d’A. mellifera du Québec provenant
de cinq sites différents. Une technologie de génotypage par séquençage (GBS) a été utilisée pour
identifier à l’échelle du génome entier des milliers de marqueurs à partir de polymorphismes
nucléotidiques singletons (SNPs). Puis, l’association des marqueurs avec le phénotype SMR a été
testée avec des modèles statistiques : le modèle linéaire mixte (MLM) et le modèle linéaire mixte
multi-locus (MLMM) par des outils bio-informatiques. Ce projet se joint à d’autres tentatives de
produire des outils de sélection plus efficaces pour les apiculteurs afin de lutter contre la varroase.
Abstract
The literature generally agrees that ectoparasite Varroa destructor is the most important threat to the
honey bee (Apis mellifera). Currently, varroa is controlled primarily by acaricide treatments that
present a risk of contamination of hive products and the environment. In some colonies of A. mellifera
is a hygienic behavior that reduces varroa mite infestation, VSH "Varroa Sensitive Hygiene", and is
associated with a decrease in the reproduction of varroa mites in bee brood, "Supressed Mite
Reproduction" (SMR). Identifying the genomic architecture that regulates this resistance to varroa
mites would help to accelerate its evolution in all honeybee populations and reduce the damage
caused by the parasite. This master’s project aimed to shed light on the relationship between the
genome and this quantitative resistance phenotype by a genome-wide association study on a sample
of A. mellifera colonies taken from five different sites across Quebec. Genotyping sequencing (GBS)
technology has been used to identify thousands of markers on the whole genome scale from single
nucleotide polymorphisms (SNPs). Then the association of the markers with the SMR phenotype was
tested with statistical models: the mixed linear model (MLM) and the mixed linear multi-locus model
(MLMM) with bioinformatic tools. This project joins other attempts to produce more effective breeding
tools for beekeepers to control varroosis.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... vii
Liste des abréviations, sigles, acronymes ... viii
Remerciements ... x
Introduction générale ... 1
Chapitre 1 : Revue de littérature ... 2
1.1 Apis mellifera ... 2
1.1.1 Classifications et origines ... 2
1.1.2 Biologie ... 4
1.1.3 Génétique d’Apis mellifera ... 7
1.1.4 Mortalité des abeilles ... 8
1.2 Varroa destructor ... 9
1.2.1 Biologie ... 9
1.2.2 Varroase ... 13
1.2.3 Contrôle actuel du Varroa ... 13
1.3 Résistance à V. destructor chez Apis mellifera ... 15
1.3.1 Trait SMR ... 15
1.3.2 Comportement VSH ... 15
1.3.3 Trait quantitatif ... 17
1.3.4 Études génomiques de la résistance aux varroas ... 19
1.4 Les études d’association pangénomiques ... 22
1.4.1 Comment fonctionne une étude d’association? ... 22
1.4.2 Étapes d’une étude d’association... 25
1.5 Buts et hypothèses du projet ... 45
Chapitre 2 : Étude d’association pangénomique du trait SMR dans des colonies d’A. mellifera au Québec .... 46
2.1 Méthodologie ... 46
2.1.1 Échantillonnage ... 46
2.1.3 Évaluation du génotype ... 49 2.1.4 Association ... 50 2.2 Résultats ... 50 2.2.1 Phénotype ... 50 2.2.2 Génotypage ... 54 2.2.3 Association ... 57 2.3 Discussion ... 73 2.3.1 Résultats obtenus ... 73
2.3.2 Le problème de la puissance statistique ... 78
Conclusion ... 83
Bibliographie ... 86
Annexe A : Phénotypes des colonies échantillonnées ... 96
Annexe B : Relations entre les individus ... 98
Annexe C : Correction des valeurs p ... 101
Liste des figures
Figure 1. Cycle reproducteur de V. destructor dans une cellule ouvrière d’Apis mellifera (adapté de
Rosenkranz et al. 2010) ... 11
Figure 2. Morphologie de Varroa destructor ... 12
Figure 3. Graphique de Manhattan avec mauvais (graphique du haut) et bon (graphique du bas) contrôle des faux-positifs. (Tiré de Segura, 2016). ... 44
Figure 4. Caractéristiques des stades de développement du couvain d’Apis mellifera et les stades de développement attendus de la progéniture du Varroa associés. (adapté de COLOSS BEEBOOK volume I: Standard methods for Apis mellifera Research) ... 48
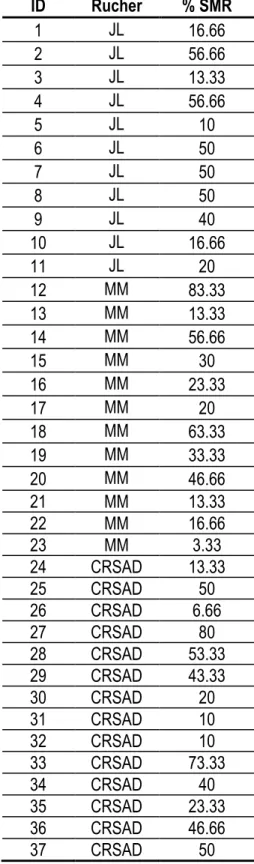
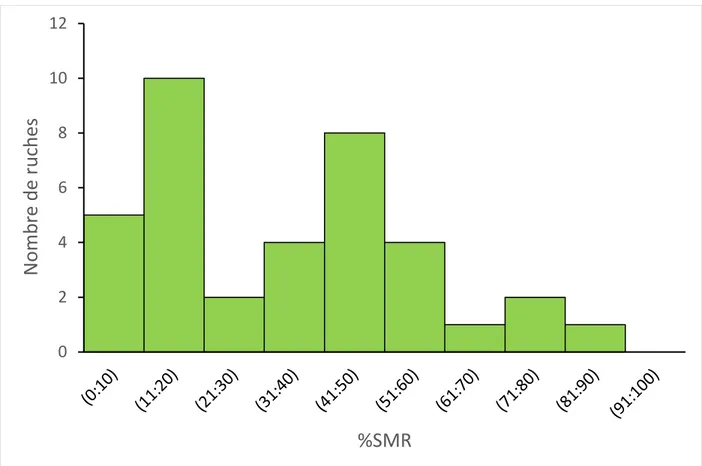
Figure 5. Distribution du trait SMR (en %) des 37 colonies après l’évaluation phénotypique ... 53
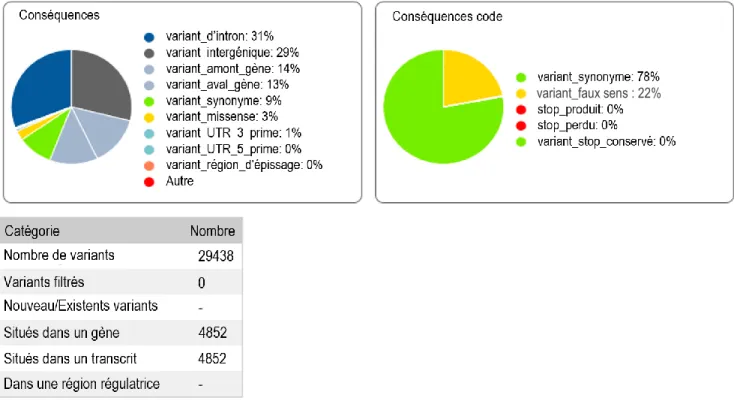
Figure 6. Prédiction des effets des variations nucléotidiques trouvées par l’analyse génomiques des 37 colonies tests ... 55
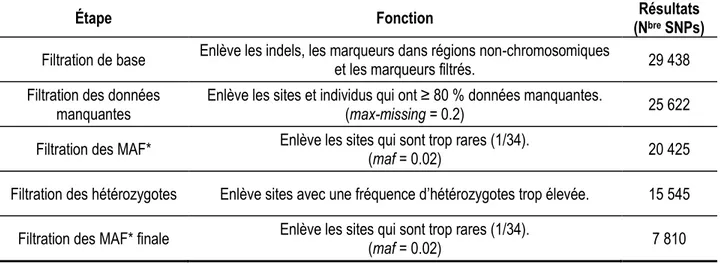
Figure 7. Représentation graphique de la matrice de parenté des colonies (N = 34) ... 58
Figure 8. Arbre phylogénétique de la population étudiée produite avec TASSEL 5.0... 59
Figure 9. Graphique des résultats des tests statistiques GLM... 62
Figure 10. Graphiques des résultats des tests statistiques MLM avec TASSEL ... 65
Figure 11. Graphiques des résultats des tests statistiques MLM avec GenABEL ... 66
Figure 12. Distribution des valeurs p pour l’ensemble des marqueurs (N = 7810) pour les tests MLM . 67 Figure 13. Graphique de lambda pour le test MLMM avec GAPIT ... 70
Figure 14. Graphique Manhattan du test MLMM avec GAPIT. ... 71
Figure 15. Puissance statistique relative à l’erreur de type I (α) pour la population et les marqueurs utilisés dans l’étude... 72
Liste des tableaux
Tableau I. Répartition des sous-espèces d’Apis mellifera en groupes selon leurs origines
géographiques ... 3 Tableau II. Comparaison des temps de développement du couvain des différentes castes d’Apis mellifera du stade d’œuf jusqu’à l’émergence de la cellule operculée (adapté de Bertholf, 1925). ... 6 Tableau III. Régions génomiques et gènes candidats potentiellement associées au comportement VSH et/ou au trait SMR trouvés par différentes études utilisant diverses approches méthodologiques. ... 21 Tableau IV. Résultats de l’évaluation du trait phénotypique SMR (en %) des 37 colonies utilisées pour les analyses génomiques ... 52 Tableau V. Variations obtenues après chaque étape de filtration ... 56 Tableau VI. Marqueurs ayant les valeurs p des coefficients des tests avec GLM les plus significatives avec les outils GenABEL et TASSEL ... 61 Tableau VII. Résultats des tests statistiques d’association MLM avec les outils GenABEL et TASSEL 64 Tableau VIII. Marqueurs les plus proches de la signification, obtenus par les tests MLMM avec GAPIT ... 69 Tableau IX. Comparaison des marqueurs trouvés par différents outils des tests d’association qui sont proches de la significativité (seuil p = 0.05) et qui sont sur les mêmes chromosomes ... 77
Liste des abréviations, sigles, acronymes
ADN : Acide DésoxyriboNucléique, molécule en double-hélice portant l’information des caractères génétiques ARN : Acide RiboNucléique, molécule de transport de l’information de l’ADN et de la synthèse de protéines CNV : (Copy number variant) Variant de nombre de copies
FDR : (False discovery rate) Taux de découverte des faux-positifs GBS : génotypage par séquençage
GLM : (General Linear Model) Modèle de régression linéaire généralisé GWAS : Étude d’association pangénomique
HWE : (Hardy-Weinberg equilibrium) Équilibre de Hardy-Weinberg
IBD : (Identity by descent) Identitée déterminée par la descendance génétique IBS : (Identity by sequence) Identitée déterminée par la ressemblance génétique LD : (Linkage disequilibrium) Déséquilibre de liaison
MAF : (Minor Allele Frequency) Fréquence de l’allèle mineur MLM : modèle linéaire mixte
MLMM : modèle linéaire mixte multi-locus
MNV: (Multi-Nucleotide Variant) Variantion génétique composée de plusieurs nucléotides NV: (Nucleotide Variant)
PC: (Principal component) Composantes principales
PCA: (Principal Component Analysis) Analyses des composantes principales PCR: Réaction en chaîne par polymérase
QTL: Quantitative trait loci
QTN: Quantitative trait nucleotique
RAD: marqueurs génétiques associés à de sites de restriction RE: Enzymes de restriction
SMR : (Suppressed mite reproduction) trait de résistance de l’abeille mellifère au parasite V. destructor par la diminution de son taux de reproduction
SNP : polymorphismes nucléotidiques singletons
SNV : (Single nucleotide variant) Variant nucléotidique singleton SV : (Structural variant) Variant de la structure
VSH : Varroa sensitive hygiene, comportement de résistance de l’abeille au parasite V. destructor WGR : Whole genome resequencing
À mon père, le premier à avoir éveillé ma
curiosité scientifique.
Remerciements
En premier lieu, je souhaite remercier mon directeur de maîtrise, Nicolas Derome, pour cette occasion de réaliser ce projet et son soutien ainsi que sa disponibilité pendant toute la durée de ma maîtrise. Ce fut une merveilleuse expérience dont je garderai de très bons souvenirs. J’aimerais remercier mon codirecteur Pierre Giovenazzo pour ses précieux conseils et son enthousiasme permanent.
Je me dois de remercier aussi toute l’équipe Derome. Travailler à vos côtés est un réel plaisir. Ce travail n’aurait pu être possible sans le soutien de l’équipe apicole du CRSAD. Je remercie en particulier Marilène Paillard pour sa compagnie et son expertise lors de notre semaine d’échantillonnage.
Il va sans dire que ce projet n’aurait pu se réaliser sans le soutien financier du MAPAQ et du programme Innov’Action dans le cadre de Cultivons l’avenir 2, une initiative fédérale-provinciale-territoire.
Je voudrais adresser ma gratitude au professeur François Belzile pour ses conseils judicieux qui ont modelé mon projet. Le projet présenté ici n’aurait pu être mené à bien sans la contribution généreuse de Martine Jean, professionnelle de recherche de l’équipe Belzile, et de Davoud Torkamaneh, ancien doctorant de l’équipe Belzile, qui furent mes mentors dans la méthodologie des études d’associations génomiques.
Je voudrais exprimer ma reconnaissance envers Josiane Mongrain et Alexandra Carrier pour leur amitié et leur soutien tout au long de mon parcours. Enfin, je tiens à témoigner toute ma gratitude à Ulysse Martin pour sa confidence, sa patience et sa gentillesse de chaque instant. Ta présence à mes côtés est un cadeau inestimable.
Introduction générale
L’Abeille mellifère, Apis mellifera, est le principal Insecte pollinisateur domestique, retrouvé à l’échelle internationale, qui assure un rôle vital dans le maintien des écosystèmes, dans l’agroalimentaire et dans l’économie internationale (Danforth, 2007). Varroa destructor, un Acarien ectoparasite ayant co-évolué avec l’abeille asiatique Apis cerana, s’est adaptéà A. mellifera vers le début du 20e siècle (Ritter, 1981; Nazzi & Le Conte, 2016). Varroa destructor est
considéré comme l’une des plus grandes menaces actuelles pesant sur l’apiculture (Rosenkranz, Aumeier, & Ziegelmann, Biology and control of Varroa destructor, 2010). Il est responsable des importantes pertes hivernales de colonies observées au Canada depuis 2006 (Currie, et al., 2010; Guzman-Novoa, et al., 2010) et en Europe (Aston, 2010; Gaiger, et al., 2010; Mutinelli, et al., 2010; Potts, et al., 2010). L’abeille n’est cependant pas sans défense contre ce parasite, puisque certaines colonies expriment une résistance au Varroa. Cette résistance, dénommée dénommée Varroa Sensitive Hygiene (VSH), est un comportement hygiénique recherché qui permettrait de lutter efficacement contre le Varroa et d’éviter l’utilisation de contrôles chimiques (Behrens, et al., 2011). Dans les colonies qui démontrent ce trait comportemental, il y a une baisse de la reproduction des varroas dans le couvain d’abeilles, le SMR « Supressed Mite Reproduction ». L’architecture génétique de cette résistance demeure cependant mal comprise. Nous postulons que le trait SMR est un trait quantitatif complexe contrôlé par un grand nombre de sites à faibles effets. Cette étude a pour objectif d’aider à élucider les régions génomiques associées au trait SMR et de présenter une méthodologie d’étude d’association pangénomique appropriée pour de futures études.
Pour mieux comprendre le danger réel que présente la varroase, la maladie parasitaire des abeilles due au Varroa, il faut se familiariser avec le cycle de vie de son hôte. Ainsi, le premier chapitre de ce travail sert à dresser un tableau d’A. mellifera et de Varroa destructor, puis de la varroase et conséquemment du trait de résistance de l’Abeille mellifère. Ce premier chapitre se continue par un survol des études d’A. mellifera qui ont cherché à élucider la génomique de la résistance au parasite V. destructor à ce jour et la présentation des études d’association pangénomiques. Le chapitre 1 se termine par la présentation des objectifs et hypothèses du projet. Le deuxième chapitre fait l’étalage de la réalisation d’une étude d’association pangénomique pour identifier des régions génomiques associées au trait SMR, d’abord par la présentation de la méthodologie puis par la présentation des résultats, et se clos par la discussion des résultats. Finalement, une conclusion achève le document en faisant un retour sur l’ensemble du mémoire et en présentant une perspective de l’avenir des études sur la résistance au Varroa d’A. mellifera. Dans l’ensemble de ce document, l’appellation Varroa réfère à l’espèce Varroa destructor.
Chapitre 1 : Revue de littérature
1.1 Apis mellifera
1.1.1 Classifications et origines
L’Abeille mellifère, Apis mellifera, fait partie du clade des abeilles dans l’ordre des Hyménoptères et est un membre du sous-groupe Apoidea. Plus spécifiquement, elle fait partie de la famille Apidae et du genre Apis (Hedtke, et al., 2013). Les membres du genre Apis sont regroupés en trois sous-genres, établis sur des bases phylogéniques de l’ADN mitochondrial : Micrapis les abeilles « naines » (Apis florea et Apis andreniformis), Megapis les abeilles « géantes » (Apis dorsata, Apis binghami et Apis laboriosa), et Apis les abeilles « cavitaires » (Apis mellifera, Apis
cerana, Apis koschevnikovi, Apis nuluensis et Apis nigrocincta) (Hedtke, et al., 2013).
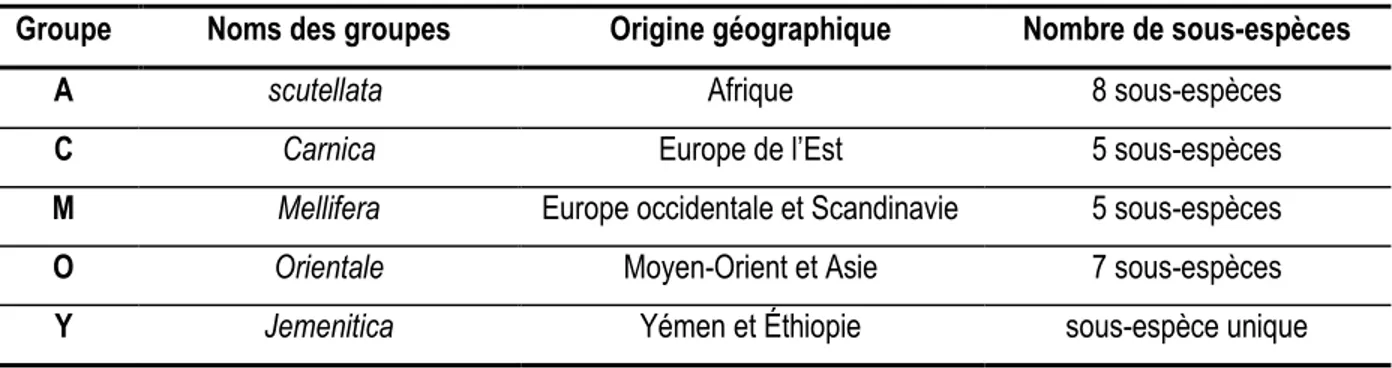
On reconnait à A. mellifera 27 sous-espèces, classées selon leurs différences morphologiques, leurs caractéristiques physiologiques et écologiques. Ces sous-espèces sont elles-mêmes subdivisées en cinq groupes majeurs, présentés dans le tableau I, suivant leur répartition géographique et histoire évolutive (Han, Wallberg, & Webster, 2012; Franck, et al., 2001; Wallberg, et al., 2014).
Le cinquième groupe « Y », qui rassemble les sous-espèces originaires de l’Afrique du Nord Est, a été proposé par plusieurs chercheurs, mais n’est pas d’utilisation courante (Franck, et al., 2001). Il est intéressant de noter que les groupes C et M, qui sont les plus proches géographiquement, sont aussi les plus éloignés génétiquement. Les origines ancestrales d’A. mellifera et les parcours d’invasion sont encore des sujets débattus. La littérature présente trois possibilités (Han, Wallberg, & Webster, 2012) :
1) Originaire du Moyen-Orient qui s’est répandu par deux routes en Europe (Nord et Ouest) 2) Originaire du Moyen-Orient qui s’est répandu par le Nord en Europe (une route)
Tableau I. Répartition des sous-espèces d’Apis mellifera en groupes selon leurs origines géographiques. La
lettre désignant le groupe était originellement le nom du sous-groupe; des classifications subséquentes ont causé l’utilisation de nouveaux noms de groupes, mais l’utilisation des lettres est restée (Franck, et al., 2001).
Groupe Noms des groupes Origine géographique Nombre de sous-espèces
A scutellata Afrique 8 sous-espèces
C Carnica Europe de l’Est 5 sous-espèces
M Mellifera Europe occidentale et Scandinavie 5 sous-espèces
O Orientale Moyen-Orient et Asie 7 sous-espèces
1.1.2 Biologie
Castes et tâchesL’Abeille mellifère fait partie du moins de 2 % des insectes qui sont dits eusociaux. Par définition, les espèces eusociales réunissent trois caractéristiques : 1) chevauchement des générations 2) coopération dans les soins parentaux 3) division du travail avec des castes d’individus stériles (Andersson, 1984). Les abeilles mellifères sont organisées en castes sociales ayant des fonctions distinctes afin d’assurer le maintien et la reproduction de la colonie. Les femelles sont divisées en deux castes, soit la caste de reine et celle d’ouvrière. À l’exception de la reine fertile, toutes les femelles sont des ouvrières stériles. La caste des femelles (reine ou ouvrière) est déterminée au stade larvaire par l’alimentation. Les mâles quant à eux ont une caste unique : les faux-bourdons.
Dans chaque colonie, une seule reine pondeuse est présente. Elle pond environ 200 000 œufs par année, à raison de 1000 par jour (Chauvin, 1968). La caste ouvrière est largement dominante dans les colonies, le nombre d’individus atteignant plusieurs dizaines de milliers en saison estivale de la miellée. Les ouvrières font du polyéthisme lié à l’âge, c’est-à-dire que leur comportement se modifie en fonction de leur âge (Seeley, 1982). En début de vie, elles ont des fonctions de nourricières des larves et de la reine et sont aussi responsables du nettoyage des alvéoles et de la fermeture des alvéoles du couvain au cœur de la ruche. Après quelques jours, elles se redirigent en périphérie pour réaliser du travail d’entretien : nettoyage, ventilation. À 12 jours, les ouvrières s’alternent pour garder l’entrée de la ruche. Dès la deuxième semaine de leur vie d’adultes, les glandes cirières s’activent et les ouvrières peuvent construire les cadres de cires avec les alvéoles. Finalement, à trois semaines de maturité, les glandes de cire s’atrophient et les ouvrières terminent leur vie en tant que butineuses. Le butinage se produit dans un rayon de 3 km autour de la ruche, pouvant s’étendre jusqu’à 6 km. Les comportements des ouvrières ne sont pas mutuellement exclusifs. Une certaine plasticité est nécessaire afin d’assurer que tous les besoins de la colonie sont comblés (Gary, 1963).
Les faux-bourdons sont des membres temporaires des colonies. Ils ont comme fonction principale la reproduction, c’est pourquoi ils sont produits seulement à certains moments durant la période estivale, soit lorsque des reines vierges pourraient être présentes et que les ressources alimentaires sont abondantes. Les faux-bourdons sont coûteux aux colonies : ils s’alimentent uniquement du travail des ouvrières et ne contribuent pas au travail de maintien de la colonie. Lorsque la production de la ruche baisse, à la fin de l’été et au début de l’automne, les ouvrières vont chasser les faux-bourdons hors de la ruche ou les tuer (Gary, 1963).
Reproduction et développement
Pour assurer la reproduction, une nouvelle reine doit s’accoupler peu après sa sortie de l’alvéole. La reine vierge quitte la colonie et trouve un rassemblement de faux-bourdons pour effectuer son vol nuptial. En un seul vol, la reine
peut s’accoupler avec plus d’une dizaine de mâles; elle peut faire jusqu’à quatre vols nuptiaux (Gary, 1963). Par la suite, la reine ne s’accouplera plus, puisqu’elle aura entreposé quelques millions de spermatozoïdes dans un organe spécialisé appelé spermathèque (Tarpy & Page, 2000; Rousseau, et al., 2015). L’abeille domestique présente un système de détermination sexuelle haplodiploïde, ce qui signifie que les femelles sont diploïdes (deux copies d’un même génome, avec présence de deux allèles différents aux sites dits hétérozygotes) alors que les mâles sont haploïdes (un seul allèle). La présence de deux allèles différents du gène sexuel détermine le sexe femelle et un seul allèle sexuel détermine le sexe mâle. En fonction de la taille de la cellule construite par les ouvrières, la reine déposera un œuf fertilisé de femelle ou un œuf de mâle (Chauvin, 1968). Cela signifie que les femelles héritent de 50 % des gènes de la reine et 100 % des gènes du faux-bourdon, tandis que les mâles héritent uniquement de 50 % des gènes de la reine. De plus, tous les spermatozoïdes d’un mâle sont génétiquement identiques.
Les ouvrières et les mâles sont alimentés au stade larvaire d’une gelée nourricière, un mélange de pollen, de miel, d’eau et de sécrétions hypopharyngiennes des nourrices (Chauvin, 1968). Pendant les premiers jours, toutes les femelles sont nourries de gelée royale. Si une larve est toujours nourrie de gelée royale par les ouvrières, elle deviendra une reine vierge, sinon elle deviendra une ouvrière. Le terme « reine vierge » est assez explicatif, il désigne simplement une reine qui n’a pas encore fait de vol nuptial, et donc n’a pas de sperme emmagasiné dans sa spermathèque.
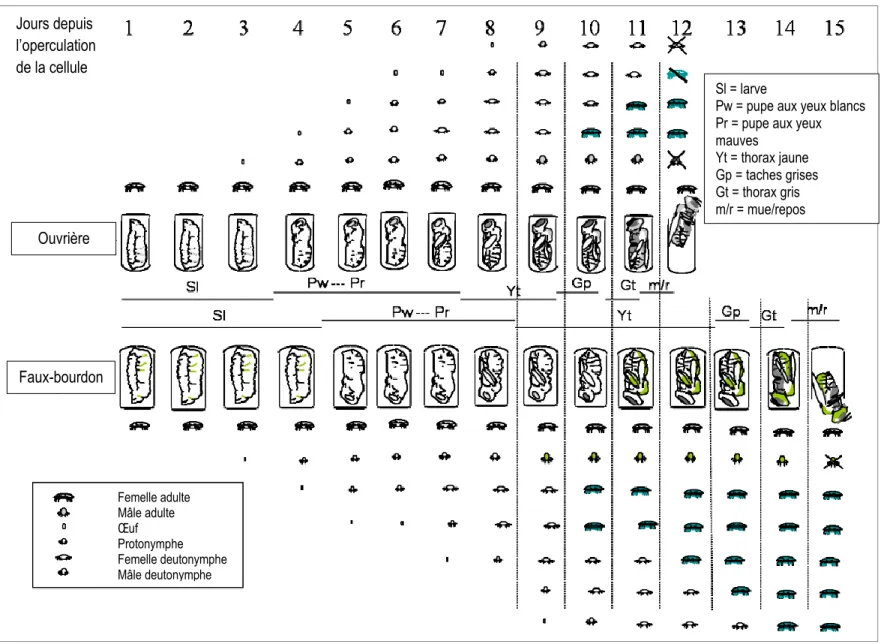
Les abeilles sont des Insectes holométaboles, c’est-à-dire que leur cycle de vie est divisé en quatre étapes : œuf, larve, pupe et adulte. Initialement, les œufs sont pondus par la reine dans les alvéoles. Ceux-ci éclosent après 3 jours, libérant une larve. La larve demeure dans l’alvéole de cire et grandit durant 5,5 jours pour la reine, 6 jours pour une ouvrière et 7 jours pour les faux-bourdons). L’alvéole est ensuite operculé avec de la cire sécrétée par les ouvrières. La larve enfermée poursuit son développement en tissant un cocon jusqu’à se transformer en pupe. Subséquemment, la pupe subit une métamorphose sur une période de 7,5 jours pour les reines, 12 jours pour les ouvrières et 14 jours pour les faux-bourdons avant d’émerger en dévorant l’opercule. Au total, il faut compter 16 jours pour le développement complet des reines à partir d’un œuf, 21 pour les ouvrières et 24 pour les faux-bourdons. Le temps de chacune de ces phases de développement est présenté au tableau I et au tableau II.
Tableau II. Comparaison des temps de développement du couvain des différentes castes d’Apis mellifera du stade d’œuf jusqu’à l’émergence de la cellule operculée (adapté de Bertholf, 1925). L’imago est la forme
définitive de l’insecte adulte qui émerge de la cellule.
Ouvrières Reines Faux-bourdons
Jours Stades Évènements Stades Évènements Stades Évènements 1
œuf Œuf œuf
2
3 éclosion éclosion éclosion
4 larve 1re mue Larve 1re mue larve 1re mue
5 2e mue 2e mue 2e mue
6 3e mue 3e mue 3e mue
7 4e mue 4e mue 4e mue
8
9 operculation operculation
10 pré-pupe pré-pupe 5e mue operculation
11 5e mue Pupe pré-pupe 12 pupe 13 14 5e mue 15 6e mue pupe 16 imago émergence 17 18 19 20 6e mue 21 imago émergence 22 6e mue 23 imago émergence
Cycle annuel
La durée de vie des individus varie en fonction de la caste. Une ouvrière peut vivre de deux à quatre semaines durant la période estivale; un faux-bourdon, de quatre à huit semaines. Les reines ont une plus grande longévité et peuvent vivre de deux à cinq ans. Dans les zones de climat continental comme au Québec, la reine cesse de pondre durant l’hiver. Les ouvrières de cette période survivent plus longtemps en consommant leurs réserves de glucides et en adoptant une formation en grappe au sein de la ruche afin de maintenir une température d’environ 21 ˚C (Fahrenholz, Lamprecht, & Schricker, 1989).
L’immunité d’Apis mellifera
L’immunité de l’abeille peut être présentée en deux niveaux distincts : l’immunité individuelle classique et l’immunité sociale, issue de comportements de groupe. L’immunité individuelle englobe les défenses comportementales (nettoyage, hygiène), mécaniques, physiologiques et immunologiques. Une étude pangénomique sur A. mellifera a révélé qu’elle ne possède qu’un tiers du nombre de gènes de la réponse immunitaire connue chez les Insectes solitaires (ex : drosophile) (Evans et al., 2006). Pour compenser, l’abeille possède une l’immunité sociale. L’immunité sociale se rapporte à des comportements de défense en groupe, soit le nettoyage social, l’utilisation de matériaux antimicrobiens pour la fabrication de la ruche (ex : résine propolis) (Christe et al., 2003), le comportement hygiénique (Cremer et al., 2007), et le comportement Varroa sensitive hygiene (VSH), qui sera présenté plus loin.
1.1.3 Génétique d’Apis mellifera
Le génome de l’Abeille mellifère a été complètement séquencé et publié dans la revue Nature en 2006, puis rendu public sur le site Hymenoptera Genome Database : integrated community resources for insect species of the order
Hymenoptera (The Honeybee Genome Sequencing Consortium, 2006). L’annotation du génome de l’abeille a
ensuite été mise à jour en 2014, avec une couverture améliorée à 30 X par les données de séquençage avec SOLiD et 454. On lui attribue 14,016 gènes pour un génome de 250 Mb (NCBI GenBank). Une caractéristique particulière du génome d’A. mellifera est son contenu élevé de nucléotides AT. Une autre particularité de ce génome est son haut taux de recombinaison, soit 19 cM Mb-1 (cM, CentiMorgan, une unité qui exprime le ratio de recombinaison sur une distance, 1 cM = 1 % de probabilité de recombinaison) sur l’ensemble des chromosomes, ce qui est très élevé pour un organisme multicellulaire eucaryote (The Honeybee Genome Sequencing Consortium, 2006). Comparativement, Drosophila melanogaster, certainement l’Insecte le mieux caractérisé à ce jour, à un taux de recombinaison de 1,6 cM Mb-1, l’Humain possède un taux encore moins élevé à 1,1 cM Mb-1 et Mus musculus
(Souris) est à seulement 0.4 cM Mb-1 (Wilfert, Gadau, & Schmid-Hempel, 2007). À ce jour, aucune explication claire
n’a été avancée pour expliquer ces singularités génomiques, sinon la supposition que l’absence des transposons typiquement attendus pourrait être reliée au haut taux de recombinaison. Dans le génome d’A. mellifera, plus de
2000 marqueurs de type microsatellite ont été identifiés, la distance moyenne entre les marqueurs étant de 2,1 cM. Aucun intervalle n’atteint 10 cM. La haute densité en marqueurs est propice à l’utilisation d’une approche d’étude d’association pangénomique (Genome wide association study, GWAS) pour détecter des gènes associés à des phénotypes chez A. mellifera.
1.1.4 Mortalité des abeilles
Les mortalités « hivernales » sont bien documentées au Canada (Comité sur les enquêtes nationales de l'ACPA, 2018). En effet, c’est l’hiver que les colonies ont la plus grande probabilité de dépérir, puisque la ponte de la reine est minime et que la colonie dépend de la survie des abeilles hivernales et de leur longévité accrue. Plusieurs causes expliquent la mortalité hivernale : mort de la reine, manque de réserves de nourriture, conditions de butinages sous-optimales pendant la période estivale, population pré-hivernation trop maigres, maladies et parasites (Le Conte, Ellis, & Ritter, 2010).
Durant les hivers de 2006 à 2008, la perte d’un grand nombre de colonies domestiques d’A. mellifera en Amérique a été constatée (vanEngelsdorp, et al., 2007; vanEngelsdorp, et al., 2008). Au Canada, l’hiver de 2008 s’est vu attribuer le plus haut pic de mortalité de l’histoire, soit 35 % des colonies dans tout le pays qui ont été perdues (le taux de perte considéré comme usuel est de 15 %) (Comité sur les enquêtes nationales de l'ACPA, 2018). L’hiver 2017-2018 ne s’en tire guère mieux, avec une recrudescence des pertes de colonies qui ont atteint 32,6 % pour l’ensemble du Canada, variant de 18,4 % à 45,7 % selon les provinces (CAPA, 2018). La perte de colonies d’abeilles n’est pas une occurrence inhabituelle (Oldroyd, 2007). Le taux de mortalité au Canada oscille habituellement entre 16 et 25 %, à l’exception de la Nouvelle-Écosse, qui atteint 40 % (van der Zee, et al., 2012). Ces taux de mortalité sont associés à la période hivernale et non à la production annuelle de colonies; il n’y a donc pas de diminution du nombre de colonies dans leur ensemble. Au contraire, le nombre total de colonies au Canada a augmenté de 22,4 % entre 2007 et 2015 (Comité sur les enquêtes nationales de l'ACPA 2016, et al., 2016). Malgré ces données encourageantes, les apiculteurs disposent de peu de ressources pour lutter contre la varroase et la nosémose, les fléaux actuels de l’apiculture au Canada. Le risque de développement d’organismes résistants aux pesticides est une menace qui plane sur l’apiculture et qui souligne l’importance de trouver des méthodes plus efficaces de lutte contre les parasites, particulièrement contre V. destructor, qui est actuellement très étudié car il compromet la santé des colonies d’Abeilles mellifères (Huang, 2012; Nazzi & Le Conte, 2016). En 2014, c’est 73 % des apiculteurs canadiens qui ont rapporté la présence du parasite dans leurs colonies (Comité sur les enquêtes nationales de l'ACPA 2015, et al., 2015).
1.2 Varroa destructor
1.2.1 Biologie
Varroa destructor est un Acarien (Classe des Arachnidés) ectoparasite obligatoire d’A. mellifera associé à de
nombreuses pathologies virales de l’Abeille (Nazzi & Le Conte, 2016). Il est souvent présenté comme le parasite le plus important de l’abeille mellifère (Huang, 2012). Les colonies infestées par Varroa meurent généralement en deux à trois ans après le début de l’infestation, si elles ne sont pas traitées chimiquement par les apiculteurs.
Originalement identifiée comme Varroa jacobsoni, une distinction des deux espèces a été établie à la découverte d’une variation dans la séquence du gène cytochrome oxydase I du génome mitochondrial (Anderson & Fuchs, 1998). À la différence de V. jacobsoni, V. destructor possède la capacité de se reproduire sur A. mellifera en plus d’A. cerana. Varroa destructor est originaire de l’Asie du Sud-Est, mais a connu une expansion de sa distribution à partir de 1967, où elle s’est répandue en Europe, en Amérique, en Afrique et dans l’est de l’Asie (Nazzi & Le Conte, 2016). Cela est dû au transport mondial des abeilles et à une adaptation qui lui a permis de passer de son hôte naturel, A. cerana, à un nouvel hôte, A. mellifera (Navajas, et al., 2010).
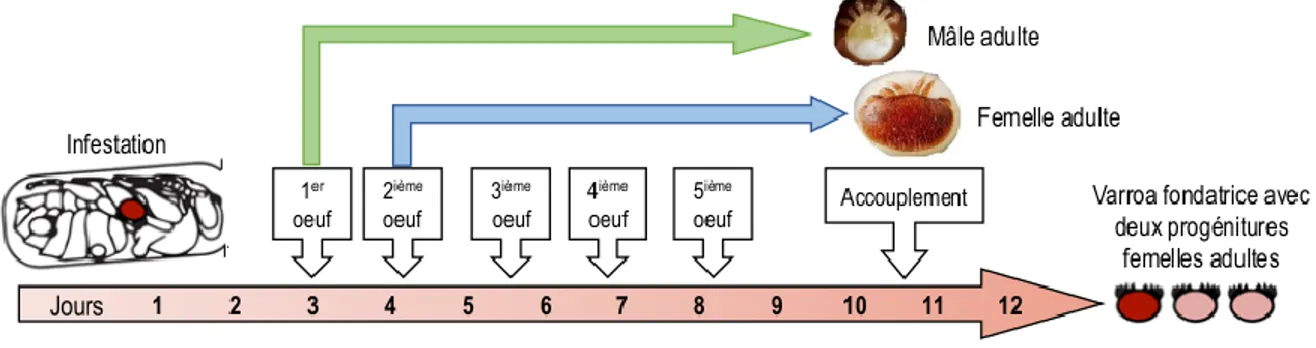
Son cycle de vie peut se diviser en deux étapes distinctes : l’étape phorétique et l’étape de reproduction (Rosenkranz, et al., 2010). Durant l’étape phorétique, le Varroa est accroché à son hôte adulte et se nourrit de son hémolymphe. On le retrouve généralement sur la membrane intersegmentale de l’abdomen. Cet état peut durer de cinq à onze jours lorsque la colonie génère de la progéniture, autrement l’acarien peut rester à ce stade jusqu’à six mois. Au cours de cette période, les varroas ont la capacité de changer d’hôte en sautant d’une abeille à l’autre, ce qui permet le transfert horizontal vers d’autres colonies (Nazzi & Le Conte, 2016). Le stade phorétique présente un plus haut taux de mortalité que l’étape de reproduction, puisque les varroas sont exposés au comportement hygiénique des ouvrières et à leurs déplacements hors de la ruche. L’étape de reproduction, imagée dans la figure 1, se déroule dans les cellules de couvain operculées. La femelle mature s’introduit dans une cellule contenant une larve, juste avant l’operculation. Cinq heures plus tard, au moment où toute la nourriture contenue dans la cellule a été consommée par l’hôte, le Varroa commence à se nourrir de l’hémolymphe de la larve. La ponte de la femelle débute environ 70 heures après l’operculation. Le premier œuf déposé n’est pas fertilisé et donne un mâle. Les œufs subséquents, pondus à des intervalles de 30 heures, sont femelles à cause du déterminisme sexuel haplodiploïdique (Rosenkranz et al. 2010; Nazzi et Le Conte, 2016). Un total de cinq à six œufs femelles peuvent être pondus par la mère, toutefois la plupart d’entre eux n’auront pas le temps d’atteindre la maturité. Effectivement, les pupes des ouvrières ont une incubation de onze jours alors qu’un œuf de Varroa femelle prend six jours pour se développer correctement. La fréquence de reproduction est de 1,3 à 1,45 femelles matures produites dans une cellule d’ouvrière
et de 2,2 à 2,6 produites dans une cellule de faux-bourdon à cause de leur temps d’operculation plus long (Martin, 1994; Martin, 1995).
La progéniture qui émerge des œufs se nourrit de la pupe au site préparé par la mère (Nazzi & Le Conte, 2016). L’alimentation des varroas cause des dommages directs à l’hôte en plus d’effets indirects liés aux pathogènes dont le Varroa est un vecteur de transmission (Chen, et al., 2004). Une fois la maturité atteinte, le jeune mâle s’accouple à répétition avec ses sœurs, puis décède peu après, son cycle de vie n’impliquant jamais de stade phorétique. À l’émergence de l’abeille adulte, la femelle Varroa et sa progéniture mature quittent la cellule avec l’abeille. La femelle Varroa peut faire jusqu’à trois cycles reproducteurs au cours de sa vie (Fries & Rosenkranz, 1996). Si une désoperculation de l’alvéole a lieu alors que les jeunes varroas ne sont pas encore matures, et donc pas encore sclérifiés (durcies), cela provoque leur mort par déshydratation. Les femelles immatures (deutonymphes) sont blanches alors que les matures sont « pigmentés ».
L’acarien parasite a développé certaines stratégies pour déjouer les systèmes de défense de son hôte. Au stade reproducteur, le Varroa peut faire un mimétisme chimique pour échapper à la détection par les ouvrières (Kather, et
al., 2015a; Kather, et al., 2015 b). Les abeilles ont la capacité de reconnaître les individus provenant de leur propre
colonie par l’apprentissage de proportion spécifique d’hydrocarbures cuticulaires, qui est copiée par le Varroa. Celui-ci peut même mimer la signature assoCelui-ciée aux différents stades développementaux de l’hôte (Martin, et al., 2001). De plus, il pourrait éviter les défenses immunitaires de l’hôte en les réprimant, notamment en inhibant le métabolisme de peptides antibactériens de l’abeille (Gregory, et al., 2005; Schwarz, et al., 2015).
Figure 1. Cycle reproducteur de V. destructor dans une cellule ouvrière d’Apis mellifera (adapté de Rosenkranz et al. 2010). Les varroas adultes émergent de la cellule au même moment que la progéniture d’abeille
mature. Les progénitures varroa qui ne sont pas encore matures à ce moment meurent au contact de l’air. Jours
Figure 2. Morphologie de Varroa destructor. La composition normale d’une « famille » du parasite retrouvée dans
une cellule d’ouvrière au stade des yeux violets, approximativement 11 jours après l’opperculation de la cellule. En ordre, de gauche à droite, en partant de la ligne du haut : protonymphe, protochrysalide, deutonymphe. Ligne du bas : jeune adulte, femelle fondatrice et mâle adulte. (Tiré de Rosenkranz et al, 2010)
1.2.2 Varroase
Les impacts négatifs de l’infestation de Varroa destructor dans une colonie d’abeilles sont multiples. L’effet le plus évident du parasite est sa consommation répétitive des corps gras de son hôte, autant des pupes que des adultes parasitées (Ramsey, et al., 2019). Cela cause des dommages physiques et réduit leur contenu protéique tout en diminuant leur masse corporelle et raccourcissant la longévité des individus. Cette conséquence peut être mortelle pour les abeilles et les colonies durant l’hivernage. Les varroas affectent également le développement des organes des larves (Schneider & Drescher, 1987; Bowen-Walker & Gunn, 2001) et agissent comme vecteur de transmission de pathogènes (Chen, et al., 2004; Chen, et al., 2005). Des 18 virus ayant été isolés des abeilles mellifères, les varroas sont vecteurs de 5 : le Kashmir Bee VirusI (KBV), le Sacbrood virus (SBV), l’Acute Bee Paralysis Virus (ABPV), l’Israeli acute paralysis virus (IAPV) et le Deformed Wing Virus (DWV) (Boecking et Genersch 2008). Ce rôle de vecteur est apparent depuis l’émergence dans les années 1970 de maladies virales dans le monde apicole, qui coïncide avec l’époque de la découverte de la varroase sur A. mellifera (Shen, Yang, Cox-Foster, & Cui, 2005). Le DWV est presque toujours retrouvé en association avec la présence de varroa (Genersch, 2005). La croissance des cas d’infections virales depuis 1987 aux États-Unis correspond aussi à une augmentation du nombre de pertes de colonies d’abeilles à travers le pays. Des virus autrefois considérés non létaux pour les colonies, comme le virus de la paralysie aigüe en Grande-Bretagne, sont désormais mortels par leur combinaison synergique avec la varroase (Genersch & Aubert, 2010). Ces différents virus appareillés à la varroase contribuent aux difformités morphologiques des individus de la colonie (ailles déformées, corps plus petit, abdomen raccourci) qui ont un impact néfaste sur la vigueur et la longévité des abeilles et leur colonie. Les capacités réduites des ouvrières butineuses affectent leur habileté et efficacité à accomplir leurs tâches (Schneider & Drescher, 1987). D’autre part, le Varroa présente des fonctions activatrices de la réplication virale, en plus de provoquer une forme d’immunosuppression humorale chez l’abeille (Yang & Cox-Foster, 2007). Ce qui signifie que des facteurs de stress habituellement non létaux recèlent désormais un potentiel pathogène important lorsqu’une colonie est parasitée par V. destructor.
1.2.3 Contrôle actuel du Varroa
Il existe actuellement diverses méthodes pour traiter les colonies infestées par le Varroa. Ces traitements nécessitent cependant une application périodique, sans laquelle les colonies des climats tempérés s’effondreraient en six mois à trois ans après le début de l’infestation (Rademacher & Harz, 2006; Boecking & Genersch, 2008; Rosenkranz, et al., 2010). Les apiculteurs utilisent un large éventail de produits chimiques, de techniques d’application et de méthodes alternatives pour contrôler les infestations du Varroa. Ces traitements comprennent les acaricides synthétiques, les acaricides naturels (acides organiques et huiles essentielles) et les techniques biologiques (Rosenkranz, et al., 2010; Giovenazzo & Dubreuil, 2011).
Les acaricides synthétiques sont des produits chimiques dits « durs » : l’organophosphate coumaphos (nom commercial : Checkmite), la pyréthrine, la tau-fluvalinate (nom commercial : Apistan), la fluméthrine (nom commercial : Bayvarol) et la formamidine amitraze (nom commercial : Apivar) (Rosenkranz, Aumeier, & Ziegelmann, 2010). La tau-fluvalinate agit sur des canaux sodiques voltage dépendants, alors que le coumaphos agit sur la signalisation et les fonctions nerveuses. Malgré leur facilité d’utilisation, leur accumulation dans les produits de la ruche après une utilisation répétitive est potentiellement dommageable pour les abeilles.
La classe des acaricides dits « doux » (naturels) contient l’acide formique, l’acide oxalique, l’acide lactique et le thymol (Rosenkranz, Aumeier, & Ziegelmann, 2010). Plusieurs études ont couvert l’ensemble des aspects d’utilisation de ces produits naturels comme moyen de contrôle de la varroase. Il en ressort qu’ils sont moins polluants que leur contrepartie synthétique, cependant leur application est plus restrictive et leur efficacité est variable en fonction des conditions d’utilisation (Calderone, 1999; vanEngelsdorp, et al., 2008 b; Giovenazzo, 2011).
Des méthodes alternatives employées par les apiculteurs contribuent à la lutte contre la varroase en ralentissant son développement. Entre autres, la « trapping comb method », qui consiste à retirer du couvain operculé, préférentiellement du couvain mâle, en espérant retirer en même temps des acariens emprisonnés, est assez efficace (Engels & Preston, 1984; Maul, et al., 1988). La plupart des autres méthodes alternatives n’ont pas une efficacité réelle prouvée (Hoppe & Ritter, 1987 ; Rosenkranz, 1987).
En somme, les acaricides synthétiques et la lutte intégrée avec les acaricides « doux » sont en ce moment les méthodes les plus efficaces de lutte contre la varroase. Toutefois plusieurs désavantages proviennent de leur utilisation, comme la variation de leur efficacité selon la présence ou l’absence de couvain operculé ainsi que du moment de la saison lors de leur usage (Gregoric & Planing, 2002). De plus, leur application répétitive implique un coût important, sans compter que des études ont démontré la persistance des acaricides dans les produits de la ruche, comme le miel et la cire (Sanchez-Bravo & Goka, 2014). Le rendement à long terme de l’utilisation des acaricides est aussi remis en cause par l’émergence de populations de Varroa résistantes (Ellis, et al., 2001; Webster & Delaplane, 2001). À ces problématiques s’ajoute la complication que l’utilisation d’acaricides peut affecter l’élevage de reines et la production de sperme (Haarman, et al., 2002). L’ensemble des limites d’utilisation des acaricides et des autres méthodes de contrôle souligne l’importance de développer de nouvelles approches afin de juguler l’impact de Varroa destructor sur l’Abeille mellifère.
1.3 Résistance à V. destructor chez Apis mellifera
Une relation hôte-parasite est souvent décrite comme une course évolutive à l’armement entre le développement de défenses chez l’hôte et de résistances chez le parasite. C’est l’hypothèse de la reine rouge de Leigh Van Valen (1973), qui se résume comme suit : l’évolution d’une espèce est nécessaire à sa survie pour maintenir ses aptitudes par rapport aux adaptations des espèces avec lesquelles elle coévolue. La conception moderne de l’évolution est plus sensible et adresse plutôt les caractéristiques des individus qui leur permettre de s’adapter (ou non) à leur environnement et que ces caractéristiques présentent des variations dans leur expression. Il n’en demeure pas moins que l’hypothèse de la reine rouge, avec la nuance dans son contexte historique, demeure pertinente de nos jours. Dans le cas d’une relation hôte-parasite, il doit y avoir un équilibre évolutif entre les deux organismes, puisque l’hôte est nécessaire à l’existence du parasite. La multiplication trop rapide du parasite pourrait causer une chute de la population d’hôtes, ce qui causerait la mort du parasite par association. Dans le cas d’A. mellifera et de Varroa
destructor, cet état d’équilibre n’est pas encore atteint, puisque Varroa destructor s’est récemment adapté à A. mellifera. Ce nouvel hôte n’a pas encore développé des adaptations permettant d’établir une relation stable avec le
parasite, tandis que le parasite est bien armé contre le genre Apis duquel il dépend depuis longtemps. On peut toutefois constater que certains individus de l’espèce A. mellifera présentent des comportements de défense innés contre la varroase.
1.3.1 Trait SMR
Probablement pour la toute première fois, Ruttner et al. découvrent que les Varroas dans des colonies d’abeilles ont un haut taux de non-reproduction en 1984. Ce phénomène est indépendant de l’origine du couvain d’abeilles, c’est-à-dire que peu importe de quelle colonie provient le couvain, la fréquence de non-reproduction du Varroa est identique dans la colonie d’introduction (Fuchs, 1994). En 1997, Harbo et Hoopingarner publient que ce sont certaines colonies d’A. mellifera qui ont la capacité, transmissible, de diminuer la reproduction au parasite V.
destructor. Ces colonies sont alors qualifiées de résistantes, puisque la résistance contre un parasite se définit
comme étant l’habileté à limiter la charge du parasite (Raberg, Graham, & Read, 2009). La sélection est faite pour ces colonies présentant un haut taux d’infestation de Varroas non reproductrives (incapables de produire au moins une femelle mature), et ce caractère est baptisé le trait répresseur de reproduction des varroas (supressing mite
reproduction, SMR) (Harbo et Hoopingarner, 1997).
1.3.2 Comportement VSH
En 2005, le comportement VSH est proposé comme étant la cause du trait SMR. Il consiste en l’action de désoperculer puis de refermer les cellules infestées ou à en retirer la progéniture parasitée (Harbo & Harris, 2005;
Harris, 2007; Villa, et al., 2009). La désoperculation suffit à causer la mort de la progéniture immature du Varroa. Quand une pupe infestée est retirée, la femelle Varroa adulte peut être retirée en même temps. Si elle survit, elle monte habituellement sur l’abeille qui retire la pupe hôte, ou encore se déplace sur le cadre où elle s’expose au comportement de nettoyage des abeilles. Effectivement, lorsque le Varroa se retrouve à l’extérieur du couvain, au stade phorétique, les abeilles sont capables de les détecter et de les mordre, ce que l’on appelle le comportement de nettoyage (grooming behavior). La morsure peut estropier ou tuer le varroa, qui tombe au fond de la ruche et sera ensuite jeté à l’extérieur par des ouvrières d’entretien. Même si la mère fondatrice Varroa est capable d’infester de nouveau une cellule, l’interruption de son cycle de reproduction précédent peut suffire à l’empêcher de se reproduire correctement dans son cycle suivant, en ne produisant par exemple que des œufs femelles ou en produisant une désynchronisation entre sa ponte et le développement de son hôte (Kirrane, et al., 2015). Le comportement VSH est exprimé par des ouvrières âgées de 15 à 18 jours (Harbo & Harris, 2001).
Le comportement VSH d’A. mellifera est donc un comportement hygiénique de résistance au parasite V. destructor. De façon générale, le comportement hygiènique des abeilles se définit comme la capacité à retirer le couvain mort, malade ou parasité des cellules operculées (Spivak & Gilliam, 1998 a; 1998 b). Le comportement VSH se différencie du simple comportement hygiénique par sa spécificité de détection du couvain parasité par V. destructor. Il n’est pas limité aux colonies sélectionnées car il a été observé dans colonies non-sélectionnées (Boecking & Ritter, 1993; Boecking & Spivak, 1999; Aumeier, et al., 2000). Le comportement VSH est ciblé car il est héritable et ne semble pas nuire aux autres performances zootechniques des abeilles (Harbo et Harris, 2005; 2009; Harris 2007; Harris et al. 2010; Rinderer et al. 2010). Le comportement VSH est caractérisé par la diminution du taux d’infestation du Varroa (Villa, Danka, & Harris, 2009). Des études indiquent que la fertilité du Varroa dans une colonie d’abeilles VSH diminue après une exposition d’une semaine (Harbo et Harris, 2005), cependant l’étude de Kirrane et al. (2015) remet en doute cette trouvaille et indique que l’effet de la baisse de fertilité se ferait plutôt ressentir à délais, lors de l’infestation subséquente des varroas. Des études précédentes ont postulé que les abeilles VSH choisissaient préférentiellement les cellules infestées par les varroas fertiles (Harbo et Harris 2005, 2009) pour expliquer l’augmentation de l’infertilité, cependant une étude par Harris, Danka et Villa (2010) a démontré qu’au contraire, il n’y a pas de sélection préférentielle par les abeilles VSH. Bien que le comportement VSH semble au premier abord apparenté au comportement hygiénique, la littérature est inconsistante lorsqu’il s’agit de déterminer si le niveau SMR/VSH d’une colonie est corrélé directement avec le comportement hygiénique (Boecking & Drescher, 1992; Büchler, et al., 2010; Rinderer, et al., 2010). Le stimulus amorçant l’action VSH des abeilles est généralement attribué à des signaux olfactifs émanant des cellules infestées qui n’ont toujours pas été clairement identifiés. Les abeilles VSH différencient une cellule infestée vide d’une cellule contenant du couvain, ce qui incite à penser que les signaux olfactifs proviendraient de la pupe attaquée (Nazzi, et al., 2004). Le comportement VSH s’exprime habituellement envers les pupes operculées d’au moins quatre jours (Martin, et al., 2012). Kirrane et al. (2015)
observent que le taux d’infestation initial est positivement corrélé avec le pourcentage de couvain retiré par les ouvrières. Cela pourrait indiquer qu’un seuil minimal d’infestation est requis pour que le comportement VSH soit exprimé à un degré significatif. Le coût à la valeur sélective (fitness) d’enlever les jeunes ouvrières pourrait expliquer cette théorie.
Bien que l’on assimile souvent le trait SMR au comportement VSH, il est prudent de différencier ces deux termes. Le comportement VSH est une explication du trait SMR, mais d’autres facteurs pourraient contribuer au trait SMR. En somme, le trait SMR est caractérisé par la non-reproduction des Varroas, alors que le comportement VSH est défini par la diminution du taux d’infestation par le Varroa, une nuance importante. Le trait SMR a une importance équivalente au comportement VSH, mais son évaluation phénotypique et sa sélection pour la reproduction sont beaucoup plus faciles à accomplir comparativement à des comportements complexes comme le VSH (Behrens, et al., 2011).
Les apiculteurs peuvent déjà bénéficier des développements récents de production de lignées présentant une résistance à V. destructor (Dietemann, et al., 2012; Danka et al. 2012). La nature génétique de la résistance au Varroa et de la transmission de ce trait ont été montrées dans une étude par ensemençant une reine de lignée non-VSH avec le sperme de mâles de colonie non-VSH (Danka, et al., 2012).
1.3.3 Trait quantitatif
La résistance des colonies d’abeilles peut être mesurée par le trait phénotypique SMR. Les traits phénotypiques peuvent entrer dans l’une de deux catégories :
1) Trait qualitatif : Il s’agit d’une classification discrète, souvent utilisée pour des valeurs non numérales. Toutefois, dans certains cas, des valeurs numérales qui expriment un identifiant plutôt qu’une numération vont faire partie de cette catégorie.
2) Trait quantitatif : Classification de valeurs continues, presque exclusivement numérale (ex : taille, concentration moléculaire, temps, etc.).
Les traits qualitatifs sont aussi qualifiés de discrets ou encore de caractères mendéliens, car un caractère qualitatif est habituellement gouverné par des variations à un seul gène et qui se reconnait par son héritabilité dans une famille, comme cela est décrit par les principes Mendéliens.
Le trait SMR (comme le comportement VSH) est un trait quantitatif. Les traits quantitatifs sont aussi appelés traits complexes, l’expression de ces traits étant le résultat de la somme de variations de plusieurs gènes et leurs
interactions avec des facteurs environnementaux. Une représentation classique des traits quantitatifs est la taille des individus dans une population donnée (Visscher, 2008). Effectivement, la taille dans une population est un caractère qui varie selon des valeurs continues, dont on s’attend à ce que la distribution produise une courbe normale – lorsque l’échantillon est suffisamment grand pour bien représenter la population – en partie à cause du théorème central limite. Ainsi, en observant la distribution de la fréquence des tailles, on s’attend à ce que la taille moyenne ait la plus grande fréquence, alors que les valeurs extrêmes auront la plus basse fréquence. Le modèle génétique qui permet d’expliquer un trait quantitatif et la grande variation dans l’expression de ce phénotype est le modèle infinitésimal de Fisher (1918) (Barton, et al., 2017). Ce modèle soutient que les variations génétiques quantitatives sont le résultat de la ségrégation des allèles d’un grand nombre de gènes, une grande partie ayant un très petit effet. On s’attend donc à ce qu’un trait quantitatif implique un grand nombre de loci avec un faible effet individuel et des interactions complexes, dont l’impact combiné est important (Yang, et al., 2010). Ce n’est pas toujours le cas. Par exemple, un seul site polymorphe avec plusieurs allèles différentiellement exprimés peut produire une variation continue du phénotype dans la population. L’épigénétique peut aussi être en cause d’un trait quantitatif par la variation dans la régulation de l’expression du trait (Asada, et al., 1994).
Une région du chromosome où sont localisés un ou plusieurs gènes intervenant dans l’expression d’un caractère quantitatif est nommée locus de caractère quantitatif (Quantitative Trait Locus, QTL). Les QTL peuvent être identifiés par des approches moléculaires, ce qui permet de cartographier des régions du génome contenant des gènes impliqués dans la spécification du caractère associé. À partir de cette région restreinte identifiée, il est possible d’identifier des gènes qui pourraient, selon leur fonction, être au moins une partie de l’architecture génétique du phénotype. Ces gènes sont dits « gènes candidats » (ou encore « gènes d’intérêts »).
L’expression d’un trait phénotypique est déterminée par une combinaison de facteurs génétiques et non génétiques, souvent dits facteurs environnementaux. Si l’on reprend l’exemple de tailles dans une population, l’alimentation des individus durant la croissance aura aussi un impact sur l’expression du phénotype. Ce facteur et d’autres agiront de concert avec la génétique de l’individu pour produire le phénotype qui sera observable. L’interaction avec l’environnement a un effet sur le phénotype et doit être prise en considération par les modèles statistiques utilisés lorsque l’on cherche à identifier l’action du génome sur le phénotype (Korte & Farlow, 2013). Idéalement, les facteurs environnementaux devraient être contrôlés lors d’une étude d’association entre le génome et le phénotype afin de limiter l’impact environnemental sur l’expression du trait et permettre de maximiser l’impact génétique sur la variation du trait (Lewis, 2002).
1.3.4 Études génomiques de la résistance aux varroas
L’importante problématique qu’est la varroase depuis déjà plusieurs années a incité beaucoup de chercheurs à se pencher sur l’exploration de l’architecture génétique et l’identification des fonctions physiologiques associées au SMR/VSH. Le premier modèle théorique des gènes contrôlant le comportement VSH l’assimilait au comportement hygiénique classique des abeilles. Il s’agit du modèle de Rothenbuhler en 1964, à l’époque où l’on croyait que le comportement hygiénique était l’un des rares traits complexes expliqués par un système mendélien à deux locus. Il proposait deux loci homozygotes récessifs déterminant le comportement, chacun régissant l’une de deux actions, soit la désoperculation de la cellule infestée et le retrait de la pupe. Ces deux actions étaient décrites comme étant les composantes du comportement hygiénique. Effectivement, la résistance au Varroa était indissociable du simple comportement hygiénique au début de son étude. Un modèle à trois gènes a par la suite été présenté et incluait un gène supplémentaire pour la détection par l’odorat de la maladie/infestation. Cependant, la littérature a permis de démontrer que le comportement de résistance au Varroa possède une régulation beaucoup plus complexe que celles présentées précédemment (Lapidge, et al., 2002; Oxley, et al., 2010; Spötter, et al., 2012; Tsuruda, et al., 2012).
C’est Lapidge et al. (2002) qui ouvre le bal sur la complexité de la régulation de ce comportement, par la découverte de sept régions génomiques qui sont associées au comportement en utilisant des marqueurs RAPD. À l’époque, le génome de référence de l’abeille n’avait pas encore été publié, ce qui complique la comparaison des loci identifiés dans cette étude pionnière et ceux détectés dans des travaux plus récents, qui utilisent le génome de référence. L’étude de l’architecture génomique du comportement doit attendre huit ans avant d’être explorée de nouveau, cette fois par Oxley, Spivak et Oldroyd (2010) par une approche de cartographie des QTL. Ils détectent six régions génomiques associées avec le comportement hygiénique, plus spécifiquement influençant la désoperculation, le retrait, l’apprentissage de l’olfaction (ces trois plus importantes se situant sur les chromosomes 2, 5 et 2 respectivement), le comportement social et la locomotion circadienne. Behrens et al. en 2011 analysent des populations en Suisse, aussi par une approche de cartographie des QTL. Trois régions candidates sont trouvées sur les chromosomes 4, 7 et 9. Cependant la forte épistasie (l’influence d’une région génomique sur l’expression d’une autre région) dans ces trois régions génétiques complique leur utilisation dans un programme de sélection assistée par marqueurs génétiques. Par la suite une autre étude (Tsuruda, et al., 2012) utilise une approche similaire et identifie un QTL majeur sur le chromosome 9, contenant le gène « no receptor potential A » et le « dopamine
receptor gene ». Ce dernier joue un rôle dans la vision et l’olfaction chez la Drosophile. L’équipe de Kirrane (2015)
vise spécifiquement la région du chromosome 9 précédemment trouvée par Tsuruda et trouve le résultat inverse : selon leurs analyses statistiques, cette région est négativement corrélée à l’expression du comportement VSH chez l’abeille. L’article le plus récemment parût rapporte une étude d’association pangénomique, mais utilise des colonies apparentées (Spötter, et al., 2016). Il identifie six régions génomiques fortement associées au VSH, situées sur les
chromosomes 2, 3, 5, 6 et 7, toutes à des positions différentes des précédentes études (deux sites sur le chromosome 3). À partir de ces observations, six gènes candidats potentiellement responsables du trait étudié sont suggérés pour quatre des six régions. En parcourant la littérature, on s’aperçoit que beaucoup d’études sur l’architecture génomique du trait VSH, mais que pratiquement aucune d’entre elles ne s’accorde avec une autre. Aucune étude ne vient confirmer les résultats d’une précédente et certaines donnent des résultats contradictoires. Il reste donc du travail à faire pour comprendre la génétique qui affecte la résistance SMR et le comportement VSH chez l’abeille mellifère
.
Le tableau III résume les résultats des travaux sur l’architecture génomique du comportement VSH.Il est suggéré que les gènes hypothétiques du comportement VSH sont liés aux fonctions olfactives des abeilles, puisque les signaux olfactifs ont été démontrés comme étant les médiateurs généraux du comportement VSH (Gramacho & Spivak, 2003; Swanson, et al., 2009). Leur rôle dans le comportement VSH n’ayant cependant pas été clairement établi; il est possible que d’autres gènes en soient responsables.
Afin de mieux comprendre le comportement VSH et le trait SMR, de nouvelles études génomiques doivent être faites pour élucider l’architecture génomique de ce trait. Les études mentionnées ci-dessus utilisent toutes une approche d’analyse des QTL et/ou d’échantillonnage de colonies fortement apparentées et rétro croisées. Les études classiques qui utilisent des familles pour réaliser les analyses de QTL sont efficaces pour identifier les gènes qui ont des effets forts dans les traits mendéliens, mais leur efficacité est limitée dans les traits complexes communs (Altmüller, et al., 2001). Pour explorer les traits quantitatifs qui sont contrôlés par plusieurs gènes, les études d’associations pangénomiques (GWAS) présentent actuellement la meilleure approche possible : elles permettent d’évaluer l’ensemble du génome de milliers d’individus non apparentés pour identifier des régions génomiques associées au trait étudié (McCarthy, et al., 2008; Parejo, et al., 2016). Les prochaines sections décrivent les études d’association pangénomiques dans le détail, afin de permettre au lecteur de comprendre le projet de maîtrise, qui fait usage de cette approche méthodologique.
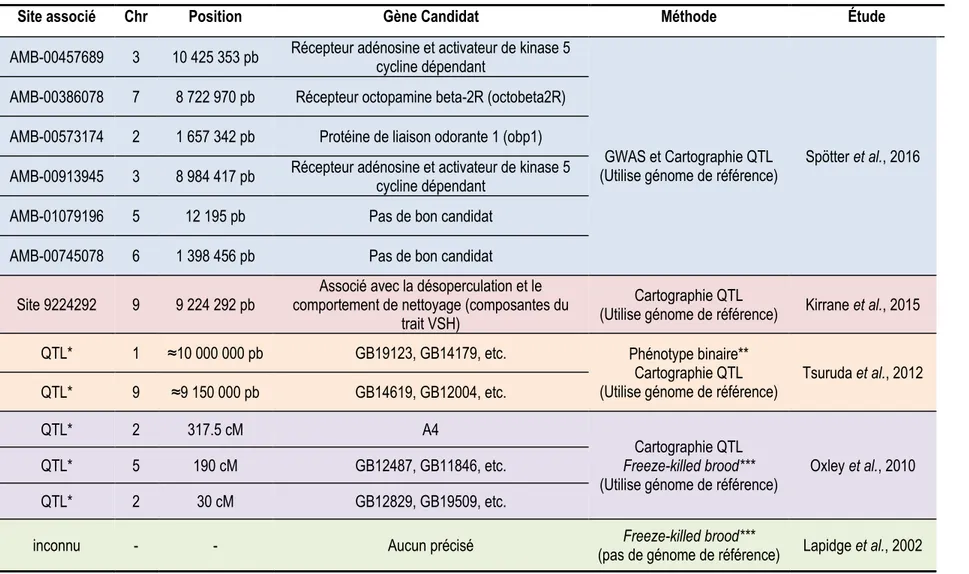
Tableau III. Régions génomiques et gènes candidats potentiellement associées au comportement VSH et/ou au trait SMR trouvés par différentes études utilisant diverses approches méthodologiques.
* La méthodologie de l’étude identifiait des régions QTL par un score de probabilité de transmission des allèles (score LOD). ** La méthode d’évaluation du phénotype binaire transforme les valeurs quantitatives des phénotypes en valeurs binaires.
*** La méthode d’évaluation du phénotype Freeze-killed brood vise le comportement hygiénique spécifiquement, plutôt que le trait SMR/comportement VSH.
Site associé Chr Position Gène Candidat Méthode Étude
AMB-00457689 3 10 425 353 pb Récepteur adénosine et activateur de kinase 5 cycline dépendant
GWAS et Cartographie QTL
(Utilise génome de référence) Spötter et al., 2016 AMB-00386078 7 8 722 970 pb Récepteur octopamine beta-2R (octobeta2R)
AMB-00573174 2 1 657 342 pb Protéine de liaison odorante 1 (obp1) AMB-00913945 3 8 984 417 pb Récepteur adénosine et activateur de kinase 5 cycline dépendant
AMB-01079196 5 12 195 pb Pas de bon candidat
AMB-00745078 6 1 398 456 pb Pas de bon candidat
Site 9224292 9 9 224 292 pb comportement de nettoyage (composantes du Associé avec la désoperculation et le trait VSH)
Cartographie QTL
(Utilise génome de référence) Kirrane et al., 2015
QTL* 1 ≈10 000 000 pb GB19123, GB14179, etc. Phénotype binaire**
Cartographie QTL
(Utilise génome de référence) Tsuruda et al., 2012
QTL* 9 ≈9 150 000 pb GB14619, GB12004, etc.
QTL* 2 317.5 cM A4
Cartographie QTL
Freeze-killed brood***
(Utilise génome de référence) Oxley et al., 2010
QTL* 5 190 cM GB12487, GB11846, etc.
QTL* 2 30 cM GB12829, GB19509, etc.
1.4 Les études d’association pangénomiques
L’étude d’association est un outil très utilisé en génomique, qui permet d’identifier des portions de génome dont la variation allélique coïncide avec la variation d’un phénotype, par exemple une maladie, une résistance ou un caractère recherché. Les études d’association pangénomiques (Genome Wide Association Studies, GWAS) ont été initialement conçues dans l’optique de fournir une approche efficace et non biaisée pour détecter les allèles liés à l’architecture génomique contrôlant des traits génétiquement complexes non mendéliens (Cantor, et al., 2010).
De façon générale, le but des études d’association de populations est d’identifier des polymorphismes qui vont varier systématiquement entre les individus exprimant différentiellement un trait. Cette corrélation permet de représenter les effets d’allèles qui augmentent l’expression d’un phénotype. On parle souvent d’allèles qui augmentent le « risque » dans ce type d’étude, car elles sont fréquemment utilisées pour identifier des allèles qui sont associés au risque augmenté d’une maladie. Les études d’association pan-génomiques sont basées sur l’utilisation de tests statistiques pour identifier les régions génomiques associées au comportement à l’étude plutôt que sur l’inférence génétique (c.-à-d. transmission du trait), comme c’est plutôt le cas pour les études de cartographie des QTLs. Le fonctionnement d’une GWAS sera décrit en détail dans cette section, avec un accent sur la manière appropriée de réaliser ce type d’étude pour identifier l’architecture génomique du trait de résistance au Varroa chez l’Abeille mellifère. La dernière section de ce chapitre aborde l’interprétation des résultats d’une GWAS et les facteurs pouvant les influencer.
1.4.1 Comment fonctionne une étude d’association?
Les marqueurs génétiques
Un marqueur génétique est une variation dans la séquence d’ADN qui est liée à un trait désiré. Les études d’association utilisent les marqueurs comme outils pour faire le lien entre le trait et la région génomique dans laquelle le marqueur se situe (Bush & Moore, 2012). La région génomique est représentée par le marqueur grâce au déséquilibre de liaison (voir définition plus loin). Les marqueurs génétiques sont des caractéristiques d’une séquence d’ADN donnée et permettent de distinguer des individus entre eux. Un marqueur a une position physique connue sur un chromosome, que l’on peut qualifier comme le site du marqueur.
Il existe deux types généraux de variations, soit les variations nucléotidiques (NV), qui sont la variation d’un seul ou de plusieurs nucléotides avoisinants (single nucleotide variants, SNVs et multi-nucleotide variants, MNVs) et les variations structurales (structural variants, SV) qui sont des réarrangements génétiques plus importants (>50pb) de plusieurs types : insertions, délétions, inversions, translocations, duplications et variants de nombre de copies (copy