Dynamique de la masse corporelle et de la survie adulte
chez la marmotte des Rocheuses : L'hibernation ne
permet pas de neutraliser les effets de la variabilité
environnementale
Mémoire
Béatrice Carrier
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Dynamique de la masse corporelle et de la survie
adulte chez la marmotte des Rocheuses :
L’hibernation ne permet pas de neutraliser les effets de la
variabilité environnementale
Mémoire
Béatrice Carrier
Sous la direction de :
Steeve D. Côté, directeur de recherche
Sandra Hamel, codirectrice de recherche
Résumé
Les mammifères alpins sont vulnérables aux changements climatiques car ils sont confinés à une certaine altitude. Toutefois, des adaptations physiologiques et comportementales chez certaines espèces d’animaux fouisseurs pourraient, en partie, atténuer les impacts négatifs des changements climatiques. En effet, chez les animaux fouisseurs qui hibernent, le fait d’avoir recours à la torpeur en hiver en plus d’avoir accès à des terriers souterrains permet aux individus de réduire leur exposition aux conditions extérieures lorsqu’elles sont défavorables. J’ai étudié les liens entre les facteurs environnementaux et les variations interannuelles de la masse corporelle et de la survie chez les adultes d’une population de marmottes des Rocheuses. Mon étude utilise des données qui ont été récoltées pendant 14 ans à Caw Ridge en Alberta. J’ai émis l’hypothèse que la variation interannuelle dans les conditions environnementales au printemps, à l’été et en hiver déterminerait la masse corporelle des individus pendant l’été en plus de la survie annuelle via des effets directs sur la qualité et la disponibilité des ressources alimentaires. J’ai aussi prédit que la masse à la fin de la saison d’activité serait l’un des principaux déterminant de la survie annuelle. Mes résultats démontrent un effet positif des printemps hâtifs sur le gain de masse estival et la survie annuelle. J’observe aussi que la masse à l’émergence des marmottes qui ont connu des hivers froids et rigoureux est 47% inférieure à celle des marmottes qui ont connu des hivers plus doux. Toutefois, les marmottes qui émergent avec une masse plus faible aux printemps suivants des hivers plus rigoureux ont un gain de masse plus important pendant l’été. Ainsi, à la fin de l’été, elles atteignent une masse similaire à celles qui ont une masse plus élevée à l’émergence suivant un hiver plus doux. Cela suggère que les individus adoptent une stratégie d’allocation des ressources qui leur permet de maximiser leur gain de masse estival afin de survivre pendant la prochaine période d’hibernation. Cette capacité des marmottes à maximiser leur gain de masse estival contribue probablement à expliquer le fait que je n’ai pas observé d’effets de la masse à la fin de la saison active sur la survie annuelle. Bien que les adultes devraient avoir des réponses tamponnées aux changements environnementaux comparés aux juvéniles, notre étude suggère que la masse corporelle et la survie des adultes peuvent être considérablement affectées par les conditions environnementales et que les changements prévus dans les conditions climatiques pourraient avoir des effets sur les espèces d’animaux fouisseurs qui hibernent en milieux alpins.
Table des matières
Résumé ... ii
Table des matières ... iii
Liste des figures ... v
Liste des tableaux ... vii
Liste des abréviations ... viii
Liste des sigles ... ix
Remerciements ... xii
Avant-propos ... xiii
Introduction ... 1
Contraintes en altitude ... 1
Stratégies adaptatives en altitude ... 2
Susceptibilité des espèces qui hibernent face à la variabilité environnementale ... 4
Anticiper la réponse des populations d’espèces alpines aux changements climatiques ... 6
Objectifs et hypothèses ... 6
Modèle d’étude : La marmotte des Rocheuses ... 8
Aire d’étude : Caw Ridge ... 9
Approche méthodologique ... 10
Chapitre 1: Coping with seasonality: dynamics of adult body mass and survival in an alpine hibernator ... 14
1.1 Résumé ... 14
Abstract ... 15
1.2 Introduction ... 15
1.3 Material and Methods ... 18
1.3.1 Study area and captures ... 18
1.3.2 Environmental conditions ... 19 1.3.3 Statistical Analyses ... 20 1.4 Results ... 22 1.5 Discussion ... 23 1.6 Acknowledgments ... 27 Conclusion ... 35 Bibliographie ... 40
Annexe B : Details on weather data ... 50 Annexe C : Parameters affecting probability of capture (p) ... 53 Annexe D : Multistate Models ... 54
Liste des figures
Figure 1.1. À Caw Ridge, les marmottes des Rocheuses sont observées sur les crêtes montagneuses et les
prairies alpines au-dessus de la limite des arbres. A) Observation typique d’une de marmottes des Rocheuses qui sont souvent observées sur un rocher. B) Les marmottes des Rocheuses utilisent des réseaux de tunnels et de terriers creusés et façonnés dans les parois rocheuses. ………10
Figure 1.2. À Caw Ridge, les marmottes des Rocheuses sont capturées dans des trappes de type Tomahawk,
puis manipulées dans des sacs de contention. A) Femelle « orange-white » âgée de 6 ans dans une trappe de type Tomahawk lors d’une recapture en 2014. B) Jeune marmotton de l’année, capturé à l’aide d’une trappe de type Tomahawk et marqué en 2015. C) Le sac de contention est placé à la sortie de la trappe, et la marmotte capturée est dirigée à l’intérieur. D) Le sac de contention est en forme de cône au bout duquel il y a un trou d’aération et vers lequel la marmotte est dirigée. Les fermetures éclaires sur le dessus permettent d’accéder à l’individu pour les manipulations………...12
Figure 1.3. Une fois dans le sac de contention, les marmottes qui n’ont jamais été capturées sont identifiées.
A) Des étiquettes d’oreilles sont insérées chacune des oreilles et des fils de couleurs y sont fixés pour la reconnaissance visuelle sur le terrain. B) Chaque marmotte capturée est aussi munie d’un transpondeur numérique dans le bas du dos, pour faciliter la reconnaissance à la capture. C) Pour déterminer le sexe et le statut reproducteur des marmottes capturées, celles-ci son immobilisées sur le dos, la tête toujours dans le sac de contention. D) À chaque capture et une fois immobilisées dans le sac de contention, les marmottes sont pesées avec une balance de type Pesola. ……….13
Figure 2.1. Graphical representation of the study, with a timeline illustrating hoary marmots’ life cycle, the
research objectives, the dependent and independent variables measured, and the annual variation for each independent variable (see Material and methods for specifications; NPI: North Pacific Index, NDVI: Normalized Difference Vegetation Index, PC1: scores of the first principal component analysis on spring conditions, masses at immergence: predicted mass for non-breeding females)………..31
Figure 2.2. Effects of environmental variation in winter (A) and spring (B) on changes in body mass during
summer, for adult hoary marmots at Caw Ridge, Alberta, Canada (2004‒2017, n=422). A: Influence of North Pacific Index winter anomalies prior to emergence (NPI t-1; Figure 2.1), illustrating the predictions for the lowest NPI year (warmer and drier winter; red) and the highest NPI year (colder and snowier winter; grey) between 2004 and 2017. B: Influence of the first component of a principal component analysis on spring conditions at emergence (PC1 t; Figures 1, 2), illustrating the predictions for the year with the highest PC1 score (warmer and earlier spring; red) and the lowest PC1 score (colder and delayed spring; grey) between 2004 and 2017. Solid lines and the shaded areas are the predictions and 95% confidence interval accounting for covariates. Dots are the partial residuals taking into account effects of the other variables in the model………32
Figure 2.3. Changes in marmot mass during summer according to sex (A: males in yellow, females in blue) and
reproductive status (B: reproductive female in yellow, non-reproductive females in blue), for adult hoary marmots at Caw Ridge, Alberta, Canada (2004‒2017, n=422). Solid lines and the shaded areas are the predictions and 95% confidence interval accounting for covariates. Dots are the partial residuals taking into account effects of the other variables in the model………33
Figure 2.4. Changes in annual survival probability in relation with the rate of spring green-up preceding
hibernation (A: NDVI t) and the ratio of summer precipitations preceding hibernation (B: number of days with heavy rain precipitations or snow on the total number of days), for hoary marmots at Caw ridge, Alberta, Canada (2004-2017, n=132). Points are the mean predictions of survival for each year accounting for covariates, the shaded polygons delimit the 95% confidence intervals around the estimates, and the red lines represent the average survival probability predicted for the whole study period………34
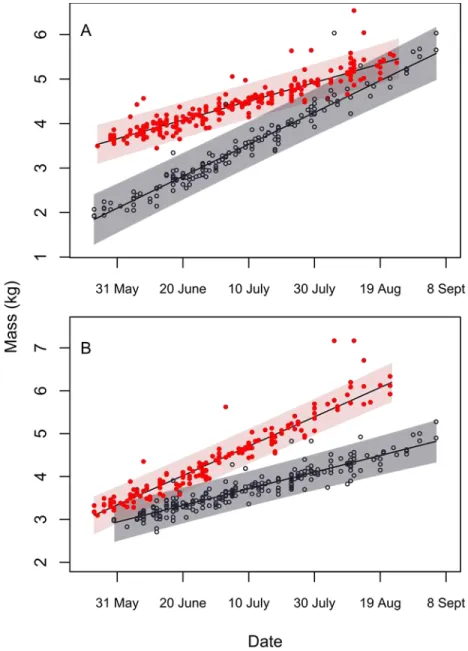
Figure S1. Correlations between the log of body mass (kg) and the log of zygomatic arch (mm) [A] and the log
of body length (cm) [B]………..49
Figure S2. Results of the principal component analysis on the three variables describing annual spring
conditions at Caw Ridge (2004-2017), presenting the scores of the first two principal components (PC), with the variability explained by each component in parenthesis……….51
Figure S3. Variations of snow cover in the area occupied by hoary marmots in relation with time of year (Julian
days starting from 1 January), for each year of the study (2004-2017), at Caw Ridge, Alberta, Canada. Black dots are the percent snow cover estimated from the Moderate Resolution Imaging Spectroradiometer (MODIS), while red dots are the percent snow cover estimated visually in the field………52
Liste des tableaux
Table 2.1. Influence of environmental conditions, sex, and reproductive status on body mass near emergence
(main effects) and summer mass gain (interactions with Julian days) of adult hoary marmots at Caw Ridge, Alberta (2004‒2017). Parameters with a confidence interval (CI) excluding zero are highlighted in bold. In grey, we present the estimates for the individual effects of the variables described by PC1 and that were fitted in three different models………..28
Table 2.2. Candidate models evaluated for identifying the parameters affecting apparent annual survival (ɸ) in
adult hoary marmots at Caw Ridge, Alberta (2004-2017)……….29
Table 2.3. Estimates (logit scale) and 95% confidence intervals (CI) for the parameters included in the two most
supported models describing apparent annual survival (ɸ) and the probability of capture (p) in adult hoary marmots, at Caw Ridge, Alberta (2004‒2017)………...30
Table S1. Candidate models evaluated for identifying the parameters affecting the probability of capture (p) in
Liste des abréviations
NAO : North Atlantic oscillationsNDVI : Normalized difference vegetation index NPI : North Pacific index
Liste des sigles
ɸ : Survie annuelle apparenteÀ Raoul Carrier, Louisette Godin, Monique Martin et Robert Blondin
-Un conseil des aînés précieux, parce que jouer dehors, c’est du sérieux.
Mais aussi un peu à Giulia Carenini
O dear little cabin, I've loved you so long,
And now I must bid you good-bye!
I've filled you with laughter, I've thrilled you with song,
And sometimes I've wished I could cry.
Your walls they have witnessed a weariful fight,
And rung to a won Waterloo:
But oh, in my triumph I'm dreary to-night --
Good-bye, little cabin, to you!
Remerciements
Je tiens à remercier plusieurs personnes sans qui cette maîtrise aurait été plus laborieuse.
D’abord, merci à mon directeur de recherche, Steeve D. Côté. Merci de m’avoir donné l’occasion de travailler trois étés à Caw Ridge. Merci aussi de m’avoir introduite au monde de la recherche. Les trois dernières années ont été stimulantes et passionnantes. Merci aussi à Sandra Hamel, ma co-directrice. Merci d’avoir été présente dès que je rencontrais des difficultés théoriques comme morales. Merci pour ton esprit critique, ta franchise et ta rigueur. Par-dessus tout, merci d’avoir collaboré à faire de ce projet un projet dont je suis fière. Mathieu Garel, merci pour l’extraction de données satellitaires, pour l’aide lors des analyses de survie et pour tes commentaires sur mon manuscrit. Chacun a grandement contribué à bonifier mon projet. Je remercie aussi Gilles Gauthier pour son implication dans mon comité d’encadrement et Jean-Pierre Tremblay pour la révision de ce mémoire. Merci à mes collègues et amis avec qui les étés sur le terrain ont été un plaisir. Édouard Bélanger et Patrick Morissette, merci pour l’enthousiasme contagieux. Andrea Panagakis, tu es une inspiration pour moi. Giulia Carenini, merci pour ces déhanchements endiablés au milieu des montagnes silencieuses. Frédéric Dulude-DeBrouin, merci pour le grain de folie. Florent Déry, merci d’avoir fait de Caw Ridge une maison, un nid confortable. Je remercie au passage toutes les assistantes et tous les assistants de terrain qui ont participé aux captures de marmottes depuis 2004. Merci aussi à tous les membres du Fish and Wildlife, à Grande-Prairie comme à Grande-Cache, qui ont été un soutien logistique pour le terrain. Merci aussi à Marc-Antoine, Simon, Limoilou et Nadine de Ram Mountain, comparses québécois exilés dans les montagnes albertaines.
Merci au laboratoire Côté-Tremblay. Merci spécialement à Caroline Hins et Julien Hénault-Richard pour votre disponibilité. Merci aussi à Michael Bonin et Émilie Champagne pour chacune des relectures.
Merci aux colocs, Frédéric Dulude-DeBroin, Frédéric Letourneux et Zoé Tolszczuk-Leclerc, pour l’auberge espagnole dans laquelle il faisait bon rentrer le soir.
Maman, merci pour l’escapade à Rome, l’animation de nos bars des sciences et pour le soutien moral. Papa, merci pour cette aventure au Yukon et d’être venu braver la foudre et les loups avec moi à Caw Ridge. Merci à vous deux pour les coups de pouce financiers. Florence, merci pour tes bouffonneries et ta franchise.
Laurence, Antoine et Rose, merci pour votre curiosité et pour la légèreté des moments passés avec vous. Florent Déry, merci de contribuer à embellir mon quotidien.
Avant-propos
L’aire d’étude de Caw Ridge, en Alberta, est connue pour le suivi à long terme de la population de chèvres de montagne (Oreamnos americanus) qui s’y déroule depuis 1989. Or, depuis 2004, sont aussi suivies des marmottes des Rocheuses (Marmota caligata). Bien qu’elle soit une espèce commune dans le nord-ouest de l’Amérique du Nord, la marmotte des Rocheuses demeure très peu étudiée. Mon projet de recherche sera donc parmi les premières études dont la marmotte des Rocheuses est le modèle d’étude.
L’objectif de ma maîtrise était d’établir les liens entre les variations interannuelles des conditions environnementales, la condition corporelle et la survie chez la marmotte des Rocheuses. Mon projet de mémoire a mené à la rédaction du manuscrit « Coping with seasonality: dynamics of adult body
mass and survival in an alpine hibernator », présenté au chapitre 2 et dont je suis la première auteure.
J’ai collaboré avec trois coauteurs présentés ci-dessous. Chacun a joué des rôles primordiaux dans l’accomplissement de ce projet (Tableau 1). L’article sera soumis au journal Global Change Biology. 1. Steeve D. Côté, professeur titulaire au Département de biologie de l’Université Laval;
2. Sandra Hamel, professeure au Département de biologie arctique et marine de l’Université de Tromsø;
3. Mathieu Garel, PhD, ingénieur à l'unité ongulés sauvages de l'office national de la chasse et de la faune sauvage (ONCFS).
Tableau 1. Implications des coauteurs pour l’article présenté dans le mémoire.
Avec la contribution du CRSNG et du FRQNT B. CARRIER S.D. CÔTÉ S. HAMEL M. GAREL Conception du projet Financement 1 Prise de données Analyses statistiques Interprétation des résultats Rédaction
Révision
Introduction
Les espèces herbivores qui vivent en hautes altitudes sont exposées à des conditions particulièrement hostiles et variables, et à une période hivernale de pénurie de ressources alimentaires prolongée. Certaines espèces de mammifères alpins ont évolué une stratégie d’hibernation et d’utilisation d’abris souterrains, appelée « sleep-or-hide » dans la littérature anglophone. Cette stratégie permet de pallier aux effets de la variabilité des conditions environnementales et de la disponibilité des ressources (Liow et al., 2008; Liow et al. 2009). Toutefois, cette stratégie ne permet pas de neutraliser complètement les effets des conditions environnementales sur la dynamique des populations de ces espèces (Inouye et al., 2000; Proulx, 2012; Van Horne et al.,1997) et les mécanismes derrière la réponse aux variations environnementales des populations d’espèces d’animaux fouisseurs qui hibernent demeurent encore peu connus.
Contraintes en altitude
Le climat alpin en milieu tempéré est relativement froid et rigoureux tout au long de l’année (Körner, 2000). Il se distingue par une période estivale très courte suivie d’une longue période hivernale durant laquelle les températures demeurent sous le point de congélation et les précipitations tombent sous forme de neige (Körner, 2000). Cette saisonnalité marquée alternant les périodes plus rigoureuses et froides et les périodes plus clémentes limite la disponibilité et l’accessibilité aux ressources végétales pour les herbivores (Stephens, 2002). Pendant l’hiver, la végétation recouverte de neige est peu accessible pour les herbivores (Turunen et al., 2009). De plus, lorsque la température est sous le point de congélation, la végétation est peu nutritive puisqu’elle est en dormance et contient beaucoup de fibres par rapport aux nutriments et aux protéines (Billings and Mooney, 1968; Morgantini & Hudson, 2006). C’est lorsqu’elle est en croissance que la qualité de la végétation est la plus élevée (Morgantini & Hudson, 2006 ; Pettorelli et al., 2007). Les contraintes imposées par la saisonnalité ont favorisé une croissance rapide chez les plantes en milieu alpin (Billings & Mooney, 1968), ce qui limite également la période d’accès à des ressources de qualité pour les herbivores. Ces variations des conditions environnementales associées aux différentes saisons sont toutefois prévisibles et les espèces alpines adoptent un rythme de vie qui suit les saisons (Inouye et al., 2000 ; Morgantini & Hudson, 2006). Les comportements auxquels sont associés de hauts coûts métaboliques, tels que la recherche de partenaire pour la reproduction et l’allaitement, sont généralement synchronisés avec la fonte de la neige et la croissance de la végétation (Barash, 1973; Loe et al., 2005; Rachlow & Bowyer, 1991), ce qui permet de pallier les coûts métaboliques associés à ces activités. La période estivale est également associée à une période intensive d’alimentation pendant laquelle les herbivores accumulent suffisamment de ressources énergétiques pour survivre à l’hiver (Armitage et al., 1996 ; Bennett, 1999 ; Douhard et al., 2018).
En plus de la variabilité saisonnière prévisible s’ajoutent des variations interannuelles des conditions météorologiques. Les conditions hivernales de températures et de précipitations à de hautes altitudes, par exemple, varient en fonction des changements annuels de la pression atmosphérique des océans (Stenseth, 2002). Ainsi, le climat hivernal des Alpes peut être décrit par les variations dans l’indice basé sur le « North Atlantic oscillations » (NAO) qui prend en compte les différences interannuelles dans la pression atmosphérique au-dessus de l’océan Atlantique (Trenberth & Hurrell, 1994; Rézouki et al., 2016). Dans les Alpes, lorsque les valeurs de l’indice NAO sont élevées, les hivers sont plus froids et peu enneigés (Tafani et al., 2013). Dans le piémont des Rocheuses, en Alberta, le climat est plutôt lié au « North Pacific Index » (NPI), qui prend en compte les différences interannuelles de la pression atmosphérique au-dessus de l’océan Pacifique et contrairement aux Alpes, les valeurs élevées de cet indice indiquent des hivers froids mais plus enneigés (Hamel et al., 2009b; Trenberth & Hurrell, 1994). Ces variations interannuelles de la rigueur de l’hiver entraînent différents coûts métaboliques associés à la thermorégulation et/ou à la recherche de nourriture chez les animaux (Douhard et al., 2018; Ferguson, 2005; Fuller, 1991). Ainsi, ces variations peuvent influencer directement les populations d’espèces alpines puisqu’elles sont déterminantes pour la condition corporelle et la survie des individus (Douhard et al., 2018 ; Milner et al., 1999). Les variations des conditions environnementales au printemps et en été ont aussi des effets potentiels sur les populations d’espèces alpines. Par exemple, lors de printemps plus hâtifs, caractérisés par des températures plus élevées et une fonte rapide du couvert nival, la croissance de la végétation est plus graduelle (Beaubien & Freeland 2000 ; Pettorelli et al. 2007; Van Vuren & Armitage, 1991). Puisque la végétation est plus nutritive lorsqu’elle est en croissance, le débourrement plus progressif permet un accès prolongé aux ressources alimentaires plus nutritives pour les herbivores (Pettorelli et al. 2007). Au quotidien, les conditions environnementales en milieu alpin peuvent être particulièrement variables et avoir des impacts considérables sur les populations animales. Ces variations sont souvent dues à des évènements météorologiques extrêmes tels que des épisodes de fortes précipitations, ou à l’inverse, des épisodes de sécheresse (Proulx, 2012; Van Horne et al., 1997). Par exemple, des précipitations abondantes pendant une dizaine de jours au printemps ont entraîné l’effondrement de terriers dans une population de spermophiles de Richardson (Urocitellus richardsonii), ce qui a augmenté le taux de mortalité (Proulx, 2012).
Stratégies adaptatives en altitude
Les contraintes présentes en milieux alpins ont favorisé plusieurs adaptations comportementales et/ou physiologiques qui permettent aux espèces alpines de tamponner les effets des variations environnementales. C’est le cas de la stratégie d’hibernation et d’utilisation d’abris souterrains qui combine deux adaptations répandues chez les petits mammifères alpins (Armitage et al., 1976; Lee et al., 2016; Ruf & Arnold, 2000). Cette stratégie est couramment nommée « Sleep-or-Hide » dans la littérature scientifique (Liow et al., 2009).
L’utilisation d’abris souterrains confère une protection physique aux animaux fouisseurs et leur permet de diminuer leur exposition à des conditions défavorables (Boero, 2001; Nikol’skii, 2009; Svendsen, 1976). Par exemple, la marmotte à ventre jaune (Marmota flaviventris) est surtout active le matin et en fin de journée et se retire dans ses terriers vers midi et pendant la nuit, un patron d’activité qui lui permet d’éviter les températures plus élevées en milieu de journée et plus froides pendant la nuit (Svendsen, 1976). Dans un abri souterrain, les écarts de températures sont considérablement plus faibles que les écarts de températures à l’extérieur (Davis, 1967). Par exemple, Nikol’skii et Savchenko (2002) ont observé que les températures dans des terriers de marmottes Bobak (Marmota Bobak) variaient entre 0,1 ̊C et 1,5 ̊C pour la période des mois de juillet à octobre alors qu’elles variaient entre 2,4 ̊C et 27,4 ̊C à l’extérieur. Ce phénomène a été observé aussi dans les terriers de pangolins à courte queue (Manis pentadactyla): au mois de janvier, la température moyenne dans les terriers était de 18,4 ̊C et connaissait des variations d’à peine 1,2 ̊C alors que le température moyenne à l’extérieur du terrier était de 14,3 ̊C et connaissait des variations de 18,2 ̊C (Bao et al., 2013). L’utilisation d’abris souterrains diminue donc la vulnérabilité des animaux fouisseurs aux variations ponctuelles, quotidiennes et saisonnières des conditions environnementales.
Quant à l’hibernation, c’est une stratégie comportementale et physiologique principalement associée à la saisonnalité qui permet aux espèces de conserver de l’énergie pendant la période hivernale de pénurie des ressources (Humphries, 2002). La majorité du temps pendant l’hibernation, les animaux sont dans un état de torpeur qui maintient leur taux métabolique et leur température corporelle au minimum (Geiser, 1988; Klug & Brigham, 2015; Thomas & Geiser, 1997). Le taux métabolique pendant une période de torpeur peut atteindre moins de 3 % du taux métabolique lorsque l’animal n’est pas en torpeur, ce qui permet de diminuer les dépenses énergétiques pendant la période hivernale (Németh et al., 2009). Cette diminution permet aussi aux animaux de survivre avec les ressources énergétiques qu’ils ont accumulées pendant la période estivale sous forme de réserves adipeuses ou de caches de nourriture (Barash 1976, Humphries et al. 2003). Les individus ne sont pas en état de torpeur de façon continue durant l’hibernation puisque des périodes d’éveil sont fréquentes, probablement pour rétablir l’homéostasie corporelle et pour excréter des déchets métaboliques (Prendergast et al., 2015; Thomas & Geiser, 1997). Pendant ces périodes, la température corporelle des individus varie de moins de 10 ̊C à plus de 35 ̊C et l’activité métabolique est augmentée (ex. : Marmota monax : Zervanos & Salsbury, 2003). Il y a beaucoup de dépenses énergétiques associées à chacun de ces épisodes de réveil et, généralement, près de 80 % de la production totale de chaleur et de la perte de masse pendant l’hibernation ont lieu pendant ces périodes (Prendergast et al., 2015). Seulement environ 20% des réserves énergétiques utilisées pendant l’hibernation sont donc dépensées pour le maintien de l’animal en état de torpeur.
Chez certaines des espèces qui hibernent, des variations de la température corporelle ont aussi été observées pendant la période estivale, ce qui suggère qu’elles sont capables d’entrer dans un état léthargique à n’importe
quel moment de l’année en réponse aux conditions environnementales. Par exemple, Zervanos et Salsbury. (2003) ont observé des fluctuations de la température corporelle chez des marmottes communes pendant une période de sécheresse qui a eu lieu au mois d’août. Pendant une période de sécheresse, la température corporelle des marmottes communes fluctuait quotidiennement et s’est stabilisée après un épisode de pluie, démontrant le recours à des périodes de léthargie (Zervanos & Salsbury, 2003). De plus, les marmottes ont diminué leur temps passé actif pendant la sécheresse (Zervanos & Salsbury, 2003). Les auteurs avancent que la combinaison des deux stratégies aurait permis aux marmottes d’éviter les conditions défavorables en plus de conserver leur énergie et limiter les pertes d’eau associées à l’activité métabolique pendant la sécheresse. La combinaison de ces deux stratégies (l’utilisation d’abris souterrains et l’hibernation) confère donc un avantage évolutif face aux pressions sélectives imposées par le climat rigoureux caractéristique des milieux alpins. L’utilisation d’abris souterrains permet de pallier les variations des conditions environnementales sur plusieurs échelles temporelles alors que l’hibernation permet de réduire les dépenses énergétiques pendant l’hiver et lors d’épisodes extrêmes de conditions défavorables (Liow et al., 2008). Les variations des conditions environnementales peuvent néanmoins avoir des impacts sur la condition corporelle et la survie annuelle des individus (Armitage et al., 1976; Inouye et al., 2000; Proulx, 2012).
Susceptibilité des espèces qui hibernent face à la variabilité
environnementale
Chez plusieurs espèces d’animaux qui hibernent, la survie hivernale est déterminée par les réserves adipeuses qu’elles accumulent pendant la période estivale (Cochet et al., 1999; Humphries et al., 2002). Ces réserves sont essentielles, puisqu’elles représentent la seule source énergétique disponible pour le maintien du métabolisme de base et la thermorégulation pendant l’hibernation, qui peut durer jusqu’à huit mois en altitude (Klug & Brigham, 2015). Les réserves s’épuisent graduellement pendant l’hiver et les individus peuvent perdre plus de 40 % de la masse corporelle qu’ils avaient atteinte avant d’hiberner, soit une moyenne de 0,2 à 0,3 % par jour (Braun et al. 2011). Cependant, ce taux d’épuisement des réserves corporelles est variable et peut être influencé par les conditions environnementales (Humphries et al., 2002; Rézouki et al., 2016). Dans une population de marmottes des Rocheuses (Marmota caligata), par exemple, un profond couvert de neige jumelé à des températures hivernales plus froides que la moyenne favorise la survie des juvéniles (Patil et al., 2013). Les auteurs expliquent ceci par le fait qu’un couvert de neige d’au moins 20 cm au-dessus des hibernacula participe à leur isolation et permet aux marmottes d’hiberner dans des conditions plus stables. De plus, l’isolation des hibernacula par la neige peut permettre de réduire la fréquence et la durée des périodes d’éveil, puisqu’elle permet de maintenir la température du terrier à des températures qui optimisent les périodes de torpeur (Németh et al., 2009). Des températures plus stables et favorables à l’état de torpeur pourraient donc diminuer les dépenses énergétiques associées aux périodes d’éveil et favoriser la survie pendant l’hiver.
L’accès à des ressources alimentaires au moment de l’émergence est lui aussi déterminant pour la condition corporelle, la reproduction et la survie chez les individus qui hibernent (Inouye et al., 2000). Généralement, les herbivores qui hibernent synchronisent leur période d’émergence et la période de reproduction avec la période de la fonte du couvert nival et de la croissance de la végétation (Heller & Poulson, 1970). Il arrive cependant que les individus ne parviennent pas à synchroniser leur émergence avec la fonte de neige. Par exemple, chez une population de marmottes à ventre jaune, des températures plus élevées au mois d’avril sont associées à une émergence plus hâtive des marmottes, mais pas nécessairement avec une fonte hâtive du couvert nival (Inouye et al., 2000). Les marmottes qui émergent plus tôt n’ont donc pas accès à de la végétation et cela augmente la période pendant laquelle elles doivent puiser dans les réserves corporelles restantes (Inouye et al., 2000). Plus l’intervalle entre l’émergence et le début de la croissance de la végétation augmente, plus les marmottes sont en déficit, ce qui peut entraîner une baisse du succès reproducteur voire même une augmentation des mortalités (Inouye et al., 2000).
Finalement, la condition corporelle et la survie annuelle des espèces herbivores qui combinent l’utilisation d’abris souterrains et l’hibernation sont potentiellement déterminées par les conditions estivales de températures et de précipitations. D’abord, les conditions de températures et de précipitations déterminent l’accessibilité et la qualité des ressources alimentaires (Turunen et al., 2009). En été, des périodes de sécheresse jumelées à des températures particulièrement élevées peuvent entraîner une sénescence rapide de la végétation, ce qui amoindrit sa qualité nutritive pour les herbivores (Pettorelli et al., 2007; Van Horne et al., 1997). Ensuite, comme les espèces en milieux alpins sont physiologiquement adaptées pour survivre à de basses températures environnementales (Türk & Arnold, 1988), une élévation des températures estivales au-dessus d’un seuil critique augmente le stress thermique subit par les individus (Melcher et al. 1990). Dans ces conditions, les individus réagissent généralement en diminuant le temps passé à la surface et en augmentant le temps passé dans leur abri souterrain (Melcher et al., 1990 ; Zervanos & Salsbury, 2003), ce qui entraîne une réduction du temps alloué à la recherche de nourriture (Melcher et al., 1990) et peut avoir un impact négatif sur la condition corporelle. Les précipitations estivales peuvent aussi influencer le taux d’activité chez les animaux fouisseurs puisqu’ils évitent les évènements de pluie et de chute de neige (Armitage, 2013 ; Zervanos & Salsbury, 2003). En somme, la condition corporelle et la survie chez les animaux fouisseurs qui hibernent sont potentiellement déterminées par les conditions environnementales qui influencent le taux d’épuisement des réserves corporelles en hiver et au printemps, la disponibilité et la qualité des ressources alimentaires au printemps et en été et le temps alloué à l’accumulation des ressources énergétiques au printemps et en été. De plus, puisque la condition corporelle des individus au moment de l’entrée en hibernation est l’un des principaux déterminants de la survie des individus pendant l’hibernation (Humphries et al., 2003), les déterminants environnementaux qui influencent la masse corporelle pendant l’été ont probablement des effets indirects sur la survie annuelle.
Anticiper la réponse des populations d’espèces alpines aux
changements climatiques
La forme caractéristique des montagnes, souvent schématisées comme un cône inversé, entraîne une réduction graduelle de la surface habitable : plus l’altitude est élevée, plus l’espace est restreint. Par conséquent, l’espace limité peut mener à une compétition inter- et intraspécifique élevée (Zeng & Lu, 2009). De plus, comme les sommets sont généralement éloignés les uns des autres, l’aire de distribution des espèces spécialisées aux conditions de haute altitude est discontinue (Rubidge et al., 2012). De plus, le rythme des changements climatiques est particulièrement rapide en milieu alpin (Beniston, 2003; Hoegh-Guldberg et al., 2018). En plus de températures de plus en plus élevées, on observe des changements dans les patrons annuels de précipitations (Hoegh-Guldberg et al., 2018). Il est aussi attendu à ce qu’il y ait de plus en plus d’évènements de températures et de précipitations extrêmes, entrainant des périodes plus fréquentes de sécheresse ou d’inondations (Hoegh-Guldberg et al., 2018).
Les changements climatiques sont l’une des principales causes des pertes de biodiversité (Foden et al., 2013) et des perturbations des conditions environnementales ont déjà commencé à affecter des populations animales spécialisées pour le climat alpin (Bonenfant et al., 2016; Douhard et al., 2018; Inouye et al., 2000; Rézouki et al., 2016). À titre d’exemple, une augmentation des températures moyennes en été a entraîné la disparition d’une population de pika (Ochotona princeps) au lac Tahoe aux États-Unis (Stewart et al., 2015). Comme cette espèce est limitée par la thermorégulation, l’occurrence de plus en plus fréquente de températures supérieures à 25 ̊C est le principal facteur qui a entraîné la perte de cette population (Stewart et al., 2015). Néanmoins, les espèces qui ont évolué une stratégie d’hibernation et d’utilisation d’abris souterrains sont sous-représentées dans la liste rouge mondiale des espèces menacées de l’Union internationale pour la conservation de la nature (Liow et al., 2008). Il est possible que la stratégie adoptée par ces espèces leur permette d’être moins exposées aux changements des conditions environnementales, mais les mécanismes qui régissent les réponses des populations d’espèces qui hibernent aux conditions environnementales demeurent encore peu connus.
Objectifs et hypothèses
L’objectif principal de mon mémoire est d’évaluer l’influence des conditions environnementales au printemps, en été et en hiver sur la masse corporelle et la survie annuelle d’une espèce alpine qui hiberne, la marmotte des Rocheuses. Plus spécifiquement, je vise en premier lieu à identifier les facteurs environnementaux influençant la masse corporelle à l’émergence au printemps et le taux de croissance durant l’été. En second lieu, je veux départager les effets attribuables aux facteurs environnementaux de ceux de la masse atteinte à l’entrée en hibernation à l’automne sur la survie annuelle. En établissant des liens entre la variabilité environnementale, la condition corporelle et la survie des individus, mon étude permettra d’améliorer notre
connaissance des mécanismes qui régissent les réponses des populations d’espèces qui hibernent aux conditions environnementales.
Pour mon premier sous-objectif, j’ai émis l’hypothèse que la variation interannuelle des conditions environnementales au printemps, à l’été et en hiver détermine la masse corporelle des marmottes des Rocheuses via des effets directs sur la qualité et la disponibilité des ressources alimentaires. J’ai donc prédit:
1. Un effet positif d’un épais couvert de neige en hiver sur la masse à l’émergence au printemps, puisque dans ces conditions les hibernacula sont mieux isolés par la neige, ce qui diminue les coûts énergétiques associés à la thermorégulation et la perte de masse corporelle en hiver.
2. Des effets négatifs d’un printemps tardif, c’est-à-dire de faibles températures printanières, une fonte tardive du couvert de neige et un débourrement rapide de la végétation, sur la masse à l’émergence et le taux de croissance estival puisque ces conditions augmentent les coûts associés à la thermorégulation et diminuent la disponibilité et la qualité de la végétation disponible au printemps. 3. Des effets négatifs de faibles températures et précipitations en été sur le taux de croissance estival puisque ces conditions limitent l’accessibilité à des ressources alimentaires de qualité et augmentent les coûts énergétiques associés à la thermorégulation.
Pour ce qui est de mon deuxième sous-objectif, j’ai émis une première hypothèse selon laquelle la survie annuelle chez la marmotte des Rocheuses est déterminée par les réserves énergétiques. J’ai donc prédit:
1. Un taux de survie annuel plus élevé les années où les marmottes atteignent une plus grande masse corporelle avant la période hivernale d’hibernation.
J’ai ensuite émis une hypothèse alternative selon laquelle c’est plutôt la variation interannuelle des conditions environnementales au printemps, à l’été et en hiver qui détermine le taux de survie chez la marmotte des Rocheuses. J’ai donc prédit :
1. Un taux de survie annuel négativement influencé par des printemps tardifs, c’est-à-dire faibles températures printanières, fonte tardive du couvert de neige et débourrement rapide de la végétation, puisque les printemps tardifs entraînent des coûts énergétiques liés à la thermorégulation et réduisent l’accès aux ressources alimentaires.
2. Un effet positif d’un épais couvert de neige en hiver sur le taux de survie annuel puisque la neige isole les hibernacula, diminuant ainsi les dépenses énergétiques pour la thermorégulation et favorisant une utilisation plus graduelle des réserves corporelles.
3. Des effets directs et indirects négatifs des étés chauds et secs sur le taux de survie annuel, puisque ces conditions ont un effet sur la qualité de ressources alimentaires et augmentent les coûts associés à la thermorégulation. Les marmottes entameraient donc l’hibernation avec une plus faible condition corporelle, ce qui diminue leurs chances de survie.
Pour chacune des prédictions concernant mes deux sous-objectifs, je m’attends à ce qu’il y ait une différence dans la réponse individuelle aux conditions environnementales. Entre autres, les mâles devraient avoir une masse corporelle et un taux de croissance plus élevé que les femelles (Braun et al., 2011). Dû aux coûts associés à la reproduction, je m’attends aussi à ce que la réponse des individus reproducteurs soit plus forte lors de conditions défavorables que celle des individus non reproducteurs (Patil et al.,2015). Puisque c’est la réponse au niveau de la population qui m’intéresse dans le cadre de mon projet, j’ai contrôlé pour les individus, leur sexe et leur statut reproducteur dans mes analyses. Finalement, les juvéniles devraient avoir une réponse plus forte aux conditions défavorables que les adultes (Allainé et al.,1998; Bennett, 1999; Lenihan & VanVuren, 1996). Or, mon étude inclut uniquement les adultes puisque les juvéniles capturés chaque année sont trop peu nombreux pour nous permettre d’analyser les tendances de leur taux de croissance estival et leur survie.
Modèle d’étude : La marmotte des Rocheuses
La marmotte des Rocheuses fait partie des espèces de mammifères les moins étudiées en Amérique du Nord (Patil et al., 2013). Des populations de marmotte des Rocheuses sont retrouvées dans l’ouest de l’Amérique du Nord à partir de l’Alaska jusqu’au sud de l’État de Washington et du Montana (Braun et al., 2011). Au Canada, on la retrouve principalement au Yukon, dans les Territoires du Nord-Ouest, et au centre-nord de l’Alberta et de la Colombie-Britannique (Braun et al., 2011). Elle occupe des habitats pouvant atteindre jusqu’à 2500 m d’altitude, ce qui rend l’accès difficile pour la recherche scientifique (Barash 1989; Braun et al. 2011).
La marmotte des Rocheuses est un animal fouisseur qui hiberne en milieux alpins. En général, les marmottes peuvent passer près de 80 % de leur temps sous terre (Svendsen, 1976), où les conditions environnementales sont moins variables. Elles hibernent en groupes familiaux environ huit mois par an pendant la période hivernale (Barash 1976; Barash 1989), une période durant laquelle la survie est déterminée par les réserves corporelles adipeuses qu’elles ont accumulées pendant la période estivale (Armitage & Downhower, 1976). La période de reproduction a lieu dès la sortie de l’hibernaculum et les femelles reproductives n’ont qu’une seule portée de 2 à 5 jeunes par an (Braun et al. 2011). Les femelles reproductrices allaitent jusqu’à 4 semaines après la
naissance des jeunes qui émergent ensuite du terrier vers la mi-juillet (Barash 1980, Braun et al. 2011). L’âge de maturité sexuelle est atteint à deux ans (Barash 1989). Le système d’appariement est polygyne et les mâles adultes sont généralement plus lourds que les femelles adultes (Braun et al., 2011).
Le régime alimentaire des marmottes des Rocheuses varie au cours de la saison selon la disponibilité des ressources. Au début de la saison, elles consomment les feuilles des plantes herbacées puis, aux mois de juin et de juillet, elles se nourrissent davantage de fleurs et d’herbacées (Braun et al. 2011). À la fin du mois d’août, leur régime alimentaire est composé de graminées (Braun et al. 2011). Le synchronisme avec les ressources alimentaires est fondamental puisqu’il permet d’obtenir les réserves corporelles nécessaires à leur survie hivernale (Van Vuren & Armitage, 1991).
Aire d’étude : Caw Ridge
La population de marmottes des Rocheuses étudiée pour vérifier mes prédictions se trouve à Caw Ridge (54°N, 119°W) au nord-ouest de l’Alberta (Canada), dans le piémont des montagnes Rocheuses. L’altitude varie entre 1750 et 2170 m. La végétation typique de la toundra alpine est retrouvée à une altitude supérieure à 1900 m, avec une majorité de plantes herbacées et de saules arbustifs (Salix sp). Les espèces végétales dominantes sont les genres Carex, Kobresia, Poa, Agropyron et Phleum (Hamel et Côté. 2009). En dessous de 1900 m d’altitude, la forêt subalpine se compose principalement d’épinettes d’Engelmann (Picea engelmanii) et de sapins des Rocheuses (Abies lasiocarapa). Le climat alpin-subalpin est un intermédiaire entre un climat tempéré et polaire. Des températures inférieures à -4 °C et des chutes de neige sont fréquentes tout au long de l’année. La période de croissance de la végétation et de disponibilité des ressources alimentaires s’étend de la fin mai à la fin août. L’hiver est rude et marqué par des températures souvent inférieures à -40 °C (Festa-Bianchet & Côté, 2008). À Caw Ridge, les marmottes des Rocheuses sont souvent observées sur la crête montagneuse, au-dessus de la limite des arbres (Figure 1.1). Elles se trouvent généralement dans les parois rocheuses au sein desquelles elles se font des réseaux de tunnels et de terriers (Figure 1.1).
Figure 1.1. A) Observation typique d’une de marmottes des Rocheuses qui sont souvent observées sur un
rocher. B) Les marmottes des Rocheuses utilisent des réseaux de tunnels et de terriers creusés et façonnés dans les parois rocheuses.
Approche méthodologique
Pour mon projet, j’utilise les données obtenues lors de captures/recaptures d’individus accumulées entre les années 2004 à 2017 inclusivement. Chaque année, des individus sont capturés/recapturés dans des trappes Tomahawk et Havahart (Figure 1.2). De l’urine humaine est utilisée pour attirer les marmottes dans les trappes (Taulman, 1989). La période de capture débute à la fin du mois de mai et se termine au début du mois de septembre. Les individus sont manipulés dans un sac de contention (Figure 1.2), ce qui permet de les identifier, les peser et de récolter divers échantillons (Figure 1.3). Pour les identifier, les individus sont munis d’un transpondeur (« Passive Integrated Transponder », Avid Identification Systems, Inc. Californie, É.-U.) en plus de bagues d’oreilles sur lesquelles est gravé un code numérique unique et sont fixées de fils de couleurs dont la combinaison unique permet l’identification d’un individu à distance (Figure 1.3).
Au moment des manipulations, les individus sont pesés (±0,05 kg) avec des balances Pesola (Pesola AG, Baar, Switzerland) (Figure 1.3), la largeur de l’arc zygomatique est mesurée (±0,02 mm) avec un vernier (Mitutoyo Corporation, Takatsu, Japan), puis la longueur de leur corps et de leur queue est mesurée (±0,5 cm). Un échantillon d’ADN est aussi récolté pour chaque individu via un fragment de peau d’oreille. Le sexe de l’individu est déterminé pendant la capture par l’observation des organes génitaux (Figure 1.3). Le sexe de l’individu est ensuite validé par séquençage génétique (Gorrel et al., 2012). Le statut reproducteur est déterminé visuellement (Figure 1.3) : le scrotum d’un mâle est hypertrophié lorsqu’il s’est reproduit au printemps et les mamelles d’une femelle qui est reproductrice sont gorgées de lait jusqu’à la fin juillet. L’âge est estimé par des caractéristiques morphologiques telles que la taille et la masse. Les individus marqués sont souvent capturés plus d’une fois au cours d’une même saison.
Pour vérifier les effets des conditions en hiver, au printemps et à l’été sur la masse corporelle et sur la survie, j’ai utilisé des variables environnementales susceptibles d’influencer cette population (Chapitre 2, Figure 2.1). Pour les effets des conditions en hiver, j’ai utilisé le « North Pacific Index », dont des valeurs élevées sont associées à des hivers froids et enneigés (Hamel et al., 2009b). Pour le printemps, j’ai utilisé les températures maximales cumulées entre le premier avril et le 31 mai, le pourcentage de neige au sol à l’émergence estimé à partir d’images satellitaires et la vitesse de débourrement de la végétation calculée avec l’indice satellitaire «
Normalized difference vegetation index (NDVI) ». Finalement, j’ai utilisé la température cumulée entre le 1 juin
et le 15 septembre et un ratio du nombre de jours pour lesquels il y a eu des précipitations par rapport au nombre de jours total passé sur le terrain pour vérifier l’influence des conditions estivales. J’ai réalisé mes analyses statistiques en deux étapes. J’ai d’abord construit un modèle linéaire mixte afin de déterminer quelles sont les conditions environnementales influençant la masse à l’émergence et le gain en masse estivale. J’ai ensuite utilisé un modèle de capture-marquage-recapture (CMR) de type Cormack-Jolly-Seber pour évaluer les effets des conditions environnementales et de la masse à l’entrée en hibernation sur la survie annuelle. Les modèles CMR permettent de prendre en compte la probabilité de capture/recapture des individus et d’estimer ainsi la survie apparente (Jolly, 1965).
Figure 1.2. À Caw Ridge, les marmottes des Rocheuses sont capturées dans des trappes de type Tomahawk,
puis manipulées dans des sacs de contention. A) Femelle « orange-white » âgée de 6 ans dans une trappe de type Tomahawk lors d’une recapture en 2014. B) Jeune marmotton de l’année, capturé à l’aide d’une trappe de type Tomahawk et marqué en 2015. C) Le sac de contention est placé à la sortie de la trappe, et la marmotte capturée est dirigée à l’intérieur. D) Le sac de contention est en forme de cône au bout duquel il y a un trou d’aération et vers lequel la marmotte est dirigée. Les fermetures éclaires sur le dessus permettent d’accéder à l’individu pour les manipulations.
Figure 1.3. Une fois dans le sac de contention, les marmottes qui n’ont jamais été capturées sont identifiées.
A) Des étiquettes d’oreilles sont insérées sur chacune des oreilles et des fils de couleurs y sont fixés pour la reconnaissance visuelle sur le terrain. B) Chaque marmotte capturée est aussi munie d’un transpondeur numérique dans le bas du dos, pour faciliter la reconnaissance à la capture. C) Pour déterminer le sexe et le statut reproducteur des marmottes capturées, celles-ci son immobilisées sur le dos, la tête toujours dans le sac de contention. D) À chaque capture et une fois immobilisées dans le sac de contention, les marmottes sont pesées avec une balance de type Pesola.
Chapitre 1: Coping with seasonality: dynamics of
adult body mass and survival in an alpine hibernator
Résumé
En milieux alpins, le climat est caractérisé par une saisonnalité marquée de plus en plus perturbée par les changements climatiques. Chez les espèces qui hibernent, le fait d’avoir recours à la torpeur en hiver en plus d’avoir accès à des terriers souterrains permet aux individus de réduire leur exposition aux conditions extérieures lorsqu’elles sont défavorables et ainsi d’atténuer les impacts négatifs des changements climatiques. Nous avons étudié les liens entre les facteurs environnementaux et les variations interannuelles de la masse corporelle et de la survie chez les adultes d’une population de marmottes des Rocheuses à Caw Ridge en Alberta. Nous avions émis l’hypothèse que la variation interannuelle dans les conditions environnementales au printemps, à l’été et en hiver détermine la masse corporelle des individus en été en plus de la survie annuelle via des effets directs sur la qualité et la disponibilité des ressources alimentaires. Nous nous attendions aussi à ce que la masse à la fin de la saison d’activité soit l’un des principaux déterminant de la survie annuelle. Nos résultats démontrent un effet positif des printemps hâtifs sur le gain de masse estival et la survie annuelle. Nous observons aussi que la masse à l’émergence des marmottes qui ont connu des hivers froids et rigoureux est 47% inférieure à celle des marmottes qui ont connu des hivers plus doux. Toutefois, les marmottes qui émergent avec une masse plus faible aux printemps suivants des hivers plus rigoureux ont un gain de masse plus important pendant l’été. Ainsi, à la fin de l’été, elles atteignent une masse similaire à celles qui ont une masse plus élevée à l’émergence suivant un hiver plus doux. Cela suggère que les individus adoptent une stratégie d’allocation des ressources qui leur permet de maximiser leur gain de masse estival afin de survivre pendant la prochaine période d’hibernation. Cette capacité des marmottes à maximiser leur gain de masse estival contribue probablement à expliquer le fait que nous n’avons pas observé d’effets de la masse à la fin de la saison active sur la survie annuelle. Notre étude suggère que la masse corporelle et la survie des adultes peuvent être considérablement affectées par les conditions environnementales. Les changements prévus dans les conditions climatiques pourraient donc avoir des effets sur les espèces d’animaux fouisseurs qui hibernent en milieux alpins.
1.1 Abstract
Alpine mammals are highly vulnerable to current and projected climate change because they are confined to a certain elevation range. Physiological and behavioral adaptations in burrowing species could partly buffer the negative impacts of these forecasted changes. Sleep-or-hide behavior enable individuals to find shelter in burrows when the summer conditions are unfavorable and to hibernate during the winter, a stressful period of resources shortage. We studied the links between environmental factors and annual variations in adult body mass and survival over 14 years in a population of hoary marmots. We hypothesized that annual variation in seasonal environmental factors determines individual body mass and survival through direct effects on food quality and availability, and expected greater survival when marmots reach higher body mass at the end of the season. We found that harsh winters decreased mass at emergence from hibernation by 47% compared with mild winters. Nonetheless, adult marmots had a greater mass gain in summers following harsh winters and reached a similar mass at the end of the summer compared with summers following mild winters. This suggests that individuals can adopt a resources allocation strategy that allow them to maximize summer mass gain to survive the next hibernation and that probably contributed to the fact that we did not observe effects of mass at immergence on annual survival. Earlier springs also increased summer mass gain by 15 g/day, and tended to increase apparent survival by 23%, compared with late springs. Although adults are expected to have buffered responses to environmental changes compared to juveniles, our study suggests that adult traits can be considerably affected and that forecasted changes in climate conditions would trigger both positive and negative effects on the demography of alpine burrowing species.
1.2 Introduction
At high altitudes, changes in temperature and precipitation regimes induced by climate change have led to a widespread concern about the long-term viability of animal populations (McDonald & Brown, 1992; Parmesan & Yohe, 2003; Parmesan & Yohe, 2006). Several species restricted to the highest elevations are already near their climatic and geographic limits, and warming temperatures have led to drastic range collapses (McCain & King, 2014). Reduction of suitable habitat has also led to local extinctions for some alpine-dwelling species (Beever, et al., 2003; Beever et al., 2010; Moritz et al., 2008; Stewart et al., 2015), also decreasing genetic variability (Dirnböck et al., 2011; Ditto & Frey, 2007; Kerhoulas et al., 2015; Rubidge et al., 2012). Furthermore, the pace of climate change may exceed the capacity of many species to adapt to the altered climate (Barnosky & Kraatz, 2007; Davis et al., 2005; Parmesan, 2006). Sensitivity, level of exposure, and adaptive capacity to climatic changes greatly vary among species (Foden et al., 2013; McCain & King, 2014; Pacifici et al., 2015). Therefore, studies assessing species-specific responses to annual fluctuations in environmental and weather conditions are essential to understand, predict, and mitigate the impacts of climate change in high altitude ecosystems. Among alpine herbivores, some behavioral and physiological adaptations are assumed to buffer species facing climate change, such as the sleep-or-hide behavior (Armitage, 2014). Sleep-or-hide behavior is most common among small mammals (McCain & King, 2014; Robertson et al., 2004), and it includes the use of burrows and hibernation to avoid periods of low resource availability and/or unfavorable conditions (Liow et al., 2009; Rutherford-Thomas, 1974; Zervanos & Salsbury, 2003). For instance, burrowing species benefit from the more moderate and less variable temperatures in their underground burrows (Feldhamer et al., 2007). Individuals’ ability to isolate themselves and turn to low metabolic mode reduce their exposure to environmental stress. This may allow animals with the ability to perform sleep-or-hide behavior to better cope with a changing environment (Liow et al., 2009). Still, a growing number of studies are highlighting the effects of variation in environmental conditions on different body traits and population dynamics of burrowing species (Davidson et al., 2012; Humphries et al., 2002; Inouye et al., 2000; Lane et al., 2012; Rézouki et al., 2016). For instance, Canale et al. (2016) showed that environmental conditions shaped body size and body mass in alpine marmots (Marmota
marmota). Both traits benefited from earlier springs and body mass was affected by conditions during summer
and winter. Nonetheless, fewer studies have yet evaluated the influence of environmental conditions on both body mass and demographic components like survival.
Most species of ground-dwelling squirrels have an annual cycle typical of species with sleep-or-hide behavior: they store fat during the active season in prevision of several months of hibernation in burrows (Buck & Barnes, 1999; Eddingsaas et al., 2004). Burrows may also be used daily during the active period to avoid unfavorable conditions (Reichman & Smith, 1990; Young, 1990). Even though they have access to shelters, several environmental factors can directly or indirectly impact ground-dwelling squirrels (Armitage, 2013-2014; Van
Horne et al., 1997; Kneip et al., 2011; Lenihan & Van Vuren, 1996). For instance, conditions during winter may affect directly the metabolic rate and reserves depletion of hibernating individuals because the presence of a thick snow cover above hibernaculum increases insulation from low, stressful temperatures (Armitage, 2014; Barash, 1973; Inouye et al., 2000; Rézouki et al., 2016). On the other hand, persistent snow cover in spring could indirectly impair both survival at emergence and summer mass gain of ground-dwelling squirrels because it limits forage availability and shortens the growing season (Van Vuren & Armitage, 1991). Reduced food availability at emergence could force individuals to subsist on stored fat until vegetation growth begins (Van Vuren & Armitage, 1991). Direct impacts of environmental conditions during the active season may also be experienced because of thermoregulatory stress (Türk & Arnold, 1988). Temperatures over a critical thermal threshold increase energy expenditure and reduce activity (Melcher et al., 1990). Less time spent above-ground leads to reduced foraging bouts (Melcher et al., 1990) which can potentially impact body mass. Indirect effects of warmer summer temperatures may also occur through a reduction in forage digestibility due to accelerated vegetation growth and plant lignification (Doiron et al., 2013; Lenart et al., 2002). Additionally, summer rainfall may influence both forage availability and quality as well as individuals’ activity rate (Armitage, 2014; Zervanos & Salsbury, 2003). The relationships between seasonal variations of environmental variables and life-history traits of ground-dwelling squirrels are expected to have strong demographic consequences (Armitage, 2014; Van Horne, 2007; Kneip et al., 2011). They provide relevant insight to disentangle the prevalent environmental factors driving populations of mammals with sleep-or-hide tactics.
The hoary marmot (Marmota caligata) is the largest species of ground-dwelling squirrels in North-western America and is almost exclusively found in high alpine meadows (Braun et al., 2011). Despite their wide distribution, knowledge about their population dynamics is scarce (Patil et al., 2013). Hoary marmots, with their relatively long lifespan, hibernating behavior, and high altitudinal distribution, are a relevant model species to investigate the effects of interannual variations in environmental conditions. Here, we evaluated the influence of winter, spring, and summer conditions on adult body mass and survival in a population of hoary marmots monitored for 14 years in the foothills of the Canadian Rocky Mountains. In marmots, energy stored is directly linked with body mass (Armitage, 2007; Inouye et al., 2000). Therefore, we used body mass at emergence and summer mass gain as proxies for the energy reserves available in spring and the accumulation of body reserves during summer, respectively. Because marmots do not store food but rely uniquely on body fat during hibernation, body reserves are key to survive the winter (Humphries et al., 2003). Furthermore, in marmots, adult survival is a crucial demographic parameter (Ozgul et al., 2010). Because juveniles are more vulnerable to unfavorable conditions than adults (Lenihan & Van Vuren, 1996; Patil et al., 2013; Rézouki et al., 2016), we expected to find a highly buffered response to changes in weather conditions because we focused our work on adults.
Our first objective was to identify environmental factors determining body mass in hoary marmots. First, we hypothesized that winter conditions are a key determinant of body mass following hibernation and predicted that years with a thick layer of isolating snow would reduce thermoregulatory costs and lead to higher mass at emergence (Patil et al. 2013; Rézouki et al., 2016). Second, we hypothesized that access to high-quality forage during the active period would determine body mass gain in summer because high quality forage better fulfills the energetic demands associated with energy storage (Garel et al., 2011; Herfindal et al., 2006). We predicted a higher body mass gain in years with a more gradual vegetation growth, mild temperatures, and early snowmelt. Because drought lowers forage nutritional value (Van Horne et al., 1997) and enhances thermoregulatory stress (Melcher et al., 1990), we predicted years with hot and dry summers to reduce summer mass gain. Our second objective was to identify how environmental factors and body condition near immergence affect the survival of adult marmots. We hypothesized that mass at immergence prior to hibernation and winter conditions are the main determinants of annual survival (Ozgul et al., 2010). We expected positive effects of greater mass at immergence and snowier winters on annual survival. We also expected survival to be affected by spring conditions preceding and following hibernation, and conditions during summer via their influence on individual body mass.
1.3 Material and Methods
1.3.1 Study area and captures
Caw Ridge (54°N, 119°W) is in the foothills of the Rocky Mountains in west-central Alberta, Canada. The landscape includes a few cliffs and is mainly composed of steep grassy slopes and rocky hills. Hoary marmots are located at altitudes varying from the tree line (ca. 1900 m a.s.l.) up to the rocky ridges (2100 m a.s.l.). They feed on grassy slopes and often use rocky ridge lines. The alpine environment they inhabit is characterized by an arctic-subarctic climate, with rapidly changing weather. Winters at Caw Ridge are long and harsh with temperatures reaching below -40°C (Festa-Bianchet & Côté, 2008).
Each year between 2004 and 2017, we captured hoary marmots in Tomahawk and Havahart live traps baited with human urine (Taulman, 1989). The capture/recapture period started in late May (around emergence; Figure 1) and lasted until early September (around immergence; Figure 1). We manipulated captured individuals in contention bags, enabling us to mark and measure them. We identified every individual with numbered ear-tags to which we attached color-coded wires for identification from a distance. In addition, we implanted subcutaneously a Passive Integrated Transponder, PIT tag (Avid Identification Systems, Inc. California, USA), providing reliable long-term identification with a unique barcode for each marmot. We measured body mass (±0.05 kg) with Pesola scales (Pesola AG, Baar, Switzerland). We verified the log-log relationship between these skeletal measurements and body mass to detect any outlier (Annexe A). We knew the exact age of the
individuals that were first captured when they were pups or yearlings. Otherwise, the age of the marmots that were captured when they were already adults was estimated at two years or more. All analyses focused on mass and survival for individuals of two years old and over because we had limited sample size for pups and yearlings. We added one more adult individual according to the width of its zygomatic arch measured in the field (Annexe A). Sex and reproductive status (breeder vs non-breeder) were determined by observing the genitalia and lactation marks in females. Reproductive males have extra scrotal testes and reproductive females have nipples swollen with milk and surrounded by patches of flattened hairs. We collected DNA samples to validate sex assignments by PCR (Gorrell et al., 2012). Handling time was on average 15 min [range: 3-40 min]. We had a research permit issued by the Alberta Environment and Parks Policy and Planning Division, Fish and Wildlife Policy Branch, and our protocols were approved by the animal care committee (CPAUL) at Laval University, Quebec, Canada. Furthermore, our research did not involve endangered or protected species.
1.3.2 Environmental conditions
To assess the influence of environmental variation on mass at emergence, summer mass gain, and annual survival, we compiled variables describing annual variation in conditions during winter, spring, and summer (Figure 1). As a global index for winter conditions, we used the November-March anomalies of the North Pacific Index (NPI; Trenberth & Hurrell, 1994). At Caw Ridge, NPI is negatively correlated with local temperatures and positively correlated with local precipitations (Hamel et al., 2009b). Winters with high NPI values are therefore snowier and colder than winters with low NPI values.
We defined spring conditions with three variables: percent snow cover at emergence, cumulated spring temperatures, and the rate of spring green-up (Figure 1). Snow cover was estimated based on satellite data from the National Snow and Ice Data Center and the MODIS/Terra Snow Cover 8-Day L3 Global 500m Grid product (MOD10A2; Hall & Riggs, 2016). Images were available every 8 days with a spatial resolution of 500 m. The area occupied by marmots included 42 pixels and we used the maximum extent of snow cover during an eight-day period by coding 1 if a pixel was covered by snow and 0 if not. We computed the percentage of pixels with a value of 1 on 16 May as a measure of snow persistence around emergence because hoary marmots generally emerge from hibernation in early to mid-May (Braun et al., 2011). Higher values indicate a larger area covered by snow. The percentages of snow on the ground estimated with satellite images were highly consistent with those observed directly in the field (Annexe B). To contrast cooler versus warmer springs and as an index of spring phenology (e.g. Moyes et al., 2011), we estimated cumulated temperatures from 1 April to 31 May with data obtained from Hendrickson Creek meteorological station. We used data from the meteorological station rather than data collected directly in the field because field work only started in mid-May and temperatures at Hendrickson Creek were highly correlated with temperatures at Caw Ridge (Annexe B). We included April in the spring index because marmots multiply arousal bouts underground during the last weeks of hibernation (French,







![Figure S1. Correlations between the log of body mass (kg) and the log of zygomatic arch (mm) [A] and the log of body length (cm) [B]](https://thumb-eu.123doks.com/thumbv2/123doknet/3187861.91042/63.918.150.416.212.568/figure-correlations-body-mass-zygomatic-arch-body-length.webp)