Caractérisation fonctionnelle de facteurs de
virulence chez Streptococcus suis
Thèse
Bruno Haas
Doctorat en microbiologie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Bruno Haas, 2016
Caractérisation fonctionnelle de facteurs de
virulence chez Streptococcus suis
Thèse
Bruno Haas
Sous la direction de :
iii
RÉSUMÉ
Les progrès technologiques dans l'industrie de la viande ont des répercussions considérables sur les agents pathogènes de ces environnements. Parmi ceux-ci,
Streptococcus suis occupe une place prédominante dans l’industrie porcine. En effet, S. suis, colonisateur naturel des voies respiratoires et digestives du porc, peut infecter son
hôte en provoquant des méningites, septicémies, endocardites, arthrites ou pneumonies. De surcroît, S. suis peut également infecter l’humain en provoquant majoritairement des méningites et septicémies, et a notamment été la cause de deux épidémies en Chine en 1998 et 2005. La pathogenèse des infections à S. suis demeure partiellement connue à l’heure actuelle, rendant difficile le contrôle des infections. Il est par conséquent essentiel de caractériser les facteurs de virulence chez S. suis puisqu'ils pourraient représenter des cibles d’intérêt pour des applications préventives ou thérapeutiques. Ce projet de doctorat consiste donc en la caractérisation fonctionnelle de facteurs de virulence chez S. suis. Dans un premier temps, la capacité de S. suis à moduler son potentiel pro-inflammatoire en présence de concentrations sous-inhibitrices d'amoxicilline a été mise en évidence. Dans un second temps, la caractérisation plus avancée de la hyaluronate lyase de S. suis a permis de démontrer que son activité ne contribue pas à la virulence de la bactérie étant donné son absence au sein de souches les plus virulentes, mais que les interactions avec l'acide hyaluronique pourraient moduler la virulence de S. suis. Par la suite, l'étude fonctionnelle d’une DNase de S. suis a permis de démontrer son implication comme facteur de virulence et suggère son intérêt dans le développement de vaccins. Finalement, le dernier objectif du projet a permis la mise en évidence de la production de microvésicules fortement immunogéniques par S. suis. La présence de facteurs de virulence dans leur contenu protéique représente un élément encourageant dans le développement de vaccins contre l'agent pathogène.
Ce projet a donc permis d'élargir les connaissances sur le potentiel néfaste de l'utilisation des antibiotiques à faible concentration dans l'industrie porcine, sur le rôle des activités hyaluronate lyase et DNase dans la virulence de S. suis, et de découvrir un nouveau mécanisme impliqué dans la virulence de la bactérie par le biais des microvésicules.
iv
ABSTRACT
Technological progress in the meat industry has a substantial impact on pathogens within these environments. Among these pathogens, Streptococcus suis is of utmost importance in the swine industry. S. suis, natural colonizer of the respiratory and digestive tracts of porks, can infect its host causing mainly meningitis and septicemia as well as endocarditis, arthritis and pneumonia. Furthermore, S. suis can infect humans causing mainly meningitis and septicemia, and was the cause of two major outbreaks in China in 1998 and 2005. The pathogenesis of S. suis infections remains partially understood, making the control of infections challenging. Consequently, it is of utmost importance to characterize virulence factors that could represent targets of interest for preventive or therapeutic applications. This project focused on the functional charaterization of virulence factors produced by
S. suis. First, the ability of S. suis to modulate its pro-inflammatory potential in the
presence of sub-inhibitory concentrations of amoxicillin was demonstrated. Then, a further characterization of S. suis hyaluronate lyase brought evidence that this activity does not contribute to the bacterium's virulence since it is absent in most virulent strains. However, interactions with hyaluronic acid could modulate S. suis virulence. The functional study of
S. suis DNase showed its implication as a virulence factor and suggested its interest in
vaccine development. Finally, the last objective of this project lead to the discovery of the production of highly immunogenic microvesicles by S. suis. The presence of major virulence factors associated with these structures also represents an exciting fact for the development of vaccines against S. suis.
This project allowed to expand the knowledge on the noxious potential of the use of low concentrations of antibiotics in the swine industry, on the role of hyaluronate lyase and DNase activities in S. suis virulence as well as on the production of microvesicles by S. suis that represents a new virulence mechanism.
v
TABLE DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... iv
TABLE DES MATIÈRES ... v
LISTE DES TABLEAUX ... x
LISTE DES FIGURES ... xi
LISTE DES ABRÉVIATIONS ... xiii
REMERCIEMENTS ... xv
AVANT PROPOS ... xvii
CHAPITRE I : Introduction ... 1
L’industrie porcine ... 1
L’industrie porcine et sa place dans l’économie mondiale ... 1
L’industrie porcine au Canada ... 1
L’industrialisation des procédés : une épée à double tranchant ... 2
Les agents pathogènes porcins ... 2
Streptococcus suis ... 3
Historique ... 3
Classification ... 3
Distribution... 5
L’infection à S. suis ... 6
Pathogenèse des infections à S. suis ... 7
Colonisation de l’hôte ... 8
Dissémination et évasion des défenses de l’hôte ... 10
Dérégulation du système immunitaire de l’hôte ... 12
Passage de la barrière hématoencéphalique : la méningite à S. suis ... 13
Composantes de S. suis dont le rôle dans la virulence est inconnu ou incertain ... 14
La problématique des infections à S. suis ... 17
Le traitement des infections ... 17
La résistance de S. suis aux antibiotiques ... 17
vi
Le projet à l’étude ... 22
Problématique... 22
Hypothèse ... 22
Objectifs spécifiques ... 22
Objectif 1 : Impact de concentrations sous-inhibitrices d’amoxicilline sur la virulence de S. suis ... 23
Objectif 2 : Caractérisation de la hyaluronate lyase de S. suis ... 24
Objectif 3 : Caractérisation d’une DNase extracellulaire de S. suis ... 26
Objectif 4 : Mise en évidence de la production de microvésicules par S. suis et leur possible rôle dans la virulence ... 28
Pertinence du projet ... 31
CHAPITRE 2 : Impact de concentrations sous-inhibitrices d’amoxicilline sur la virulence de S. suis ... 32
Article 1 : Impact of sub-inhibitory concentrations of amoxicillin on Streptococcus suis capsule gene expression and pro-inflammatory potential ... 32
Résumé ... 33
Abstract ... 34
Introduction ... 35
Results ... 37
Determination of MIC of Amoxicillin for S. suis ... 37
S. suis Capsule Expression ... 37
Visualization of S. suis Capsule by Transmission Electron Microscopy ... 38
Pro-Inflammatory Potential of S. suis ... 38
Activation of the NF-κB Pathway in Monocytes ... 39
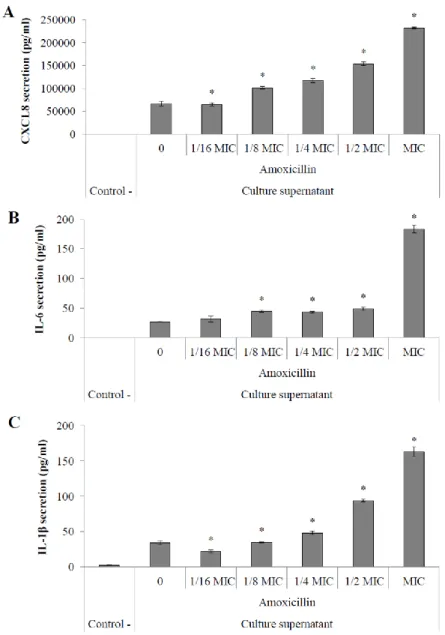
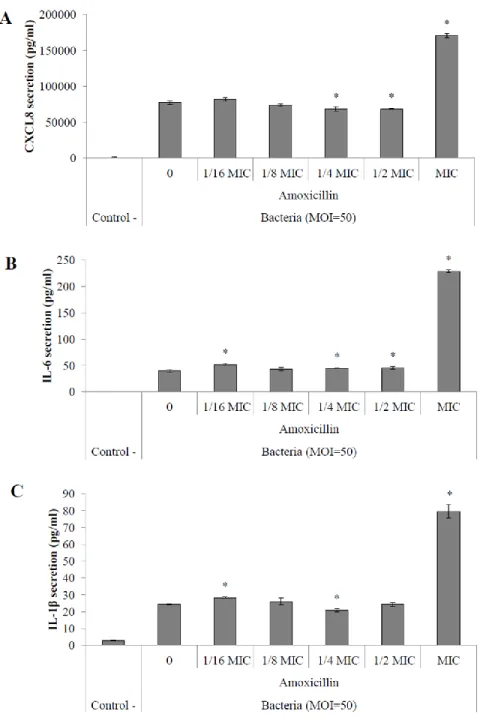
Pro-Inflammatory Cytokine Secretion by Macrophages ... 40
Discussion ... 43
Materials and methods ... 47
Bacteria and growth conditions ... 47
Determination of Minimal Inhibitory Concentration (MIC) of Amoxicillin on S. suis 47 S. suis Capsule Expression ... 47
Visualization of S. suis Capsule by Transmission Electron Microscopy ... 48
Analysis of the Pro-Inflammatory Potential of S. suis Conditionned with Sub-Inhibitory Concentrations of Amoxicillin ... 48
vii
Activation of the NF-κB Pathway in Monocytes ... 49
Quantification of Pro-Inflammatory Cytokine Secretion by Macrophages... 49
Statistical Analysis ... 50 Acknowledgments ... 51 Author Contributions ... 51 Conflicts of Interest ... 51 Abbreviations ... 51 References ... 52
CHAPITRE 3 : Caractérisation de la hyaluronate lyase de S. suis... 58
Article 2 : Hyaluronate lyase activity of Streptococcus suis serotype 2 and modulatory effects of hyaluronic acid on the bacterium's virulence properties ... 58
Résumé ... 59
Abstract ... 60
Background ... 61
Methods ... 64
Bacterial strains and culture conditions ... 64
Plate assay for hyaluronate lyase activity ... 65
Gene amplification and sequencing ... 66
Effect of hyaluronic acid on biofilm formation by S. suis ... 67
Effect of hyaluronic acid on adherence of S. suis to BMEC ... 67
Effect of hyaluronic acid on virulence factor gene expression by S. suis ... 68
Effect of hyaluronic acid on secretion of pro-inflammatory cytokines by BMEC ... 69
Statistical analysis ... 69
Results ... 70
Distribution of hyaluronate lyase activity among S. suis STs ... 70
Comparative analysis of S. suis hyaluronate lyase gene ... 70
Effect of hyaluronic acid on biofilm formation, adherence to BMEC, and virulence factor gene expression in S. suis P1/7 ... 71
Effect of hyaluronic acid on pro-inflammatory cytokine secretion by BMEC ... 74
Discussion ... 76
Conclusions ... 79
viii
Authors' contributions ... 80
Acknowledgments ... 80
References ... 80
Supporting informations ... 85
Hyaluronic acid binding assay ... 85
CHAPITRE 4 : Caractérisation d’une DNase extracellulaire de S. suis ... 86
ARTICLE 3 : Characterization of DNase activity and gene in Streptococcus suis and evidence for a role as virulence factor ... 86
Résumé ... 88
Abstract ... 89
Background ... 90
Methods ... 92
Bacterial strains and culture conditions ... 92
Determination of DNase activity... 94
Activity spectrum of S. suis DNase activity ... 95
Genotyping and sequence analysis ... 95
Isolation and characterization of a DNase deficient mutant ... 96
Virulence assay in an amoeba model ... 96
Cytokine and MMP-9 secretion by a macrophage model ... 97
Results ... 98
Distribution of DNase activity and comparative analysis of ssnA gene in S. suis according to STs ... 98
Genetic organization of ssnA gene (SSU1760) ... 99
Percentage identity of the DNase SsnA (SSU1760) with similar proteins found in pathogenic streptococci ... 99
Characterization of S. suis P1/7 DNase activity ... 100
Isolation of a DNase-deficient mutant from a bank of mutants ... 102
Virulence of the DNase-deficient mutant in an amoeba virulence model ... 103
Inflammatory response induced by the DNase-deficient mutant in a macrophage model ... 103
Discussion ... 105
ix
Conflicts of interest ... 107
Authors' contributions ... 107
Acknowledgments ... 108
References ... 108
CHAPITRE 5 : Mise en évidence de la production de microvésicules par S. suis et leur possible rôle dans la virulence ... 113
Article 4 : Isolation, characterization and biological properties of membrane vesicles produced by the swine pathogen Streptococcus suis ... 113
Résumé ... 114
Abstract ... 115
Introduction ... 116
Materials and Methods ... 118
Bacterial strain and isolation of membrane vesicles ... 118
Transmission electron microscopy ... 118
Proteomic analysis... 118
Determination of enzymatic activities... 120
Neutrophil extracellular traps degradation ... 120
Activation of the NF-κB signaling pathway in monocytes and macrophages ... 121
Cytokine secretion by macrophages ... 122
Statistical analysis ... 122 Results ... 123 Discussion ... 135 Acknowledgments ... 137 References ... 138 CHAPITRE 6 : Discussion ... 145 Conclusion ... 161 Bibliographie ... 162
x
LISTE DES TABLEAUX
Tableau 1. Distribution géographique et prévalence des sérotypes de S. suis ... 6 Table 2. Primers used for the determination of capsule expression in S. suis P1/7. ... 48 Table 3. Sequence type, origin, type of infection, and hyaluronate lyase activity of S. suis serotype 2 isolates. ... 64 Table 4. Primers used for the amplification of hyaluronate lyase gene in S. suis strains. .... 66 Table 5. Primers used for the determination of virulence factor gene expression in S. suis P1/7. ... 69 Table 6. Sequence type (ST), origin, and DNase activity of S. suis serotype 2 strains used in this study. ... 92 Table 7. Stability, optimal conditions and inhibition of DNase activity of S. suis P1/7. ... 101 Table 8. Susceptibility of S. suis P1/7 and its DNase-deficient mutant (M2D) to predation of D. discoideum. ... 103 Table 9. Protein content of S. suis P1/7 membrane vesicles identified by ES MS/MS in order of abundance in each functional group. ... 125 Table 10. Virulence factors identified in S. suis P1/7 membrane vesicles. ... 129
xi
LISTE DES FIGURES
Figure 1. Relative expression of the capsule gene cps2J by S. suis P1/7 in the presence of sub-inhibitory concentrations of amoxicillin. ... 37 Figure 2. Transmission electron microscopy of overnight cultures of S. suis P1/7 grown in THB alone (A) or THB supplemented with 1/2 MIC of amoxicillin (B). ... 38 Figure 3. Activation of NF-κB signaling pathway in monocytes stimulated with culture supernatants (A) or S. suis P1/7 whole cells (B) conditioned in sub-inhibitory
concentrations of amoxicillin. ... 40 Figure 4. Secretion of pro-inflammatory cytokines CXCL8 (A), IL-6 (B) and IL-1β (C) by macrophages stimulated with culture supernatants of S. suis P1/7 conditioned with
amoxicillin. ... 41 Figure 5. Secretion of pro-inflammatory cytokines CXCL8 (A), IL-6 (B) and IL-1β (C) by macrophages stimulated with S. suis P1/7 whole cells (MOI = 50) conditioned with
amoxicillin. ... 42 Figure 6. Hyaluronate lyase activity of S. suis MGGUS2 (HylA -, left) and S. suis S735 (HylA +, right), as determined using the plate assay... 66 Figure 7. Comparative analysis of nucleic acid sequence of the hyaluronate lyase gene (hylA) in S. suis belonging to ST1, ST25 and ST28. ... 71 Figure 8. Effect of hyaluronic acid on S. suis P1/7 growth (A) and biofilm formation (B). 72 Figure 9. Effect of hyaluronic acid on the adherence of S. suis P1/7 to BMEC. ... 73 Figure 10. Effect of hyaluronic acid on virulence factor gene expression by S. suis P1/7. . 74 Figure 11. Effect of hyaluronic acid on the secretion of IL-6 (A) and IL-8 (CXCL8) (B) by BMEC. ... 75 Figure 12. Binding of hyaluronic acid to BMEC and S. suis P1/7 (bacteria).. ... 78
xii
Figure 13. Comparative analysis of the ssnA gene according to STs. ... 99 Figure 14. Electrophoretic analysis of DNA degradation by S. suis P1/7 cells. ... 102 Figure 15. Quantification of pro-inflammatory cytokines produced by macrophages
stimulated with S. suis P1/7 and M2D. ... 104 Figure 16. Transmission electron micrographs of an overnight culture of S. suis P1/7 (panel A) and the membrane vesicle preparation (panel B). ... 123 Figure 17. General locations (A) and functions (B) of proteins identified in S. suis P1/7 membrane vesicles by ES MS/MS. ... 128 Figure 18. Determination of subtilisin (A) and DNase (B) activities in S. suis membrane vesicles. ... 130 Figure 19. Quantification of NET degradation by S. suis membrane vesicles. ... 131 Figure 20. Quantification of NF-κB activation in U937-3xκB-LUC monocytes (A) and macrophage-like cells (B) by S. suis membrane vesicles (0.01 to 40 µg/ml), E. coli LPS (10 µg/ml), and S. suis P1/7 whole bacteria (MOI = 100). ... 132 Figure 21. Quantification of CXCL-8 (A), TNF-α (B), and IL-1β (C) secretion by
macrophage-like cells stimulated with S. suis membrane vesicles (1 to 40 µg/ml), E. coli LPS (10 µg/ml), and S. suis P1/7 whole bacteria (MOI = 100)... 134
xiii
LISTE DES ABRÉVIATIONS
A550 : absorbance à 550 nmADN : acide désoxyribonucléique ARN : acide ribonucléique
BHI : infusion de cœur et de cerveau (Brain Heart Infusion)
BLASTp : outil de recherche basique d’alignements locaux pour les protéines (Basic Local Alignment Search Tool
protein)
BMEC : cellules endothéliales microvasculaires cérébrales (Brain
microvascular endothelial cells)
BSA : albumine sérique bovine CC : complexes clonaux CO2 : dioxyde de carbone CXCL8 (IL-8) : interleukine-8 DIG : digoxygénine DMSO : diméthylsulfoxyde DNase : désoxyribonucléase DppIV : dipeptidyl-peptidase IV EDTA : acide éthylène diamine tétraacétique
EGTA : acide éthylène glycol tétraacétique
ELISA : enzyme linked immunosorbant
assay
FBS : sérum bovin fœtal
Fbps : protéine de liaison au fibrinogène Fhb : protéine de liaison au facteur H FITC : isothiocyanate de fluorescéine GAS : Streptocoques de groupe A GBS : Streptocoques de groupe B HCl : acide chlorhydrique IFN : interféron IgA : immunoglobuline A IgG : immunoglobuline G IL : interleukine LPS : lipopolysaccharide MgCl2 : chlorure de magnésium
MIC : concentration minimale inhibitrice (CMI)
MLST : multilocus sequence typing MMP : métalloprotéinase matricielle MOI : multiplicité d’infection MVs : vésicules membranaires NBT : nitroblue tetrazolium
NETs : neutrophil extracellular traps NF-κB : facteur nucléaire kappa-B OD : densité optique
PBS : phosphate buffered saline PCR : réaction en chaîne de la polymérase
PMA : phorbol myristate acétate qRT-PCR : réverse transcription et réaction en chaîne par polymérase quantitative
RNase : ribonucléase
RPMI : Roswell Park Memorial Institute
medium
ST : sequence type THB : Todd-Hewitt Broth TLR : toll-like receptor
xiv
« Only two things are infinite, the universe and human stupidity,
and I'm not sure about the former. »
xv
REMERCIEMENTS
Je tiens tout d’abord à remercier le Dr Daniel Grenier de m’avoir accueilli dans son laboratoire et m’avoir laissé la chance d’effectuer ces travaux sous sa direction. Votre patience et votre gentillesse ont permis de rendre mon séjour au Canada très enrichissant, autant par les enseignements professionnels que personnels. Merci du fond du cœur de m’avoir soutenu jusqu’au bout, car, par moments, j’en avais vraiment besoin !
Une pensée toute particulière va pour mes parents, qui, malgré leur réticence du début (surtout pour toi Maman), m’ont laissé prendre cet avion pour « traverser la rivière ». Votre soutien m’a toujours aidé à garder la tête hors de l’eau, mais toujours sur les épaules, sans vous je n’en serais pas là actuellement. D’ailleurs, merci à toi Papa de m’avoir bercé de messages subliminaux, tes « quoi de neuf docteur ? » vont enfin porter leurs fruits !
Merci à Cindy de m’avoir soutenu depuis le début, tu m’as toujours poussé de l’avant et cru en moi, surtout en cas de coups durs. Tu as toujours représenté un exemple pour moi et je t’en suis grandement reconnaissant. Nos escapades nord-américaines ont permis de nous évader et ont rendu ce séjour inoubliable. Tu as su me supporter dans tous mes états, ça n’a pas été facile tous les jours, mais tu n’as jamais baissé les bras. Ta persévérance m’a toujours motivé et permis d’avoir confiance en moi dans les pires moments.
A Jordan, petite bouille que tu étais au moment de partir, je t’ai vu grandir à travers l’écran de mon PC lors de nos conférences Skype, c’est à cause de toi que mes retours sont de plus en plus difficiles. Je suis désolé d’avoir raté tant de choses, mais la vie requiert des sacrifices, tu le comprendras dans... beaucoup de dodos... Tu as rythmé ma vie de fin de semaine ici avec tes appels inopinés, ça a toujours été un plaisir de savoir que tu penses à moi, même de si loin. Merci également à mon frère et sa conjointe d’avoir permis de développer et renforcer ce lien avec le petit.
Un grand merci à Dre Laetitia Bonifait, tu m’as accueilli à mon arrivée et tu as su être une parfaite mentore lorsque j’ai commencé. Ton honnêteté et ta franchise ont rendu mon adaptation et mon intégration à la vie québécoise tellement plus facile. Merci pour ta bonne humeur qui m’a permis de garder le moral au labo durant les trois premiers mois qui ont
xvi
parfois été durs. Tu n’es pas passée par quatre chemins pour me remettre en place lorsque cela était nécessaire, tu as parfaitement géré l’affaire !
Un énorme merci à Jabrane, à mes yeux tu n'es pas qu'un simple collègue ou ami, tu fais partie de ma famille au Canada! Ta bonne humeur, ta positivité, ta générosité et ta gentillesse m'ont beaucoup aidé à garder le cap, je ne l'oublierai jamais, merci du fond du coeur.
Merci à tous les membres du laboratoire du Dr Grenier : Katy, Geneviève et Amel, pour votre continuelle bonne humeur et vos coups de main dans les manips, vous faites vivre cette équipe et votre dynamisme rend la vie au laboratoire tellement plus agréable !
Je tiens également à remercier tous les étudiants et stagiaires de passage au laboratoire qui ont contribué de près ou de loin à apporter de la vie et de la bonne humeur au laboratoire : Annie, Marie-Pierre, Jade, Fanny, Olivia, Myriam, Andréanne, Telma et Philippe. J’en oublie certainement et je m’en excuse.
Finalement, je tiens à remercier les membres de mon comité d’encadrement, Dre Fatiha Chandad, Dr Steve J. Charette et Dr Michel Frenette d’avoir pris le temps de me suivre durant ce doctorat, merci pour vos critiques constructives lors de nos entretiens qui m’ont permis d’améliorer sans cesse ma démarche scientifique. Merci également au Dr Nahuel Fittipaldi d’avoir accepté de contribuer à l’évaluation de mes travaux en tant qu’examinateur externe.
xvii
AVANT PROPOS
La présente thèse de doctorat est divisée en trois sections. La première section représente une mise en contexte et une introduction sur Streptococcus suis en présentant son importance économique de même que l’avancée des connaissances sur la virulence de la bactérie, de sa découverte à aujourd’hui. La seconde section contient les résultats obtenus au cours du doctorat sous forme de quatre articles. Finalement, la dernière section de la thèse constitue une discussion générale des résultats obtenus au cours du projet et leur mise en contexte avec les connaissances actuelles sur la virulence de S. suis.
Premier article :
Impact of sub-inhibitory concentrations of amoxicillin on Streptococcus suis capsule gene expression and pro-inflammatory potential.
Cet article a été publié en avril 2016 dans la revue Pathogens sous la référence 2016,5,37. La contribution des auteurs est la suivante : le premier auteur (Bruno Haas) a effectué les expériences et a rédigé la première version du manuscrit. Le tout a été effectué sous la supervision de Dr Daniel Grenier qui a également contribué à la conception des expériences, l’analyse des données et la rédaction du manuscrit.
Deuxième article :
Hyaluronate lyase activity of Streptococcus suis serotype 2 and modulatory effects of hyaluronic acid on the bacterium's virulence properties.
Cet article a été publié en 2015 dans la revue BioMed Central Research Notes sous la référence (2015) 8:722. La contribution des auteurs est la suivante : Bruno Haas était l’expérimentateur principal de cette étude tandis que Dre Laetitia Bonifait a effectué le criblage d’activité hyaluronidase. Katy Vaillancourt était chargée des essais de biologie moléculaire et de leur analyse. Le Dr Marcelo Gottschalk a fourni les souches de S. suis au laboratoire. Le Dr Daniel Grenier a supervisé et conçu l’étude. La rédaction de l’article a été effectuée par Bruno Haas sous la supervision de Dr Daniel Grenier. Tous les auteurs ont lu et approuvé le manuscrit avant sa soumission.
xviii
Troisième article :
Characterization of DNase activity and gene in Streptococcus suis and evidence for a role as virulence factor.
Cet article a été publié en 2014 dans la revue BioMed Central Resarch Notes sous la référence (2014), 7:424. La contribution des auteurs est la suivante : Bruno Haas était l’expérimentateur principal de l’étude tandis que Dre Laetitia Bonifait a effectué le criblage de la banque de mutant pour l’activité DNase, a isolé le mutant DNase et a effectué une partie des tests de virulence. Katy Vaillancourt a effectué les essais de biologie moléculaire et a procédé à leur analyse. Le Dr Steve J. Charette a supervisé les tests de virulence. Le Dr Marcelo Gottschalk a fourni les souches de S. suis au laboratoire. Le Dr Daniel Grenier a conçu et supervisé cette étude ainsi que la rédaction du manuscrit par Bruno Haas. Tous les auteurs ont lu et approuvé le manuscrit avant sa soumission.
Quatrième article :
Isolation, characterization and biological properties of membrane vesicles produced by the swine pathogen Streptococcus suis.
Cet article a été publié en 2015 dans la revue PLoS ONE sous la référence (2015)
10(6):e0130528. La contribution des auteurs est la suivante : Bruno Haas était
l’expérimentateur principal de ce projet. Le projet a été conçu par Dr Daniel Grenier et Bruno Haas. Les analyses protéomiques ont été réalisées par la plateforme de protéomique du CHUL de Québec. Bruno Haas a rédigé l’article sous la supervision du Dr Daniel Grenier.
Les numéros de figures et tableaux ont été modifiés par rapport aux articles originaux afin de suivre une suite logique dans la présente thèse. De plus, les tableaux et figures ont été insérés dans le texte suivant le paragraphe où ils ont été cités pour la première fois.
1
CHAPITRE I : Introduction
L’industrie porcine
L’industrie porcine et sa place dans l’économie mondiale
L’industrie de la viande occupe une place très importante dans l’économie mondiale. En effet, pour répondre à la demande accrue de la population, la production totale de viande destinée à la consommation en 2015 est estimée à plus de 315 millions de tonnes. Les dix entreprises en tête dans le secteur ont généré un revenu estimé à près de 200 milliards de dollars annuellement (données collectées entre 2011 et 2013) [1]. Tandis que l’industrie bovine est demeurée stable sur la dernière décennie, les industries aviaire et porcine ont, quant à elles, pris leur envol au cours des vingt dernières années. Cette tendance est principalement liée à l’industrialisation des procédés, l’élevage en masse et le rendement accru des abattoirs qui ont permis de réduire les coûts de production afin de rendre les denrées plus accessibles. En 2012, l’industrie porcine dominait le marché mondial de la viande avec 36,3% de la production totale. Entre 2010 et 2012, cette industrie a produit près de 100 millions de tonnes de viande en moyenne par année, dont la moitié en Chine. L’Europe vient en seconde position avec une production de viande porcine s’élevant à 23 millions de tonnes par année, devant les États-Unis (10,2 millions de tonnes), le Brésil (3,3 millions de tonnes) et la Russie (2,5 millions de tonnes) [1].
L’industrie porcine au Canada
Le Canada représente le sixième producteur mondial de viande porcine avec 2,1 millions de tonnes produites en moyenne par année entre 2010 et 2012. L’industrie porcine occupe donc une place importante dans l’économie canadienne, et près de la moitié de la production de viande porcine est destinée à l’exportation. Les principaux pays importateurs sont les États-Unis, le Japon, l’Union européenne, la Russie et la Chine. La production de viande porcine génère des recettes annuelles de plus de trois milliards de dollars canadiens par année. Ceci représente 30% des revenus générés par la production animale canadienne et 10% des revenus totaux de l’agriculture dans le pays. Afin de permettre au secteur de
2
perdurer et de demeurer compétitif, le gouvernement canadien surveille de près les exploitations agricoles (http://www.canadapork.com).
L’industrialisation des procédés : une épée à double tranchant
L’industrialisation des procédés d’élevage et d’abattage amène des avantages économiques importants. En effet, au cours des années, une augmentation de la capacité des exploitations agricoles ainsi que l’utilisation de compléments alimentaires ont permis d’accélérer la croissance et l’engraissement des animaux tout en réduisant leur coût de production. De plus, la création d’abattoirs à haute capacité a permis l’augmentation de la production de viande tout en diminuant le nombre d’établissements. En effet, à l’heure actuelle, il est possible d’obtenir les produits finis à partir d’un animal vivant en l’espace de quelques minutes. Ainsi, la seconde entreprise leader dans le domaine, Tyson Foods, est capable de procéder à la préparation de 42 millions de poulets, 170 000 bovins et 350 000 porcs par semaine [1]. Un tel rendement représente une avancée économique considérable dans l’industrie de la viande, mais la centralisation des procédés représente également un risque majeur. L’augmentation de la capacité des élevages et des abattoirs concentre un très grand nombre d’animaux dans des espaces restreints. Or, cette tendance a comme conséquence de rendre plus difficile le contrôle des agents pathogènes à l’intérieur des établissements. Les animaux présentant des symptômes peuvent être plus difficilement décelés et, généralement, au moment où un animal à risque est identifié, l’agent pathogène a probablement été disséminé à d’autres animaux du troupeau.
Les agents pathogènes porcins
L’industrie porcine est touchée par de nombreux agents pathogènes microbiens. En effet, plus de vingt maladies infectieuses porcines sont bien connues à l’heure actuelle, lesquelles mettent en cause des virus, au moins 18 agents bactériens, de même que certains mycètes et parasites [2]. Ces infections d’origine diverses entraînent d’importantes dépenses pour l’industrie autant en ce qui a trait à la prévention qu’au traitement. En effet, les contraintes logistiques impliquées lorsqu’un agent à risque est identifié peuvent aboutir à la mise en quarantaine des animaux infectés, jusqu’à l’abattage de cheptels entiers suivi d’une quarantaine et une décontamination des infrastructures. Parmi les agents bactériens
3
menaçant l’industrie porcine, les streptocoques, plus spécifiquement Streptococcus suis, sont une cause majeure d’infection.
Streptococcus suis
Historique
Les streptocoques sont des bactéries à Gram positif appartenant au genre Streptococcus généralement organisés en courtes chaînes ou en paires. La classification de Lancefield permet de classer les streptocoques en fonction de l’activité sérologique des polysaccharides de surface qu’ils possèdent. De manière générale, les streptocoques ont un métabolisme fermentaire bien qu’ils soient aérotolérants [3].
Dans les années 1950 aux Pays-Bas et en Angleterre, plusieurs exploitations porcines ont été touchées par un début d’épidémie de méningo-encéphalite chez les porcelets. Après analyse de prélèvements sur les porcs malades, des streptocoques, ovoïdes organisés en courtes chaînes ou par paires et possédant une activité α- ou β-hémolytique (sur gélose au sang de mouton ou de cheval, respectivement) ont été identifiés [4]. Au cours des années suivantes, plusieurs souches de streptocoques possédant des propriétés biochimiques similaires ont été isolées de porcs souffrant de pneumonie, d’arthrite ou encore d’endocardite. L’agent causatif de ces infections a été finalement identifié comme étant
S. suis. Chez le porc, cette bactérie colonise naturellement les amygdales et cavités nasales
ainsi que les voies respiratoires, et les tractus digestif et génital [2].
Classification
Lorsqu’une première classification de S. suis a été tentée, le test de Lancefield a permis de classer les souches parmi les streptocoques des groupes R, S et T. Cette classification est cependant influencée par la manière dont les extraits bactériens ont été préparés. En effet,
S. suis étant une bactérie encapsulée (propriété découverte beaucoup plus tard), les premiers
essais de classification ont été effectués avec des préparations d’antigènes capsulaires plutôt que localisés dans la paroi bactérienne. Ce n’est qu’en 1977 que Eliott et collaborateurs ont déterminé que les antigènes présents dans la paroi de ces bactéries
4
réagissaient avec l’antisérum du groupe D [5]. La présence d’une capsule polysaccharidique a permis de classer les souches de S. suis dans 35 sérotypes initialement (1 à 34 et 1/2). Cette méthode de sérotypage repose sur la composition antigénique de la capsule des bactéries, ce qui rend difficile le typage des souches ne présentant pas de capsule. Les souches non encapsulées de S. suis ne sont pas typables par cette méthode. De plus, les gènes codant pour la capsule de S. suis peuvent être soumis à de nombreuses modifications génétiques (mutations spontanées, délétions, insertions, translocations ou transferts horizontaux) générant une très grande diversité phénotypique et génotypique au sein de l'espèce [6]. L’arrivée des techniques de biologie moléculaire a permis d’affiner davantage la classification des souches de S. suis [7]. En effet, des études ont démontré que les sérotypes 32 et 34 appartenaient en fait à l’espèce Streptococcus orisratti [8]. De plus, une analyse récente des ARN ribosomaux 16S a permis de démontrer que les sérotypes 20, 22 et 26 de S. suis divergent génétiquement des autres souches de S. suis. Par conséquent, la création d’une nouvelle espèce nommée Streptococcus parasuis sp. nov. a été proposée pour ces trois sérotypes de S. suis [9]. Il est donc considéré à l’heure actuelle que l’espèce
S. suis peut être subdivisée en 29 sérotypes [10].
Une classification récente a vu le jour grâce au développement d’une technique de « multilocus sequence typing » (MLST) permettant de classer les souches de S. suis par complexes clonaux ou « sequence type » (ST). Cette technique permet de regrouper les isolats en fonction de la variation des séquences nucléotidiques de sept gènes domestiques :
cpn60, codant pour une chaperonne de 60 kDa ; dpr, codant pour une potentielle protéine
de résistance au peroxyde ; recA, codant pour un facteur de recombinaison homologue ;
aroA, codant pour une 5-enolpyruvylshikimate 3-phosphate synthase ; thrA, codant pour
une aspartokinase/homosérine deshydrogénase ; gki, codant pour une glucose kinase ; et
mutS, codant pour une enzyme de réparation de mésappariements d’ADN [11]. Il existe à
l’heure actuelle 616 ST de S. suis identifiés, dont 379 qui ont été attribués à des sérotypes spécifiques [12]. Les sérotypes 9 et 2 comptabilisent plus de la moitié de ces derniers avec 108 ST au sein du sérotype 9 et 98 appartenant au sérotype 2. Plusieurs complexes clonaux (CC) ont pu être définis en fonction de la proximité génétique des différents ST par rapport à un ST de référence [11]. Ainsi, quatre CC majeurs sont représentés au sein de l'espèce soient le CC-ST1 comprenant les souches les plus virulentes appartenant au ST1 mais
5
également les souches épidémiques appartenant au ST7, le CC-ST16, le CC-ST25, et le CC-ST27 [13, 14].
Distribution
Les souches de S. suis les plus souvent isolées de porcs malades appartiennent généralement aux sérotypes 1 à 8, quoique le sérotype 2 est le plus souvent retrouvé [15]. Par conséquent, les souches appartenant au sérotype 2 sont considérées comme les plus virulentes et ont été les plus étudiées à l’heure actuelle, bien que toutes les souches de sérotype 2 ne soient pas forcément virulents. Au niveau mondial, les trois sérotypes les plus souvent isolés de cas cliniques d’infection à S. suis chez le porc sont le sérotype 2 avec une prévalence de près de 28%, le sérotype 9 (19,4% des souches) et le sérotype 3 (15,9%). La distribution des sérotypes isolés de porcs malades varie en fonction de la localisation géographique. En Amérique du Nord, par exemple, les sérotypes dominants sont le sérotype 2 (24,3% des isolats), le sérotype 3 (21%) et le sérotype 1/2 (13%). Au Brésil, les sérotypes 2, 1/2 et 14 sont prédominants avec 57,6%, 9,6% et 8,8% de prévalence, respectivement. En Asie, le sérotype 2 est également le plus souvent retrouvé (44,2% des cas) suivi par les sérotypes 3 et 4 (12,4% et 5,6% des cas, respectivement). Il est intéressant de noter qu’en Europe, le sérotype 9 est isolé dans la majorité des cas d’infections chez le porc (61% des cas) alors que le sérotype 2 représente 18,4% des souches et le sérotype 7 compte pour 6,7% (Tableau 1). Dans les cas d’infections chez l’humain, sur les 1642 cas reportés à ce jour, 74,7% ont été causés par des souches de sérotype 2 [16].
La distribution géographique des souches de S. suis en fonction de leur ST a été possible pour les isolats appartenant au sérotype 2 uniquement. Cette analyse révèle que les souches les plus souvent isolées dans le cadre d’infections chez le porc ou l’humain appartiennent au ST1, et ce, partout dans le monde, à l’exception de l’Amérique du Nord où les ST principaux retrouvés sont les ST25 et ST28 [12, 16].
6
Tableau 1. Distribution géographique et prévalence des sérotypes de S. suis Pays ou région Sérotypes (prévalence)
Monde 2 (28%) — 9 (19,4%) — 3 (15,9%) Amérique du Nord 2 (24,3%) — 3 (21%) — 1/2 (13%) Brésil 2 (57,6%) — 1/2 (9,6%) — 14 (8,8%) Asie 2 (44,2%) — 3 (12,4%) — 4 (5,6%) Europe 9 (61%) — 2 (18,4%) — 7 (6,7%)
L’infection à S. suis
Comme mentionné précédemment, S. suis colonise naturellement les voies respiratoires et digestives du porc. La transmission de la bactérie au sein des animaux peut se faire par transfert vertical : le porcelet acquiert des organismes de la microflore bactérienne de la mère à la naissance [17] ; ou par transfert horizontal, par contact avec les autres membres du troupeau. Il est également possible que la bactérie soit transmise par le biais de vecteurs comme les mouches en porcherie [18]. En 2002, une étude a montré que des porcs exposés à des aérosols contenant S. suis subissaient une colonisation par la bactérie suggérant que ce mode de transmission soit important dans l’industrie [19]. Cette hypothèse a été récemment confirmée lorsque des sérotypes virulents de S. suis ont été retrouvés dans des échantillons d’aérosols issus de porcheries [20]. Ces données suggèrent que les employés de l’industrie porcine peuvent être sujets à une transmission de S. suis par voie aérienne. Ce paramètre s’ajoute à la transmission à l’humain par contact avec des animaux malades ou la viande contaminée, principalement par l’exposition de plaies [21]. Finalement, la voie de transmission de S. suis considérée comme étant prédominante dans le cas de zoonose est la voie orale, et ce, principalement dans les pays d’Asie. En effet, dans ces pays, des pratiques culturelles favorisant la transmission de l’agent pathogène à l’humain persistent toujours à
7
l’heure actuelle. L’une de ces pratiques consiste en la consommation de sang de porc cru qui a pu être directement liée à la transmission de S. suis à l’humain [22].
Chez l’humain, l’infection à S. suis peut se caractériser par l’apparition de symptômes tels que l’arthrite ou l’endocardite pour les cas les moins graves [23]. Dans les cas sévères, l’infection à S. suis peut rapidement mener à la mort de l’individu infecté suite à une septicémie comme il a été le cas lors d’épisodes épidémiques en Chine en 1998 et 2005 [24]. La méningite à S. suis est une évolution grave et la plus courante de l’infection à
S. suis, pouvant laisser des séquelles permanentes [23]. La bactérie est en effet considérée
comme la première cause de méningite bactérienne chez l’adulte au Vietnam [25], la deuxième en Thaïlande [26] et la troisième à Hong Kong [27]. La méningite à S. suis peut mener à l’apparition de séquelles irréversibles telles que la perte d’audition [28]. Bien que les pays d’Asie soient les principaux concernés par S. suis comme agent de zoonose émergente, le reste du monde n’est pas épargné. Les infections à S. suis chez l’humain demeurent toutefois sporadiques à l'échelle mondiale et n’ont jamais atteint l’ampleur des vagues d'infection en Chine qui ont touché près de 300 personnes. Depuis la découverte de l’agent pathogène jusqu’à aujourd’hui, près de 1600 cas d’infections à S. suis chez l’humain ont été recensés dans plus de 30 pays ou régions du monde [29]. Il est donc important de comprendre la pathogenèse des infections à S. suis afin d’identifier des cibles potentielles pour des applications préventives ou thérapeutiques dans le but de mieux contrôler les infections à S. suis.
Pathogenèse des infections à S. suis
Bien que les mécanismes de pathogenèse des infections à S. suis ne soient pas totalement élucidés à l’heure actuelle, la contribution de facteurs de virulence à différentes étapes de l’infection a été décrite (pour des revues complètes, voir [29-31]). L’infection à S. suis se déroule suivant plusieurs étapes. Dans un premier temps, la bactérie doit coloniser son hôte. L’agent pathogène est ensuite contraint de survivre dans l’hôte avant de pouvoir s’y disséminer. S. suis est également capable d’induire une réponse pro-inflammatoire pouvant mener à un choc septique. Finalement, la bactérie peut traverser la barrière
8
hématoencéphalique, lui permettant d’envahir le système nerveux central entraînant l’apparition de méningites, chez le porc comme chez l’humain.
Colonisation de l’hôte
S. suis colonise naturellement les voies respiratoires et digestives de même que le tractus
urogénital du porc. Plus précisément, la niche écologique principale de la bactérie est la muqueuse des amygdales. En effet, les souches virulentes ou non peuvent perdurer dans les invaginations de ces muqueuses où elles vont pouvoir se dissimuler du système immunitaire de l’hôte [2, 32]. Cette colonisation peut également se faire par la formation d’un biofilm [33, 34].
Dans le but de coloniser son hôte, S. suis produit plusieurs facteurs de nature protéique permettant une adhérence de l’agent pathogène aux cellules ou à des composantes de la matrice extracellulaire telles que le collagène, le fibrinogène, la fibronectine et le plasminogène. Ainsi, une protéine de liaison à la fibronectine, nommée Fbps est capable de lier le fibrinogène et la fibronectine humaine [35]. Cette protéine n’est pas la seule à démontrer de telles propriétés. En effet, un mutant de S. suis déficient pour Fbps n’a pas démontré de baisse dans sa capacité à lier la fibronectine comparativement à la souche sauvage [36]. De plus, cette étude a permis de démontrer qu’un mutant non capsulé de
S. suis avait une capacité à adhérer davantage aux protéines de la matrice extracellulaire
qu’une souche sauvage encapsulée. Ceci suggère que les protéines impliquées dans l’adhérence aux composantes de la matrice extracellulaire peuvent être cachées par la capsule, et, dans le cadre de l’infection, S. suis pourrait sous-exprimer sa capsule afin d’exposer ces protéines [31]. Des énolases capables de lier le plasminogène et la fibronectine ont été identifiées à la surface de S. suis et contribuent également à l’adhérence de l’agent pathogène à la matrice extracellulaire de l’hôte [37]. La caractérisation d’une dipeptidyl-peptidase IV (DppIV) de S. suis a permis de démontrer l’interaction de cette protéine avec la fibronectine [38]. De plus, ce facteur semble avoir un rôle important dans la virulence de l’agent pathogène puisqu’un mutant déficient pour la DppIV s’est montré moins virulent que la souche sauvage dans un modèle de souris [38]. Récemment, six nouvelles protéines ont été identifiées comme étant capables de lier des composantes de la
9
matrice extracellulaire, mais leur caractérisation reste à être effectuée afin de mettre en évidence leur rôle précis dans la pathogenèse des infections à S. suis [39].
D’autres facteurs, dont le rôle principal n’est pas l’adhérence, contribuent également à la colonisation de l’hôte. En effet, une étude portant sur un mutant pour lequel une sortase (SrtA) a été inactivée a démontré que la délétion de cette protéine entraîne une diminution de l’adhérence de S. suis aux protéines de la matrice extracellulaire ainsi qu’aux cellules endothéliales [40]. SrtA est impliquée dans l’attachement à la paroi de protéines comprenant le motif d’ancrage LPXTG. Ceci suggère l’implication de plusieurs protéines de surface ancrées dans la paroi dans l’adhérence de S. suis aux muqueuses de l’hôte et, par conséquent, contribuant à la virulence de la bactérie [40]. Une autre enzyme participant à l’adhérence de l'agent pathogène a été identifiée comme une glycéraldehyde-3-phosphate déshydrogénase (GAPDH). Ce type d’enzyme est généralement impliqué dans la glycolyse avec une localisation cytoplasmique. Néanmoins, la GAPDH de S. suis est également retrouvée à la surface de la bactérie et s’est avérée impliquée dans l’adhérence de S. suis aux cellules de la trachée du porc [41, 42]. D’autres facteurs ont également un rôle modulatoire dans l’adhérence de S. suis aux épithéliums, comme une 6-phosphogluconate-déshydrogénase, une glutamine synthétase, une amylopullulanase, de même que des récepteurs orphelins [43-48]. Récemment, quinze nouvelles protéines liant la laminine et deux liant la fibronectine ont été identifiées [49]. Leur rôle dans l’adhésion de S. suis sérotype 2 aux cellules épithéliales humaines (Hep-2) a également été démontré suggérant ainsi un potentiel rôle dans la virulence de la bactérie [49].
Un autre aspect de la colonisation par S. suis peut se faire par le biais de la formation d’un biofilm. Bien que la majorité des souches de S. suis ne produisent pas de biofilm dans les conditions de culture classiques, il a été démontré que la bactérie est capable de former un biofilm en présence de fibrinogène ou de sucres tels que le glucose et le fructose [50, 51]. La formation de biofilm à la surface d’un épithélium pourrait contribuer à l’apparition de symptômes tels que l’endocardite lors de l’infection à S. suis. La capsule de S. suis joue un rôle important dans la modulation de la formation de biofilm. Il a effectivement été démontré que des souches non capsulées de S. suis ou des mutants incapables de former une capsule possèdent une plus grande capacité à former un biofilm, suggérant que des
10
récepteurs permettant l’interaction entre les bactéries peuvent être cachés par la capsule [33].
Dissémination et évasion des défenses de l’hôte
Une fois S. suis établie au sein de l’hôte, l’infection peut progresser par dissémination de la bactérie dans le système circulatoire. Peu de données sont disponibles à propos des mécanismes par lesquels S. suis parvient à traverser les barrières épithéliales de l’hôte pour atteindre le système circulatoire et ainsi se disséminer vers d’autres organes. L’une des hypothèses proposées est que la suilysine, une hémolysine possédant des propriétés cytotoxiques pourrait lyser les cellules formant l’épithélium, permettant ainsi le passage des bactéries à travers cette barrière [52]. Des souches n’exprimant pas la suilysine demeurent toutefois capables d’induire une infection systémique dans un modèle animal porcin [53] ; il est donc fort probable que la suilysine ne soit pas l’unique facteur permettant le passage à travers les épithéliums. De plus, une caractérisation plus approfondie de la suilysine a permis de démontrer qu’elle ne jouait pas un rôle critique dans la pathogenèse des infections à S. suis, quoique la toxine possède toutefois des propriétés immunostimulatrices. En effet, une surproduction de TNF-α et d’IL-6, deux médiateurs pro-inflammatoires reconnus pour leur surexpression dans le cadre de maladies infectieuses et inflammatoires, a été observée suite à la stimulation de monocytes humains et de macrophages alvéolaires porcins avec de la suilysine recombinante [54]. À l’heure actuelle, la voie d’entrée principale suggérée de S. suis dans le système circulatoire du porc serait par le biais de l’épithélium des amygdales [55]. Chez l’homme, l’infection à S. suis débute généralement par un contact au niveau d’une plaie permettant à l’agent pathogène de causer directement une infection systémique. Un second mode pour S. suis d’induire l’infection chez l’humain serait par voie orale, à la suite de la consommation de produits porcins contaminés et mal cuits [22]. Ainsi, S. suis coloniserait et traverserait la barrière épithéliale du système digestif.
Après avoir atteint le système circulatoire, S. suis doit échapper au système immunitaire de l’hôte afin que l’infection persiste. La capsule polysaccharidique représente un facteur déterminant à cette étape de l’infection. Elle confère à la bactérie une protection contre la phagocytose par les neutrophiles, monocytes, macrophages et les cellules dendritiques, et
11
peut également assurer à l’agent pathogène une survie intracellulaire pouvant mener à sa dissémination subséquente [56, 57]. En effet, la capsule prévient le dépôt de facteur C3 lors du processus d’opsonisation, empêchant ainsi la voie alterne du complément de mener à la phagocytose de l’agent pathogène [58]. De plus, la capsule de S. suis peut également être impliquée dans l’adhérence de la bactérie aux monocytes. De cette observation émane l’hypothèse du « cheval de Troie modifié », soit que S. suis pourrait adhérer à la surface des monocytes pour échapper au système immunitaire et se disséminer efficacement dans l’hôte [59]. Mais la virulence de S. suis étant multifactorielle, la présence de capsule n’implique pas forcément une virulence de la souche à l’étude. En effet, il existe des souches encapsulées de sérotype 2 non virulentes en modèle animal et des souches ne présentant pas de capsule ont été isolées de cas d'endocardites porcines [56, 60]. La suilysine décrite précédemment permet également à S. suis de résister aux défenses de l’hôte d’une part grâce à ses propriétés cytotoxiques envers les cellules phagocytaires [61], et d’autre part via des interactions avec le complément [62, 63]. Des modifications au niveau de la paroi, soit par N-déacétylation du peptidoglycane ou par D-alanylation des acides lipoteichoïques permettent à S. suis de résister à l'action du lysozyme [64, 65].
La dégradation de chimiokines impliquées dans le recrutement de phagocytes comme CCL5 et l’interleukine 8 (CXCL8) par des protéases à groupement sérine est également un mécanisme utilisé par S. suis pour échapper aux défenses de l’hôte [66, 67]. Une telle dégradation a pour conséquence d’empêcher le recrutement de cellules phagocytaires au site d’infection, permettant à l’agent pathogène de persister au sein de l’hôte.
S. suis peut également interagir avec les mécanismes de défense du système immunitaire
inné de l’hôte. En effet, une protéine de liaison au facteur H, Fhb a été identifiée récemment chez S. suis [68, 69]. Le facteur H est un important régulateur de la cascade protéolytique du complément en modulant le clivage des résidus C3 et C5, empêchant une réponse pro-inflammatoire trop importante qui pourrait être néfaste pour l’hôte [70]. Les études effectuées sur Fhb ont montré que cette protéine permet à S. suis de résister à la phagocytose via la voie alterne du complément in vitro [69]. De plus, un mutant n’exprimant pas Fhb s’est avéré moins virulent et plus rapidement éliminé par le système immunitaire chez les porcelets que sa souche sauvage respective [68]. Fhb semble donc
12
jouer un rôle important pour S. suis dans l’interaction avec le système immunitaire inné en conférant une protection contre la phagocytose suite à l’opsonisation des agents pathogènes au sein de l’hôte.
Les immunoglobulines A (IgA) sont d’importants acteurs de la défense immunitaire de l’hôte au niveau respiratoire et sur les muqueuses [71]. Dans le but d’échapper à cette défense, S. suis est dotée d'une protéase d’IgA1 possédant un fort potentiel immunogénique et capable de cliver ce type d’immunoglobuline [72]. L’inactivation du gène codant pour cette protéase résulte en un mutant moins virulent que la souche sauvage dans le cadre d’une infection chez le porcelet [73]. Ces observations suggèrent que la protéase d’IgA1 pourrait permettre à S. suis d’augmenter sa capacité invasive en favorisant le passage à travers les muqueuses afin d’atteindre le système circulatoire de l’hôte.
Lorsque S. suis s’est établie et disséminée efficacement dans son hôte, une réaction pro-inflammatoire se produira dans le but de combattre et d’éliminer l’agent pathogène. Cette réaction se doit d’être précisément régulée afin de ne pas être néfaste pour l’hôte. Plusieurs facteurs entrent en jeu à cette étape pour déréguler la réponse pro-inflammatoire pouvant aboutir à des chocs septiques.
Dérégulation du système immunitaire de l’hôte
La réponse inflammatoire de l’hôte est cruciale pour sa protection lors d’une infection bactérienne. Les micro-organismes ont la capacité de détourner ce mécanisme de défense en provoquant une exagération de l’inflammation qui peut nuire à l’organisme infecté. Un tel phénomène est la cause typique des chocs septiques [74]. De nombreuses composantes de S. suis entraînent une réponse pro-inflammatoire de l’hôte pouvant aboutir à un choc septique caractérisé par une hyperactivation de la réponse pro-inflammatoire (incluant une suractivation de la réponse Th1) pouvant mener au décès de l’hôte (porc ou humain) dans les heures suivant l’infection [29]. Les chocs septiques associés à S. suis diffèrent toutefois des cas rencontrés lors des infections à des streptococques de groupe B ou
Staphylococcus aureus étant donné qu'il n'y a aucune évidence scientifique de la présence
de superantigènes chez S. suis. Lorsque l’infection à S. suis devient systémique, une sécrétion accrue de médiateurs pro-inflammatoires peut être observée, aboutissant à
13
l'apparition de signes cliniques tels que la septicémie [23]. Les composantes à la surface de
S. suis sont en grande partie responsables d’une telle stimulation. En effet, les constituants
de la paroi de S. suis stimulent la sécrétion d’IL-1, CXCL8 et MCP-1 (un agent chimiotactique des monocytes) par les cellules endothéliales microvasculaires cérébrales humaines (hBMEC) [75]. Une telle réponse pourrait provoquer une augmentation de la perméabilité de la barrière hématoencéphalique, favorisant par conséquent le passage de
S. suis vers le cerveau induisant l’apparition de méningite. Dans un modèle de souris, il a
été observé que dans près de 20% des cas de mort subite, les animaux présentaient un taux élevé de cytokines et chimiokines pro-inflammatoires dans leur système (incluant le TNF-α, l’IL-6, l’IL-12, l’interféron (IFN)-γ, CCL2, CXCL1 et CCL5) après 24 heures d’infection. De plus, les animaux ayant survécu au choc septique ont ensuite développé une méningite montrant une activation transcriptionnelle des TLR-2 et -3, de CD14, NF-κB, IL-1β, CCL2 et TNF-α par les cellules myéloïdes aux alentours des zones infectées [76]. Le TLR-2 est principalement impliqué dans la reconnaissance de l’agent pathogène pour l’activation de la réponse pro-inflammatoire chez les macrophages. Ces récepteurs sont majoritairement activés par les composantes de la capsule de S. suis [77]. Plusieurs facteurs de virulence de S. suis sont fortement immunogènes, notamment la suilysine, la subtilisine, une DNase extracellulaire et d’autres [54, 67, 78]. De plus, la subtilisine de S. suis peut dégrader certains médiateurs de l’inflammation, lui permettant de réguler la réponse immunitaire afin de persister au sein de l’hôte [66, 67].
Passage de la barrière hématoencéphalique : la méningite à S. suis
Un signe clinique typique des infections à S. suis est l’évolution en méningite avec des séquelles permanentes telles que la perte de l’audition chez l'humain [28]. Le développement de tels signes cliniques se fait après que S. suis ait traversé la barrière hématoencéphalique. Les cellules microvasculaires cérébrales (BMEC) sont les constituantes principales de cette structure. Il est bien connu que les streptocoques de groupe B (GBS) adhèrent et envahissent les hBMEC afin de traverser la barrière hématoencéphalique [79]. S. suis possède également la capacité d’adhérer aux hBMEC, mais ne peut pas envahir ces cellules. Cette adhésion a été démontrée comme indépendante de la présence de la capsule [80]. Les données actuelles suggèrent que le passage de S. suis
14
à travers la barrière hématoencéphalique se ferait grâce à l’hémolysine. La suilysine est effectivement cytotoxique pour les hBMEC compromettant ainsi l’intégrité de cette structure, favorisant par conséquent le passage de l’agent pathogène vers le cerveau [80]. Toutefois, la suilysine ne semble pas conférer à elle seule les propriétés invasives de S. suis puisque des mutants déficients dans la production de la suilysine étaient toujours en mesure d’envahir les cellules endothéliales [81]. Dans cette étude ciblant les interactions entre
S. suis et les BMEC porcines, Vanier et al. ont démontré que la bactérie possède des
propriétés invasives pour ce type cellulaire, et peut également y survivre durant plusieurs heures [81]. Toutefois, il n’est pas certain que le nombre de bactéries vivantes qui traversent la barrière hématoencéphalique soit suffisant pour provoquer la méningite étant donné que seules l'adhérence et l'invasion des cellules endothéliales par S. suis ont été démontrées [82, 83].
S. suis peut entrer dans le cerveau de son hôte par une autre voie qu’à travers la barrière
hématoencéphalique. En effet, la bactérie peut subir une translocation à travers la barrière sang-liquide cérébro-spinal formé de cellules épithéliales du plexus choroïde (CPEC).
S. suis serait en effet en mesure d’adhérer à la face basale des CPEC, d’y pénétrer et d’être
transportée par des vacuoles d’endocytose vers le côté apical des cellules avant d’y subir une exocytose. Ce mécanisme dépend fortement de la présence de la capsule, suggérant l’implication de composantes de surface ou de la paroi de S. suis [84].
Composantes de S. suis dont le rôle dans la virulence est
inconnu ou incertain
S. suis possède un impressionnant arsenal de facteurs de virulence pour provoquer
l’infection (pour des revues détaillées, voir [29-31]). Au sens large, un facteur de virulence est une composante produite par un organisme qui contribue à sa pathogénicité en causant des dommages à l'hôte et englobe donc les toxines, enzymes sécrétés ainsi que des composés associés aux cellules. Un grand nombre de facteurs ont été identifiés comme contribuant à la virulence de S. suis, mais leur rôle exact n’est pas entièrement compris. Leur contribution dans la pathogenèse des infections à S. suis a pu être démontrée par mutagenèse dirigée. Parallèlement à cela, la présence d'anticorps dirigés contre des
15
composantes de S. suis dans le sérum d’animaux infectés par la bactérie procure également des informations sur les facteurs exprimés in vivo pour lesquels le système immunitaire de l’hôte va répondre. Ces facteurs immunogènes peuvent représenter des candidats de choix dans le développement de vaccins sous unités.
Deux protéines de surface de S. suis ont été associées à la virulence de S. suis depuis plus de vingt ans, mais leur rôle exact dans la pathogenèse des infections à S. suis demeure toujours inconnue. La « muraminidase released protein » (MRP), une protéine de 136 kDa retrouvée à la surface de la bactérie et relarguée dans le milieu extracellulaire sous l’action d’une muraminidase, et le facteur extracellulaire (EF), une protéine de 110 kDa, ont été toutes deux démontrées nécessaires pour la virulence totale de S. suis étant donné qu’un double mutant n’exprimant pas ces deux protéines était incapable de générer des signes cliniques de l’infection [85].
Une glutamine synthétase a été associée à la virulence de S. suis étant donné qu’une souche mutante pour cette protéine présentait des capacités réduites d’adhérence et montrait une virulence atténuée en modèle animal par rapport à sa souche sauvage [44]. Un facteur opacifiant du sérum (SOF) a été également identifié d’une manière similaire. Cette protéine peut dégrader les lipoprotéines de haute densité générant des micelles lipidiques ayant comme conséquence une opacification du sérum. Des mutants pour ce facteur ont également démontré une virulence atténuée en modèle animal comparativement à la souche sauvage. Toutefois, les auteurs de cette étude ont signalé que, malgré une virulence atténuée des mutants, ceux-ci colonisaient toujours efficacement les animaux [86]. Les lipoprotéines de haute densité possèdent un rôle anti-inflammatoire pour l’hôte ; leur dégradation pourrait par conséquent aboutir à une dérégulation de la réponse immunitaire en faveur d’une réponse pro-inflammatoire exagérée [87].
Plusieurs régulateurs transcriptionnels ont également été suggérés comme agissant dans la modulation de la virulence de S. suis [29]. Ainsi, des régulateurs du métabolisme ont pu être associés à la virulence de S. suis puisque des mutants pour ces protéines démontraient une virulence atténuée en modèle animal. C’est le cas pour AdcR, un régulateur du transport du zinc [88]. L’impact d’une inactivation de l’expression d’une protéine sur l’expression de facteurs de virulence connus de S. suis peut également donner une
16
information sur l’implication de celle-ci dans la virulence de la bactérie. Une telle observation a pu être notée suite à une délétion du gène ccpA codant pour une protéine de contrôle des catabolites dans le métabolisme des sucres. Comparativement à la souche sauvage, la souche mutante pour ce gène a montré une expression réduite de facteurs de virulence, dont l’énolase. De plus, l’épaisseur de la capsule chez ce mutant s’est avérée réduite résultant en une atténuation de la résistance de la souche à l’action des neutrophiles [89].
Plusieurs systèmes de régulation à deux composantes ont également été associés à la régulation de la virulence chez S. suis. L’un d’entre eux, le système salK-salR est compris dans l’ilot de pathogénicité 89K présent chez les souches les plus virulentes responsables d’épisodes épidémiques chez l’humain en Chine. Il a été démontré que le système
salK-salR régule l’expression de plus d’une vingtaine de gènes. De plus, la délétion de ce
système aboutit à la baisse d’expression de ces gènes et à l’augmentation de la sensibilité des souches à l’action des leucocytes polymorphonucléaires [90]. Quatre autres systèmes à deux composantes ont également été associés à la régulation de la virulence de S. suis. Le système ciaK-ciaR a été démontré nécessaire dans la régulation de l'adhérence de S. suis aux cellules épithéliales ainsi que dans la résistance de la bactérie à l'activité bactéricide des macrophages. De plus, une souche mutante pour ce système s'est avérée moins virulente en modèle murin et porcin [48]. L'implication du système ihk-irr dans la régulation de la réponse au stress oxydatif a également été démontrée, et une délétion de ce système a entraîné une réduction de l'adhérence de S. suis aux cellules épithéliales, une plus grande sensibilité vis-à-vis l'activité bactéricide des macrophages ainsi qu'une virulence réduite en modèle animal [91]. Une délétion du système à deux composantes virR-virS a entraîné des modifications phénotypiques majeures pour S. suis telles que la formation de chaînes plus courtes et une capsule moins épaisse comparativement à la souche sauvage. De plus, la souche mutante pour ce système a été plus rapidement éliminée du système circulatoire de l'hôte et sa virulence en modèle murin a été atténuée par rapport à la souche sauvage [92]. Le système à deux composantes nisK-nisR s'est montré impliqué dans la régulation de la virulence de S. suis in vitro étant donné que son inactivation a engendré une réduction de l'activité hémolytique de la souche, une réduction de l'adhérence aux cellules épithéliales ainsi qu'une plus grande sensibilité à l'action bactéricide des macrophages et neutrophiles.