HAL Id: dumas-01294750
https://dumas.ccsd.cnrs.fr/dumas-01294750
Submitted on 29 Mar 2016HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
délétères des UV-A : mise en évidence des haptènes
amino-imino-propène : intérêts potentiels des
antioxydants lipophiles en cosmétologie
Valérie Hiltenbrand
To cite this version:
Valérie Hiltenbrand. Place de la peroxydation lipidique dans les effets délétères des UV-A : mise en évidence des haptènes amino-imino-propène : intérêts potentiels des antioxydants lipophiles en cosmétologie. Sciences pharmaceutiques. 1999. �dumas-01294750�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
thesebum@ujf-grenoble.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteur1111111,1f
1J~rnm1~
11111
UNIVERSITE JOSEPH FOURIER 1 FACULTE DE PHARMACIE DE GRENOBLE
.Année :
1998-1999
N° D'ordre :PLACE DE LA PEROXYDATION LIPIDIQUE
DANS LES EFFETS DELETERES DES UV-A : MISE EN EVIDENCE
DES HAPTENES AMINO-IMINO-PROPENE
INTERETS POTENTIELS DES ANTIOXYDANTS LIPOPHILES
EN COSMETOLOGIE
THESE
PRESENTEE POUR L'OBTENTION DU DOCTORAT EN PHARMACIE
DIPLOME D'ETAT
Par
Valérie HILTENBRAND
Née le
1er
Février1970
à StrasbourgThèse soutenue publiquement le 5 Mars 1999 à 11 heures
devant le JURY composé de :
Madame le Docteur M.-J. RICHARD Monsieur le Professeur A. FA VIER Monsieur le Docteur Y. CHANCERELLE Monsieur le Professeur J.-C. BEANI
UNIVERSITE JOSEPH FOURIER 1 FACULTE DE PHARMACIE DE GRENOBLE
Année : 1998-1999 N° D'ordre:
PLACE DE LA PEROXYDATION LIPIDIQUE
DANS LES EFFETS DELETERES DES UV-A : MISE EN EVIDENCE ·
DES HAPTENES AMINO-IMINO-PROPENE
INTERETS POTENTIELS DES ANTIOXYDANTS LIPOPHILES
EN COSMETOLOGIE
THESE
PRESENTEE POUR L'OBTENTION DU DOCTORAT EN PHARMACIE
DIPLOME D'ETAT
Par
Valérie HILTENBRAND
Née le 1er Février 1970 à Strasbourg
Thèse soutenue publiquement le 5 Mars 1999 à 11 heures
devant le JURY composé de:
Madame le Docteur M.-J. RICHARD Monsieur le Professeur A. FA VIER Monsieur le Docteur Y. CHANCERELLE Monsieur le Professeur J.-C. BEANI
ALARY BAKR!
Domaine de la Merci 38700 LA TRONCHE
Doyen de la Faculté M. le Professeur P. DEMENGE Vice Doyen M. le Professeur J. CALOP
PROFESSEURS DE PHARMACIE
Josette Chimie Analytique Abdelaziz Phannacie Galènique
BENO/T-GUYOD jean-Louis Chimie Toxicologie et Eco-toxicologie GALOP jean Pharmacie Clinique et Bio-technique CUSSAC Max Chimie Thérapeutique
DECO UT jean-Luc Chimie Générale
DEMENGE Pierre Physiologie/Pharmacologie DROUET Emmanuel Microbiologie-Immunologie FAVIER Alain Biochimie
GOULON Chant.al Physique-Pharmacie GRILLOT Renée Parasitologie
LECLERC Gérard Chimie Organique MARIOTTE Anne-Marie Pharmacognosie
ROCHAT Jacques Hygiène environnement Droit et Economie Pharmaceutiques
ROUSSEL Anne-Marie Biochimie
SEIGLE-MURANDI Françoise Botanique et Cryptogamie ST El MAN Régine Biologie Cellulaire
Ce travail a été effectué au laboratoire de Biochimie C de l'hôpital Michallon à La Tronche, sous la direction de Madame Marie-Jeanne Richard, Pharmacien Biologiste. Je lui exprime toute ma reconnaissance pour l'accueil qu'elle m 'a réservé dans son équipe de recherche. Son exigence m'a permis d'aller plus loin dans mes recherches et de faire de cette thèse, un travail vraiment enrichissant. Aussi, je lui adresse mes plus sincères remerciements pour avoir encadré ce travail.
Je suis très reconnaissante à Monsieur le Professeur Alain Favier, Pharmacien Biologiste, de m'avoir accueillie dans son laboratoire et de m'avoir donné les moyens de réaliser ce travail. Merci également pour ses cours, enseignés avec tant de bonne humeur !
J'adresse mes plus vifs remerciements à Monsieur le Docteur Yves Chancerelle, Pharmacien Chimiste en Chef au Centre de Recherches du Service de Santé des Armées (CRSSA), pour m'avoir aidée dans l'élaboration et la mise en œuvre de la partie expérimentale de ce travail et pour l'honneur qu'il mefait d'accepter de siéger dans le jury de cette thèse.
Je tiens à exprimer toute ma reconnaissance à Monsieur le Professeur Jean-Claude Béani, Médecin Chef dans le service de Dermatologie de l'hôpital Michallon pour avoir accepter de représenter le côté médical dans le jury de cette thèse.
J'adresse mes remerciements les plus sincères à toute l'équipe du laboratoire de Biochimie C auprès de qui j'ai trouvé aide et soutien tout au long de mes 6 mois de stage : Anne-Marie, Jacotte et les autres. Merci à Anne-Marie pour sa patience, sa disponibilité et pour m'avoir permis d'acquérir les connaissances de cultures cellulaires nécessaires à la réalisation de ce travail.
Un grand merci également aux chercheurs Christine et Nathalie, ainsi qu'aux internes de passage.
A Jacqueline A Emmanuelle et Jean-Paul A Stéphane A Olivia et Gaël A ma grand-mère Mounette A Flory et à Bernard A Toute ma Famille
A Sophie Clerc, Agnès Gondard et Alban Dhanani mes premiers « collègues » de travail
A Guy-Noël Fau bel et Henri Prat, qui m'ont permis de beaucoup apprendre au sein des
Laboratoires Boiron.
A Hélène Trin, qui m'a donné mes premières notions de cosmétologie chez Boiron et qui m'a
surtout donné envie de persévérer. Merci pour ton soutien et tes encouragements.
A Marie-Christine Bressolle, qui m'a permis d'apprendre beaucoup de choses au sein des
Laboratoires Pierre Fabre. Merci pour votre confiance, votre encadrement et vos encouragements pendant et après mon stage.
Merci à Pierre pour sa patience durant nos longues conversations !
A Amande, pour tous les bons moments qui marquèrent ces quelques années et surtout pour te donner du courage pour ta thèse !
A Christophe, c'est sûrement grâce au phosphore contenu dans le saumon préparé par le grand cuisinier que tu es, que j'ai réussi ma quatrième année !
A Fahy sans qui ces 6 années d'études n'auraient pas été ce qu'elles ont été !
A mon binôme préféré: Fred, qui m'est resté ''fidèle" jusqu'au bout! Pardon de t'avoir laissé tomber la dernière année !
A tous mes autres amis de fac : Anne-Laure, Aude, Carole, Christine, Delphine, Elodie, Florence, Jean-Sébastien, Jérôme, Manu, Marie-Cécile, Marion, Stephan, Valérie, Xavier ... pour tous les merveilleux moments que nous avons passés ensemble et sans qui je ne regretterai pas autant d'avoir fini mes études !
A Marion, en attendant d'assister à ta thèse, merci de m 'avoir aidée et soutenue durant la préparation de ma thèse. Grâce à toi, je suis presque une experte sur Excel ! Merci pour ton
amitié sincère.
A tous mes autres amis de la rue Servan: Raph, Gaêl, Marc, Fabienne et Serge, Olivier, Fred, ...
A ma colocataire préférée: Nuria, la marmotte catalane avec qui j'ai passé une année
fantastique à Nantes et à Ca~tres.
A Thomas, le véritable p 'tit nantais qui m'a permis d'apprécier encore davantage cette belle
ville. Merci pour ton accueil.
A toutes mes amis de Nantes : Alban, Cécile, Hojung, Magali, Marie, Pascale et Sophie
pour m'avoir fait découvrir le pays nantais, angevin, breton et ... coréen! et grâce à qui les 6 mois de DESS restent inoubliables !
A mes amis castrais: Béatrice, Cécile et Bertrand, Florence, Linda et Towako pour tous
les bons moments passés au labo et ailleurs !
A Karine, en souvenir de tout ce chemin parcouru depuis le lycée ...
§oMMAIRE
MM.d<##klM44P.tL.U .. J#.t .. ,.Jf LL .. LhMJJ. .. AMJ.iLLlM.Jii..t.J.JJ.&hML.ILJ.iLk-. .... W&ZM4.iWIMK4ttWWWXiWMMW#.MtU.MLWIU&iUJiL."W
ITNTRODUCTION ... 4
JIDU RAYONNEMENT SOLAIRE AU PHENOMENE DE CANCEROGENESE ... 6
I EFFET DU RAYONNEMENT UV SUR LES CELLULES CUTANEES ... 6
II LES RADICAUX LIBRES ... 7
II-JI Genèse des radicaux: libres ... 7
II-21 Les cibles biologiques de l'attaque radicalaire ... JO II-31 Conséquences en terme de vieillissement cutané ... J 1 ID SYSTEMES DE DEFENSE ET PHOTOPROTECTION ... 17
III-JI La photoprotection naturelle ... J 7 III-21 Les moyens de défense anti-radicalaire ... J 8 111-1-1/ Les systèmes de défense enzymatique ... 18
111·1-2/ Autres protéines antioxydantes ... 20
III-1-3/ Les systèmes de défense non enzymatique ... ,. ... 21
III-31 Répartition des ~ystèmes antioxydants endogènes ... 25
lV LES CONSEQUENCES CELLULAIRES ... 29
IV-JI Apoptose et nécrose cellulaires ... 29
IV-1-1/ La nécrose ... 29
IV-1-2/ L'apoptose ... 29
IV-1-3/Nécrosc ou apoptose ... 32
IV-21 Cancérogenèse ... 33
IV-2-1/ Les cellules tumorales ... 33
IV-2-2/ Les cancers cutanés ... 34
IV-2-3/ Incidence des cancers cutanés ... 35
IV -2-4/ Les facteurs de risque du mélanome ... 35
lLA PEROXYDATION LIPIDIQUE SOUS UV ET SES CONSEQUENCES EN CANCEROGENESE ... 39
ILE PHENOMENE DE PEROXYDATION LIPIDIQUE SOUS UV ... 39
II LES PRODUITS DE DEGRADATION DE LA PEROXYDATION LIPIDIQUE ... 40
II-li Formation des produits de décomposition ... 40
II-21 Les produits issus de la dégradation lipidique et leur réactivité ... 41
11-2-1/ Les aldéhydes ... 41
11-2-2/ Les alcanes ... 44
II-31 Evaluation de la peroxydation lipidique à partir des produits de dégradation ... 45
11-3-1/ Les diènes conjugués ... 45
II-3-2/ Les lipofuscines ... 45
11-3-3/ Les hydrocarbures ... 46
11-3-4/ Les hydropcroxydcs lipidiques ... 46
-2-ID DOMMAGES AU NIVEAU DEL' ADN ET SES POSSIBLES LIENS AVEC LE PHENOMENE DE
PEROXYDATION LIPIDIQUE ... 47
III-li Les dommages créés par le rayonnement UV. ... 47
III-21 Les systèmes de réparation de l 'ADN (Myles ; Parsons) ... 51
Ill-31 Interaction entre les produits de dégradation de la peroxydation lipidique et les modifications au niveau de l'ADN ... 52
~UELLES APPLICATIONS POUR UNE PREVENTION EFFICACE? ... 55
I PHOTOPROTECTION TOPIQUE ... 55
I-11 Ecrans et filtres solaires ... 55
I-1-1/ Notions d'évaluation des photoprotecteurs ... 55
I-1-2/ Les écrans ... 57
I-1-3/ Les filtres: Quelques exemples ... 58
l-21 Les antioxydants ... 62
1-2-1/ Les antioxydants lipophiles ... 62
I-2-2/ Autres composés antioxydants utilisés en cosmétologie ... 70
II PHOTOPROTECTION ORALE ... 71
:œ:'ARTIE EXPERIMENTALE: MISE AU POINT D'UN MARQUEUR BIOLOGIQUE POUR L'ETUDE D' ANTIOXYDANTS LJ:POPHaES ... 74
I INTRODUCTION ... 74
II MATERIEL ET METHODES ... 75
Il-JI Les cultures cellulaires ... 75
Il-2 I Induction des stress oxydants ... 75
II- 2-1 /Stress physique: L'irradiation ultraviolette A ... 75
II- 2-2 /Stress chimique : Le peroxyde d'hydrogène ... 76
Il-31 Protocole de supplémentation des cellules en vitamine E ... 76
Il-41 Evaluation de la cytotoxicité des cellules : Mesure de la lyse des membranes lysosomiales par la technique du Rouge Neutre ... 76
Il- 51 Evaluation de l'apoptose ... 77
Il-61 Evaluation de la peroxydation lipidique : Immuno-marquage des haptènes amino-imino-propène ... 78
II- 6-1/ Principe ... 78
II- 6-2/ Les réactifs ... 78
II- 6-3/ Mode opératoire ... 79
II-6-4/ Examen en microscopie à fluorescence ... 80
11-6-5/ Validation de la méthode d'immuno-marquage ... 80
III RESULTATS ... 81
III-li Etude de la cytotoxicité du rayonnement UV-A sur les fibroblastes en culture: apoptose et nécrose cellulaire ... 81
111-1-1/ Evaluation de la cytotoxicité ... 82
III-1-2/ Evaluation de l'apoptose ... 83
Ill-21 Evaluation de la peroxydation lipidique par immunomarquage des haptènes amino-imino-propène ... 84
III- 2-1/ Choix du matériel de culture ... 84
111-2-3/ Critères de spécificité des immuno-marquages ... 84
III-2-4/ Immuno-marquage des haptènes amino-imino-propène avec l'anticorps monoclonal après le stress oxydant. .... 86
IV DISCUSSION ET PERSPECTIVES ... 87
IV-JI Incidence de l'acijonction de vitamine E sur la cytotoxicité des fibroblastes cutanés induite par un stress oxydant ... 87
IV-21 Immuno-marquage des haptènes amino-imino-propène ... 89
IIDISCUSSION GENERALE ••.•••••••••.•••••••••.•••••••••••.•••••••••.••••.•••••••••••••.•••••.•.••••••••••••••••••••••••••.•••••••••••.••••••••••••.••••••••.•• 91
CCONCLUSION ••••••••••••••••••••••••••••.••••••••••••••••••••••••.•••••••••••••••••••••.••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••••• 95
JIBIBLIOGRAPHIE •••••••••.••••••••••••.•••••.•••••••••••••••••.••••••••••••••••.••••••••••••••••••••••••••••••••••••••••••.••••••••••••••••••••.••••••••••••••••••••• 97
4
-IlNTRODUCTION
dMl.ik,.&.l.X.LZ&4tLtl.JX.Li...MLJ..tWl ... .LU .. @J.iW@kL .. Jt, . ..G.roJ04.JJ ... ~JJ.1.A1Mi .. RiKk,.UtAJ.J.2. ... ,_,,_ .... kldl.?.Mt»M&&JlU:@UtMMAL.4@J.Jtb4kWWWWk.-YJStJW,l ... JJ.%#.
Les radicaux libres représentent actuellement un centre d'intérêt important en cosmétologie et leur impact dépasse de loin ce domaine. Les radicaux superoxyde (02 ·-), hydroxyle (OH),
oxygène singulet (102) et le peroxyde d'hydrogène (H202) sont responsables de nombreuses pathologies.
Normalement, la formation endogène de radicaux libres est contrebalancée par tous les mécanismes de défense. Leur production peut même être bénéfique pour lutter contre les infections. Cependant, de nombreuses situations peuvent entraîner un excès de radicaux libres : radiation, exposition solaire intense, baisse des défenses, intoxication par certains produits chimiques, ...
Les rayons ultraviolets, qu'ils soient A ou B, sont connus pour favoriser la formation de ces espèces oxygénées. Ainsi, la peau continuellement exposée aux rayons ultraviolets et à la lumière visible ainsi qu'à de fortes concentrations en oxygène, est un tissu particulièrement sensible au stress oxydant.
Les lipides polyinsaturés présents au niveau de la peau mais aussi constituants majeurs des membranes cellulaires, sont des cibles privilégiées des espèces activées de l'oxygène, de même que les acides nucléiques et les protéines. Selon la cible moléculaire atteinte, les dommages ne seront pas les mêmes, de même que les conséquences. Apoptose, peroxydation lipidique, mutation génique sont autant de phénomènes qui peuvent être induits par les ultraviolets via les espèces oxygénées.
Les altérations résultant des oxydations de ces biomolécules par les radicaux libres, sont incriminées dans les phénomènes de vieillissement mais aussi de cancérogenèse développés suite à des expositions solaires.
Une première partie sera consacrée au phénomène radicalaire. A présents mieux connus, les radicaux libres occupent une place importante dans les recherches cosmétologiques et médicales. Leur implication dans de nombreuses maladies n'est plus à démontrer. Cette première partie est donc consacrée à une meilleure connaissance de ces espèces radicalaires : de leur genèse à leurs
conséquences en terme de vieillissement cutané mais aussi, plus grave, leur implication dans les phénomènes d'apoptose cellulaire et de cancérogenèse. Nous y aborderons également, les systèmes de défense "naturels", endogènes, mis en œuvre par l'organisme pour s'en protéger.
La seconde partie portera sur le phénomène de peroxydation lipidique, une autre conséquence de l'agression radicalaire. Un lien entre les produits de dégradation de la lipoperoxydation et les dommages photo-induits del' ADN sera étudié.
La troisième partie définira les deux grands types de photoprotection, à savoir, la photoprotection topique et la photoprotection orale, beaucoup plus récente.
Enfin, une quatrième partie, expérimentale, nous permettra d'approfondir le phénomène de peroxydation lipidique avec la mise en évidence, par une technique d'immunofluorescence indirecte, des ponts amino-imino-propène (AIP) formés entre une molécule de dialdéhyde malonique (MDA) et le groupement-NH2 d'une protéine.
Dans un deuxième temps, nous évaluerons l'activité protectrice d'un antioxydant lipophile: l'a-tocophérol, sur les phénomènes de peroxydation lipidique, de nécrose et d'apoptose.
-6-IWu
RAYONNEMENT SOLAIRE AU PHENOMENE DE
CANCEROGENESE
...,;nrr· :···-,r·TwetrTP 'Tr··rTi'W'Miil!li!rr·r!lf'ffflœr1·-"-w=emrz·r··zrrrrv-1!i!:•rwe·rnrmr··7new-z:··r,,.,.r,:r-t:ttm'n··mw1nn
1 EFFET DU RAYONNEMENT UV SUR LES CELLULES CUTANEES
Les radiations nocives du soleil s'étendent de 250 à 800 nm. Ces radiations, en fonction de leur longueur d'onde, pénètrent plus ou moins à travers la peau.Trois bandes sont distinguées :
les UV-A compris entre 320 et 400 nm, les UV-B compris entre 290 et 320 nm
et les UV-C en deçà de 290 nm, jusqu'à 1 nm environ. Seuls, les UV-A et les UV-B parviennent à la surface de la terre~ les UV-A étant en quantité 100 fois plus importante que les UV-B (Dubertret ).
Les ultraviolets parvenant à l'épiderme subissent des réflexions, réfractions ou absorptions mais en dépit de cela, des quantités non négligeables d'ultraviolets parviennent jusqu'à la couche basale de l'épiderme (15 % d'UV-B) et dans le derme (50% d'UV-A) où ils atteignent notamment les fibroblastes. Ils entrent alors en réaction avec les différents constituants cellulaires : principalement les protéines, les acides nucléiques et les lipides membranaires.
Il est souvent dit, de façon schématique, que les UV-B ont plutôt une action sur l'ADN, induisant des mutations au niveau d'oncogènes (ras, c-fos et c-jun) et de gènes suppresseurs de tumeurs (p53) (Brash) alors que les UV-A seraient davantage responsables de réactions photooxydatives telles que la peroxydation des lipides membranaires et activeraient des facteurs nucléaires de transcription (Bergstresser). La peroxydation lipidique serait le principal phénomène que l'on constate après une exposition UV-A (Moysan).
En réalité, UV-A et UV-B agissent tout deux sur le matériel génétique et sur les membranes cellulaires, les enzymes et les protéines mais avec plus ou moins d'impact.
II LES RADICAUX LIBRES
11-1/ Genèse des radicaux libres
Avant de voir brièvement leur formation, il est important de les définir. Les radicaux libres sont des espèces chimiques (atome, groupe d'atomes, molécule) qui comportent un électron célibataire sur leur orbitale externe (Pryor). Extrêmement instables, les radicaux libres présentent une forte réactivité avec les molécules voisines les plus stables. La réactivité chimique des radicaux libres a pour but de réapparier leur électron célibataire afin d'en annuler le champ magnétique et de donner un composé stable. L'électron et l'atome d'hydrogène auquel il est électriquement lié, sont alors arrachés à une chaîne carbonée voisine. Il y a naissance d'un nouveau radical libre qui va, à son tour, partir en quête d'un autre électron. Il se créé ainsi un processus de réactions en chaîne (Carlotti).
Classiquement, on distingue 3 étapes : étape d'initiation
étape de propagation étape de terminaison. Phase d'initiation :
A :B ----~ A•+ B•
Il y a rupture de la liaison covalente au sein d'une molécule par clivage homolytique. Ce clivage peut être déclenché de différentes façons :
par absorption de radiations ionisante, visible, ultraviolet, thermique par catalyse enzymatique ou métallique
par réaction spontanée sans l'intervention de catalyseur (Pryor). Phase de propagation :
par addition:
R•
+ 02
---~Roo·
par arrachement : R•
+
H-C- ---~ RH+
-c·
8
-Phase de terminaison :
La réaction en chaîne s'arrête et les radicaux libres sont détruits par paire (Pryor). R•
+
H"
---~ R-HR•
+
Ct
---~ R-ClSous l'action des radiations solaires, la molécule d'oxygène normalement stable peut donner naissance à des espèces radicalaires instables. Les radicaux libres dérivés de l'oxygène sont les espèces le plus agressives vis à vis des systèmes biologiques.
A l'état fondamental, la molécule d'oxygène est un biradical possédant 2 électrons célibataires. Elle constitue le récepteur universel d'électrons, au terme de la chaîne respiratoire cellulaire. Très stable, elle peut sous l'effet d'un apport d'énergie, arracher un électron à une molécule voisine pour apparier l'un de ses électrons libres. Cette réduction se fait essentiellement de façon enzymatique (NAD PH oxydase, cytochrome oxydase mitochondriale, xanthine oxydase). Il y a alors naissance de l'anion superoxyde :
02 + e - ---~
02·-Relativement peu réactif, l'anion superoxyde peut néanmoins intervenir dans diverses réactions de destruction de molécules organiques. Sa réactivité ne se manifeste, en effet, qu'en milieu aprotique. Cette propriété en fait un attaquant privilégié des doubles fèuillets phopholipidiques des membranes cellulaires. En milieu protoné, 02·-subit un phénomène de dismutation selon la réaction:
2 02·-
+
2W
---~ H202+
02Cette réaction peut se produire spontanément mais elle est considérablement augmentée en présence des superoxydes dismutases (SOD).
Le peroxyde d'hydrogène ainsi formé, n'est pas un radical libre mais il est extrêmement réactif et il
a un fort pouvoir oxydant (Clavel; Therond). En présence d'ions ferreux (Fe2+), il se décompose
selon la réaction de Fenton, pour donner un ion OH" inoffensif et un radical hydroxyle •oH très agressif, capable d'attaquer les structures organiques les plus stables. Sa cible principale sont les lipides et plus généralement les acides gras insaturés (Clavel).
H202 + Fe2+ ---~ Fe3+ + OH" + ·oH
L'anion superoxyde 02·- entretient la réaction de Fenton par réduction du fer ferrique (Fe3
l
en fer ferreux (Fe21).
L'ensemble de ces réactions, de la dismutation spontanée ou enzymatiquement accélérée d'02._ à la régénération de Fe2+ constitue le cycle de Haber-Weiss (Clavel; Therond).
Ainsi, c'est la présence simultanée de 2 espèces réactives (l'anion superoxyde et le peroxyde d'hydrogène) qui permet la production de la troisième espèce oxygénée: le radical hydroxyle. Si l'oxygène est pratiquement inerte à l'égard des molécules à électrons uniformément appariés, il réagit énergiquement avec les radicaux libres pour former des radicaux peroxyles Roo•.
R • + 02 ---~ Roo·
Les radicaux peroxyles ainsi formés peuvent se recombiner, formant alors un pont tetroxyde extrêmement instable, qui se fragmente et libère l'oxygène singulet 10 2 dont tous les électrons sont appariés. 102 n'est pas une forme radicalaire mais une molécule en état d'excitation qui se comporte
comme un radical libre. 10 2 constitue néanmoins la forme active de l'oxygène la plus agressive dans les milieux biologiques.
Le radical peroxyle arrache, par ailleurs, des hydrogènes dans le milieu où il apparaît, amorçant ainsi des chaînes de réactions radicalaires. Les acides gras polyinsaturés, principaux constituants des membranes cellulaires, favorisent l'apparition de radicaux libres stables, par délocalisation électrique. Le radical peroxyle conduit alors à la formation d'un hydroperoxyde lipidique ROOH et d'un nouveau radical lipidique qui initie à son tour un cycle. Les hydroperoxydes lipidiques sont peu réactionnels mais, en présence de, Fe2+ subissent une forte réaction de Fenton qui les convertit en
radicaux alkoxyles Ro•, agents très agressifs: ROOH + Fe2+ ---~ Ro· + OH- + Fe3+
Parmi les 4 radicaux libres oxygénés, seuls •oH et 10 2 constituent un réel danger pour l'intégrité
cellulaire.
Toutes ces réactions pourraient se dérouler sans conséquences graves si l'oxygène n'avait pas cette affinité pour les radicaux libres. En effet, les radicaux libres apparus dans un premier temps, se recombinent aisément en atmosphère inerte alors que les peroxydes formés avec l'oxygène sont à
-
10-Il-2/ Les cibles biologiques de l'attaque radicalaire
Il est important d'avoir conscience que si la formation endogène de radicaux libres s'inscrit dans un processus tout à fait physiologique, il en est tout autrement lorsque la formation des espèces réactives est d'origine exogène. Les radicaux libres d'origine exogène représentent tous, en effet, un potentiel toxique élevé, surtout ceux produits par des agents physiques (lumière, rayons ultraviolets, rayons X, ... ). De plus, alors que la production endogène de radicaux libres est souvent bien localisée et se trouve sous contrôle de systèmes protecteurs, les espèces oxygénées d'origine physique externe sont, quant à elles, distribuées aléatoirement et partout dans l'organisme. Plusieurs cibles moléculaires peuvent être oxydées, selon le site de production des espèces radicalaires.
Les radicaux libres sont en principe capables d'agir au niveau de n'importe quel composé biologique mais ils ont des cibles cutanées privilégiées qui sont le collagène, le tissu élastique, l~s lipides membranaires, les protéines et l' ADN .
...a.. Le collagène et le tissu élastique :
Ils sont dénaturés par l'agression radicalaire du fait de leur richesse en protéines (collagène, élastine, etc ... ) qui sont facilement atteintes par les oxydants (Boyer ; Dalle Carbonare ).
La synthèse du collagène est régie par des enzymes dont certaines sont synthétisées par les fibroblastes, cellules très sensibles au rayonnement UV. Un disfonctionnement enzymatique va ainsi être, en partie, à l'origine de l'altération de la tonicité dermique. Un autre phénomène, non enzymatique, va en effet, agir sur les fibres de collagène matures, il s'agit d'une réaction de glycation.
Les fibres d'élastine ont, quant à elles, tendance à fixer le calcium et à se saturer en lipides, ce qui a pour conséquences une perte d'élasticité progressive ; de plus, une augmentation de la synthèse d'élastases et donc de la fragmentation de l'élastine sont observées (Robert).
Composants essentiels du tissu de soutien, la peau perd de son élasticité et vieillit prématurément. ...a.. Les autres protéines :
Elles constituent aussi une cible radicalaire, surtout du fait de leur teneur en soufre. Sous l'action des radicaux libres, elles sont scindées en polypeptides, dénaturées, rassemblées sous forme d'agrégats ou encore inhibées s'il s'agit d'enzymes (Hu). Il s'en suit des perturbations voire un
blocage dans les mécanismes essentiels du métabolisme cellulaire. La "mort métabolique" des cellules peut alors survenir et affecter tant les cellules au repos que les cellules en division.
La formation de pontage au niveau de la SOD et de la catalase, ainsi que la dénaturation des protéines et la perte de l'activité enzymatique qui en résulte seraient fonction de la dose d'exposition UV-A reçue (Dalle Carbonare et Pathak).
"'4t Les lipides membranaires :
Les lipides membranaires, particulièrement riches en acides gras poly-insaturés (AGPI) représentent une cible privilégiée pour l'agression radicalaire. Ils sont le siège de la peroxydation lipidique (voire chapitre du même nom). Leur oxydation conduit à une désorganisation membranaire avec des modifications de la fluidité et de la perméabilité. Un certain nombre d'enzymes et de récepteurs membranaires sont également inactivés.
~ L' ADN cellulaire :
L' ADN constitue la cible la plus importante car ses dommages retentissent sur l'ensemble des synthèses cellulaires. Nous étudierons plus en détails les conséquences d'une attaque radicalaire à ce niveau dans un chapitre ultérieur.
11-3/ Conséquences en terme de vieillissement cutané
Nous venons de le voir, les ultraviolets via la genèse de radicaux libres, entraîne des pontages entres protéines (collagène), l'oxydation de groupements sulfhydriles permettant l'établissement de ponts disulfures, l'oxydation et l'inactivation de nombreuses enzymes ayant pour conséquence un mauvais fonctionnement cellulaire (fibroblastes, kératinocytes, cellules de Langerhans, mélanocytes). Enfin, ils sont à l'origine de la libération de protéases, collagénases et élastases (Danno ). Toutes ces modifications provoquent un vieillissement prématuré de la peau. Ce vieillissement cutané photo-induit se traduit par des modifications histologiques et physiologiques, à
savoir:
un amincissement de l'épiderme avec diminution de la cohésion entre les coméocytes
une diminution de la tonicité dermique avec, notamment, altération de la trame fibreuse et altération des fibroblastes
-
12-La peau devient alors sèche, atrophique, lâche, elle s'épaissit. On observe l'apparition de ridules
,
puis de rides profondes, elle prend une couleur jaunâtre dite citréine avec des zones hyper et hypo-pigmentées (hypomélanose en gouttes, éphélides, lentigos). Des télengiectasies et une hyperplasie sébacée font également partie des aspects cliniques de l'héliodermie (Leccia 1995).
La perte d'élasticité est due à une modification de l'élastine. L'élastine résulte de l'action d'enzymes : les élastines synthétases. Son bon état est du à un équilibre entre ces enzymes et les enzymes qui catalysent sa dégradation: les élastases. Les élastases sont nombreuses et regroupent toutes les enzymes capablent de provoquer la solubilisation de l'élastine par un clivage protéique. Elles sont identifiées dans les fibroblastes mais aussi dans des micro-organismes tels que les macrophages, plaquettes, globules blancs et au niveau aortique et pancréatique.
Au cours du vieillissement, les fibroblastes, sous l'effet d'un certain nombre de facteurs, sécrèteraient en quantité croissante des élastases qui s'attaqueraient aux fibres élastiques du derme. Le rayonnement U-V est capable d'intensifier l'activité élastasique, on parle alors d'élastose solaire, localisée uniquement sur les parties découvertes.
Le japonais Kawaguchi a étudié sur des cultures de fibroblastes cutanés humains, l'effet d'une irradiation UV-A et des radicaux libres générés par un couple xanthine/xanthine oxydase sur l'expression de l' ARN messager (ARNm) de l'élastine. Il en résulte que l'irradiation UV-A n'affecte pas l'expression de
1'
ARNm de l'élastine. En revanche, dans les cultures de fibroblastes, les radicaux libres augmentent le taux d' ARNm d'un facteur multiplicatif 1,8. L'auteur conclut que les radicaux libres produits dans le derme, pourraient donc contribuer à la formation de dépôts d'élastine observés lors du photo-vieillissement.La perte de tonicité résulte, quant à elle, de modifications au niveau du collagène. Ce sont, en effet, les fibres de collagène qui confèrent au derme sa résistance mécanique et son organisation. Le collagène subit en permanence des remaniements importants avec des phénomènes de maturation, de remodelage et de régression. Ces changements se font sous l'influence de plusieurs enzymes: les collagènes synthétases, responsables de la synthèse collagénique, les collagènases qui assurent le fractionnement des fibres de collagène et les peptidases qui réduisent les fibres en peptides de petites tailles.
Le rayonnement UV va induire au niveau des fibroblastes, une augmentation de l'activité des collagènases, d'où une diminution du taux de collagène et une teneur dermique en collagène plus faible que la normale.
Plusieurs auteurs se sont intéressés ces dernières années à ces enzymes protéolytiques intervenant dans le vieillissement photo-induit: les metalloprotéinases. C'est le cas de l'équipe de Fisher qui a étudié le rôle des métalloprotéinases, médiateurs des dommages collagéniques lors du photo-vieillissement. Cinquante neuf sujets de race blanche ont participé à cette étude. Après avoir irradié une petite partie de leur anatomie, différents paramètres ont été mesurés, à savoir : l'expression des metalloprotéinases, la dégradation du collagène induite par une irradiation UV et le taux de protéines inhibant les metalloprotéinases. Une simple exposition à la lumière ultraviolette a montré l'expression de trois metalloprotéinases: une collagénase, une 92-kd gélatinase et une stromelysine. La dégradation des fibres de collagène de type I fût augmentée de 58 % en comparaison avec la peau non irradiée. En outre, une analyse Western blot a permis de révéler un inhibiteur endogène des metalloprotéinases de type I. Après quatre expositions à une irradiation UV, délivrée à deux jours d'intervalle, l'activité de la collagénase et de la gélatinase resta particulièrement élevée pendant 7 jours. Un pré-traitement avec de l'acide trans-rétinoïque inhiba l'induction et l'activité des metalloprotéinases de 70 à 80 % mais n'eut aucun effet sur leur inhibiteur endogène ..
Un autre phénomène intervient grandement dans la perte de tonicité de la peau, il s'agit d'un phénomène de pontage inter-fibrillaire. Déjà dans les années soixante, un chercheur (Verzar) lors d'une étude sur le vieillissement des fibres de collagène, avait montré qu'elles subissaient des pontages qui augmentaient avec le temps. Aujourd'hui, il est établi que ces pontages sont dû à une fixation non-enzymatique de molécules de glucose. La glycation se traduit par un phénomène de réticulation avec création de liaisons croisées anormales entre les fibrilles de collagène. Elle est le résultat d'une réaction chimique, appelée réaction de Maillard, entre une molécule de glucose (fonction aldéhyde) et des protéines (fonction amine), qui se condensent pour aboutir à la formati<?n irréversible de produits terminaux, appelés Advanced Glycation End-products (AGE). La réaction de Maillard est progressive et se déroule en trois stades (Figure 1 ).
14
-Figure 1 : Les trois stades qui conduisent à la glycation du collagène,
selon la réaction de Maillard (d'après Mariethoz) initiation: formation d'un produit d' Amadori
propagation : glyco-oxydation
terminaison: formation de produits de glycation avancée (AGE).
Protéine Glucose
lî
R-NH=CH-(CHOH)4-CH
20H
+
H
20
Bases de Schiff+
R-NH-CHrCO-(CHOH)
4-CH20H
Produits d' Amadori 1 1 1 : 02 1..
AGE
Au cours du dernier stade, l'oxydation provoque la formation d'une liaison croisée entre deux produits d' Amadori donnant naissance à un produit polycyclique : un AGE (Figure 2).
Les AGE, à la fois toxiques et immunogènes, s'accumulent au cours du vieillissement cutané, au niveau des fibres de collagène (Nagaraj).
Les collagènes dermiques fibrillaires extra-cellulaires sont très exposés aux élévations de la glycémie et donc à la glycation (Cerami). Chez le sujet âgé, le collagène glyqué se dégraderait mal et s'accumulerait, donnant des pigments bruns fluorescents (Rosenberg).
Ce mécanisme, désormais établi, pour expliquer les altérations du collagène dermique lors du vieillissement cutané, est-il accrût sous l'action des radicaux libres? Peu d'études, à notre connaissance, font le lien entre le vieillissement photo-induit et une augmentation des réactions de Maillard. Il est difficile de dire aujourd'hui si l'exposition aux ultraviolets entraîne via la formation d'AGE une perte de souplesse et de fermeté de la peau. L'équipe japonaise de Masaki s'est intéressée à clarifier le possible rôle des AGE dans le photo-vieillissement. Ils ont examiné sur des cultures de fibroblastes cutanés humains, les interactions existant entre les AGE et les UV-A. Les fibroblastes ont été exposés sous lumière ultraviolette A en présence d' AGE couplés à de l'albumine sérique bovine (AGE-BSA). Une analyse ESR spin-trapping a révélé la formation de radicaux libres instables dans les cultures de fibroblastes en présence du complexe AGE-BSA. A partir des résultats obtenus, les auteurs s'autorisent à dire que les AGE constituent via la formation d'espèces oxygénées: 02·-, H202 et OH9, un important facteur de promotion du vieillissement photo-induit. L'équipe de Horie, qui travaille notamment sur l'implication du stress glyco-oxydatif dans la néphropathie du diabétique, a étudié la coexistence des AGE et des produits de la peroxydation lipidique. Leurs résultats montrent que la localisation des AGE varie par rapport à leur structure. Ils ont pris en compte trois AGE; la pyrraline, la N-carboxymethyl lysine (CML) et la pentosidine. La pyrraline se révèlerait être spécifique du collagène de type III alors que la CML et pentosidine ne seraient pas associées à un type de collagène particulier et seraient réparties de façon ubiquitaire au sein du réseau collagénique. La coexistence de marqueurs de glyco-oxydation (tels que la pentosidine) et de marqueurs de la peroxydation lipidique (tels que le MDA) reflèteraient un stress oxydatif local. Ainsi, les marqueurs du phénomène de glycation pourraient servir de marqueurs de lésions oxydatives.
Après avoir vu les aspects cliniques et histologiques du vieillissement cutanée photo-induit,
il est important de souligner que ces modifications au sein du derme et de l'hypoderme sont bien différentes de celles observées au cours du vieillissement intrinsèque. En effet, la tendance est à
16
-penser que le photo-vieillissement est une simple accélération du phénomène de vieillissement intrinsèque. Le tableau récapitulatif de Leccia (Leccia, 1995) (Tableau I) permet de bien faire la distinction entre les deux. Lors du vieillissement cutané intrinsèque, les fibroblastes se raréfient et leur activité est diminuée, entraînant une perte qualitative et quantitative du matériel élastotique alors qu'au cours du vieillissement photo-induit, l'activité de ces mêmes cellules est stimulée.
Tableau I : Principales différences caractéristiques du vieillissement intrinsèque et de l'héliodermie (Leccia, 1995)
Vieillissement intrinsèque Héliodermie Fibroblastes Activité diminuée Activité augmentée Cellules inflammatoires Absentes Présentes
Tissu élastique Diminué Quantité augmentée anormale, Dégénérescence des fibres masses amorphes
Collagène Synthèse diminuée Dégénérescence basophile Solubilité diminuée Solubilité diminuée Glycosaminoglycanes Un peu diminués Augmentés
Vaisseaux cutanés Diminution modérée Télangiectasies
Qu'il soit photo-induit ou non, le vieillissement cutané touche d'autres macromolécules de la matrice, tels que les protéoglycanes qui ont un rôle très important dans l'hydratation du derme. Ces protéoglycanes sécrétés par les fibroblastes cutanés, subissent des modifications quantitatives et qualitatives : la chondroïtine sulfate et le dermatane sulfate, petites protéines, deviennent majoritaires (Kaminester). C'est l'acide hyaluronique qui est le plus touché.
III SYSTEMES DE DEFENSE ET PHOTOPROTECTION
111-1/ La photoprotection naturelle
Face à l'agression des rayonnements ultraviolets, l'organisme humain dispose d'une photoprotection naturelle qui lui permet, du moins pour un temps, de lutter par ses propres moyens.
&a
La pilosité
Bien que son rôle soit négligeable par rapport à l'animal, nous pouvons toutefois considérer qu'elle constitue une barrière importante que ce soit sous forme de cheveux, de moustache ou de barbe!
&P
Le stratum corneum
Son effet protecteur est mis en évidence par l'absence de coups de soleil sur les paumes des mains et la plantes des pieds car la couche cornée y est particulièrement bien développée. De plus, les coups de soleil répétés entraînent un épaississement de ce stratum comeum.
Le stratum comeum se défend grâce à sa richesse en acides aminés polaires qui absorbent les ultraviolets mais aussi par des phénomènes de réflexion du fait de sa structure pseudo-cristalline.
&P
Les mélanines
Les mélanines jouent le rôle principal de la photoprotection, bien démontré chez un sujet noir. Elles agissent contre les rayons UV selon divers mécanismes :
par des phénomènes de diffraction, à la manière d'un filtre. L'importance de la diffraction est fonction de la taille des mélanosomes
par dissipation de l'énergie: Les mélanines absorbent les rayons UV et visible et restituent l'énergie sous forme de chaleur
par formation d'une sorte de "bouclier génétique": Lorsqu'il y a irradiation, les mélanosomes se groupent autour du noyau du mélanocyte afin de protéger
1'
ADN.par un rôle de "tampon" des radicaux libres: On constate qu'après une irradiation, la concentration en radicaux libres d'une peau pigmentée est inférieure à celle trouvée au niveau d'une peau non pigmentée.
18 -&t> Autres composants photoprotecteurs
- L'acide urocanique :
C'est un composé produit par la désamination de l'histidine présente dans les grains de kératohyaline. Il absorbe les UV-B, les empêchant ainsi de pénétrer dans les molécules d'ADN qui présentent les mêmes caractéristiques d'absorption. Il agit donc comme un véritable filtre naturel au niveau de la peau. Cependant son action pourrait présenter des aspects négatifs tels que l'immunosuppression.
- Les lipides de surface
Les lipides présents dans le sébum, en particulier le cholestérol, absorbent une partie des UV. Leur rôle est démontré par le fait qu'une peau délipidée est plus fragile et présente une dose érythémateuse minimale (DEM) plus faible que la normale.
ill-2/ Les moyens de défense anti-radicalaire
Face aux dommages que peuvent créer certaines substances antioxydantes au sein d'organismes vivants, il existe de formidables systèmes naturels de défense que l'on appelle familièrement les "piégeurs de radicaux libres". Ce sont des enzymes, des molécules ou des composés antioxydants présents à l'intérieur ou à l'extérieur des cellules. Cette protection radicalaire peut également être d'origine exogène, sous forme de vitamines, d'oligoéléments, d'acides aminés apportés par l'organisme ou par l'alimentation (Deby).
ID-1-1/ Les systèmes de défense enzymatique
A l'intérieur des cellules, les moyens de défense contre l'agression radicalaire sont surtout enzymatiques. Les superoxydes dismutases (SOD), catalases, peroxydases et thioredoxine reductase (TR) constituent les enzymes clé de cette défense.
• Les superoxydes dismutases (SOD)
Comme leur nom l'indique, elles provoquent la dismutation de deux anions superoxydes 02 ·-en eau oxygénée H202 et en oxygène moléculaire 02.
2 02·-+
2W
---~ H202+
02Ces enzymes sont présentes chez tous les eucaryotes vivant en aérobie. Deux SOD sont connues chez les mammifères, l'une est mitochondriale (SODMn) et l'autre cytoplasmique (SODcuZn).
• La catalase
Elle catalyse la réduction du peroxyde d'hydrogène H202 en eau H20 et oxygène moléculaire 02. 2H202 ---~ 2H20
+
02Présente chez tous les mammifères, c'est une hémoprotéine localisée dans les peroxysomes. • Les glutathion peroxydases (GPX)
Elles décomposent les radicaux peroxyles, les hydroperoxydes (notamment les lipoperoxydes) et même le peroxyde d'hydrogène.
2R
+
2GSH ---~ 2RH+
GSSGROOH
+
2GSH ---~ ROH+
GSSG+
H20H202
+
2GSH ---~ 2H20+
GSSGCe sont des enzymes à sélénium, elles utilisent un co-facteur: le glutathion réduit (GSH) provenant de trois acides aminés alimentaires : l'acide y-glutamique, le glycocolle et la cystéine.
Le maintien de leur activité implique le recyclage du glutathion par la glutathion réductase, en présence de NADPH.
• La thioredoxine reductase (FR)
Autrefois, connue pour exercer une activité "SOD-like", la TR remplace la SOD absente du derme. Localisée au niveau des membranes des kératinocytes, elle pourrait jouer un rôle majeur dans la défense antiradicalaire au niveau épidermique (Schalbrauter et Wood). Nous savons aujourd'hui que les radicaux libres agissent indirectement sur l'initiation et la progression des tumeurs par modification du potentiel redox intracellulaire (Sun; Nakumara). En effet, il s'avère que ce potentiel détermine l'état redox d'un certain nombre de facteurs de transcription tels que AP-1 impliqué dans la synthèse de oncogènes, la protéine p53 ayant une action à la fois dans la réparation de l' ADN et
-20-dans le phénomène d'apoptose et la famille des protéines bcl2/bax intervenant -20-dans la mort cellulaire programmée. Ainsi, lorsqu'il y a modification, la cellule peut évoluer vers un état prolifératif, de différenciation ou se transformer en cellule apoptotique. La TR aurait un rôle dans le maintien de ce potentiel redox du fait de sa capacité à recycler la thioredoxine (TRx). Une dysrégulation du couple TR-TRx conduirait à une prolifération cellulaire excessive.
ill-1-2/ Autres protéines antioxydantes
• Les thioredoxines (TRx)
Présentes chez les procaryotes et chez les eucaryotes, ce sont des protéines de petit poids moléculaire contenant des résidus cystéine dans leur site actif: Cys32 -Gly-Pro-Cys35 -Lys. L'enzyme thioredoxine reductase avec laquelle elles font couple pour maintenir la fonctionnalité des facteurs de transcription, catalyse, de manière réversible, le passage de la forme réduite à la forme oxydée des résidus cystéine du site actif (Wang).
• Les métallothionéines (MI')
Protéines particulièrement riches en cystéine et en zinc, les métallothionéines sont capables d'inhiber la peroxydation lipidique (Dudek).
• La céruloplasmine
Elle agirait de trois façons :
soit par une activité catalytique sur la dismutation de 02·-soit en piégeant 02 ·_;oH et 102
soit en inhibant la réaction de Fenton à la manière d'une ferroxydase.
• L 'hème oxygénase (HO)
Dans le domaine de l'UV, l'hème oxygénase est une protéine clef. Elle catalyse la dégradation oxydative de l 'hème en biliverdine IXa, un précurseur de la bilirubine. Son expression est induite par les UV-A, les rayons X, H202, les métaux lourds, la peroxydation lipidique et la phagocytose (Basu-Moka; Keyse; Polla). Son expression est liée à celle de la ferritine. En effet, l'expression de la ferritine suit l'activité de l'HO. Toutefois, lors d'un stress oxydatif, l'augmentation de
l'expression de la ferritine n'est pas nécessairement accompagnée d'une augmentation de l'expression de l'hème oxygénase (Dennery).
• Bien d'autres protéines sont impliquées dans la défense antiradicalaire, telles que la famille bcl2/bax, les heat-shock prote in (HSP ),la ferritine, etc ...
Jll..1-3/ Les systèmes de défense non enzymatique Ce sont généralement des moyens de défense exogènes.
• Les piégeurs occasionnels
Ce sont des molécules endogènes qui captent les électrons célibataires aux dépends de leur propre intégrité. Principalement, on y trouve :
lesAGPI
les fonctions thiols des protéines (métallothionéine) les acides nucléiques
-
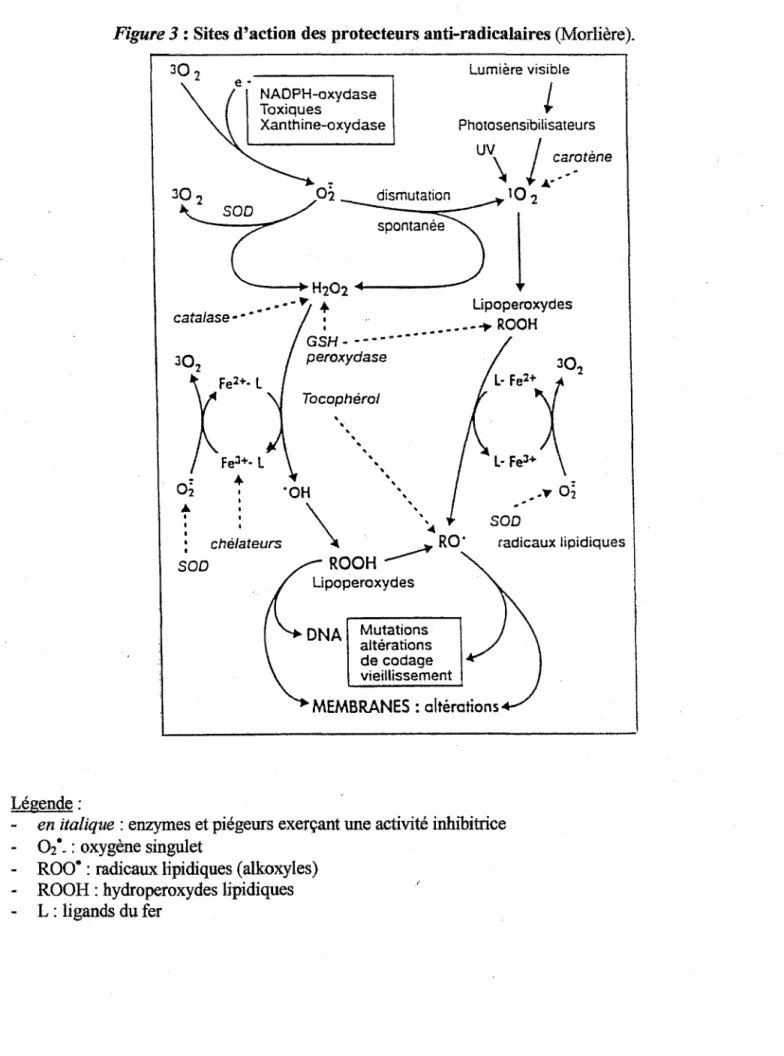
22-Figure 3:
Sites d'action des protecteurs anti-radicalaires(Morlière).
Légende:
SOD NAD PH-oxydase Toxiques Xanthine-oxydase spontanée Lumière visible PhotosensibilisateursUV\
l ...
c-~"!tène
10 2---+
H102 '4---~l
••.. --.- +
Lipoperoxydes catalase - - • 1 ·· _____ ..,.. ROOH Fe2+. L o~"'
1 1 • chélateurs SOD GSH - - - - • - - - • - • peroxydase Tocophérol. .
.
.
.
•.
• "OH '. \ •• ':cRO'ROCH~
Lipoperoxydes Mutations altérations de codage vieillissement SOD radicaux lipidiques MEMBRANES : oltérationsen italique : enzymes et piégeurs exerçant une activité inhibitrice
02·-: oxygène singulet
Roo· :
radicaux. lipidiques ( alkoxyles)
ROOH : hydroperoxydes lipidiques
L : ligands du fer
• Le glutathion
Présent dans divers systèmes biologiques, en particulier dans le cytoplasme, il joue un rôle majeur dans la protection des cellules de mammifères contre les UV-A et les UV-B.
Il existe une corrélation directe entre le taux de glutathion endogène (GSH) et une sensibilité aux UV-A. En effet, une déplétion en GSH de cultures de fibroblastes humains, provoque une augmentation de la sensibilité de ces cellules aux UV-A et aux UV-B (Tyrrell et Pidoux) et inversement, une irradiation UV-A induit une déplétion en GSH dans les fibroblastes cutanés humains (Emonet).
Dans les tissus, il est présent sous sa forme réduite. C'est sous cette forme qu'il capte les radicaux libres et produit une dismutation. Il réduit le peroxyde d'hydrogène et les lipoperoxydes. Il est ensuite régénéré par la glutathion réductase, en présence d'un co-facteur : le NADPH.
Emonet et coll. (Emonet; Emonet-Piccardi) ont démontré qu'une augmentation des taux de GSH par un traitement à la N-Acétyl Cystéine (NAC), protège vis à vis d'un effet léthal UV-A dépendant. De plus, lorsque les fibroblastes sont supplémentés en NAC, une diminution significative des dommages au niveau de l' ADN, est observée. Les auteurs concluent que le glutathion joue un rôle important dans la stabilité du matériel génétique des fibroblastes cutanés humains soumis à une exposition UV-A.
• L'acide urique
L'acide urique est l'élément final du métabolisme des purines chez 1 'homme. Il interviendrait en inactivant ·oH et 102. Il inhiberait également la chélation du fer Fe3+ et de ce fait, corrigerait le rôle néfaste de l'ascorbate (chélateur des ions Fe3
l.
• Certains acides aminés
La taurine serait un capteur de ·oH, l'hypotaurine pourrait également intervenir dans la protection des membranes cellulaires.
• Les oligoéléments
Ils ont un rôle dans la défense contre le stress oxydatif du fait qu'ils sont présents
dans
de nombreuses enzymes à action antiradicalaire mais certains agissent également en tant qu'anti-oxydant par interaction avec les groupements thiols (Zn). Le sélénium (Se) a une action via les-
24-enzymes. Il réduit le phénomène de peroxydation lipidique engendré par une irradiation UV (Leccia 1993b; Richard) et prévient les dommages de l 'ADN induits par une exposition UV-A Le zinc (Zn) joue aussi un rôle important dans la régulation de la mort cellulaire pendant et après une irradiation UV. Il protège également, comme le sélénium, les kératinocytes de la lipo-peroxydation provoquée par les UV, des dommages de l'ADN et du phénomène d'apoptose (Parat; Emonet). Son action est encore mal élucidée.
• Les vitamines
Nous le verrons de manière plus approfondie dans un chapitre suivant ainsi que dans la partie expérimentale, l' a-tocophérol ou vitamine E est connue pour son activité antiradicalaire très puissante, c'est même l'antioxydant lipophile le plus important (Record). Localisé principalement sur la partie externe des membranes cellulaires, l'a-tocophérol s'oppose à la peroxydation lipidique. Par leur action sur les hydroperoxydes (et notamment sur les lipoperoxydes), il semblerait que la vitamine E et les peroxydases sélénodépendantes agissent de façon complémentaire.
La vitamine C agirait, quant à elle, à la fois de façon indépendante comme piégeur de radicaux libres et également en collaboration avec la vitamine E avec laquelle il y aurait une synergie d'effet. Il est important de noter que l'auto-oxydation de l'acide ascorbique, dans des conditions aérobies, conduit à la formation d'ions 02•_, L'acide ascorbique est donc à la fois pro-oxydant et anti-oxydant. Le rôle de protection de l'ascorbate contre les radicaux libres est montré au niveau de l'œil : le cristallin de l'œil humain est pauvre en SOD mais riche en ascorbate qui constitue une première défense naturelle contre les effets délétères de l'exposition permanente de l'œil à la lumière.
Les caroténoïdes auraient une action antioxydante vis à vis de 102 et protégeraient de cette façon les
membranes de la lipidoperoxydation. Leur rôle sera également développé dans un chapitre suivant. Un rôle antioxydant a été reconnu à la vitamine K.
Malgré la suggestion selon laquelle l'ubiquinone peut agir comme un générateur de radicaux oxygénés, il peut avoir des propriétés antioxydantes in vitro et in vivo. Sous sa forme réduite, il est aussi actif que l'a-tocophérol dans son rôle antioxydant, et même plus grâce à sa forte propriété lipophile et régénératrice.
III-3/ Répartition des systèmes antioxydants endogènes
Première barrière contre l'agression radicalaire, la peau et surtout l'épiderme, devraient disposer d'une défense antioxydante de grande importance. Deux niveaux sont à considérer:
un niveau tissulaire un niveau cellulaire.
Antioxydants au niveau des couches cutanées :
Beaucoup d'études relatent la mesure d'antioxydants au niveau cutané, la plupart de ces explorations se limitent à l'étude d'un seul ou de deux antioxydants. Cependant, après avoir pris connaissance des différents systèmes de défense enzymatiques et non enzymatiques, on se rend compte que chacun d'entre eux a sa spécificité et qu'ils constituent un ensemble. C'est donc la proportion de chaque antioxydant au sein des différentes couches cutanées qui est importante.
Shindo et son équipe se sont ainsi intéressé à l'ensemble des composés antioxydants de la peau chez la souris et chez l'homme. Ils ont volontairement séparé le derme et l'épiderme du fait que le cancer concerne plutôt l'épiderme et que le vieillissement intéresse davantage le derme.
Chez la souris :
Considérons dans un premier temps, les activités des systèmes enzymatiques de la souris. Au niveau de l'épiderme, trois des quatre antioxydants enzymatiques (la catalase, la GPX et la Glu-R) se trouvent à des activités supérieures par rapport au derme (respectivement de 49, 86 et 74%) lorsque l'activité est exprimée par gramme de peau. La SOD a la même activité dans les deux couches. Cependant, si l'activité est exprimée par milligramme de protéine, seule la SOD montre une différence d'activité: elle est supérieure de 135% au niveau du derme (Tableau II).
-
26-Tableau II: Activités des antioxydants enzymatiques au niveau de l'épiderme et du derme chez la souris sans poils.
Enzyme Epiderme Derme
SOD 708±35 900±78 11.7± 1.4 27.5±2.5 Catalase 1662±204 1109± 112 30.4±4.3 33.3 ± 1.6 Glutathion peroxidase 2.46±0.32 1.32±0.08 0.049 ± 0.003 0.040 ± 0.004 Glutathion reduetase 2.42 ±0.30 1.39 ± 0.11 0.042 ± 0.001 0.041±0.001
n = 5 ; les résultats sont rendus à ± SE
Valeur supérieure; U/g peau; valeur inférieure; U/mg protéine Epiderme différent du derme, p < 0.001
Epide1me différent du derme, p < 0.05 Epiderme différent du derme, p < 0.01
Concernant les antioxydants non enzymatiques de la souris, les mêmes variations sont observées. Les concentrations en composés lipophiles (tocophérol, ubiquinone et ubiquinol) et en composés hydrophiles (acide ascorbique, acide dehydroascorbique et glutathion réduit) sont supérieures dans l'épiderme par rapport au derme: respectivement de 45, 52 et 55% pour les antioxydants lipophiles et de 24, 48 et 95% pour les hydrophiles (Tableau ID).
Tableau III : Concentrations en antioxydants lipophiles et hydrophiles au niveau de l'épiderme et du derme chez la souris sans poils.
Concentration dans Concentration dans
Antioxydant !'Epiderme le Derme
( nmol / sz tissu) (nmol / g tissu)
a-Toeopherol 4.81 ±0.47 3.32 ±0.33
Ubiquinol 9 l.87 ±0.20 1.21±0.24
Ubiquinone 9 15.21±1.13 10.03 ±0.65
Total (ubiquinol +ubiquinonc) 17.08 ± 1.08 11.35 ± 0.45
% ubiquinone 9 88.7±1.5 89.1±2.3
Acide ascorbique 1321±77 1064±54
Acide dehydroascorbique 1324 ± 176 895±109
Total (acide ascorbique+ acide dehydroascorbique) 2663±197 1959 ± 139
% acide dehydroascorbique 48.3 ± 3.9 44.6±2.7
Glt1tathion réduit 1160±84 594±69
Ulutathion oxydé 66± 19 163 ± 30
Total (glutathion réduit + glutathion oxydé) 1226±82 757±75
% glutathion oxydé 5.5 ± 1.6 21.7 ± 4.2
n = 5 ( ascorbate, n = 10) ; les résultats sont rendus à ± SE Epiderme différent du derme, p < 0.001
Epidenne différent du derme, p < 0.05 Epiderme différent du derme, D < 0.01
Chez l'homme :
Les mesures effectuées sur les échantillons provenant de six personnes (sans distinction d'âge, de sexe, de race ou de localisation du prélèvement) ont donné des résultats comparables à ceux obtenus chez la souris. Concernant les antioxydants enzymatiques, la SOD, la glutathion peroxydase (GPX), la glutathion reductase (GluR) et la catalase présentent des activités (en unités par gramme de peau) supérieures au niveau de l'épiderme par rapport au derme de 126, 61, 215 et 720%. L'activité des deux autres enzymes intervenant comme cofacteur de la GluR (régénération du glutathion par le NADPH): la glucose-6-phosphate deshydrogénase (GPDH) et l'isocitrate deshydrogénase (ICDH) montrent la même élévation épidermique (Tableau IV).
Tableau IV: Activités des antioxydants enzymatiques au niveau de l'épiderme et du derme chez l'homme.
Enzyme Epiderme Derme
SOD 816± 105 361±28 17.8± 1.0 15.0 ± 1.3 Ca ta la se 2912±406 355 ±89 62.0±6.0 14.6±2.9 Glutathion peroxidase 0.71 ±0.09 0.44 ±0.04 0.013 ± 0.002 0.018±0.004 Glutathion reductase 0.63 ± 0.11 0.20±0.01 0.013 ± 0.001 0.008 ± 0.001 Glucose-6-phosphate deshydrogenase 0.57±0.09 0.27±0.04 0.012 ± 0.002 0.010 ± 0.001 Isocitrate deshydrogenase 1.53 ± 0.22 0.37±0.04 0.033 ± 0.045 0.019±0.002
n = 6 ; les résultats sont rendus à ± SE
Valeur supérieure; U/mg peau; valeur inférieure; U/mg protéine Epiderme différent du derme, p < 0.001
Epiderme différent du derme, p < 0.05 Epiderme différent du derme, p < 0.01
Les concentrations épidermiques en antioxydants non enzymatiques sont aussi supérieures de 90% pour l'a-tocophérol, de 900% pour l'ubiquinol, de 425% pour l'acide ascorbique et de 513% pour le GSH par rapport au derme (Tableau V).
-
28-Tableau V : Concentrations en antioxydants lipophiles et hydrophiles au niveau de l'épiderme et du derme chez l'homme.
Concentration dans Concentration dans
Antioxydant l'Epidenne le Derme
(nmol / 11 tissu) (nmol / 11 tissu)
y-Tocopherol 3.26± 1.00 1.78 ±0.15
a-Tocopherol 31.0 ± 3.8 16.2± 1.10
Total vitamine E 34.2±4.6 18.0±1.06
Ubiquinol 10 3.53 ±0.79 0.35±0.08
Ubiquinone 10 4.12 ± 0.59 2.86±0.84
Total (ubiquinol + ubiquinone) 7.66±0.45 3.15±0.87
% ubiquinone 10 54.6±8.25 90.4± 3.02
Acide ascorbique 3.798± 1016 723 ±320
Acidee dehydroascorbique 3.802±1552 588±240
Total (acide ascorbique+ acide dehydroascorbique) 7.600±2498 1.311 ±559
% acide dehydroascorbique 46.6±4.0 44.9± 1.9
Acide urique 1071±242 182±24
Glutathion réduit 460.9±77.4 75.1 ±9.0
Glutathion oxydé 23.3 ± 6.41 9.6±3.8
Total (glutathion réduit +glutathion oxydé) 484.3 ± 81.4 84.8 ± 11.5
% glutathion oxydé 5.0±0.86 10.5±2.7
n = 6 ; les résultats sont rendus à ± SE Epiderme différent du derme, p < O. OO 1 Epidenne différent du derme, p < 0.05 Epiderme différent du derme, p < 0.01
Antio.xydants au niveau cellulaire :
Le chercheur Y ohn et son équipe ont étudiés des cultures cellulaires extraites de deux groupes de sujets: des sujets à peau blanche et d'autres à peau noire. Ils ont mesurés dans chaque type cellulaire (kératinocytes, fibroblastes et mélanocytes), l'activité des enzymes antioxydantes. Les résultats obtenus montrent une hiérarchie cellulaire en SOD, catalase et GPX : le contenu des fibroblastes serait supérieur à celui des kératinocytes qui serait supérieur à celui des mélanocytes.
IV LES CONSEQUENCES CELLULAIRES
Soumise en permanence aux rayonnements solaires, la peau est particulièrement concernée par l'agression radicalaire. Le parfait équilibre entre systèmes producteurs et systèmes protecteurs peut être perturbé, entraînant un taux excessif de radicaux libres et par voie de conséquence, le vieillissement cutané ou plus grave, la photocarcinogénèse.
IV-1/ Apoptose et nécrose cellulaires
Le stress oxydant généré par le rayonnement ultraviolet A provoque des lésions de l 'ADN mais également des membranes cellulaires, il peut alors se produire, un blocage des signaux de prolifération cellulaire ou, à l'inverse, une amplification; d'autres messages, qui vont conduire la cellule à son suicide ou à sa nécrose, peuvent se mettre en place.
La mort des cellules peut donc survenir de deux façons, par nécrose ou par un phénomène d'apoptose. Nécrose et apoptose se différencient par leurs caractères morphologiques et biochimiques.
IV-1-1/ La nécrose
La nécrose s'accompagne d'une augmentation de la perméabilité membranaire aux ions, les cellules se gonflent jusqu'à ce qu'il y ait rupture de la membrane, entrainant la libération d'enzymes toxiques contenues à l'intérieur; ces substances tuent les cellules environnantes, déclenchant une réaction inflammatoire et une cicatrice fibreuse.
IV-1-2/ L'apoptose
L'apoptose se présente très différemment: la cellule qui se suicide se détache de ces voisines et se désintègre de façon ordonnée. Son noyau se condense, puis se fragmente, les chromosomes et le génome se brisent en fragments réguliers, et le cytoplasme se divise en petits sacs, rapidement ingérés par les cellules voisines. La grande caractéristique de l'apoptose est la membrane cellulaire qui prend un aspect «bourgeonnant» et qui ne se rompt pas, évitant ainsi la libération des constituants cellulaires toxiques à l'origine d'une réaction inflammatoire (Ameisen). Au cours de l'apoptose, il y a activation d'une endonucléase endogène. C'est cette endonucléase calcium.-magnésium dépendante qui coupe la double chaîne d' ADN au niveau de la région intemucléosomale la plus accessible, générant des mono- et oligo-nucléosomes (multiples de 180 paires de base)
-
30-(Arends). En revanche, l' ADN des nucléosomes, très fortement complexé avec le cœur des histones est par conséquent épargné du clivage par l' endonucléase.
L'emichissement en mono- et oligo-nucléosomes dans le cytoplasme de la cellule apoptique est dû au fait que la dégradation de 1' ADN se produit plusieurs heures avant la rupture de la membrane cellulaire.
La mise en évidence de la fragmentation de l'ADN au cours du phénomène d'apoptose peut être réalisée par différentes méthodes telles que la cytométrie en flux (Lizard). Cette technique est utilisée pour distinguer la nécrose de l'apoptose ainsi que pour identifier et quantifier les cellules apoptotiques. Le plus souvent, les techniques utilisées sont basées sur l'incorporation de désoxynucléotides soit par nick-translation in situ, soit par la méthode TUNEL (TdT dUTP Nick End Labelling) (Grasl-Kraupp).
Beaucoup de travaux de recherche sur le phénomène d'apoptose, ont été publiés ces dernières années et ont ainsi permis de connaître un peu mieux la manière dont se déroule le processus. Il s'avère que des événements affectant les mitochondries représentent une étape précoce et obligatoire dans le déroulement du phénomène d'apoptose (Mignotte). Un certain nombre de signaux apoptiques entraînent l'ouverture de mégapores, associée à une diminution du potentiel transmembranaire de la mitochondrie (Dym). Tl s'en suit une libération de facteurs induisant l'apoptose ou protéases apoptogènes (AIF) (Polla, 1998). En fait, la transition de la perméabilité membranaire peut être inhibée par Bcl-2, présente sur la membrane extérieure de la mitochondrie, près des sites de contact membranaire (externe/interne), c'est à dire là où les mégapores sont supposés se former (May). Par ailleurs, au cours de l'apoptose, le cytochrome c, en se dissociant des mitochondries, activerait des protéases impliquées dans les manifestations nucléaires de l'apoptose (May).
Plusieurs gènes sont donc impliqués dans le contrôle de l'apoptose. Nous savons depuis longtemps que la protéine p53 est un régulateur du cycle cellulaire dont l'expression est induite principalement par les événements susceptibles d'endommager l' ADN mais aussi, dans certains cas, par la privation de facteurs de croissance. Son rôle est de bloquer le passage de la phase G 1 à la phase S afin de permettre la réparation des altérations de l 'ADN et, le cas échéant de déclencher l'apoptose. Elle agit également en augmentant l'expression de Bax, activateur de l'apoptose et en diminuant Bcl-2 qui favorise la survie cellulaire (Phelouzat). D'autres protéines, connues plus