Synthèse et caractérisation de molécules peptidiques
bioactives et catalytiques
Thèse
Christopher Bérubé
Doctorat en chimie
Philosophiæ doctor (Ph. D.)
Québec, Canada
Synthèse et caractérisation de molécules peptidiques
bioactives et catalytiques
Thèse
Doctorat en chimie Philosophiae Doctor (Ph. D.)Christopher Bérubé
Sous la direction de :
Résumé
Les peptides sont des molécules uniques et ubiquitaires puisqu’ils modulent presque tous les processus physiologiques et biochimiques des êtres vivants. En ce sens, l’essence de ma thèse de doctorat s’inscrit principalement dans le développement de nouvelles méthodologies de synthèse de peptides cycliques pour des fins catalytiques et pharmaceutiques. L’ensemble des molécules peptidiques cycliques ont été préparées via les propriétés uniques de la résine oxime, qui permet une étape simultanée de cyclisation/clivage, ce qui en fait une méthode efficace et rapide pour la synthèse de peptides sur support solide, particulièrement de peptides cycliques difficiles à préparer par les méthodes conventionnelles.
D’abord, dans le bloc A, une chimiothèque (95) de nouveaux peptides bio-inspirés a été préparée. Ceux-ci ont été utilisés pour le développement de nouveaux procédés chimiques écoresponsables, soit l’époxydation énantiosélective en milieu aqueux. Le recours aux peptides comme biocatalyseurs opérant dans l'eau est très avantageux tant sur le plan environnemental que de l’économie puisque ces catalyseurs sont peu coûteux, ne génèrent que peu de déchets toxiques et sont réutilisables. La présente étude, séparée en quatre grands chapitres où la catalyse est une thématique centrale, nous fait comprendre les conditions expérimentales optimales selon l’utilisation de peptides cycliques ou d’oligopeptides linéaires pour l’époxydation énantiosélective de cétones insaturées. Parallèlement, certains dipeptides cycliques ont été employés comme précurseurs clés pour la synthèse de nouveaux ligands diaminés de type pipérazines ainsi que pour la première synthèse totale de la chrysamide B, partie intégrante du bloc B.
Finalement, les deux derniers blocs (C et D) consistent à pallier aux problèmes de cyclisation de peptides en solution pour la synthèse de peptides cycliques. Celle-ci est fastidieuse et mène à de faibles rendements et puretés. Notre groupe s’intéresse à développer une nouvelle méthodologie de cyclisation/clivage à l’aide de la résine oxime afin d’offrir une alternative rapide, générale et efficace à la cyclisation de peptides en solution. L’efficacité de la stratégie a permis la synthèse totale et la caractérisation de plus de 18 peptides cycliques naturels, dont certains possèdent des activités antimalariales très intéressantes. Par ailleurs, l’étude de la méthodologie a permis le développement d’une nouvelle stratégie de cyclisation tête-chaîne latérale permettant la préparation de sept peptides cycliques naturels de type anabaénopeptines et pseudacyclines.
Abstract
Peptides are unique and ubiquitous molecules since they modulate almost all the physiological and biochemical processes of living organisms. In this regard, the essence of this PhD thesis is mainly in the development of new cyclic peptide synthetic methodologies for catalytic and pharmaceutical areas. Cyclic peptide molecules have been prepared via the unique properties of the oxime resin, which allows a concomitant cyclization/cleavage step. This methodology has been applied for the synthesis of cyclic peptides by an on-resin cyclization, alternatively to conventional methods using in-solution cyclization.
First, in block A, a library (95) of new bio-inspired peptides was prepared. These peptides have been used for the development of new eco-friendly chemical process, which is an enantioselective epoxidation in aqueous medium. The use of peptides as biocatalysts operating in water is very advantageous towards environmentally and economically aspects since these catalysts are inexpensive, generate few toxic waste and are reusable. The present study, separated into four main chapters in which catalysis is a central theme, makes us understand the optimal experimental conditions according to the use of cyclic peptides or linear oligopeptides for the enantioselective epoxidation of unsaturated ketones. Also, cyclic dipeptides have been used as key precursors for the synthesis of new piperazine-type diamino ligands as well as for the first total synthesis of chrysamide B, an integral part of block B.
Finally, the last two blocks (C and D) aim to overcome the cyclization of peptides in solution for the synthesis of cyclic peptides. This is tedious and leads to low yields and purities. Our group is interested in developing a new methodology for cyclization/cleavage using oxime resin in order to offer a fast, general and efficient alternative to the cyclization of peptides in solution. The effectiveness of the strategy has allowed the total synthesis and characterization of more than 18 natural cyclic peptides, some of which have very interesting antimalarial activities. In addition, the study of the methodology allowed the development of a new strategy of head-to-side chain cyclization allowing the preparation of seven natural cyclic peptides, two anabaenopeptins and five pseudacyclins.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... x
Liste des schémas ... xiii
Liste des tableaux ...xiv
Liste des abréviations ... xv
Remerciements ...xxi
Avant-propos et organisation de la thèse ... xxiv
Introduction ... 1
Les peptides ... 1
Les peptides cycliques ... 1
Classification des peptides cycliques ... 2
Synthèse de peptides sur support solide ... 4
Paramètres de cyclisation ... 6
Cyclisation de peptides en solution... 8
Cyclisation par cyclisation/clivage ... 8
La résine oxime ... 14
La catalyse asymétrique enzymatique ... 44
Les organocatalyseurs biomimétiques ... 44
Objectifs de la thèse ... 47
Objectif 1o : Exploiter la résine oxime pour la préparation d’une librairie de peptides cycliques et étudier leurs propriétés en catalyse asymétrique ... 47
Objectif 2o : Développer une stratégie de synthèse efficace de pipérazines à partir d’acides aminés et de la résine oxime ... 48
Objectif 3o : Développer une méthodologie de synthèse de peptides cycliques naturels tête-chaîne latérales sur résine oxime ... 48
Objectif 4o : Exploiter la résine oxime pour réaliser la synthèse de peptides cycliques naturels de type tête-queue ... 48
Bloc A : Époxydation asymétrique catalysée aux peptides cycliques et linéaires ... 49
Chapitre 1 : Biomimetic epoxidation in aqueous media catalyzed by cyclic dipeptides ... 50
(Article I) ... 50
1.2. Résumé de l’article I ... 52
1.3. Contenu de l’article I... 53
1.3.1. Abstract ... 53
1.3.2. Introduction ... 53
1.3.3. Results and discussion ... 54
1.3.4. Conclusion ... 59
1.3.5. Experimental ... 59
1.3.6. Acknowledgments ... 63
Chapitre 2 : Interfacial supramolecular biomimetic epoxidationcatalyzed by cyclic dipeptides ... 64
(Article II) ... 64 2.1. Avant-propos de l’article II ... 65 2.2. Résumé de l’article II ... 66 2.3. Contenu de l’article II ... 67 2.3.1. Abstract ... 67 2.3.2. Introduction ... 67
2.3.3. Results and discussion ... 68
2.3.4. Conclusion ... 81
2.3.5. Experimental ... 82
2.3.6. Acknowlegments ... 95
Chapitre 3 : Crown-ether-modified cyclic dipeptides as supramolecular chiral catalysts ... 96
(Article III) ... 96
3.1. Avant-propos de l’article III ... 97
3.2. Résumé de l’article III ... 98
3.3. Contenu de l’article III ... 99
3.3.1. Abstract ... 99
3.3.2. Introduction ... 99
3.3.3. Results ans discussion ... 101
3.3.4. Conclusion ... 109
3.3.5. Experimental section ... 109
3.3.6. Acknowlegments ... 117
Chapitre 4 : Revisiting the Juliá-Colonna enantioselective epoxidation: supramolecular catalysis in water ... 118
(Article IV) ... 118
4.2. Résumé de l’article IV ... 120
4.3. Contenu de l’article IV ... 121
4.3.1. Abstract ... 121
4.3.2. Introduction ... 121
4.3.3. Results and discussion ... 122
4.3.4. Conclusion ... 127
4.3.5. Experimental ... 128
4.3.6. Acknowlegments ... 134
Bloc B: Synthèse de dérivés pipérazines ... 135
Chapitre 5 : Novel chiral N,N’-dimethyl-1,4-piperazines with metal binding abilities... 136
(Article V)... 136 5.1. Avant-propos de l’article V ... 137 5.2. Résumé de l’article V ... 138 5.3. Contenu de l’article V ... 139 5.3.1. Abstract ... 139 5.3.2. Introduction ... 139
5.3.3. Results and discussion ... 140
5.3.4. Conclusion ... 145
5.3.5. Experimental section ... 146
Chapitre 6 : Total synthesis of chrysamide B (Article VI) ... 157
6.1. Avant-propos de l’article VI ... 158
6.2. Résumé de l’article VI ... 159
6.3. Contenu de l’article VI ... 160
6.3.1. Abstract ... 160
6.3.2. Introduction ... 160
6.3.3. Results and discussion ... 161
6.3.4. Experimental section ... 164
6.3.5. Acknowledgments ... 170
Bloc C : Mise au point d’une cyclisation tête-chaîne latérale sur résine oxime ... 171
Chapitre 7 : A novel route towards cycle-tail peptides using oxime resin: teaching an old dog a new trick .... 172
(Article VII) ... 172
7.1. Avant-propos de l’article VII ... 173
7.3. Contenu de l’article VII ... 175
7.3.1. Abstract ... 175
7.3.2. Introduction ... 175
7.3.3. Results and discussion ... 176
7.3.4. Conclusion ... 182
7.3.5. Experimental ... 182
7.3.6. Conflicts of interest ... 192
7.3.7. Acknowledgements ... 192
Chapitre 8 : Total synthesis of pseudacyclins A–E by an on-resin head-to-side chain concomitant cyclization-cleavage reaction ... 193
(Article VIII) ... 193
8.1. Avant-propos de l’article VIII ... 194
8.2. Résumé de l’article VIII... 195
8.3. Contenu de l’article VIII ... 196
8.3.1. Abstract ... 196
8.3.2. Introduction ... 196
8.3.3. Results and discussion ... 197
8.3.4. Conclusion ... 200
8.3.5. Experimental ... 201
8.3.5. Acknowledgments ... 204
Bloc D : Synthèse de peptides macrocycliques naturels de type tête-queue ... 205
Chapitre 9 : Total synthesis of Crotogossamide using an on-resin concomitant cyclization/cleavage reaction ... 206 (Article IX) ... 206 9.1. Avant-propos de l’article IX ... 207 9.2. Résumé de l’article IX ... 208 9.3. Contenu de l’article IX ... 209 9.3.1. Abstract ... 209 9.3.2. Introduction ... 209
9.3.3. Results and discussion ... 209
9.3.4. Conclusion ... 213
9.3.5. Experimental ... 213
(Article X)... 217 10.1. Avant-propos de l’article X ... 218 10.2. Résumé de l’article X... 219 10.3. Contenu de l’article X ... 220 10.3.1. Abstract ... 220 10.3.2. Introduction ... 220
10.3.3. Results and discussion ... 221
10.3.5. Conclusion ... 225
10.3.5. Experimental ... 225
10.3.6. Acknowledgments ... 229
Chapitre 11 : Total synthesis and antimalarial activity of dominicin, a cyclic peptide from a marine sponge .. 230
(Article XI) ... 230
11.1. Avant-propos de l’article XI ... 231
11.2. Résumé de l’article XI... 232
11.3. Contenu de l’article XI ... 233
11.3.1. Abstract ... 233
11.3.2. Introduction ... 233
11.3.3. Results and discussion ... 235
11.3.4. Conclusion ... 239
11.3.5. Experimental ... 240
11.3.6. Associated content ... 244
11.3.7. Author information ... 244
11.3.8. Acknowledgments ... 244
Chapitre 12 : Catching peptides by the tail: the Ouroboros strategy towards macrocyclic peptides ... 245
(Article VII) ... 245
12.1. Avant-propos de l’article XII ... 246
12.2. Résumé de l’article XII ... 247
12.3. Contenu de l’article XII ... 248
12.3.1. Abstract ... 248
12.3.2. Introduction ... 248
12.3.3. Results and discussion ... 249
12.3.4. Conclusion ... 256
12.3.6. Conflicts of interest ... 262
12.3.7. Acknowledgements ... 262
Conclusions et perspectives ... 263
Retour sur les objectifs ... 263
Objectif 1o : Exploiter la résine oxime pour la préparation d’une librairie de peptides cycliques et investiguer leurs propriétés en catalyse asymétrique ... 263
Objectif 2o : Développer une réaction d’époxydation asymétrique uniquement dans l’eau et catalysée par des oligopeptides hydrophobes. ... 263
Objectif 3o : Développer une méthodologie de synthèse de peptides tête-chaîne latérales naturels sur résine oxime ... 264
Objectif 4o : Réaliser la synthèse de peptides cycliques naturels de type tête-queue et investiguer leurs propriétés biologiques par le biais de collaborations... 264
Perpsectives ... 266
Macrolactonisation sur résine oxime ... 266
Approfondissement de la réactivité du lien ester d’oxime ... 267
Liste des figures
Figure i1 : Exemples de peptides cycliques sur le marché pharmaceutique ... 2
Figure i2 : Stratégie de cyclisation de peptides cycliques ... 3
Figure i3 : Différenciation entre des peptides cycliques homo- et hétérodétiques... 4
Figure i4 : Groupements protecteurs Boc et Fmoc pour la synthèse sur support solide ... 5
Figure i5 : Supports solides permettant une étape de cyclisation/clivage ... 9
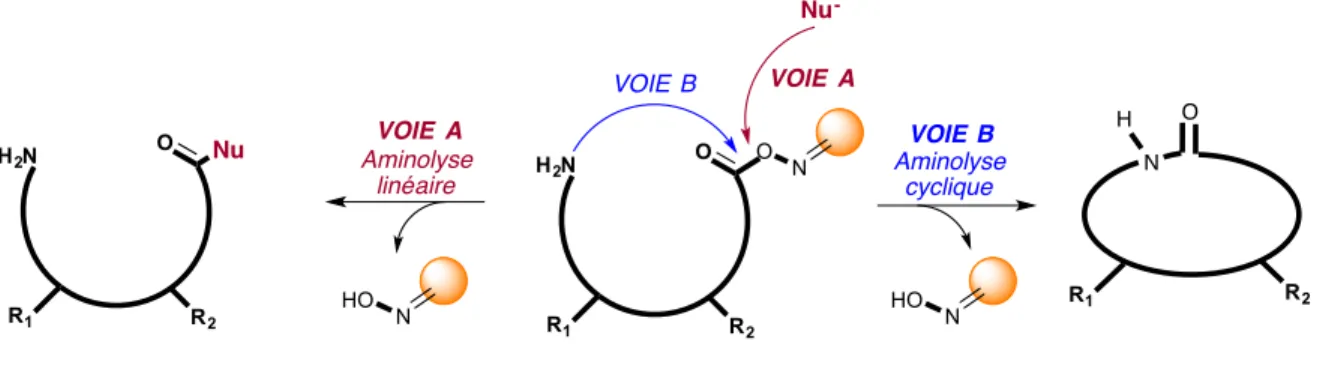
Figure i6 : Aminolyse linéaire ou cyclique sur résine oxime ... 15
Figure i7 : Synthèse de la résine oxime ... 15
Figure i8 : Modification des propriétés électroniques de la fonction oxime ... 17
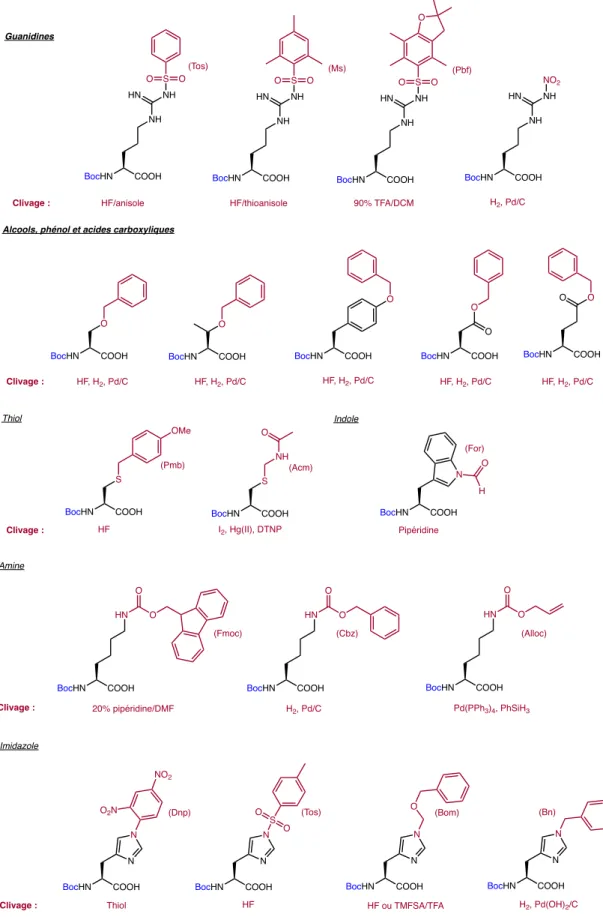
Figure i9 : Acides aminés protégés orthogonalement compatibles avec la résine oxime ... 18
Figure i10 : Réactions d'oligomérisation et de cyclisation sur résine oxime... 19
Figure i11 : Représentation schématique de différents taux de substitution sur résine oxime ... 20
Figure i12 : Facteurs extrinsèques influençant l'efficacité de la cyclisation sur résine oxime ... 20
Figure i13 : Hexapeptides à octapeptides cycliques préparés par le groupe Voyer ... 32
Figure a14: Résumé graphique de l’article I ... 52
Figure a15 : Cyclic and linear bio-inspired catalysts used in this study ... 54
Figure a16 : Résumé graphique de l’article II ... 66
Figure a17 : Catalyst rigidity effect in the asymmetric epoxidation of a1 ... 68
Figure a18 : Synthetic strategy towards CDPs ... 69
Figure a19 : cis-(L,L) CDPs synthezised ... 70
Figure a20 : cis-(D,D) CDPs synthesized ... 70
Figure a21 : trans-(D,L) CDPs synthesized ... 71
Figure a22 : Functional groups modification of CDP a3a ... 77
Figure a23. Frequency distributions of the SASA(hexane)/SASA(water) ratio for CDP a3a (blue) and trans-chalcone a1 (red). Frequencies for each molecule sums to 100%. A ratio of one denotes an equal exposure to hexane and water. ... 78
Figure a24 : Orientation of CDP a3a (left) and trans-chalcone a1 (right) with respect to the interface. Orientation is expressed as a distribution of angle Θ between the Z axis (normal of the interface) and each vector (V1) ⃗, (V2) ⃗ and (V3) ⃗. Frequency for distribution profiles sums to 100% ... 79
Figure a25 : (Left) Optimized supramolecular complex proposed as model for the enantioselective epoxidation of a1 catalyzed by CDP. CDP a3a (green), trans-chalcone a1 (cyan), hydroperoxyde are in sticks and sodium is represented as a sphere. Only hydrogen involved in polar interactions are represented. The polar interactions are identified with dashed yellow lines. A grey dashed line is arbitrarily placed to represent the hexane/water interface. (Right) Illustration of the productive and non-productive supramolecular complexes. 80 Figure 26 : Comparison of the calculated models for functional supramolecular complex of CDP a3a and CDP a26a. (Left) CDP a3a (green), CDP a26a (orange), trans-chalcone a1 (cyan) and hydroperoxide are in sticks, sodium is a sphere. Only hydrogen involved in polar in polar interactions are represented. The polar interactions are identified with dashed yellow lines. A grey dashed line is arbitrarily placed to represent the hexane/water interface. Clash between the ethyl chain on beta carbon of CDP a26a (orange) with trans-chalcone a1 is shown with orange lines. (Right) Superimposition of the optimized supramolecular complex obtained with CDP a3a in green and CDP a26a in orange showing the two calculated position for a1, the orange structure is located in water. ... 81
Figure a28 : Previous work by Sonveaux and Závada ... 100
Figure a29 : Synthetic procedure for crowned DOPA amino acid derivatives a57-a59 ... 102
Figure a30 : Synthetic procedure for crown-CDPs ... 103
Figure a31 : Résumé graphique de l’article IV ... 120
Figure a32 : A) Interaction of trans-chalcone a1 with PLL and PLA. PLL and PLA are represented in gray cartoon. Leucine side chains interacting with trans-chalcone a1 are represented as spheres. B) Contact surface area (Å) between trans-chalcone a1 and PLL (red) or PLA (black). ... 126
Figure a33 : Angular distribution of angle θ between trans-chalcone a1 (green) carbonyl (red) and PLL helix. The angle between the PLL helix axis and the trans-chalcone a1 carbonyl vector was calculated from the inverse cosine of the scalar product of these two vectors. PLL is represented in gray cartoon. Leucine side chains interacting with trans-chalcone a1 are represented as spheres. ... 126
Figure a34 : Supramolecular complexes proposed for the “groove sliding” mechanism. Trans-chalcone a1 and PLL are represented in sticks and ribbon respectively. Hydroperoxide is in red spheres. Only the complex depicted in A has a distance of 2.5Å and a 98° angle between the hydroperoxide and trans-chalcone a1 reactive atoms. ... 127
Figure a35 : poly-L-Leucine spectrum ... 131
Figure a36 : poly-L-Alanine spectrum... 132
Figure a37 : poly-L-Isoleucine spectrum... 132
Figure a38 : poly-L-Valine spectrum ... 133
Figure a39 : Solid-state ATR spectra of homo-oligopeptide catalysts in the amide I region ... 133
Figure a40 : Résumé graphique de l’article V ... 138
Figure a41 : Metal chelating features shown by a) (-)-sparteine281 (b1) and b) 1,4-piperazines269 ... 139
Figure a42 : Retrosynthetic approach towards the desired N,N’-dimethyl-1,4-piperazines. ... 140
Figure b43 : Metal picrate extraction procedure to evaluate binding ability of potential ligands for different metal ions ... 142
Figure b44 : Résumé graphique de l’article VI ... 159
Figure b45 : Structures of chiral piperazine derivatives isolated from marine microorganisms ... 161
Figure b46 : Retrosynthetic approach to chrysamide B ... 161
Figure b47 : D-Alanine derived 1,4-piperazine b37 synthetic procedure ... 162
Figure b48 : Epoxy-acid b38 and chrysamide B b36 synthetic procedures. ... 164
Figure c49 : Résumé graphique de l’article VII ... 174
Figure c50 : Chemical structures of schizopeptin 791 and anabaenopeptin NZ825 (red: endocyclic lysine) .. 176
Figure c51 : Retrosynthetic approach towards the AP scaffold ... 177
Figure c52 : Synthesis of APs cyclic peptides c5 and c6 and their cyclic dimers isolated. ... 178
Figure 53 : ESI mass spectrum of cyclized peptide c5 obtained (above) and cyclic dimer c7 (below) with calculated monomer (c5) and dimer (c7) isotopic (inserts). ... 180
Figure c54 : Side-chain synthesis, exocyclic ureamidation and deprotection procedures for the synthesis of c1 and c2. ... 181
Figure c55 : Résumé graphique de l'article VIII ... 195
Figure c56 : Structures of pseudacyclins A-E (red: endocyclic ornithine) ... 197
Figure c57 : Retrosynthetic approach towards pseudacyclin cycle-tail peptide scaffold ... 198
Figure c58 : Procedure for the total synthesis of pseudacyclins A-E (c15-c19). ... 200
Figure d60 : Peptide macrocycles prepared on oxime resin and Crotogossamide d1 with its structural features
... 210
Figure d61 : Synthetic route towards Crotogossamide d1 ... 211
Figure d62 : ESI-Mass spectrum of cyclized peptides obtained (above: monomer; below: dimer) with calculated monomer and dimer isotopic distributions ... 212
Figure d63 : Résumé graphique de l'article X ... 219
Figure d64 : Structure of natural products isolated from Mortierella species. ... 221
Figure d65: Mortiamides A to D synthetic procedures ... 223
Figure 66 : IC50 of mortiamides A, B, and D (1, 2, and 4). ... 224
Figure 67 : in vitro 72 h viability assays. Shown here are representative assays for both strains treated with each mortiamide. ... 224
Figure d68 : Résumé graphique de l'article XI ... 232
Figure d69 : Natural head-to-tail peptides (orbitides) isolated from the Jatropha genus that exhibit antimalarial activity against P. falciparum. ... 234
Figure d70 : Structural features of dominicin (d6) ... 235
Figure d71 : Solid-phase/solution phase synthesis of dominicin (d6). Dashed line indicates cyclization site and numbers relate to the cyclic monomer: cyclic dimer ratio. ... 236
Figure d72 : Entirely on-resin synthesis of dominicin (d6). Dashed line indicates cyclization site and numbers relate to the cyclic monomer: cyclic dimer ratio... 238
Figure d73 : in vitro 72h viability assays of P. falciparum 3D7 and Dd2 strains with dominicin d6. ... 239
Figure d74 : Résumé graphique de l'article XII ... 247
Figure d75 : Natural head-to-tail macrocyclic peptides previously prepared using the oxime resin ... 250
Figure d76 : Oxime resin preparation for SPPS ... 250
Figure d77 : General Ouroboros synthetic procedure towards macrocyclic peptides d7-d18 ... 251
Figure d78 : Natural macrocyclic peptides prepared by Ouroboros head-to-tail cyclization on oxime resin. Blue dashed lines represent connections between N- and the C-terminals of linear precursors, with number 1 in red representing the first coupled amino acid on the resin. Numbers in blue a) represent the monomer : dimer : trimer ratios, b) the macrocyclization yields and c) the overall yields, from top to bottom respectively. d) Numbers at the center of the macrocycles represent the ring size. ... 253
Figure d79 : 54-membered ring cyclic dimers isolated from the cyclization of cycloleonuripeptides d16a and d17a ... 255
Figure d80 : Cyclisation de type tête-queue et tête-chaîne latérale sur résine oxime ... 264
Figure d81 : Rétrosynthèse de l’aspergillicine D ... 267
Liste des schémas
Schéma i1 : Synthèse de l’hexapeptide cyclique MK-678 avec la résine de Kenner... 10
Schéma i2 : Synthèse totale du depsipeptide cyclique kahalalide A ... 10
Schéma i3 : Synthèse de tripeptides peptidomimétiques par Deslongchamps ... 11
Schéma i4 : Méthodologie de Dawson pour la synthèse de peptides thioesters... 12
Schéma i5 : Synthèse de tétra- et pentapeptides cycliques sur résine Fmoc-MeNbz ... 12
Schéma i6 : Macrothiolactonisation sur support solide développée par Albericio ... 14
Schéma i7 : Régénération de la résine oxime après l’étape de cyclisation/clivage ... 16
Schéma i8 : Premier exemple de synthèse peptidique sur résine oxime : Synthèse de peptides hydrazines .. 21
Schéma i9 : Clivage de la résine oxime avec des d’acides aminés protégés par un ester au C-terminal ... 22
Schéma i10 : Préparation de peptides amides C-terminaux par clivage nucléophile de la résine oxime ... 23
Schéma i11 : Clivage à la n-propylamine de peptides renfermant un macrocycle diaza ... 24
Schéma i12 : Synthèse de glycopeptides C-terminaux par le clivage d'une serine protégée a-glucose benzyl ester ... 25
Schéma i13 : Préparation d'esters de peptides C-terminaux ... 25
Schéma i14 : Synthèse de sulfahydantoïnes sur résine oxime ... 27
Schéma i15 : Synthèse sur résine oxime de dipeptides cycliques par Lipton et Bobko... 28
Schéma i16 : Cyclisations possibles en présence de deux amines primaires ... 29
Schéma i17 : Cyclisation de tétrapeptides selon la séquence du précurseur linéaire ... 30
Schéma i18 : Cyclisation prématurée en présence d'une arginine à la position C-terminale ... 30
Schéma i19 : Synthèse du tétrapeptide naturel cyclo(L-Phe-L-Leu-L-Phe-L-Leu) sur résine oxime ... 31
Schéma i20 : Hexapeptides cycliques préparés par Barkley ... 31
Schéma i21 : Synthèse d'un dérivé de la gramicidine S ... 33
Schéma i22 : Synthèse de l'hexafluorovaline gramicidine S par Nishino... 34
Schéma i23 : Synthèse de la tyrocidine A ... 34
Schéma i24 : Synthèse d'heptapeptides cycliques cationiques dérivés de la polymixine B sur résine oxime... 36
Schéma i25 : Synthèse de peptide cyclique renfermant un groupement l'acide aminosubérique ... 37
Schéma i26 : Synthèse d'oligomères cycliques de sucres aminés ... 39
Schéma 27 : Synthèse d'hydrides de peptides cycliques renfermant des amino-sucres ... 40
Schéma i28 : Synthèse de peptides cycliques d'hétérocycles azotés ... 41
Schéma i29 : Synthèse du peptide cyclique naturel N-4090 ... 42
Schéma i30 : Méthode initial d’époxydation asymétrique de cétones insaturées développée par Julià et Colonna ... 45
Schéma i31 : Seul exemple démontrant l’utilisation d’un dipeptide cyclique dans l’époxydation asymétrique de cétones insaturées ... 46
Scheme 32 : General procedure for the synthesis of non-commercial a,b-unsaturated ketones via Claisen-Schmidt conditions ... 128
Scheme a33 : General procedure for the polymerisation of N-Carboxyanhydrides ... 131
Liste des tableaux
Tableau i1 : Comparaison en la stratégie Boc et Fmoc sur support solide ... 6
Tableau i2 : Tableau comparatif de cyclisation en solution vs par cyclisation/clivage selon différentes résines43 Table a3 : Optimization of catalyst loading and solventsa ... 55
Table a4 : Optimization of the basea ... 56
Table a5 : Catalyst rigidity and chirality effects in the epoxidation of a1aa ... 58
Tableau a6 : Substrates scope in the epoxidation process catalyzed by a3aa ... 58
Table a7 : Catalytic efficiency of cis-(L,L) CDP in the triphasic epoxidation of trans-chalcone a1... 73
Table a8 : Catalytic efficiency of cis-(D,D) CDP in the triphasic epoxidation of trans-chalcone a1 ... 75
Table a9 : Catalytic efficiency of trans-(D,L) CDP in the triphasic epoxidation of trans-chalcone a1... 76
Table a10 : Novel synthesized crown-CDPs ... 104
Table a11 : Optimization of epoxidation conditionsa ... 105
Table a12 : Evaluation of crown-CDPs synthesized in the optimized asymmetric reaction conditionsa ... 107
Table a13 : Reaction scope in the epoxidation processa catalyzed by a60 ... 108
Table a14 : Optimisation of reaction conditionsa ... 122
Tableau a15 : Substrate scope in the epoxidation process catalyzed by PLLa ... 124
Table b16 : 2,5-diketopiperazines (DKPs) and N,N’-dimethyl-1,4-piperazines (DMPs) ... 140
Table b17 : Metal picrate extraction (%) results for b1 and N,N’-dimethyl-1,4-piperazines b20a-b31 ... 143
Table b18 : Diethylzinc addition to aryl aldehydes in the presence of N,N’-dimethyl-1,4-piperazine ligandsa . 145 Tableau b19 : Chemical shifts comparison between isolated and synthetic c1 and c2 ... 190
Liste des abréviations
Ac acétyle
Acm acétamidométhyle
Alloc allyloxycarbonyle
ATR Attenuated Total Reflectance (réflectance totale atténuée) Boc tert-butyloxycarbonyle
Bom benzyloxyméthyle acétate
BOP 1H-benzotriazol-1-yloxytris(diméthylamino)phosphonium hexafluorophosphate
Bn benzyle
Bts 2-sulfonyle-benzothiazole
Bzl benzyle
Cbz carboxybenzyle
cond. conditions
CSI isocyanate de chlorosulfonyle
Cys cystéine
DBU 1,8-diazabicyclo[5.4.0]undéc-7-ène
Dbz acide 3,4-diaminobenzoïque
DCC N,N-dicyclohexylcarbodiimide
DCM dichlorométhane
DEAD azodicarboxylate de diéthyle
DIAD azodicarboxylate d’isopropyle
DIBAL hydrure de diisobutylaluminium
DIEA N,N-diisopropyléthylamine DIPEA N,N-diisopropyléthylamine DMAP 4-diméthylaminopyridine DME 1,2-diméthoxyéthane DMF diméthylformamide DMSO diméthylsulfoxide Dnp dinitrophényle DTNP 2,2′-Dithiobis(5-nitropyridine)
EDC hydrochlorure de N-éthyl-N’-(3-diméthylaminopropyl)carbodiimide
ee excès énantiomérique
equiv. Équivalent
ESI electronic supplementary information
ESI electrospray ionisation (ionisation par électronébuliseur)
FDA food and drug administration
FID flame ionization detector (détecteur à ionisation de flamme)
Fmoc fluorénylméthoxycarbonyle
FTIR Fourier Transform Infrared spectroscopy (spectroscopie infrarouge à transformée de Fourier) GC-MS chromatographie gazeuse couplée à un spectromètre de masse
HBTU hexafluorophosphate de 2-(1H-benzotriazol-1-yl)-1,1,3,3-tétraméthylaminium
HCTU hexafluorophosphate de 2-(6-chloro-1-H-benzotriazole-1-yl)-1,1,3,3-tétraméthylaminium
Hph homophénylalanine
6-Cl-HOBt 6-chloro-1-hydroxybenzotriazole
HOBt hydroxybenzotriazole
HOAt 1-hydroxy-7-azabenzotriazole
HPLC chromatographie liquide à haute performance (high-performance liquid chromatography) HRMS-ESI high resolution mass spectrometry with electrospray ionization
(spectrométrie de masse haute résolution avec ionisation par électronébuliseur) IC50 half maximal inhibitory concentration (concentration inhibitrice médiane)
iPr isopropyle
IR infrarouge
LC-MS chromatographie liquide couplée à un spectromètre de masse
L ligand
MALDI Matrix assisted laser desorption ionisation (désorption-ionisation laser assistée par matrice) m-CPBA acide métachloroperbenzoïque
Me méthyle
mp melthing point
MS molecular sieves (tamis moléculaire)
Mts mésyle
NMP N-méthylpyrrole
NMR nuclear magnetic resonance (Résonnance magnétique nucléaire)
Nu nucléophile
P polystyrène
Ph phényle
Pmb p-méthoxybenzyle ppm partie par million
pyr pyridine
RMN résonnance magnétique nucléaire
RP-HPLC reverse-phase high performance liquid chromatography (chromatographie liquide haute performance en phase inverse) t-Bu tert-butyle
TBHP tert-butylhydroperoxide TFA acide trifluoroacétique
THF tétrahydrofurane
TIS triisopropylsilane
TMEDA tétraméthyléthylènediamine TMOF orthoformiate de triméthyle
TMS tétraméthylsilane
TMSFA acide trifluorométhanesulfonique TOF time of flight (temps de vol)
Tos tosyle
Trt trityle
t.p. température pièce
TPP pyrophosphate de thiamine
UHP urea hydroperoxide (hydroperoxide d’urée)
À tous ceux qui ont fait partie de l’aventure,
Merci !
< Il faut toujours viser la lune, car même en
cas d’échec, on atterrit dans les étoiles. –
Oscar Wilde >
Remerciements
Cette thèse a occupé une place prédominante dans ma vie durant ces dernières années. Cette thèse représente donc la conclusion d’un grand projet qui englobe à la fois succès, échecs et sacrifices. Bien que j’ai planifié, replanifié et replanifié l’écriture de cette page, chacun d’entre vous aura fait parti de cette étape marquante de ma vie.
Je tiens d’abord à remercier le Pr. Éric Marsault d’avoir accepté d’évaluer ma thèse de doctorat comme évaluateur externe. Je tiens à remercier également les Prs. Denis Giguère et Jean-François Paquin pour avoir fait partie de mon comité d’évaluation de thèse de doctorat.
Une partie de ses travaux n’auraient pas été possible sans de précieux collaborateurs. Je dois un énorme merci à Xavier Barbeau et Patrick Lagüe pour les études de modélisation moléculaire, à Dominic Gagnon et Dave Richard pour les essaies biologiques antimalariaux et à Daniel Grenier pour les essaies biologiques antimicrobiens. Également, même si ces travaux ne font pas l’objet de cette thèse, je me dois de remercier le Pr. Denis Giguère et ses étudiants Thomas, Gabrielle, et Meggan, avec qui nous avons initié plusieurs collaborations durant les deux dernières années. Au plaisir de collaborer avec vous tous dans le futur.
Mon passage au laboratoire aura été marqué par plusieurs personnes, dont mes stagiaires, Corinne, Alexandre, et Catherine, avec qui j’ai eu la chance de travailler. Au cours des étés 2016 à 2019, vous avez été des étudiants très curieux, talentueux et surtout passionnés. Sans vous, je n’aurais pu accomplir tout ce travail sans votre acharnement et votre passion à l’avancement de la science.
Je tiens à remercier le Département de chimie pour leur confiance pour enseigner le cours Caractérisation des biomolécules. Ce fût un immense plaisir d’enseigner à des étudiants passionnés et enthousiastes envers ce domaine de la chimie. Cette expérience d’enseignement que j’ai eu la chance d’effectuer pendant trois ans m’a permis de me confirmer que c’est bien ce métier que je désire entreprendre dans le futur. En ce sens, je tiens à remercier la Pre Michèle Auger pour sa confiance et l’ensemble de son support. Sincèrement, merci pour tout Michèle, ce fût un honneur et un plaisir de travailler avec toi. Un merci spécial à Rodica Plesu pour toute sa générosité, son expertise et son précieux temps pour remettre en place une section expérimentale dans ce cours. Également, je tiens à remercier François Otis, Christian Côté, Pierre Audet et Pierre-Alexandre Paquet-Côté pour leur support pour la supervision de chacune des expériences.
Je tiens à remercier messieurs René Gendron et Ken Thibodeau, chargé d’enseignement pour les cours compensateurs, pour leur support tout au long de ces trois années comme auxiliaire d’enseignement.
Également, je tiens à remercier mon collègue Philippe Legros pour ces trois belles années à travailler ensemble. Je tiens également à remercier Marie Gonay, Audrey Gilbert et Maryline Marois pour leur excellent travail.
Je dois de chaleureux remerciements à celui qui a su prendre le temps de me former lorsque j’étais stagiaire et de me transmettre toute sa passion pour la chimie organique. J’ai immensément appris de ta passion, de ta volonté et de ta rigueur. Sébastien Cardinal, merci d’être aussi dévouer pour l’enseignement et aux partages de connaissance. Je te souhaite beaucoup de succès dans ta carrière professionnelle de chercheur académique.
Autant d’amitié se sont développées depuis le début de mon premier stage chez Normand. Je garderai de chaleureux souvenirs avec toi Alexandre, Catherine, Charles, Claudia, Corinne, David, Pier-Luc, Claudia, François, Jean-Christophe, Jean-Daniel, Jean-François, Laura-Lee, Nicolas, Meggan, Pierre-Alexandre, Pier-Luc, Rachelle, Romain, Rosalie, Sarah, Sébastien et Xavier. Je remercier particulièrement deux collègues, Claudia et Jean-François, dans le groupe de Pierre Deslonchamps, avec qui j’ai partagé cette aventure du début à la fin. Nous avons eu beaucoup de plaisir à initier des projets, partager des idées, à s’entraider et surtout, à s’amuser. Je tiens également à remercier mon cercle d’amis de sports pour toutes ces belles années, principalement Alex, Julien et Pier-Luc. Je tiens à remercier le groupe Giguère, Auger et Paquin pour le partage de connaissances et également l’atmosphère joyeux.
Je me dois de remercier mon collègue François Otis qui est là depuis mon premier jour de stage au laboratoire. François, merci pour tout ! Merci d’avoir été toujours présent et de m’avoir autant aidé pour des manipulations en laboratoire, la correction d’articles et également la relecture de cette thèse. Tu es une personne tellement aimable et un précieux ami et collègue. Bon succès dans ton nouveau poste, c’est bien mérité.
Et à toi, Normand Voyer.
Comment en être certain? Le choix d’une vie dans laquelle la majorité des jeunes ressentent l’insécurité, le doute, la peur. J’y étais, moi aussi, à la fois indécis envers ma carrière professionnelle mais, à ce moment, particulièrement attentif et captivé par une conférence dans laquelle je ne me suis jamais autant senti interpellé. Pour la première fois, j’étais convaincu. Convaincu de poursuivre des études universitaires en chimie. Ce matin-là, au Cégep de Rimouski, le conférencier invité, Normand Voyer, professeur titulaire au Département de chimie à l’Université Laval, nous présente : La chimie de l’amour. À partir de ce moment, tout a changé. J’assistais à une conférence à la fois interactive, enrichissante et motivante. Et bien oui, c’est la chimie de l’amour qui m’as donné l’amour de la chimie. Au tout début de mes études universitaires, je n’avais nul autre choix que de contacter le Pr Voyer afin de me tailler une place dans son laboratoire. Aujourd’hui, je suis finissant doctorant dans son laboratoire de recherche. Au cours de ces années, j’ai appris à connaitre un scientifique inspirant, un professeur dynamique, un vulgarisateur passionné, et un directeur de thèse engagé. Pour tous ceux à qui tu as
enseigné, supervisé, vulgarisé, merci de nous livrer ta rigueur scientifique, l’importance du partage des connaissances, ta passion pour la vulgarisation scientifique et sans oublier, l’amour de ce que l’on fait. Comme tu le dis si bien « Love my job ! » Également, au cours de ces années à te côtoyer, que ce soit au labo, en congrès ou bien à ton chalet, nombreuses discussions qu’elles soient scientifiques ou bien conviviales ont pris naissance. Je garderai d’excellents souvenirs à gratter et à chanter ensemble des classiques des années 80 et 90 au chalet en compagnie d’excellents cépages. En terminant, j’insiste sur le fait que ton dévouement à la vulgarisation et à la promotion des sciences auprès des jeunes ne cesse de les inspirer et d’attirer leur regard à la science. Merci Normand d’être ce modèle, ce chimiste engagé si inspirant à qui on doit de nombreuses carrières et source de motivation. Tu as été un mentor d’exception. Merci également pour ta liberté dans le labo et de m’avoir ouvert les yeux sur le monde avec ces nombreux congrès internationaux.
Sur le plan personnel, mes derniers vœux vont à ceux qui m’ont épaulé depuis toujours et lors de cette aventure. Je veux remercier l’ensemble de ma famille qui m’a toujours supporté, encouragé et motivé à poursuivre des études graduées. Et un merci spécial à Solange, ma grand-mère, pour ces nombreux petits plats déjà préparés.
J’aimerais dédier cette thèse à ma mère, Johanne et à mon père, Régis, en qui j’ai toujours reçu amour et support. Maman, papa, merci pour votre écoute, votre support inconditionnel au travers de ces longues années d’études et oui encore une fois, pour tous ces petits plats préparés. Maman, papa, vous êtes remplis de bienveillance, de générosité, d’amour, et sans vous, je n’aurai pas pu accomplir tout ce que j’ai fait jusqu’à maintenant. Vous avez toujours cru en moi et je vous en suis très reconnaissant. Vous êtes des personnes si inspirantes et je remercie la vie de vous avoir à mes côtés. Un grand merci à toi Rébecca, merci de m’avoir dirigé dans la bonne direction au bon moment.
À toi maman, à toi papa et à ma tante Guylaine et à mon grand-père Fernand, à vous quatre qui avez battu le cancer pendant mon doctorat ! Bien que ce fut difficile pour tout le monde, vous avez été une source d’inspiration unique rempli de courage et de détermination. « Les espèces qui survivent ne sont pas les espèces les plus fortes, ni les plus intelligentes, mais celles qui s’adaptent le mieux aux changements. » - Charles Darwin. Finalement, à celle en qui je pourrai toujours comptée, merci à toi Élise. Merci d’arrêter le temps à chaque petit et grand moment de la vie. La dernière année a sans aucun doute été la plus difficile de ma vie, et je te remercie de m’avoir fait plonger à chaque jour dans un avenir toujours plus lumineux. Je crois que la vie s’est occupé de croiser nos chemins pour une raison et certainement au bon moment. Je suis plus que chanceux de partager ma vie avec toi et d’entreprendre tous ces beaux projets ensemble. Je t’aime énormément Élise, de t’avoir à mes côtés fait de moi une meilleure personne à tous les jours.
Avant-propos et organisation de la thèse
La première section de cette thèse, l’introduction, présente les précédents rattachés aux projets de recherche pour l’ensemble des blocs décrits dans cette thèse. Cette thèse de doctorat est divisée en quatre principaux blocs (A-D) qui représentent chacun un axe de recherche correspondant aux objectifs spécifiques définis. La présente thèse renferme 12 articles scientifiques, dont 10 publiés et deux soumis.
Chacun des blocs est constitué d’articles scientifiques qui ont été rédigés en anglais provenant de journaux avec comité de lecture. Afin de spécifier la contribution détaillée de chaque auteur, un avant-propos précédera chaque chapitre. Voici un aperçu des différents blocs :
Bloc A, contient quatre chapitres
Le Bloc A présente la préparation d’une variété de dipeptides cycliques en exploitant la résine oxime comme support solide. Par la suite, ces dipeptides ont été investigués dans une réaction d’époxydation asymétriques d’énones insaturées. Également, le dernier chapitre du Bloc A décrit les travaux réalisés pour l’époxydation asymétriques d’énones insaturées uniquement dans l’eau par le biais de polypeptides.
Bloc B, contient deux chapitres
Le Bloc B présente des nouvelles avancées pour la synthèse de pipérazines chirales substituées pour des applications en catalyse de même que pour la première synthèse d’un produit naturel, la chrysamide B. La méthodologie de synthèse implique la résine oxime pour la préparation des précurseurs dipeptides cycliques.
Bloc C, contient deux chapitres
Le Bloc C, renfermant deux chapitres, présente une nouvelle méthodologie de synthèse sur résine oxime. Une nouvelle stratégie de cyclisation de type tête-chaîne latérale est présentée, menant à la première synthèse des anabaenopeptines NZ825 et schizopeptine 791 en plus des peudacyclines A-E.
Bloc D, contient quatre chapitres
Ce dernier bloc, le Bloc D, présente la préparation de peptides homodétiques cycliques naturels de type tête-queue sur résine oxime ainsi que l’évaluation de leurs propriétés antimicrobiennes et antimalariales via des collaborations. Finalement, le chapitre 12 présentera la généralité de la résine oxime pour la préparation d’une variété de peptides macrocycliques naturels.
Introduction
Les peptides
Les peptides font partie des motifs naturels des plus importants puisqu’ils modulent de nombreux processus physiologiques et biochimiques. D’ailleurs, ils constituent une immense famille de molécules naturelles bioactives1,2. De plus, une multitude de ce type de composés et de leurs analogues sont utilisés actuellement
en clinique dans des applications d'une très grande variété3-7. Bien que les peptides linéaires possèdent de
hauts degrés de spécificité, les peptides sont généralement difficiles à manufacturer en raison de leur coût de production à large échelle ainsi que de leur possible dégradation au pH, à la chaleur, et à l’oxydation8.
Également, leur susceptibilité à la protéolyse, leurs extrémités chargées diminuant considérablement leur perméabilité membranaire et leur faible degré de sélectivité/activité en raison de leur degré de liberté trop élevé limitent l’utilisation de peptides linéaires comme agents thérapeutiques9. Toutefois, malgré ces limitations,
plusieurs polypeptides sont sur le marché pharmaceutique dont certains d’origine naturelle10, semi-synthétiques
ou bien ayant une forme cyclique. Puisque la chimie peptidique occupe de plus en plus de place sur le marché pharmaceutique, il est donc essentiel de développer de nouvelles méthodologies de synthèse ouvrant la voie à de nouveaux squelettes peptidiques.
Les peptides cycliques
Bien que les peptides linéaires occupent une place importante sur le marché pharmaceutique, l’incorporation de contraintes de conformations via la préparation de peptides cycliques a suscité beaucoup d’intérêt dans la communauté scientifique pour le développement de nouveaux agents pharmaceutiques depuis que le premier peptide cyclique naturel, la Gramicidine S a été découvert par Gause et Brazhnikova11. Même si les peptides
cycliques ne respectent pas les règles de Lipinski12 principalement en raison de leur haut poids moléculaire et
de leur polarité, plus de 40 peptides cycliques occupent le marché pharmaceutique présentement et environ un peptide cyclique fait son apparition sur le marché pharmaceutique par année13. Entre 2006 et 2015, la FDA a
approuvé neuf peptides cycliques, ce qui équivaut à 3% des médicaments approuvés pendant cette période13.
Les peptides cycliques, beaucoup plus stables envers les peptidases (endopeptidases et exopeptidases), possèdent un nombre de degrés de liberté de conformation beaucoup plus faible. Au niveau de la cible biologique, ils permettent donc d’augmenter la stabilité métabolique, la biodisponibilité, la spécificité, ce qui est prometteur pour le développement de nouveaux agents thérapeutiques14-26 administrés oralement. On retrouve
les peptides cycliques sur le marché pharmaceutique principalement dans deux grandes catégories, soit comme médicaments qui ciblent les hormones peptidiques ou bien comme antibiotiques. Comme l’illustre la figure i1, l’oxytocine, l’octréotide et la vasopressine sont employés comme hormones tandis que la daptomycine, la gramidicin S et la polymixine B sont utilisés comme agents antimicrobiens13. Bien que les peptides cycliques
soient très prometteurs, certains défis demeurent toujours présents pour le développement de peptides cycliques comme agents thérapeutiques. La biodisponibilité orale ainsi que la pénétration cellulaire doivent être mieux étudiées afin d’augmenter la biodisponibilité des peptides cycliques.
Figure i1 : Exemples de peptides cycliques sur le marché pharmaceutique
Classification des peptides cycliques
Avant de poursuivre avec les méthodologies de synthèse des peptides cycliques, il est d’abord important de connaître leur classification, illustrée à la figure i2. Premièrement, le motif tête-queue est le motif le plus couramment observé dans les produits naturels15. Celui-ci s’obtient via une lactamisation entre les deux
extrémités d’un peptide, c’est-à-dire entre le C- et le N-terminal. Les peptides tête-chaîne latérale ou queue- chaîne latérale peuvent quant à eux être obtenus par cyclisation entre la chaîne latérale d’un acide aminé et soit
HN H N NH NH NH N H HN HN H N NH NH NH N H HN H N O O O O O O O H2N NH2 H2N HO Polymixine B antibiotique O N H NH2 H N N H O O OH NH2 O H N O O O O O O O H2N N H H N O OH H2N O O N H O H N O N H O OH O S N H2N Bacitracine antibiotique S S NH HN H N NH NH O N H O O O O O N H HO HO OH NH O NH2 H2N Octréotide
Inhibiteur d'hormone de croissance O HO O NH N O S S HN H N HN HN N H O O O O O OH HN HO NH HO H2N Oxytocine
Neuropeptide (contraction musculaire) H N NH N NH NH N H HN N HN HN O O O O O O O O O O H2N NH2 Gramicidine S antibiotique N O S S O N H O HN O HN O H N O NH O NH2 O NH2 OH NH2 O HN N H2N NH2 O H N O H2N Vasopressine Homone anti-diurétique
l’extrémité C- ou N- terminale respectivement, où le C-terminal représente la tête du peptide. Ces motifs laissent donc le groupement amine ou bien acide en position exocyclique permettant une fonctionnalisation post-cyclisation. Finalement, la cyclisation entre deux chaines latérales mène au motif chaîne latérale-chaîne latérale, ce qui laisse à la fois le N- et le C-terminal positionnés de façon exocyclique. Dépendamment du type de cyclisation effectuée entre la position nucléophile et électrophile, ces méthodologies donnent accès à deux grandes classes de peptides cycliques, soit homodétique et hétérodétique, représentés à la figure i317,27. Les
peptides homodétiques renferment uniquement des liaisons amides tandis que les peptides hétérodétiques se différencient par au moins une liaison non-peptidique. Au fil des ans, les progrès en synthèse peptidique ont permis d’incorporer une diversité moléculaire variée afin d’offrir à la communauté scientifique des nouveaux squelettes de peptides cycliques. À cet effet, les depsipeptides, qui se caractérisent par au moins une liaison ester, sont retrouvés fréquemment dans la nature d’où l’importance de développer de nouvelles méthodologies de macrolactonisation.28 Ces peptides sont généralement préparés par une étape d’estérification sur résine
suivie d’une étape de lactamisation en solution27. Parallèlement, les depsipeptides cycliques peuvent être
obtenus par une réaction de type Mitsunobu29 ou bien Shiina30. Également, tirant profit de la réaction de
métathèse développée par Grubbs, Chauvin et Schrock, la fermeture de cycle par métathèse est l’une des réactions de macrocyclisation les plus utilisées31. De plus, de nouvelles méthodologies ont été développées afin
d’incorporer des hétérocycles azotés pour la préparation de dérivés synthétiques ou naturels32-34. De récents
progrès ont été effectués par Albericio et Chatterjee pour la synthèse de thiodepsipeptides35 et de dérivés
comprenant une thioamide cyclique36. Finalement, d’autres techniques permettent des liens non peptidiques de
type imine37, pont disulfure et thioéther27.
H2N
R1 R2
Tête-queue Tête-chaîne latérale
Queue-chaîne latérale
H2N
Chaîne latérale-chaîne latérale
N O H R1 R2 R1 R2 R2 O H2N R1 R1 O R1 O O OH O OH HO
Figure i3 : Différenciation entre des peptides cycliques homo- et hétérodétiques
Synthèse de peptides sur support solide
La chimie peptidique actuelle inclut un large éventail d’outils de synthèse permettant la préparation de petits peptides jusqu’à des protéines de masses moléculaires élevées. Initialement décrite par du Vigneaud en 195338,
la préparation de peptides en solution donne accès à une synthèse de peptides convergente, mais laborieuse, étant donné que chaque peptide individuel nécessite de nombreuses étapes de purification. C’est pourquoi la synthèse sur support solide, décrite pour la première fois par Merrifield en 196339, est une méthode
incontournable pour la fabrication de peptides en parallèle. Cet apport à la synthèse peptidique a énormément simplifié les étapes de purifications associées à ce type de chimie. De nombreuses méthodes sur support solide impliquant divers types de résines ont été par la suite développées40-42.
La synthèse peptidique sur support solide consiste en l’élongation d’un peptide du C- au N-terminal. Chacun des acides aminés est greffé un à la suite des autres par un lien amide grâce aux réactifs d’activation et de couplage peptidique en présence d’une base encombrée non-nucléophile. Toutefois, pour que cette stratégie soit possible, chaque acide aminé doit être protégé à la position N-terminale afin d’éviter la réaction d’amidation entre ceux-ci. Les deux principales stratégies employées incluent les groupements protecteurs tert-butoxycarbonyle (Boc) ou bien fluorénylméthoxycarbonyle (Fmoc) comme illustré à la figure i4. Comparativement à la stratégie Fmoc, le groupement protecteur Boc est généralement plus facile à déprotéger43. Également, le groupement Boc est instable en présence d’’acide trifluoroacétique (TFA), ce qui
mène à des temps de déprotection courts. Également, le TFA est facilement éliminable par trituration, évaporation, lyophilisation ou extraction. Toutefois, des acides comme l’acide fluorhydrique (HF) ou l’acide trifluorométhane sulfonique (TMSFA) sont nécessaires afin de cliver et de déprotéger complètement le peptide. Finalement, les acides aminés N-Boc sont stables à température ambiante, mais il est tout de même
X N H O Y X O O Y Homodétique Depsipeptide X Y Alcène X N R Y X Oxazole (X = O) Thiazole (X = S) Imidazole (X = N) N NN Y X Triazole N N N N Y X Tétrazole Hétérodétique X S O Thioester X S Y Thioéther X S S Y Pont disulfure X Y X N H S Thioamide Peptide cyclique X N Y Imine N N O Y X Oxadiazole Lien amide
recommandé de les conserver à 4 °C. Quant à la stratégie Fmoc, celle-ci est la plus couramment utilisée de nos jours. Le principal avantage est qu’elle permet, via des protections orthogonales Fmoc/tBu, le clivage et la
déprotection des chaînes latérales en une seule étape. Également, les conditions de déprotection douces en présence de pipéridine permettent une synthèse automatisée, c’est à dire sur un synthétiseur de peptides. Le tableau i1 résume les principaux avantages et inconvénients pour chacune des méthodologies.
Figure i4 : Groupements protecteurs Boc et Fmoc pour la synthèse sur support solide N H COOH R O O N H COOH R O O Boc Fmoc
Tableau i1 : Comparaison en la stratégie Boc et Fmoc sur support solide
Stratégie Boc Stratégie Fmoc
Support en polystyrène Support en polystyrène, polyamides
Protection orthogonale de la chaîne latérale en benzyle (Bn) (labile en condition neutre)
Protection orthogonale de la chaîne latérale en tert-butyle (tBu) (labile en milieu acide)
Déprotection du Boc en conditions acide fort (TFA) Déprotection du Fmoc en conditions basique douces (pipéridine)
Étape de neutralisation nécessaire Aucune étape de neutralisation
Multi-solvent Un seul solvant (DMF ou NMP)
Pré-activation de l’acide nécessaire Pré-activation de l’acide non nécessaire
Clivage/déprotection en présence de HF ou TMSFA Clivage/déprotection en présence de TFA
Synthèse en flux-continu impossible Synthèse en flux-continu possible
Moins d’acides aminés disponibles commercialement
Large éventail d’acides aminés disponibles commercialement
Économie d’atomes (Boc, 101 g/mol) Groupement Fmoc volumineux (223 g/mol)
Paramètres de cyclisation
Paramètres de cyclisation intrinsèques
La pré-organisation des précurseurs peptidiques linéaires est primordiale pour rassembler les deux extrémités terminales dans un environnement spatial rapproché.27 Par conséquent, la création de ponts hydrogènes
intramoléculaires entre les groupements amides, autrement appelées interactions trans-annulaires, est un facteur capital à considérer pour stabiliser le précurseur linéaire dans une conformation très rapprochée à celle cyclisée. D’ailleurs, le rendement obtenu au cours du processus de cyclisation est fonction de la capacité du précurseur linéaire d’adopter la conformation nécessaire pour favoriser le processus intramoléculaire en compétition avec les réactions secondaires possibles d’oligomérisation. D’abord, il est important de considérer que la taille du macrocycle est le facteur prédominant pour une cyclisation efficace27. Contrairement aux peptides
de petites tailles44, les peptides cycliques de plus larges tailles possédant des degrés de liberté plus élevés ont
tendance à cycliser plus facilement27, mais avec une probabilité d’oligomérisation indésirable quasiment aussi
importante que les peptides de petites tailles45,46. C’est d’ailleurs pourquoi la cyclisation de peptides de plus
courtes tailles est beaucoup plus difficile, notamment dans le cas de tripeptides47-50 et de tétrapeptides51-58. La
cyclisation d’un tripeptide aura lieu seulement si les trois liens amides adoptent une conformation cis. C’est pourquoi la cyclisation d’un précurseur tripeptidique mène généralement à l’hexapeptide correspondant via le processus de dimérisation46. Ainsi, plus le nombre d’acides aminés augmente pour un précurseur linéaire donné,
plus la conformation du lien amide trans devient possible48. Conséquemment, les pentapeptides cycliques59-61
sont beaucoup plus faciles à synthétiser que les tri- ou les tétrapeptides62 puisque le cycle peptidique à 15
membres leur confère une flexibilité supérieure primordial pour la cyclisation de peptides. Ce dernier se caractérise par la formation d’un lien intramoléculaire entre le carbonyle de l’amide du résidu i et le proton de l’amide i + 3 (conformation ‘U’)50. Également, quelques exemples démontrent que l’incorporation d’acides
aminés ayant une configuration D peuvent influencer le rendement de cyclisation par l’introduction de tournants-b27. La N-substitution des acides aminés de départ agit également comme modulateur de tournants-b51,63,64.
La séquence du précurseur linéaire est aussi un facteur intrinsèque très important à considérer. Ainsi, le site de cyclisation, c’est-à-dire au point d’ancrage de la résine, ne doit préférablement pas être constitué de substituants N-alkyles, a,a substitués ou bien comportant une ramification en position b comme une valine ou une isoleucine. L’ensemble de ces paramètres englobe les éléments intrinsèques à considérer au niveau du précurseur linéaire pour faciliter le processus de lactamisation intramoléculaire désirée27,65. En outre, la prise de
connaissance des éléments intrinsèques permettra un développement rationnel de chaque structure primaire pour chaque peptide donné afin de favoriser la réaction intramoléculaire.
Paramètres de cyclisation extrinsèques
En plus de l’organisation stratégique de la conformation et de la séquence du précurseur linéaire peptidique, l’ajout et la modulation d’éléments externes à la séquence primaire du peptide peuvent faciliter le processus de cyclisation. Afin de faciliter la cyclisation de peptides conformationnellement rigides, l’ajout de cations comme éléments externes aux conditions de cyclisation s’avère une alternative de choix.66-70 Initialement rapporté par
les travaux de Beck et Zhang, puis par les travaux subséquents menés par le groupe de Tian, il a été démontré que l’ajout de cations sodium et césium favorise la cyclisation de pentapeptides et d’heptapeptides, respectivement69.
Comme discuté précédemment, plusieurs paramètres intrinsèques ou extrinsèques peuvent mener à la réaction secondaire d’oligomérisation. Cependant, l'ancrage du peptide linéaire sur un support solide peut réduire le taux de diffusion, diminuant ainsi la probabilité de dimérisation et d'oligomérisation27. Bien que tout processus de
macrocyclisation est difficile, étant donné que des réactions secondaires non souhaitées d'oligomérisation et d'épimérisation peuvent se produire, l'ancrage du peptide linéaire sur un support solide peut réduire le taux de diffusion et la probabilité de dimérisation et de cyclodimérisation71. En d’autres mots, la vitesse de diffusion en
solution d’un peptide linéaire greffé sur résine est beaucoup plus petite qu’un peptide seul en solution, diminuant ainsi considérablement le risque d’oligomérisation. Pour une cyclisation en solution, on peut contrôler la concentration du peptide afin d’éloigner le plus possible les molécules les unes des autres pour favoriser le processus intramoléculaire défavorisé entropiquement.
Cyclisation de peptides en solution
La cyclisation de peptides en solution est la technique la plus utilisée dans la littérature. Cette stratégie doit être généralement effectuée dans un milieu réactionnel très dilué (10-3-10-4 M) afin d’éviter la polymérisation linéaire,
c’est-à-dire le processus d’oligomérisation. De plus, des conditions hautement diluées nécessite souvent des temps réactionnels plus long. Également, le peptide cyclique désiré doit être séparé des réactifs d’activation/couplage, du précurseur linéaire issue de l’étape de macrocyclisation incomplète ainsi que des oligomères obtenus. Toutetois, l’ajout de microquantité de peptide via une seringue automatisée72 ou bien la
macrocyclisation en flux continue73 permettent de diminuer cette réaction secondaire indésirable. Également, la
cyclisation en solution comporte certains avantages pour la formation de macrolactames ou de macrolactones. L’utilisation de réactifs d’activation très puissants transforme l’acide carboxylique en ester très activé afin de favoriser l’attaque intramoléculaire d’une amine ou d’un alcool. Bien qu’il existe un risque d’épimérisation au niveau de l’acide aminé à la position C-terminale, de nouvelles avancées dans le développement de nouveaux agents de couplage, comme le DEPBT43, limitent considérablement cette réaction secondaire indésirable.
Cyclisation par cyclisation/clivage
Malgré une variété de supports solides utilisés pour la synthèse peptidique, peu permettent d'obtenir des peptides cycliques par une étape concomitante de cyclisation/clivage. Comme pour les supports solides traditionnels permettant l’élongation d’un peptide, le point d’ancrage de la résine doit être stable dans des conditions de couplage peptidique et finalement devenir réactif lors de l’étape cruciale de macrocyclisation. Pour une utilité étendue, la méthode de fonctionnalisation idéale devrait employer un support solide commercial, utiliser des réactifs d’activation verts et doux, subir une réaction avec une variété de nucléophiles aux propriétés stériques et de nucléophilie variables, et procéder à température ambiante sans épimérisation des résidus au C-terminal. En outre, cette approche devrait permettre la cyclisation de peptides protégés et d’ouvrir également la voie à la diversification en solution des peptides déprotégés. Un des principaux avantages de cette technique est que si la cyclisation n’est pas quantitative, le précurseur linéaire reste piégé sur la résine, facilitant ainsi la purification post-cyclisation. Également, la cyclisation sur résine s’effectue dans des conditions beaucoup plus douces qu’en solution, c’est-à-dire généralement sans agents d’activation et de couplages, permettant ainsi
d’obtenir une plus grande pureté après l’étape de cyclisation. Finalement, comparativement aux méthodes de cyclisation en solution, il est démontré qu’en greffant une chaîne peptidique sur un support solide, les sites réactionnels ont moins tendance à réagir entre eux, créant un effet de pseudodilution71,74 tandis qu’en solution,
les molécules indépendantes peuvent diffuser plus librement, augmentant ainsi le risque d’oligomérisation. La figure i5 illustre des résines permettant une étape de cyclisation/clivage développé jusqu’à maintenant.
Figure i5 : Supports solides permettant une étape de cyclisation/clivage
La résine ‘safety-catch’ de type arylsufonamide de Kenner
La résine ‘safety-catch’ de type arylsulfonamide de Kenner est une des résines les plus utilisées pour la macrocyclisation de peptides via une réaction de type cyclisation/clivage. Le lien arylsulfonamide est stable dans des conditions acides, basiques et nucléophiles. Afin de permettre une étape de cyclisation/clivage, une étape d’alkylation de la résine est nécessaire afin d’activer la résine. Yang et Moriello chez Merck ont été les premiers à démontrer l’efficacité de la résine de Kenner (Schéma i1)75. Une fois que le peptide linéaire a été assemblé
sur la résine de Kenner en stratégie Fmoc, le groupement trityle est incorporé en position N-terminale puisque le groupement Fmoc est instable face à la cyanométhylation. Ensuite, le lien sulfonamide est activé en N-cyanométhylsulfonamide, un groupement davantage électrophile en présence d’iodure d’acétonitrile. Finalement, après déprotection du groupement trityle en milieu acide, l’étape de cyclisation/clivage en présence de diisopropylethylamine (DIEA) mène à l’hexapeptide i1 désiré avec 52% de rendements et 79% de pureté. Bien que ce support solide tire avantage de la stratégie Fmoc, celle-ci comporte deux principaux désavantages, soit les étapes de cyanométhylation et d’incorporation du groupement trityle qui à la fois, allongent la synthèse et empêchent la réutilisation de la résine.
P N NO2 OH N HO
Résine oxime (Kaiser)
N H O H N O H2N FmocHN
Résine HMBA-Chem Matrix (Fmoc-Dbz)
S H2N
O O
Résines de type sulfonamide 'safety catch' N H O S H2N O O N H O H N O HN FmocHN
Résine HMBA-Chem Matrix (Fmoc-MeDbz) N H O TrS Résine mercaptopropionamide
Schéma i1 : Synthèse de l’hexapeptide cyclique MK-678 avec la résine de Kenner
Également, le groupe de Ganesan a employé la résine ‘safety-catch’ de type arylsufonamide de Kenner afin d’effectuer la synthèse totale de la kahalalide A (i2) via une cyclisation, cette fois-ci par la chaîne latérale comme l’illustre le schéma i276.
Schéma i2 : Synthèse totale du depsipeptide cyclique kahalalide A
La résine mercaptopropionamide
Le groupe de Deslongchamps s’est intéressé à la synthèse d’une nouvelle classe de macrocycles peptidimimétiques31. Structurellement, le macrocycle cible est un tripeptide cyclique obtenu par une étape de
cyclisation/clivage de type chaîne latérale-chaîne latérale, relié par un lien ‘tether’, catalysée en présence d’argent à titre d’acide de Lewis pour activer le point d’ancrage de la résine mercaptopropionamide. La méthodologie développée par Deslongchamps s’avère efficace pour un large spectre de chaîne latérales d’acides aminés (L), (D), a-, b-, g-, N-méthylés et a,a-bi-substitués. Également, la méthodologie englobe une
AAn AA6 FmocHN NH S HN O O AA1 N H O S H2N O O n = 5 AAn AA6 TrtHN NH O S N O O AA1 n = 5 Résines de type sulfonamide 'safety catch'
(Stratégie Fmoc) 1. 20% piperidine/DMF 2. TrCl, DIEA, DCM 3. ICH2CN, DIEA, NMP 1. 3% TFA/5% TIS DCM 2. DIEA, THF 3. 95% TFA N H NH NH N HN HN O O O O O NH MK-678 (i1) O HO NH2 NH O S HN O O Activation par cyanométhylation N N Support solide irrécupérable O O N H O O H N N H O O O tBuO NH O NH OtBu O NHFmoc H N O NH O S O O HN O NH NH NH HN O H N O O O O O H N O N H O O OtBu OtBu 1. 20% pipéridine/DMF 2. TrCl, DIPEA 3. ICH2CN, DIPEA TFA, TIS, H2O NH NH NH HN O H N O O O O O H N O N H O O OH OH Kahalalide A (i2)