Pour l'obtention du grade de
DOCTEUR DE L'UNIVERSITÉ DE POITIERS École nationale supérieure d'ingénieurs (Poitiers) Institut de chimie des milieux et matériaux de Poitiers - IC2MP
(Diplôme National - Arrêté du 7 août 2006)
École doctorale : Sciences pour l'environnement - Gay Lussac (La Rochelle) Secteur de recherche : Chimie et microbiologie de l'eau
Présentée par : Pamela Abdallah
Chloration de produits de soins corporels dans l'eau en présence d'ions bromure et d'azote ammoniacal
Directeur(s) de Thèse :
Nathalie Karpel vel Leitner, Marie Deborde Soutenue le 09 décembre 2014 devant le jury
Jury :
Président Naim Ouaïni Professeur, Université St Esprit de Kaslik, Jounieh, Liban Rapporteur Naim Ouaïni Professeur, Université St Esprit de Kaslik, Jounieh, Liban Rapporteur Stéphan Brosillon Professeur, Polytech, Université de Montpellier
Membre Nathalie Karpel vel Leitner Directrice de recherche CNRS, IC2MP, Université de Poitiers Membre Marie Deborde Maître de conférences, IC2MP, Université de Poitiers
Membre Justine Criquet Maître de conférences, Université de Lille
Membre Isabelle Baudin Ingénieure R&D, CIRSEE, SUEZ Environnement, Le Pecq
Pour citer cette thèse :
Pamela Abdallah. Chloration de produits de soins corporels dans l'eau en présence d'ions bromure et d'azote
ammoniacal [En ligne]. Thèse Chimie et microbiologie de l'eau. Poitiers : Université de Poitiers, 2014. Disponible
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITE DE POITIERS (ECOLE SUPERIEURE d’INGENIEURS de POITIERS)
(Diplôme National - Arrêté du 7 août 2006)
Ecole Doctorale : Sciences pour l’Environnement Gay Lussac Secteur de Recherche : CHIMIE ET MICROBIOLOGIE DE L’EAU
Présentée par :
Pamela ABDALLAH
Maitre ès Sciences
************************
Chloration de produits de soins corporels
dans l’eau en présence
d’ions bromure et d’azote ammoniacal
************************ Soutenue le 9 Décembre 2014 devant la Commission d’Examen
************************
JURY
Rapporteurs : M. Stephan BROSILLON
M. Naim OUAINI
Examinateurs : Mme Isabelle BAUDIN
Mme Justine CRIQUET
Directeurs de Thèse : Mme Nathalie KARPEL VEL LEITNER Mme Marie DEBORDE
Ce travail de thèse a été réalisé au sein de l’équipe Eau Géochimie organique Santé (EGS) de l'Institut de Chimie des Milieux et Matériaux de Poitiers (IC2MP), UMR CNRS 7285, dans le cadre d’un financement de la région Poitou-Charentes.
J'adresse mes sincères sentiments de gratitude à mes directrices de thèse Madame Nathalie KARPEL VEL LEITNER, Directrice de l’équipe EGS et Directeur de Recherche au CNRS, et Madame Marie DEBORDE, Maître de Conférences à l'IC2MP, qui m’ont accompagnée pendant mes travaux au sein du laboratoire. Je les remercie pour tous les conseils, leur encouragement et les compétences scientifiques qu’elles m’ont fait parvenir.
J’adresse tous mes remerciements à Monsieur Stephan BROSILLON, Professeur à l’Université de Montpellier 2, pour avoir bien voulu juger ce travail de thèse et accepté d'en être rapporteur.
Je souhaite remercier Monsieur Naim OUAINI, Professeur à l'Université Saint-Esprit de Kaslik, Liban (USEK) et ancien Doyen de la faculté des sciences et génie informatique (USEK), d’avoir accepté de juger ce travail de thèse en tant que rapporteur.
Je remercie également Madame Isabelle BAUDIN, Docteur-Ingénieur, pôle procédés Eau et application, chez SUEZ Environnement, et Madame Justine CRIQUET, Maître de conférences à l’Université de Lille I pour avoir accepté d'examiner ce travail.
Je tiens à remercier Madame Florence BERNE, Maître de conférences à l’Ecole Nationale Supérieure d’Ingénieurs de Poitiers (ENSIP), pour sa collaboration et tous ses conseils au cours de ce travail.
Je remercie Monsieur Bernard LEGUBE, ancien directeur de l’ENSIP, et Monsieur Jean-Yves CHENNEBAULT, directeur de l’ENSIP, de m’avoir accueillie au sein de l’ENSIP en 2010 en tant que Master 2 jusqu'à présent en tant qu’Attaché Temporaire d’Enseignement et de Recherche (A.T.E.R.). Je remercie également l’ensemble de l’équipe Eau Génie Civil qui
Monsieur Joseph DE LAAT.
J’adresse toute ma reconnaissance à Madame Claude DAOU, Maître de conférences à l’Université Libanaise et précédemment à l’Université Saint-Esprit de Kaslik, pour m’avoir donné la chance de venir à Poitiers dans le cadre des collaborations entre l’ENSIP et l’USEK, pour sa confiance, sa gentillesse et tous ses conseils.
Je voudrais remercier l’ensemble des personnes du laboratoire. Merci aux personnels permanents, Hervé, Jérôme, Bertrand, Cristina, Dimitry, Audrey, Béatrice, Sylvie, Christophe, ainsi qu’aux doctorants et docteurs de l’équipe EGS avec qui j’ai passé de bons moments tout au long de mes années au laboratoire, Alice, Virginie, Marie, Elodie, Ghizlane, Arnaud, Leslie, Nasma, Odissa, Sahidou, Diab, Joëlle, Aude, Gaëlle, Mélissa, Turki, Julien, Emilie, Patrick… Je remercie particulièrement Ayane pour son aide au cours des manipulations que nous avons pu faire ensemble.
Finalement, je remercie ma famille et mes amis pour leur encouragement tout au long de ce travail de thèse. Je remercie particulièrement mes parents, mon frère Anthony et ma sœur Pascale pour m’avoir toujours soutenue au cours de mes années d’étude. Je souhaite surtout remercier Majed MOUBARAK pour son encouragement et son soutien continu. Je remercie également mes amis à Poitiers ainsi qu’à Beyrouth, pour leur présence pendant toutes ces années : Aline, Muriel, Patricia, Raëd, Rania, Grace…
TABLE DES MATIERES………..ii
INTRODUCTION GENERALE………..….1
CHAPITRE I : SYNTHESE BIBLIOGRAPHIQUE I- Les produits de soins corporels ... 4
I.1- Les filtres UV ... 5
I.1.1- Utilisation et origine des filtres UV ... 5
I.1.2- Présence des filtres UV dans l’environnement ... 8
I.2- Les conservateurs : les parabènes... 11
I.2.1- Utilisation et origine des parabènes ... 11
I.2.2- Présence des parabènes dans l’environnement ... 14
II- Traitement, stabilité et toxicité des produits de soins corporels ... 15
II.1- Présence et devenir dans les STEP et les usines de traitement d’eau potable .. 15
II.1.1- Devenir au sein des STEP ... 15
II.1.2- Présence et devenir dans les usines de traitement d’eau potable ... 16
II.2- Evolution dans l’environnement ... 17
II.3- Toxicité et risques potentiels dus à la présence de produits de soins corporels dans les eaux ... 18
II.3.1- Toxicité des filtres UV ... 18
II.3.2- Toxicité des parabènes ... 20
III- Réactivité du chlore en solution aqueuse ... 24
III.1- Chimie du chlore en solution... 24
III.2- Réactivité du chlore sur les composés organiques ... 25
III.2.1- Mécanismes et réactivité sur différentes classes de molécules organiques aliphatiques . 26 III.2.2- Chloration des composés aromatiques et des PSC ... 28
a- Chloration des filtres UV ... 30
b- Chloration des parabènes ... 33
III.3- Action du chlore sur les composés inorganiques ... 35
III.3.1- Réaction du chlore avec l’azote ammoniacal ... 35
a- Chimie des chloramines ... 35
b- Réactivité du brome avec les composés inorganiques : étude des bromamines ... 41
c- Réactivité du brome avec les composés organiques ... 43
III.4- Les chloroisocyanurates dans le traitement des eaux de piscine ... 46
III.4.1- Chimie des chloroisocyanurates en solution aqueuse ... 48
III.4.2- Réactivité des chloroisocyanurates et mode d’action ... 50
Réactivité des chlorocyanurates avec les molécules organiques ... 51
CHAPITRE II :MATERIEL ET METHODES I- Réactifs et solutions ... 53
I.1- Solutions de 3-benzophénone et de methylparabène ... 53
I.2- Solutions des compétiteurs : phénol et 17α-ethinylestradiol (EE2) ... 54
I.3- Solution de chlore ... 54
I.4- Solution de brome ... 55
I.5- Solution de monochloramine ... 55
I.6- Solution de monobromamine ... 55
I.7- Solutions de NaDCC et de ATCC... 56
II- Protocoles expérimentaux ... 56
II.1- Etude cinétique... 56
II.1.1- Etude cinétique par dégénérescence d’ordre ... 56
II.1.2- Méthode par cinétique compétitive ... 57
II.2- Etude de l’influence de la concentration en ions bromure et en azote ammoniacal au cours de la chloration ... 58
II.3- Identification des sous-produits et suivi de la toxicité au cours de l’oxydation ... 59
III- Méthodes analytiques ... 60
III.1- Dosage du chlore ... 60
III.1.1- Dosage par iodométrie ... 60
III.1.2- Dosage par la méthode spectrophotométrique à la DPD ... 61
III.4- Dosage de BP3, MP et des compétiteurs ... 62
III.5- Identification des sous-produits d’oxydation ... 63
IV- Etude et suivi de la toxicité ... 66
V- Modélisation de la dégradation de BP3 et MP ... 66
CHAPITRE III :IDENTIFICATION DES SOUS-PRODUITS ET SUIVI DE LA TOXICITE I- Identification des sous-produits d’oxydation de BP3 et MP ... 69
II- Evolution des sous-produits et mécanisme réactionnel ... 74
III- Evolution de la toxicité au cours de l’oxydation de BP3 et MP... 77
IV- Conclusion partielle ... 81
CHAPITRE IV: ETUDE CINETIQUE I- Etude cinétique d’oxydation de la 3-benzophénone et du methylparabène à différents pH ... 83 I.1- Chloration ... 83 I.2- Bromation ... 86 I.3- Haloamination ... 88 I.3.1- Monochloramination ... 88 I.3.2- Monobromamination ... 89
II- Effet du pH sur la chloration et la bromation de BP3 et de MP. Détermination des constantes des réactions élémentaires ... 90
AMMONIACAL
I-Estimation de la dégradation de BP3 et du MP au cours de la chloration des eaux..100
I.1- Impact des ions bromure et de l’azote ammoniacal ... 100
I.2- Réactions mises en jeu ... 102
I.3- Calcul des constantes cinétiques ... 104
I.3.1- Réactions impliquant le chlore et le brome ... 104
I.3.2- Réactions impliquant les haloamines ... 107
I.4- Modélisation ... 108
I.4.1- Influence des ions bromure ... 108
I.4.2- Influence de l’azote ammoniacal ... 111
I.4.3- Influence de l’ajout de mélanges d’ions bromure et d’azote ammoniacal ... 113
II- Dégradation de BP3 et du MP par les chloroisocyanurates ... 118
II.1- Comparaison de la réactivité des chloroisocyanurates et du chlore libre avec BP3 et MP ... 119
II.2- Impact des ions bromure et de l’azote ammoniacal sur l’oxydation de BP3 et MP par les chloroisocyanurates ... 121
III- Conclusion partielle ... 124
DISCUSSION ET CONCLUSION GENERALE ... 126
REFERENCES BIBLIOGRAPHIQUES……….134
LISTE DES PRINCIPALES ABREVIATIONS ... 154
La présence des produits de soins corporels (PSC) dans l’environnement et en particulier l’environnement aquatique constitue depuis quelques années une préoccupation de plus en plus importante. Ces produits à usage quotidien constitués de parfums, conservateurs, filtres UV, antiseptiques etc…, rentrent dans la composition des cosmétiques, des shampoings, des crèmes solaires, gels, etc…. et sont aujourd’hui utilisés par une large part de la population mondiale.
Deux familles de composés retrouvés dans les produits de soins corporels sont considérés dans ce travail: les filtres UV et les conservateurs. Suite à la prise de conscience des dangers provoqués par les rayons solaires, notamment les nombreux effets délétères sur la peau (tels que les cancers, les taches brunes, le vieillissement de l’épiderme, la couperose, etc.….), les filtres UV sont de plus en plus utilisés et sont employés, non seulement dans les crèmes solaires, mais dans une large gamme de produits de soins. Quant aux conservateurs, ces composés à vertus antimicrobiennes et antifongiques sont retrouvés dans la majorité des produits finis sur le marché, assurant ainsi une meilleure conservation des produits de soins dans le temps. On distingue principalement la famille des parabènes. Bien que sujet de polémiques depuis plusieurs années au niveau santé publique, les parabènes restent les conservateurs les plus utilisés dans la majorité des produits de soins corporels.
Des centaines de tonnes de ces composés sont rejetés dans le cadre des activités humaines chaque année (Kasprzyk-Hordern et al., 2008). En plus des sols et sédiments, les produits de soins sont ainsi retrouvés dans les eaux d’usage, les eaux de baignade et les eaux naturelles, ce qui leur confère le caractère de contaminants émergents. En raison de leur application cutanée dans la plupart des cas, ils peuvent se retrouver dans les eaux de surface et les eaux de baignade d’une façon directe par le simple acte de baignade, ou par voie indirecte par l’intermédiaire des rejets des stations d’épuration des eaux usées (STEP). Récemment, diverses études ont évoqué les effets secondaires des PSC sur la santé humaine, et en particulier leur effet perturbateur endocrien.
Concernant l’Homme, en plus de l’exposition cutanée notamment dans les eaux de baignade (eaux naturelles ou eaux de piscine), l’eau potable produite à partir d’eaux polluées pourrait constituer une voie d’exposition à de tels polluants. En matière de Santé Publique, une évaluation du devenir de ces composés au cours de la filière de traitement des eaux et dans les eaux de piscine est donc essentielle, notamment pour les professionnels de l’eau.
Au cours du traitement des eaux de piscine et de la production de l’eau potable, des procédés de désinfection sont fréquemment utilisés notamment la chloration. En raison des sous-produits potentiels qu’ils peuvent générer, ces procédés ne sont pas communément utilisés pour des objectifs d’oxydation de certains composés organiques. Toutefois, lorsque ces polluants organiques sont présents dans les eaux à traiter, il est important de connaître leur réactivité. Concernant les produits de soins corporels organiques, très peu d’informations sont connues à ce sujet (Santos et al., 2012).
L’eau traitée peut contenir, en plus des micropolluants organiques, une large variété de composés inorganiques tels que les ions bromure et l’azote ammoniacal. Au cours de la chloration de l’eau, ces composés inorganiques peuvent réagir avec le chlore pour former divers oxydants tels que le brome et les haloamines (chloramines, bromamines) qui, à leur tour, peuvent réagir avec les molécules organiques présentes dans l’eau.
Dans ce contexte, l’objectif de ce travail a été d’étudier l’impact de la chloration en présence d’ions bromure et d’azote ammoniacal sur la dégradation de deux produits de soins choisis parmi les plus fréquemment utilisés et les plus retrouvés dans l’environnement aquatique, un filtre UV organique : la 3-benzophénone (BP3) et un conservateur: le methylparabène (MP).
Le chapitre I de cette thèse sera consacré à l’ensemble des données bibliographiques sur les produits de soins corporels dans l’environnement ainsi que sur la réactivité du chlore et ses dérivés. Le chapitre II détaillera les principales méthodes employées au cours de ce travail ainsi que le matériel utilisé. Ensuite, les résultats de ce travail seront présentés en trois chapitres.
Le chapitre III portera sur l’étude d’identification des sous-produits d’oxydation par CLHP-SM ainsi que l’évaluation de la toxicité lors de la chloration en présence et en absence des ions bromure et au cours de la bromation des molécules considérées (i.e. BP3 et MP).
Le chapitre IV présentera l’étude cinétique effectuée pour déterminer les constantes cinétiques d’action du chlore, du brome et des haloamines sur la 3-benzophénone et le methylparabène à différents pH.
A partir des résultats obtenus, la modélisation de l’élimination des composés étudiés dans les eaux, en présence de différentes concentrations d’ions bromure et d’azote ammoniacal, sera réalisée dans le chapitre V. Afin de compléter ce travail, l’impact des
chloroisocyanurates, dérivés chlorés employés dans le traitement des eaux de piscine, sur la dégradation de produits de soins corporels sera également évalué en présence et en absence des ions bromure et de l’azote ammoniacal. Ce dernier point a pour objectif une meilleure compréhension de la réactivité de tels oxydants dans les eaux de piscine vis-à-vis des polluants organiques.
L’ensemble des résultats sera ensuite discuté dans le dernier chapitre avec une présentation des conclusions et des perspectives de ce travail.
Chapitre I:
Synthèse bibliographique
I- Les produits de soins corporels ... 4
I.1- Les filtres UV ... 5
I.1.1- Utilisation et origine des filtres UV ... 5
I.1.2- Présence des filtres UV dans l’environnement ... 8
I.2- Les conservateurs : les parabènes... 11
I.2.1- Utilisation et origine des parabènes ... 11
I.2.2- Présence des parabènes dans l’environnement ... 14
II- Traitement, stabilité et toxicité des produits de soins corporels ... 15
II.1- Présence et devenir dans les STEP et les usines de traitement d’eau potable .. 15
II.1.1- Devenir au sein des STEP ... 15
II.1.2- Présence et devenir dans les usines de traitement d’eau potable ... 16
II.2- Evolution dans l’environnement ... 17
II.3- Toxicité et risques potentiels dus à la présence de produits de soins corporels dans les eaux ... 18
II.3.1- Toxicité des filtres UV ... 18
II.3.2- Toxicité des parabènes ... 20
III- Réactivité du chlore en solution aqueuse ... 24
III.1- Chimie du chlore en solution... 24
III.2- Réactivité du chlore sur les composés organiques ... 25
III.2.1- Mécanismes et réactivité sur différentes classes de molécules organiques aliphatiques ... 26
a- Composés oxygénés et composés aliphatiques à chaines insaturées ... 26
b- Composés contenant du soufre et de l’azote ... 26
III.2.2- Chloration des composés aromatiques et des PSC ... 28
a- Chloration des filtres UV ... 30
b- Chloration des parabènes ... 33
III.3- Action du chlore sur les composés inorganiques ... 35
III.3.1- Réaction du chlore avec l’azote ammoniacal ... 35
b- Réactivité des chloramines ... 38
III.3.2- Réaction du chlore avec les ions bromure ... 40
a- Formation du brome ... 40
b- Réactivité du brome avec les composés inorganiques : étude de la bromamine . 41 c- Réactivité du brome avec les composés organiques ... 43
III.4- Les chloroisocyanurates dans le traitement des eaux de piscine ... 46
III.4.1- Chimie des chloroisocyanurates en solution aqueuse ... 48
III.4.2- Réactivité des chloroisocyanurates et mode d’action ... 50
La pollution de l’environnement aquatique par les produits pharmaceutiques et les produits de soins corporels, et le devenir de ces composés apparaît parmi les thèmes de recherche les plus évoqués ces quinze dernières années (Rodil et al., 2012). Plusieurs auteurs se sont intéressés à la présence et au devenir des médicaments dans les environnements aquatiques ainsi que dans les filières de traitement de l’eau (Heberer, 2002; Houeto et al., 2012; Kümmerer, 2009, 2001; López-Serna et al., 2010; Mompelat et al., 2009; Petrović et Barceló, 2007; Stackelberg et al., 2004; ter Laak et al., 2010), mais récemment la problématique des produits de soins corporels (PSC) retrouvés dans l’environnement aquatique est devenue de plus en plus préoccupante.
Dans un premier temps les deux familles de produits de soins corporels choisies, les filtres UV et les conservateurs, seront détaillées, avant d’aborder les procédés de traitement étudiés dans ce travail.
I- Les produits de soins corporels
Les produits de soins corporels (ou PSC) regroupent aujourd’hui une grande variété de composés destinés à l’usage quotidien et sont retrouvés dans les parfums, les crèmes solaires, les produits de beauté, shampoings, gels etc.… (Brausch et Rand, 2011; Daughton et Ternes, 1999; Richardson, 2009). Ces composés, utilisés en grandes quantités et d’une manière régulière, se retrouvent dans l’environnement. Contrairement aux médicaments, les produits de soins corporels sont souvent des produits destinés à l’usage externe et ne subissent de phénomènes de modifications métaboliques qu’après passage à travers les barrières cutanées. Ainsi, des quantités importantes de ces composés sont détectées régulièrement dans l’environnement sans aucune métabolisation (Ternes et al., 2004). Dans la composition des produits de soins on distingue les parfums, les désinfectants, les conservateurs, les filtres UV etc…. Le fait que ces composés soient introduits en grandes quantités, d’une façon régulière et sans altération leur confère une persistance dans l’environnement. De plus, des études ont confirmé leur possibilité de bioaccumulation ainsi que leur activité biologique notamment leur effet perturbateur endocrinien (Mackay et Barnthouse, 2010; Peck, 2006). Par définition, d’après l’Organisme Mondial de la Santé (OMS), les perturbateurs endocriniens sont des substances chimiques d’origine naturelle ou artificielle, étrangères à l’organisme. Elles
agissent même à très faible dose et ne sont guère considérées comme toxique mais peuvent néanmoins perturber l’organisme de manière discrète, difficile à reconnaitre parfois.
Les produits de soins corporels ont récemment fait l’objet de nombreuses études portant sur leur rejet et leur devenir dans l’environnement et notamment l’environnement aquatique (Cabeza et al., 2012; Cuderman et Heath, 2007; Gago-Ferrero et al., 2013b; Jurado
et al., 2014; Postigo et Barceló, 2014; etc…). La pollution aquatique par les PSC touche non seulement les eaux de surface mais aussi les eaux souterraines (Cabeza et al., 2012; Jurado et
al., 2014; Postigo et Barceló, 2014).
Deux groupes de produits de soins corporels ont été considérés dans ce travail : les filtres UV et les conservateurs (principalement les parabènes). En général, ces deux composés sont retrouvés dans la majorité des produits de soins à usage quotidien tels que les crèmes et produits de beauté, les shampoings etc…
I.1- Les filtres UV
I.1.1- Utilisation et origine des filtres UV
Les filtres UV sont des composés chimiques destinés à la protection contre les rayonnements ultraviolets du soleil. On distingue les filtres UV minéraux et les filtres UV organiques nommés aussi filtres UV chimiques. Le mode d’action de ces composés dépend de leur nature : en effet, les filtres UV minéraux agissent en réfléchissant, diffusant ou en absorbant les rayons UV alors que les filtres UV organiques agissent en absorbant les rayons UV (principalement les UVB) (Balmer et al., 2004; Cuderman et Heath, 2007; Steinberg, 2000).
Le tableau I.1 regroupe la liste de quelques filtres UV accrédités actuellement dans le monde ainsi que leurs caractéristiques.
Tableau I.1 : Liste de quelques filtres UV accrédités dans le monde et leur
propriétés.(Giokas et al., 2007; Orsi et al., 2006; Rastogi, 2002; Rastogi et Jensen, 1998; Shaath, 2010; Silvia Díaz-Cruz et al., 2008)
Filtre UV Symbole Région
UV λmax (nm) ԑ (L.mol-1.cm-1) Solubilité (g/L) 3-Benzophénone 4-Benzophénone BP3 BP4 UVA/B UVA/B 290 286 14380 13400 0,2100 --
Butyl methoxydibenzoylmethane BMDM UVA 357 34140 0,0370
Ethylhexyl dimethyl PABA EHDPABA UVB 311 27300 0,0021
Ethylhexyl methoxycinnamate EHMC UVB 311 23300 0,1500
Ethylhexyl salicylate EHS UVB 305 4130 0,0280
Homosalate HS UVB 306 4300 0,0200
Octocrylene OC UVB 303 12290 0,0002
Acide p-aminobenzoïque PABA UVB 283 15300 915
Acide phenyl benzimidazole sulfonique PBSA UVB 302 26060 _
Dioxyde de titane TiO2 UVA/B _ _ _
Les filtres UV sont principalement employés dans les produits de soins corporels : crèmes solaires, teintures et gels pour cheveux, cosmétiques etc… mais peuvent aussi être retrouvés dans d’autres produits pour lesquels une certaine protection contre les rayons UV est recherchée ; ils sont ainsi ajoutés aux textiles, plastiques et lustrants des voitures (Giokas
et al., 2007). Jusqu'à présent, le composé le plus étudié a été la 3-benzophénone (BP3), qui en plus d’être le principal composant actif dans de nombreux produits cosmétiques, est employé dans les usines de pigments, les plastiques agricoles, les films et les peintures comme un absorbeur de rayons UV. D'autres utilisations de BP3 concernent notamment les médicaments pour les photodermatoses et les additifs dans les emballages alimentaires (Okereke et al., 1995). Dans le cadre de ce travail, on s’intéressera aux filtres UV dans les produits de soins corporels puisqu’ils représentent la source majoritaire de ces composés dans l’environnement.
Les filtres UV accrédités ainsi que les concentrations tolérées dans les produits commercialisés sont règlementés par diverses lois et autorités sanitaires comme la « Directive Cosmétique » de l’Union Européenne, la « Législation sur les cosmétiques » du Japon et la « Food and Drug Administration » aux Etats-Unis. Une liste des filtres UV autorisés ainsi que leurs concentrations maximales dans les produits commerciaux ont été établies par ces différentes autorités régulatrices. Actuellement, 55 filtres UV sont accrédités mondialement parmi lesquels seuls dix sont accrédités uniformément par l’ensemble des autorités
régulatrices dont deux sont des filtres UV inorganiques : TiO2 et ZnO (EEC Directive
83/574,1983 ; FDA Département of Health and Human services, 1999 ; Japanese Standard of Cosmetic Ingredients, 1985). Parmi les huit filtres UV organiques autorisés, il faut noter que l’acide p-aminobenzoique n’est pas utilisé actuellement suite à des effets secondaires observés (Mancel et al., 1999).
Dans les produits solaires, la concentration en filtres UV varie entre 0,5% à 10% mais peut parfois atteindre 25% (Brausch et Rand, 2011; Hauri et al., 2003). En effet, en raison de réactions dermatologiques décrites suite à l’utilisation de filtres UV organiques (Schmidt et
al., 1998), des normes ont été établies pour les crèmes solaires quant à la quantité de filtres UV autorisée et leur nature (Chisvert et al., 2001). Le tableau I.2 regroupe les 7 filtres UV organiques avec leurs concentrations maximales autorisées.
Tableau I.2: Les concentrations maximales autorisées de filtres UV dans les produits de
soins corporels (Chisvert et al., 2001)
Filtre UV
Concentrations autorisées (g/100 g)
UE Etats Unis Japon
4-Benzophénone 5 10 10
3-Benzophénone 10 6 5
Butylmethoxydibenzoylmethane (BMDM) 5 3 10
Octyldimethyl PABA (ODP) 8 8 10
Octylmethoxycinnemate (OMC ou EHMC) 10 7,5 10
Homosalate (HS) 10 15 10
Ethylhexyl salicylate (EHS) 5 5 10
Suite à la prise de conscience de la gravité des effets que peuvent engendrer les rayons solaires sur l’être humain, notamment le cancer de la peau, l’utilisation des filtres UV a augmenté remarquablement ces dernières années. En outre, il y a une tendance chez les consommateurs à utiliser des produits avec des facteurs de protection solaire (SPF) plus élevés (SPF > 20). Un SPF plus élevé signifie une concentration plus élevée de filtres UV, et généralement, l’association de deux ou plusieurs filtres UV est utilisée pour assurer une plus grande protection des rayons UVA et UVB (Balmer et al., 2004).
I.1.2- Présence des filtres UV dans l’environnement
La présence de traces de filtres UV dans l’environnement a récemment fait l’objet de plusieurs études. Grâce au progrès des méthodes d’analyses physico-chimiques, la présence des filtres UV a pu être mise en évidence dans l’environnement, même à l’état de traces. En effet, malgré l’utilisation actuelle des méthodes CL-UV et CL-SM pour la détermination d’un certain nombre de PSC notamment les filtres UV organiques dans les produits cosmétiques, ces méthodes n'offrent pas toujours la sensibilité requise pour l'analyse des résidus dans l'environnement. Toutefois, dans certaines études environnementales, les méthodes de chromatographie liquide (CL) ont été utilisées avec une sensibilité tout à fait acceptable (Gasparro, 1985; Giokas et al., 2005, 2004). Les techniques de chromatographie gazeuse (CG) sont préférables, car les limites de détection (LD), pour les plus faibles concentrations (ng/L), sont nettement meilleures. Toutefois, pour l'analyse des filtres UV non analysables par CG en raison de leur faible volatilité (par exemple, l’éthylhexyl triazone), la CL a été couplée à la détection UV ou SM avec ionisation électrospray positif (ESI+) (Plagellat et al., 2006). A partir de ces techniques, des traces de filtres UV organiques ont ainsi été détectées dans les eaux superficielles et souterraines, les sols et sédiments et les animaux, notamment les poissons (Balmer et al., 2005; Boyd et al., 2004, 2003; Gago-Ferrero et al., 2012; Hany et Nagel, 1995; Janjua et al., 2004; Nagtegaal et al., 1997; Pablo Gago-Ferrero, 2011; Poiger et
al., 2004; Schlumpf et al., 2010). Les filtres UV sont donc des contaminants émergents à considérer, surtout que les quantités retrouvées dans certaines eaux de surface ne sont pas très inférieures aux doses engendrant un effet toxique chez certains animaux (Richardson, 2009). Ceci doit ainsi conduire à plus de recherches et d’investigations sur ces produits et leurs voies d’entrée dans l’environnement (Cuderman et Heath, 2007).
Une des caractéristiques principales des filtres UV organiques est la présence pour certains d’une chaîne carbonée insaturée et/ou d’un ou plusieurs cycles aromatiques dans leur structure chimique. Dans la majorité des cas, ces cycles sont reliés à des groupements hydrophobes (Li et al., 2007) qui font que les filtres organiques sont des composés très lipophiles. Les données de la littérature montrent que, bien que de nature hydrophobe, ces composés peuvent passer dans l’environnement aquatique (Stokes et al., 1998; Stokes et Diffey, 1999) et se retrouver ainsi à l’état de micropolluants, principalement dans les eaux de surface, mais aussi dans les eaux souterraines (Rapport Aquaref, 2009).
Selon les études de Fent et al.( 2010), pour un même site de la rivière Glatt en Suisse et dans les mêmes conditions d’échantillonnage, les quatre filtres UV suivants ont été toujours détectés dans cet ordre de concentrations décroissantes :
[BP4] > [BP3] > [4MBC] > [EHMC]
En effet, la concentration des filtres UV retrouvés dans l’eau diminue avec l’augmentation de la lipophilicité du composé. Les benzophénones étant les molécules les plus hydrophiles sont ainsi retrouvées avec les concentrations les plus importantes dans les eaux de surface. Cette liposolubilité leur permet également de se bioaccumuler dans le biotope, notamment dans les poissons. Ainsi, Nagtegaal et al. (1997) ont identifié six filtres UV chez les poissons du lac de Maarfelder en Allemagne avec des concentrations pouvant attteindre 2 mg/kg de lipides.
Les principaux filtres organiques retrouvés dans diverses eaux (eaux naturelles et eaux de piscine) et qui ont fait l’objet d’études sont : 3-benzophénone (BP3), 4-benzophénone (BP4), 4-methylbenzylidène camphor (4MBC), 2-ethylhexyl-4-methoxycinnamate (EHMC ou OMC), homosalate (HMS), octocrylène (OC) et acide octyl-diméthyl-p-aminobenzoïque (OD-PABA ou EH-PABA). Des traces de ces composés ont pu être retrouvées dans les eaux naturelles telles que les eaux de rivières, les lacs et les mers (même dans des zones très éloignées dans l’océan pacifique où des filtres UV ont été détectés dans les couches superficielles). Des analyses d’échantillons d’eaux ont montré des concentrations en filtres UV de quelques ng/L dans des rivières et des lacs en Allemagne et en Suisse (Balmer et al., 2004; Cuderman et Heath, 2007; Goksøyr et al., 2009; Jeon et al., 2006; Langford et Thomas, 2008; Poiger et al., 2004; Rodil et al., 2008). D’autres études ont confirmé la présence des filtres UV dans les eaux de rivières en Corée (Jeon et al., 2006), et dans les eaux de mer (Giokas et al.,2005). A noter que, jusqu'à présent, la majorité des études sur la présence des filtres UV dans l’eau proviennent des Etats-Unis ou d’Europe avec très peu de données en provenance des pays d’Asie (Li et al., 2007). Une étude de Tsui et al. (2014) a cependant porté sur la présence de filtres UV dans les eaux de surface de plusieurs pays dont la Chine, le Japon et la Thailande indiquant une valeur moyenne des concentrations < 250 ng/L pour tous les filtres UV détectés.
Le tableau I.3 regroupe les différentes concentrations de trois filtres UV organiques : la 3–benzophénone (BP3), le 4-methylbenzylidène camphor (4MBC) et l’ethylhexylmethoxycinnamate (EHMC) retrouvées dans les différents types d’eaux d’après
les travaux de Balmer et al., 2004, Cuderman et Heath, 2007, Giokas et al., 2005, Lambropoulou et al., 2002 et Poiger et al., 2004.
Tableau I.3 : Concentrations de trois filtres UV (BP3, 4MBC et EHMC) retrouvées
dans les eaux de mer, piscines, lacs et rivières
aBalmer et al.,2004 ; bPoiger et al.,2004 ; cLambropoulon et al.,2002 ; dGiokas et al., 2005 ; eCuderman et Heath, 2007
Il est possible d’identifier deux sources de contamination des eaux superficielles par les PSC, et en particulier les filtres UV et les parabènes, les sources directes et les sources indirectes (figure I.1). La contamination par voie directe résulte du simple acte de baignade dans les eaux superficielles (lacs, mers, rivières). Dans ces conditions, les filtres UV passent directement dans l’eau. Ainsi, les concentrations en filtres UV retrouvées dans les eaux de surface sont généralement beaucoup plus importantes pendant les saisons chaudes du fait des activités aquatiques qui sont plus répandues. Par ailleurs, des concentrations non négligeables (de l’ordre de quelques centaines de ng/L) de 4MBC, BP3 et EHMC ont été observées dans des eaux de piscine (Cuderman et Heath, 2007; Zwiener et al., 2007). La contamination par voie indirecte se fait quant à elle, via les eaux usées et les stations d’épuration (STEP) ; dans ces conditions, l’élimination des crèmes solaires lors des bains, le lessivage des filtres UV attachés aux habits et aux serviettes ou aussi l’excrétion urinaire après absorption cutanée ou orale (ex : rouge à lèvres) (Li et al., 2007) de ces produits constituent une voie de contamination secondaire importante.
Echantillon Filtre UV
BP3 4MBC EHMC
Concentration (ng/L) Concentration (ng/L) Concentration (ng/L)
eaux de mer 8,2a,b 19,7a,b 10,7a,b
eaux de piscine 400e 330e < 238e
eaux des lacs < 2 - 35 (saison froide)
2 - 125 (saison chaude)c,d < 2 - 29 (saison froide) 3 - 82 (saison chaude)c,d < 2 - 15 (saison froide) < 2- 15 (saison chaude)c,d eaux de rivières 114e 181e 88e
Figure I.1 :Voies directes et indirectes d'entrée des filtres UV et des parabènes dans les eaux de surface (d’après Cuderman et Heath, 2007; Daughton et Ternes, 1999; Giokas et
al., 2007)
I.2- Les conservateurs : les parabènes
I.2.1- Utilisation et origine des parabènes
Les conservateurs sont des composés ajoutés à un produit final comme les produits de soins et d’hygiène, les aliments, les boissons, les médicaments, le bois, les produits biologiques etc… pour éviter leur décomposition suite aux développements microbiens ou
leurs modifications chimiques indésirables (Jiménez-Díaz et al., 2014). Parmi les conservateurs les plus utilisés sur le marché on distingue la famille des parabènes. Les parabènes sont un groupe de composés ayant comme structure principale un noyau ester de l’acide parahydroxybenzoïque (figure I.2). Les parabènes sont principalement employés dans les produits de soins (lotions, crèmes, shampoings, gels, etc…) mais aussi dans l’industrie agroalimentaire (avec des pourcentages massiques de l’ordre de 0,1 %) (Daughton et Ternes, 1999).
Figure I.2 : Structure chimique des parabènes
Actuellement, sept types de parabènes différents sont retrouvés sur le marché (Brausch et Rand, 2011). En fonction de la nature du radical R, on distingue le benzylparabène (BzP), l’ethylparabène (EtP), le methylparabène (MP), le propylparabène (PP), le butylparabène (BP), l’isopropylparabène (iPP) et l’isobutylparabène (iBB). Les propriétés physico-chimiques des parabènes dépendent de la longueur de la chaîne alkyl ; les parabènes à chaîne courte (methyl et ethylparabène) sont plus solubles que les parabènes à chaînes longues (valeurs de solubilité situées entre 0,5 g/L pour le benzylparabène et 20 g/L pour le methylparabène (Jewell et al., 2007), et moins hydrophobes avec des valeurs de log kow
situées entre 1,66 pour MP et 3,56 pour BzP (Golden et al., 2005). De plus, étant donné leurs points d’ébullition supérieurs à 270°C, les parabènes sont stables à une température de cuisson habituelle des aliments ; ils ne seraient donc pas dénaturés lors de leur utilisation en cuisine lorsqu’ils sont employés dans les produits agroalimentaires (Soni et al., 2005).
Figure I.3 : Structures des différents parabènes utilisés en tant que conservateurs sur le
marché
L’utilisation des parabènes dans l’industrie cosmétique et pharmaceutique a augmenté considérablement depuis les années 80. En fait, en 1987 plus de 7000 kg de parabènes ont été utilisés dans l’industrie cosmétique (Soni et al., 2005). Les parabènes sont présents dans presque 80% des produits cosmétiques (Pouillot et al., 2006) et sont ainsi considérés comme les composés les plus retrouvés dans les formulations des cosmétiques après l’eau (Janjua et
al., 2007). A la fin des années 1990, et suite aux nombreuses études évoquant l’effet perturbateur endocrinien et cancérigène des parabènes (Darbre et al., 2004; Oishi, 2001; Routledge et al., 1998), des produits à formulations “sans parabène” ont été introduits sur le marché par des industries, en remplaçant les parabènes par d’autres conservateurs. Malgré ceci, le nombre de formulations des PSC contenant des parabènes a continué à augmenter d’un facteur de 1,7 avec un nombre de formulations passant de 13200 en 1981 (Liebert, 1984) à 22000 en 2006 (CIR 2008) (FDA). Cependant, les concentrations de parabènes dans les PSC sont en train de diminuer progressivement. En effet, les pourcentages de parabènes dans la composition des produits de soins sont passés de 1% en 1981 (Liebert, 1984) à des valeurs
situées entre 0,01 et 0,87% en 1995 (Rastogi et al., 1995). On retrouve le méthylparabène, l’éthylparabène, le propylparabène ou le butylparabène dans presque tous les produits de soins ainsi que dans l’industrie agroalimentaire, et bien plus particulièrement le methylparabène (MP) et le propylparabène (PP).
I.2.2- Présence des parabènes dans l’environnement
Comme pour les filtres UV, des sources de contamination directes et indirectes des eaux par les parabènes peuvent être identifiées (figure I.1). Les parabènes, utilisés en grandes quantités par l’Homme, se retrouvent dans les eaux de piscine et aussi dans les eaux résiduaires urbaines jusqu’au rejet des stations d’épuration. Ils peuvent aussi se trouver dans l’environnement suite à un ruissellement provenant des sources non ponctuelles et des dépôts de particules dans l’atmosphère. De ce fait, les eaux de surface, d’autant qu’elles se situent dans les points les plus bas du paysage, sont souvent plus sensibles à la contamination (Błędzka et al., 2014). Toutefois, tous les parabènes ne sont pas présents dans ces milieux.
Les parabènes sont retrouvés dans les eaux de rivières avec des quantités variables. Kasprzyk-Hordern et al. (2008) donnent des valeurs maximales de 400 et 69 ng/L pour le methylparabène et le propylparabène respectivement dans les rivières européennes. Cependant, les quantités retrouvées dans les rivières chinoises par González-Mariño et al. (2009) et Peng et al. (2008) sont de 1062 ng/L pour MP et 3142 ng/L pour PP. En outre, ces parabènes sont aussi trouvés dans les sols et sédiments (Liao et al., 2013) et peuvent même être synthétisés naturellement par certains organismes tels que les plantes et les insectes .
Ces produits chimiques entrant dans la composition des aliments et cosmétiques, à l’origine de leur présence dans l’environnement peuvent engendrer des effets néfastes sur les organismes aquatiques en raison de leur toxicité, et notamment leur effet perturbateur endocrinien (Brausch et Rand, 2011).
II- Traitement, stabilité et toxicité des produits de soins corporels
II.1- Présence et devenir dans les STEP et les usines de traitement
d’eau potable
II.1.1- Devenir au sein des STEP
La contamination des eaux par les produits de soins corporels par voie indirecte peut conduire à des concentrations non négligeables de filtres UV et de parabènes dans l’eau. A la sortie des STEP, certains PSC peuvent persister dans les eaux et seront ainsi déversés dans les eaux de surface, d’où l’importance de trouver un procédé de traitement avec des conditions adéquates pour les éliminer à ce niveau-là.
Les concentrations des filtres UV dans les eaux usées peuvent atteindre quelques ng/mL (Kupper et al., 2006 ; Balmer et al., 2005). En effet, plusieurs filtres UV (BP3, BP4, 4MBC, EHMC) ont été trouvés dans les eaux usées non traitées dans plusieurs pays avec des concentrations allant de 1,5 à 19 μg/L (Balmer et al., 2005 ; Li et al., 2007 ; Rodil et al., 2008). Des concentrations plus faibles (de l’ordre de 0,01 à 2,7 μg/L) sont retrouvées dans les eaux usées traitées (Blamer et al., 2005 ; Rodil et al., 2008) indiquant ainsi une certaine élimination de ces composés par le traitement au niveau des STEP. Kupper et al. (2006) constatent aussi une élimination des filtres UV par sorption sur la phase solide et biodégradation au cours du traitement des eaux usées. D’une manière générale, on retiendra pour ces composés, que la dégradation au sein des stations d’épuration est variable suivant les propriétés physico-chimiques du composé et des traitements utilisés. Selon une étude de Balmer et al. (2005) des pourcentages d’élimination dans les STEP allant de 68 à 96% pour BP3, 18 à 82% pour 4MBC, 97 à 99% pour EHMC et 88 à 99% pour l’octocrylène ont été montrés. Li et al. (2007) ont étudié l’influence de différents traitements de l’eau sur l’élimination des filtres UV. Pour cela, ils ont considéré une usine de traitement comportant les 3 étapes suivantes: coagulation / floculation, microfiltration continue, et ozonation. Selon ces auteurs, le maximum d’élimination de ces produits est obtenu par l’ozonation (16-28%), suivi par la coagulation/floculation (7,6-21%) et finalement, avec un moindre effet, par la microfiltration continue (3,6-8,2%), sachant que le changement de saison n’a aucun effet sur l’efficacité du traitement.
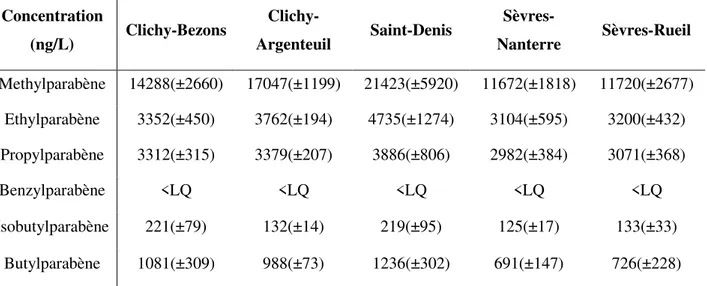
Les parabènes sont également largement retrouvés dans les eaux usées. Le tableau I.4 présente les concentrations des parabènes dans les eaux usées en France d’après les travaux de Geara-Matta et al. (2011).
Tableau I.4 : Concentrations moyennes des parabènes dans la phase dissoute des
échantillons d’eaux usées de cinq émissaires en France (Geara-Matta et al. 2011).
Concentration (ng/L) Clichy-Bezons Clichy-Argenteuil Saint-Denis Sèvres-Nanterre Sèvres-Rueil Methylparabène 14288(±2660) 17047(±1199) 21423(±5920) 11672(±1818) 11720(±2677) Ethylparabène 3352(±450) 3762(±194) 4735(±1274) 3104(±595) 3200(±432) Propylparabène 3312(±315) 3379(±207) 3886(±806) 2982(±384) 3071(±368) Benzylparabène <LQ <LQ <LQ <LQ <LQ Isobutylparabène 221(±79) 132(±14) 219(±95) 125(±17) 133(±33) Butylparabène 1081(±309) 988(±73) 1236(±302) 691(±147) 726(±228)
Les parabènes ont ainsi été détectés dans les influents et les effluents des STEP ainsi que dans les rivières recevant ces effluents. Les concentrations des parabènes dans les influents pouvaient atteindre 13 μg/L et alors que dans les effluents et les rivières à la sortie des STEP les concentrations étaient plutôt de 0,085 μg/L (Benijts et al., 2004; Canosa et al., 2006; Lee et al., 2005). Ceci indique une élimination importante des parabènes au niveau des stations d’épuration de l’eau.
II.1.2- Présence et devenir dans les usines de traitement d’eau potable
Hernández-Leal et al. (2011) ont évalué l’impact du charbon actif en grain sur l’élimination des parabènes et d’autres micropolluants organiques en aérobie en considérant une colonne de charbon actif et des débits lents ou similaires à la réalité. Les résultats ont montré une élimination supérieure à 50% avec des taux >90% pour l’ethyl-, le propyl- et le butylparabène. De plus, diverses méthodes ont été utilisées pour dégrader les parabènes, telles que la biodégradation qui est utilisée dans les traitements biologiques par exemple et aussi la méthode d’oxydation, en utilisant comme oxydant le chlore ou le dioxyde de chlore ou encore l’ozone.
Dans la littérature, les concentrations des parabènes dans l’eau potable se révèlent contradictoires: Casas Ferreira et al. (2011) ont rapporté l’apparition du MP, plus couramment retrouvé dans l’eau du robinet à des concentrations d’environ 15 ng/L (17 ± 4 ng/L), alors que Loraine et Pettigrove (2006) n’ont pas détecté le MP dans l’eau potable traitée, provenant d’une usine de filtration d’eau.
II.2-
Evolution dans l’environnement
Une fois libérés dans l’environnement par voie directe et par leur transfert via les systèmes d’assainissement domestiques, les produits de soins corporels sont sujets à plusieurs voies d’élimination dont la biodégradation, la dégradation chimique et photochimique (Farré
et al., 2008).
Les réactions de photolyse sont souvent complexes et peuvent donner lieu à plusieurs produits pouvant être plus toxiques que les composés de départ (DellaGreca et al., 2003). Egalement, l’atténuation naturelle (ex : dispersion, dilution, sorption aux sédiments) joue un rôle important dans la décontamination du milieu aquatique sans nécessairement changer les molécules (Farré et al., 2008).
Une étude de Ji et al. en 2013 a porté sur l’effet de la dégradation photochimique d’un filtre UV retrouvé dans les eaux naturelles : l’acide 2-phenylbenzimidazole-5-sulfonique (PBSA). Les résultats obtenus montrent que la photolyse directe de PBSA, accentuée dans les conditions acides ou basiques, présente la voie d’atténuation majoritaire de ce filtre UV dans les eaux de surface par les rayons solaires, en comparaison aux phénomènes de dégradation biologique et d’adsorption. La photolyse indirecte, par l’intermédiaire des radicaux HO• par
exemple, reste moins importante suite à l’instabilité des radicaux hydroxyle dans les eaux de surface.
En outre, les concentrations des PSC dans les eaux, et en particulier les filtres UV (tableau I.3), fluctuent de manière significative en fonction de l'emplacement de l'échantillon, la taille du système sous étude (par exemple, les lacs et les piscines), la fréquence et le type d'activités de loisirs, la saison et l’heure de la journée. Dans les eaux, les concentrations maximales ont été observées à la mi-journée lors des journées chaudes d'été. En effet, des concentrations plus élevées sont observées en saison chaude du fait de l’utilisation accrue des
produits solaires pendant cette période et des activités nautiques qui sont presque absentes en saison froide (Díaz-Cruz et Barceló, 2009).
Toutefois, il faut signaler que le fait que les PSC soient rejetés de manière diffuse et continue dans l’environnement aquatique confère un caractère de pseudo-persistance à ce type de polluants (Rapport Aquaref, 2009).
II.3- Toxicité et risques potentiels dus à la présence de produits de
soins corporels dans les eaux
Les risques sanitaires et environnementaux liés à l’utilisation des produits de soins et d’hygiène corporelle sont encore peu connus, notamment en ce qui concerne les effets sur la santé humaine et les effets écologiques liés à une exposition chronique et simultanée à plusieurs composés. Cependant, plusieurs auteurs ont évoqué la problématique de l’effet perturbateur endocrininen de ces molécules.
Diverses études ont récemment porté sur l’exposition de l’Homme à ce genre de composés. Une étude de Correia et al. en 2013 a montré que l’Homme est exposé à 904 μg/jour de galaxolide, un parfum synthétique retrouvé dans les produits de soins comme les crèmes, shampoings et les dentifrices. De même, une étude de Bagasra et al. en 2013 a porté sur le rôle des parfums synthétiques dans des cas d’autisme chez l’homme.
Dans cette partie, les travaux de plusieurs auteurs sur la toxicité relative aux filtres UV ainsi qu’aux parabènes seront détaillés.
II.3.1- Toxicité des filtres UV
Les Hommes peuvent être exposés aux filtres UV par absorption cutanée ou par voie orale (Giokas et al., 2007; Jiang et al., 1999; Schlumpf et al., 2010). En fait, après application cutanée des filtres UV, ils peuvent être absorbés et accumulés dans l'organisme. Ils passent à travers la peau et atteignent le foie et les reins, où ils peuvent être métabolisés et par la suite excrétés, de sorte que les composés initiaux et leurs métabolites peuvent alors entrer dans le
milieu aquatique. L'urine est la principale voie, les matières fécales étant la voie secondaire pour l'élimination des composés initiaux et de leurs métabolites (Okereke et al., 1994).
Plusieurs études ont été réalisées sur la 3-benzophénone (BP3), un des filtres UV les plus utilisés actuellement. BP3 a été détectée dans 98% des échantillons d’urine dans une étude sur la population américaine (Calafat et al., 2008). En effet, BP3 est absorbée au niveau du tractus gastro-intestinal et a été détectée avec son métabolite (2,4-dihydroxybenzophénone) dans le plasma ainsi que dans les urines 4 heures après l’application de crèmes solaires (Felix
et al., 1998; Hayden et al., 1997). L’o-désalkylation de la chaîne latérale méthoxy serait la
principale voie du métabolisme de BP3 donnant le métabolite le plus abondant, la 2,4-dihydroxybenzophénone. L’hydroxylation du cycle aromatique serait la voie secondaire, au cours de laquelle les métabolites 2,3,4-trihydroxybenzophénone et 2,2 -dihydroxy-4-méthoxy-benzophénone sont formés (Felix et al., 1998; Okereke et al., 1995, 1994). Ce dernier est connu pour être un agent mutagène bactérien (Mortelmans et al., 1986).
Une étude de Tarazona et al. en 2013 a également confirmé la présence de BP3 et deux de ces métabolites, le 2,4-dihydroxybenzophénone et le 2,2'-dihydroxy-4-methoxybenzophénone, dans le sérum humain après application cutanée de crèmes contenant la 3-benzophénone. BP3 a été également détectée dans le sperme à des concentrations de quelques ng/mL (León et al., 2010) et plusieurs filtres UV ont été retrouvés dans 85% des échantillons de lait maternel en Suisse (Schlumpf et al., 2010).
Des études récentes montrent que BP3 est capable de traverser la barrière sang-placenta lors de l’exposition de la femme enceinte à ce filtre UV (Krause et al., 2012). Le fœtus, ne présentant pas encore la majorité des isoenzymes uridine diphosphate glucoronosyltransférase (UDPGT) nécessaire à la dégradation des phénols, est alors beaucoup plus vulnérable à la présence de ces molécules dans son organisme, en raison de l’élimination beaucoup plus lente que celle observée dans le sang maternel (Coughtrie et al., 1987; Takahashi et Oishi, 2000).
Tang et al. (2013) ont étudié le lien entre l’exposition aux phénols et plus précisément BP3 en période prénatale et le développement du fœtus lors de la période de gestation ainsi que la durée de cette période. Les études ont été réalisées sur 567 femmes enceintes en Chine. Les résultats montrent que les effets sont liés au sexe du fœtus : une influence sur les garçons a été observée sans trouver d’effets marqués sur les filles. De plus, un lien entre une exposition prénatale à BP3 et une courte période de gestation a été remarqué. Malgré ces
données sur BP3, les connaissances manquent sur l'accumulation, le métabolisme et l’excrétion des agents de protection solaire chez l’Homme.
Les filtres UV peuvent également être absorbés chez les mammifères, les insectes, les organismes et biota aquatiques et peuvent engendrer des effet toxiques (Buser et al., 2006; Fent et al., 2010; Gago-Ferrero et al., 2013, 2012; Kaiser et al., 2012; Ozáez et al., 2014, 2013). Selon la littérature, sept filtres UV, en particulier BP3 et BP4, ont montré une activité oestrogénique in vitro (Kunz et Fent, 2006a, 2006b), et deux autres, 4MBC et EHMC, une activité œstrogénique in vivo chez les poissons (Inui et al., 2003; Kunz et Fent, 2009). Certains filtres UV sont capables d’interagir avec les récepteurs androgéniques, entraînant notamment des effets antiandrogéniques (Schreurs et al., 2005). De même, 4MBC, EHMC et BP3 auraient un effet utérotrophique chez les rats en fonction de la dose administrée par voie cutanée et orale (Schlumpf et al., 2001; Tinwell et al., 2002), alors que pour d’autres composés, des effets sur la fécondité et la reproduction ont été mis en évidence (Kunz et al., 2006; Weisbrod et al., 2007). L’étude de Schlumpf et al. (2008) sur les effets toxiques du 4-MBC et du 3-benzylidène camphor au niveau du développement du système endocrinien des rats confirme des effets possibles de ces filtres UV sur le système endocrinien et le besoin de poursuivre les recherches sur ce sujet.
II.3.2- Toxicité des parabènes
Depuis quelques années, l’utilisation des parabènes dans les produits de soins corporels est devenue un sujet très controversé, suite à la parution de plusieurs études évoquant leur effet perturbateur endocrinien. L’action de plusieurs dérivés du parabène sur le corps et notamment le methyl-, éthyl-, propyl-, butyl-, isobutyl- et benzylparabène a été étudié par plusieurs auteurs, ce qui a permis de trouver des liens importants entre les altérations de l’ADN, le cancer du sein et les maladies endocriniennes d’une part et l’application des parabènes d’autre part.
Du fait de leur usage comme conservateurs dans plusieurs produits cosmétiques et pharmaceutiques, et de leur capacité à pénétrer à travers la peau, l’Homme est régulièrement exposé aux parabènes. Ainsi, la présence de parabènes dans des échantillons d’urine a été mise en évidence par plusieurs auteurs (Calafat et al., 2010; Meeker et al., 2010). Meeker et
pour le propylparabène, et 32% pour le butylparabène. La présence du butylparabène dans les urines était associée à des effets néfastes tels que des dommages de l’ADN du sperme sans que ceci ne conduise à des dérèglements hormonaux ou une diminution de la qualité du sperme.
L’action œstrogénique des parabènes et par la suite leur implication dans le cancer du sein a été largement étudiée. La détection des parabènes dans des échantillons de tumeurs des patients atteints de ce type de cancer est une preuve assez importante qui a joué le rôle majeur dans les études menées sur le cancer du sein et le lien avec les parabènes (Darbre, 2003; Darbre et al., 2004; Darbre et Charles, 2010; Harvey et Everett, 2004).
En plus de son effet perturbateur endocrinien, la cytotoxicité du methylparabène (MP) a été confirmée en raison de son effet inhibiteur sur le transport membranaire et les fonctions mitochondriales. Cet effet dépend néanmoins de plusieurs facteurs, notamment l’irradiation par les rayons UV ainsi que le rôle des estérases de la peau pour former les métabolites du MP conduisant à des altérations de l’ADN comme indiqué dans la figure I.4 (Okamoto et al., 2008; Okamoto, 2006).
Figure I.4 : Activation de MP par l'irradiation solaire et par les estérases de la peau
conduisant à une altération oxydative de l'ADN(Okamoto et al., 2008; Yoshinori Okamoto, 2006).
Pour conclure, il est possible de dire que les effets suite à l’utilisation des parabènes peuvent être assez importants allant de simples allergies jusqu’à l’attaque de l’ADN et
différents cancers. Toutefois il faut noter que les parabènes ne sont pas toujours toxiques. Ils le sont dans certains cas seulement, lorsque :
- ces derniers sont absorbés par voie cutanée et non pas par voie orale, - la durée d’exposition est assez longue,
- la peau est irradiée par la lumière solaire.
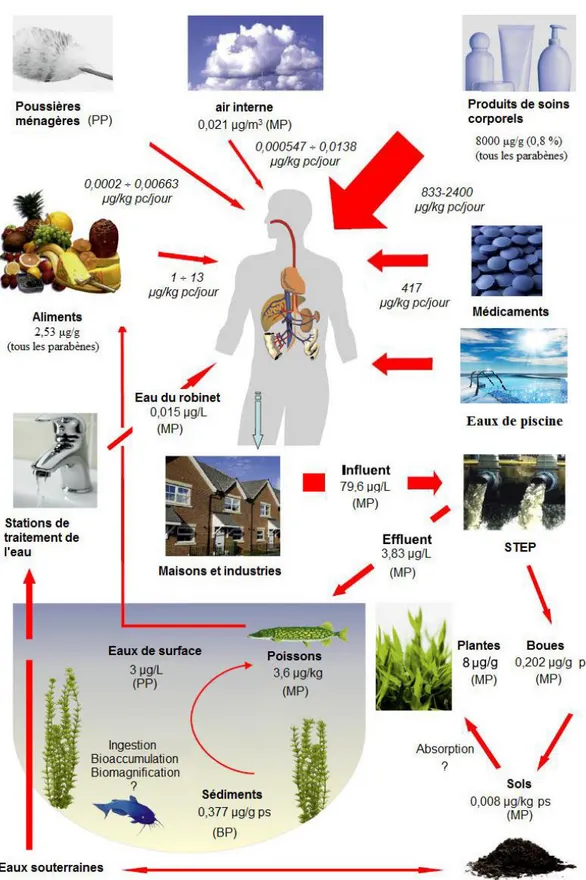
C’est pour cela que les parabènes présents dans les produits cosmétiques et surtout dans les déodorants et les crèmes solaires sont les plus étudiés, étant appliqués directement sur la peau et maintenus pendant un temps plus ou moins important. Cependant, l’Homme est également exposé aux parabènes par diverses autres voies parmi lesquelles la pollution de l’eau joue un rôle important. La figure I.5 représente ces principales voies d’exposition comme illustré par Błędzka et al. (2014).
Figure I.5 : Sources d’exposition et voies de contamination de l’Homme par les
parabènes et leur devenir dans l’environnement tiré de Błędzka et al., 2014 et complété (pc : poids corporel ; ps : poids sec)
La désinfection de l’eau potable, qui consiste à rendre cette eau exempte de germes pathogènes et d’autres germes considérés comme indicateurs pour la consommation humaine, est une étape essentielle des traitements de potabilisation.
Les désinfectants employés dans le traitement des eaux sont le chlore, l’ozone, l’UV, le dioxyde de chlore voire la monochloramine pour certains pays. En raison de sa fréquente utilisation au sein de filières de traitement des eaux en France et pour la désinfection des eaux de piscine, la connaissance de la réactivité du chlore dans les solutions aqueuses est primordiale.
III- Réactivité du chlore en solution aqueuse
III.1- Chimie du chlore en solution
Le dichlore (Cl2) est un gaz jaune verdâtre qui, en solution aqueuse, se dismute en
acide hypochloreux (HOCl), ion chlorure (Cl-) et proton (H+) selon l’équilibre d’hydrolyse
suivant :
Cl2 + H2O HOCl +Cl- + H+ K1=1,5.10-4 à 4.10-4 M-1s-1 de 0 à 25°C (Doré 1989) (I.1)
Pour des eaux contenant une faible concentration en chlorures, l’hydrolyse est considérée complète pour des pH supérieurs à 4.
L’acide hypochloreux résultant de cette hydrolyse est un acide faible qui se dissocie partiellement dans l’eau selon l’équilibre acide-base ci-dessous :
HOCl ClO- + H+ K
a=1,6.10-8 à 3,2.10-8M-1s-1 de 0 à 25°C (Doré 1989) (I.2)
Ainsi, les espèces les plus représentatives résultant de la dissociation du chlore moléculaire dans l’eau sont l’acide hypochloreux et l’hypochlorite dont les concentrations relatives varient en fonction du pH (figure I.6).
pH 0 2 4 6 8 10 12 14 Pou rc en tag e 0 20 40 60 80 100 Cl2 HOCl ClO
-Figure I.6 :Distribution des principales formes du chlore en solution en fonction du pH (déterminée à 20°C et pour [Cl-]=5.10-3M)
Le chlore est un oxydant puissant. En solution, son pouvoir oxydant dépend des espèces présentes dans le milieu (E0 compris entre 1,5 et 0,9 Volts, selon les espèces chlorées)
(Soulard et al., 1983).
III.2-
Réactivité du chlore sur les composés organiques
La réactivité du chlore avec les polluants organiques dépend de sa spéciation et donc du pH. Parmi les différentes espèces du chlore en solution, l’acide hypochloreux est généralement la forme réactive majoritaire dans les conditions de traitement des eaux (Morris, 1975). Pour la plupart des réactions de chloration des composés organiques, la vitesse d’oxydation suit une cinétique d’ordre 2 (Deborde et Von Gunten, 2008). D’un point de vue réactionnel, l’acide hypochloreux (HOCl) présente un potentiel d’oxydation élevé (E0= 1,494
V) et sa structure moléculaire est caractérisée par la polarisation de la liaison Cl-O dans le sens Clᵟ+→OHᵟ-. Ce composé peut agir sur les molécules organiques selon trois modes
d’action :
- par oxydation sur les fonctions réductrices, - par addition sur les liaisons insaturées,
- par substitution électrophile sur les sites nucléophiles (Doré, 1989).
L’action du chlore sur les composés organiques peut ainsi conduire à la formation de composés organochlorés, mais aussi d’aldéhydes, d’acides organiques, et d’anhydride carbonique. La formation de sous-produits chlorés (THM, TOX) est un phénomène observé
pour plusieurs substances organiques en particulier pour les espèces présentant des groupements phénol ou amine dans leurs structures (Bedner et MacCrehan, 2006; Gallard et von Gunten, 2002).
III.2.1- Mécanismes et réactivité sur différentes classes de molécules organiques aliphatiques
Plusieurs auteurs ont étudié la chloration de différentes classes de molécules organiques aliphatiques et aromatiques. Dans cette partie, la réactivité du chlore vis-à-vis des molécules organiques aliphatiques sera détaillée.
a- Composés oxygénés et composés aliphatiques à chaines insaturées
Le chlore est très peu réactif avec les molécules organiques présentant des liaisons doubles dans leur structure ainsi que les molécules contenant des groupements oxygénés, tels que les alcools, les aldéhydes, les cétones et en particulier les acides carboxyliques qui présentent une stabilité vis-à-vis du chlore. La figure I.7 représente le mécanisme réactionnel de l’action du chlore sur les composés à chaine insaturée comme illustrés par Deborde et von Gunten (2008) d’après les travaux de Morris (1978) et Ghanbari et al. (1983).
Figure I.7 : Mécanisme réactionnel de la chloration de composés aliphatiques à liaisons
insaturées (dans le cas où R2 : groupement plus électron-donneur que R1) (Morris, 1978 ; Ghanbari et al., 1983).
b- Composés contenant du soufre et de l’azote
Les molécules organiques renfermant du soufre ou de l’azote dans leur structure présentent généralement une réactivité importante vis-à-vis du chlore. Concernant les composés sulfurés de formule RSH, la réaction rapide provient d’une attaque initiale du chlore sur le groupement sulfur de la molécule engendrant ainsi un intermédiaire réactionnel
(R-S-Cl) (Armesto et al., 2000; Folkes et al., 1995; Fu et al., 2002; Prütz, 1996; Silverstein et Hager, 1974; Winterbourn et Brennan, 1997), suivie par une série de réactions dépendantes des conditions de chloration:
- Formation de l’acide sulfonique R-SO3H suite à des réactions d’hydrolyse faisant
intervenir les intermédiaires tels que R-SOH, R-SO2H (Armesto et al., 2000; Doré,
1989; Folkes et al., 1995; Fu et al., 2002; Hawkins et al., 2003).
- Réaction avec une deuxième molécule contenant un groupement thiol pour former des composés RSSR (Armesto et al., 2000; Fu et al., 2002; Winterbourn et Brennan, 1997).
- Réaction avec le chlore en excès pour former RSO2Cl qui pourrait donner lieu à
l’acide sulfonique ou le thiosulfonate.(Davies et Hawkins, 2000; Fu et al., 2002; Prütz, 1996; Winterbourn et Brennan, 1997)
Le chlore réagit rapidement avec les molécules renfermant des groupements azotées dans leur structure. Parmi ces molécules, on distingue les amines (primaires, secondaires et tertiaires) donnant lieu après réaction avec le chlore à des chloramines. Au niveau du mécanisme réactionnel, l’attaque du HOCl sur la forme neutre des amines est la réaction principale par attaque de Clᵟ+ sur l’atome d’azote. De même, les amides peuvent réagir rapidement avec le chlore mais présentent une réactivité inférieure à celle des amines suite à la présence d’un groupement carbonyl, électro-attracteur, dans leur structure.
Le tableau I.5 regroupe les constantes cinétiques de l’action du chlore sur des molécules modèles appartenant aux différentes classes de composés organiques. Les constantes cinétiques apparentes à pH 7 ont été obtenues par la littérature ou par le calcul à partir des constantes élémentaires.



![Figure I.6 : Distribution des principales formes du chlore en solution en fonction du pH (déterminée à 20°C et pour [Cl - ]=5.10 -3 M)](https://thumb-eu.123doks.com/thumbv2/123doknet/7913881.264994/40.892.255.637.102.386/figure-distribution-principales-formes-chlore-solution-fonction-déterminée.webp)