1
UNIVERSITE
DE
PICARDIE
JULES
VERNE
FACULTE
DE
MEDECINE
D’AMIENS
Année 2016
N° 2016 - 192
PNEUMONIE ET COLONISATION PAR
PNEUMOCYSTIS JIROVECII :
COMPARAISON DE LA CHARGE FONGIQUE DANS DIFFERENTS TYPES
D’ECHANTILLONS RESPIRATOIRES ET DETERMINATION DE SEUILS DE
QUANTIFICATION PAR PCR
MEMOIREDUDIPLOMED’ETUDESSPECIALISEESDEBIOLOGIEMEDICALE
TENANTLIEUDE
THESEPOURLEDIPLOMED’ETATDEDOCTEURENMEDECINE
PRESENTEE
ET
SOUTENUE
PUBLIQUEMENT
LE
16
DECEMBRE
2016
PAR
ESTHER
GYDE
PRESIDENTE
DU
JURY :
P
ROFESSEURA
NNETOTET
MEMBRES
DU
JURY :
P
ROFESSEURJ
EAN-L
UCSCHMIT
P
ROFESSEURV
INCENTJOUNIEAUX
P
ROFESSEURG
ILLESDUVERLIE
2
Remerciements
Madame le Professeur Anne TOTET
Professeur des Universités-Praticien Hospitalier (Parasitologie et mycologie)
Chef de service du laboratoire de Parasitologie et Mycologie médicales Pôle biologie, pharmacie et santé des populations
Vous me faites l’honneur de présider ce jury,
Votre compétence, vos conseils et vos idées m’ont été précieux, au long de ce travail ainsi que pendant mes semestres dans votre service,
Soyez assurée de mon profond respect, et veuillez accepter mes sincères remerciements.
3
Monsieur le Professeur Jean-Luc SCHMIT
Professeur des Universités-Praticien Hospitalier (Maladies infectieuses et tropicales)
Responsable du service des maladies infectieuses et tropicales
Pôle "Médico-chirurgical digestif, rénal, infectieux, médecine interne et endocrinologie" (D.R.I.M.E)
Chevalier dans l’Ordre des Palmes Académiques
Vous avez accepté de participer à ce jury,
Soyez assuré de ma sincère reconnaissance et de mon profond respect.
4
Monsieur le Professeur Vincent JOUNIEAUX
Professeur des Universités-Praticien Hospitalier (Pneumologie) Chef du Service de Pneumologie, Pôle "Coeur - Thorax - Vaisseaux"
Chef du Service de Réanimation Respiratoire, Pôle « Anesthésie – Réanimations »
Vous me faites l’honneur de juger ce travail,
5
Monsieur le Professeur Gilles DUVERLIE
Professeur des Universités-Praticien Hospitalier (Virologie, biologie)
Chef du laboratoire de Virologie
Pôle biologie, pharmacie et santé des populations
Doyen, Directeur de l'Unité de Formation et de Recherche de Pharmacie d'Amiens Chevalier dans l'Ordre des Palmes Académiques
Vous avez accepté de juger ce travail,
Soyez assuré de ma sincère reconnaissance et de mon profond respect.
6
Madame le Docteur Céline DAMIANI
Maître de Conférences des Universités-Praticien Hospitalier Laboratoire de Parasitologie et Mycologie médicales
Pôle biologie, pharmacie et santé des populations Centre Hospitalier Universitaire d’Amiens
Tu m’as énormément aidée et conseillée, dans ce travail comme dans mes choix de parcours,
Merci pour tout, ta disponibilité et ton soutien ; ils m’ont été indispensables pour mener à bien ce projet.
7
Aux biologistes du service de Parasitologie-Mycologie,
Votre gentillesse, vos connaissances et votre envie de les partager font de ce stage un point de passage indispensable pour les internes.
Merci Patrice et Tayeb pour tout ce temps passé à m’apprendre de nouvelles choses. Merci Anne et Céline d’avoir toujours été disponibles, de m’avoir si bien encadrée.
Aux techniciens du service de Parasitologie-Mycologie,
Merci à Xavier d’avoir pensé jusqu’au bout que j’investiguais le PHRC national. Merci à Cécilia et Béa pour votre aide et vos conseils en biologie moléculaire. Merci à Christelle pour ton accueil lors de mes deux stages.
Merci à Jean-Marc pour ta bonne humeur et ton soutien au quotidien.
A mes co-internes Claire, Safia et Sarah,
Merci d’avoir couru vers moi à chaque fois qu’un échantillon était positif en IF ou en PCR. Je vous suis reconnaissante de m’avoir permis d’effectuer ce travail en toute sérénité. Travailler avec vous était un vrai plaisir. Je vous souhaite le meilleur pour la suite, et j’espère bien que nos chemins se recroiseront.
8
A Adrien,
Mon amour, mon meilleur ami, mon allié au quotidien. Merci de me soutenir dans tous mes choix, et de me supporter, merci d’être là tous les jours tout simplement.
A ma famille,
Merci à mes parents de m’avoir permis d’en arriver là, de m’avoir soutenu tout au long de mes études. Vous avez toujours cru en moi et je vous remercie pour votre soutien au quotidien. Merci Gazou et Sidou d’avoir toujours vu en moi la grande sœur modèle ; vous avez avancé dans vos propres voies, loin d’être faciles et évidentes, vous pouvez être fiers du chemin parcouru.
A ma mamie et mon papi,
Merci pour votre soutien permanent, votre bonne humeur et vos petites anecdotes toujours pleines d’humour et de sagesse.
Mathilde et Anne-Elise, amie de toujours et copine coup de foudre de l’internat. Merci de
toujours être là pour moi. Je sais que je peux tout vous demander, c’est évidemment réciproque. Gauthier, merci pour ta bonne humeur et tes blagues potaches, merci pour les vacances de gros ! Léa, je suis bien contente que tu aies passé autant de temps au labo et qu’on se soit rencontrée. Les pauses thé, le jogging, les weekends… ça ne fait que commencer ! Lucas, Alexis, Sébastien, merci pour ces parties de ping-pong endiablées ! Je suis contente d’avoir passé ces six mois avec vous et d’avoir appris à mieux vous connaître. Merci
Pauline de m’avoir relue, c’était vraiment chouette d’être avec toi au labo. Maintenant, il
9
Sommaire
Liste des abréviations ... 11
Table des illustrations ... 13
Figures ... 13 Tableaux ... 14 Introduction ... 15 Revue de la littérature ... 16 Pneumocystis jirovecii ... 16 Aspects historiques ... 16 Cycle de développement ... 16
Manifestations cliniques et radiologiques des pneumonies à Pneumocystis ... 18
Détection de Pneumocystis jirovecii ... 20
Echantillons respiratoires ... 20
Examen direct ... 21
Techniques de PCR ... 22
Intérêt de la PCR en temps réel quantitative pour distinguer pneumonie à Pneumocystis et colonisation ... 22
Objectifs de l’étude ... 25
Matériels et méthodes ... 26
Echantillons et patients ... 26
Détermination de la charge fongique par PCR en temps réel quantitative dans les échantillons de LBA et échantillons non-LBA ... 26
10
Résultats ... 29
Echantillons et patients ... 29
Données épidémiologiques ... 29
Comparaison des charges fongiques ... 31
Corrélation de la charge fongique entre LBA et échantillons non-LBA ... 33
Détermination de seuils de quantification pour les échantillons non-LBA à l’aide de l’équation de corrélation ... 34
Discussion ... 37
Conclusion ... 42
Annexes ... 43
Annexe 1 : Recueil de données cliniques, radiologiques et biologiques des 41 patients de l’étude ... 43
Annexe 2 : Résultats de la PCR quantitative en nombre de copies d’ADN de P. jirovecii/µL dans chacun des échantillons respiratoires des 41 patients de l’étude ... 46
11
Liste des abréviations
ADN : acide désoxyribonucléique
[ADN P. jirovecii]LBA : concentration d’ADN de P. jirovecii dans les LBA
[ADN P. jirovecii]nonLBA : concentration d’ADN de P. jirovecii dans les prélèvements autres que
les LBA
AB : aspiration bronchique ANP : aspiration naso-pharyngée
BPCO : broncho-pneumopathie chronique obstructive CBH : centre de biologie humaine
CHU : centre hospitalier universitaire
Ct : « cycle threshold » ou cycle seuil de détection DHFR : dihydrofolate réductase
DHPS : dihydroptéroate synthétase EFT : équivalent forme trophique ENP : écouvillon naso-pharyngé ES : expectoration spontanée HSP70 : « Heat Shock Protein » 70 IF : immunofluorescence
ITS : « Internal Transcribed Spacers » LBA : lavage broncho-alvéolaire MSG : « major surface glycoprotein »
mtLSU : « mitochondrial large subunit » ou grande sous-unité mitochondriale
P. jirovecii : Pneumocystis jirovecii
PCR : « polymerase chain reaction » ou réaction de polymérisation en chaine PPC : pneumonie à Pneumocystis
PTP : prélèvement trachéal protégé qPCR : PCR quantitative
RNA : acide ribonucléique
12 ROP : rinçage oro-pharyngé
rRNA : ARN ribosomal TS : thymidilate synthétase
13
Table des illustrations
Figures
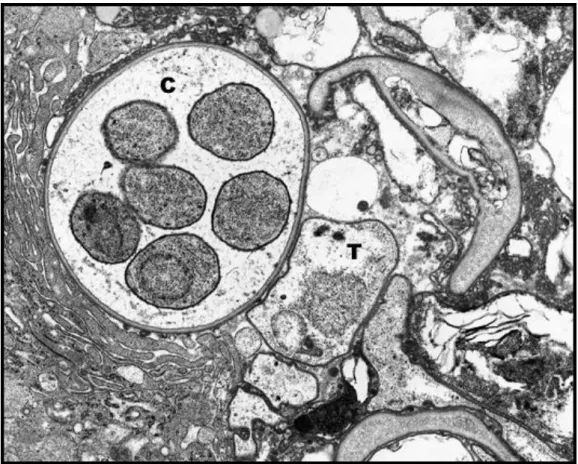
Figure 1 : Asque de P. jirovecii (C) contenant six sporozoïtes intrakystiques, trophozoïtes adjacents (T), en microscopie électronique (X16000) (15)
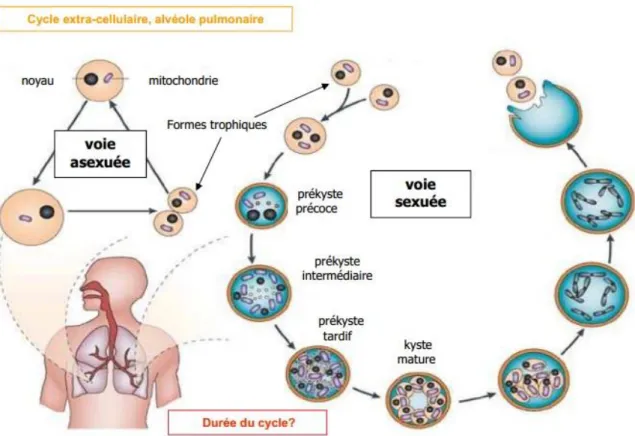
Figure 2 : Cycle de développement de P. jirovecii, figure reproduite d’après Charles F. Thomas et Jr & Andrew Limper (17)
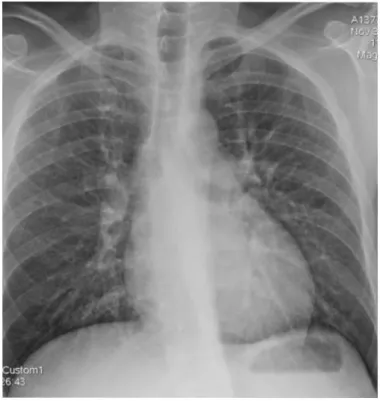
Figure 3 : Radiographie pulmonaire de face, syndrome interstitiel bilatéral à prédominance périhilaire
Figure 4 : Tomodensitométrie thoracique avec injection de produit de contraste iodé, reconstruction dans le plan axial (gauche) et coronal (droite), fenêtre parenchymateuse, plages de condensation en verre dépoli confluentes et symétriques prédominant en région péri-hilaire
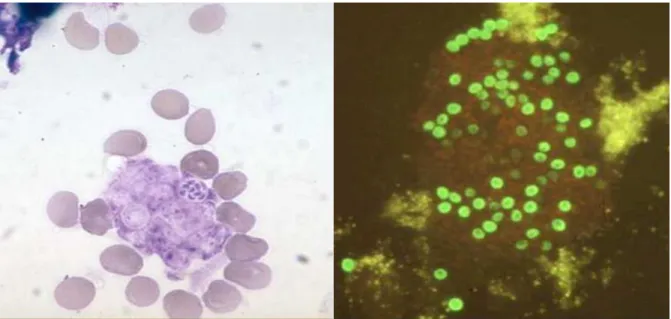
Figure 5 : Examen direct d’un LBA, présence de trophozoïtes et d’asques de P. jirovecii au May-Grünwald-Giemsa (gauche), et d’asques de P. jirovecii en immunofluorescence (droite) Figure 6 : Design de l’étude
Figure 7 : Comparaison de la charge fongique dans les LBA entre le groupe PPC prouvée et le groupe colonisation
Figure 8 : Comparaison de la charge fongique dans les échantillons non-LBA entre le groupe PPC prouvée et le groupe colonisation
Figure 9 : Comparaison de la charge fongique dans les échantillons de LBA et dans d’AB post-LBA
Figure 10 : Comparaison de la charge fongique des échantillons non-LBA (AB post-LBA exclues) entre le groupe PPC prouvée et le groupe colonisation
Figure 11 : Etude de la corrélation de la quantité d’ADN de P. jirovecii entre les échantillons de LBA et les échantillons non-LBA en nombre de copies d’ADN de P. jirovecii/µL ; échelle logarithmique
Figure 12 : Classement des patients en fonction de la charge fongique dans les échantillons non-LBA
Figure 13 : Classement des patients en fonction de la charge fongique dans les échantillons de LBA
14 Tableaux
Tableau 1 : Principales études portant sur la détermination des seuils pour le diagnostic de PPC dans différents types d’échantillons
Tableau 2 : Données épidémiologiques des patients
Tableau 3 : Comparaison des données épidémiologiques entre les patients présentant une PPC et les patients colonisés
15
Introduction
Pneumocystis jirovecii (P. jirovecii) est un champignon ubiquitaire, opportuniste, et spécifique
de l’homme. Il est responsable, chez les patients immunodéprimés, de la pneumonie à
Pneumocystis (PPC) dont l’évolution est fatale en l’absence de traitement spécifique. En marge
de cette forme sévère, ce champignon peut également être responsable de colonisation pulmonaire chez les patients présentant un diagnostic alternatif à la PPC.
La détection de P. jirovecii est réalisée par un examen direct microscopique dans les échantillons de lavages broncho-alvéolaires (LBA) de patients à risque de développer une PPC. En cas d’infestation massive, la détection du champignon est relativement aisée à l’aide de la microscopie. En revanche, l’examen direct est classiquement négatif au cours des pauci-infestations, que celles-ci se rapportent à des PPC ou à des colonisations. Le recours aux techniques de PCR en temps réel, plus sensibles que la microscopie, s’avère alors essentiel. La PCR quantitative (qPCR) permettant d’évaluer la concentration de P. jirovecii dans les échantillons de LBA, certaines équipes proposent d’appliquer des valeurs seuils qui discriminent les diagnostics de PPC et de colonisation pulmonaire.
Le LBA est considéré l’examen de référence pour le diagnostic de PPC car il permet le recueil d’un échantillon riche en matériel alvéolaire. Il présente cependant des désavantages tels qu’une douleur et une anxiété pour le patient, ou des contre-indications rencontrées chez des patients fragiles comme une instabilité hémodynamique, des troubles de l’hémostase, une hypoxie.
Dans ce contexte, l’objectif général de notre travail a été de déterminer et d’évaluer des valeurs seuils en qPCR dans des échantillons respiratoires moins invasifs que les LBA dans le but de distinguer les PPC et les colonisations.
16
Revue de la littérature
Pneumocystis jirovecii
Aspects historiques
P. jirovecii est un champignon atypique ubiquitaire découvert en 1909 (1), et considéré jusque
très récemment comme étant non cultivable in vitro. Le genre Pneumocystis regroupe plusieurs espèces largement répandues chez les mammifères, mais qui présentent une étroite spécificité d’hôte. Les infections croisées entre différentes espèces sont impossibles (2,3) ; ainsi, P. jirovecii est spécifique de l’homme. Par ailleurs, il ne dispose pas de réservoir environnemental, sa transmission est strictement inter-humaine par voie aérienne (4–6), et on considère que l’ensemble des populations humaines infectées par P. jirovecii constitue le réservoir du champignon (7).
P. jirovecii a longtemps été considéré comme une espèce parasitaire. La proximité de son cycle
de réplication avec celui des protozoaires, son caractère non cultivable, et sa sensibilité vis-à-vis de molécules antiparasitaires comme le cotrimoxazole et la pentamidine étayaient entre autres cette hypothèse. Aujourd’hui, il est communément admis que P. jirovecii appartient à l’embranchement des Ascomycota (8). En biologie moléculaire, de nombreuses homologies de
structure avec des champignons ont été décrites. En effet, le séquençage révèle que le génome de Pneumocystis sp. présente 68% d’homologie avec ceux des levures Saccharomyces
cerevisiae et Schizosaccharomyces pombe (9) et des champignons filamenteux Aspergillus et Neurospora crassa (10). Sa paroi trilamellaire riche en chitine et en β-D-glucane (11,12) est un
argument de plus plaidant pour l’origine fongique de P. jirovecii (13). D’autre part, une équipe allemande a récemment réussi à cultiver P. jirovecii au sein d’une interface en trois dimensions composée de cellules épithéliales différenciées, d’air et du liquide de LBA prélevé sur le patient (14).
Cycle de développement
Toutes les espèces du genre Pneumocystis se multiplient dans les alvéoles pulmonaires, au sein desquelles le champignon présente différents stades morphologiques. Les deux formes principales du cycle sont la forme trophique ou végétative (trophozoïte), et l’asque (kyste mature). Il existe une forme intermédiaire, le sporocyste (prékyste), qui comporte trois stades de maturation : précoce, intermédiaire et tardif (figure 1).
17
Figure 1 : Asque de P. jirovecii (C) contenant six sporozoïtes intrakystiques, trophozoïtes adjacents (T), en microscopie électronique (X16000) (15)
Aujourd’hui, le cycle de développement de Pneumocystis ne fait pas l’objet de consensus, deux types de multiplication sont toutefois évoqués (figure 2). L’existence d’une multiplication sexuée, avec formation d’asques après conjugaison de deux formes trophiques, est à présent admise (16). La multiplication asexuée, au cours de laquelle les formes trophiques se divisent par fission binaire sans intervention des kystes, est quant à elle encore hypothétique (17).
18
Figure 2 : Cycle de développement de P. jirovecii, figure reproduite d’après Charles F. Thomas et Jr & Andrew Limper (17)
Manifestations cliniques et radiologiques des pneumonies à Pneumocystis
P. jirovecii est responsable de PPC chez des personnes présentant un déficit immunitaire. Il est
le plus fréquemment observé chez les patients greffés sous immunosuppresseurs, ou encore chez les malades infectés par le virus de l’immunodéficience humaine (VIH). On considère, en cas d’infection par le VIH, que le risque de développer une PPC est particulièrement élevé lorsque le taux sérique de lymphocytes T CD4 est inférieur à 200/mm3. La PPC reste encore
aujourd’hui le mode de découverte de l’infection par le VIH même si l’utilisation des traitements antirétroviraux a nettement diminué la représentation de cette population au sein des PPC, au profit d’autres catégories de patients : les patients transplantés, les patients présentant des maladies inflammatoires ou auto-immunes, les patients présentant des hémopathies malignes ou des cancers solides (18). Cliniquement, la PPC se manifeste par une dyspnée, une toux sèche et une fièvre, avec une évolution insidieuse chez les patients atteints par le VIH, et au contraire très brutale chez les patients non infectés par le VIH. Elle est caractérisée par un taux de mortalité évalué à moins de 10% chez les patients infectés par le
19 VIH, 10% chez les patients greffés rénaux, et jusque 50% chez les patients présentant une néoplasie (19–21). La radiographie de thorax montre des infiltrats interstitiels diffus (figure 3). La tomodensitométrie est plus évocatrice et retrouve un aspect des poumons « en verre dépoli » (figure 4).
Figure 3 : Radiographie pulmonaire de face, syndrome interstitiel bilatéral à prédominance périhilaire
Figure 4: Tomodensitométrie thoracique avec injection de produit de contraste iodé, reconstruction dans le plan axial (gauche) et coronal (droite), fenêtre parenchymateuse, plages de condensation en verre dépoli confluentes
20 Ce champignon peut également être responsable de colonisation pulmonaire chez des patients immunodéprimés, notamment les patients infectés par le VIH avec un taux sérique de lymphocytes T CD4 inférieur à 400/mm3 (22) ou traités par corticothérapie au long cours.
Les patients présentant des affections pulmonaires aigües ou chroniques telles que les broncho-pneumopathies chroniques obstructives (BPCO), la sarcoïdose, la mucoviscidose, ou la fibrose pulmonaire, sont aussi susceptibles d’être colonisés par le champignon. On observe également des colonisations chez des femmes enceintes (en lien avec une modification physiologique de l’immunité), des personnes âgées, et le personnel soignant en contact avec des patients présentant une PPC (18,23,24). La colonisation par Pneumocystis est définie par la présence du champignon au niveau pulmonaire alors qu’un diagnostic alternatif à la PPC est retenu. Par ailleurs, au cours des colonisations par P. jirovecii, l’évolution clinique du patient est favorable en l’absence de traitement spécifique contre le champignon.
Détection de Pneumocystis jirovecii
Echantillons respiratoires
Le LBA est un prélèvement respiratoire invasif qui permet l’exploration des territoires alvéolaires. Il consiste en l’injection par naso-fibroscopie de sérum physiologique stérile à 37°C dans les voies respiratoires du patient. Le liquide de lavage est ensuite récupéré par aspiration, et envoyé au laboratoire pour être analysé.
Le LBA est aujourd’hui considéré comme le prélèvement de référence pour le diagnostic de PPC (25) car il permet le recueil d’un échantillon riche en matériel alvéolaire.
Cet examen est douloureux et anxiogène pour le patient qui a la sensation de se noyer. Il est de plus contre-indiqué en cas d’instabilité hémodynamique, de troubles de l’hémostase, ou encore d’une hypoxie non corrigée, situations souvent rencontrées dans les services de réanimation et d’hématologie clinique.
D’autres types d’échantillons respiratoires peuvent être utilisés pour la détection de P.
jirovecii : les prélèvements trachéaux protégés (PTP), les expectorations spontanées (ES), les
aspirations naso-pharyngées (ANP), les aspirations bronchiques (AB), les rinçages oro-pharyngés (ROP), ainsi que les écouvillons naso-oro-pharyngés (ENP). Les expectorations induites (EI) sont des échantillons dont la richesse en matériel alvéolaire s’apparente à celle des LBA et peuvent également être analysées pour rechercher le champignon. Leur réalisation est
21 toutefois contraignante, puisqu’il s’agit d’expectorations de sécrétions bronchiques après stimulation de la toux, induites par un aérosol hypertonique de chlorure de sodium.
L’intérêt de l’utilisation de ces échantillons moins invasifs que les LBA pour le diagnostic de PPC a fait l’objet de travaux (26–30), encore peu nombreux à ce jour.
Examen direct
L’examen direct microscopique est réalisé à partir du culot de cytocentrifugation du LBA. Il associe classiquement deux types de coloration : la coloration au May-Grünwald-Giemsa (MGG) qui permet de visualiser les formes trophiques et les corps intra-kystiques, et la coloration de Gomori Grocott, technique d’imprégnation argentique, ou celle au bleu d’orthotoluidine qui toutes deux ne colorent que les asques (figure 5).
L’utilisation d’anticorps monoclonaux en immunofluorescence (IF) indirecte (figure 5) a permis d’augmenter la sensibilité du diagnostic et d’améliorer ainsi la détection en cas de faible charge fongique (31).
En règle générale, les prélèvements respiratoires autres que les LBA et les EI ne font pas l’objet d’un examen direct, car ils sont considérés trop pauvres en matériel alvéolaire et donc trop peu sensibles pour la détection microscopique du champignon. Par ailleurs, le coffret MONOFLUO KIT P. jirovecii commercialisé par Biorad pour la détection d’asques de P. jirovecii en IF n’est validé que pour les LBA et les EI.
Figure 5 : Examen direct d’un LBA, présence de trophozoïtes et d’asques de P. jirovecii au May-Grünwald-Giemsa (gauche), et d’asques de P. jirovecii en immunofluorescence (droite)
22
Techniques de PCR
Dans les années 1990, les techniques d’amplification génique par PCR ont permis d’augmenter la sensibilité de la détection de P. jirovecii par rapport à la microscopie (18). En raison de cette sensibilité, les réactions de PCR permettent la détection de P. jirovecii dans les prélèvements biologiques moins invasifs que les LBA, tels que les produits d’aspirations bronchiques ou les expectorations (27). Ces réactions sont également assez sensibles pour détecter les faibles quantités de P. jirovecii, que celles-ci se rapportent aux PPC pauci-parasitaires ou aux colonisations pulmonaires (28,29).
Le gène cible le plus fréquemment utilisé pour détecter le champignon est un fragment du gène codant la grande sous-unité de l’ARN ribosomique mitochondrial (mtLSU rRNA) (32–34). D’autres gènes ont été proposés : le gène de la « major surface glycoprotein » (MSG), les régions des « Internal Transcribed Spacers » (ITS), les gènes de la thymidilate synthétase (TS), de la dihydrofolate réductase (DHFR), de la dihydroptéroate synthétase (DHPS) (34), de la β-tubuline (35) ou de la « Heat Shock Protein » 70 (HSP70) (36–39).
Aujourd’hui, ce sont les réactions de PCR en temps réel qui sont le plus utilisées. Leur rapidité d’exécution et la réduction des risques de contamination en font une technique de choix pour la détection de P. jirovecii dans les échantillons respiratoires, qu’ils s’agissent de LBA ou d’échantillons respiratoires moins invasifs (40–43).
Intérêt de la PCR en temps réel quantitative pour distinguer pneumonie à Pneumocystis et colonisation
L’amélioration de la sensibilité diagnostique obtenue grâce aux techniques de PCR en temps réel a généré des difficultés d’interprétation, un résultat positif pouvant se rapporter à une PPC pauci-parasitaire ou à une colonisation. Plusieurs équipes se sont alors attelées à déterminer des valeurs seuils de qPCR dans les échantillons de LBA pour distinguer la PPC de la colonisation pulmonaire. Les premiers travaux ont proposé une valeur seuil unique de nombre de copies d’ADN de P. jirovecii (34,36,39,44,45). La sensibilité et la spécificité pour le diagnostic de PPC variaient respectivement de 65% à 100% et de 82% à 100% selon les méthodes utilisées et les gènes amplifiés. D’autres équipes ont suggéré d’appliquer deux valeurs seuils afin d’augmenter la sensibilité et la spécificité de la qPCR (30,46–49). Ainsi, un
23 nombre de copies d’ADN de P. jirovecii situé au-dessous de la valeur seuil inférieure permettrait d’exclure le diagnostic de PPC avec une sensibilité de 100% tandis qu’un nombre de copies situé au-dessus de la valeur seuil supérieure permettrait de retenir ce diagnostic avec une spécificité de 100%. La zone grise située entre les deux valeurs seuils ne permettait cependant pas d’exclure ou de retenir le diagnostic de PPC. Certaines équipes ont proposé des valeurs seuils tenant compte du statut des patients vis-à-vis du VIH (50,51). Ils obtenaient ainsi une zone grise plus réduite.
Très peu d’équipes ont travaillé sur l’intérêt d’élaborer des seuils dans des échantillons moins invasifs que les LBA pour le diagnostic de PPC. Larsen et al. ont déterminé un seuil unique à 50 copies/5µL d’ADN sur 52 ROP avec une sensibilité et une spécificité respectivement égales à 70% et 100% (26). Fujisawa et al. ont établi un seuil à 30 copies/10µl d’ADN sur 86 EI de patients non infectés par le VIH avec une sensibilité de 82,4% et une spécificité de 98,6% (52). Quant aux deux seules études ayant proposé deux seuils en qPCR, les échantillons de LBA et de non LBA y avaient été analysés de façon indistincte (30,49).
Le tableau 1 présente les principales études portant sur la détermination de seuils pour le diagnostic de PPC dans différents types d’échantillons.
24
Tableau 1 : Principales études portant sur la détermination des seuils pour le diagnostic de PPC dans différents types d’échantillons Auteur, année Nombre et type d’échantillons analysés Gène Amplifié par qPCR
Valeur seuil déterminée par qPCR Sensibilité (%) de la qPCR pour le diagnostic de PPC Spécificité (%) de la qPCR pour le diagnostic de PPC Flori, 2004 (44)
32 LBA MSG 103 copies/5 µL d’ADN 100 98,6
Larsen, 2004 (26)
52 ROP MSG 50 copies/5 µL d’ADN 70 100
Huggett, 2008 (36)
136 LBA HSP70 10 copies/réaction 98 96
Fujisawa, 2009 (52)
86 EI ITS2 30 copies/10 µL d’ADN 82,4 98,6
Chumpitazi, 2011 (39)
54 LBA MSG 53,4 copies/mL d’échantillon 100 97,7
Matsumura, 2012 (34)
36 LBA et EI DHPS 1300 copies/mL d’échantillon 80 100
Montesinos, 2015 (45) 120 LBA β-tubuline mtLSU 34 (Ct) 2,8 x 105 copies/mL d’échantillon 65 72 85 82 Fillaux, 2008 (47) 101 LBA MSG Inférieure : 28 (Ct) Supérieure : 21 (Ct) 100 74,2 98,1 100 Alanio, 2011 (49) 278 LBA et EI mtLSU rRNA
Inférieure : 120 EFT/mL d’échantillon Supérieure : 1900 EFT/mL d’échantillon
100 85,7 96,9 100 Mühlethaler, 2012 (46)
171 LBA MSG Inférieure : 85 pathogènes/mL d’échantillon Supérieure : 1450 pathogènes/mL d’échantillon NA 66 NA 99,4 Botterel, 2012 (48) 353 LBA mtLSU rRNA
Inférieure : 2,6 log10 copies/µL d’ADN
Supérieure : 4 log10 copies/µL d’ADN
100 ND ND 100 Maillet, 2013 (30)
35 LBA et AB MSG Inférieure : 3160 copies/mL d’ADN Supérieure : 31600 copies/mL d’ADN
100 80 70 100 Damiani 2013 (53) 46 LBA mtLSU rRNA
Inférieure : 1,6 x 103 copies/µL d’ADN
Supérieure : 2 x 104 copies/ µL d’ADN
100 ND ND 100 Louis, 2015 (50) 1211 LBA mtLSU rRNA
VIH+ : 1,5 x 104 copies/mL d’échantillon
VIH-, inférieure : 3,39 x 103 copies/mL
d’échantillon
VIH-, supérieure : 2,87 x 104 copies/mL
d’échantillon 100 100 ND 100 ND 100 Fauchier 2016 (51) 166 LBA mtLSU rRNA Inférieure : 35 (Ct) Supérieure : 31 (Ct) VIH+, inférieure : 30 (Ct) VIH+, supérieure : 27 (Ct) VIH-, inférieure : 35 (Ct) VIH-, supérieure : 31 (Ct) 80 66 80 73 80 59 63 80 79 100 60 80
Ct : cycle seuil ; DHPS : dihydroptéroate synthétase ; EFT / mL : équivalent forme trophique par millilitre ; EI : expectoration induite ; HSP 70 : heat shock protein ; ITS : internal transcribed spacers ; LBA : lavage broncho-avéolaire ; MSG : major surface protein ; mtLSU : grande sous-unité mitochondriale ; NA : non applicable ; ND : non déterminée ; rRNA : acide ribonucléique ribosomal ; ROP : rinçage oro-pharyngé ; VIH : virus de l’immunodéficience humaine.
25
Objectifs de l’étude
L’objectif général de notre travail a été de définir et d’évaluer des valeurs seuils en qPCR dans des échantillons respiratoires moins invasifs que les LBA dans le but de distinguer les PPC et les colonisations.
Pour définir les seuils, nous avons :
quantifié P. jirovecii dans des couples d’échantillons de LBA et de non-LBA provenant d’un même patient ;
recherché une différence significative de la charge fongique en fonction de la présentation clinique de l’infection (PPC versus colonisation), à la fois pour les échantillons de LBA et les échantillons non-LBA ;
cherché à corréler la charge fongique des échantillons de LBA et celle des échantillons non-LBA ;
et déterminé des valeurs seuils discriminant les PPC et les colonisations dans ces échantillons non-LBA.
26
Matériels et méthodes
Echantillons et patients
Cette étude rétrospective a été réalisée sur des ADNs conservés à -80°C au laboratoire. Ils avaient été extraits de couples d’échantillons LBA/non-LBA (EI, ES, ANP, AB, ENP, PTP, ROP) recueillis entre janvier 2012 et août 2016 et qui répondaient aux critères suivants :
détection de P. jirovecii en PCR dans un LBA, que le résultat de l’examen direct soit positif ou négatif,
et disponibilité d’au moins un autre échantillon respiratoire recueilli dans un délai inférieur à 20 jours par rapport au recueil du LBA.
Chaque échantillon prélevé plus de trois jours après l’instauration d’un traitement
anti-Pneumocystis était exclu de ce travail.
Pour chaque couple d’échantillons LBA/non-LBA, les informations suivantes relatives aux patients ont été recueillies : sexe, âge, pathologie sous-jacente, date de réalisation des différents prélèvements respiratoires, diagnostic de PPC retenu ou non par le clinicien, instauration et durée du traitement anti-Pneumocystis et évolution clinique.
Après étude des dossiers cliniques, les patients ont été classés en trois groupes distincts a
posteriori selon les critères suivants :
PPC prouvée : examen microscopique du LBA positif ;
Diagnostic indéterminé : examen microscopique du LBA négatif mais signes cliniques et/ou radiologiques compatibles avec une PPC motivant l’instauration d’un traitement anti-Pneumocystis toutefois associé à une autre prise en charge thérapeutique ; Colonisation par P. jirovecii : examen microscopique du LBA négatif, diagnostic
alternatif à la PPC, évolution clinique favorable en l’absence de traitement
anti-Pneumocystis.
Détermination de la charge fongique par PCR en temps réel quantitative dans les échantillons de LBA et échantillons non-LBA
La charge fongique des couples d’échantillons de LBA et non-LBA provenant d’un même patient a été déterminée en qPCR dans une même série. La cible amplifiée correspondait à
27 une portion du gène multicopie codant la mtLSU rRNA de P. jirovecii (54,55). Les amorces utilisées étaient PCW3 CTT AAA ATA AAT AAT CAG ACT ATG TGC GAT AAG-3’) et PCW4 (5’-GCC CAG AAC AGT AAT TAA AGC TCC-3’). La sonde P. jirovecii (5’-AGA TAG TGA AAG GGA AAC-3’) était marquée à son extrémité 5’ par le fluorophore 6FAM couplé à un quencher MGB non fluorescent à son extrémité 3’. La réaction a été réalisée dans un volume final de 25 μL, comprenant 0,2 μM de chaque amorce, 0,1 μM de sonde, du Master Mix (Taqman® Gene Expression Master Mix Applied Biosystems, Foster City, CA) et 5 μL d’extrait d’ADN. Le programme de la PCR comportait une activation de l’uracyl-N-glycosylase à 50°C pendant 2 minutes, une activation de la Taq polymérase à 95°C pendant 10 minutes suivie de 40 cycles comprenant chacun une dénaturation de 15 secondes à 95°C, une hybridation et une extension de 1 minute à 60°C. Chaque réaction a été réalisée en duplicat, un puit permettant en plus de la détection de P. jirovecii, l’amplification d’un contrôle d’extraction (TaqMan® RNAse P Control Reagents, Applied Biosystems, Foster City, CA) et l’autre permettant, en plus de la détection de P. jirovecii, l’amplification d’un contrôle d’inhibition (TaqMan® Exogenous Internal Positive Control Reagents, Applied Biosystems, Foster City, CA). La qPCR a été réalisée sur l’automate AbiPrism 7500 d’Applied Biosystems.
Un témoin négatif (eau stérile) et une gamme de standards quantifiés (de 102 à 107 copies
d’ADN de P. jirovecii/µL) étaient inclus dans chaque série et permettaient respectivement de contrôler l’absence de contamination et de quantifier le nombre de copies d’ADN de P.
jirovecii présent dans chaque échantillon. Dans les échantillons de LBA, les seuils inférieurs et
supérieurs respectivement de 1,6.103 et de 2.104 copies d’ADN/ µL préalablement définis par
le laboratoire ont été utilisés (53). Analyse statistique
L’ensemble de l’analyse statistique a été réalisé en ligne à l’aide du logiciel R (56).
Les données quantitatives des différents groupes ont été comparées à l’aide des tests de Student ou de Wilcoxon-Mann Whitney. Pour cela, la distribution des valeurs de chaque groupe a été analysée par le test de Shapiro-Wilk. Les données pour lesquelles la distribution était normale ont été analysées par le test paramétrique de Student ; celles pour lesquelles la distribution ne suivait pas une loi normale ont été analysées par le test non paramétrique de Wilcoxon-Mann Whitney.
28 Les données qualitatives des groupes ont été comparées à l’aide du test du Chi2.
Une corrélation entre la quantification fongique par qPCR dans les échantillons de LBA et celle dans les échantillons non-LBA dans les différents groupes a été recherchée par le test non paramétrique de Spearman.
29
Résultats
Echantillons et patients
Quarante et un ADNs extraits de LBA (41 patients) dans lesquels P. jirovecii avait été initialement détecté par PCR et pour lesquels au moins un ADN extrait d’échantillon non LBA prélevé chez le même patient était disponible au laboratoire ont été analysés.
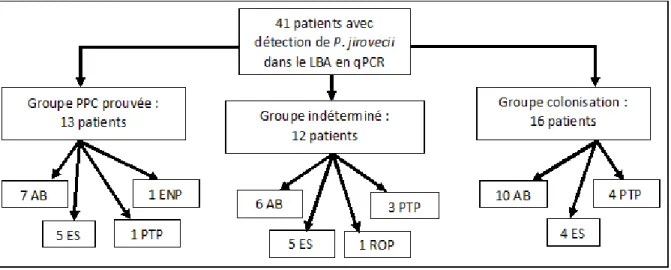
Pour six des 41 patients, deux échantillons autres que le LBA avaient été prélevés (figure 6). Au total, nous disposions donc de 47 ADNs extraits d’échantillons non LBA ; il s’agissait de 23 AB, 14 ES, 8 PTP, 1 ENP et 1 ROP. Quarante-sept couples LBA/non-LBA ont ainsi été analysés, correspondant à 41 patients.
L’analyse des dossiers a permis de classer 13 patients dans le groupe de PPC prouvée, 12 dans le groupe de diagnostic indéterminé, et 16 dans le groupe de colonisation. Les données clinico-biologiques des 41 patients sont présentées en annexe 1.
Figure 6 : Design de l’étude
Données épidémiologiques
Il s’agissait de 25 hommes et 16 femmes avec une moyenne d’âge de 60,39 ans (±12,42). L’étude des pathologies sous-jacentes montrait une prépondérance des hémopathies malignes (31,71%), puis, dans l’ordre de fréquence décroissant, des transplantations rénales (26,83%), des tumeurs solides (19,51%), des maladies respiratoires (14,63%), des infections
30 par le VIH (7,32%), des maladies auto-immunes (7,32%). Pour un des patients colonisés, aucune pathologie sous-jacente n’a été retrouvée (2,44%) (tableau 2).
Tableau 2 : Données épidémiologiques des patients
Totalité des patients n = 41 PPC prouvée n = 13 Indéterminé n = 12 Patients colonisés n = 16
Age moyen ± écart-type 60,39 ± 12,42 59,46 ± 12,62 61,33 ± 16,26 60,44 ± 9,43 Sexe masculin / féminin (%) 25 (60,98) /16 (39,02) 7 (53,85) / 6 (46,15) 8 (66,67) / 4 (33,33) 10 (62,50) / 6 (37,50) Pathologies sous-jacentes VIH (%) 3 (7,32) 2 (15,38) 0 (0) 1 (6,25) Hémopathies malignes (%) 13 (31,71) 0 (0) 8 (66,66) 5 (31,25) Tumeurs solides (%) 8 (19,51) 3 (23,08) 0 (0) 5 (31,25) Maladies auto-immunes (%) 3 (7,32) 1 (7,69) 1 (8,33) 1 (6,25) Transplantations rénales (%) 11 (26,83) 6 (46,15) 2 (16,67) 3 (18,75) Maladies respiratoires (%) 6 (14,63) 1 (7,69) 2 (16,67) 3 (18,75) Aucune (%) 1 (2,44) 0 (0) 0 (0) 1 (6,25)
Quatre patients présentaient deux de ces terrains favorisants : une tumeur solide associée à une hémopathie maligne pour deux d’entre eux, un myélome et une pseudo-polyarthrite rhizomélique pour le troisième patient, une greffe rénale et une infection par le VIH pour le quatrième patient.
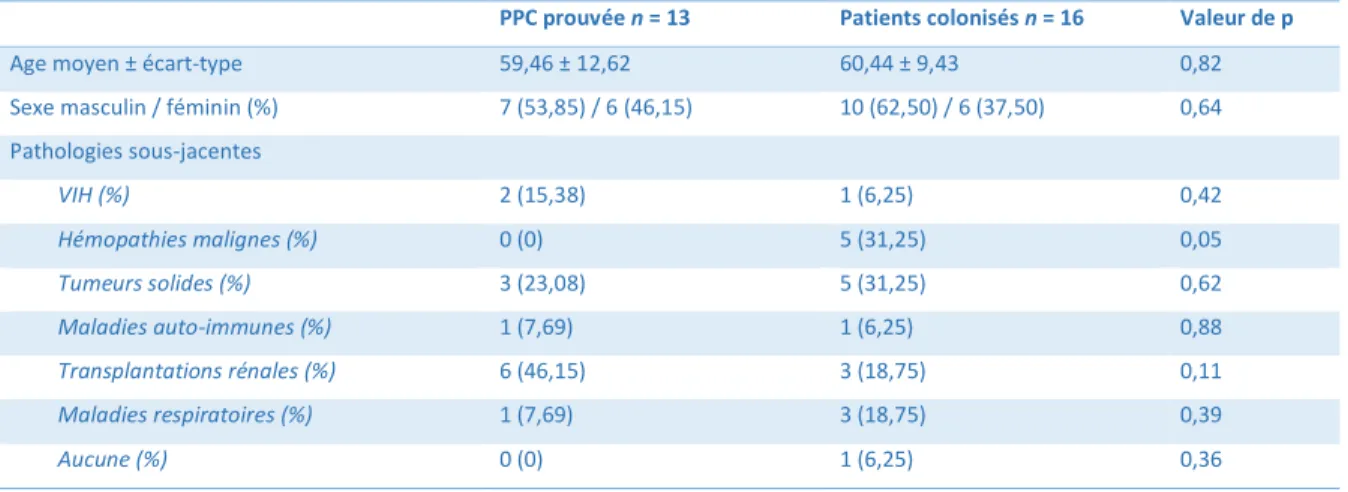
Nous avons ensuite comparé les données des patients des groupes PPC prouvée et colonisation. Aucune différence significative n’a été mise en évidence (tableau 3). Les patients colonisés semblaient toutefois présenter plus d’hémopathies malignes avec des résultats à la limite de la significativité (p=0,05).
Tableau 3 : Comparaison des données épidémiologiques entre les patients présentant une PPC et les patients colonisés
PPC prouvée n = 13 Patients colonisés n = 16 Valeur de p
Age moyen ± écart-type 59,46 ± 12,62 60,44 ± 9,43 0,82 Sexe masculin / féminin (%) 7 (53,85) / 6 (46,15) 10 (62,50) / 6 (37,50) 0,64 Pathologies sous-jacentes VIH (%) 2 (15,38) 1 (6,25) 0,42 Hémopathies malignes (%) 0 (0) 5 (31,25) 0,05 Tumeurs solides (%) 3 (23,08) 5 (31,25) 0,62 Maladies auto-immunes (%) 1 (7,69) 1 (6,25) 0,88 Transplantations rénales (%) 6 (46,15) 3 (18,75) 0,11 Maladies respiratoires (%) 1 (7,69) 3 (18,75) 0,39 Aucune (%) 0 (0) 1 (6,25) 0,36
31 Comparaison des charges fongiques
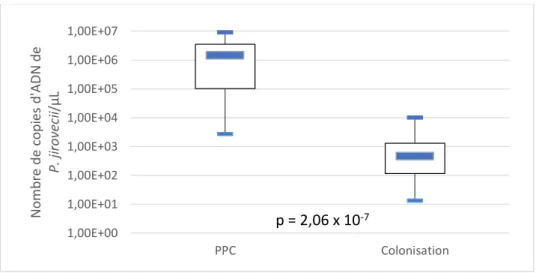
Les résultats de la quantification fongique dans les différentes natures d’échantillons sont présentés en annexe 2. La charge fongique était significativement plus élevée dans les LBA des patients présentant une PPC prouvée que dans ceux des patients colonisés (moyennes : 2,19 x 106 vs. 2,15 x 103 copies d’ADN de P. jirovecii/µL, p=2,06 x 10-7) (figure 7).
Figure 7 : Comparaison de la charge fongique dans les LBA entre le groupe PPC prouvée et le groupe colonisation
La charge fongique était significativement plus élevée dans les échantillons non-LBA des patients présentant une PPC prouvée que dans les échantillons non-LBA des patients colonisés (moyennes : 6,42 x 105 vs. 1,46 x 103 copies d’ADN de P. jirovecii/µL, p=3,26 x 10-6) (figure 8).
Figure 8 : Comparaison de la charge fongique dans les échantillons non-LBA entre le groupe PPC prouvée et le groupe colonisation
1,00E+00 1,00E+01 1,00E+02 1,00E+03 1,00E+04 1,00E+05 1,00E+06 1,00E+07 PPC Colonisation N o mb re d e co p ies d 'AD N d e P . ji ro vec ii/ µ L p = 2,06 x 10-7 1,00E+00 1,00E+01 1,00E+02 1,00E+03 1,00E+04 1,00E+05 1,00E+06 1,00E+07 PPC Colonisation N o mb re d e co p ies d 'AD N d e P . ji ro vec ii/ µ L p = 3,26 x 10-6
32 Parmi les 23 AB initialement recueillies (sept dans le groupe PPC prouvée, six dans le groupe de diagnostic indéterminé, et 10 dans le groupe colonisation), 20 correspondaient à des AB post-LBA, plus riches en matériel alvéolaire que les trois AB prélevées isolément.
Dans ces 20 AB post-LBA, la charge fongique n’était pas significativement différente de celle des échantillons de LBA, quel que soit le groupe de patient (moyennes : 6,32 x 105 vs. 2,72 x
105 copies d’ADN de P. jirovecii/µL, p=4,41 x 10-1) (figure 9).
Figure 9 : Comparaison de la charge fongique dans les échantillons de LBA et d’AB post-LBA
Considérant que ces 20 AB post-LBA et présentaient un intérêt moindre pour cette étude, nous les avons exclues de la suite de ce travail. En effet, notre objectif était de pouvoir interpréter des résultats de qPCR dans les prélèvements respiratoires des patients pour lesquels il est impossible de prélever un LBA, et par extension, impossible d’obtenir une AB post-LBA. Ainsi, nous avons exclu les 20 couples d’échantillons LBA / AB post-LBA. Nous avons par conséquent étudié 27 couples d’échantillons de LBA et de non-LBA sur les 47 couples initiaux. Ces 27 couples avaient été prélevés chez 23 patients dont huit présentaient une PPC (huit LBA et neuf LBA), sept n’avaient pas de diagnostic déterminé (sept LBA et 10 non-LBA) et huit qui étaient colonisés (huit LBA et huit non-non-LBA).
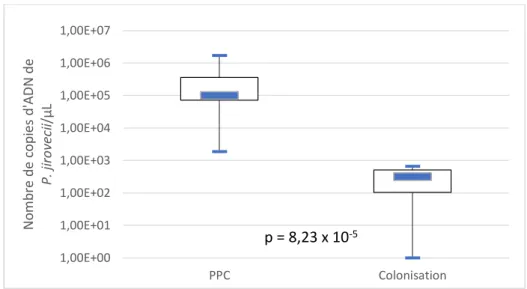
Ainsi, dans les échantillons autres que les LBA et autres que les AB post-LBA, la charge fongique était significativement plus élevée dans les échantillons des patients présentant une PPC prouvée que dans les échantillons des patients colonisés (moyenne : 3,98 x 105 vs. 3,16 x 102
copies d’ADN de P. jirovecii/µL, p=8,23 x 10-5) (figure 10).
1,00E+00 1,00E+01 1,00E+02 1,00E+03 1,00E+04 1,00E+05 1,00E+06 1,00E+07 LBA AB post-LBA N o mb re d e co p ies d 'AD N d e P . ji ro veci i / µ L p = 4,41 x 10-1
33
Figure 10 : Comparaison de la charge fongique des échantillons non-LBA (AB post-LBA exclues) entre le groupe PPC prouvée et le groupe colonisation
Corrélation de la charge fongique entre LBA et échantillons non-LBA
Nous avons montré une corrélation entre la charge fongique des 23 échantillons LBA et celle des 27 échantillons non-LBA leur correspondant (test de Spearman, R2=0,6 et p=2,36 x 10-5).
Cette corrélation nous a permis de modéliser les données obtenues en traçant la droite de régression linéaire concordant avec le nuage de points. L’équation de cette droite a ainsi été utilisée pour matérialiser la relation entre la charge fongique dans les échantillons de LBA et celle dans les échantillons non-LBA (figure 11) :
[ADN P. jirovecii]LBA = 100,7368log([ADN P. jirovecii]nonLBA) + 1,5552
[ADN P. jirovecii]nonLBA = 100,8181log([ADN P. jirovecii]LBA) + 0,0213
où [ADN P. jirovecii]désigne la charge fongique.
1,00E+00 1,00E+01 1,00E+02 1,00E+03 1,00E+04 1,00E+05 1,00E+06 1,00E+07 PPC Colonisation N o mb re d e co p ies d 'AD N d e P. ji ro vec ii/ µ L p = 8,23 x 10-5
34
Figure 11 : Etude de la corrélation de la quantité d’ADN de P. jirovecii entre les échantillons de LBA et les échantillons non-LBA en nombre de copies d’ADN de P. jirovecii/µL ; échelle logarithmique
Détermination de seuils de quantification pour les échantillons non-LBA à l’aide de l’équation de corrélation
L’équation obtenue à l’aide du test de Spearman permet de calculer une charge fongique dans les échantillons non-LBA à partir d’une charge fongique déterminée dans les échantillons de LBA. Ainsi, l’équation a été appliquée aux valeurs seuils validées par le laboratoire pour les LBA : une charge fongique de 1,6 x 103 copies d’ADN/µL dans un échantillon de LBA (seuil
inférieur) serait équivalente à une charge fongique de 4,4 x 102 copies d’ADN/µL dans un
échantillon non LBA. De la même manière, une charge fongique de 2 x 104 copies d’ADN / µL
dans un échantillon de LBA (seuil supérieur) serait équivalente à une charge fongique de 3,5 x 103 copies d’ADN/µL dans un échantillon non LBA.
Dans un second temps, nous avons évalué les performances des seuils définis ci-dessus en réassignant les patients dans les différents groupes en fonction de la charge fongique mesurée dans les échantillons non-LBA. Il nous a également semblé opportun de réévaluer les performances des seuils validés par le laboratoire en réassignant les patients dans les différents groupes en fonction de la charge fongique mesurée dans les échantillons de LBA (figures 12 et 13). y = 0,7368x + 1,5552 x = 0,8181y + 0,0213 R² = 0,6028 1 2 3 4 5 6 7 0 1 2 3 4 5 6 7 L BA
Non LBA sauf AB post-LBA
35
PX : patient du groupe PPC selon les critères de l’étude
PX : patient du groupe colonisation selon les critères de l’étude
PX : patient du groupe indéterminé selon les critères de l’étude Cercle rouge : groupe PPC selon le résultat de la qPCR dans le non-LBA Cercle bleu : groupe colonisation selon le résultat de la qPCR dans le non-LBA
Croisement des deux cercles : groupe indéterminé selon le résultat de la qPCR dans le non- LBA
AB : aspiration bronchique, ENP : écouvillon naso-pharyngé, ES : expectoration spontanée, PPC : pneumonie à Pneumocystis ; PTP : prélèvement trachéal protégé, ROP : rinçage oro- pharyngé.
Figure 12 : Classement des patients en fonction de la charge fongique dans les échantillons non-LBA
PX : patient du groupe PPC selon les critères de l’étude
PX : patient du groupe colonisation selon les critères de l’étude
PX : patient du groupe indéterminé selon les critères de l’étude Cercle rouge : groupe PPC selon le résultat de la qPCR dans le LBA Cercle bleu : groupe colonisation selon le résultat de la qPCR dans le LBA
Croisement des deux cercles : groupe indéterminé selon le résultat de la qPCR dans le LBA
Figure 13 : Classement des patients en fonction de la charge fongique dans les échantillons de LBA
P1 P2 P7 P8 P11 P13 P18 P4 P10 P16 P24 P25 P30 P14 P15 P23 P26 P29 P33 P35 P37 P40 P41 P1-AB P2-ES P7-ES P8-ES P10-PTP P11-ES P13-ES /P13-AB P23-ES P25-AB P4-ENP P16-ES / P16-PTP P30-ES P35-ES P37-ES P14-ES / P14-PTP P15-PTP P18-ES P24-ES P25-ROP P26-PTP P29-PTP P33-ES P40-PTP P41-PTP
36 Selon les critères définis dans l’étude, huit patients présentaient une PPC prouvée. En appliquant les seuils ici pour les échantillons non LBA, la PPC aurait été diagnostiquée pour sept d’entre eux. En appliquant les seuils validés par le laboratoire pour les LBA, elle aurait été diagnostiquée pour six d’entre eux.
De la même manière, huit patients étaient classés dans le groupe colonisation. En appliquant les seuils ici définis pour les échantillons non LBA, la colonisation aurait été diagnostiquée pour cinq d’entre eux. En appliquant les seuils validés par le laboratoire pour les LBA, elle aurait été diagnostiquée pour sept d’entre eux.
37
Discussion
Nous avons montré dans un premier temps que les patients avec une PPC prouvée présentaient une charge fongique significativement plus importante que les patients colonisés, que ce soit dans les échantillons de LBA et de non-LBA. Ces résultats étaient attendus et concordent avec les données de la littérature (30,34,36,44–46,49–53,57). Cependant, l'interprétation de la charge fongique, déterminée par qPCR, reste un défi. C’est pourquoi de plus en plus d’équipes proposent d’utiliser des valeurs seuils de qPCR pour aider à distinguer les diagnostics de PPC et de colonisation (34,39,46,48,49). Les seuils décrits dans la littérature et définis pour les échantillons de LBA sont pourtant difficilement comparables entre eux, dans la mesure où les gènes cibles et les technologies employés pour les déterminer
diffèrent en fonction des équipes (30,34,46,49,57). Dans ce contexte, le laboratoire de
Parasitologie et Mycologie Médicales du CHU Amiens-Picardie a validé ses propres seuils dans des échantillons de LBA à l’aide d’un travail portant sur une cohorte de 46 patients, dont 17 patients présentaient une PPC et 29 patients étaient colonisés (53). Le seuil inférieur de 1,6 x
103 et le seuil supérieur de 2 x 104 copies d’ADN de P. jirovecii/µL permettaient d’obtenir
respectivement une sensibilité et une spécificité de 100% pour le diagnostic de PPC. En pratique, la quantification de la charge fongique et l’interprétation de cette quantification sont réalisées sur tout échantillon de LBA pour lequel un signal positif a été détecté en PCR. En revanche, dans la mesure où le laboratoire ne dispose pas de seuils d’interprétation pour les échantillons d’une autre nature, la quantification de la charge fongique n’est pas réalisée. Cependant, le caractère invasif et les contre-indications inhérentes à la pratique du LBA ne permettent pas toujours de recueillir un échantillon riche en matériel alvéolaire pour la détection de P. jirovecii. De plus, un signal positif obtenu en PCR pour un échantillon issu des voies aériennes supérieures reflète probablement une charge fongique plus importante au sein des alvéoles pulmonaires (58).
Ainsi, certains auteurs ont cherché à déterminer des seuils de quantification en qPCR dans les échantillons autres que les LBA. L’étude de Larsen et al. portait sur 52 ROP et établissait un seuil d’interprétation unique à 50 copies/5µL d’ADN, obtenant une sensibilité et une spécificité égales respectivement à 70% et 100% (26). Fujisawa et al. ont défini un seuil unique de 30 copies/10µL d’ADN en ciblant le gène de la MSG dans 86 EI, obtenant une sensibilité et
38 une spécificité respectivement égales à 82,4% et 98,6% (52). L’étude de Matsumura et al. portait sur 36 LBA et EI, indistinctement. Un seuil unique de 1300 copies/mL a été déterminé en amplifiant le gène de la DHPS et permettait d’obtenir une sensibilité et une spécificité respectivement égales à 80% et 100% (34). Plus récemment, quelques équipes ont préféré déterminer deux seuils afin d’obtenir une sensibilité et une spécificité de 100% et améliorer ainsi les performances du test. Cependant, seules deux équipes se sont intéressées aux échantillons autres que les LBA (30,49). L’équipe d’Alanio a déterminé des seuils après amplification du gène de la mtLSU rRNA dans 278 échantillons de LBA et EI (49), leur permettant d’obtenir d’une sensibilité et d’une spécificité égales à 100% en appliquant respectivement les seuils de 120 et 1900 équivalents formes trophiques/mL. L’équipe de Maillet a examiné une plus petite cohorte de 35 échantillons de LBA et AB (30). Après amplification du gène de la MSG, les seuils définis permettant d’obtenir une sensibilité et une spécificité de 100% étaient de 3160 et 31600 copies/mL. Cependant, ces deux équipes n’ont pas distingué les échantillons de LBA des autres échantillons et il est difficile de concevoir qu’un même seuil d’interprétation puisse être appliqué indifféremment.
Parallèlement, un projet de recherche clinique multicentrique auquel le CHU Amiens-Picardie participe a récemment été initié par le CHU de Rennes. Ce projet vise à évaluer les performances de la qPCR dans les ROP de patients non infectés par le VIH pour établir le diagnostic de PPC. L’objectif est de définir des seuils d’interprétation dans les ROP, et de proposer, pour les cas de PPC possible, un arbre décisionnel incluant des paramètres cliniques et biologiques.
Au total, peu d’équipes ont essayé d’établir des seuils d’interprétation dans les échantillons respiratoires autres que les échantillons de LBA. De plus, la disparité des techniques et des gènes cibles utilisés ne nous permettait pas de transposer les seuils définis par ces équipes à notre propre technique de qPCR.
La détermination de seuils dans les échantillons non-LBA est pourtant un enjeu important pour le laboratoire de Parasitologie et Mycologie Médicales du CHU Amiens-Picardie. Deux étudiantes en médecine ont effectué des travaux de recherche dans le cadre d’un stage de Master 1 dans le service. Le premier travail, effectué en 2013, s’appliquait à déterminer deux seuils d’interprétation de la charge fongique dans 14 échantillons non-LBA afin d’établir un diagnostic de PPC avec une sensibilité et une spécificité égales à 100%. L’utilisation d’un seuil
39 inférieur à 1,4 x 103 et d’un seuil supérieur à 3,2 x 103 copies d’ADN/µL avait permis de retenir
le diagnostic de PPC pour cinq des sept patients initialement assignés à ce groupe et permis d’exclure le diagnostic de PPC pour trois des sept patients initialement assignés au groupe de colonisation. Le second travail, effectué en 2014, avait porté sur 56 échantillons non-LBA provenant de 56 patients. L’utilisation d’un seuil inférieur à 1,2 x 104 et d’un seuil supérieur à
6,8 x 104 copies d’ADN/µL avait permis de retenir le diagnostic de PPC pour 16 des 25 patients
initialement assignés à ce groupe et permis d’exclure le diagnostic de PPC pour 20 des 31 patients initialement assignés au groupe de colonisation. La discordance des seuils déterminés dans ces travaux peut s’expliquer par la définition imprécise des critères d’inclusion : la positivité de l’examen direct n’était pas un critère obligatoire pour être assigné au groupe PPC, de même que l’absence de traitement anti-Pneumocystis n’était pas nécessaire pour appartenir au groupe colonisation. Nous ne pouvons donc pas exclure l’hypothèse que des patients aient été assignés au mauvais groupe. Il était alors nécessaire de réévaluer les données issues de ces travaux. Dans le présent travail, la définition stricte des critères d’inclusion permet de renforcer la fiabilité des seuils d’interprétation définis. Cela souligne l’importance d’avoir analysé conjointement les échantillons de LBA et de non LBA.
Cette analyse conjointe a également permis de corréler les charges fongiques dans les couples d’échantillons obtenus chez le même patient puis d’en déduire des seuils d’interprétation pour les échantillons non-LBA. A notre connaissance, aucune équipe ne s’est attelée à rechercher une telle corrélation. En effet, les seuils d’interprétation présentés dans la littérature ont tous été calculés à partir de la construction d’une courbe ROC (26,30,34,36,39,45–47,49–53). Notre travail est innovant dans la mesure où la recherche d’une corrélation et par conséquent le calcul des seuils étaient indépendants du groupe auquel était assigné le patient.
Dans un second temps, nous avons évalué à la fois les seuils définis dans ce travail pour les échantillons non-LBA et les seuils préalablement définis pour les échantillons de LBA et utilisés en routine au laboratoire. Pour cela, nous avons réassigné les patients dans les différents groupes en fonction de la charge fongique dans chacun des échantillons du couple.
Aucun patient initialement assigné au groupe des PPC prouvées n’était réassigné au groupe des colonisations, confirmant ainsi que les seuils inférieurs définis à la fois pour les échantillons de non-LBA et ceux de LBA présentent une sensibilité de 100% pour le diagnostic
40 de PPC. De la même manière, aucun patient initialement assigné au groupe des colonisations n’était réassigné au groupe des PPC prouvées, confirmant ici que les seuils supérieurs définis pour les deux types d’échantillons présentent une spécificité de 100% pour le diagnostic de PPC.
Un seul (P4) des huit patients présentant une PPC prouvée et un seul (P30) des huit patients colonisés avaient été réassignés dans le groupe de diagnostic indéterminé sur la mesure de la charge fongique dans chacun de leurs deux types d’échantillon. Un autre patient présentant une PPC prouvée (P10) avait lui aussi été réassigné dans le groupe de diagnostic indéterminé sur la seule mesure de la charge fongique dans son échantillon de LBA. Deux autres patients colonisés (P35 et P37) avait eux aussi été réassignés dans le groupe de diagnostic indéterminé sur la seule mesure de la charge fongique dans leur échantillon de non-LBA.
Diverses hypothèses peuvent être émises pour expliquer ces discordances ; en particulier, l’échantillon non-LBA du patient P4 était un ENP, considéré comme prélèvement superficiel, le moins adapté à la détection de P. jirovecii (59). D’autre part, les discordances observées entre les deux échantillons d’un même couple pour les patients P35 et P37 peuvent s’expliquer par une fluctuation de la charge fongique liée à un intervalle prolongé (10 et 17 jours respectivement) entre le recueil de ces deux échantillons.
Parmi les sept patients initialement assignés au groupe de diagnostic indéterminé, la mesure de la charge fongique évoquait une colonisation dans chaque type d’échantillon pour deux d’entre eux (P14 et P15). En revanche, elle n’a pas permis d’apporter d’arguments supplémentaires en faveur de l’un ou l’autre diagnostic pour les autres patients de ce groupe. Par ailleurs, il est intéressant de constater que la charge fongique mesurée dans les échantillons de non-LBA des patients P23 et P25 permettait de les assigner au groupe des PPC. A l’inverse, celle mesurée dans leurs échantillons de LBA permettait de les assigner au groupe des colonisations. Il est toutefois important de noter que chez ces patients, le recueil des échantillons de non-LBA avait été réalisé avant l’instauration d’un traitement
anti-Pneumocystis, alors que le recueil du LBA avait eu lieu 48 heures après.
Quoiqu’il en soit, l’ensemble de ces données souligne les limites d’un résultat biologique considéré de manière isolée. En effet, lorsque le résultat se situe dans une zone d’incertitude,
41 entre les deux seuils définis, il est capital de l’intégrer dans une démarche clinico-biologique globale.
42
Conclusion
Ce travail innovant a permis de définir des seuils de quantification de P. jirovecii dans des échantillons respiratoires recueillis de manière moins invasive qu’un LBA. Ces données pourront à terme aider le biologiste dans sa démarche globale d’interprétation des résultats. Plusieurs points doivent pourtant être soulignés. En effet, notre travail a montré que la charge fongique pouvait fluctuer rapidement, en particulier après l’instauration d’un traitement
anti-Pneumocystis ; l’interprétation des résultats apparait impossible chez un patient traité, et par
conséquent impossible en l’absence de renseignements cliniques. Malgré ces restrictions, il est important de noter qu’aucun cas de PPC n’a été interprété comme une colonisation et de la même manière, qu’aucune colonisation n’a été interprétée en tant que PPC. C’est pour cette raison que nous avons pu confirmer une sensibilité et une spécificité de 100% aux seuils définis pour le diagnostic de PPC, tant dans les échantillons de LBA que dans les échantillons d’une autre nature.
Cette étude ouvre la voie à de nouveaux travaux sur le cheminement le plus approprié pour conduire au diagnostic de PPC lorsque l’état clinique du patient ne permet pas la réalisation d’un LBA.
Il est toutefois essentiel de garder à l’esprit que ces seuils d’interprétation ne sont qu’une aide pour le biologiste, qu’un résultat biologique ne peut à lui seul permettre de guider la prise en charge d’un patient infecté par P. jirovecii et que le dialogue entre le clinicien et le biologiste reste une étape indispensable.
43
Annexes
Annexe 1 : Recueil de données cliniques, radiologiques et biologiques des 41 patients de l’étude
Patient Sexe Age Pathologie
sous-jacente
Diagnostic retenu par le service clinique
Traitement anti-Pneumocystis et date de début
Evolution Date du LBA Date de l'ES Date de l'AB Date du PTP Date du ROP Date de l'ENP
P1 M 67 CHC PPC cotrimoxazole
04/09/2015
Favorable 07/09/2015 NR 04/09/2015 NR NR NR
P2 M 66 Cancer œsophagien PPC cotrimoxazole 22/12/2015
Favorable 18/12/2015 21/12/2015 NR NR NR NR
P3 M 66 Greffe rénale PPC cotrimoxazole 29/03/2016
Favorable 29/03/2016 NR 29/03/2016 NR NR NR
P4 F 64 PR sous CC PPC atovaquone
18/03/2016
Favorable 18/03/2016 NR NR NR NR 17/03/2016
P5 M 57 Greffe rénale PPC cotrimoxazole 27/04/2016
Favorable 26/04/2016 NR 26/04/2016 NR NR NR
P6 F 36 Greffe rénale PPC cotrimoxazole 15/04/2016 Favorable 15/04/2016 NR 15/04/2016 NR NR NR P7 M 49 VIH PPC atovaquone 24/02/2015 puis cotrimoxazole Favorable 24/02/2015 20/02/2015 NR NR NR NR P8 F 37 VIH et toxoplasmose cérébrale PPC atovaquone 20/11/2012 NP 19/11/2012 16/11/2012 NR NR NR NR
P9 F 66 Greffe rénale PPC cotrimoxazole 27/03/2012
Décès J+137
28/03/2012 NR 28/03/2012 NR NR NR
P10 M 76 Greffe rénale PPC cotrimoxazole 16/02/2016
Favorable 15/02/2012 NR NR 15/02/2012 NR NR
P11 F 59 Sarcoïdose pulmonaire sous CC et MTX
PPC cotrimoxazole 13/09/2011
Favorable 09/09/2011 10/09/2011 NR NR NR NR
P12 M 75 Cancer bronchique PPC cotrimoxazole 29/07/2016
Favorable 29/07/2016 NR 29/07/2016 NR NR NR
P13 F 55 Greffe rénale PPC cotrimoxazole 03/08/2016
Favorable 05/08/2016 03/08/2016 04/08/2016 NR NR NR
P14 M 81 Lymphome T PPC cotrimoxazole 27/08/2015
44
Patient Sexe Age Pathologie
sous-jacente
Diagnostic retenu par le service clinique
Traitement anti-Pneumocystis et date de début
Evolution Date du LBA Date de l'ES Date de l'AB Date du PTP Date du ROP Date de l'ENP
P15 M 64 AREB-2 Colonisation, PNP bactérienne cotrimoxazole du 23/08/2015 au 01/09/2015 Décès J+57 22/08/2015 NR NR 24/08/2015 NR NR P16 M 80 Myélome et PPR sous CC PPC cotrimoxazole, NP Décès J+13 05/10/2015 02/10/2015 NR 05/10/2015 NR NR P17 F 68 Myélome PPC et PNP bactérienne cotrimoxazole 30/12/2015 Favorable 29/12/2015 NR 29/12/2015 NR NR NR P18 F 27 LAL B, Greffe de MO PPC cotrimoxazole 14/04/2016 NP 15/04/2016 08/04/2016 NR NR NR NR P19 F 65 Fibrose pulmonaire Sous IS et CC PPC cotrimoxazole 10/04/2016 Favorable 08/04/2016 NR 08/04/2016 NR NR NR P20 M 39 Leucémie bi-phénotypique, greffe de MO PPC cotrimoxazole 23/05/2016 Décès J+21 17/05/2016 NR 17/05/2016 NR NR NR P21 M 75 Tabagisme chronique PPC et PNP bactérienne cotrimoxazole 12/12/2014 Favorable 23/10/2014 NR 23/10/2014 NR NR NR P22 M 48 LH PPC cotrimoxazole 31/07/2014 Décès J+52 31/07/2014 NR 31/07/2014 NR NR NR P23 F 57 LAL PPC cotrimoxazole 23/02/2013 Décès J+169 25/02/2013 21/02/2013 NR NR NR NR P24 M 67 Greffe rénale PPC et PNP bactérienne cotrimoxazole 09/01/2012 Favorable 06/01/2012 05/01/2016 NR NR NR NR
P25 M 65 Greffe rénale PPC cotrimoxazole 23/07/2016
Favorable 25/07/2016 NR 20/07/2016 NR 25/07/2016 NR
P26 M 69 Cancer bronchique Colonisation, PNP bactérienne - Décès J+27 26/10/2015 NR 26/10/2015 26/10/2015 NR NR P27 F 62 PNP infectieuses à répétition Colonisation, PNP bactérienne - Favorable 15/12/2015 NR 15/12/2015 NR NR NR
P28 M 62 Greffe rénale Colonisation, PNP bactérienne
- Favorable 17/12/2015 NR 17/12/2015 NR NR NR
P29 M 56 Lymphome B Décès suite à un SDRA - Décès J+3 13/12/2015 NR NR 16/12/2015 NR NR
P30 M 66 Ostéosarcome Colonisation, PNP bactérienne
- Favorable 02/12/2015 01/12/2015 NR NR NR NR
P31 F 68 Greffe rénale Colonisation, OAP hypertensif
- Favorable 11/01/2016 NR 11/01/2016 NR NR NR
P32 M 50 LAM Colonisation, API - Favorable 19/01/2016 NR 19/01/2016 NR NR NR
P33 M 78 SMD Cancer prostatique Colonisation, PNP bactérienne - Décès J+3 27/05/2016 27/05/2016 27/05/2016 NR NR NR P34 M 53 LAM 2 allogreffe de moelle Colonisation, PNP à CMV et API - Favorable 14/04/2014 NR 14/04/2014 NR NR NR
45
Patient Sexe Age Pathologie
sous-jacente
Diagnostic retenu par le service clinique
Traitement anti-Pneumocystis et date de début
Evolution Date du LBA Date de l'ES Date de l'AB Date du PTP Date du ROP Date de l'ENP
P35 F 55 Sd dysimmunitaire bicytopénie Colonisation, PNP bactérienne - Favorable 11/06/2013 01/06/2013 NR NR NR NR P36 M 56 LAM 4 Colonisation, Bactériémie - Décès J+160 12/07/2013 NR 12/07/2013 NR NR NR P37 F 53 VIH Greffe rénale Colonisation, PNP bactérienne - Favorable 09/07/2013 22/06/2013 NR NR NR NR P38 F 46 Aucune Colonisation, PNP bactérienne - Favorable 24/03/2015 NR 24/03/2015 NR NR NR
P39 M 66 Cancer bronchique Colonisation, Abcès pulmonaire bactérien - Favorable 20/04/2012 NR 20/04/2012 NR NR NR P40 F 51 BPCO Colonisation, PNP bactérienne, API - Favorable 08/06/2016 NR NR 08/06/2016 NR NR P41 M 76 BPCO Colonisation, EP - Favorable 13/06/2016 NR NR 13/06/2016 NR NR
API : aspergillose pulmonaire invasive ; AREB : anémie régénérative avec excès de blastes ; BDG : β-D-glucane ; BPCO : broncho-pneumopathie chronique obstructive ; CC : corticoïdes ; CMV : cytomégalovirus ; EP : embolie pulmonaire ; F : femme ; H : homme ; IS : immunosuppresseurs ; LAL : leucémie aigüe lymphoïde ; LAM : leucémie aigüe myéloïde ; LH : lymphome de Hodgkin ; MO : moelle osseuse ; NP : non précisé ; NR : non réalisé ; PPC : pneumonie à Pneumocystis ; PNP : pneumopathie ; SMD : syndrome myélodysplasique ; VIH : virus de l’immunodéficience humaine.