Sécurisation du circuit des médicaments de thérapie génique en essais cliniques : application d’une analyse préliminaire des risques sein de l’Institut Universitaire du Cancer de Toulouse - Oncopole
Texte intégral
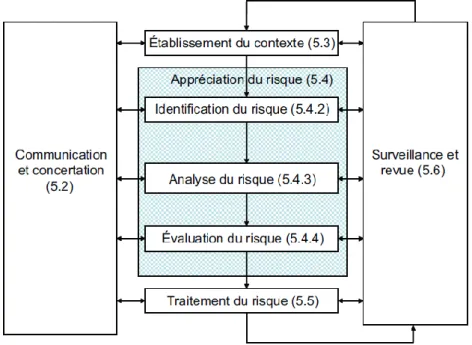
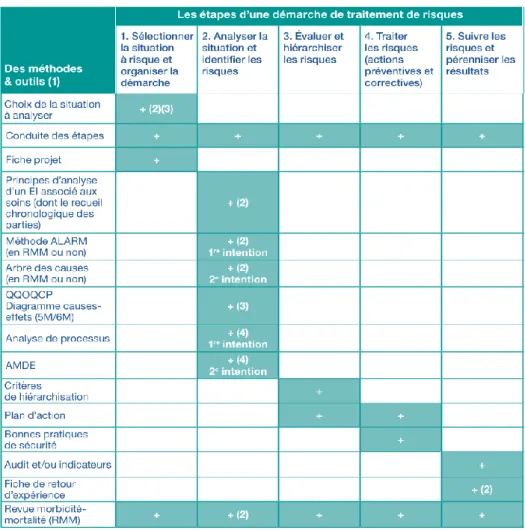
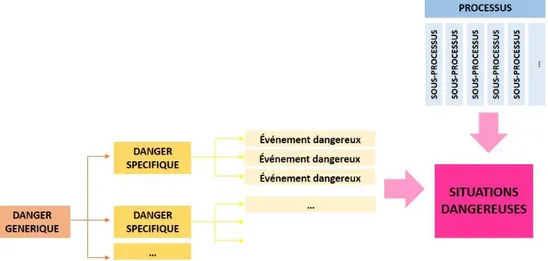
Figure
Documents relatifs
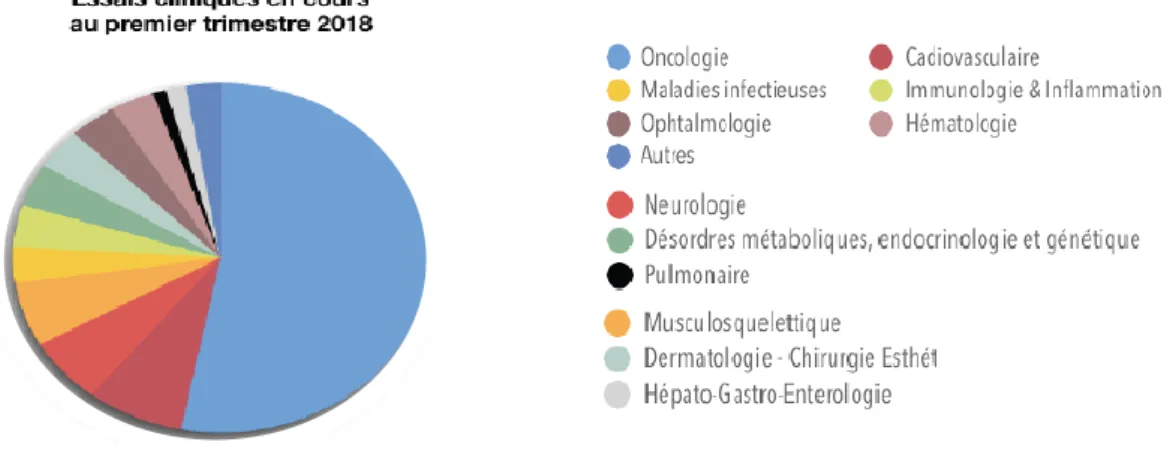
Quatre essais sont actuellement en cours, trois autres demandes (pour l'instant stade préclinique) sont actuellement étudiées et les premiers résultats sont
To address the therapy to cancer cells without affecting healthy cells, a model of endothelial precursor cell (EPCs) was used as targeting cell able to reach specifically
• Application de la thérapie cellulaire et génique au traitement du syndrome cutané radio-induit.. • Cellules souches d’origine adipocytaire autologues et allogéniques
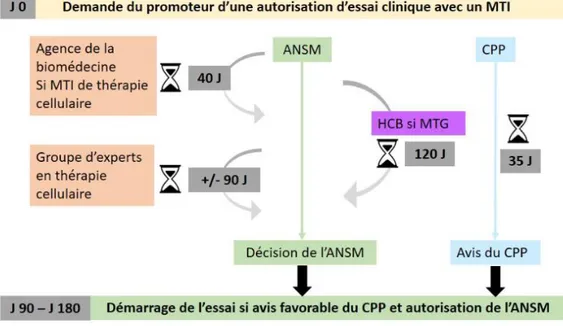
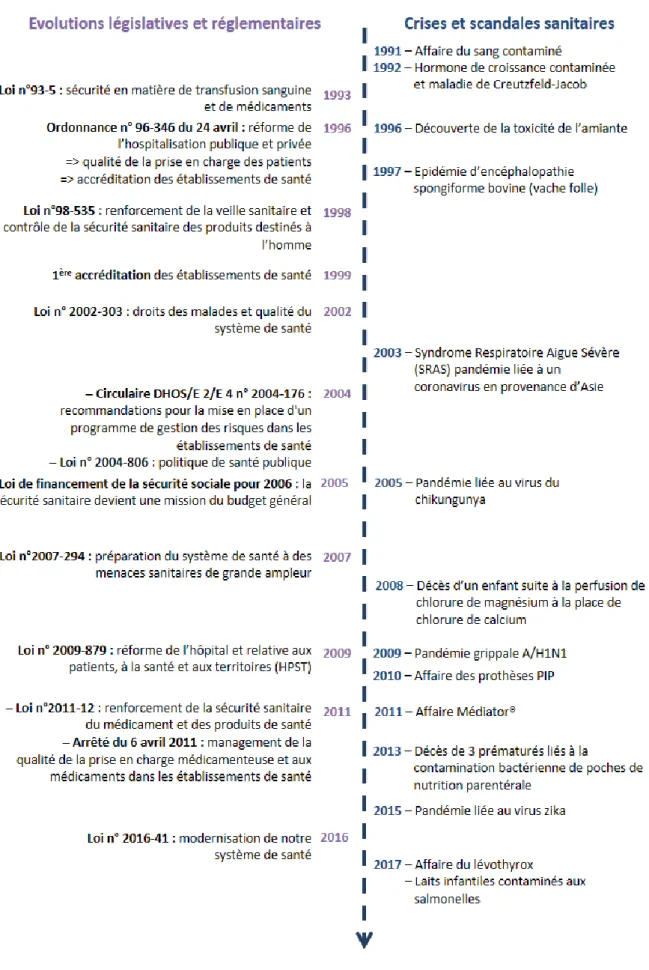
La réglementation française prévoit deux possibilités de développement des produits de thérapie génique, afin de contrôler l’utilisation de ces pro- duits dans l’intérêt de
De nombreux essais ont été réalisés dans des modèles tumoraux murins, avec des gènes codant pour des molécules de membrane impliquées dans la présentation de l'antigène ou
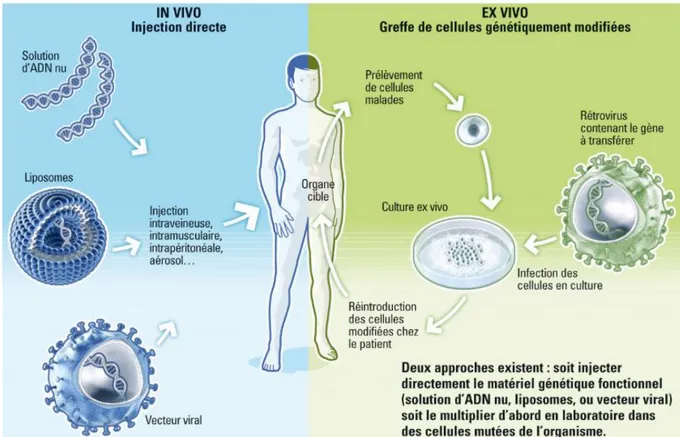
Seule la thérapie génique somatique semble adaptée au traitement des malades : elle peut être pratiquée, selon les affections, par autogreffe de cellules
L'infection directe de l'organisme à l'aide d'un virus recombinant permet d'effectuer une thérapie génique dans des types cellulaires que l'on ne peut isoler et maintenir
tion de la transcription : la séquence de Shine Dalgarno, indispensable à la fixation des ribosomes bactériens au mes sager, et donc à sa traduction ; un