Suivi d’abeilles domestiques et de pollinisateurs
indigènes lors des semis de cultures traitées aux
néonicotinoïdes.
Mémoire
OLIVIER SAMSON-ROBERT
Maîtrise en biologie végétale
Maître ès sciences (M. Sc.)
Québec, Canada
Résumé
Les insecticides néonicotinoïdes, qui sont omniprésents en agriculture, sont un des principaux facteurs impliqués dans le déclin des populations d’abeilles domestiques et d’autres pollinisateurs sauvages. Dans cette étude, nous avons évalué les impacts des traitements de semences néonicotinoïdes sur le niveau de mortalité des abeilles domestiques, l’intoxication du bourdon fébrile (par le suivi d’un biomarqueur, acétylcholinestérase ou AChE) ainsi que sur la contamination de l’eau. Les résultats démontrent qu’à proximité des semis de maïs traités à l’insecticide le niveau de mortalité des colonies d’abeilles domestiques est quadruplé et le niveau d’AChE des bourdons est également plus élevé. Le projet a également permis de confirmer que les flaques d’eau à la surface des champs sont une nouvelle voie d’intoxication potentielle pour les abeilles. Ces résultats démontrent les nombreux impacts de l’utilisation massive des traitements de semences néonicotinoïdes et met en évidence le rôle essentiel qu'ils jouent dans l’actuel déclin des pollinisateurs.
Abstract
Neonicotinoid insecticides, which are ubiquitous in agriculture, are one of the main factors involved in the recent decline of honey bees’ and native pollinators’ populations. In this study, we evaluated the impact of neonicotinoid seed treatments on honey bee mortality levels, bumble bees intoxication (through monitoring of acetylcholinesterase (AChE) as a biomarker) and water contamination. The results show that honey bee mortality level is quadrupled and that AChE levels of bumble bees are higher when living and foraging in a pesticide-treated corn-dominated environment. The project also confirmed that puddles of water at the surface of corn fields are a new potential route of intoxication for bees. These results demonstrate the harmful impact of the widespread use of neonicotinoid seed treatments and highlight the key role they play in the current pollinators’ decline.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... xi
Liste des figures ... xiii
Remerciements ... xvii
Avant-Propos ... xix
Introduction générale ... 1
Chapitre 1 : État des connaissances ... 3
1.1 La pollinisation ... 5
1.1.1 Un service écosystémique précieux ...5
. . L’i po ta e elative de l’a eille ...6
. Pe tes de olo ies d’a eille do esti ue ... 7
1.2.1 Les parasites et pathogènes ...8
1.2.1.1 La varroase ... 8
1.2.1.2 Les acariens trachéaux ... 8
1.2.1.3 Le petit coléoptère de la ruche ... 9
1.2.1.4 La fausse-teigne ... 9
1.2.1.5 La loque... 10
1.2.1.6 La nosémose ... 10
1.2.1.7 Les virus ... 10
1.2.2 Les pratiques apicoles ... 11
. . L’affai lisse e t gé éti ue ... 11
1.2.4 Intensification des pratiques agricoles ... 12
1.2.5 Le rôle des insecticides ... 12
1.3 Les néonicotinoïdes... 13
1.3.1 Origine et utilisation actuelle ... 13
1.3.2 Nouvelles propriétés, nouvelles possibilités ... 14
. . Mode d’a tio ... 14
. . Ris ues pou l’e vi o e e t ... 16
. . . L’air ... 16
1.3.3.2 Le sol ... 16
. . . L’eau ... 17
. . . Les da gers pour l’abeille ... 18
. . . De ultiples voies d’expositio ... 21
1.3.5 Le risque pour les pollinisateurs ... 27
. .6 Les éo i oti oïdes et l’a tualité ... 28
1.3.7 Contexte agricole québécois ... 28
. .7. A pleur de l’utilisation ... 28
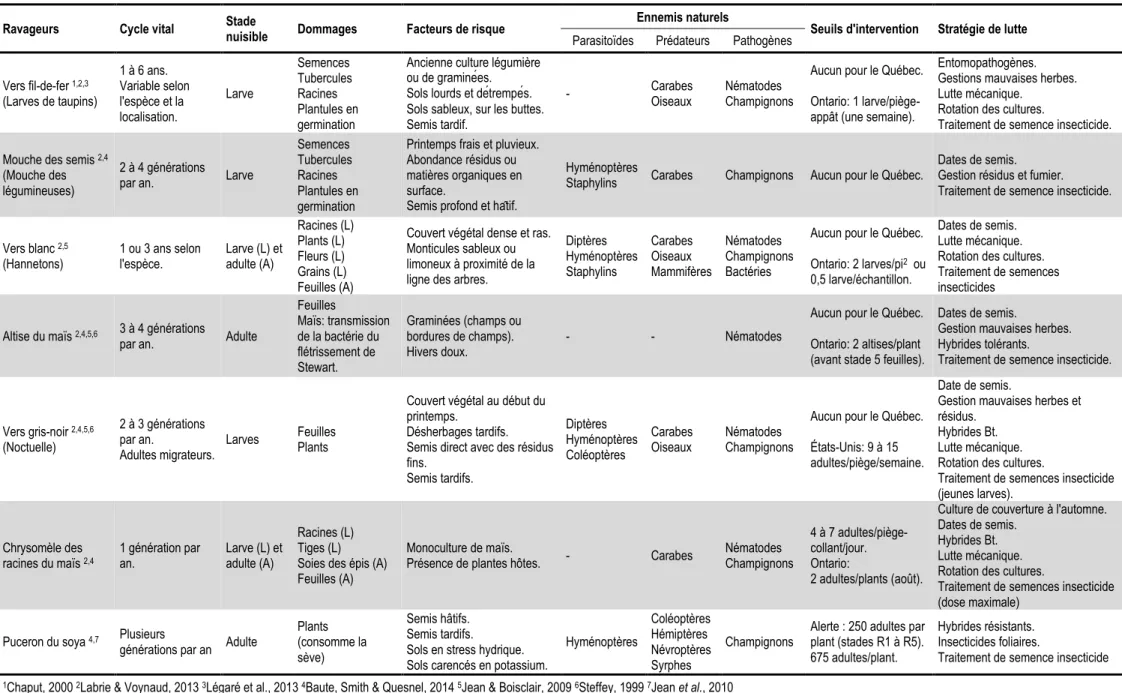
1.3.7.2 Les insectes ravageurs ... 29
1.4 Problématique ... 31
1.5 Objectifs et hypothèses de recherche ... 32
1.5.1 Objectif général ... 32
1.5.2 Premier volet ... 32
1.5.3 Second volet ... 33
1.5.4 Troisième volet ... 33
1.6 Approche méthodologique ... 34
Chaptire II : Honey Bee Mortality in Bee Yards Increases During Nearby
Neonicotinoid-Coated Corn Sowing: A Field Study under Natural Conditions. ... 35
Résumé ... 37
Abstract ... 39
Introduction ... 40
Materials and Methods ... 41
Ethics Statement ... 41
Experimental Setting ... 41
Honey Bee Colonies ... 42
Mortality Index ... 42 Chemical analysis ... 42 Circumstantial investigations ... 43 Statistical Analysis ... 43 Results ... 44 Mortality Index ... 44
Multi-residue analyses of dead honey bees ... 44
Discussion ... 45
Conclusion ... 47
Acknowledgments ... 48
References ... 48
Appendices ... 52
Chapitre III : Neonicotinoid-Contaminated Puddles of Water Represent a Risk of
Intoxication for Honey Bees. ... 57
Résumé ... 59
Introduction ... 63
Materials and methods ... 65
Ethics Statement ... 65
Study Area ... 65
Field water puddles ... 65
Chemical analyses ... 66
Conversions and risk evaluation ... 67
Results ... 68
Multiresidue analyses of puddle water ... 68
Risk assessment of neonicotinoid insecticides in water ... 69
Discussion ... 69
Neonicotinoid residues in puddles of water ... 70
Implications and flaws of risk assessment ... 70
Occurrence of water puddles and relative importance to honey bees ... 72
Conclusions ... 72
Acknowledgments ... 73
References... 73
Appendices ... 83
Chapitre IV : Increased Acetylcholinesterase Expression in Bumble Bees During
Neonicotinoid-Coated Corn Sowing. ... 87
Résumé ... 89
Abstract ... 91
Introduction ... 93
Materials and methods ... 95
Experimental setting ... 95
Bumble bee colonies ... 95
Brain dissection ... 96 AChE assays ... 96 Statistical analysis ... 97 Results ... 97 Discussion ... 98 Conclusion ... 101 Acknowledgments ... 101 References... 102 Appendices ... 109
Chapitre V : Conclusion générale ... 111
Liste des tableaux
Tableau 1. Persistance des néonicotinoïdes dans les sols aérobiques. ... 17 Tableau 2. Dose létale médiane topique et orale des insecticides néonicotinoïdes envers l'abeille. ... 20 Tableau 3. Synthèse d'information sur les principaux insectes ravageurs du maïs et du soya ciblés par les traitements de semence néonicotinoïdes au Québec. ... 30 Table 4. ANOVA table from the analysis of the mortality index for both years combined. ... 52 Table 5. Pesticide concentrations found in dead honey bees collected in front of colonies in control groups (neonicotinoid-free agricultural environment) during corn planting... 53 Table 6. Pesticide concentrations found in dead honey bees collected in front of colonies in exposed groups (neonicotinoid-dominated environment) during corn planting. ... 54 Table 7. Aggravating factors implicated in the 58 (N) high honey bee mortality events that occurred during the 2012 and 2013 corn planting periods. ... 55 Table 8. Pesticide concentrations found in puddle water samples taken from corn fields in 2012 and 2013, when planting was in progress. ... 83 Table 9. Pesticide concentrations found in puddle water samples taken from corn fields one month after planting was completed (in 2013). ... 84 Table 10. Risk assessment of puddle water during corn planting and one month after completion (2012-2013). ... 85 Table 11. Number of samples that were collected on-site, had at least 10 bumble bee foragers or used in qPCR analyses based on RNA integrity... 109 Table 12. ANOVA table from the analysis of AChE levels for both years combined... 109
Liste des figures
Figure 1. Index of foragers’ mortality within honey bee colonies over 48 hour periods during the corn planting season. ... 52 Figure 2. AChE relative quantity in bumble bee heads as obtained from RealTime qPCR analyses (n=32 for control and n=52 for exposed) for both years combined (F1,21 = 9.274, p = 0. 006**).. ... 109
Remerciements
Je tiens tout d’abord à remercier ma directrice Valérie Fournier, ma codirectrice Geneviève Labrie ainsi que Madeleine Chagnon de m’avoir offert votre disponibilité, votre soutien, votre expérience, vos conseils, qui ont été nombreux et importants et, par-dessous tout, votre confiance tout au long de mon parcours. Vous avez partagé avec moi vos passions et m’avez initié au monde de la recherche.
Je désire aussi exprimer ma reconnaissance envers mes collègues Amélie Gervais, Johanne Méthod, Andrée Rousseau, Martine Bernier et Étienne Normandin. Vous avez répondu présent dans les moments où il me fallait décrocher et me changer les idées, tout comme vous avez souffert avec moi lorsqu’il fallait travailler et garder le sérieux. Vous avez contribué, chacun à votre façon, à faire de ma maîtrise une expérience inoubliable.
Je tiens également à remercier Chantale Beauchamps et Marie-Odile Benoît-Biancamano d’avoir accepté d’évaluer ce mémoire ainsi que pour leurs conseils, commentaires et suggestions qui ont permis l’amélioration de cette œuvre.
Merci à tous ceux qui m'ont prêté main-forte au cours des deux dernières années : Étienne Nadeau, Pierre-Luc Mercier, Claude Boucher, André Rondeau, André Pettigrew, Ermin Menkovic, Luc Gagnon, Christian Deblois, Josée Rondeau, et Diane Boucher. Je souligne aussi l'aide précieuse de Gaétan Daigle tout au long des analyses statistiques. Un énorme merci à tous les apiculteurs qui ont accepté que je côtoie leurs ruches et qui m’ont transmis leur passion pour l’apiculture.
Je ne saurais oublier ma mère Claire Samson et mon père Alain Robert qui m’ont encouragé et soutenu tout au long de mes études. Vous plus que quiconque connaissez le chemin parcouru pour arriver jusqu’ici. Sachez que sans vous, rien de tout cela n’aura été possible. Merci d’avoir toujours cru en moi et de m’avoir épaulé dans les bons, comme les moins bons coups.
En terminant, il serait impensable de ne pas remercier mon conjoint Simon Létourneau-Robert qui a été près de moi au courant des dernières années et sans qui j’aurais fort probablement abandonné depuis longtemps. De l’Angleterre à la Pennsylvanie, entre Sherbrooke, St-Hyacinthe et Québec, tu as toujours été présent et m’as toujours poussé à me dépasser pour aller de l’avant. Tu as été une source d’inspiration au quotidien et le mortier qui m’a maintenu fort.
Avant-Propos
Les chapitres II, III et IV de ce mémoire sont présentés sous forme d’articles scientifiques rédigés en anglais. Les chapitres II et IV ont été soumis pour publication respectivement dans Journal of Applied Ecology et Scientific Reports. Le chapitre III, intitulé Neonicotinoid-Contaminated Puddles of Water Represent a Risk of Intoxication for Honey Bees est un manuscrit qui a été soumis et accepté pour publication par le journal scientifique PLoS ONE.
La récolte des données, l’analyse des résultats ainsi que la rédaction de l’ensemble des textes sont issus du candidat. Valérie Fournier (directrice), Ph.D., professeure d'entomologie à l'Université Laval, Geneviève Labrie (codirectrice), Ph.D., chercheure en entomologie au CÉROM (Centre de recherche sur les grains Inc.), de même que Madeleine Chagnon, Ph.D., professeure associée à l'Université du Québec à Montréal ont collaboré aux textes et sont coauteures des chapitres II, III et IV.
M. Nicolas Derome, Ph.D. professeur agrégé en biologie à l’Université Laval et Pierre-Luc Mercier sont également coauteurs du chapitre IV présenté dans ce mémoire.
Introduction générale
La pollinisation est un service écosystémique essentiel à la production végétale en agriculture. Le vent, l’eau et une panoplie d’animaux interviennent dans les processus de reproduction des plantes, mais de tous les vecteurs de pollinisation existants, les insectes sont les plus importants. L’abeille domestique (Apis mellifera L.) est sans nul doute l’emblème de la pollinisation par excellence. Très largement utilisée pour la pollinisation des cultures, l’abeille domestique fait aujourd’hui partie intégrante des agroécosystèmes. Aussi indispensable soit-elle à la production agricole, l’abeille n’en demeure pas moins vulnérable aux pratiques agricoles modernes.
L’intensification des pratiques agricoles et l’utilisation répandue d’agents agrochimiques sont parmi les facteurs les plus fréquemment mentionnés dans le déclin des abeilles. L’abeille domestique n’est cependant pas la seule espèce à subir les conséquences de ce mode d’agriculture et l’ensemble des abeilles sauvages y est tout aussi vulnérable. Au cours des dernières années, une nouvelle classe d’insecticides, les néonicotinoïdes, a été rapidement associée à une mortalité accrue des abeilles et l’innocuité pour l’environnement de ces composés est aujourd’hui remise en question. À ce jour, les néonicotinoïdes sont les insecticides les plus utilisés à travers le monde et représentent, par conséquent, un investissement considérable. Une gestion plus contraignante de leur utilisation, voire un retrait de leur homologation, pourrait mener à des conséquences économiques importantes autant pour les agriculteurs que pour les consommateurs. Il est donc essentiel de comprendre leur implication au sein du déclin des pollinisateurs. La littérature sur le sujet est déjà très abondante et plusieurs voies d’exposition pour les pollinisateurs ont été identifiées. Des mesures de mitigations concernant certaines routes de contamination ont d’ores et déjà été adoptées. En revanche, plusieurs lacunes demeurent, auxquelles il incombe de remédier. L’acquisition de connaissances relatives, notamment, aux impacts de ces insecticides sur les pollinisateurs domestiques et sauvages dans leur milieu naturel représente une priorité.
Les objectifs de ce projet de recherche sont d’évaluer l’impact des semences traitées aux néonicotinoïdes sur les colonies d’abeilles domestiques, sous conditions naturelles, durant la période de semis du maïs, moment où l’exposition à ces composés insecticides est très importante et de déterminer si l’eau de surface prélevée dans des champs de maïs traités aux néonicotinoïdes comporte un risque potentiel pour ces abeilles. Finalement, cette étude visait également à déterminer si les traitements de semences néonicotinoïdes affectent le système nerveux d’autres espèces d’abeilles en utilisant le biomarqueur acétylcholinestérase (AChE) et une espèce de bourdon (Bombus impatiens) en tant que représentant des pollinisateurs sauvages. Une synthèse des connaissances disponibles sur le sujet sera suivie des résultats obtenus dans le cadre de cette étude; ces derniers seront présentés sous forme d’articles scientifiques
1.1 La pollinisation
1.1.1 Un service écosystémique précieux
Les insectes participent à une grande diversité de services écosystémiques de grande valeur, tels que le contrôle des ravageurs, le recyclage des nutriments et la pollinisation. La pollinisation est le mode de reproduction privilégié de la majorité des espèces végétales terrestres et implique le transport d’un grain de pollen depuis les étamines (organes mâles) jusqu’aux stigmates (organes femelles). Bien que le vent, certains oiseaux et quelques mammifères contribuent à la pollinisation, ce sont essentiellement les insectes qui en sont responsables, tels que les abeilles, les guêpes, les mouches, les coléoptères, les fourmis, les papillons et les mites. De tous ces organismes cependant, les abeilles sont considérées comme les plus importants pollinisateurs des climats tempérés. En Amérique du Nord uniquement, il existe environ 4000 espèces d'abeilles (Michener 2007), dont la quasi-totalité y est indigène.
La pollinisation est un processus fondamental au maintien de la biodiversité et à l’intégrité des écosystèmes terrestres (Kearns et al. 1998, Blüthgen & Klein 2011). Concrètement, ce service écosystémique intervient dans le processus de reproduction de plus de 90% des espèces végétales angiospermes de la planète (Kearns et al. 1998). Sans ce service, de nombreuses espèces et de nombreux processus fonctionnant au sein d’un même écosystème sont voués à disparaître. En plus de son importance écologique, la pollinisation occupe une place cruciale dans la sécurité alimentaire et les moyens de subsistance des humains (Aizen et al. 2009). Il est estimé que 87 des 115 principales cultures alimentaires mondiales dépendent, dans une certaine mesure, de la pollinisation animale (Klein et al. 2007). En plus d’intervenir dans le processus de reproduction de ces cultures, la pollinisation contribue à en augmenter la nouaison (soit un pourcentage plus élevé de fleurs qui produisent des fruits), à améliorer le volume, la forme et la qualité des fruits produits, de même qu’à augmenter leur durée de conservation sur les étalages et leur valeur commerciale (Kevan 1999, Desjardins & De Oliveira 2006, Garibaldi et al. 2013, Brittain et al. 2013, Klatt et al. 2014). En terme de volume alimentaire, il est estimé que 35% de l’assiette alimentaire mondiale serait le résultat de ce service écosystémique (Klein et al. 2007). Cette proportion peut sembler faible, car plusieurs
cultures d’envergure, telles que le maïs, le riz et le blé, dépendent du vent pour assurer leur pollinisation ; elle est toutefois principalement constituée de la production des fruits, légumes et noix (Gallai et al. 2009). La pollinisation contribue donc surtout à la diversité nutritionnelle et à un apport vitaminique suffisant. Les bénéfices pour la production alimentaire humaine de ce service écosystémique sont d’ailleurs si importants que leur valeur annuelle à l’échelle de la planète est estimée à près de 240 milliards de dollars (Gallai et al. 2009). Bien entendu, la véritable valeur de la pollinisation est beaucoup plus importante puisqu’il faut en réalité tenir compte également des bénéfices associés aux cultures destinées à la consommation animale et à la fabrication des biocarburants, à la production de semences pour les cultures ornementales et à la production d’une panoplie de produits issus de plantes aux propriétés médicinales (Kremen et al. 2007, Gallai et al. 2009). Ainsi, la conservation des insectes pollinisateurs est extrêmement importante afin de préserver à la fois la biodiversité et l'agriculture.
1.1.2 L’importance relative de l’abeille
En agriculture, l’importance de la pollinisation est reconnue depuis fort longtemps. En fait, aux États-Unis, il est possible de retracer les premières colonies d’abeilles mellifères à avoir été louées pour la pollinisation commerciale des pommiers dans l’état du New Jersey en 1λ0λ (Morse & Calderone 2001). Depuis cependant, l’agriculture moderne, et plus particulièrement les productions fruitières et maraichères, en est venue à dépendre pratiquement exclusivement d’un seul insecte pollinisateurμ l’abeille domestique (A. mellifera) (Westerkamp & Gottsberger 2002). À chaque année aux États-Unis, plus du trois quarts des colonies d’abeilles domestiques du pays sont louées par des producteurs agricoles dans l’unique but de polliniser leurs cultures (Morse & Calderone 2001). L’amande est un excellent exemple de culture dépendante de la pollinisation. Chaque année, 1,6 million de colonies d’abeilles domestiques sont transportées en Californie afin d’y polliniser cette unique culture, soit plus de 60% des colonies du pays entier (Pettis & Keith 2010, Cresswell et al. 2012). En raison de l’utilisation quasi systématique de l’abeille domestique en agriculture, la pollinisation de l’incroyable diversité de fleurs et de cultures à travers le monde est aujourd’hui attribuée à tort à cet unique organisme (Westerkamp & Gottsberger 2002). En réalité, sur une base
individuelle l’abeille domestique est à proprement parler un piètre pollinisateur (Westerkamp 1991). Sa morphologie uniforme et la façon dont elle récolte le nectar et le pollen ne sont pas adaptées à l’ensemble des fleurs. En revanche, l’utilisation de l’abeille domestique comporte aussi plusieurs avantages. Alors que même les espèces de pollinisateurs sauvages de plus grande taille ne parviennent qu’à voler à l’intérieur de quelques kilomètres, l’abeille domestique est reconnue pour se déplacer à plus de 10 km de la ruche (Ribbands 1951). Cette distance de vol lui permet donc de butiner et de contribuer à la pollinisation d’un territoire de grande envergure (Ribbands 1951). De plus, étant donné qu’une seule ruche peut comporter plus de 60 000 individus, dont près de la moitié participent activement aux activités de butinage (Boucher et al. 2011), l’abeille domestique demeure l’un des vecteurs de pollinisation par excellence (Johnson 2010).
1.2
Pertes de colonies d’abeille domestique
Depuis la moitié du dernier siècle, le nombre de colonies commerciales d’abeilles domestiques en Amérique du Nord (-49,5%) tout comme en Europe (-26,5%) a fortement diminué (FAO 2009). Il est d’ailleurs estimé qu’il ne reste aujourd’hui plus que 2,3 millions de ruches des quelques 6 millions qui constituaient le cheptel des États-Unis pendant les années 40’ (Pettis & Keith 2010, Ellis et al. 2010, Carreck & Neumann 2010, Potts et al. 2010, Ellis 2012). Depuis 2006, un nouveau joueur a également fait son apparition, le syndrome d’effondrement des colonies (ou Colony Collapse Disorder, CCD) (Johnson 2010, Ratnieks & Carreck 2010, Ellis 2012). Caractérisé par une disparition rapide de la quasi-totalité des abeilles de la ruche, ce syndrome a eu tôt fait de propulser l’abeille domestique sous le feu des projecteurs. Par conséquent, au cours de la dernière décennie, la santé des pollinisateurs a été un sujet de préoccupation pour les médias nationaux et internationaux, les gouvernements, les scientifiques et le grand public. Dans les dernières années, plusieurs facteurs, agissant seuls ou en interaction, ont été étudiés et identifiés comme causes potentielles dans ce déclin des pollinisateurs. Parmi ces facteurs, on compte notamment les parasites, les pathogènes, la transhumance, l’affaiblissement génétique, de même que l’intensification de l’agriculture (Ratnieks & Carreck 2010, Ellis 2012, Johnson et al. 2013, Doublet et al. 2014).
1.2.1 Les parasites et pathogènes
Les abeilles sont en proie à un certain nombre de parasites et d'agents pathogènes, dont beaucoup doivent être activement contrôlés par les apiculteurs afin de préserver la santé des colonies. La plupart d'entre eux sont reconnus pour décimer les colonies ou compromettre la santé des colonies de manière à en influencer la productivité globale.
1.2.1.1 La varroase
Même avec l'apparition du syndrome d’effondrement des colonies, la varroase demeure, à travers le monde, l’une des plus grandes menaces pour l'apiculture moderne (Ellis 2012). Le varroa (Varroa destructor) est un acarien parasite qui s’attaque aux abeilles adultes ainsi qu’aux larves et aux nymphes. Il s’agrippe au corps de l’abeille et se nourrit à même son hémolymphe (sang). Son mode d’alimentation prive ainsi l’abeille affectée d’une partie de son volume sanguin et de divers nutriments dont elle a besoin pour accomplir ses tâches. Entre autres, la gelée produite par les nourrices affectées par la varroase est de moins bonne qualité et nuit au bon développement du couvain. Les acariens adultes sont aussi reconnus pour se loger à l’intérieur des cellules du couvain afin de s’y reproduire. En s’alimentant à même le couvain, les parasites peuvent entrainer des déficiences en protéines et éléments nutritifs limitant le développement des larves et des nymphes. Parfois, ces déficiences sont assez importantes pour entrainer la mort des individus. Néanmoins, l’effet le plus dévastateur du varroa demeure sa capacité à transmettre bon nombre de pathogènes et de virus à ses victimes (Francis et al. 2013).
1.2.1.2 Les acariens trachéaux
Comme leur nom l'indique, ces acariens (Acarapis woodi) sont des parasites internes et se logent à l’intérieur des tubes de la trachée des abeilles adultes. Les effets pathogènes dépendent fortement du nombre de parasites dans les trachées et sont attribuables d’une part aux lésions dans les parois des trachées et à la déperdition en hémolymphe, mais sont principalement imputables à l’obstruction des conduits d’air, ce qui nuit fortement aux transferts gazeux dans les trachées et peut compromettre la survie de l’abeille (Ritter 2008). De plus, ce parasite bénéficie du comportement social de l’abeille afin de se répandre plus
efficacement au sein de la colonie. En effet, lorsque les abeilles recourent à la trophallaxie, qui consiste à transférer d’un individu à un autre de la nourriture prédigérée par régurgitation, elles risquent de contaminer leurs consœurs et d’ainsi contribuer à répandre l’infestation.
1.2.1.3 Le petit coléoptère de la ruche
Le petit coléoptère de la ruche (Aethina tumida M.) est un nouveau ravageur des colonies d'abeilles originaire de l’Afrique du Sud (Lundie 1940). Les adultes, reconnus pour vivre plusieurs mois, infiltrent les colonies d’abeille pour y pondre leurs œufs et permettre aux larves de s’y nourrir et de s’y développer (Lundie 1940). Les larves peuvent causer des dommages importants tandis que la levure qui leur est associée (Kodamaea ohmeri) entraine la fermentation du miel, qui perd alors ses valeurs nutritives (Elzen et al. 1999). Des taux élevés d'infestation sont reconnus pour pouvoir entraîner l’effondrement de colonies (Elzen et al. 1999). Il n’existe actuellement aucun programme de lutte intégrée, chimique ou autre, afin de contrôler efficacement ce ravageur (Ellis 2012).
1.2.1.4 La fausse-teigne
La grande fausse teigne (Galleria mellonella) et la petite fausse teigne (Achroia grisella) sont des papillons de nuit appartenant à la famille des mites. Il pond à l’intérieur des ruches et les larves se développent dans les rayons de cire de la ruche. Les larves sont reconnues pour creuser un réseau de galeries qu’elles tapissent de soie dans tout le rayon. Comme les abeilles sont incapables de retirer cette soie, les cellules abimées ne peuvent être réparées et deviennent dès lors impropres autant à la ponte qu’à la mise en réserve du nectar et du miel. De plus, lorsque les larves de fausse-teigne croissent, elles commencent à établir des ponts de soie entre les rayons, ce qui entrave fortement la circulation des abeilles à l’intérieur de la ruche. La fausse-teigne peut être si dévastatrice que des colonies entières peuvent succomber à l'infestation, surtout si la colonie est affaiblie par d'autres raisons.
1.2.1.5 La loque
La loque américaine (Paenibacillus larvae) et la loque européenne (Melissococcus pluton) sont des infections d’origine bactérienne qui affectent exclusivement le couvain (Ellis 2012). Contrairement à ce que leur nom indique, ces deux maladies de l’abeille sont répandues dans le monde entier. Les jeunes larves sont plus vulnérables, et seules quelques bactéries ou spores, à l’intérieur du miel transmis par les abeilles nourricières, sont suffisantes afin de provoquer une infection mortelle (Genersch 2010). La loque américaine est généralement plus grave, car P. larvae présente la capacité de produire des spores (van Engelsdorp & Meixner 2010). Sous cette forme, la bactérie peut survivre en dormance pendant plus de 35 ans (Genersch 2010).
1.2.1.6 La nosémose
Cette pathologie est causée par une microsporidie unicellulaire (un champignon microscopique) qui réside dans l’intestin moyen de l’abeille. La nosémose est généralement corrélée avec une durée de vie réduite des abeilles, une diminution du rendement des colonies et la mortalité accrue à l’hivernage (Fries et al. 1984). L'abeille peut être l'hôte de deux espèces différentes, Nosema apis, qui est connu depuis longtemps comme un agent pathogène de l’abeille, et Nosema ceranae, qui a récemment fait son apparition. Les infections de Nosema se transmettent d’une abeille à une autre par ingestion de spores provenant de l'environnement, le plus souvent des fèces contaminées (van Engelsdorp & Meixner 2010).
1.2.1.7 Les virus
L’abeille domestique peut également être l’hôte d’un grand nombre de virus qui s’attaquent à différents stades de développement et castes d’abeilles, y compris les œufs, larves, nymphes, ouvrières adultes, faux-bourdons et reines. Des 18 virus répertoriés à ce jour, les plus fréquents sont le virus des ailes déformées, le virus du couvain sacciforme, le virus israélien de la paralysie aiguë, le virus cachemirien de l'abeille et le virus de la cellule royale noire (van Engelsdorp & Meixner 2010). Les virus de l’abeille persistent le plus souvent sous forme d’infections inapparentes sans signe manifeste de maladie. Sous certaines conditions cependant, particulièrement lorsque les abeilles sont aux prises avec d’autres pathologies ou
parasites, l’incidence des virus augmente considérablement jusqu’à affecter la santé et la survie des abeilles (van Engelsdorp & Meixner 2010, Francis et al. 2013, Di Prisco et al. 2013).
1.2.2 Les pratiques apicoles
La location de ruches vouées à la pollinisation des cultures est devenue une source importante de revenus pour de nombreux apiculteurs. Ces services de pollinisation impliquent nécessairement le transport des colonies à proximité de la culture à polliniser. En 2013, plus de 65% des ruches du Québec (23 399) furent louées afin de participer à la pollinisation des cultures de bleuet nain (ISQ 2013). Ces ruches ont par conséquent dû être transportées de leur lieu d’origine jusque dans la région du Lac St-Jean, soit sur plusieurs centaines de kilomètres. Ces migrations, que l’on nomme transhumance, sont nocives pour les colonies d’abeilles (Ellis 2012). D’une part, de nombreuses abeilles mourront durant le transport et d’autre part, le risque de contracter une maladie ou un parasite est accru puisqu’un nombre très élevé de ruches de partout au Québec se retrouve confiné à un territoire restreint. Qui plus est, certaines ruches peuvent être déplacées plusieurs fois lors d’une même saison apicole afin de polliniser différentes cultures. Chaque déplacement ajoute un stress supplémentaire à la colonie qui doit, à chaque fois, se familiariser avec son nouvel environnement.
1.2.3
L’affaiblissement génétique
L’abeille domestique est originaire d’Europe et les populations qui sont présentes dans les Amériques sont issues des diverses importations qui ont eu lieu au cours des 400 dernières années (Ellis 2012). En raison de l’apparition de divers pathogènes et parasites dans certaines régions du monde, certains pays ont fermé leurs frontières à l’importation de nouvelles abeilles. Ainsi, il a été démontré que la variabilité génétique des populations d'abeilles domestiques aux États-Unis est considérablement réduite par rapport à celles en Europe (Sheppard 1988). La consanguinité et l’apport génétique limité sont susceptibles d’accentuer la vulnérabilité des populations d’abeilles aux pathogènes, parasites ou tout autre facteur de stress auxquels elles font face (Ellis 2012). De plus, les pressions de sélection naturelle sur les populations d’abeilles sont aujourd’hui fortement influencées par les pratiques apicoles modernes comme le contrôle des parasites et
pathogènes grâce aux insecticides et aux antibiotiques, l’isolation des colonies contre le froid hivernal ou encore la supplémentation alimentaire. Par conséquent, des colonies faibles et sensibles, qui auraient normalement succombé aux processus de sélection naturels, sont maintenues en vie et continuent à participer aux processus de reproduction et au flux génétique (van Engelsdorp & Meixner 2010).
1.2.4 Intensification des pratiques agricoles
Plusieurs pratiques découlant de l’intensification de l’agriculture ont des conséquences négatives sur la santé des pollinisateurs. Depuis plusieurs années, les superficies vouées aux monocultures ont connu une augmentation, au détriment des exploitations agricoles comportant plusieurs cultures. Les abeilles vivant dans ces zones agricoles, ou placées à proximité afin d’en faire la pollinisation se retrouvent sur un territoire où la diversité florale, et par conséquent la diversité en nutriments, est très limitée (Naug 2009, Girard et al. 2012). Un régime alimentaire basé sur un nombre réduit d’espèces florales ne permet pas aux colonies de combler leur besoin en protéines et en acides aminés (Brodschneider & Crailsheim 2010). Ce phénomène est d’ailleurs accentué par l’application massive de composés herbicides. Étant utilisés afin de limiter ou d’empêcher la croissance d’espèces végétales compétitrices, les herbicides réduisent la diversité florale des superficies agricoles et contribuent à limiter la diversité nutritionnelle pour les pollinisateurs (Benedek 1972, Johansen 1977, Corbet et al. 1992). Cependant, l’élément le plus nuisible de l’intensification des pratiques agricoles est sans nul doute l’emploi de composés insecticides, qui affectent directement la santé de l’ensemble des arthropodes des systèmes agricoles.
1.2.5 Le rôle des insecticides
Les insecticides constituent une composante essentielle des systèmes de production agricole afin de contrôler une panoplie d’insectes ravageurs des cultures. Sans ces composés phytosanitaires, il est impensable que l’agriculture, telle qu’elle est pratiquée aujourd’hui, maintienne ses rendements actuels (EC, 2006). Il est reconnu depuis longtemps que l’application d’insecticides pour la répression des ravageurs agricoles peut entraîner des répercussions négatives sur les colonies d’abeilles domestiques (Johansen & Mayer 1990). Les effets néfastes des insecticides sur les colonies d’abeilles remontent aussi loin que le début
des années 1λ00 alors que les pulvérisations d’arsenic sur les arbres fruitiers avaient été répertoriées comme l’une des cinq principales causes du déclin du nombre de colonies d’abeilles (Voorhies et al. 1933).
1.3 Les néonicotinoïdes
1.3.1 Origine et utilisation actuelle
Les néonicotinoïdes sont des insecticides de synthèse dont la structure moléculaire et le mode d’action sont similaires à la nicotine, un composé végétal naturel largement utilisé comme insecticide avant la Seconde Guerre mondiale (Hopwood et al. 2012). C’est au cours des années 1λ70 que l’apparition de nouvelles technologies a rendu possible l’analyse des structures moléculaires. C’est ainsi que l’étude de la nicotine a permis le développement d’une matière active novatrice nommé la nithiazine (Tomizawa 2013). Ce nouveau composé, de par la toxicité extrême qu’il démontrait envers les insectes et parce qu’il se montrait plus sécuritaire pour l’homme, se démarquait des anciennes classes de composés insecticides (Tomizawa 2013). Cependant, cette molécule était particulièrement sensible à la lumière et n’était donc pas appropriée pour la protection des cultures. Lors des années 1λ80, l’industrie agrochimique a poursuivi ses recherches sur la nithiazine et est parvenue à perfectionner cette molécule en améliorant fortement sa stabilité à la lumière (Matsuda et al. 2001). Cette nouvelle famille d’insecticides fut nommée « néonicotinoïde » en raison des similitudes qu’elle partage avec la nicotine. Cette classe d’insecticide est d’ailleurs la seule à avoir été développé lors des 50 dernières années. Ils sont utilisés pour contrôler une très large panoplie d’insectes ravageurs qui nuisent aux cultures commerciales ou ornementales (comme les pucerons ou les chrysomèles), à la structure des bâtiments (termites) et aux animaux domestiques (puces). Il existe présentement sept insecticides néonicotinoïdes qui sont commercialisés à travers le monde : l'imidaclopride, la clothianidine, le thiaméthoxame, le dinotéfurane, l’acétamipride, le thiaclopride et le nitenpyram. À cela s’ajoutent trois autres composés en processus d’homologation aux États-Unis ou en Chine (Jeschke et al. 2011). De tous les néonicotinoïdes, l'imidaclopride fut le premier à être commercialisé et demeure le plus couramment utilisé (Elbert et al. 2008). Au Canada, l’imidaclopride fut homologué pour la première fois en 1996 comme moyen de lutte contre le doryphore de la pomme de terre. Depuis leur introduction sur le marché agricole et horticole,
les néonicotinoïdes correspondent désormais à la classe d’insecticide la plus utilisée à travers le monde et compte pour plus de 30 % des parts du marché insecticide mondial (Jeschke et al. 2013).
1.3.2 Nouvelles propriétés, nouvelles possibilités
Les néonicotinoïdes se démarquent des autres familles d’insecticide à bien des égards et les caractéristiques qui leur sont propres ont contribué à leur énorme succès. Une des composantes clés des néonicotinoïdes est sans contredit leur propriété systémique, c’est-à-dire la capacité à se solubiliser dans l’eau. Grâce à cette propriété, ils peuvent être absorbés par les racines ou les feuilles d’une plante, puis transportés via le système vasculaire (xylème) et se diffuser à travers tout l’organisme. Tous les organes de la plante, des tiges aux feuilles en passant par les fleurs et même les fruits acquièrent ainsi des propriétés insecticides. Cette caractéristique systémique des néonicotinoïdes leur confère aussi une très grande flexibilité d’application (Hopwood et al. 2012). Ils peuvent être utilisés sous forme de granules que l’on étend à la surface des champs, par pulvérisation foliaire, en ajout à l’eau d’irrigation, par injection directe à l’intérieur des troncs d’arbre ou encore sous forme d’enrobage de semences. À l’exception du fipronil, les néonicotinoïdes sont les seuls insecticides à pouvoir être appliqués comme traitement de semences. Les enrobages insecticides sont en fait si populaires que près de 60% des applications de néonicotinoïdes dans le monde se font sous cette forme (Jeschke et al. 2011). De plus, les composés néonicotinoïdes ont la particularité de cibler une catégorie de récepteurs chimiques qui sont principalement présents chez les insectes, mais très peu chez les mammifères, ce qui leur confère une très forte toxicité envers les arthropodes tout en étant relativement sécuritaire pour l’homme (Tomizawa & Casida 2001, Thany 2010, Jeschke et al. 2011). Cette variété de méthodes d'application, ainsi que leur propriété systémique et leur faible toxicité pour les vertébrés sont les principales raisons pour lesquelles ces produits phytosanitaires sont aussi populaires à travers le monde (Elbert et al. 2008).
1.3
.3 Mode d’action
Les insecticides néonicotinoïdes, de même que certains de leurs métabolites, possèdent une signature moléculaire similaire à un neurotransmetteur naturel très important du système nerveux :
l'acétylcholine (ACh). Cette similitude leur permet d’agir à titre d’agonistes, c’est-à-dire qu’ils possèdent la capacité à se substituer au neurotransmetteur et à le remplacer dans l’organisme. Les néonicotinoïdes agissent ainsi de manière sélective sur les récepteurs post-synaptiques nicotiniques de l'acétylcholine (nAChERs) à l’intérieur du système nerveux central des insectes (Tomizawa 2013, Jeschke et al. 2013). Une fois à proximité des synapses, les molécules d’insecticides se lient avec une très forte affinité à ces récepteurs de la membrane synaptique et conduisent à une hyperexcitation anormale des neurones. En demeurant excitées, les synapses poursuivent la transmission de l’influx nerveux et entrainent des contractions musculaires. Lorsque suffisamment de neurones sont affectés, les insectes commencent à montrer des symptômes visibles tels que des frissonnements, des tremblements, des contractions musculaires incontrôlées. Éventuellement, cet état de surexcitation peut causer la mort d'un insecte en quelques minutes (Tomizawa 2013, Palmer et al. 2013). De plus, il a été démontré que les composés néonicotinoïdes se lient de manière irréversible aux récepteurs nicotiniques de l'acétylcholine (Tennekes & Sánchez-Bayo 2013). Ainsi, bien que les insectes soient en mesure de détoxifier leur métabolisme, une fois qu’une molécule atteint le cerveau, ses effets deviennent permanents.
Les récepteurs nicotiniques chez les insectes sont un assemblage formé de plusieurs sous-unités et ils présentent des profils pharmacologiques très différents des récepteurs nicotiniques chez les vertébrés (Tomizawa & Casida 2001). Cette différence d’affinité des récepteurs nicotiniques est la raison pour laquelle les néonicotinoïdes font preuve d’une toxicité très sélective envers les insectes et demeurent moins toxique pour les mammifères et les poissons (Tomizawa & Casida 2001, Jeschke & Nauen 2008, Tomizawa 2013, Jeschke et al. 2013). Avant l'avènement des néonicotinoïdes, les organophosphorés et les carbamates partageaient plus de 80% des parts du marché insecticide (Casida 2011). Cependant, ces deux anciennes classes d'insecticides agissent directement en inhibant la production d'acétylcholinestérase (AChE), l’enzyme régulatrice responsable de l’hydrolyse de l’acétylcholine. Comme l’AChE est identique chez les insectes et les mammifères, ces insecticides possédaient une toxicité élevée pour l’ensemble de ces organismes (Matsuda et al. 2001, Attencia et al. 2005, Jeschke et al. 2013). Toutefois, les néonicotinoïdes agissent sur les
récepteurs nicotiniques en imitant l’acétylcholine et stimulent ainsi le métabolisme de l’insecte à poursuivre sa production d’AChE comme une réponse naturelle afin de mettre fin à la transmission des influx nerveux à l’intérieur des synapses. Une augmentation de l'activité de l’AChE a été signalée, à la fois chez les abeilles et d’autres arthropodes, en réponse à une exposition à des composés néonicotinoïdes (Morakchi et al. 2005, Boily et al. 2013). Parmi tous les produits phytosanitaires, les néonicotinoïdes sont les seuls, à l'exception rare d'un pyréthrinoïde (deltaméthrine) (Badiou et al. 2008), à provoquer une augmentation de l'activité de l'acétylcholinestérase. Par conséquent, l’étude de l’activité de l’AChE représente un outil utile afin de poser un diagnostic sur la présence de composés néonicotinoïdes dans l’écosystème et pour révéler l’exposition et la contamination des organismes aux insecticides.
1.3
.3 Risques pour l’environnement
1.3
.3.1 L’air
Aucun des insecticides néonicotinoïdes ne possède une pression de vapeur élevée. En général, les valeurs sont comprises entre 2,8 x 10-8 et 0,002 mPa à 25 °C pour ces composés (Bonmatin et al. 2014). Le
faible potentiel de volatilisation de ces substances indique que ces pesticides ne sont présents à l'état gazeux que pendant une très courte période de temps lors des applications par pulvérisation.
1.3.3.2 Le sol
Les néonicotinoïdes ont la capacité de se lier aux particules du sol, ce qui réduit leur susceptibilité à être lessivés à travers le profil du sol. Il a été démontré que la capacité de sorption est positivement corrélée à la teneur en matière organique et en argile minérale. À l’inverse, les néonicotinoïdes sont plus facilement désorbés à basse température et lorsque leurs concentrations dans le sol sont faibles (Bonmatin et al. 2014). D’autre part, dans les cas des traitements de semences, seule une fraction du composé néonicotinoïde (entre 1,6 et 20%) est absorbé par les plantes (Sur & Stork 2003) alors que la majorité de l'ingrédient actif, typiquement plus de 90%, demeure dans les sols (Goulson 2013). De plus, les néonicotinoïdes fréquemment utilisés en tant que traitement de semence possèdent un temps de demi-vie dans le sol (Voir Tableau 1) oscillant généralement entre 200 à plus de 1000 jours (28 à 1 250 jours pour l'imidaclopride, 7 à 3 001 jours
pour le thiaméthoxame et 148 à 6 931 jours pour la clothianidine) (Goulson 2013). Compte tenu de leur persistance dans les sols, il est attendu que les néonicotinoïdes s’accumulent dans les sols lorsqu’ils sont appliqués lors d’années successives.
Tableau 1. Persistance des néonicotinoïdes dans les sols aérobiques.
1.3.3.3
L’eau
L’activité systémique des néonicotinoïdes dépend fortement de leur solubilité afin de permettre une distribution plus uniforme de l’ingrédient actif à l’intérieur des tissus végétaux (Goulson 2013). Les néonicotinoïdes sont donc conçus afin d’être particulièrement solubles. Cependant, leur solubilité dans l’eau dépend de nombreux facteurs tels que la température et le pH de l'eau ainsi que l'état physique du pesticide au moment de son application. Malgré tout, les néonicotinoïdes sont si solubles que des études récentes en ont retrouvé dans de l'eau d'irrigation agricole, dans des rivières et même dans des marais (Giroux & Pelletier 2012, Starner & Goh 2012, Van Dijk et al. 2013, Main et al. 2014, Vijver & van den Brink 2014, Sánchez-Bayo & Hyne 2014).
Néonicotinoïdes
Demi-vie dans le sol
(conditions aérobiques)
Acétamipride 1 - 8 jours1 Clothianidine 148 - 1 155 jours2 Dinotéfurane 138 jours3 Imidaclopride 40 - 997 jours4 Thiaclopride 1 - 27 jours5 Thiaméthoxame 25 - 100 jours61.3.4 Les néonicotinoïdes et les pollinisateurs
1.3
.4.1 Les dangers pour l’abeille
La recherche portant sur les effets des néonicotinoïdes sur les pollinisateurs est presque exclusivement limitée à l’abeille domestique. Apis mellifera est l’espèce de prédilection, car il s’agit d’une espèce économiquement importante, facilement disponible en grand nombre et pour laquelle les protocoles d’analyses sont déjà existants. On recense plus d’une quarantaine d’études indépendantes à avoir examiné les effets des insecticides néonicotinoïdes sur les abeilles domestiques. Lors des dernières années, l’élevage commercial des colonies de bourdons a connu un grand essor et les tests de toxicité portant sur les bourdons se sont multipliés. À ce jour, une douzaine d’études portant sur les néonicotinoïdes et les bourdons ont été publiées dans des revues avec comité de révision par les pairs. Cependant, un nombre encore très réduit d’études ont examiné les effets des néonicotinoïdes sur les abeilles solitaires en Amérique du Nord. Le manque d'études concernant les effets des néonicotinoïdes sur les espèces sauvages non commerciales est très préoccupant, car ces abeilles comprennent la plupart des espèces en Amérique du Nord et contribuent également de manière significative à la pollinisation des cultures (Winfree 2010). Les traits d’histoire de vie des abeilles affectent différemment leur sensibilité aux insecticides (Brittain & Potts 2011) et les arguments provenant d’un vaste corpus de recherche indiquent que différentes espèces d’insectes ne réagissent pas aux insecticides de la même façon (Robertson et al. 2007). Fort est à parier que l’abeille domestique et les abeilles sauvages réagissent différemment aux insecticides néonicotinoïdes.
1.3.4.1.1 La toxicité
Selon les études menées en laboratoire sur les doses létales des néonicotinoïdes, la clothianidine, l’imidaclopride, le thiaméthoxame et le dinotéfurane sont catégorisés comme étant très toxiques pour les abeilles alors que l’acétamipride et le thiaclopride sont considérés comme modérément toxiques. Ces deux derniers présentent des différences structurelles les rendant moins toxiques pour les abeilles en comparaison avec les autres néonicotinoïdes (Iwasa et al. 2004). Par conséquent, la dose létale topique (par contact direct) de l’acétamipride pour les abeilles est 816 fois supérieure à celle de l’imidaclopride (Iwasa et al. 2004, Hopwood et al. 2012).
La toxicité des néonicotinoïdes ne s’arrête pas à la matière active initiale, car lorsqu’ils sont métabolisés, plusieurs produits de dégradation (métabolites) sont également toxiques pour les abeilles. Alors que certains métabolites sont moins toxiques que leur composé d’origine, d’autres comme l’imidaclopride-oléfine sont en fait deux fois plus toxiques (Suchail et al. 2001). Le thiaméthoxame, quant à lui, produit, lorsqu’il se dégrade, un nouveau composé néonicotinoïde : la clothianidine (Jeschke & Nauen 2008).
1.3
.4. . . L’exposition létale
La dose létale médiane (DL50) est un indicateur quantitatif décrivant la toxicité d’une substance et
sert à mesurer la dose requise afin d’entraîner la mort de 50% des individus exposés. La toxicité particulièrement élevée des insecticides néonicotinoïdes envers les abeilles est reflétée par les valeurs de DL50 extrêmement faible (Voir Tableau 2). Dans le cas de la clothianidine, la DL50 pour une exposition topique
oscille entre 22 à 44 µg par abeille (EPA 2003a, Iwasa et al. 2004), alors que si la matière active est ingérée il en faut moins de 4 µg pour causer la mort de l’abeille (EC 2005). Les DL50 du thiaméthoxame et de
l’imidaclopride sont tout aussi faibles, respectivement entre 24 à 29 µg par abeille pour une exposition topique (Iwasa et al. 2004, Syngenta Group 2005) et de 5 µg dans le cas d’une ingestion (Syngenta Group 2005) et entre 18 à 24 µg par abeille pour une exposition topique (Schmuck et al. 2001, NPIC 2010) et entre 3,7 à 8 µg par abeille suite à une exposition orale (Schmuck et al. 2001, Jeschke & Nauen 2008). La toxicité de ces insecticides est telle qu’en tenant compte du taux actuel de l'application de ces composés pour la culture du maïs (entre 0,25 mg et 1,25 mg/grain), un seul grain de maïs peut contenir suffisamment de matière active pour tuer une colonie entière.
Bien que le pollen et le nectar soient peu susceptibles de contenir des quantités aussi élevées en résidus de néonicotinoïdes lorsque les consignes d’utilisation des traitements de semences sont respectées, des données suggèrent que des niveaux de résidus dépassant la DL50 peuvent, dans certaines circonstances,
être retrouvés à l’intérieur même de la plante (Maus et al. 2005). Par contre, il a été démontré que la production de poussière contaminée lors de semis contient des résidus de néonicotinoïdes à des doses plus
élevées que les DL50 et pose donc un risque considérable pour les abeilles (Marzaro et al. 2011, Krupke et al.
2012, Girolami et al. 2012).
Tableau 2. Dose létale médiane topique et orale des insecticides néonicotinoïdes envers l'abeille.
Néonicotinoïdes
Toxicité pour Apis mellifera (µg/abeille)
DL
50topique
DL
50orale
Acétamipride 7,1 – 8,09 2,3 8,85 –14,52 3 Clothianidine 0,022 – 0,044 2,4 0,00379 5 Dinotéfurane 0,024 – 0,061 2,6 0,0076–0,023 6 Imidaclopride 0,0179 – 0,243 4,7 0,0037 – 0,081 7,8 Thiaclopride 14,6 – 38,83 2,9 8,51–17,3 9 Thiamethoxame 0,024 – 0,029 2,10 0,005 101WSDA 2010; 2Iwasa et al. 2004; 3EC 2004b; 4EPA 2003a; 5EC 2005; 6EPA 2004; 7Schmuck et al.
2001; 8Nauen et al. 2001 ; 9EC 2004a; 10Syngenta Group 2005.
1.3
.4. . . L’exposition chronique
Contrairement à l’exposition létale, une exposition chronique à des doses beaucoup plus faibles que les DL50 est beaucoup plus susceptible de se produire dans les milieux agricoles même si les produits
phytosanitaires sont appliqués selon le mode d’emploi, étant donné que les abeilles visitent à plusieurs reprises ces cultures en quête de pollen et de nectar. Des études menées en laboratoire ont montré qu’une exposition chronique à des insecticides néonicotinoïdes peut avoir des conséquences graves et se manifester de plusieurs façons. Parmi les effets délétères, on retrouve notamment une augmentation de la réplication virale et donc la susceptibilité aux agents pathogènes (Di Prisco et al. 2013), une réduction de la consommation de pollen et de nectar (Elston et al. 2013), une fécondité réduite (Laycock et al. 2012), une diminution de la taille de glandes hypopharingienne et donc de la qualité nutritive de la gelée (Hatjina et al. 2013), une diminution de l’intensité des activités de butinage (Schneider et al. 2012) ainsi qu’une réduction de la croissance de la colonie et de la production de reines (Whitehorn et al. 2012a).
1.3.4.1.3 La synergie
Les effets des insecticides sont généralement considérés individuellement alors que ces pesticides sont bien souvent utilisés en combinaison avec d’autres produits phytosanitaires. Divers fongicides sont généralement pulvérisés en combinaison avec des insecticides ou sont utilisés en combinaison dans les enrobages de semence comme c’est le cas pour la culture du maïs et du soya. Une interaction synergique entre des pyréthrinoïdes et des fongicides inhibiteurs de déméthylase (DMI) comme le triflumizole a déjà été démontré chez les abeilles. Le triflumizole augmente la toxicité de l'insecticide en retardant le métabolisme et la désintoxication (Pilling et al. 1995). Il a même été démontré en laboratoire que ce fongicide, lorsqu’il est appliqué en combinaison avec de l’acétamipride ou du thiaclopride, en augmente la toxicité jusqu’à plusieurs centaines de fois (Iwasa et al. 2004). Même à l’intérieur de la famille des néonicotinoïdes, certains insecticides comportent de légères différences structurelles qui leur permettent de se lier de manière non compétitive aux récepteurs nicotiniques des insectes. Ainsi, certains néonicotinoïdes démontrent une toxicité additive comme c’est le cas pour la clothianidine et le thiaméthoxame (Kayser et al. 2004, Wellmann et al. 2004).
1.3.4.2 De multiples v
oies d’exposition
Les abeilles peuvent être exposées à des néonicotinoïdes de nombreuses façons, y compris suite à un contact direct avec des résidus lors de pulvérisation sur les plantes ou par l'ingestion de pollen ou de nectar. Une panoplie d’autres insectes floricoles tels les papillons, les mouches et les coléoptères, dont beaucoup sont des pollinisateurs, peuvent également être affectés de la même manière. Cependant, la présence d'insecticides systémiques dans les plantes présente un risque particulier pour les abeilles, car elles se nourrissent de nectar au stade adulte et récoltent du nectar et du pollen afin d’alimenter le couvain. Malheureusement, lors du processus d’homologation des néonicotinoïdes aux États-Unis, la grande gamme des voies d’exposition des pollinisateurs n’avait pas été prise en considération par l'Environmental Protection Agency (EPA), l’agence de réglementation responsable de l’approbation et de l’homologation des pesticides (EPA 1996). De manière générale au Canada, l’Agence de réglementation de la lutte antiparasitaire (ARLA) se base en grande partie sur des critères d’évaluation similaires à son équivalent américain et les diversités
des voies d’exposition n’ont pas non plus été considérées lors du processus d’homologation. Par contre, il est vrai que plusieurs voies de contamination étaient encore inconnues à ce moment et n’auraient donc pas influencé les processus décisionnels.
Il importe par contre de noter que la présence d'une voie d'exposition n'est pas une preuve de contamination ni d'un danger pour les abeilles, mais simplement un moyen par lequel les abeilles peuvent entrer en contact avec des composés néonicotinoïdes. En outre, une exposition n’équivaut pas non plus à un effet néfaste pour les abeilles. Un contact avec des néonicotinoïdes peut entraîner des effets létaux, sous létaux et même n’avoir aucune conséquence si les quantités auxquelles des pollinisateurs ont été exposés sont négligeables.
1.3.4.2.1 Pulvérisation foliaire
Un contact direct avec des gouttelettes d’insecticide lors d’une pulvérisation foliaire est probablement la voie d’exposition la plus évidente pour les abeilles. Cela peut se produire lorsqu’une application d’insecticide s’effectue alors que les abeilles butinent sur les fleurs ou nichent dans le sol du champ ou du verger. Ce contact peut également se produire lorsque les insecticides pulvérisés dérivent avec le vent jusqu’à un habitat adjacent.
La taille du corps des abeilles est un facteur déterminant quant à la façon dont les organismes réagissent à un contact direct avec des néonicotinoïdes. Bon nombre d’abeilles solitaires sont nettement plus petites que l’abeille domestique et, par conséquent, sont exposées à une dose relativement plus élevée lorsqu’elles sont directement touchées par une pulvérisation de néonicotinoïdes en raison de la plus grande surface de contact de leur corps par rapport à leur volume.
Des tests de toxicité des pesticides réalisés sur des ouvrières d’une même espèce de bourdons ont confirmé que la toxicité est corrélée avec la taille du corps: les petits bourdons ont tendance à avoir une DL50
les bourdons de plus grandes tailles possédent un DL50 plus élevée (Thompson & Hunt 1999, Malone et al.
2000).
1.3.4.2.2 Contact avec des résidus
L'exposition avec des résidus de néonicotinoïdes peut se produire lorsque les abeilles butinent des fleurs ou marchent sur le feuillage de plantes qui ont été traitées par pulvérisation foliaire. Ceci est particulièrement problématique lorsqu’il s’agit d’un néonicotinoïde dont la persistance dans l’environnement est longue. Par exemple, des résidus de clothianidine appliquées sur le feuillage demeurent toxiques pour les abeilles de 5 à 21 jours après la pulvérisation (EPA 2010).
1.3.4.2.3 Le pollen et le nectar contaminés
Le pollen et le nectar des plantes peuvent être contaminés par des néonicotinoïdes, indépendamment du mode d’application de ces produits phytosanitaires. Les abeilles et autres pollinisateurs qui consomment du nectar et du pollen à l’intérieur desquels se retrouvent ces composés vont directement ingérer l’ingrédient actif toxique. Certains insecticides systémiques sont d’ailleurs très persistants et peuvent demeurer à l’intérieur des tissus des plantes pendant de nombreux mois, voire années, et ont le potentiel de s'accumuler suite à des applications répétées (Hopwood et al. 2012).
Les larves de l’abeille domestique sont en grande partie alimentées de gelée royale sécrétée par des ouvrières adultes et ne consomment que de petites quantités de miel dilué et de pollen (Winston 1987). En fait, l’alimentation directe du pollen correspond à seulement 5% de la diète en protéines lors du développement larvaire (Babendreier et al. 2004). Des néonicotinoïdes ont été retrouvés dans les pelotes de pollen rapportées aux ruches par les abeilles butineuses (Chauzat et al. 2006), dans le pollen entreposé à l’intérieur de la ruche (Bernal et al. 2010, Mullin et al. 2010, Krupke et al. 2012) ainsi que dans le miel entreposé à l’intérieur de la ruche (Chauzat et al. 2009). Pour ce qui est des abeilles indigènes de l’Amérique du Nord, les larves se nourrissent en général directement de pollen brut et de nectar pur (Michener 2007) et tous deux peuvent contenir des résidus de néonicotinoïdes.
1.3.4.2.4 Poussières de semences
La mise en terre de semences traitées aux néonicotinoïdes produit un échappement dans l’air de fines particules d’insecticide. Ces poussières d’enrobage, qui sont ensuite transportées par le vent et se déposent au sol et sur la végétation environnante, sont suffisamment contaminées à l’insecticide afin de causer la mort des abeilles exposées (Greatti et al. 2006, Marzaro et al. 2011, Krupke et al. 2012, Girolami et al. 2012, Tapparo et al. 2012). En Allemagne, plusieurs apiculteurs ont d’ailleurs subi d’importantes pertes de colonies au printemps alors que l’agent fixateur servant à maintenir l’insecticide autour des semences n’avait pas été appliqué et que de grandes quantités de poussières ont été émises dans l’air et ont dérivé sur la végétation en fleur à proximité (Pistorius et al. 2009).
L’ampleur de l’exposition en lien avec la production de poussière contaminée est inconnue, pourtant des millions d'hectares de semences traitées sont semées chaque année (Krupke et al. 2012). Afin de limiter la production de poussière et l’exposition pour les pollinisateurs, il est nécessaire d’utiliser uniquement des enrobages de semences de haute qualité. Malgré tout, même lorsque les traitements de semences sont adéquats, l’abrasion des grains entre eux et lorsqu’ils pénètrent dans le sol lors des semis produit un échappement de particules qui expose les abeilles à ces composés insecticides (Tapparo et al. 2012). En Amérique du Nord, où les traitements de semences néonicotinoïdes sont utilisés pour la protection de nombreuses cultures annuelles, de la poudre de talc ou de graphite est souvent utilisée comme agent de fluidité et ajouté au bac de semences afin de faciliter l’écoulement des grains enrobés et collants à l’intérieur des unités du semoir (Krupke et al. 2012). L’excédant de cet agent de fluidité est ensuite expulsé lors du semis, soit au sol ou dans l’air, par la trappe d’échappement derrière les semoirs. Des taux de clothianidine et de thiaméthoxame qui dépassent de loin les doses létales pour les abeilles ont été retrouvés dans le talc à la sortie des trappes d’échappement des semoirs de maïs (Krupke et al. 2012). Les poussières de talc et de graphite sont particulièrement fines et mobiles et peuvent facilement être transportées par le vent sur de grandes distances et contaminer la végétation à l’intérieur ou en périphérie du champ ensemencé (Krupke et al. 2012). Les abeilles qui volent traversent le nuage de poussières contaminées produit par les semoirs ou entrent en contact avec des résidus d’insecticides dérivant avec le vent risquent d’être exposées à des
quantités de néonicotinoïdes suffisantes pour les tuer (Krupke et al. 2012, Girolami et al. 2012, Tapparo et al. 2012).
1.3.4.2.5 Eau de guttation et rosée
La guttation est un processus biologique naturel chez les plantes vasculaires caractérisées par l’exsudation de gouttelettes d’eau, le matin, à l’extrémité et aux bords des feuilles. Les pollinisateurs peuvent recueillir ces gouttelettes d’eau sur la plante et s’exposer aux néonicotinoïdes qu’elles contiennent. Il a été démontré que l’eau de guttation provenant des plantules de maïs issus de semences traitées aux néonicotinoïdes peut contenir des concentrations assez élevées d’imidaclopride, de clothianidine et de thiaméthoxame et que ces gouttelettes sont hautement toxiques pour les abeilles (Girolami et al. 2009, Pistorius et al. 2012, Simon et al. 2013). Le maïs n’est pas la seule espèce végétale où des gouttelettes toxiques ont été observées. Des résidus d’insecticides systémiques ont également été retrouvés dans l’eau de guttation de plusieurs cultures comme la carotte, l’oignon, la betterave, le tournesol, la pomme de terre, le concombre (Pistorius et al. 2012). Des concentrations toxiques ont même été retrouvées dans les cultures de melon et de colza (Hoffmann & Castle 2012, Pistorius et al. 2012). Bien que la fréquence à laquelle l’eau de guttation est consommée par les abeilles soit inconnue, le risque associé à cette voie d’exposition est considéré comme étant faible. D’une part parce qu’il s’agit d’un phénomène qui nécessite des conditions de sol, de température et d’humidité spécifiques afin de se produire et d’autre part, car l’apparition des gouttelettes se fait tôt le matin et pour une courte période de temps. Considérant que l’abeille domestique requiert de grande quantité d’eau principalement pour réguler la température à l’intérieur de la ruche, il est peu probable que la température soit trop élevée tôt le matin (Johansson & Johansson 1978, Kühnholz & Seeley 1997, Gary 2005). De plus, les sources d’eau exploitées par les abeilles doivent être situées à proximité de la ruche, car lors du transport de l’eau les abeilles ne peuvent compter que sur leurs réserves métaboliques en énergie alors qu’elles peuvent, au besoin, consommer le nectar qu’elles transportent si elles manquent d’énergie (Gary 2005).