Diatomées des eaux courantes de Guyane : essai de biotypologie et application au diagnostic du bon état écologique
Texte intégral
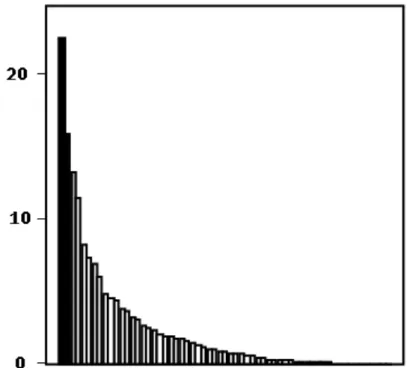
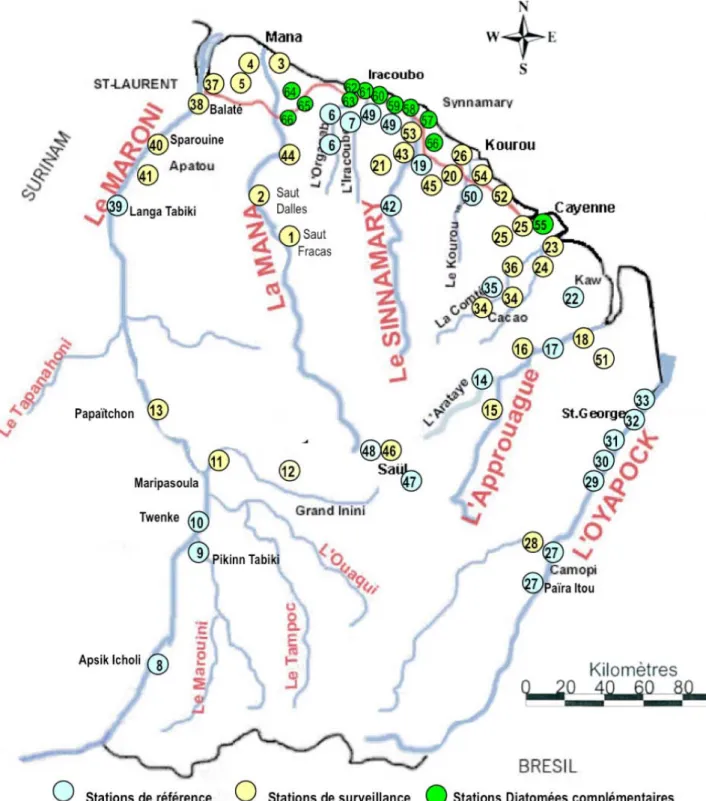
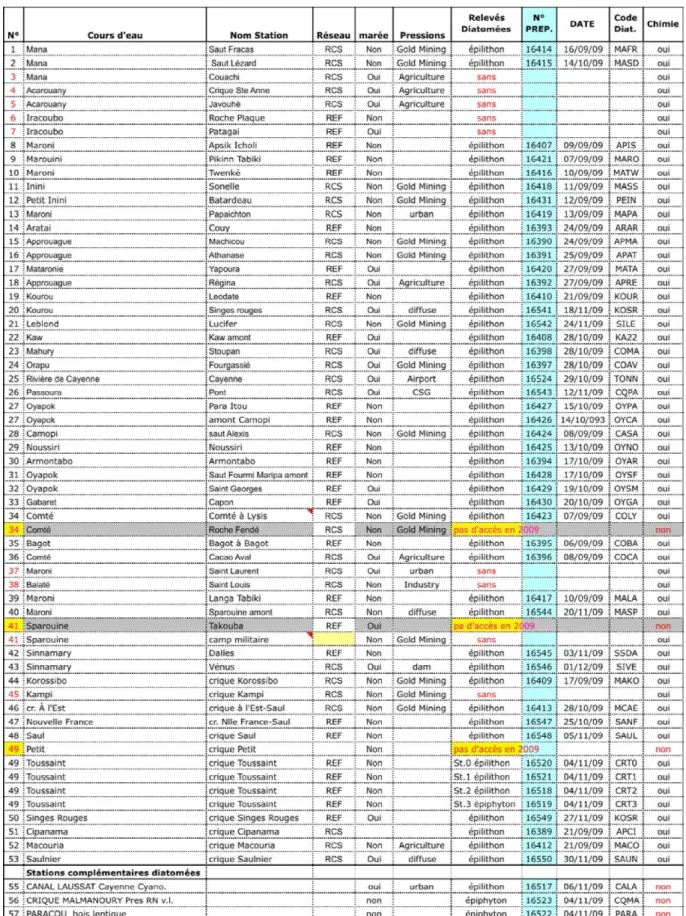
Figure

Documents relatifs
Tous les spécimens subissent une rupture en cisaillement, sauf la série de poutre SB-S2 (poutre élancée, avec espacement des aciers transversaux de s = d/4). Aucun des spécimens
Bloemen, S, Zwaveling, S, Douxfils, J, Peters, T, Wagenvoord, R, Hemker, HC, Mullier, F, de Laat, B, Roest, M & Kremers, R 2017, A New Method for Determining Concentrations
Ais Kind kommt Leyla nach Deutschland und findet eine Heimat - bis sie var ihrem gewalt- tatigen Mann in ein Frauenhaus fliehen
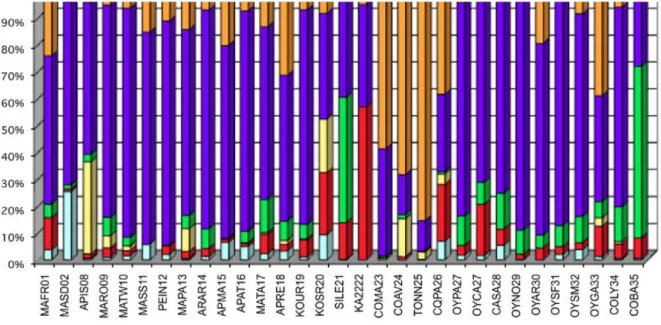
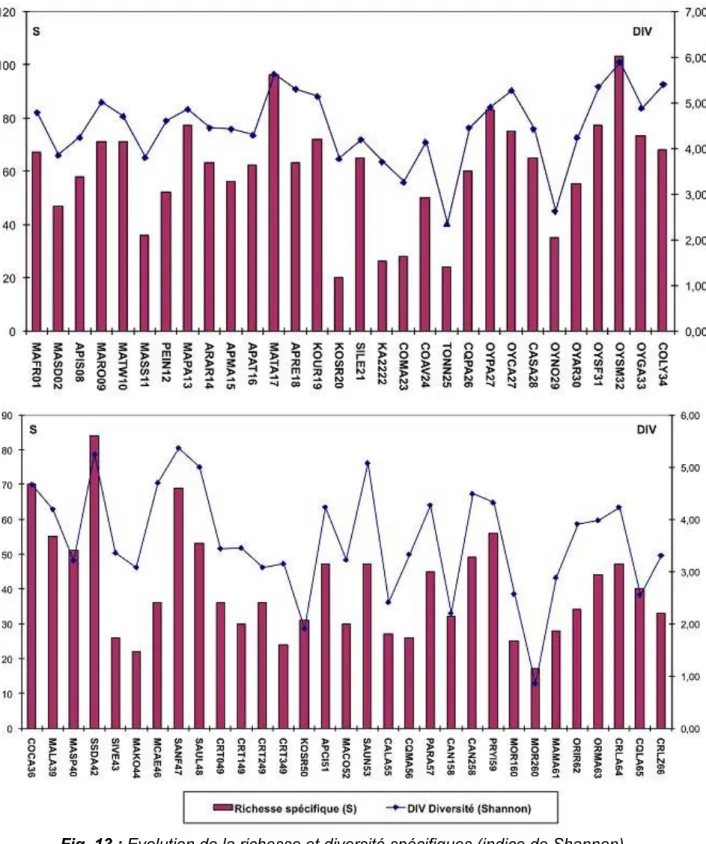
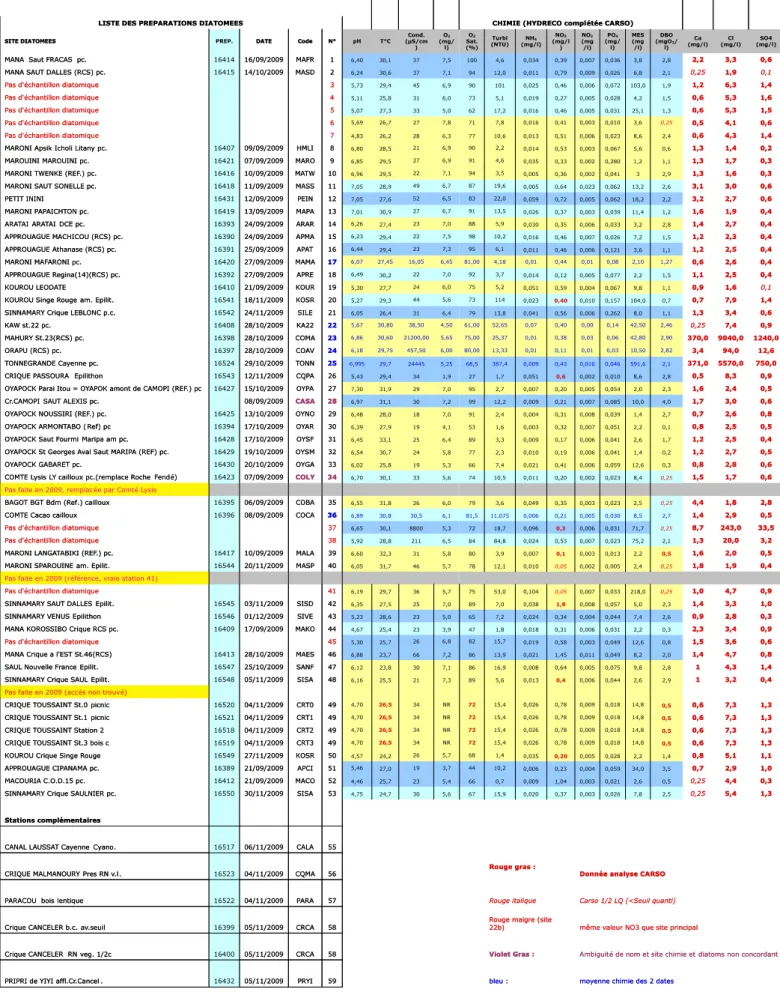
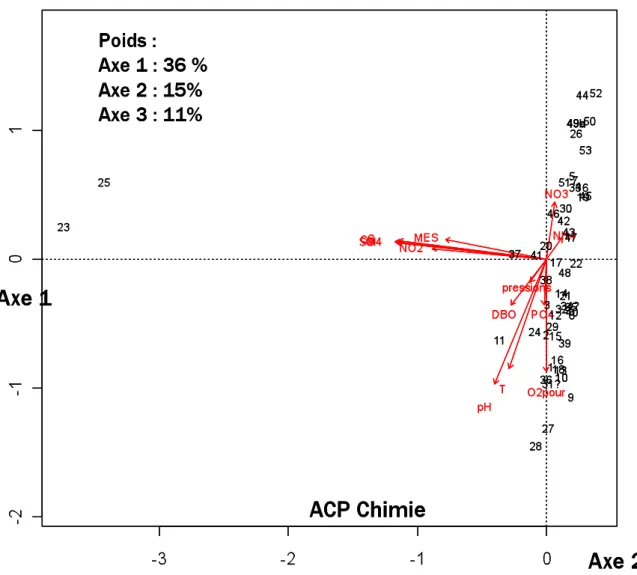
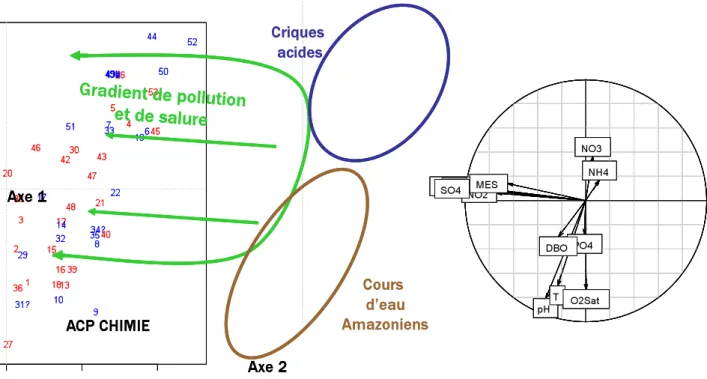
L'intérêt des organismes gestion- naires pour des méthodes alternatives capables d'être appliquées sur tous les types de cours d'eau et de donner des indications
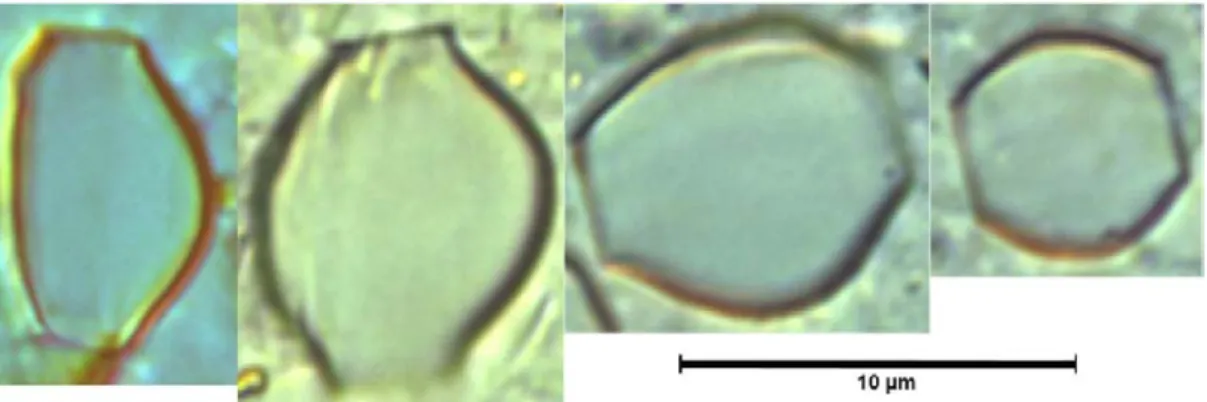
parvulum is known to be a species with a great morphological variability and taxonomists often have problems in distinguishing morphologically among taxa belonging
Es wurden viele wissenschaftliche Geräte ausgestellt die man sich anschauen konnte und mit denen man interagieren konnte wie zum Beispiel eine Zentrifuge oder einige
Woman Chillout #M102 Woman Chillout #M102 Pintura, 70x50x2 cm ©2022
[r]