N° d’ordre 2768 THÈSE DE DOCTORAT Présentée par Imane TAÏ Discipline : Biologie
Spécialité : Écologie marine
PEUPLEMENTS DÉMERSAUX ET ÉPIBENTHIQUES DES FONDS CHALUTABLES DE LA CÔTE NORD ATLANTIQUE
MAROCAINE
Soutenue le 16 mai 2015 devant le jury : Président :
Abdelaziz BENHOUSSA PES, Faculté des Sciences -Rabat Examinateurs :
Ahmed YAHYAOUI PES, Faculté des Sciences -Rabat Hocein BAZAIRI PH, Faculté des Sciences -Rabat
Hicham MASSKI Dr, Ecologue Halieute, INRH-Casablanca Ahmed ERRHIF PH, Faculté des Sciences Aïn Chock-Casablanca
Raemond LAË Directeur de Recherche, IRD, Brest-France
Faculté des Sciences, 4 Avenue Ibn Battouta B.P. 1014 RP, Rabat – Maroc
i
Je dédie cette thèse à toutes les personnes qui m’ont soutenu,
encouragé et supporté tout le long de mon parcours :
À la mémoire de ma grand-mère qui, malheureusement, nous a quitté
depuis deux ans ;
À ma chère maman, en témoignage de ma reconnaissance pour les
sacrifices qu’elle a consentis à mon égard, c’est grâce à elle que j’ai pu
finaliser ce travail ;
À mon père, en témoignage d’amour et de respect ;
À Karim mon mari, pour sa patience, son soutien moral et ses
encouragements ;
À mes adorables chéries Marwa, Lina et Lilia ;
À mes biens aimés Fadwa, Moussa, Meryem, Yassine, Hanane et Naoual ;
À tous les membres de ma grande famille pour leurs encouragements, en
particulier, hbibi Mustapha, tata Leïla, tata Batoula, Papi et la famille
Errhouni ;
ii
AVANT–PROPOS
Les travaux présentés dans ce mémoire ont été effectués dans le cadre des axes de recherche de
l’UFR "Biodiversité et Aquaculture" du Département de Biologie de la Faculté des Sciences de Rabat, laboratoire de Zoologie et de Biologie Générale. Mes premiers remerciements sont adressés à Monsieur le Doyen de la Faculté des Sciences de Rabat d’avoir accepté ma candidature.
Cette thèse a été réalisée au sein du laboratoire de Biologie et Ecologie du Département Ressources Halieutiques, à l’Institut National de Recherche Halieutique (INRH) à Casablanca. Ce travail s’inscrit ainsi dans le cadre d’une convention entre la Faculté des Sciences de Rabat et l’INRH.
Mes remerciements vont tout d’abord mon Directeur de thèse M. Hocein BAZAIRI pour tous les efforts qu’il a fournis pour l’aboutissement de ce travail, pour sa disponibilité, son appui et ses qualités humaines et professionnelles.
Je remercie également mon encadrant à l’INRH, M. Hicham MASSKI qui m’a aidé tout au long de cette étude, avec ses conseils, ses encouragements, sa disponibilité et sa grande générosité. Il a su encadrer ce travail, en y apportant son expérience scientifique et son savoir-faire. C’est grâce à lui que ce travail a pu voir le jour. Merci tout simplement.
Je tiens à remercier les différents membres du jury qui ont accepté d’évaluer mon travail : Je remercie chaleureusement M. Abdelaziz BENHOUSSA, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat, d'avoir accepté d’être le Président du jury de ma soutenance de thèse.
Mes remerciements les plus chaleureux vont à M. Ahmed YAHYAOUI, Professeur de l’Enseignement Supérieur à la Faculté des Sciences de Rabat, qui a m’a fait l’insigne honneur d’être rapporteur et membre de jury de cette thèse.
Mes remerciements les plus sincères à M. Ahmed ERRHIF, Professeur habilité à la Faculté des Sciences Aïn chock de Casablanca, pour avoir accepté d'être rapporteur de cette thèse et membre de son jury.
Je tiens à exprimer ma plus grande gratitude à M. Raymond LAË, Directeur de recherche à l’Institut de Recherche et Développement à Brest, pour avoir accepté d'être rapporteur de cette thèse et membre de son jury.
Mes remerciements vont aussi à Monsieur le Directeur Général de l'Institut National de Recherche Halieutique et Madame la Secrétaire Générale de l’INRH, pour l'intérêt qu'ils accordent au développement de la recherche scientifique dans notre établissement.
iii
J’adresse mes vifs remerciements à M. M. MALOULI IDRISSI, Chef du Département des Ressources Halieutiques à l’INRH, pour son appui et la confiance qu’il m’a accordée depuis sa nomination.
Cette thèse n’aurait pu voir le jour sans l’aide et l’encouragement de mes amis et collègues qui m’ont permis de travailler dans une ambiance agréable. Je pense plus particulièrement à S. BENCHOUCHA, S. ABDELLAOUI, A. CHAGHIF, M. NAJI et A. KELMOUNI, pour leur disponibilité, leur soutien et leur assistance au laboratoire, en mer et à terre.
Je remercie l’équipe de mon laboratoire K. MANCHIH, F. WAHBI, K. AMENZOUI, F.H. IDRISSI et R. ERROUAGUI pour les gestes d’encouragement et d’appui qu’ils ont toujours exprimé à mon égard.
J’adresse mes vifs remerciements à l’ensemble des amis et collègues de l’INRH particulièrement ; H. CHEHABI, N. MARFOUK, A. RARRAS, H. ELMOUTARAJI, A. BENAZOUZ, J. LARISSI, M. BARECHDI, H. EL HABOUZ, A. NAJD, A. BOUMAAZ, A. DRIDI, A. SRAIRI, A. RAMZI, J. BENSBAI, N. CHARKAOUI, A. ZOUBAI, S. KODAD, A. BENHADOUCH, R. HOUSSA et l’ensemble du personnel navigant à bord du navire de recherche Charif Al Idrissi.
Je n’oublirai pas de remercier Monsieur Bastien MERIGOT pour son aide précieuse et sa générosité à chaque fois que j’avais besoin de ses conseils.
Je ne manquerai pas également, de remercier chaleureusement Monsieur, Alexandre DEWEZ, pour m’avoir corrigé ce manuscrit avec un regard bien avisé.
Enfin, je remercie toutes les personnes qui m’ont aidé de près ou de loin à la concrétisation de ce travail, je citerai les chauffeurs de l’INRH, les collègues du Département d’Appui à la Recherche et tous ceux que je n’ai pas pu citer, qu’ils trouvent ici l’expression de ma profonde reconnaissance.
iv
RÉSUMÉ :
Le présent travail s’intéresse aux peuplements démersaux et épibenthiques des substrats meubles de la côte nord atlantique marocaine, entre Cap Spartel (35°47’N) et la région de Sidi Ifni (29°22’N). Cet écosystème de vasière, présente des caractéristiques hydrologiques et géomorphologiques particulières. Il est connu pour sa richesse en crevette rose (Parapenaeus
longirostris) et merlu blanc (merluccius merluccius) et abrite également des poissons associés à
haute valeur commerciale tels que les pagres, les dorades, les lottes, les poissons plats…etc. Face à l’exploitation intense de cet écosystème et afin d’assurer la pérennité de ces ressources, le suivi scientifique régulier au moyen des campagnes de prospection par chalutage de fond a été assuré par l’Institut National de Recherche Halieutique (INRH) depuis les années 1980. Le présent travail s’inscrit dans un objectif plus général d’étudier les peuplements démersaux et épibenthiques de la zone précitée. Les données utilisées proviennent de la série historique des campagnes scientifiques de prospection par chalutage entreprises par l’INRH, entre 1981 et 2010. Les résultats montrent que l’ensemble de la zone d’étude peut être considérée comme une seule unité biogéographique, du point de vue des peuplements qu’elle abrite. Un total de 334 espèces a été recensé avec une prédominance du groupe des poissons osseux et des espèces subtropicales. Les analyses multitableaux ont mis en évidence la forte stabilité temporelle de l’organisation spatiale des assemblages de poissons démersaux entre 2000 et 2010. La composition spécifique des assemblages est organisée autour de trois zones bathymétriques au sein desquelles s’exprime l’hétérogénéité des habitats.
Quatre assemblages ont été mis en évidence par cette étude : le premier côtier, inféodé aux fonds vaso-sableux situés à moins de 100 m de profondeur. Il comporte des espèces de faible niveau trophique et un mégabenthos riche et diversifié. Le second est propre au talus continental, sur des fonds essentiellement vaseux au-delà de 300 m de profondeur. Il est pauvre en mégabenthos et riches en ressources zooplanctoniques, notament les crevettes. Un troisième assemblage localisé entre 100 et 200 m de profondeur sur des substrats meubles à proximité des fonds rocheux et coralligènes. Il est constitué d’espèces de faible niveau trophique. Ces communautés sont parmi les moins diversifiées. Un quatrième assemblage à répartition plus large, qui se distingue par la dominance d’espèces ubiquistes, qui effectuent des migrations saisonnières, liées à leur cycle de vie, de la côte vers le large et qui, à l’âge adulte abondent principalement au niveau du plateau profond et le haut du talus continental.
La bathymétrie, les caractéristiques de l’habitat et la nature du substrat semblent jouer un rôle prépondérant dans cette structuration.
Mots clés :
v
ABSTRACT :
This work focuses on demersal and epibenthic communities along the northern Atlantic waters of Morocco, between Cape Spartel (35° 47'N) and the region of Sidi Ifni (29° 22'N). This is a transition zone between northeastern Atlantic warm-temperate waters, cold-temperate waters and Mediterranean outflow. This area is influenced by the Canary current and characterized by the occurrence of strong upwelling during summer. The continental shelf is characterized by a wide range of soft bottom (sand, mud and muddy sand) and hard bottoms (rocky and coralligenous) and the occurrence of a coral barrier (Dendrophyllia ramea). All these characteristics give to this region an important biodiversity, which includes a wide range of species, many of which are of commercial interest. The most important target species in this region are white hake Merluccius merluccius and pink shrimp Parapenaeus longirostris.
This work aims to study the biological marine diversity aspects and the spatial distribution of the soft bottom species in the area, on the basis of regular monitoring of nearly 30 years, through scientific bottom trawl surveys. Data used are collected from 46 bottom surveys, undertaken by the Marine National Research Institute (Institut National de Recherche Halieutique INRH), during the period 1981-2010, at depths ranging from coast to 900 m. 334 species were identified.
The class of actinopterygians ranks with the dominance of subtropical species affinity.
The multitable analysis showed that the demersal fish assemblages of the study area exhibited strong spatial structuring, mainly orientated along a bathymetric gradient. As a result of multivariate analyzes, four assemblages were defined. The group I, was located from 200 to 300 m, on the muddy-sands bottoms on the outer continental shelf and the upper slope, and characterized by high abundance and high diversity. The group II, distributed on trawlable bottoms between 100 to 200 m, limited and influenced by the rocky and coralligenous grounds. The group III, localized on the middle slope, beyond 300 m depth, on muddy bottoms and characterized by deep sea species. The group IV, situated in less than 100 m depth on sandy-muddy bottoms and characterized by typical shelf species. Each assemblage was characterized by specific species and had both qualitative and quantitative differences.
Depth appeared to be the main structuring factor of demersal and epibenthic communities in the northern Atlantic coast of Morocco. The substrate type seems also, play an important role in this structuration.
Keywords :
vi
Sommaire
INTRODUCTION GÉNÉRALE... 1
CHAPITRE I. ... 6
CADRE GÉOGRAPHIQUE ET CONTEXTE ÉCOLOGIQUE ... 6
I. ENVIRONNEMENT CLIMATIQUE ET OCÉANOGRAPHIQUE DE LA ZONE NORD ATLANTIQUE MAROCAINE ... 7
1. Climat Général ... 7
2. Caractéristiques Géomorphologiques et nature du fond ... 7
3. Environnement océanographique ... 14
4. Productivité du milieu ... 21
II. PRÉSENTATION DES PEUPLEMENTS DE FOND DE LA ZONE NORD ATLANTIQUE MAROCAINE ... 22
II. 1. Biogéographie... 22
II. 2. Description des peuplements de fond de la côte nord atlantique marocaine ... 25
II. 3. Associations faunistiques ... 30
I. CONCLUSION ... 35
CHAPITRE II. ... 36
PEUPLEMENTS DES FONDS CHALUTABLES DE LA COTE NORD ATLANTIQUE MAROCAINE : ... 36
COMPOSITION ET REPARTITION ... 36
I. INTRODUCTION... 37
II. MATÉRIEL ET MÉTHODES... 38
III. RÉSULTATS ... 43
III.1. Composition du peuplement ... 43
III.2. Les poissons osseux : Actinoptérygiens ... 44
III.3. Les poissons cartilagineux : Élasmobranches ... 50
III. 4. Les Crustacés ... 54
III. 5. Les Céphalopodes ... 57
III. 6. Autres groupes zoologiques ... 60
III. 7. Composante spatiale ... 60
IV. DISCUSSION ... 68
V. CONCLUSION ... 72
CHAPITRE III. ... 73
ORGANISATION SPATIO-TEMPORELLE DES PEUPLEMENTS ICHTYQUES DE LA COTE NORD ATLANTIQUE MAROCAINE ... 73
I. INTRODUCTION... 74
II. MATÉRIELS ET MÉTHODES ... 75
II. 1. Évolution spatio-temporelle... 75
II. 2. Organisation spatio-temporelle ... 76
II. 3. Évolution temporelle ... 77
III. RÉSULTATS ... 78
III. 1. Évolution spatio-temporelle... 78
III. 2. Analyse de l’organisation spatio-temporelle ... 83
vii
III. DISCUSSION ... 96
II. CONCLUSION ... 100
CHAPITRE IV. ... 102
CARACTERISATION DES ASSEMBLAGES DEMERSAUX ET EPIBENTHIQUES DE LA COTE NORD ATLANTIQUE MAROCAINE ... 102
I.INTRODUCTION ... 103
II. MATÉRIELS ET MÉTHODES... 104
II. 1 Échantillonnage ... 104
II. 2 Analyse des données ... 106
II. 2. 3 Caractérisation des peuplements ... 109
IV. RÉSULTATS ... 111
III. 1. Description du peuplement ... 111
III. 2. Structuration spatiale de la faune épibenthiques et démersale... 114
III. 3. Caractérisation des peuplements ... 119
III. DISCUSSION ... 128
IV. CONCLUSION ... 131
SYTHÈSE ET CONCLUSION GÉNÉRALE ... 132
RÉFÉRENCES BIBLIOGRAPHIQUES ... 141
ANNEXES ... 156
viii
Liste des tableaux
Tableau 1. Répartition des zones chalutables du plateau continental de Cap Spartel au Cap Draâ (Belvèze et Bravo de Laguna 1980) ... 12 Tableau 2. Composition biogéographique de la faune ichthyologique du Maroc (Furnestin et al. 1958) ... 24 Tableau 3. Composition spécifique des autres invertébrés marins (1981-2010) ... 60 Tableau 4. Comparaisons multiples des indices d’abondance par paires suivant la procédure de
Steel-Dwass-Critchlow-Fligner / Test bilatéral ... 81 Tableau 5. Comparaisons multiples de la richesse spécifique par paires suivant la procédure de
Steel-Dwass-Critchlow-Fligner / Test bilatéral ... 82 Tableau 6. Répartition des espèces au sein des classes construites par la classification ... 91 Tableau 7. Liste des espèces prises en compte dans l’analyse multivariée ... 108 Tableau 8. Distribution bathymétrique des espèces communes et fréquentes sur la base des fréquences
d’occurrence ... 113 Tableau 9. Résultats de l’Analyse de Variance Multiple non paramétrique pour tester l’effet de la
profondeur, la latitude, la nature du substrat et la durée de chalutage sur la richesse spécifique ... 114 Tableau 10. Résultats de l’Analyse de Variance Multiple non paramétrique pour tester l’effet de la
profondeur, la latitude, la nature du substrat et la durée de chalutage sur l’abondance des espèces .. 115 Tableau 11. Résultats de l’Analyse de Variance Multiple non paramétrique pour tester l’effet de la
profondeur, la latitude, la nature du substrat et la durée de chalutage sur la biomasse des espèces ... 115 Tableau 12. Nombre de traits de chalut, abondances totale, biomasse totale et indices de biodiversité par
groupe ... 120 Tableau 13. Test de comparaisons multiples de Steel-Dwass-Critchlow-Fligner par paires de groupe
d’assemblages calculé pour l’abondance et la richesse ... 121 Tableau 14. Les espèces indicatrices des groupes identifiés (méthode IndVal) ... 121 Tableau 15. Pourcentages en nombre et en poids des 10 premières espèces dominantes dans les différents
ix
Liste des figures
Figure 1. Zone d’étude et principaux cours d’eau (Ibouhouten et al. 2010) ... 9 Figure 2. Carte de la nature de fond et la bathymétrie de la zone, les informations sur les zones chalutables
et non chalutales datent des années 1980 (INRH 2009) ... 11 Figure 3. Carte biosédimentaire du plateau continental entre Tanger et El Jadida (Bayed et Glémarec 1987) ... 14 Figure 4. Schéma des principaux courants dans le bassin du courant des Canaries. Les courants principaux
: courants superficiels (bleu clair); le courant de fond (en bleu foncé) ; Les caps majeurs, sources d'eaux douces (flèches bleues) et des apports de poussière (> 10 g m-² y -¹ en hachuré jaune) ; Les zones de rétention (orange) et de dispersion (vert) situées sur le plateau continental ; Les zones frontales entre des masses d'eau (tirets bleus) et les structures tourbillonnaires mesoéchelles (bleu : cyclones ; rouge : anticyclones) au sud des Îles Canaries. Les différentes masses d’eau : Eau Centrale Nord Atlantique (NACW) ; SACW : Eau Centrale Sud Atlantique (SACW) ; le Courant des Açores (AC) ; le Courant des Canaries (CanC) ; le Courant Mauritanien (MC) ; Courant Nord Equatorial (NEC) ; Contre courant Nord équatorial (NECC). (Arístegui et al 2009) ... 15 Figure 5. Diagramme de Hovmöller représentant l’indice d’upwelling et la largeur du plateau continental
(ligne noir) (Nieto et al. 2012) ... 19 Figure 6. Localisation des principales zones d’upwelling le long de la côte marocaine (Makaoui 2008) ... 19 Figure 7. Variabilité saisonnière et interannuelle de l’indice d’upwelling à long terme (1982-2011). a)
Diagramme de Hovmöller représentant l’indice d’upwelling.Tendances de la SSTmax (ligne rouge), la SST min (ligne bleu), l’IUCSST (ligne noire) pour les zones : b) Cap Ghir (31.5), c) 26-33°N (Benazouz et al. 2014a, b) ... 21 Figure 8. Répartition des principales espèces péchées au large d’Asilah, en fonction de la bathymétrie et de
la nature des fonds. A - Fonds de 180 à 220 m, vase sableuse détritique à Caryophyllia clauus et Brissopsis lyrifera. B - Fonds de 300 à 350 m, sable vaseux détritique à Caryophyllia clauus et Munida
cuvuimana. C - Fonds de 350 à 500 m, vase profonde peu sableuse à Açtinauge. D – Fonds de 500 à 600
m, vase à Isidella (Maurin 1968). ... 33 Figure 9. Répartition des principales espèces rencontrées au sud d'Agadir. A - Fonds de 10 à 30 m, sables
vaseux à alcyonaires et Atelecyclus. B - Fonds de 40 à 80 m, vase terrigène à Cymbium et Inachus. C - Fonds de 100 à 150 m, sables vaseux à Leptometra. D - Fonds de 350 à 450 m, vase à funiculines (Maurin 1968). ... 34 Figure 10. Photo du navire de recherche CHARIF AL IDRISSI ... 38 Figure 11. Photos de l’engin de pêche utilisé à partire de 1994 (photos 1 et 2) et du contenu du chalut après
30 min de chalutage (photo 3) ... 39 Figure 12. Évolution du réseau d’échantillonnage : (a) plan d’échantillonnage systématique. (b) plan
d’échantillonnage aléatoire stratifié. (c) réseau d’échantillonnage aléatoire stratifié maillé couvrant deux sous zones distinctes. (d) réseau d’échantillonnage aléatoire stratifié couvrant toute la zone. ... 41 Figure 13. Composition des captures lors des campagnes de prospection par chalutage de fond (1981-2010). . 44 Figure 14. Composition spécifique par famille des Actinoptérygiens récoltées dans la zone d’étude entre 1981
et 2010. ... 45 Figure 15. Principales espèces d’Actinoptérygiens captures en fonction de leur fréquence d’occurence ... 46 Figure 16. Répartition des Actinoptérygiens selon leur mode de vie (a) et leur affinité biogéographique (b) .... 47
x
Figure 17. Amplitudes latitudinales des Actinoptérygiens par groupe taxonomique. Le rectangle rouge
correspond aux coordonnées latitudinales de la zone d’étude. ... 48
Figure 18. Répartition bathymétrique des Actinoptérygiens par famille. ... 49
Figure 19. Composition spécifique des Élasmobranches (a) et principales espèces d’Élasmobranches capturées en fonction de leur fréquence d’occurrence(b) ... 51
Figure 20. Répartition des Élasmobranches (a) selon leur mode de vie. (b) selon leur affinité biogéographique ... 52
Figure 21. Amplitudes latitudinales des Élasmobranches par groupe taxonomique. Le réctangle rouge correspond aux coordonnées latitudinales de la zone d’étude Amplitudes latitudinales ... 53
Figure 22. Répartition bathymétrique des élasmobranches ... 54
Figure 23. Composition spécifique des Crustacés (a) et Principales espèces de Crustacés capturées en fonction de leur fréquence d’occurrence (b) ... 55
Figure 24. Répartition des Crustacés selon leur mode de vie(a) et selon leur affinité biogéographique (b). ... 56
Figure 25. Répartition bathymétrique des Crustacés ... 57
Figure 26. Composition spécifique des Céphalopodes (a) et Principales espèces de céphalopodes capturées en fonction de leur fréquence d’occurrence (b). ... 58
Figure 27. Répartition des Céphalopodes selon leur mode de vie a) et selon leur affinité biogéographique (b) ... 59
Figure 28. Répartition bathymétrique des Céphalopodes ... 59
Figure 29. Cartographie de l’ensemble des traits de chaluts effectués durant la période 1981-2010 ... 61
Figure 30. Évolution de la richesse spècifique en function de l’effort d’échantillonnage ... 62
Figure 31. Distribution de la richesse totale toute espèces confondues (1981-2010) ... 63
Figure 32. Évolution de la richesse spécifique (série 1981-2010) en fonction de la profondeur (strates bathymétriques) (a) et en fonction de la latitude (degrés) (b) ... 64
Figure 33. Évolution de la biomasse moyenne en fonction de l’effort d’échantillonnage ... 65
Figure 34. Distribution de la biomasse moyenne, toutes espèces confondues (1981-2010) ... 66
Figure 35. Évolution de la biomasse moyenne (série 1981-2010) en fonction de la profondeur (strates bathymétriques) (a) et en fonction de la latitude (degrés) (b) ... 67
Figure 36. Schéma simplifié de fonctionnement de la méthode STATIS. ... 77
Figure 37. Évolution spatio-temporelle de la richesse spècifique et des indices d’abondance : a) richesse spècifique par campagnes, b) richesse spècifique par latitudes, c)richesse spècifique par strates de profondeur, d) indices d’abondances par campagnes, e) indices d’abondance par latitude, f) indices d’abondance par strates bathymétriques. ... 80
Figure 38. Courbes k-dominance en biomasse par campagne... 83
Figure 39. Le plan principal de l’Interstructure de l’analyse Statis-CoA bidimensionnel explique 67% de l’inertie totale ... 84
Figure 41. Plan principal de l’analyse multitableaux réalisée sur les campagnes de prospection par chalutage, effectuées entre 2000 et 2010. ... 86
Figure 42. Projection spatiale des coordonnées des stations sur les trois premiers axes de Statis (axe 1, axe 2 et axe3). Négatif en bleu et positif en rouge ... 87
Figure 43. Projection des coordonnées des espèces sur les trois premiers axes de Statis (axe 1, axe 2 et axe 3) ... 89
Figure 44. Projection des trajectoires des espèces sur le plan principal du compromis de l’analyse STATIS. ( ) Position de chaque espèce par campagne ... 90
Figure 45. Classification des espèces sur la base de la variabilité de leur trajectoire autour du compromis de l’analyse STATIS-CoA... 91
xi
Figure 47. Projection de la variabilité des trajectoires des espèces sur le plan 1*3 ... 93 Figure 48. Évolution de la biomasse par assemblage de poissons ... 95 Figure 49. Évolution de la richesse specifique par assemblage de poissons ... 95 Figure 51. Composition spécifique des captures, (a) proportions en nombre d’espèces (richesse totale), (b)
proportions en nombre d’individus (abondance totale), (c) proportion en poids (biomasse totale)... 112 Figure 52. Cartographie de la richesse spécifique, l’abondance et la biomasse ... 113 Figure 53. Plan factoriel (30% d’inertie totale) de l’analyse en composantes principales. Le cercle de
corrélation des espèces (a) Projection des traits de chalut (b) ... 116 Figure 54. Classification ascendante hiérarchique (lien moyen) des traits de chalut réalisée à partir des
coordonnées factorielles d’une Analyse en Composantes Principales calculée sur les abondances des espèces... 118 Figure 55. Cartographie des abondances (ind/h) des différents groupes d’assemblages identifiés ... 119 Figure 56. Variations des dominances dans la zone nord atlantique marocaine (été 2010) ... 123 Figure 57. Courbes ABC par groupe, basées sur l'abondance et la biomasse dans la zone nord atlantique
marocaine (été 2010) ... 124 Figure 58. Proportions des groupes fonctionnels dans les 4 assemblages identifiés : (a) pourcentage en
1
2
L’impact de l’Homme par la pêche, la pollution, l’urbanisation, le trafic maritime et la destruction des habitats et de la nature, par le changement climatique et les catastrophes naturelles, se fait ressentir de plus en plus sur la biodiversité marine (Lobry et al. 2003). La pression de pêche affecte, indirectement, la structure des communautés et le fonctionnement général des écosystèmes marins (Shears et Babcock 2003, Gray et al. 2005). Elle contribuerait à réduire la capacité de résistance des peuplements marins face aux modifications des conditions du milieu (Cury et al. 2008). Elle modifie les caractéristiques biologiques des espèces exploitées, par une diminution des biomasses, des changements dans la densité et dans la répartition spatiale, une réduction de la taille moyenne des individus et de l'âge à la première maturité sexuelle et des modifications de la structure trophique (Blaber et al. 2000, Däan et al. 2005, Piet et Jennings 2005, Shin et al. 2005, Kifani et al. 2008). L’effet de la surexploitation peut conduire, non seulement à l’effondrement de certains stocks, mais aussi à la disparition complète de certaines espèces (Charuau et Biseau 1989, Myers et Worm 2003, Worm et al. 2006). Ainsi, la dégradation de la biodiversité marine peut s’aggraver rapidement et considérablement sous l’effet de l'exploitation intense des ressources halieutiques (Jennings et Kaiser 1998, Blaber et al. 2000, Shears et Babcock 2003). Or, il est presque impossible d’évaluer l’ampleur et les effets de ces modifications, tant que les mécanismes et les processus régissant la biodiversité marine sont peu connus (Angel 1993, Nye et al. 2009).
L’étude de la biodiversité marine, et ses dynamiques spatiale et temporelle, est fondamentale pour analyser la structure et le fonctionnement des écosystèmes marins (Gaertner 1997, Whitfield et Elliott 2002, Martin et McKay 2004). D’autant plus que l’exploitation intense des ressources vivantes modifie la structure des écosystèmes marins (Roberts 1995). Selon Martin et McKay (2004), la connaissance de la diversité biologique marine par l’étude de
3
l’assemblage des gènes, des individus, des espèces, des populations, des peuplements ou des communautés, qui sont présents dans des régions géographiques déterminées, permet de comprendre la structure et le fonctionnement des écosystèmes marins.
À l’échelle du Maroc, les ressources marines sont des plus riches et des plus diversifiées du bassin méditerranéen et du proche atlantique (DE 2012). La faune marine, encore incomplètement répertoriée, compte environ 7826 espèces connues (ENB 1998, DE 2014). Le potentiel biologique exploitable est estimé à 500 000 tonnes pour les espèces demersales et à 1 500 000 tonnes pour les espèces pélagiques (DPM 2012). La production halieutique totale a atteint 1 165 000 tonnes, pour une valeur de 7,82 milliards de Dirhams en 2012, contribuant pour près de 58% aux exportations alimentaires (DPM 2012), plaçant ainsi le Maroc parmi les grandes nations halieutiques et au premier rang des producteurs africains (Hourmat Allah et El Morchid 2011).
La zone nord atlantique marocaine s’étend du Cap Spartel (35°47’N) à la région de Sidi Ifni (29°22’N), à des profondeurs allant de la côte jusqu’à 900 m. C’est un écosystème de vasières, distingué par une grande diversité biologique peu explorée (INRH 2002). Il est connu, historiquement, pour sa richesse en crevette rose (Parapenaeus longirostris Lucas, 1846) et en merlu blanc (merluccius merluccius Linnaeus, 1758) (Cervantes et Goñi 1986, Sobrino et Garcia 1994, Benchoucha et al. 2008, El Habouz 2011). Ces deux espèces font l’objet d’une pêche ciblée de plusieurs flottes de pêche et revêtent un intérêt économique important (El Ouairi et Idlhaj 1993, INRH 2002). Quoique les dernières évaluations de la FAO (2010) indiquent que ces deux stocks sont surexploités. Les biomasses actuelles représentent 34% et 57% de la biomasse cible, respectivement pour la crevette rose et le merlu blanc (FAO 2010). Cette surexploitation
4
constitue un indicateur des pressions subies par les stocks, mais ne renseignent pas sur les évolutions dans les peuplements marins en termes de composition et de structure.
En dépit de l’importance biologique, écologique et socioéconomique de cet écosystème, c’est un milieu qui est resté peu investigué. Les études relatives aux communautés de fond sont de nature monospécifique, focalisées sur la dynamique de population et certains aspects de la biologie des espèces à intérêt économique, sans tenir compte des espèces avec peu ou pas de valeur commerciale. D’où la nécessité d’approfondir les connaissances sur le peuplement marin en sa globalité, en tenant compte des associations entre espèces et des facteurs environnementaux susceptibles de les influencer. La présente étude s’intègre dans cette thématique et constitue la première contribution qui vise à étudier, la communauté demersale et épibenthique des fonds meubles de la côte nord atlantique marocaine, à travers les campagnes de prospection par chalutage de fond.
La démarche suivie dans la présente étude consiste, tout d’abord, à compiler et synthétiser l’existant en matière de travaux scientifiques réalisés au niveau de la zone d’étude. Cette partie présente un descriptif du milieu d’étude et une synthèse de l’état des connaissances sur les peuplements marins de fond dans la zone nord atlantique marocaine (chapitre I).
Un inventaire faunistique de la mégafaune des fonds chalutables au niveau de la zone d’intérêt a été établi, en capitalisant la série historique des campagnes scientifiques menées par l’INRH, sur une durée de 30 années. Ce travail a permis de décrire la biodiversité de la zone d’étude et de réaliser une caractérisation biogéographique et écologique, au sein des grands groupes taxonomiques (chapitre II).
5
L’organisation spatio-temporelle des poissons demersaux au niveau de la zone d’étude, a été analysée à partir des données issues des campagnes de prospection réalisées entre 2000 et 2010. Cette analyse a mis en évidence la forte stabilité dans l’organisation spatiale des assemblages étudiés durant une décenie et a permis de détérminer les principaux facteurs environnementaux susceptibles d’expliquer cette organisation (chapitre III).
Enfin, la caractérisation des assemblages démersaux et épibenthiques, en termes d’abondances, de biomasse et de diversité, a été realisée en se basant sur la campagne de prospection par chalutage de fond réalisée en juillet 2010, vu que c’est une campagne exceptionnelle durant laquelle, plusieurs informations ont été collectées pour la première fois. Cette étude a permis d’identifier des assemblages de stations, sur la base de leur composition en espèces et de mettre en exergue les liens existants au sein des peuplements (chapitre IV).
6
Chapitre I.
7
I. ENVIRONNEMENT CLIMATIQUE ET OCÉANOGRAPHIQUE DE LA
ZONE NORD ATLANTIQUE MAROCAINE
1. Climat Général
La côte nord atlantique marocaine comprise entre Cap Spartel (35°47’N) et Sidi Ifni (29°22’N) se situe au niveau de la zone subtropicale. Son climat est régulé par la conjugaison de deux unités distinctes ; l’anticyclone des Açores et la dépression saharienne (Belvéze 1983, Orbi et Nemmaoui 1992). Le déplacement saisonnier de ces deux unités engendre, sur la façade Atlantique, un régime éolien (Alizés) dont la direction est sensiblement parallèle à la côte (Nord-Est).
La zone d’étude se distingue par un climat très variable selon les régions : le littoral bénéficie d’une influence océanique. Il est de caractère méditerranéen, tempéré à chaud avec un été chaud et sec et un hiver relativement doux et pluvieux (Emberger 1971). Alors que l’intérieur des terres se caractérise par une diversité bioclimatique importante : sub-humide (entre Tanger et Rabat), semi-aride (entre Casablanca et Safi) et aride (entre Essaouira et Tiznit) (Matuhe 2001).
2. Caractéristiques Géomorphologiques et nature du fond
En ce qui concerne la géomorphologie, la façade maritime de la zone d’étude s’étend sur environ 1200 km (figure 1). C’est un écosystème de vasières, alimenté par des bassins versants transportant des quantités variables d’eaux et de sédiments. La zone littorale reçoit des apports liquides et terrigènes des plus importants fleuves du Maroc (Bayed 1991, Cheggour 1999) et des résurgences de sources sous-marines en plusieurs endroits (Safi, El Jadida, au Sud d’Agadir) (Collignon 1965).
8
Les six principaux oueds, qui y débouchent se présentent du nord au sud comme suit ; Loukkos, Sebou, Bou Regreg, Oum Er Rbia, Tensift, Souss-Massa. Ces oueds présentent des caractéristiques hydrologiques très différentes, compte tenu de leurs bassins versants et du nombre de barrages érigés sur leur parcours, avec toutes les conséquences engendrées en termes d’apports terrigènes, notamment pendant la saison d’hiver et les périodes de crues. Leurs débits moyens se présentent comme suit (Riad 2003, Cherkaoui 2006) :
· Loukkos : débit très irrégulier, presque nul en été et pouvant atteindre 3400m3/s en
hiver. Le débit moyen est de 42,5 m3/s ; · Sebou : débit moyen de 137 m3/s ;
· Bou Regreg : débit moyen de 23 m3/s ;
· Oum Er Rbia : débit moyen de 105 m3/s ;
· Tensift : débit très irrégulier, presque nul en été et pouvant atteindre 1200m3/s en
hiver ;
· Souss-Massa : débit très irrégulier, presque nul en été et pouvant atteindre 1200m3/s
en hiver.
Les trois bassins versants Sebou, Oum Er Rbia et Bou Regreg renferment à eux seuls plus des 2/3 du potentiel hydraulique du pays (Bayed 1991, Cheggour 1999, Cherkaoui 2006).
9
Figure 1. Zone d’étude et principaux cours d’eau (Ibouhouten et al. 2010)
Le plateau continental se présente en pente généralement douce inférieure à 1‰, orientée vers le large, suivie d’une pente brusque, dont l’inclinaison peut atteindre 25‰, du rebord continental jusqu’aux fonds de 250 à 300 m. À partir de ces profondeurs, la pente s’adoucit, formant un palier jusqu’aux fonds de 400 à 600 m selon la région, puis replonge jusqu’aux abysses (Furnestin 1957, Refk 1985).
La largeur du plateau continental varie, selon la position géographique, de 30 à 150 km (Moujane 2011). Il s’étrécit jusqu’à une vingtaine de kilomètres en deux points où il est entaillé par des baies sous-marines évasées et profondes : la fosse de Rabat-Mehdia au Nord
10
et celle d’Agadir au Sud (Furnestin 1957). Quoiqu’au nord du cap Ghir, la largeur de cette plateforme varie entre 5 et 25 m ; elle tend à s’approfondir de Safi (50 m) jusqu’au Cap Ghir (200 m) (Bernikov 1991, Orbi et al. 1998). Au Sud du Cap Ghir, elle devient plus large, moins profonde, et sa pente s’affaiblit.
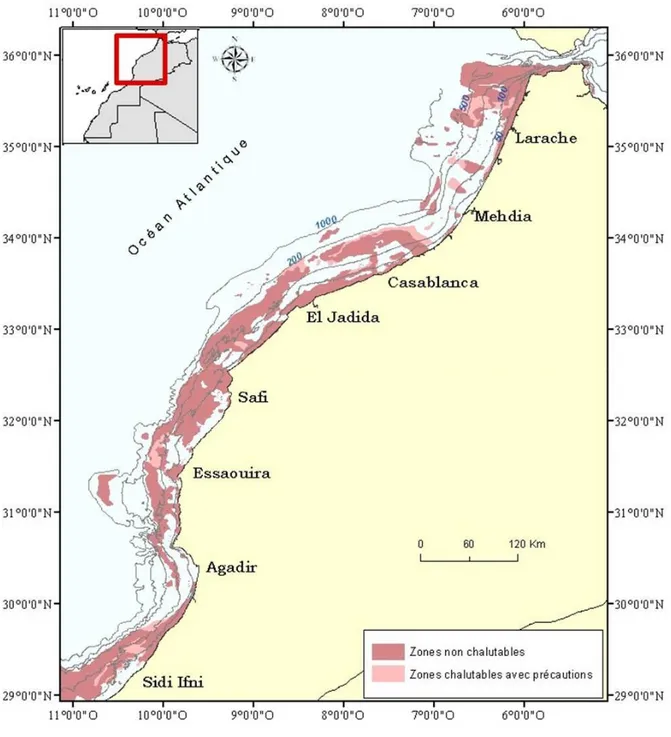
Depuis la fin du 19ème siècle, les chercheurs européens se sont intéressés à la nature du fond des côtes marocaines. Plusieurs cartes des fonds de pêche ont été publiées par différents auteurs (e.g. Lozano 1948, Navarro et Lozano 1950, Maurin 1962, Collignon 1965, Maurin et Bonnet 1969, Bonnet Duclerc et Pichot 1971, Belvèze et Bavo de Laguna 1980). Certains travaux (Gruvel 1925, 1929, Gruvel et Besnard 1933, Maurin 1962, Collignon 1965, Bayed et Glémarec 1987, INRH 2009) ont synthétisé les connaissances acquises sur les fonds de pêche du plateau continental marocain et ont fourni des précisions sur la répartition des fonds meubles chalutables et des zones non chalutables (rocheuses et coralligènes) (Figure 2).
11
Figure 2. Carte de la nature de fond et la bathymétrie de la zone, les informations sur
les zones chalutables et non chalutales datent des années 1980 (INRH 2009)
Les proportions des zones chalutables, entre Cap Spartel et Cap Draâ, de la côte à 500 m de profondeur sont présentées au tableau 1.
12
Tableau 1. Répartition des zones chalutables du plateau continental de Cap Spartel au
Cap Draâ (Belvèze et Bravo de Laguna 1980)
Région Strates de profondeur Proportion de la surface chalutable
Du Cap Spartel à El Jadida
0 - 50 m 50- 150 m 150 – 300 m 300 – 500 m 30 % 64 % 89 % 100 % Surface totale 68 %
D’El Jadida au Cap Ghir
0 - 50 m 50- 150 m 150 – 300 m 45 % 71 % 84 % Surface totale 68 %
Du Cap Ghir au Cap Draâ
0 - 50 m 50- 150 m 150 – 300 m 300 – 500 m 88 % 90 % 85 % 92 % Surface totale 89 %
Du point de vue couverture sédimentaire, le plateau continental est séparé, sur environ toute son étendue, en une zone côtière et une zone profonde, par une barrière coralligéne dont la largeur et la situation en profondeur varient selon la région. Cette barrière, presque continue et parallèle à la côte, se situe entre 120 et 180 m de profondeur. Elle est formée de coraux appartenant, en majorité, à l'espèce Dendrophyllia ramea (Furnestin 1957, Erimesco 1965, Maurin 1968, Bayed 1980, Bayed et Glémarec 1987). Néanmoins, entre ces bancs de coraux se trouve la vase riche en débris coquillers grossiers et débris de Dendrophyllia (Bayed 1980).
D’après plusieurs auteurs (Furnestin 1959, Mathieu 1968, 1971, 1972, Collignon 1970, Bayed 1980), l’étagement vertical des différents types de fond reste à peu près constant dans la zone qui s’étend entre Cap Spartel et Cap Ghir. Le plateau continental semble être recouvert, dans ses grandes lignes, de sédiments répartis en bandes longitudinales, de superficies inégales et parallèles au rivage. Ce plateau se présente comme suit :
13
Ø Une bande côtière située entre la côte et l’isobathe 30 à 50 m. Le fond est à forte dominance sableuse, avec quelques affleurements rocheux ;
Ø La teneur en sable diminue très vite pour arriver à des vases plastiques pratiquement pures à partir de 80 à 90 m.
Ø Une deuxième zone dominante sableuse, et même parfois de sable assez grossier, fait suite aux fonds de vase. Elle est rencontrée de façon constante entre 120 et 270 m de profondeur. C'est au niveau de cette zone où s’installent les coraux, ils constituent des bancs de 200 m à 300 m de diamètre avec une hauteur de 2 à 4 m (Bayed et Glémarec 1987).
Ø Une zone profonde débute vers 300 mètres et s'étend vers les grandes profondeurs. Le fond semble être sablo-vaseux ou vaseux.
D’après Belvèze et Bravo de Laguna (1980), les fonds durs du plateau continental marocain, sont en majorité constitués de lumachelles, coquilles et sables agglomèrés et consolidés. L’érosion marine active sur ces roches tendres et peu homogènes produit des fonds accidentés non chalutables.
Bayed et Glémarec (1987) ont dressé une carte biosédimentaire de la plateforme continentale entre Tanger et El Jadida, en se basant sur les données de la campagne BIOMAR (Bayed et Glémarec 1987). Cette carte révèle l’existence, au niveau de cette zone, d’une vasière très étendue bordée vers la côte de sables moyens et de sable fins et limitée vers le large par des sables biogènes envasés ou par des formations coralligènes en position bathylittorale (Figure 3).
14
Figure 3. Carte biosédimentaire du plateau continental entre Tanger et El Jadida
(Bayed et Glémarec 1987)
3. Environnement océanographique
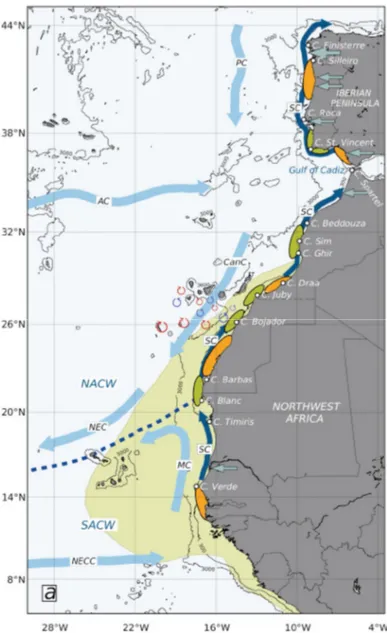
La zone d’étude fait partie de l’écosystème marin du Courant des Canaries qui couvre la zone comprise, entre les latitudes 12°N et 43°N (Arístegui et al. 2009). Elle est considérée parmi les quatre zones distinguées mondialement, par le phénomène de remontée d’eau froides « upwellings » qui les rend riches en ressources halieutiques (Moujane et al. 2011) (Figure 4).
15
Figure 4. Schéma des principaux courants dans le bassin du courant des Canaries. Les
courants principaux : courants superficiels (bleu clair); le courant de fond (en bleu foncé) ; Les caps majeurs, sources d'eaux douces (flèches bleues) et des apports de poussière (> 10 g m-² y -¹ en hachuré jaune) ; Les zones de rétention (orange) et de dispersion (vert) situées sur le plateau continental ; Les zones frontales entre des masses d'eau (tirets bleus) et les structures tourbillonnaires mesoéchelles (bleu : cyclones ; rouge : anticyclones) au sud des Îles Canaries. Les différentes masses d’eau : Eau Centrale Nord Atlantique (NACW) ; SACW : Eau Centrale Sud Atlantique (SACW) ; le Courant des Açores (AC) ; le Courant des Canaries (CanC) ; le Courant Mauritanien (MC) ; Courant Nord Equatorial (NEC) ; Contre courant Nord équatorial (NECC). (Arístegui et al 2009)
La circulation des eaux superficielles est induite principalement par la circulation atmosphérique. Elle se rattache à une branche du grand tourbillon anticyclonique des eaux
16
nord-atlantiques « le courant des Canaries » (Erimesco 1967, Atlantniro 1980, Orbi et al. 1998, Moujane et al. 2011). Largement dépendant du régime éolien (Alizés), ce courant forme la branche orientale du gyre subtropical atlantique et longe les côtes marocaines jusqu’aux environs du Cap Blanc en été et jusqu’aux côtes sénégalaises en hiver (Fréon 2006).
De direction Sud-ouest, le courant des Canaries est situé généralement entre la surface et 500 m de profondeur. Sa vitesse moyenne est de 0,5 nœuds, mais peut parfois atteindre 2 nœuds selon l’orientation du vent ; sa largeur peut atteindre 1000 km (Orbi et al. 1998, Moujane et al. 2011). Ce courant est froid (18°C en plein été) puisqu´il provient des latitudes plus septentrionales et se nourrit, en partie, des remontées d’eaux profondes qui se produisent au large des côtes marocaines. En se déplaçant vers l’équateur, l’intensité du courant diminue rapidement sous la surface marine (à 100 m de profondeur). Le jet instable se sépare de la côte et crée des méandres, des tourbillons et des filaments dont certains sont quasi permanents, tel qu’au niveau du cap Ghir (Knoll et al. 2002, Pelegri et al. 2005, Nieto et al. 2012). Ces filaments jouent un rôle important dans le transfert des masses d’eaux de la zone côtière vers le large et l’enrichissement des eaux côtières en sels nutritifs (Fréon 2006).
La zone d’étude est également caractérisée par la présence d’un contre-courant, remontant de la côte sénégalo-mauritanienne et dirigé vers le Nord, à l’opposé de la dérive générale des Alizés. Ce système est situé en sub-surface ou en profondeur, au-dessus du plateau ou du talus continental. L’une des branches de ce sous-courant vient du fond du golfe de Guinée (Binet 1991). L’enfoncement de ce courant se poursuit au fur et à mesure qu’il se dirige vers le nord. Il atteint 500 à 1000 m de profondeur, entre les parallèles 30° et 34° N (Mittelstaedt 1983).
17
L’hydrologie de la zone d’étude se trouve également influencée par l’écoulement en profondeur des masses d’eau provenant de la Méditerranée (Knoll et all. 2002, Borenäs et al. 2002). En effet, en se dirigeant vers l’océan atlantique, les masses d’eaux méditerranéennes de forte densité se mélangent aux eaux Atlantiques moins denses et plus froides et forment, en surface, au niveau du détroit de Gibraltar, une couche d’eau Atlantique modifiée (Millot 1999). Celle-ci prend la forme d'une veine qui se subdivise verticalement en deux branches principales. La première longe la côte ibérique et la seconde coule le long de la côte africaine et par conséquent, la côte marocaine (Millot 1999, Knoll et al. 2002 ; Borenäs et al. 2002).
En se dirigeant vers le sud, ce courant s’enfonce progressivement pour couler en profondeur, prés du fond marin (Knoll et al. 2002). Au niveau de la zone considérée, cette circulation est observée durant toute l’année, avec une plus forte intensité en hiver (Johnson et Stevens, 2000).
Le phénomène d’upwelling côtier est l’une des principales caractéristiques de la zone d’étude. Ce phénomène résulte de la combinaison du courant des Canaries et des effets de la dérive des eaux superficielles par les vents ‘Alizés’ (cf. Orbi et Nemmaoui 1992, Makaoui et al 2005, Benazzouz et al 2014a).
Furnestin (1959) fut le premier auteur à avoir décrit en détail l’hydrologie des côtes atlantiques marocaines et, particulièrement, le phénomène des résurgences des eaux froides entre le détroit de Gibraltar (36°N) et le Cap Juby (28°N). Des études océanographiques plus récentes (Belvèze 1984, Binet 1988, Mittelstaedt 1991, INRH 2000, Makkaoui et al 2005, Makkaoui 2008, Benazzouz et al. 2006, 2014, Moujane et al. 2011, Nieto et al. 2012, Benazzouz 2014), ont démontré que la côte marocaine est sous l’influence d’un phénomène
18
d’upwelling côtier permanent qui présente des variabilités latitudinale et saisonnière importantes.
Son intensité augmente régulièrement du Nord vers le Sud (Figure 5) et elle est étroitement liée à la direction et à l’intensité des vents Alizés. Ces résurgences se produisent le plus souvent en certains points du littoral, essentiellement au voisinage de certains caps et inflexions de la côte (Figure 6).
19 Figure 5. Diagramme de
Hovmöller représentant
l’indice d’upwelling et la
largeur du plateau
continental (ligne noir) (Nieto et al. 2012)
Figure 6. Localisation des principales zones
d’upwelling le long de la côte marocaine (Makaoui 2008)
En résumant les observations des différents auteurs cités précédemment, l’upwelling au niveau de la zone d’intérêt pourrait être décrit comme suit :
§ Du Cap Spartel à Cap Cantin : L’upwelling est le moins actif, voire même absent, aussi bien en hiver qu’en été ;
20
§ Du Cap Cantin à Cap Ghir : L’upwelling est pratiquement permanent tout au long de l’année, avec une forte intensité estivale ;
§ Du Cap Ghir à Sidi Ifni : L’upwelling s’affaiblit.
L’intensité de l’upwelling a montré des variabilités interannuelles durant la période 1982-2011 (Benazouz et al. 2014b), sans tendance particulière, avec des périodes de faible intensité, correspondant aux années chaudes, et des périodes de forte intensité, correspondant aux années froides.
Par ailleurs, les moyennes annuelles des températures de surface maximale et minimale, calculées sur la période 1982-2011 (figure 7a, b et c), toutes saisons confondues, montrent une nette tendance vers le réchauffement au niveau de la côte nord atlantique marocaine (Benazouz et al. 2014a).
21
Figure 7. Variabilité saisonnière et interannuelle de l’indice d’upwelling à long terme
(1982-2011). a) Diagramme de Hovmöller représentant l’indice
d’upwelling.Tendances de la SSTmax (ligne rouge), la SST min (ligne bleu), l’IUCSST (ligne noire) pour les zones : b) Cap Ghir (31.5), c) 26-33°N (Benazouz et al. 2014a, b)
4. Productivité du milieu
L’upwelling côtier s'accompagne non seulement des températures froides, mais aussi d'un enrichissement des eaux de surface en sels nutritifs (phosphates, nitrates, silicates)
22
aboutissant à une richesse en phytoplancton et en zooplancton (Pelet 1985, Morel 2000, Pichevin 2004).
Il a été observé que l’évolution générale de la biomasse phytoplanctonique est répartie sur toute la côte atlantique marocaine, avec des concentrations variables en fonction des saisons et de la latitude (INRH 2000, Makaoui et al. 2005, Makaoui 2008). Au niveau de la zone d’intérêt, les plus fortes concentrations de chlorophylle a sont observées en été entre cap Cantin et cap Ghir (8mg/m3).
La production primaire suit la même évolution que celle de la chlorophylle a : elle est répartie sur toute la côte, importante en été et faible en hiver. Ainsi, au niveau de la zone Cap Cantin-Cap Ghir, les valeurs ne dépassent pas 0,8 gC/m2/jour en hiver et atteignent 2,69 gC/m2/jour en été (Makaoui et al. 2001).
Les biomasses zooplanctoniques montrent également des variabilités saisonnières entre les parallèles (32° - 26°N). Les concentrations en zooplancton ne dépassent pas 500 mg/m3 en hiver et peuvent atteindre 960 mg/m3 en été (Berraho 2007).
II. PRÉSENTATION DES PEUPLEMENTS DE FOND DE LA ZONE NORD
ATLANTIQUE MAROCAINE
II. 1. Biogéographie
II. 1. a. Provinces biogéographiques
La distribution biogéographique des organismes marins a intéréssé les biologistes depuis les premières campagnes océanographiques. Le Forbes et Godwin Austen (1859) (in Watling 2013) furent les premiers auteurs à avoir synthétisé la distribution des organismes marins des mers bordant l'Atlantique Nord et l’Europe de l'Ouest. Ils ont identifié cinq zones d'endémisme dans la région s'étendant de l'océan Arctique à la mer Méditerranée.
23
Le concept de province biogéographique a été proposé par les phytogéographes (Lomolino et al. 2010), et se réfère à une zone de présence d’une espèce, avec un certain niveau d'endémisme. Valentine (1973) a expliqué que le globe terrestre est organisé en une structure hiérarchique et que les espèces sont organisées dans des associations ou des assemblages qui sont ensuite agrégés dans des écosystèmes. Les provinces sont des associations des écosystèmes et ont la capacité de changer au fil du temps. Lomolino et al. (2010) présentent une définition plus moderne, en proposant qu'une province ne soit pas seulement un lieu avec un certain niveau d'endémisme, mais un lieu où ces espèces endémiques ont été isolées pendant longtemps par une combinaison de facteurs écologiques.
Du pôle Nord au pôle Sud, les diverses parties du domaine marin sont subdivisées en provinces faunistiques en fonction des organismes marins qui les peuplent (Maurin 1968) : provinces arctique, boréale, atlanto-méditerranéenne, tropicale.
Le Maroc est inclus dans la province atlanto-méditerranéenne (Furnestin et al. 1958). Il est géographiquement intermédiaire entre trois sous-secteurs, à savoir ; la région méditerranéenne, la région lusitanienne du détroit de Gibraltar aux côtes anglaises et la région mauritanienne du détroit de Gibraltar au cap Blanc (Furnestin et al. 1958). Toutefois, certains auteurs (Maurin 1968, Hall 1964) ont situé la limite méridionale de la province lusitanienne au niveau du Cap blanc, lieu de confrontation entre les masses d’eaux d’origine nord atlantique et tropicales. Par contre Saldahna 1974, Briggs 1976 (in Menioui 1988) placent cette frontière à la hauteur du Cap vert.
II. 1. b. Peuplements ichtyologiques
La synthèse des observations réalisées par Furnestin et al. (1958) et Maurin (1962, 1965, 1968) sur les poissons de la zone comprise entre le cap Spartel et le cap Juby, permet de
24
montrer que l’ichtyofaune marocaine est dans de très fortes proportions du type atlanto-méditerranéen. Les espèces tropicales ou subtropicales sont moyennement représentées, tandis que les espèces boréales sont rares (Tableau 2).
Selon Maurin (1965), la côte atlantique marocaine constitue avec la région méditerranéenne, une zone de transition à caractère subtropical affirmé. Elle abrite des poissons à vaste répartition géographique qui se concentrent surtout, au niveau des zones tempérées chaudes. Les espèces à affinité tropicale deviennent très rares au nord du cap Blanc qui, d’après Maurin (1968), constitue une importante limite faunistique. Néanmoins, la faune ichthyologique de profondeur présente une grande analogie avec celle de la région septentrionale, alors que les espèces pélagiques à affinité tropicale sont rencontrées au large (Furnestin et al. 1958, Maurin 1968).
Le fait que l’ichtyofaune de la zone conserve dans l'ensemble un caractère septentrional, s'explique par la particularité hydrologique des eaux de la côte nord africaine reliée au phénomène « d’upwelling » (Furnestin 1959, Bayed 1980, Bayed et Glémarec 1987).
Tableau 2. Composition biogéographique de la faune ichthyologique du Maroc (Furnestin
et al. 1958)
Type d’espèces Proportions
Espèces boréales ou subboréales 7 %
Espèces atlanto-méditerranéennes 67 %
Espèces tropicales ou subtropicales 26 %
25
La macrofaune benthique des substrats meubles, entre Tanger et el Jadida, comprend plus de 300 espèces, appartenant principalement aux polychètes, crustacés, mollusques et échinodermes. Boucher et Glémarec (1974) et Bayed (1980) ont rattaché ces espèces à la faune lusitanienne (Ibéro-marocaine), caractérisée par une absence totale des espèces tropicales, une présence des espèces subtropicales et une dominance d’une faune à affinité tempérée froide ou moyenne.
Toutefois, ils ont remarqué que la répartition de la macrofaune benthique des substrats meubles, se trouve modifiée dans les zones où se manifeste le phénomène d’upwelling. Les peuplements s’identifient d’une façon frappante avec ceux du Golfe de Gascogne situé à 10° de latitude plus au nord, avec en particulier la submergence de la faune tempérée moyenne de l’infralittoral du Golfe de Gascogne, au circalittoral côtier marocain et, de façon inverse, à l’émergence de la faune tempérée froide qui devrait descendre en profondeur lorsque la latitude décroit. Quant à la faune subtropicale, elle n’apparaît qu’à très faible profondeur (Maurin 1962, Boucher et Glémarec 1974).
II. 2. Description des peuplements de fond de la côte nord atlantique marocaine
II. 2. a. Généralités
Les différents travaux menés sur les peuplements des fonds chalutables de la côte nord atlantique marocaine, mettent l’accent sur l’importance et la diversité des poissons osseux, par rapport aux autres groupes taxonomiques (Coupe 1952, Dollfus 1955, Maurin 1952, 1954, 1955, 1962, 1965 et 1968, Alloncle 1966, Furnestin et al. 1958). Les espèces de poissons de fond, les plus abondantes, appartiennent principalement, aux merlus, pageots, rougets, poissons plats et grondins (Furnestin et al. 1958, Maurin 1968, Collignon 1969, 1971a, 1971b, Collignon et Aloncle 1972, Srour 1984 INRH 2002, El Habouz 1995). Les
26
familles les plus riches en espèces sont les Sparidés qui en comptent environ une vingtaine d’espèces (Coupé 1952, Dollfus 1955, Alloncle 1966, Bonnet 1969) et les Soleidés, représentés par environ une trentaine d’espèces (Srour 1984, Belghiti et al. 1995). Le merlu blanc, Merluccius merluccius demeure toutefois, l’espèce la plus fréquente dans la zone d’intérêt (Maurin 1968, Collignon 1972, Lahrizi 1996, INRH 2002, El Habouz 2011).
La grande richesse des poissons cartilagineux a également été rapportée par plusieurs auteurs (Belloc 1934, Maurin 1968, Collignon 1969, Boyer 1984). Ceux-ci ont noté la prédominance des squales, des roussettes et des chiens de mer. Les raies, sont représentées principalement, par la famille des Rajidés, particulièrement Raja asterias Delaroche, 1809 et Raja batis Linnaeus, 1758.
Cette zone est également, connue pour sa richesse en Crustacés qui correspondent en majorité à des crevettes, représentées essentiellement par la crevette rose Parapenaeus
longirostris (Crosnier et Forest 1973, INRH 2002, Najd 1992, Laghmari 2003, Benchoucha
et al. 2008). Le homard, les langoustes, la langoustine, les crabes, les araignées et les cigales de mer sont également, rencontrés en grande quantité dans la zone.
Les Céphalopodes sont de moindre importance dans cette zone. Ils sont représentés essentiellement par le poulpe Octopus vulgaris Cuvier, 1797, le casseron commun
Allotheutis subulata Lamarck, 1798 et l’encornet rouge Illex coindetti Vérany, 1839 (Maurin
1968, El Habouz 2011).
II. 2. b. Répartition des peuplements des fonds sableux côtiers
La répartition bathymétrique du peuplement de sable côtier est décrite sur la base des prospections réalisées au niveau d’une radiale, au nord-ouest de Casablanca. Ainsi, Collignon (1971b) a subdivisé ce peuplement en trois populations :
27
Ø Populations stables ; composées de la sole pole Pegusa lascaris Risso, 1810 ou de céteau Dicologlossa cuneata Moreau, 1881. Ces espèces, relativement sédentaires, passent presque toute leur existence sur ces fonds auxquels elles peuvent être considérées comme inféodées.
Ø Populations saisonnières : la plus typique étant la population de rouget-barbet de roche Mullus surmuletus Linnaeus, 1758, caractérisée par l’apparition saisonnière de jeunes individus, qui y passent une courte période de leur cycle vital.
Ø Populations irrégulières : caractérisée par l’apparition et la disparition de groupes d’espèces de différents âges : c'est le cas du chinchard Trachurus trachurus Linnaeus, 1758, du merlu Merluccius merluccius et du tacaud commun Trisopterus
luscus Linnaeus, 1758.
II. 2. c. Peuplements des fonds meubles du plateau et du talus continental
En étudiant le peuplement ichtyologique des fonds meubles du plateau continental marocain entre les isobathes 20 et 120 mètres de profondeur, sur une radiale au niveau de Casablanca, Collignon (1971 a) a permis la distinction de 3 assemblages de poissons :
· Un peuplement près de la côte où dominent certains poissons plats ; Dicologlossa
cuneata, Pegusa lascaris, Solea senegalensis Kaup, 1858, des vives, Trachinus draco Linnaeus, 1758 et Tr. Vipera Cuvier, 1829 et les juvéniles de rouget Mullus surmuletus ;
· Un peuplement intermédiaire où domine la bésugue Pagellus acarne Risso, 1826 et les Grondins Trigla hirundo et Tigla Iucerna Linnaeus 1758 ;
28
· Un peuplement plus profond, avec Merlucius merlucius, Trisopterus Iuscus,
Argentina sphyraena Linnaeus 1758 et des espèces de raies.
Selon le même auteur (Collignon 1972), les Crustacés des fonds chalutables du talus continental, au large de Casablanca, entre 200 m et 600 mètres se répartissent comme suit :
· La crevette rose du large (Parapenaeus longirostris) abonde surtout entre 250 et 400 mètres.
· Les langoustines (Nephrops norvegicus Linnaeus, 1758), les crevettes à œufs bleus (en particulier Plesionika martia A. Milne Edwards, 1883) et les galathées (Munida
sp), sont rencontrées entre 300 et 500 mètres, avec un maximum très net aux
alentours de 400 mètres ;
· Les crevettes rouges apparaissent à partir de 500 mètres, notamment les espèces
Aristeomorpha foliacea Risso, 1827, Aristeus antennatus Risso, 1816 et Plesiopenaeus edwardsianus Johnson, 1867.
II. 2. d. La macrofaune benthique des substrats meubles de la côte nord atlantique marocaine
Boucher et Glémarec (1974) furent les premiers auteurs, à avoir étudié la macrofaune benthique de la côte atlantique marocaine, en milieu subtidal. Leurs travaux ont concerné la zone cap Sim - cap Ghir. Ils y ont identifié, de la côte vers le large, quatre unités majeures :
· De la côte à environ 30 m, c’est un peuplement de sable fin aux Polychètes Onuphis
29
· Entre 30 et 50 m, c’est un peuplement de sable envasé (10 à 25% de pélites) à l’Échinoderme Amphiura filiformis, au Polychète Aponuphis grubii, aux Mollusques bivalves Tellina pulchella et Lucinoma borealis ;
· Entre 50 et 100 m, c’est un peuplement de vase sableuse et de vase, où sont rencontrées les espèces suivantes : le mollusque bivalve Nucula sulcata, les Crustacés décapodes Goneplax rhomboïdes, Jaxea nocturna, et Alpheus glaber ; · Au-delà de 100 m, c’est un peuplement de vase bathyale au Mollusque bivalve
Nucula tenuis, à l’Échinoderme Amphiura chiajei, et au Polychète Melinna sp, vivant
à des températures de 10-12°C.
Des années plus tard, Bayed et Glémarec (1987) se sont basés sur les données de la campagne de prospection BIOMAR (1978) pour décrire les invertébrés benthiques des substrats meubles de la plate-forme continentale entre Tanger et d’El Jadida. Ils ont, ainsi, déterminé trois unités principales :
· Le peuplement des sables moyens au Polychète Nephtys cirrosa, et au Mollusque bivalve Angulus fabula ;
· Le peuplement des sables fins au Mollusque bivalve Mactra stulroum, et au Polychète Diopatra neapolitana ;
· Le peuplement des vases sableuses et des vases pures au Polychète Sternaspis
scutata, et au Mollusque bivalve Thyasira flexuosa.
Par la suite, la macrofaune benthique de la zone intermédiaire, située entre Safi et Essaouira (Sidi Boulbra) et qui est restée non explorée auparavant, a été abordée par Fadlaoui (1994) et Fadlaoui et Retière (1995). Cette zone est caractérisée par la communauté des sédiments fins, plus ou moins envasés et plus ou moins compacts, au Mollusque bivalve
30
Abra alba et l’Annélide Polychète Diopatra marocenis. Au niveau de cette zone, les
Annélides polychètes et les Crustacés sont représentés par un grand nombre d’espèces et d’individus, en comparaison avec les Mollusques Lamellibranches et Gastéropodes. Les Échinodermes y forment le groupe zoologique le plus faiblement diversifié (Fadlaoui et Retière 1995).
II. 3. Associations faunistiques
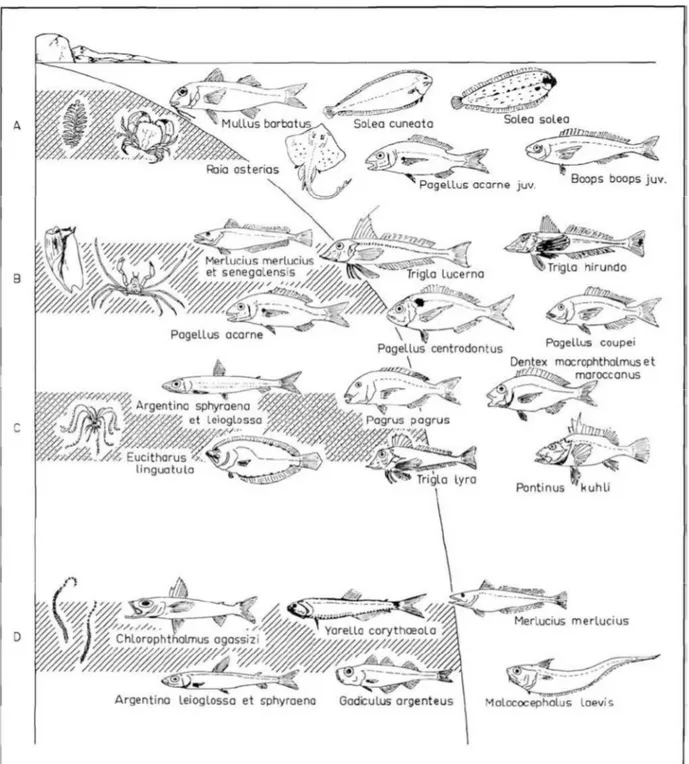
Maurin (1968) s’est basé sur les données issues de 382 opérations de chalutage, 153 dragages, 2 pêches à la palangre et 12 plongées, pour décrire les peuplements marins des côtes nord-ouest africaines et leur organisation bathymétrique. Toutefois, ces prospections n’ont pas couvert toute notre zone d’étude, ils se sont limités à des secteurs particuliers et des profondeurs bien précises. Ainsi, la description des associations faunistiques concerne uniquement les zones explorées (Figures 8 et 9).
ü Invertébrés benthiques
· Du cap Spartel à Asilah : entre 180 et 230 m de profondeur, la crevette rose (Parapenaeuslongirostris) ainsi que les Céphalopodes Illex coindetii, Alloteuthis
media et Alloteuthis subulata, Todaropsis eblanae et Eledone cirrosa sont abondants.
les cnidaires (Caryophyllia clavus et Brissopsis lyrifera) sont rencontrés, mais en moindre importance que les autres espèces.
· D’Assila à Larache : entre 175 et 200 m de profondeur, les Cnidaires sont très fréquents, en particulier l’espèce Alcyonium palmatum. Les crevettes et les Céphalopodes, appartenant aux mêmes espèces de la zone nord, sont encore nombreux. Entre 300 et 350 m ; le Crustacé Munida curvimana, le Gastéropode
31
oculata, Desmophyllum cristagali et Caryophyllia clavus) sont abondants. Alors que
l’importance des Crustacés, Parapenaeus longirostris, Paromola cuvieri et Munida
curvimana diminue. De 350 à 500 m ; apparition du Cnidaire Actina ugerichardi.
Entre 500 et 600m ; présence locale des coraux bambous Isidella.
· Au niveau du Cap Ghir : les fonds entre 10 et 30 m, sont riches en Crustacés, notamment Dorippela nata, Homola barbata, Atelecyclus rotundatus et Maia
goltziana. Entre 100 et 150 m les taches de Dendrophyllies sont très nombreuses et
entre elles s'étendent des passages recouverts de sable vaseux riche aux Échinodermes Leptometra sp. et Stichopus sp.
ü Peuplements ichthyologiques
Maurin (1968) a regroupé les poissons de la zone considérée en cinq catégories :
· Les espèces du plateau continental : Pagellus acarne, Gadus luscus, Trachurus
picturatus, Mullus surmuletus, Umbrina canariensis, Dentex maroccanus, Trigla hirundo, Microchirus variegatus, Trigla pinni, Euçitharus linguatula, Arnoglossus laterna, Ophisurus serpens ;
· Les poissons à large répartition bathymétrique : Merlucius merlucius, Conger
conger, Scylliorhinus caniculus, Ariosoma mystax, Trachurus trachurus, Lophius piscatorius ou Lophius budegassa ;
· Les poissons qui vivent à proximité des zones rocheuses : les espèces
Macrorhamphosus scolopax, Capros aper, sont abondantes en présence de Peristedion cataphr actum, Trigla lyra et Lepidotrigla cavillone ;
32
· Au niveau de la partie supérieure du talus : Argentina sphyraena et leioglossa,
Lepidopus caudatus, Callionymus phaeton, Maurolicus muelleri et Pagellus centrodontus ;
· Les espèces profondes : Hexanchus griseus, Onos biscayensis, Gadella maraldi,
33
Figure 8. Répartition des principales espèces péchées au large d’Asilah, en fonction de la
bathymétrie et de la nature des fonds. A - Fonds de 180 à 220 m, vase sableuse détritique à Caryophyllia clauus et Brissopsis lyrifera. B - Fonds de 300 à 350 m, sable vaseux détritique à Caryophyllia clauus et Munida cuvuimana. C - Fonds de 350 à 500 m, vase profonde peu sableuse à Açtinauge. D – Fonds de 500 à 600 m, vase à Isidella (Maurin 1968).
34
Figure 9. Répartition des principales espèces rencontrées au sud d'Agadir. A - Fonds de 10
à 30 m, sables vaseux à alcyonaires et Atelecyclus. B - Fonds de 40 à 80 m, vase terrigène à Cymbium et Inachus. C - Fonds de 100 à 150 m, sables vaseux à