Évaluation de l'interaction entre les interneurones et la
microglie dans la région CA1 de l'hippocampe de souris
présentant les symptômes de la maladie d'Alzheimer
Mémoire
Etienne Gervais
Maîtrise en biochimie - avec mémoire
Maître ès sciences (M. Sc.)
Évaluation de l’interaction entre les interneurones et la
microglie dans la région CA1 de l’hippocampe de souris
présentant les symptômes de la maladie d’Alzheimer
Mémoire
Étienne Gervais
Sous la direction de :
Résumé
La maladie d’Alzheimer est la forme de démence qui affecte le plus de gens mondialement. Les mécanismes associés à cette maladie neurodégénérative ne sont pas complètement connus et considérant le phénomène de vieillissement de la population, il devient impératif de développer de nouveaux outils de diagnostic et de nouvelles thérapies pour cette pathologie. Il y a de plus en plus de preuves qui associent les déficits cognitifs de l’Alzheimer à un dysfonctionnement de l’équilibre entre l’excitation et l’inhibition de l’hippocampe, mais aussi à un niveau soutenu de neuroinflammation par l’activation exagérée de la microglie. Malgré les nombreuses études sur l’interaction fonctionnelle entre les neurones principaux et la microglie, aucune étude ne s’est concentrée sur l’interaction de la microglie avec les interneurones GABAergiques de l’hippocampe. En utilisant l’immunofluorescence et la microscopie confocale, nous avons étudié l’interaction structurelle de la microglie avec deux sous-types d’interneurones inhibiteurs impliqués dans les processus de la mémoire : les cellules exprimant la somatostatine (SOM+) et celles exprimant la parvalbumine (PV+). Nos résultats ont montré que la quasi-totalité de ces interneurones interagissaient avec la microglie en conditions contrôles et que ce niveau d’interaction était maintenu chez des souris présentant les symptômes de la maladie d’Alzheimer (APP/PS1). Nous avons aussi montré que la microglie interagissait avec tous les domaines structurels des interneurones. Le soma des interneurones était contacté différemment chez les cellules SOM+ et celles PV+ suggérant un contrôle différent selon le type de neurones contacté. La microglie interagissait préférentiellement avec le domaine proximal des dendrites suggérant un rôle de ces contacts dans l’intégration synaptique. Nos résultats n’ont montré aucun changement structurel majeur chez les souris imitant la maladie d’Alzheimer indiquant que les dysfonctionnements observés pendant la maladie seraient causés par des modifications fonctionnelles de ces contacts ou que ces contacts ne sont pas impliqués dans la pathologie.
Abstract
Alzheimer’s disease (AD) is the most common form of dementia. The mechanisms associated to this neurodegenerative disease are not completely understood and with the aging population it is now imperative to develop new diagnosis tools and therapies for this pathology. There is growing evidence associating AD cognitive deficits to a dysregulation of the excitation/inhibition balance in the hippocampus, but also to a sustained level of neuroinflammation caused by exaggerated microglia activation. While numerous studies have assessed the functional interaction between principal neurons and microglia, much less is known about the specific interaction between microglia and hippocampal GABAergic interneurons. Using immunofluorescence and confocal microscopy, we studied the structural interaction between microglia and two subtypes of inhibitory interneurons involved in memory processes: somatostatin- (SOM+) and parvalbumin-expressing interneurons (PV+). Our results showed that almost all of these interneurons were interacting with microglia in control conditions and that this high level of interaction was maintained in mice presenting AD symptoms (APP/PS1 mice). We also reported that microglia interacted with every neuronal structural domain. Interneurons somata were contacted differently in each subtype suggesting a different control depending on the type of interneuron contacted. Microglia was preferentially interacting with proximal dendrites suggesting a role of these contacts in synaptic integration. Our results showed no major structural changes in AD mice indicating that the observed functional impairments during AD may be caused by functional modifications in these contacts or that these interactions are not involved in the pathogenesis of AD.
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... vi
Liste des abréviations ... vii
Remerciements ... viii
Introduction ... 1
La maladie d’Alzheimer ... 1
Symptômes de la maladie ... 1
Principales observations dans le cerveau affecté par la maladie ... 2
L’hippocampe : rôle central dans la mémoire ... 3
Anatomie et circuiterie ... 4
Organisation cellulaire ... 6
Interneurones GABAergiques ... 6
Interneurones exprimant la somatostatine ... 8
Interneurones exprimant la parvalbumine ... 9
Changements des interneurones pendant la maladie d’Alzheimer ... 10
Densité des interneurones ... 10
Dysfonctionnements des interneurones ... 11
Hyperactivité de l’hippocampe pendant la maladie d’Alzheimer ... 12
Neuroinflammation ... 13
La microglie ... 14
Interactions neurone-microglie ... 16
Neuroinflammation pendant la maladie d’Alzheimer ... 18
Liens entre microglie et interneurones dans la maladie d’Alzheimer ... 19
1. Hypothèse et objectifs spécifiques ... 21
1.1 Hypothèse ... 21
1.2 Objectifs spécifiques ... 21
2. Matériels et méthodes ... 22
2.1 Animaux ... 22
2.2 Préparation des tranches ... 22
2.3 Immunofluorescence ... 23
2.4 Acquisition et analyse des images ... 24
2.5 Analyse des données et analyse statistique ... 24
3 Résultats ... 26
3.1 Une grande proportion d’interneurones interagissent avec la microglie ... 26
3.2 Les cellules microgliales contactent les interneurones de diverses manières ... 28
3.3 Les somas des sous-types d’interneurones sont contactés différemment ... 30
3.4 La microglie préfère interagir avec la partie proximale des dendrites ... 32
3.5 Le niveau d’interaction entre les deux types cellulaires est conservé chez les souris APP/PS1 hétérozygotes ... 34
3.6 Caractéristiques d’interaction chez les souris APP/PS1 hétérozygotes ... 37
Discussion ... 40
Conclusion ... 46
Liste des figures
Figure 1. Formation des plaques amyloïdes et des enchevêtrements de protéine tau. ... 3
Figure 2. Anatomie transversale de l’hippocampe de souris. ... 5
Figure 3. Propagation de l’influx nerveux dans l’hippocampe. ... 5
Figure 4. Diversité des interneurones du cerveau. ... 7
Figure 5. Les interneurones GABAergiques de la région CA1 de l’hippocampe. ... 8
Figure 6. Effets positifs et négatifs de la neuroinflammation. ... 14
Figure 7. Cellules microgliales dans une souris APP/PS1-VIPCre. ... 15
Figure 8. Modèle mécanistique de la maladie d’Alzheimer impliquant l’inflammation soutenue et les peptides Aβ. ... 19
Figure 9. Une grande proportion d’interneurones exprimant la SOM et d’interneurones exprimant la PV interagissent avec la microglie. ... 27
Figure 10. Analyse structurelle et quantitative des interactions entre les interneurones et la microglie. ... 29
Figure 11. Différentes parties des cellules microgliales contactent le soma des interneurones. ... 31
Figure 12. Les cellules microgliales interagissent principalement avec les dendrites proximales. ... 33
Figure 13. Phénotype des souris APP/PS1 hétérozygotes. ... 35
Figure 14. Niveau d’interaction chez les souris APP/PS1 hétérozygotes. ... 36
Figure 15. Comparaison des paramètres d’interaction entre les souris WT et APP/PS1 hétérozygotes. ... 38
Liste des abréviations
• APP : protéine précurseuse de l’amyloïde • Aβ : bêta-amyloïde
• SNC : système nerveux central • CA : corne d’Ammon
• DG : gyrus denté • EC : cortex enthorinal • Sub : subiculum
• O/A : stratum oriens/alveus • PYR : stratum pyramidale • RAD : stratum radiatum
• LM : stratum lacunosum moleculare • GABA : acide γ-aminobutyrique
• IS : interneurone spécifique aux interneurones • SOM : somatostatine
• O-LM : cellules oriens-lacunosum moleculare • SOM+ : positif à la somatostatine
• PV : parvalbumine • Ca2+ : calcium
• PV+ : positif à la parvalbumine
• FS-BC : cellules en paniers à décharges rapides (fast spiking-basket cells) • IL-1 : interleukine 1
• IL-4 : interleukine 4
• TNF : facteur de nécrose tumorale • ROS : dérivés réactifs de l’oxygène • iNOS : oxyde nitrique synthase inductible • CCL2 : ligand chimiokine 2
• IL-6 : interleukine 6
• TBI : lésion cérébrale traumatique • IFNγ : interféron gamma
• AMPA : α-amino-3-hydroxy-5-methylisoasol-4-propionate • mGluR5 : récepteur métabotropique au glutamate 5 • ATP : adénosine triphosphate
• CD200 : cluster de différentiation 200 • CX3CL1 : fractalkine
• CB1 : récepteur aux cannabinoïdes 1 • WT : souris APP-/PS1
-• PS1 : préséniline 1 • PFA : paraformaldéhyde • PB : tampon phosphate • TB : tampon Trizma
• NGS : sérum normal de chèvre • ThioS : thioflavine S
• Iba1 : molécule adaptatrice liant le calcium ionisé 1
• IS3 : interneurone spécifique aux interneurones de type 3
Remerciements
Je tiens à remercier ma directrice de recherche, Dre Lisa Topolnik, pour cette expérience très enrichissante. Sa passion et sa rigueur m’ont permis de développer mon esprit scientifique et d’accroître mon intérêt pour la recherche. Ces trois dernières années en tant que stagiaire et étudiant à la maîtrise dans son laboratoire m’ont permis d’en apprendre énormément sur le domaine des neurosciences, mais m’ont surtout permis de me développer professionnellement. Je serai toujours reconnaissant de l’expertise que j’ai pu acquérir au sein de cette équipe. Je remercie donc Dre Topolnik de m’avoir offert l’opportunité et la confiance de cheminer dans un domaine qui m’attirait depuis très longtemps. Merci à mes anciens et actuels collègues pour vos conseils et votre aide : Sona Amalyan, Olivier Camiré, Sarah Côté, Ruggiero Francavilla, Xiao Luo, Beatrice Marino, Ekaterina Martianova, Einer Muñoz-Pino, Émilie Pic, Stéphanie Racine-Dorval, Vincent Villette et Alfonsa Zamora Moratalla.
J’aimerais aussi remercier les autres membres de mon comité d’encadrement : Dr Abid Oueslati et Dre Marie-Ève Tremblay de m’avoir conseillé pendant ces études. Vos commentaires m’ont permis de voir mon projet sous un autre angle et d’en comprendre davantage sur tous les aspects de ce dernier.
Finalement, je tiens à remercier ma famille et mes amis qui m’ont soutenu tout au long de mes études. Leur soutien m’a grandement aidé à maintenir mon niveau de motivation.
Introduction
La maladie d’Alzheimer
La maladie d’Alzheimer est la forme de démence qui touche le plus grand nombre d’individus à travers le monde. Cette pathologie est caractérisée comme une maladie neurodégénérative, c’est-à-dire qu’elle cause des déficits cognitifs par la dégénérescence des neurones et de leurs connexions. Au Canada, il y a plus d’un demi-million de personnes souffrant de cette maladie et considérant le phénomène de vieillissement de la population, ce nombre pourrait doubler d’ici 20 ans. Elle affecte généralement les personnes âgées de plus de 65 ans, mais de nombreux cas ont également été diagnostiqués chez des personnes de 40 à 65 ans. Les coûts associés à cette maladie s’élèvent à des centaines de milliards de dollars à travers le monde et comme le vieillissement de la population n’est pas un phénomène isolé au Canada, les gouvernements devront débourser des sommes beaucoup plus grandes dans les prochaines années pour soutenir les patients et leur famille (Wong, Gilmour and Ramage-Morin, 2016). Il est donc impératif d’examiner tous les aspects de la maladie d’Alzheimer pour en connaître les causes et développer des outils de diagnostic et des traitements efficaces pour que les personnes qui en souffrent cessent de perdre leurs souvenirs.
Symptômes de la maladie
Les personnes atteintes de la maladie connaissent plusieurs troubles cognitifs qui s’aggravent plus la maladie évolue. Entre autres, elles développent un trouble du langage, appelé aphasie ; elles ont de la difficulté à trouver les bons mots lorsqu’elles s’expriment. De plus, les patients peuvent souffrir d’hallucinations visuelles et auditives, de problèmes psychosociaux, d’une diminution de leur capacité à prendre des décisions et de désorientation temporelle et spatiale. Ce dernier symptôme est causé par la perte de mémoire qui constitue le signe majeur de cette pathologie. La détérioration de la mémoire s’effectue progressivement et affecte autant la mémoire épisodique, à court terme et sémantique, c’est-à-dire les connaissances générales. Plus les signes de la maladie s’intensifient, moins les personnes malades peuvent s’occuper d’elles-mêmes et elles requièrent donc de l’aide en tout temps (Unzeta et al., 2016; Wong, Gilmour and Ramage-Morin, 2016; Maurer, Volk and Gerbaldo, 1997). Les causes biologiques associées à ces symptômes ne sont pas entièrement comprises, mais le cerveau des patients présente des marques distinctives après autopsie.
Principales observations dans le cerveau affecté par la maladie
C’est à Alois Alzheimer, ce neuropathologiste allemand, que nous devons la découverte et le nom de cette maladie. En 1906, il a décrit un cas de démence que présentait une de ses patientes à ce moment décédée. Considérant ses symptômes neurologiques et grâce à l’étude histologique de son cerveau, Alzheimer a caractérisé pour la première fois cette forme de démence. Il a observé que le cortex de sa patiente présentait des plaques et des enchevêtrements neurofibrillaires (Maurer, Volk and Gerbaldo, 1997). Ces manifestations histologiques sont toujours considérées comme des caractéristiques de la maladie.
Aujourd’hui, les causes et l’identité de ces plaques et enchevêtrements sont connues. En effet, les plaques, dites séniles, sont le résultat du clivage de la protéine précurseuse de l’amyloïde (APP) en résidus polypeptidiques bêta-amyloïdes (Aβ) qui s’agrègent ensemble pour former ces régions denses. Ce sont deux protéases qui sont responsables de ce clivage séquentiel de l’APP et donc de la formation de ces résidus neurotoxiques. La β-sécrétase, cette enzyme transmembranaire, coupe l’APP dans l’espace extracellulaire, tandis que la γ-sécrétase la clive au niveau membranaire ce qui relâche les résidus Aβ dans la matrice extracellulaire. Il a été montré que les plaques Aβ induisent des dysfonctionnements synaptiques, des changements morphologiques des neurones et que la proximité de ces plaques avec les neurones pouvait causer de la dégénérescence par stress oxydatif. Les enchevêtrements quant à eux sont causés par l’hyperphosphorylation de la protéine tau. Normalement, cette protéine est fixée aux microtubules dans les axones pour les stabiliser, mais sa forme phosphorylée cause son détachement. Une fois séparée des microtubules, tau s’accumule sous forme de filaments, les microtubules se désintègrent et les axones deviennent instables (Spires-Jones and Hyman, 2014; Haass et al., 2012). Malgré ces évidences biologiques, les mécanismes et les causes impliqués dans la pathogénèse de cette maladie ne sont pas encore complètement connus considérant la complexité du système nerveux central (SNC) et sa relation avec les autres systèmes du corps.
La maladie d’Alzheimer se manifeste biologiquement dans le cerveau des patients par la formation de plaques amyloïdes causée par le clivage de la protéine APP et la formation d’emmêlements neurofibrillaires causée par le détachement des microtubules et l’accumulation de la protéine tau. [Tirée et modifiée de National Institute of Aging – U.S. National Institutes of Health (NIA)]
L’hippocampe : rôle central dans la mémoire
Le symptôme clinique principal de la maladie d’Alzheimer est la perte de mémoire. Depuis les années 1960, il est connu que la structure impliquée dans cette faculté mentale est l’hippocampe. C’est grâce aux travaux de la neuroscientifique Brenda Milner et du neurochirurgien William Scoville sur le célèbre patient H. M. que le rôle de cette structure du système limbique a été découvert. En 1953, Scoville a retiré à ce patient épileptique dont aucun médicament réduisait l’intensité et la fréquence de ses crises une partie de ses lobes temporaux, où est localisé l’hippocampe. Croyant que ses crises épileptiques étaient originaires de cette région, il en a fait l’ablation bilatérale. Une fois
rétabli, le personnel médical a découvert que H. M. souffrait d’amnésie antérograde, c’est-à-dire l’incapacité de créer de nouveaux souvenirs et d’une légère amnésie rétrograde d’une dizaine d’années. Milner a étudié cet homme dans ces débuts en neuroscience et elle a établi que la cause de cette perte de mémoire était l’absence de la région hippocampique. En fait, elle a effectué plusieurs tests cognitifs sur une dizaine de patients qui avaient subi une ablation bilatérale du lobe temporal, mais à différents degrés. Ses résultats lui ont permis de déterminer que seuls les patients n’ayant plus la région hippocampique souffraient d’amnésie (Scoville and Milner, 1957). Quelques années plus tard, d’autres études ont prouvé cette hypothèse en montrant que des lésions, comme une ablation ou un accident vasculaire cérébral, à l’hippocampe, spécifiquement à la région appelée corne d’Ammon 1 (CA1), provoquaient des pertes de mémoire (Parkin, 1996). C’est finalement par des études anatomiques, électrophysiologiques et comportementales que le rôle mnémonique de l’hippocampe a été confirmé en plus de son implication dans les processus de l’apprentissage et de la navigation spatiale.
Anatomie et circuiterie
Considérant les quelques différences structurelles de l’hippocampe entre diverses espèces, il sera question ici seulement de l’hippocampe du cerveau murin. Comme cette structure possède une organisation cellulaire très définie ainsi qu’une grande diversité neuronale, elle est considérée comme l’un des meilleurs modèles pour la neurobiologie, particulièrement la région CA1. En effet, les cellules du CA1 sont très résistantes, même après la préparation de tranches ce qui facilite grandement l’étude de ces neurones. L’hippocampe est divisé en quatre régions distinctes : les trois cornes d’Ammon (CA1-2-3) et le gyrus denté (DG). De plus, il est possible de distinguer cinq couches dans la région CA1, soit l’alveus, les stratums oriens, pyramidale, radiatum et
lacunosum-moleculare (Fig. 2). Ces divisions ont été caractérisées selon la morphologie de la région, sa
composition cellulaire ainsi que les connexions effectuées par les différents types neuronaux. Le DG qui comprend entre autres une couche granulaire constituée des somas des cellules granulaires est, avec le bulbe olfactif, la seule région où il y a de la neurogenèse chez l’adulte. Cette prolifération cellulaire est suspectée de participer à l’ajout de neurones pour coder de l’information supplémentaire.
L’information neuronale se propage dans l’hippocampe principalement par une voie trisynaptique permettant au signal nerveux de passer par toutes les régions hippocampiques. L’influx
nerveux arrive par le cortex enthorinal (EC) pour former des synapses sur les cellules granulaires du DG, ce qu’on appelle la voie perforante. Ensuite, par les fibres moussues, le signal quitte le DG pour rejoindre les cellules pyramidales de la région CA3. Finalement, par les collatérales de Schaffer, l’influx nerveux va rejoindre les cellules pyramidales de la région CA1 pour quitter l’hippocampe vers les régions corticales en passant par le subiculum (Sub) (Fig. 3). Pour que tout le réseau fonctionne correctement, une balance entre l’excitation et l’inhibition de ce dernier est indispensable. Cette balance est possible grâce aux principaux types de neurones qui peuplent l’hippocampe (Anderson
et al., 2006).
O/A : stratum oriens/alveus; PYR : stratum pyramidale; RAD : stratum
radiatum ; LM : stratum lacunosum moleculare; DG : gyrus denté;
CA1-CA2-CA3 : subdivisions de la corne d’Ammon. [Tirée et Modifiée de (Ruiz i Altaba)].
Cortex enthorinal (EC) è CA3 è CA1 è Subiculum (Sub) èRégions Figure 2. Anatomie transversale de l’hippocampe de souris.
Organisation cellulaire
Étant donné que l’étude qui suit se concentre sur la région CA1 de l’hippocampe pour les raisons précédemment mentionnées, seule la description des neurones de cette région sera effectuée ici. Les cellules principales du CA1 sont les neurones pyramidaux. Ces cellules constituent la PYR avec quelques neurones localisés à l’extérieur de cette couche, caractérisés d’ectopiques. Ces cellules sont glutamatergiques, c’est-à-dire qu’elles libèrent du glutamate, le principal neurotransmetteur excitateur du SNC. Leurs épineuses dendrites se ramifient en deux principaux arbres, dont l’un occupe le stratum oriens et l’autre le RAD et le LM. Elles sont contactées par les cellules pyramidales du CA3 et les interneurones inhibiteurs qui stabilisent leur potentiel excitateur. Leur axone se propage dans des zones extrahippocampiques comme par exemple le cortex rétrosplénial impliqué dans la navigation spatiale. Aussi, l’axone se répartie dans l’O/A pour faire synapse sur les interneurones localisés à cet endroit. Cette dernière information indique que ces neurones font des synapses sur les cellules qui les contrôlent originellement signifiant qu’ils procurent une rétroaction directe sur les neurones inhibiteurs (Anderson et al., 2006).
Interneurones GABAergiques
Les interneurones inhibiteurs relâchent le principal neurotransmetteur inhibiteur du SNC : l’acide γ-aminobutyrique (GABA). Ces neurones sont considérés comme la population neuronale la plus diversifiée et occupent toutes les strates de l’hippocampe. Leur fonction principale est de réguler l’activité des cellules pyramidales, mais ils peuvent aussi contrôler de larges ensembles neuronaux par leur interconnectivité. Ces cellules sont classifiées selon leur morphologie, leur expression de peptides neuronaux, leurs cibles synaptiques et leur comportement électrophysiologique (Anderson
et al., 2006) (Fig. 4). À ce jour, 21 types d’interneurones ont été caractérisés dans la région CA1 de
l’hippocampe (Fig. 5). Ceux-ci contactent les cellules pyramidales à différents niveaux structurels comme le domaine périsomatique ou dendritique tandis que certains contactent d’autres interneurones. Il a été montré que ces cellules s’activent différemment pendant les oscillations du réseau (les ondes thêta, gamma et celles à pics aiguës) fournissant aux neurones pyramidaux un contrôle spatiotemporel distinct selon leurs connexions. Ces oscillations sont le résultat de la synchronisation d’un grand nombre de neurones à des fréquences données et sont impliquées dans des processus mentaux comme la mémoire, le sommeil et le codage neuronal. Il existe un type d’interneurones particulier qui contactent exclusivement d’autres interneurones : les interneurones
spécifiques aux interneurones (IS). Ces interneurones sont très importants dans l’équilibre du réseau hippocampique puisqu’ils font de la désinhibition : ils relèvent l’inhibition des cellules pyramidales en inhibant les interneurones qui les contrôlent (Somogyi and Klausberger, 2005; Klausberger and Somogyi, 2008).
Étant donné que ce projet porte sur la maladie d’Alzheimer et que cette pathologie est caractérisée par d’importants déficits de mémoire, seuls deux types d’interneurones ayant été majoritairement associés aux processus mnémoniques seront à l’étude.
Les interneurones présents dans le cerveau représentent la population neuronale la plus diversifiée. Ils sont classifiés selon leur morphologie, leurs cibles, les marqueurs qu’ils expriment et leur comportement électrophysiologique. [Tirée de (Kepecs and Fishell, 2014)]
Représentation schématique des interneurones du CA1 et de leurs cibles synaptiques sur les cellules pyramidales et d’autres interneurones inhibiteurs. [Tirée de (Klausberger and Somogyi, 2008)]
Interneurones exprimant la somatostatine
Les interneurones qui expriment le neuropeptide somatostatine (SOM) comprennent, entre autres, les cellules bistratifiées et les cellules oriens-lacunosum moleculare (O-LMs). Elles innervent principalement le domaine dendritique des neurones pyramidaux (Somogyi and Klausberger, 2005). La SOM est un inhibiteur de l’hormone de croissance et a été impliquée dans certains changements associés à l’activité des neurones (Epelbaum, 1986). Les cellules bistratifiées sont surtout localisées dans la PYR avec quelques-unes situées dans l’O/A. Leur arbre dendritique et leur axone occupent toute la région CA1 excepté le LM. Elles reçoivent du signal nerveux des collatérales de Schaffer, mais aussi des cellules pyramidales du CA1 signifiant une fonction rétroactive de ces neurones sur leurs cibles. Quant aux O-LMs, comme leur nom l’indique, elles occupent l’oriens et projettent leur axone dans le LM. Leurs dendrites sont exclusivement localisées dans l’oriens et sont contactées par l’axone des cellules pyramidale du CA1 révélant encore ici une rétroaction de leur inhibition. Les
types d’interneurones exprimant la SOM innervent donc deux domaines dendritiques distincts des cellules principales indiquant qu’ils contrôlent deux entrées différentes de l’influx nerveux.
Les caractéristiques fonctionnelles de ces interneurones ont permis d’établir leur rôle dans les processus de la mémoire. En effet, il a été montré que les synapses excitatrices des cellules pyramidales sur ces neurones présentaient une plasticité potentiatrice. Ce phénomène indique que la forte inhibition qu’ils génèrent permet de moduler le réseau de la région CA1 suggérant un rôle de ces synapses dans l’apprentissage et la mémoire (Vasuta et al., 2015). Finalement, il a été montré que l’inhibition que procurent ces interneurones est cruciale pour l’apprentissage. Une étude d’imagerie calcique à deux photons a révélé que l’inactivation de ces neurones pendant un test de conditionnement de la peur contextuelle bloquait l’apprentissage associé à la peur. Pendant les événements aversifs, les interneurones positifs à la SOM (SOM+) étaient activés inhibant grandement les cellules pyramidales. Cela indique que les interneurones SOM+ réduisent l’interférence entre un moment aversif sans stimulus conditionné et un avec le stimulus conditionné facilitant l’apprentissage (Müller and Remy, 2014; Vasuta et al., 2015; Lovett-Barron et al., 2014).
Interneurones exprimant la parvalbumine
Un autre type d’interneurones impliqués dans la mémoire sont ceux exprimant la parvalbumine (PV). Cette protéine de liaison au calcium (Ca2+) est uniformément distribuée dans toutes les structures de
ces neurones. Il est proposé que la PV joue un rôle clé dans les mécanismes dépendants du Ca2+
comme la plasticité synaptique puisqu’elle régule les niveaux calciques intracellulaires (Caillard et al., 2000). Les cellules positives à la PV (PV+) comprennent les interneurones contactant le domaine somatique et périsomatique des cellules pyramidales : cellules axo-axoniques et cellules en panier, mais aussi les interneurones bistratifiés et les O-LMs. Cela révèle que les interneurones exprimant la PV tiennent un rôle prédominant dans l’inhibition de la région CA1 (Somogyi and Klausberger, 2005). Le type de cellules PV+ le plus étudié est celui des interneurones en paniers à décharge rapide (FS-BCs – Fast Spiking-Baskets Cells). Les FS-BCs génèrent des potentiels d’action très courts à fréquence extrêmement élevée. De plus, elles ont la caractéristique de se connecter les unes aux autres créant un réseau très actif. Ces particularités leur confèrent une fonction de coordination d’ensembles neuronaux. En effet, ces interneurones contactent un grand nombre de cellules pyramidales induisant une forte inhibition capable d’éteindre complètement l’activité des cellules principales. Des études ont montré que ces cellules PV+ étaient essentielles pour la
génération des oscillations thêta et gamma. L’inactivation de ces interneurones empêche la synchronisation des cellules pyramidales tandis que l’inactivation des interneurones SOM+ ne fait que réduire la force et le rythme des ondes thêta. De plus, il a été rapporté que les FS-BCs s’activaient après une tâche d’apprentissage pour synchroniser la population neuronale du CA1 et induire de la plasticité synaptique pour renforcer le réseau et ainsi consolider les nouvelles informations. Ensemble, ces études montrent que ces interneurones sont à la base des oscillations du réseau hippocampique impliquées dans les processus mnémoniques (Amilhon et al., 2015; Bartos and Elgueta, 2012; Hu, Gan and Jonas, 2014; Ognjanovski et al., 2017).
Changements des interneurones pendant la maladie d’Alzheimer
La maladie d’Alzheimer se caractérise par des déficits cognitifs importants qui mènent à la perte complète d’autonomie de la personne qui en souffre. Ces déficits sont causés par la dégénérescence des structures neuronales, voir des neurones eux-mêmes ou par des modifications physiologiques des neurones menant à des dysfonctionnements du réseau hippocampique. Ici, il sera question des changements observés dans les interneurones exprimant la SOM et ceux exprimant la PV comme ce projet se concentre sur ces cellules.
Densité des interneurones
Les premières études ayant montré une perte neuronale chez les cas d’Alzheimer rapportaient une dégénérescence générale des neurones indépendamment de leur type neuronal. Maintenant, il est connu que certains types spécifiques de neurones sont plus propices à être éliminés tandis que d’autres résistent aux effets nuisibles de la maladie. En effet, les recherches s’entendent sur la vulnérabilité des interneurones SOM+ de la région CA1 pendant la maladie d’Alzheimer, mais les résultats sont contradictoires à ce qui a trait aux interneurones PV+.
Chez l’humain, des études ont montré une réduction considérable de l’immunoréactivité de la SOM autant dans le cortex que dans l’hippocampe. Celles-ci ont été effectuées sur des cerveaux obtenus de patients Alzheimer décédés, donc à un stade très avancé de la maladie. Ils ont aussi découvert qu’il y avait une perte des neurones exprimant la SOM et que ces cellules contenaient également des enchevêtrements de protéines expliquant probablement cette dégénérescence. Ils ont proposé que cette perte importante et spécifique de ces neurones pourrait être associée aux déficits cognitifs observés (Davies, Katzman and Terry, 1980; Roberts, Crow and Polak, 1985; Chan-Palay,
1987). Des années plus tard, grâce au développement de modèles murins imitant les symptômes de la maladie d’Alzheimer, des études ont pu révéler la perte spécifique des interneurones SOM+. En effet, dans le modèle APP/PS1 présentant deux mutations génétiques induisant la surexpression de peptides Aβ (décrit plus en détail dans la partie matériels et méthodes), il y avait une perte de 50 à 60% de ces interneurones dans les souris âgées de seulement six mois. Cette réduction significative apparaissait bien avant la perte des neurones principaux vers l’âge de 17 mois indiquant une vulnérabilité précoce des cellules exprimant la SOM pendant la maladie d’Alzheimer (Ramos et al., 2006). Pour ce qui est des interneurones exprimant la PV, l’utilisation de différents modèles de souris présentant la maladie a donné des résultats contradictoires. Néanmoins, il a été montré que les souris APP/PS1 âgées de dix mois exposaient une réduction d’environ 40% des cellules PV+ et que ces interneurones étaient généralement résistants avant cet âge (Takahashi et al., 2010). Cependant, pendant la maladie d’Alzheimer, ces interneurones ne présentent pas seulement une perte quantitative. Des études ont montré que des modifications structurelles de ces cellules menaient à des changements physiologiques dans le réseau inhibiteur.
Dysfonctionnements des interneurones
En plus de la réduction considérable des interneurones exprimant la SOM+ pendant la maladie, ces cellules subissent des modifications au niveau de leurs neurites provoquant des altérations physiologiques. Il a été montré que les interneurones SOM+ survivants présentaient une morphologie dégénérescente. En effet, leurs dendrites sont plus courtes et il y a du gonflement axonal menant à une détérioration des axones (Chan-Palay, 1987). Plus récemment, une étude a associé des modifications structurelles des O-LMs aux déficits de mémoire observés pendant la maladie d’Alzheimer. Ils ont rapporté une élimination significative des boutons axonaux et une grande instabilité des épines dendritiques chez des souris APP/PS1. Leurs résultats montrent que pendant la maladie d’Alzheimer les O-LMs subissent des changements au niveau de leurs connexions en aval et en amont provoquant des modifications importantes dans le câblage du réseau hippocampique. Ils ont également montré que ces changements affectent l’acquisition de mémoire puisque, comme mentionné précédemment, l’activation de ces interneurones pendant des tâches associées au conditionnement à la peur est essentielle pour l’apprentissage. Ils ont observé une réponse diminuée de ces cellules pendant le stimulus aversif chez les souris présentant les symptômes de la maladie d’Alzheimer empêchant ainsi l’acquisition correcte de l’évènement (Schmid et al., 2016).
Une autre observation a été effectuée chez des souris imitant la maladie d’Alzheimer : une altération des oscillations thêta et gamma. Ces ondes, comme mentionné plus haut, sont générées par les interneurones exprimant la PV, mais peuvent être modulées par ceux exprimant la SOM+. Une étude a montré que chez des souris APP/PS1, il y avait une réduction des ondes thêta pendant une tâche d’exploration spatiale. Ils ont associé cette réduction à la dégénérescence des interneurones SOM+ qui induit un déséquilibre entre l’excitation et l’inhibition dans l’hippocampe empêchant ainsi une synchronisation efficace des cellules principales (Cayzac et al., 2015). D’autres études ont rapporté une réduction significative des oscillations gamma dans différents modèles murins de la maladie qui se traduisaient par des déficits de mémoire (Iaccarino et al., 2016; Verret et
al., 2012). Verret et al. ont montré que l’absence d’une sous-unité d’un canal à sodium
voltage-dépendant provoquait cette altération du réseau. La sous-unité Nav1.1 est exprimée majoritairement sur les cellules PV+ et ils ont observé que leurs souris présentant la maladie présentaient des niveaux réduits de ces cellules exprimant Nav1.1. En rétablissant les niveaux de cette sous-unité, ils ont réussi à rétablir les oscillations gamma (Verret et al., 2012).
Ensemble, ces études montrent que le réseau hippocampique est grandement altéré pendant la maladie d’Alzheimer par les altérations des interneurones inhibiteurs. Ces dysfonctionnements, parmi d’autres, sont également considérés comme un mécanisme menant à un autre symptôme physiologique observé pendant la maladie : l’hyperactivité de l’hippocampe.
Hyperactivité de l’hippocampe pendant la maladie d’Alzheimer
Un phénomène courant qui est observé pendant la maladie d’Alzheimer est l’hyperactivité du réseau hippocampique. En effet, de nombreuses études ont montré que les cellules principales de l’hippocampe présentaient une hyperactivité menant même à une activité épileptique. Une étude qui représente très bien ce phénomène est celle de Busche et al. Grâce à de l’imagerie calcique in vivo, c’est-à-dire l’observation des variations de calcium dans les cellules pendant que l’animal est éveillé, ils ont montré que dans la région CA1 de l’hippocampe, les cellules pyramidales de souris APP23/PS45 âgées de six à sept mois présentaient un profil hyperactif. Ils ont rapporté une plus grande proportion de cellules hyperactives chez les souris présentant les symptômes de la maladie d’Alzheimer, mais également une plus grande fraction de cellules silencieuses. Ce qui veut dire que le réseau a probablement essayé de compenser le manque d’activité en hyperexcitant d’autres cellules. Une autre observation intéressante qu’ils ont faite, est que même dans des souris âgées
d’un à deux mois, où la maladie n’est qu’encore au stade préliminaire, il y avait une plus grande proportion de ces cellules hyperactives. À cet âge, les dépôts de protéine amyloïde ne sont pas encore présents. Ils ont donc associé cette hyperactivité à la forme soluble de la protéine, donc pas encore sous forme de plaques (Busche et al., 2012). D’autre études ont aussi mis en cause la présence de peptides Aβ dans cette activité anormale (Palop and Mucke, 2010a; Busche and Konnerth, 2016; Palop and Mucke, 2010b; Palop et al., 2007).
En plus de l’effet néfaste des peptides amyloïdes, il a été montré que des modifications du réseau GABAergique pourraient être la cause de cette hyperactivité. Comme mentionné précédemment, les interneurones subissent des changements provoquant une désynchronisation des cellules principales. La perte de signal inhibiteur pourrait expliquer la surexcitation des cellules pyramidales (Verret et al., 2012; Cayzac et al., 2015; Schmid et al., 2016; Oyelami et al., 2016). Cependant, ce qui a été proposé jusqu’à présent ne parvient pas à expliquer les causes de ces dysfonctionnements. Les mécanismes impliqués dans le dérèglement des interneurones pendant cette maladie sont encore incompris et il y a de plus en plus preuve que le système immunitaire du SNC jouerait un rôle prédominant dans la pathogénèse de la maladie d’Alzheimer.
Neuroinflammation
La neuroinflammation est une réponse immunitaire normale du système nerveux se traduisant par l’activation de la microglie et des astrocytes. Ces cellules gliales s’activent en réponse à une infection, une lésion cérébrale ou la présence de molécules toxiques. Elle se caractérise par le relâchement de cytokines, de chimiokines et de messagers secondaires induisant tous des modifications biochimiques dans les cellules cibles. Les effets de cette inflammation sur le cerveau sont nombreux et dépendent de la durée et du contexte ayant activé la réponse immunitaire. Elle peut affecter positivement ou négativement le SNC selon le degré d’activation de la glie, le type de molécules relâchés et leurs concentrations (Fig. 6). Les cellules microgliales ont comme fonction primaire de constamment surveiller le SNC et de répondre rapidement au moindre changement pour assurer la bonne santé des neurones ce qui leur confère un rôle prédominant dans la neuroinflammation (DiSabato, Quan and Godbout, 2017; Valero et al., 2017).
Dépendamment du niveau d’activation des cellules gliales, du type de cytokines relâchées ou de leurs concentrations, la neuroinflammation peut avoir un impact bénéfique ou délétère sur le SNC. IL-1 : Interleukine 1, IL-4 : Interleukine 4, M2 : phénotype anti-inflammatoire de la microglie, TNF : Facteur de nécrose tumorale, ROS : dérivés réactifs de l’oxygène, iNOS : oxyde nitrique synthase inductible, CCL2 : ligand chimiokine 2, IL-6 : Interleukine 6, TBI : lésion cérébrale traumatique, IFNγ : Interféron gamma [Tirée et modifiée de (DiSabato, Quan and Godbout, 2017)]
La microglie
La microglie est souvent caractérisée comme étant la « gouvernante » du SNC étant donné qu’elle sonde constamment l’environnement neuronal grâce à ses pseudopodes dynamiques pour s’assurer que tout fonctionne correctement (Fig. 7). Ces pseudopodes extrêmement sensibles sont des prolongements cytoplasmiques qui s’allongent et se rétrécissent continuellement et qui induisent une réponse rapide dans la cellule microgliale dès qu’ils ressentent le moindre changement (microglie ramifiée). La fonction principale de la microglie est de phagocyter les débris cellulaires, les cellules apoptotiques ou du matériel étranger. Lorsqu’elle s’active, elle subit des changements morphologiques procurant à la cellule un corps cellulaire plus rond et de plus grand volume ainsi que des pseudopodes plus courts et épaissis. De plus, elle libère des cytokines qui ont un effet direct sur
les neurones ; les cytokines induisent des cascades de signalisation dans les neurones qui modifient leur comportement comme par exemple présenter un état apoptotique. Plusieurs phénotypes sont observés chez ces cellules gliales. Une cellule M1 induit une réponse pro-inflammatoire qui peut endommager et même mener à la dégradation des neurones. Le phénotype M2 fournit une réponse anti-inflammatoire, donc de neuroprotection. Dans certains cas, les deux phénotypes peuvent être co-exprimés par une cellule microgliales (Morganti, Riparip and Rosi, 2016). Il y a aussi la microglie dite « noire » qui présente en microscopie électronique un cytoplasme très dense. Ce serait une forme très active et surtout présente pendant des épisodes d’inflammation prolongée (Nimmerjahn, Kirchhoff and Helmchen, 2005; Hanisch, 2002; Wolf, Boddeke and Kettenmann, 2017; Kinney et al., 2018; Valero et al., 2017; Bisht et al., 2016). Finalement, deux autres phénotypes ont été décrits dans la littérature : la microglie associée aux maladies (ou disease-associated microglia) et la microglie associée à la neurodégénération (Deczkowska et al., 2018; Krasemann et al., 2017). Cette grande diversité de phénotypes montre la complexité de classifier les différentes cellules microgliales. En plus de leur fonction immunitaire, des études prouvent de plus en plus l’existence d’une communication bidirectionnelle entre les neurones et la microglie qui aurait des effets directs et indirects sur la physiologie des circuits neuronaux.
Cellules microgliales marquées avec un anticorps spécifique à la microglie et aux macrophages (protéine adaptatrice liant le calcium ionisé 1 (Iba1)) dans la région CA1 de l’hippocampe d’une souris négative aux mutations APP et PS1. Il est possible d’observer la distribution uniforme de ces cellules avec leurs pseudopodes ramifiés.
Interactions neurone-microglie
Les cellules microgliales et les neurones expriment des récepteurs aux molécules libérées par l’autre type cellulaire leur permettant de communiquer de manière réciproque. Comme mentionné précédemment, les neurones réagissent aux différentes cytokines relâchées par la microglie entrainant généralement la dégénérescence du neurone affecté. L’impact des cytokines dépend toujours du type de molécule et de sa quantité libérée. Les différentes cytokines sont produites seulement lorsqu’un signal active la cellule microgliale autant en conditions physiologiques normales qu’en conditions pathologiques. Dans l’axe opposé, les neurones libèrent aussi des molécules ayant des effets sur la microglie : les neurotransmetteurs. En effet, il y a de plus en plus de preuves montrant la présence de récepteurs aux différents neurotransmetteurs sur la membrane des cellules microgliales indiquant qu’elles sont sensibles à l’activité neuronale. L’activation des récepteurs α-amino-3-hydroxy-5-methylisoasol-4-propionate (AMPA) sur la membrane microgliale entraine une libération de TNF-α tandis que celle des récepteurs métabotropiques au glutamate 5 (mGluR5) déclenche une élévation des niveaux intracellulaires de Ca2+. En revanche, l’activation des
récepteurs métabotropiques GABAB induit une fuite d’ions potassium et une diminution des cytokines
pro-inflammatoires. De plus, la microglie est sensible à l’adénosine-triphosphate (ATP) relâchée par les neurones. Une augmentation des niveaux d’ATP dans l’espace extracellulaire entraine une dépolarisation des cellules microgliales par l’entrée de potassium ainsi qu’une augmentation du Ca2+
intracellulaire. L’augmentation des niveaux intracellulaires de Ca2+ active des cascades de
signalisation modifiant l’état fonctionnel de la microglie (ramifiée à activée) (Eyo and Wu, 2013; Kettenmann, Banati and Walz, 1993; Färber and Kettenmann, 2005; Pocock and Kettenmann, 2007; York, Bernier and MacVicar, 2018).
En plus d’interagir indirectement via des signaux moléculaires, l’interaction physique entre les deux types cellulaire est maintenant un phénomène bien établi (Uweru and Eyo, 2019). En effet, de nombreuses études ont confirmé ces contacts physiques grâce à la microscopie électronique qui permet une résolution nanométrique (Wake et al., 2009; Tremblay, 2011; Chen et al., 2012; Chen et
al., 2014). Il a été rapporté que les cellules microgliales non activées et activées contactent tous les
domaines d’un neurone (soma, axone, dendrites et synapses). Ces interactions structurelles sont possibles grâce à l’expression de protéines d’adhésion cellulaire au niveau de la membrane des deux cellules. Par exemple, Cluster de différenciation 200 (CD200) est une protéine exprimée sur les neurones et son association avec son récepteur exprimé sur la microglie est l’un des mécanismes
expliquant les contacts neurone-glie. Il a été montré que l’interaction entre ces deux peptides permettait de garder la microglie dans son état de repos et ainsi empêcher la réponse inflammatoire. Un autre exemple est la fractalkine (CX3CL1) qui est présente sous forme soluble et membranaire
dans le SNC. La forme soluble sert d’attractant chimique alors que celle liée à la membrane des neurones a une fonction d’adhésion cellulaire. Après liaison de la fractalkine à son récepteur sur les cellules microgliales, cette molécule active des voies de signalisations modifiant le comportement fonctionnel de ces cellules (Szepesi et al., 2018).
L’impact fonctionnel de ces interactions physiques a été largement étudié et il est maintenant connu qu’elles sont capables d’induire des changements importants dans les circuits neuronaux : phagocytose de neurones dégénératifs, élagage et remodelage synaptique et contrôle de l’activité neuronale. Des études ont montré qu’une fois un neurone dégénératif était reconnu et contacté par les pseudopodes, la cellule endommagée était transportée vers le soma microglial suggérant une phagocytose prochaine (Nimmerjahn, Kirchhoff and Helmchen, 2005; Sierra et al., 2012). Il a été aussi rapporté, par exemple chez le poisson zèbre, que les pseudopodes contactaient des somas neuronaux et des segments initiaux d’axone conduisant à un changement du niveau d’activité du neurone : l’activité de ce neurone était réduite après une période d’hyperactivité (Li et al., 2012). La majorité des études sur les propriétés fonctionnelles de ces interactions s’est concentrée cependant sur les contacts synaptiques. Effectivement, les nombreux contacts dendritiques se font au niveau des synapses de manière dépendante de l’activité. Il est suggéré que ces interactions régulent l’activité synaptique en éliminant des synapses, remodelant les éléments synaptiques ou contrôlant la concentration des neurotransmetteurs ou des molécules de signalisation cellulaire dans la fente synaptique. Ces modifications peuvent causer une régulation négative des synapses hyperactives ou aider à la synchronisation d’ensembles neuronaux par l’élimination de synapses inhibitrices (Akiyoshi
et al., 2018; Li et al., 2012; Nimmerjahn, Kirchhoff and Helmchen, 2005; Tremblay, 2011; Wake et al.,
2009). La suppression de ces synapses inhibitrices est aussi possible par des cellules microgliales activées indiquant que même pendant des périodes d’inflammation, la microglie contribue toujours à la régulation de l’activité neuronale (Chen et al., 2014). Par contre, les effets de contacts entre un neurone et de la microglie activée peuvent également être nuisibles. Une étude a montré que l’activation de la microglie pouvait induire de la dépression synaptique par stress oxydatif. Les dérivés réactifs de l’oxygène (ROS) produit par l’activation de la microglie entrainait l’endocytose de
récepteurs AMPA réduisant ainsi la réponse neuronale du neurone post-synaptique (Zhang et al., 2014).
Ensemble, ces études montrent clairement que la microglie tient plus qu’un rôle de surveillance; elle peut aussi moduler directement et indirectement l’activité neuronale. Elle sonde constamment son environnement et lorsqu’elle sent un changement dans le SNC, elle contacte l’élément présentant un comportement anormal. Si elle considère que ce comportement nuit au réseau, elle peut modifier cet élément ou même l’éliminer pour rétablir le réseau.
Neuroinflammation pendant la maladie d’Alzheimer
Comme mentionné au début de cette partie, la neuroinflammation est une réponse normale du SNC à différents problèmes. Cependant, dans certains contextes, la réponse immunitaire se prolonge et peut causer des dommages au système nerveux. Par exemple, pendant le vieillissement non pathologique, il y a une augmentation des niveaux de cytokines libérées et un prolongement de ce relâchement. Il a été montré que dans des cerveaux âgés il y avait une surexpression des marqueurs de microglie activée même sans stimulus immunitaire. Les mécanismes causant cette activation anormale ne sont pas complètement compris, mais des études ont proposé que la sous-expression de ligands et de récepteurs impliqués dans les contacts neurone-glie empêchait le SNC de garder l’état de « repos » de la microglie. Il a été suggéré que cette suractivation induisait des déficits de mémoire chez les personnes âgées. En effet, des niveaux élevés de la cytokine pro-inflammatoire IL-1β dans l’hippocampe bloqueraient la plasticité synaptique, un processus essentiel pour l’apprentissage et la mémoire. La forte activation des cellules microgliales peut aussi générer des niveaux élevés de ROS qui induisent à leur tour de la neurodégénérescence (Barrientos et al., 2015).
Un autre contexte pendant lequel la microglie exhibe un comportement anormal est celui de la maladie d’Alzheimer. Pendant cette maladie neurodégénérative, il y a aussi une réponse immunitaire prolongée et exagérée se traduisant par une grande libération de cytokines pro-inflammatoires. Les études sur le sujet mettent en cause la présence des peptides Aβ qui constituent un défi immunitaire de taille. Les cellules microgliales s’accumulent autour des plaques amyloïdes et tentent de les éliminer pour les empêcher d’endommager le réseau neuronal. Il a même été rapporté que le niveau soutenu d’inflammation induisait un changement dans la fonction phagocytaire de la microglie. L’élimination des dépôts amyloïdes était grandement réduite et les cellules microgliales se tournaient contre les neurones pour les endommager. L’état suractivé de la microglie produit aussi
une énorme quantité de ROS et de glutamate pouvant provoquer la mort neuronale par excitotoxicité (Cameron and Landreth, 2010; Hickman, Allison and El Khoury, 2008; Kinney et al., 2018; Morgan et
al., 2005; Rogers et al., 2002; Spangenberg and Green, 2017). Avec ces informations, un nouveau
modèle mécanistique de la maladie a été développé (Fig. 8). Dans ce modèle, l’activation prolongée et exagérée de la microglie contribue à la surproduction de protéine amyloïde et cette concentration élevée de protéine toxique maintient le niveau élevé d’inflammation créant ainsi un cycle neurotoxique (Herrup, 2010). L’activation constante crée un environnement neurotoxique qui a de graves conséquences sur les réseaux neuronaux. Comme indiqué ci-haut, une activation soutenue de la microglie peut bloquer la potentialisation synaptique et induire de la dépression synaptique (Zhang et al., 2014; Barrientos et al., 2015; Jones and Lynch, 2015).
Ce nouveau modèle mécanistique propose que le niveau soutenu d’inflammation participe à la production élevée de peptides Aβ. En retour, les niveaux élevés de peptides amyloïdes maintiennent l’état activé de la microglie produisant un cycle toxique. [Tirée et modifiée de (Herrup, 2010)
Liens entre microglie et interneurones dans la maladie d’Alzheimer
Toutes les informations mentionnées dans la partie sur les interactions neurone-glie proviennent d’études sur les neurones principaux. Par contre, aucune étude n’a été effectuée jusqu’à présent sur l’interaction structurelle entre la microglie et les interneurones GABAergiques de l’hippocampe. Pourtant, comme tous les autres types de neurones, ils sont affectés pendant des pathologies
Figure 8. Modèle mécanistique de la maladie d’Alzheimer impliquant l’inflammation soutenue et les peptides Aβ.
Par exemple, deux études récentes ont observé que des changements dans les interneurones induisaient une réponse chez la microglie et ce même pendant la maladie d’Alzheimer. Dans la première étude, ils montrent que le récepteur aux cannabinoïdes 1 (CB1) a un effet indirect sur l’activité de la microglie. Les récepteurs CB1 sont exprimés dans la majorité des neurones du SNC, mais particulièrement en grande quantité sur les interneurones GABAergiques. Ils ont observé que dans des souris transgéniques où le gène de ces récepteurs était supprimé, la réponse microgliale était exacerbée et les niveaux de cytokines pro-inflammatoires étaient très élevés. Ils proposent que dans l’hippocampe, les interneurones GABAergiques tiennent un rôle clé dans le contrôle de l’activation de la microglie. Si ces neurones sont réduits en nombre et présentent des dysfonctionnements pendant la maladie d’Alzheimer, probablement que ces changements provoquent une réponse exagérée (Ativie et al., 2018) . De plus, il a été montré chez des souris présentant les symptômes de la maladie d’Alzheimer (APP/PS1), qu’il y avait une certaine sous-expression des CB1 impliquant ainsi le système des endocannabinoïdes dans cette pathologie et le dysfonctionnement microglial et neuronal (Kalifa et al., 2011). Dans la deuxième étude, ils ont observé que chez des souris imitant la maladie d’Alzheimer (5XFAD) les oscillations gamma induites principalement par les cellules PV+ et impliquées dans l’apprentissage étaient réduites. En plus, ils montrent qu’en rétablissant artificiellement ces oscillations chez les souris malades, il y avait une activation normale, c’est-à-dire non exagérée, de la microglie entrainant une diminution des niveaux de peptides Aβ. Leur étude propose donc un lien direct entre l’activité des interneurones de l’hippocampe et l’état de la microglie pendant la maladie d’Alzheimer (Iaccarino et al., 2016).
En somme, ces études indiquent que les mécanismes associés à la pathogénèse de la maladie d’Alzheimer sont complexes et impliquent plusieurs systèmes ainsi que l’interaction entre ceux-ci. Jusqu’à présent, aucune recherche n’a étudié les contacts spécifiques entre les interneurones inhibiteurs de l’hippocampe et la microglie. Examiner ces interactions structurelles en conditions non pathologiques et pathologiques de type Alzheimer pourrait révéler un nouveau mécanisme expliquant les dysfonctionnements observés dans le réseau neuronal de l’hippocampe.
1. Hypothèse et objectifs spécifiques
1.1 Hypothèse
Les différentes informations mentionnées dans l’introduction sur les causes possibles de la maladie d’Alzheimer, le réseau hippocampique et ces composantes cellulaires, la fonction des interneurones exprimant la SOM et ceux exprimant la PV dans les processus de la mémoire, les changements physiologiques observés pendant cette maladie, l’implication de la neuroinflammation dans cette pathologie et l’évidence de contacts physiques entre les neurones et la microglie indiquent que l’interaction directe entre les neurones et le système immunitaire du SNC tient un rôle majeur dans la pathogénèse de la maladie d’Alzheimer. Également, les interneurones inhibiteurs subissent plusieurs changements pendant la maladie affectant le réseau neuronal de l’hippocampe. Pour ces raisons, je propose que les contacts structurels entre la microglie et les interneurones SOM+ et les interneurones PV+ jouent un rôle clé dans les dysfonctionnements observés dans le réseau hippocampique pendant la maladie d’Alzheimer.
1.2 Objectifs spécifiques
1. Étudier le niveau d’interaction entre la microglie et les interneurones exprimant la SOM et ceux exprimant la PV dans la région CA1 de l’hippocampe.
2. Proposer un rôle pour ces contacts structurels dans le développement de la maladie d’Alzheimer en comparant les paramètres d’interactions chez des souris saines et des souris présentant les mutations APP/PS1.
2. Matériels et méthodes
2.1 Animaux
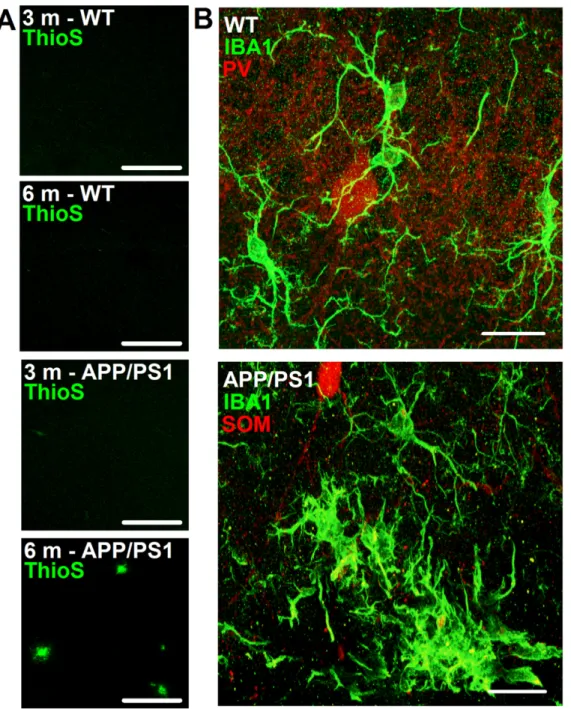
Les expérimentations ont été effectuées sur le modèle de souris APP/PS1 (B6C3-Tg(APPswe,PSEN1d9)85Dbo/Mmjax; The Jackson Laboratory, stock #34829-JAX) associé à la maladie d’Alzheimer. Des souris de ce modèle ne présentant aucune des deux mutations (ici simplifié : WT) et des souris hétérozygotes (ici simplifié : APP/PS1) exprimant les mutations sur les gènes de la protéine précurseuse de l’amyloïde murine et humaine (Mo/HuAPP695swe) et de la préséniline 1 humaine (PSEN1-dE9) ont été utilisées à l’âge de six mois pour l’analyse des interactions et à l’âge de trois et six mois pour la détection des plaques amyloïdes. Les souris exprimant les mutations montrent l’apparition de plaques amyloïdes dès l’âge de six mois tandis que les symptômes cognitifs comme l’apprentissage spatial apparaissent vers l’âge de sept mois. Dans ce projet, seuls les mâles ont été utilisés prenant en considération la différence, précédemment caractérisée, des niveaux de plaques amyloïdes dans ce modèle entre les mâles et les femelles âgées de six mois. Les animaux étaient maintenus sur un cycle lumière/noirceur de 12 h avec accès
ad libitum à de la nourriture et de l’eau. Toutes les expérimentations ont été approuvées par le
Comité de protection des animaux de l’Université Laval et le Conseil canadien de protection des animaux.
2.2 Préparation des tranches
Les souris étaient anesthésiées profondément avec une solution de kétamine/xylazine (100/10 mg/ml) et seulement utilisées lorsque que le fort pincement d’une patte provoquait aucune réaction chez la souris. Ensuite, chaque souris a été premièrement perfusée par voie intracardiaque avec une solution glaciale de sucrose contenant en mM : 2 KCl, 1.25 NaH2PO4, 7 MgSO4, 26 NaHCO3, 10
glucose, 219 sucrose, 0.5 CaCl2 (pH 7.4 ; 310 mOsm) et deuxièmement avec une solution de
paraformaldéhyde (PFA, 4%) et d’acide picrique (20%). Après décapitation et extraction du cerveau, le cerveau était post-fixé dans la même solution de PFA pendant 24h à 4°C. Par la suite, des tranches coronales de 70 µm contenant les hippocampes de chaque hémisphère ont été tranchées à partir du cerveau précédemment fixé dans de l’agar (4%) à l’aide d’un vibratome (PELCO easiSLicer™) dans du tampon phosphate (PB) 0.1 M. Finalement, les tranches hippocampiques ont
été préservées jusqu’à usage dans une solution de PB 0.1 M contenant de l’azoture de sodium (0.03%) pour prévenir la prolifération de bactéries.
2.3 Immunofluorescence
Les tranches ont été premièrement rincées dans du tampon Trizma (TB) et ont été incubées dans une solution de perméabilisation membranaire contenant 0.3% de Triton X-100 (Sigma), 10% de sérum normal de chèvre (NGS, Meridian Life Science, Inc.) et du TB pour 1 h à température pièce. Ensuite, les tranches ont été incubées dans une solution contenant 1% de NGS, l’anticorps primaire biotinylé Iba1 (1:1000 lapin, Wako) et du TB pendant la nuit à 4°C. Le jour suivant, les tranches ont été rincées dans du TB et ont été incubées pendant la nuit à 4°C dans une solution contenant 1% de NGS, les anticorps primaires pour le marquage des interneurones [SOM (1:500 rat, Millipore Sigma) ; PV (1:1000 souris, Sigma)], de la biotine chèvre anti-lapin (1:1000, VECTOR Laboratories) et du TB. Le jour d’après, les tranches ont été rincées dans du TB et les anticorps secondaires ont été appliqués pendant 2 h à température pièce dans des solutions contenants 1% de NGS, Alexa Fluor conjugué à la streptavidine (1:1000, Jackson ImmunoResearch Inc.), Cy3 (1:500, chèvre anti-rat, Jackson ImmunoResearch Inc.) ou Dylight 549 (1:500, chèvre anti-souris, Jackson ImmunoResearch Inc.) et du TB. Finalement, les tranches ont été rincées dans du TB et montées sur lame de microscope avec une lamelle de verre dans du medium de montage fluorescent Dako (Dako) pour l’acquisition des images. Pour détecter les plaques amyloïdes, deux tranches de chaque condition ont été colorées à la Thioflavine S (ThioS, Sigma) comme précédemment décrit (Ly, Cai and Song, 2011).
Les cellules microgliales ont été marquées en utilisant l’anticorps Iba1 conjugué à la biotine élevée chez le lapin. Cet anticorps a été précédemment caractérisé pour se lier à la molécule adaptatrice liant le calcium ionisé 1 (Iba1) qui est spécifiquement exprimée dans la microglie et les macrophages du SNC (Wako, 01626461;(Imai et al., 1996). Les interneurones exprimant la SOM ont été révélés en utilisant un anticorps monoclonal élevé chez le rat liant spécifiquement le peptide hormonal SOM (Millipore Sigma, MAB354;(Kawaguchi and Kubota, 1998). Dernièrement, les interneurones exprimant la PV ont été marqués avec un anticorps monoclonal élevé chez la souris liant spécifiquement la protéine de liaison du calcium PV (Sigma, P3088; (Celio, 1986).
2.4 Acquisition et analyse des images
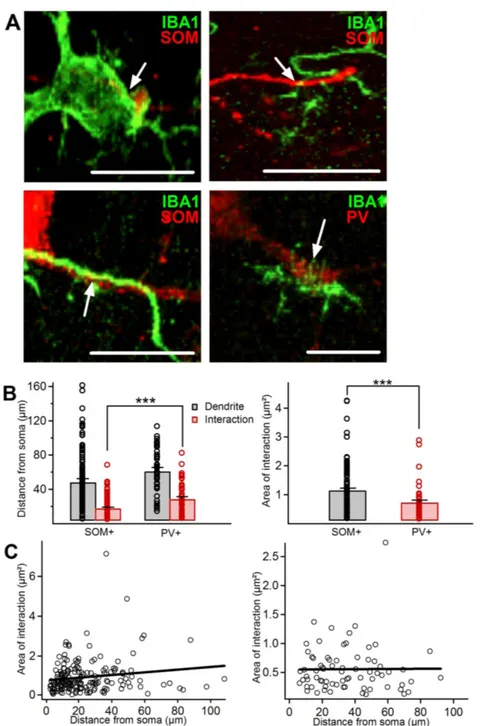
Deux images par hippocampe (section) ont été prises en utilisant les microscopes confocaux Leica Microsystems SP5 ou Zeiss LSM800 supportés respectivement par les logiciels Leica LAS et Zen 2.3. Les images étaient constituées de toutes les couches de la région CA1 de l’hippocampe médial. Des représentations 3D par empilements en z des plans focaux ont été acquises avec un objectif 40× (NA, 1.4) à immersion dans l’huile avec un espacement de 0.32 µm entre chaque plan. Les images ont été analysées avec le logiciel ZEN lite (Zeiss). L’interaction structurelle des interneurones exprimant la SOM et ceux exprimant la PV avec la microglie a été déterminée en analysant chaque plan focal. Ce qui était considéré comme une interaction était lorsque les deux signaux fluorescents provenant des deux types cellulaires se chevauchaient dans le même plan focal autour de structures cellulaires définies (somas, dendrites ou pseudopodes). Donc, ici, un contact était caractérisé par la fusion du signal Iba1 avec le signal SOM ou PV. L’analyse interactionnelle a été effectuée du point de vue des interneurones, c’est-à-dire que les interactions étaient définies comme étant une structure microgliale qui fait contact sur un interneurone. Pour obtenir la proportion d’interneurones qui interagissaient, le calcul de la densité (nombre d’interneurones/mm3) totale des interneurones et
celles des interneurones interagissant a été effectué pour chaque image. Les interactions faites par le soma ou des pseudopodes de microglie sur le soma d’un interneurone ont été comptés et l’aire d’interaction a été mesurée pour chaque type de contact (soma, pseudopode) et pour chaque interneurone. La surface de contact était mesurée en traçant un polygone autour des structures microgliales où le signal d’Iba1 chevauchait celui de SOM ou PV. Les interactions faites par la microglie sur les dendrites d’un interneurone ont été comptées et l’aire d’interaction, la distance à partir du soma de la dendrite et celle où une interaction était détectée ont été mesurées pour chaque dendrite.
2.5 Analyse des données et analyse statistique
Un échantillon de 98 cellules SOM+ et de 88 cellules PV+ provenant de trois souris négatives aux mutations APP et PS1 a été utilisé pour l’analyse des souris WT. Pour ce qui est de l’analyse des souris APP/PS1, l’échantillon utilisé était de 70 cellules SOM+ et de 75 cellules PV+ provenant de trois souris positives aux mutations APP et PS1. Les données ont été analysées en utilisant les logiciels Clampfit 10.7, Excel, IGOR Pro, Image J, Neurolucida et Statistica. Pour l’analyse statistique, la distribution des données a été testée avec le test de normalité Shapiro-Wilcoxon. Le
test t non-apparié de Student, le test de Mann-Withney et celui du coefficient de corrélation de Pearson ont été utilisés. Pour l’analyse de la corrélation, les valeurs aberrantes ont été détectées et exclues grâce à la méthode des bornes de Tukey basée sur l’écart interquartile. Les valeurs de P < 0.05 étaient considérées comme statistiquement significatives. Les données sont exprimées comme étant la moyenne ± l’erreur type (SE) avec les valeurs individuelles de chaque neurone ou dendrite.
3. Résultats
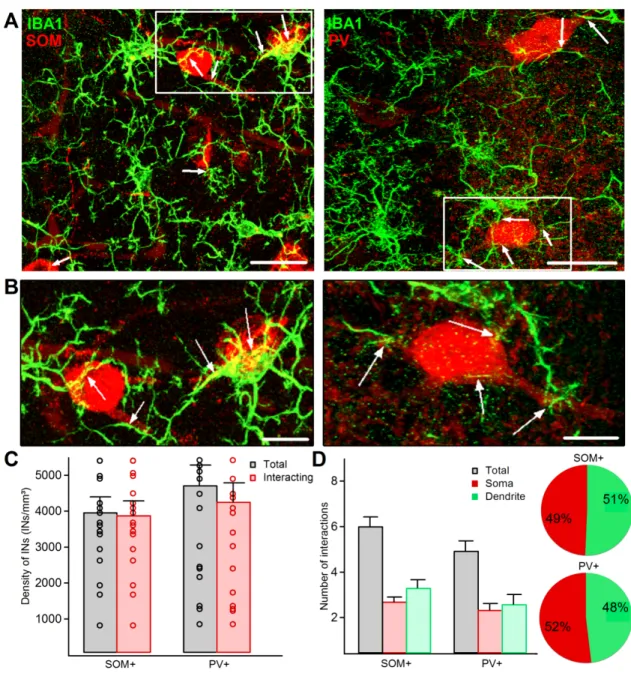
3.1. Une grande proportion d’interneurones interagissent avec la microglie
Pour évaluer le niveau d’interaction entre les deux types cellulaires, nous avons premièrement calculé la densité totale d’interneurones exprimant la SOM et ceux exprimant la PV ainsi que la densité de ces neurones qui interagissaient avec la microglie. Nos résultats ont montré qu’une grande proportion des deux sous-types d’interneurones interagissent avec la microglie chez les souris WT (98% et 89% respectivement ; SOM+ : n = 9 sections / 3 souris, PV+ : n = 11 sections / 3 souris ; Fig. 9A-C). Le dénombrement du nombre total d’interactions sur les interneurones n’a montré aucune différence entre les cellules SOM+ et les cellules PV+ indiquant qu’à l’âge de six mois chez les souris WT, la microglie n’a pas de partenaire privilégié (p > 0.05, test de Mann-Whitney). Nos résultats ont aussi révélé qu’il n’y avait aucune différence pour la fraction entre les interactions faites sur les somas et les dendrites, et ce dans les deux sous-types de neurones (p > 0.05, test de Mann-Whitney ; SOM+ : n = 63 cellules sur 98 / 10 sections sur 12 / 3 souris, PV+ : n = 32 cellules sur 88 / 10 sections sur 12 / 3 souris ; Fig. 9D). Ces résultats indiquent qu’en conditions contrôles il existe un niveau élevé d’interaction entre les cellules SOM+ et les cellules PV+ et la microglie sans aucune préférence pour le sous-type d’interneurone et pour la structure neuronale.