Effet répressif de Bacillus subtilis et de Bacillus pumilus
envers Rhizoctonia solani sur tomate et concombre de
serre
Mémoire
Elizabeth Demeule
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Effet répressif de Bacillus subtilis et de
Bacillus pumilus envers Rhizoctonia solani
sur tomate et concombre de serre
Mémoire
Élizabeth Demeule
Sous la direction de :
Russell Tweddell, directeur
Résumé
Les agents phytopathogènes telluriques constituent un problème majeur touchant les productions serricoles de concombre (Cucumis sativus L.) et de tomate (Solanum
lycopersicum L.). Les traitements biologiques efficaces sont limités pour lutter contre ces
agents pathogènes. Cette étude avait pour objectifs d’évaluer (1) l’effet antagoniste in vitro de Bacillus pumilus Meyer et Gottheil souche PTB180 et Bacillus subtilis (Ehrenberg) Cohn souche PTB185 envers Rhizoctonia solani J.G. Kühn, Pythium ultimum Trow, Sclerotinia
sclerotiorum (Lib.) de Bary, Phytophthora capsici Leonian, Fusarium oxysporum Schltdl. et F. oxysporum f.sp. radicis-lycopersici Jarvis & Shoemaker, (2) l’effet répresseur d’une
application préventive des bactéries sur la pourriture du collet et la fonte des semis causées par R. solani, sur concombre ou tomate en serre et (3) l’effet des bactéries sur la croissance et la productivité des plants de tomate cultivés en serre. Lors des essais in vitro, PTB180 et PTB185, utilisés seuls et en mélange (1:1), ont fortement inhibé la croissance mycélienne des six agents phytopathogènes. Sur plantules de concombre et de tomate, le mélange (1:1) des deux souches a permis une réduction significative (p<0,05) de la sévérité des symptômes de la pourriture du collet. PTB185 et le mélange (1:1) des deux souches ont augmenté significativement la hauteur et la masse sèche des plants infectés par R. solani. Les essais sur graines de tomate montrent que PTB180 a augmenté significativement le taux de levée des graines et que PTB185 a réduit significativement la mortalité post-levée tout en favorisant la croissance des plantules. Les tests réalisés sur plants de tomate sains n’ont pas montré d’effet significatif de PTB180 et PTB185 sur la croissance et la productivité des plants. Les bactéries à l’étude pourraient éventuellement représenter une alternative aux fongicides de synthèse pour lutter contre les agents phytopathogènes.
Table des matières
Résumé ... ii
Table des matières ... iii
Liste des tableaux ... vi
Liste des figures ... vii
Remerciements ... ix
Introduction ... 1
Chapitre 1 - Revue bibliographique ... 3
1.1. Les maladies en serre ... 3
1.1.1. Les pertes ... 3
1.1.2. Champignons et oomycètes pathogènes ... 3
1.1.3. Rhizoctonia solani J.G. Kühn ... 4
1.1.4. Sclerotinia sclerotiorum (Lib.) de Bary ... 5
1.1.5. Fusarium oxysporum Schltdl. ... 5
1.1.6. Phytophthora capsici Leonian ... 6
1.1.7. Pythium ultimum Trow ... 6
1.2. Les produits phytosanitaires ... 6
1.2.1. Utilisation des pesticides ... 6
1.2.2. Présence de pesticides dans les aliments ... 7
1.2.3. Exposition des travailleurs agricoles ... 7
1.2.4. Présence de pesticides dans l’environnement ... 8
1.2.5. Phénomène de résistance aux fongicides ... 8
1.3. L’agriculture biologique ... 9
1.3.1. L’agriculture biologique au Canada ... 9
1.3.2. L’agriculture biologique au Québec ... 9
1.4. La lutte contre les maladies racinaires en serre ... 9
1.4.1. Lutte chimique ... 9
1.4.2. Lutte biologique ... 10
1.4.3. Microorganismes utilisés en lutte biologique ... 10
1.5. Le genre Bacillus ... 12
1.5.1. Bacillus subtilis (Ehrenberg) Cohn ... 12
1.5.2. Bacillus pumilus Meyer et Gottheil ... 13
1.5.3. Effet sur les polluants ... 13
1.5.4. Effet stimulant sur la croissance et les défenses naturelles des plantes ... 13
1.6. Hypothèses et objectifs de recherche ... 15
1.6.1. Hypothèses de recherche ... 15
1.6.2. Objectifs de recherche ... 15
Chapitre 2 - Matériel et Méthodes ... 16
2.1. Microorganismes ... 16
2.1.1. Bacillus pumilus et Bacillus subtilis ... 16
2.1.2. Agents pathogènes ... 16
2.2. Essais au laboratoire ... 16
2.2.1. Effet antagoniste de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en mélange (1:1), sur la croissance radiale des différents agents pathogènes telluriques ... 16
2.2.1.1. Préparation du milieu gélosé double-couche ... 17
2.2.1.2. Préparation des inocula (agents pathogènes) ... 17
2.2.1.3. Inoculation et croissance des agents pathogènes sur la double-couche ... 17
2.2.1.4. Dispositif expérimental et analyses statistiques ... 18
2.3. Essais en serre ... 18
2.3.1. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en mélange (1:1), sur les plantules de concombre et de tomate infectées par R. solani 18 2.3.1.1. Serres ... 18
2.3.1.2. Traitements à l’étude ... 18
2.3.1.3. Inoculum de R. solani ... 19
2.3.1.4. Substrats de culture ... 19
2.3.1.5. Semis ... 19
2.3.1.6. Rempotage des plantules et début de la phase expérimentale ... 19
2.3.1.7. Paramètres mesurés ... 20
2.3.1.8. Dispositif expérimental et analyses statistiques ... 21
2.3.2. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en mélange (1:1), sur le taux de levée des graines de tomate semées dans un substrat inoculé avec R. solani, sur la mortalité post-levée, la hauteur et la masse sèche totale des plantules de tomate émergées ... 22
2.3.2.1. Serres ... 22
2.3.2.2. Traitements ... 22
2.3.2.3. Préparation de l’inoculum de R. solani ... 22
2.3.2.4. Préparation des graines ... 22
2.3.2.5. Préparation du substrat de croissance ... 23
2.3.2.6. Paramètres mesurés ... 23
2.3.3. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en
mélange (1:1), sur la croissance et le rendement en fruits de plants de tomate ... 24
2.3.3.1. Serre ... 24
2.3.3.2. Traitements à l’étude ... 24
2.3.3.3. Semis ... 24
2.3.3.4. Rempotage des plantules ... 24
2.3.3.5. Paramètres mesurés ... 25
2.3.3.6. Dispositif expérimental et analyses statistiques ... 26
Chapitre 3 – Résultats ... 27
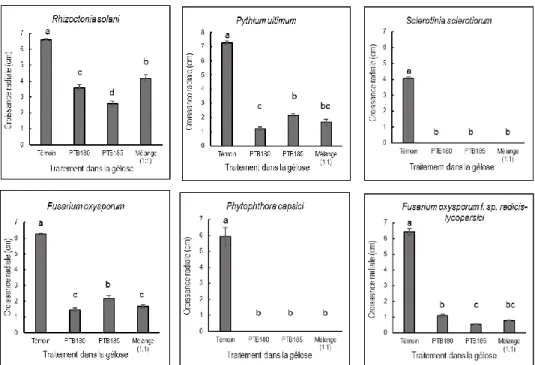
3.1. Effet antagoniste de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en mélange (1:1), sur la croissance radiale des différents agents pathogènes telluriques ... 27
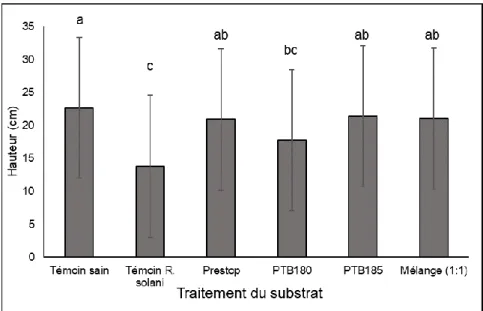
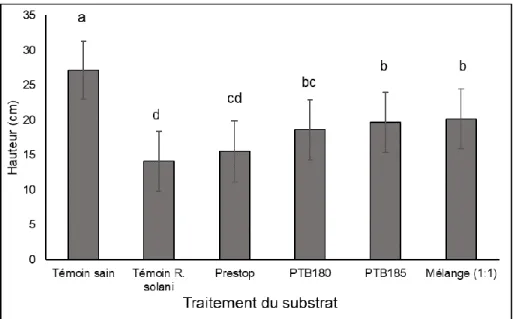
3.2. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en mélange (1:1), sur les plantules de concombre et de tomate infectées par R. solani 28 3.2.1. Effet sur la hauteur des plants ... 28
3.2.2. Effet sur la masse sèche des plants ... 29
3.2.3. Effet sur la sévérité des symptômes causés par R. solani ... 31
3.3. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en mélange (1:1), sur le taux de levée des graines de tomate semées dans un substrat inoculé avec R. solani, sur la mortalité post-levée, la hauteur et la masse sèche totale des plantules de tomate émergées ... 32
3.3.1. Effet sur le taux de levée et la mortalité post-levée ... 32
3.3.2. Effet sur la masse sèche et la hauteur des plantules ... 33
3.4. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et en mélange (1:1), sur la croissance et le rendement en fruits de plants de tomate sains 35 3.4.1. Effet sur la masse sèche racinaire et de la partie aérienne ... 35
3.4.2. Effet sur le rendement en fruits ... 36
Chapitre 4 - Discussion ... 38
Conclusions ... 45
Références bibliographiques ... 46
Annexe A – Milieux de culture ... 53
Liste des tableaux
Tableau 1. Biofongicides homologués au Canada contre les maladies racinaires ... 11 Tableau 2. Origine et date de réception des agents pathogènes à l’étude ... 16
Liste des figures
Figure 1. Schéma illustrant la méthode double-couche ... 17 Figure 2. Illustration de la méthode d’inoculation des plantules avec Rhizoctonia solani; . 20 Figure 3. Échelle visuelle de sévérité des symptômes de la pourriture du collet allant d’un indice de 0 à 4 pour le concombre et la tomate ... 21 Figure 4. Dispositif expérimental en serre. ... 21 Figure 5. Mycélium de Rhizoctonia solani dans le substrat humidifié ... 23 Figure 6. Plantule de tomate (Micro Tom) le jour du rempotage (a) et plantules dans les caissettes de germination (b) ... 25 Figure 7. Plants (Micro Tom) avec tomates rouges prêtes à être récoltées. ... 25 Figure 8. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la croissance radiale de six agents phytopathogènes telluriques ... 27 Figure 9. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la hauteur des plants de concombre ‘Marketmore 70’ ... 28 Figure 10. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la hauteur des plants de tomate ‘Celebrity Hybrid Red’ ... 29 Figure 11. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la masse sèche totale des plants de concombre ‘Marketmore 70’ . 30 Figure 12. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la masse sèche totale des plants de tomate ‘Celebrity Hybrid Red’. ... 30 Figure 13. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la sévérité des symptômes causés par Rhizoctonia solani chez des plants de concombre ‘Marketmore 70’. ... 31 Figure 14. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la sévérité des symptômes causés par Rhizoctonia solani chez des plants de tomate ‘Celebrity Hybrid Red’. ... 32 Figure 15. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la levée et la mortalité post-levée des plantules de tomate ‘Celebrity Hybrid Red’ ... 33 Figure 16. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la masse sèche totale des plantules de tomate ‘Celebrity Hybrid Red’ ... 34 Figure 17. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la hauteur des plantules de tomate ‘Celebrity Hybrid Red’. ... 34 Figure 18. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la masse sèche de la partie aérienne des plants de tomate ‘(Micro Tom)’. ... 35 Figure 19. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la masse sèche des racines des plants de tomate ‘Micro Tom’ ... 35 Figure 20. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la masse sèche des tomates produites sur une période de sept semaines par les plants du cultivar ‘Micro Tom’. ... 36
Figure 21. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur la masse sèche moyenne des tomates produites sur une période de sept semaines par les plants du cultivar ‘Micro Tom’. ... 36 Figure 22. Effet de Bacillus pumilus PTB180 et Bacillus subtilis PTB185, utilisés seuls et en mélange (1:1), sur le nombre moyen de tomates rouges produites par semaine sur une période de sept semaines par les plants du cultivar ‘Micro Tom’. ... 37
Remerciements
C’est avec un sentiment d’accomplissement que j’aimerais remercier le Dr Russell Tweddell et le Dr Hani Antoun, pour leur support et leurs judicieux conseils tout au long de mon parcours. J’adresse des remerciements particuliers à mon directeur de recherche, le Dr Russell Tweddell, qui a su m’accompagner tout au long de ma rédaction et me permettre de pousser plus loin ma réflexion. Son investissement dans mes travaux de recherche m’a permis d’étendre mes connaissances dans le domaine et de mener à terme mon projet de maîtrise. J’ai également eu l’honneur d’être la dernière étudiante à la maîtrise encadrée par le Dr Hani Antoun, qui a su me conseiller durant mon parcours à la maîtrise et m’inspirer avec ses connaissances.
J’aimerais aussi remercier chaleureusement Thi Thuy An Nguyen. Merci An d’avoir été présente lors de mes expériences au laboratoire du moment où j’étais encore au baccalauréat jusqu’à la toute dernière manipulation en serre. Ton expérience m’a été grandement précieuse et tes conseils d’autant plus.
Merci au personnel de l’Université Laval, à l’Envirotron tout comme aux serres du Pavillon Abitibi-Price, pour leur disponibilité et leur engagement. Je tiens à remercier Marie-Andrée Paré pour ses judicieux conseils pour mes travaux en serre.
Je souhaite également remercier les partenaires financiers, notamment Premier Tech, le Conseil de recherches en sciences naturelles et génie du Canada (CRSNG), le Consortium de recherche et innovations en bioprocédés industriels au Québec (CRIBIQ) et Anatis Bioprotection.
Introduction
La production maraîchère de serre est en plein essor au Québec et au Canada, notamment en raison de l’engouement pour l’achat local de produits maraîchers frais à longueur d’année et du développement de nouvelles technologies. En 2017, on recensait au Canada 887 entreprises spécialisées dans la production maraîchère de serre (Statistique Canada, 2018a, 2018b). Au Canada, près du quart (23% en tonnes métriques) des légumes sont produits en serre. Avec une superficie respective de production de 240 000 m2 et de
640 000 m2 (Ministère de l'Agriculture, des Pêcheries et de l'Alimentation [MAPAQ], 2018),
le concombre (Cucumis sativus L.) et la tomate (Solanum lycopersicum L.) constituaient les plus importantes productions maraîchères de serre au Québec en 2017.
Ces productions serricoles, les plus importantes tant au Québec qu’au Canada en termes de superficie de culture (Statistique Canada, 2018a), sont affectées par plusieurs agents phytopathogènes, notamment par des microorganismes s’attaquant aux racines. Les maladies racinaires, dont la fonte des semis et les pourritures des racines et du collet causées par les agents phytopathogènes telluriques, constituent un problème majeur touchant les productions serricoles. En 2018, 19% des maladies sur le concombre et 27% sur la tomate, rapportées par le Laboratoire d’expertise et de diagnostic en phytoprotection du MAPAQ, étaient causées par des agents pathogènes telluriques (Société canadienne de phytopathologie, 2019). L’application de produits phytosanitaires de synthèse, en dépit de leurs effets néfastes reconnus, demeure une méthode largement utilisée pour lutter contre les agents phytopathogènes dans un contexte de monoculture. Des méthodes de lutte biologique, notamment l’utilisation de bactéries antagonistes aux champignons phytopathogènes, sont de plus en plus pratiquées, et ce, plus particulièrement en productions serricoles. Les bactéries du genre Bacillus figurent parmi les microorganismes les plus étudiés pour une utilisation en lutte biologique. Bien que plusieurs souches de
Bacillus spp. s’avèrent prometteuses (Asaka et Shoda, 1996; Chowdappa et al., 2013;
Huang et al., 2012) ou sont déjà utilisées comme agents de lutte biologique, la recherche de souches plus performantes constituant une avenue de remplacement aux fongicides de synthèse est en plein essor (Shafi et al., 2017).
C’est dans ce contexte que s’inscrit ce projet de maîtrise qui, en collaboration avec l’entreprise Premier Tech, visait à évaluer (1) l’effet antagoniste de Bacillus pumilus souche PTB180 et de Bacillus subtilis souche PTB185 envers différents agents phytopathogènes telluriques, (2) l’effet répresseur de ces bactéries sur le développement de la pourriture des
racines et du collet causée par Rhizoctonia solani et (3) leur l’effet sur la croissance et le rendement en fruits de plants de tomate.
Ce mémoire est composé de quatre chapitres. Le premier chapitre présente une revue bibliographique abordant différents thèmes incluant les maladies en serre, le contexte de l’utilisation des produits phytosanitaires, l’agriculture biologique, la lutte contre les maladies racinaires en serre et les Bacillus et leurs applications. Les objectifs et hypothèses de recherche y sont également énoncés. Le deuxième chapitre présente les différentes méthodes utilisées pour réaliser les travaux. Le troisième chapitre présente les résultats obtenus au cours des travaux de recherche. Ces derniers sont analysés et discutés au quatrième chapitre.
Chapitre 1 - Revue bibliographique
1.1.
Les maladies en serre
1.1.1.
Les pertes
Les pertes en production végétale sont causées principalement par les insectes et les maladies d’ordre microbiologique. Au Québec, dans les années 90, les pertes associées aux maladies en serre et au champ étaient estimées à 15,5% pour l’ensemble des cultures, à 21% pour la tomate et à 15% pour le concombre (Richard et Boivin, 1994). Aujourd’hui, on estime qu’entre le tiers à la moitié des productions sont perdues entre le champ et l’assiette (Flood, 2010). En 2018, 19% des maladies sur le concombre et 27% sur la tomate, reportées au Laboratoire d’expertise et de diagnostic en phytoprotection du MAPAQ, étaient causées par des agents pathogènes telluriques (Société canadienne de phytopathologie, 2019). Ces pertes sont observées malgré une utilisation intensive de produits phytosanitaires conventionnels. Les diminutions de rendement pour la tomate sont d’autant plus importantes qu’il est souvent nécessaire de reprendre la production en entier, en particulier dans les cas de pourriture des racines (Rhizoctonia solani, Sclerotinia
sclerotiorum) et de fusariose des racines et du collet (Fusarium oxysporum f.sp. radicis-lycopersici), lorsqu’une production de tomates est infectée par un agent pathogène. Les
maladies fongiques sont donc responsables d’une réduction de la production, au champ et en serre (Agriculture et Agroalimentaire Canada, 2006; Huang et Jarvis, 2002; Ministère de l’Agriculture de l’Alimentation et des Affaires rurales, 2001; Richard et Boivin, 1994).
1.1.2. Champignons et oomycètes pathogènes
Les champignons et les oomycètes sont des organismes souvent microscopiques faisant partie du grand domaine des Eucaryotes et du règne des Mycètes pour l’un et des Chromistes pour l’autre. Ces organismes produisent généralement des hyphes, cloisonnées ou non, formant un mycélium produisant des spores sexuées ou asexuées ou encore des oospores, des sporanges et des zoospores. De par leur capacité à dégrader la matière organique d’origine végétale (cellulose, lignine, hémicellulose, etc.), les champignons remplissent divers rôles au sein des écosystèmes. Nécrotrophes, saprotrophes, symbiotiques ou parasites, les mycètes peuvent également être pathogènes et ainsi être nuisibles à un hôte animal, végétal ou encore fongique. Les microorganismes phytopathogènes sont ubiquitaires chez les champignons et les protistes fongiformes; on les retrouve dans les embranchements des Chytridiomycota, Blastocladiomycota,
Zygomycota, Ascomycota et des Basidiomycota ainsi que dans les Oomycota et les Hyphochytriomycota notamment. Les connaissances sur le développement et la reproduction des champignons et protistes fongiformes phytopathogènes permettent une meilleure compréhension de leur physiologie, essentielle à la gestion de leur développement dans un contexte agronomique (Agrios, 2005).
1.1.3. Rhizoctonia solani J.G. Kühn
Rhizoctonia solani, responsable de plusieurs maladies, dont la fonte des semis, la
pourriture du collet et le flétrissement vasculaire chez les plantes supérieures, est un Basidiomycète à mycélium stérile, ne produisant aucune forme de spores sexuées ou asexuées. Ce champignon ne produit que du mycélium caractérisé par ses ramifications à angle droit et par des sclérotes. Sur milieu gélosé, il produit un mycélium dense de couleur brun rouille. R. solani est un champignon du sol s’attaquant aux tiges, aux racines et autres tissus végétaux se développant dans le sol ou le substrat de culture. La température optimale de croissance de R. solani est autour de 25˚C, mais peut varier de 18 à 35˚C en fonction des souches et des conditions environnementales. Les symptômes les plus fréquemment observés chez les plantes infectées par R. solani sont la fonte des semis, la pourriture racinaire et de la tige ainsi que des chancres au niveau du collet. Ce champignon peut également s’attaquer aux tissus en contact avec le sol et causer des brûlures ou des taches sur le feuillage (Iriis phytoprotection, 2019b; Parmeter, 1970; Sneh, Burpee et Ogoshi, 1991).
La fonte des semis se développe principalement dans les sols très humides sous des températures fraîches, c’est-à-dire autour de 15 et 18˚C, mais peut se développer dans des sols plus secs (Iriis phytoprotection, 2019 a, b; Richard et Boivin, 1994). De façon générale, la maladie se développe plus sévèrement lorsque les sols sont modérément humides plutôt qu’inondés ou complètement secs. Lors d’infection de jeunes semis, le champignon s’attaque à la plante près du sol. Les tissus du collet de la plantule se gorgent d’eau, se désagrègent et ne peuvent plus supporter la jeune pousse, qui va éventuellement s’affaisser au sol et se décomposer (Agrios, 2005).
Dans les cas de pourriture racinaire et du collet, l’infection des plantules plus âgées se traduit par une invasion des tissus externes au niveau des cellules corticales, ce qui cause un brunissement des tissus infectés. Lorsque le champignon infecte toute la circonférence de la tige, la plante peut s’affaisser et mourir. Les racines les plus en surface peuvent également être infectées lorsque la température est fraîche, la température
optimale d’infection se situant entre 15 et 18˚C. L’infection se propage alors à l’ensemble du système racinaire, ce qui affaiblit la plante et réduit sa croissance (Agrios, 2005).
R. solani peut également s’attaquer aux fruits en contact avec le substrat de culture
ou avec le sol. Un fruit contaminé en contact avec des fruits sains lors du transport ou de l’entreposage peut entraîner l’infection de ces derniers (Agrios, 2005).
1.1.4. Sclerotinia sclerotiorum (Lib.) de Bary
Sclerotinia sclerotiorum est un champignon de l’embranchement des Ascomycota. Ce
champignon est responsable de la pourriture blanche, une maladie affectant plusieurs plantes maraîchères. S. sclerotiorum peut s’attaquer à toutes les parties des plantes. La maladie se manifeste principalement par la présence de mycélium blanc à la surface des tissus végétaux (Agrios, 2005).
S. sclerotiorum survit sous forme de sclérotes noirs et denses (entre 2 et 10 mm de
diamètre) dans le sol pouvant germer et produire des ascospores ou du mycélium. Ce mycélium pénètre par les racines ou le collet pour infecter les plantules ou les plants matures. Le mycélium se propage ensuite dans les tissus vasculaires provoquant une perte de turgescence et un affaissement des structures de la plante. De nouveaux sclérotes se forment et persistent dans le sol jusqu’au printemps suivant. Les fruits peuvent également être infectés lorsqu’ils sont en contact avec le sol (Agrios, 2005).
1.1.5. Fusarium oxysporum Schltdl.
Le flétrissement vasculaire et les pourritures diverses, causés par Fusarium
oxysporum, affectent une large gamme de plantes vasculaires. Ce champignon de
l’embranchement des Ascomycota comporte de nombreuses sous-espèces; chacune d’elles s’attaquant à une famille ou à une plante spécifique (Agrios, 2005; Nelson et al., 1994). Chez la tomate, ce sont Fusarium oxysporum f.sp. lycopersici W.C. Snyder & H.N. Hansen et Fusarium oxysporum f.sp. radicis-lycopersici Jarvis & Shoemaker qui infectent
les tissus. F. oxysporum produit trois types de spores asexuées : microconidies, macroconidies et chlamydospores. Ce sont les chlamydospores qui survivent le plus longtemps dans le sol et qui infectent la plante par les ouvertures formées par l’émergence d’une racine latérale. Le mycélium se propage ensuite par le xylème et provoque l’affaissement des tissus et de la plante au sol. Ce champignon phytopathogène se propage par le système d’irrigation, la machinerie, le substrat ou les transplants (Agrios, 2005).
1.1.6. Phytophthora capsici Leonian
Les protistes fongiformes phytopathogènes du genre Phytophthora de la classe des Oomycètes affectent principalement les racines et les tiges des plantes. Ces microorganismes produisent des oospores et des zoospores. La fonte des semis causée par P. capsici survient lorsque le sol est saturé d’eau; les zoospores étant des spores mobiles qui se déplacent en milieu aqueux. Les conditions humides favorisent également la formation de mycélium. Lorsque la température se situe entre 10 et 36˚C, l’agent pathogène s’attaque aux plantules, aux graines et aux racines. Chez le concombre, les symptômes peuvent apparaître dans un délai aussi court que 48 heures suivant l’infection, ce qui rend difficile le contrôle de la maladie (Agrios, 2005).
1.1.7. Pythium ultimum Trow
Les protistes fongiformes du genre Pythium de la classe des Oomycètes causent principalement la fonte des semis et la pourriture des graines et des racines. Cet agent phytopathogène cause également des lésions sur les tiges, la pourriture des fruits et légumes et des brûlures sur les pelouses. Cet oomycète s’attaque aux tissus végétaux en contact avec le sol, avant ou après l’émergence des plantules. Les Pythium se retrouvent dans les sols humides, et particulièrement dans les serres. Les ravages causés par la fonte des semis sont importants, car ils peuvent détruire l’ensemble des semailles. Chez les plants matures, le Pythium peut provoquer la formation de lésions sur les racines et les tiges, ainsi que sur les tubercules. La fonte des semis se caractérise par une diminution du taux de germination et des plantules molles et brunies à la levée qui vont finalement s’affaisser et se décomposer sur le substrat de culture. Les températures entre 10 et 18˚C induisent la production de zoospores et au-dessus de 18˚C la formation d’oospores (Agrios, 2005). Les
Pythium produisent des oospores qui survivent longtemps dans les systèmes d’irrigation et
aux conditions de sécheresse. La prolifération de P. ultimum sur les fruits et tissus végétaux est très rapide (Iriis phytoprotection, 2019a; Richard et Boivin, 1994).
1.2.
Les produits phytosanitaires
1.2.1. Utilisation des pesticides
Les pesticides, regroupant les fongicides, les insecticides et les herbicides, ont, de par leur fonction, des propriétés généralement toxiques envers les organismes vivants, ce qui implique un risque lors de leur utilisation (SAgE pesticides, 2019b). Au cours des dernières années, le public, les gouvernements et la communauté scientifique ont grandement été
sensibilisés aux conséquences néfastes de l’utilisation des pesticides dans le secteur agroalimentaire. Dans un souci de protection de la santé publique et de l’environnement, l’utilisation des produits phytosanitaires est réglementée par la loi sur les produits antiparasitaires (Gouvernement du Canada, 2009; Loi sur les produits antiparasitaires, 2002).
1.2.2. Présence de pesticides dans les aliments
Malgré la réglementation, des résidus de pesticides se retrouvent tout de même dans les aliments consommés quotidiennement par la population. En effet, des résidus de pesticides sont retrouvés sur 45% des fruits et légumes importés et sur 41% des fruits et légumes produits au Québec (Richard, 2012). La présence de pesticides au-delà des normes établies par l’Agence de réglementation de la lutte antiparasitaire (ARLA) est toutefois plutôt rare; des concentrations relativement faibles ont été observées avec certains fongicides comme le chlorothalonil (228 ng/g), le diclorane (156 ng/g) et le captane (129 ng/g) (Phaneuf et al., 2012), la limite maximale de résidus de chlorothalonil étant à 5000 ng/g (ARLA, 2018). Le chlorothalonil est le résidu de fongicide le plus fréquemment retrouvé sur les fruits et légumes (Phaneuf et al., 2012). Il est notamment utilisé pour la production en serre de tomate. Ce produit phytosanitaire est recommandé pour lutter contre différentes maladies (Étiquette du BRAVO 500, 2016). Le captane est utilisé en serre pour le traitement de substrats contre la fonte des semis (Phytophthora spp., Pythium spp., R. solani) et la pourriture des racines et du collet (R. solani, S. sclerotiorum, Fusarium spp.) (Étiquette du CAPTAN 80 WDG, 2012).
1.2.3. Exposition des travailleurs agricoles
Lorsque les normes d’application et de protection sont respectées selon les recommandations de l’étiquette du produit, les risques pour la santé des travailleurs sont grandement réduits, mais des accidents sont toujours possibles. L’exposition à long terme aux produits phytosanitaires, même à petite dose, peut entraîner des conséquences sur la santé, notamment le développement d’allergies (CSST, 2017; Santé Canada, 2007). En serre, malgré toutes les précautions d’usage, les travailleurs sont parfois exposés aux pesticides. Cette exposition est le plus souvent détectable par la présence de pesticides dans l’urine et sur la peau. Ces doses sont généralement faibles et l’exposition est limitée; cependant, il est suggéré dans le cas des insecticides organophosphorés d’imposer un délai de 24 heures (à la suite de l’application) avant l’entrée en serre. Néanmoins, des inquiétudes
persistent quant aux conséquences de l’exposition à long terme sur la santé des travailleurs agricoles (IRSST, 2002).
1.2.4.
Présence de pesticides dans l’environnement
Les pesticides peuvent se retrouver dans l’environnement, ce qui nuit à la santé des écosystèmes. La pollution du milieu peut survenir par contamination ponctuelle ou diffuse. La contamination ponctuelle survient lors d’un déversement de pesticides directement dans l’environnement, soit par débordement d’un contenant de pesticides ou par une mauvaise élimination des contenants de pesticides. La contamination diffuse est causée par la diffusion de pesticides des sols agricoles vers les sources d’eau souterraine ou de surface. Les pesticides peuvent également être dispersés par le vent ou être volatilisés dans l’atmosphère (SAgE pesticides, 2016)
1.2.5. Phénomène de résistance aux fongicides
Le phénomène de résistance aux fongicides réfère à l’acquisition héritable d’une réduction de la sensibilité à un ou plusieurs fongicides par un champignon ou un protiste fongiforme. Ce phénomène est favorisé par les mécanismes de sélection naturelle qui favorisent la survie des microorganismes non sensibles à un ou des fongicide(s). Au champ ou en serre, cette résistance s’observe par une perte d’efficacité des fongicides à contrôler les maladies. Les risques de développement de résistance pour un fongicide donné varient en fonction de sa nature. Pour les fongicides systémiques, la résistance survient parfois dans les deux ans suivant la commercialisation d’un nouveau produit (Brent et Hollomon, 2007; Fisher et al., 2018). Des inquiétudes quant au phénomène de résistance avaient déjà été rapportées à la fin des années soixante et prévoyaient même une diminution de l’efficacité des fongicides dans le futur (Georgopoulos, 1969). Actuellement, la recherche se concentre sur le développement de nouveaux produits fongicides et biologiques efficaces et à faible risque de développement d’une résistance. Les agents de lutte biologique sont de plus en plus considérés comme des éléments clés dans les stratégies pour contrer le développement de la résistance aux fongicides (Brent et Hollomon, 2007). Le développement de nouveaux produits phytosanitaires est de plus en plus encadré par les agences gouvernementales afin d’éviter l’introduction de produits favorisant la résistance (Loi sur les produits antiparasitaires, 2002).
1.3.
L’agriculture biologique
1.3.1.
L’agriculture biologique au Canada
Au Canada, la population consomme de plus en plus d’aliments biologiques. En effet, la consommation ménagère canadienne de produits biologiques était estimée à 4,7 milliards de dollars en 2015, soit 1,2 milliard de dollars de plus qu’en 2012. Les produits biologiques les plus consommés étant les fruits et les légumes, le développement de méthodes de lutte biologique est d’autant plus important (Willer et Lernoud, 2017).
1.3.2.
L’agriculture biologique au Québec
Cet intérêt pour les produits biologiques se fait également sentir au Québec, où la diversité des produits biologiques offerts est de plus en plus importante. En 2017, 1609 entreprises en productions agricoles certifiées biologiques ont été recensées soit le double du nombre recensé depuis 2008 (CARTV, 2018). En Amérique du Nord, le Québec se démarque pour l’importance de sa production en serre: 64 hectares de tomates et 24 de concombres. Le milieu contrôlé des serres est un atout de taille pour la production biologique, car le contrôle des paramètres abiotiques de croissance favorise l’utilisation d’agents de lutte biologique ce qui permet de diminuer l’utilisation de pesticides de synthèse (Carrier, 2013). En serre, il est possible d’utiliser plusieurs agents de lutte biologique, tant des insectes que des champignons ou des bactéries bénéfiques (MAPAQ, 2018).
1.4.
La lutte contre les maladies racinaires en serre
1.4.1. Lutte chimique
En cultures serricoles, l’utilisation de pesticides de synthèse est fréquente pour lutter contre les insectes ravageurs, les protistes fongiformes et les champignons phytopathogènes. Les fongicides pour lutter contre les maladies racinaires du concombre et de la tomate sont peu nombreux. Pour le traitement contre Pythium, l’emploi de Métalaxyl-M (48%) ou de Propamocarbe (72,2%) est recommandé (Réseau d’avertissement phytosanitaire [RAP], 2013). Toutefois, le risque de résistance est élevé pour le Métalaxyl-M de la famille des Phénylamides, ce qui implique une gestion rigoureuse de son utilisation (SAgE pesticides, 2019b). Pour le Propamocarbe de la famille des carbamates, le risque de résistance est moins élevé, mais son emploi nécessite tout de même des précautions pour prévenir le développement de la résistance. En ce qui concerne la fonte des semis (Pythium spp., Phytophthora spp., R. solani) et la pourriture racinaire (R. solani, S. sclerotiorum,
phytosanitaires recommandés est le Captane (80%). Les risques de résistance sont faibles pour ce fongicide de la famille des phtalimides (RAP, 2013).
1.4.2. Lutte biologique
La lutte biologique consiste en l’utilisation d’organismes vivants nuisibles ou antagonistes (appelés agents de lutte biologique) aux organismes pathogènes ou ravageurs affectant les cultures (Agrios 2005; Pal et McSpadden Gardener, 2006). Les agents de lutte biologique sont habituellement des bactéries, des mycètes ou des virus non pathogènes à la plante (O’Brien, 2017). L’utilisation d’agents de lutte biologique n’est pas réservée qu’aux producteurs biologiques. En productions dites conventionnelles, on aurait intérêt à utiliser des agents de lutte biologique dans un souci de réduction de l’utilisation des pesticides chimiques et de préservation de l’environnement (Pal et McSpadden Gardener, 2006), mais également pour des raisons économiques. En effet, le rapport coûts et bénéfices semblerait en faveur de la lutte biologique, cependant les pesticides chimiques sont encore largement utilisés pour leur facilité et rapidité d’utilisation ainsi que pour leur efficacité (Bale et al., 2007). Plusieurs produits phytosanitaires sont homologués au Canada, par l’ARLA, en tant qu’agents de lutte biologique. De plus en plus d’études montrant l’efficacité de certains agents de lutte contre les maladies racinaires font surface, ces organismes doivent toutefois passer par le processus d’homologation avant d’être commercialisés et utilisés par les producteurs, ce qui retarde leur mise en marché (Weill et Duval, 2009).
1.4.3. Microorganismes utilisés en lutte biologique
Plusieurs microorganismes sont étudiés actuellement afin de permettre le développement de divers agents de lutte biologique. Il est admis que les microorganismes prometteurs (agents de lutte biologique potentiels) devraient être davantage étudiés afin de mieux comprendre leurs mécanismes d’action et de permettre la commercialisation de nouveaux produits (Ab Rahman et al., 2018; Aboutorabi, 2018; Beneduzi et al., 2012; Hong et Park, 2016). Les agents de lutte biologique contre les microorganismes phytopathogènes exercent leurs effets antagonistes par parasitisme, prédation directe, production d’antibiotiques ou d’enzymes lytiques, compétition ou induction de mécanismes de résistance chez la plante (Ab Rahman et al., 2018; Benhamou, 2009; Pal et McSpadden Gardener, 2006). Les microorganismes les plus étudiés actuellement sont les Bacillus (B.
subtilis, B. amyloliquefaciens, B. cereus et B. licheniformis), les Pseudomonas (P. fluorescens), les Streptomyces chez les bactéries et les Gliocladium (G. catenulatum) et les
Trichoderma (T. virens) chez les champignons (Hong et Park, 2016 ; O’Brien, 2017; Pal et
McSpadden Gardener, 2006). Au Canada, divers microorganismes sont homologués comme agents de lutte biologique pour lutter contre les maladies racinaires (Tableau 1).
Tableau 1. Biofongicides homologués au Canada contre les maladies racinaires
Tableau adapté de Weill et Duval (2009). Ingrédient actif Nom
commercial Maladies racinaires
Streptomyces griseoviridis
Souche K61
Mycostop biofongicide
Fonte des semis, pourriture des racines et du collet et fusarioses vasculaires causées par Fusarium dans les concombres, tomates et poivrons de serre
Fonte des semis, pourriture des racines et du collet causée par Pythium dans les concombres de serre
Pourriture des racines et de la tige et flétrissures causées par Phytophthora dans les tomates et poivrons de serre
Gliocladium catenulatum
Souche J1446
Prestop Fonte des semis causée par Pythium et
Rhizoctonia solani dans les concombres, les tomates, les choux-fleurs, les brocolis, les laitues et les fines herbes
Pourritures du collet et des racines causées par Pythium dans les concombres, les tomates, les choux-fleurs, les brocolis, les laitues et les fines herbes
Flétrissures des racines et des tiges causées par Fusarium oxysporum dans les concombres et le basilic
Trichoderma harzianum
Souche Rifai KRL-AG2
Rootshield Fonte des semis et maladies des racines causées par Pythium, Rhizoctonia et
Fusarium
Bacillus subtilis
Souche MBI600
Subtilex Fonte des semis et maladies racinaires causées par Pythium
1.5.
Le genre Bacillus
Le genre Bacillus regroupe des bactéries Gram positif versatiles, caractérisées par leur forme en bâtonnet. Les Bacillus ont en commun la capacité de former des endospores dormantes par métabolisme aérobique lorsque les conditions sont défavorables à la croissance (Zeigler et Perkins, 2008). Les endospores de ces bactéries sont hautement résistantes à la chaleur, à la sécheresse et à la dégradation chimique (Gordon et al., 1973). La température optimale de croissance chez les Bacillus varie fortement d’une espèce à l’autre, et ce, plus particulièrement chez les espèces isolées d’environnements extrêmes. Bien que les Bacillus soient reconnus pour être des bactéries à croissance aérobie stricte, certaines espèces peuvent croître en milieu anaérobie (Schleifer, 2009). Chez le genre
Bacillus, on retrouve des bactéries fortement pathogènes aux animaux, comme Bacillus anthracis, l’anthrax. Plusieurs bactéries du genre Bacillus sont utilisées dans l’industrie
agroalimentaire et cosmétique pour la production de différents composés par fermentation (diacétyle [Wang et al., 2019], acide hyaluronique [Widner et al., 2005], riboflavine [Revuelta et al., 2017]) et pour leurs propriétés antifongiques attribuables à leur production de lipopeptides (Schleifer, 2009). Dans le domaine agronomique, le genre Bacillus a de nombreuses applications. Parmi ces applications, on retrouve notamment la dégradation de polluants présents dans le sol tels les pesticides, la stimulation de la croissance de plantes, la production de sidérophores et de composés antifongiques dans le sol (Pérez-García et al., 2011). Les Bacillus comme B. subtilis et B. pumilus sont retrouvés dans les sols, notamment dans les sols agricoles (Garbeva et al., 2003).
1.5.1. Bacillus subtilis (Ehrenberg) Cohn
Bacillus subtilis est une bactérie thermophile, dont la température optimale de
croissance est de 42˚C (température de croissance entre 10 et 55˚C). Cette bactérie forme des spores jusqu’à 44˚C. Son temps de génération est de 30 minutes dans un milieu riche (Gordon et al., 1973; Schaechter, 2009). Elle peut se développer en anaérobie en utilisant le nitrate comme accepteur d’électron (Schleifer, 2009). Bacillus subtilis s’adapte à de nombreux environnements terrestres et aquatiques et produit des endospores très résistantes en conditions de stress. Cette bactérie se retrouve en abondance dans la rhizosphère de nombreuses plantes (Earl et al., 2008). Il est reconnu dans la littérature que
B. subtilis forme des biofilms, ce qui réduirait la susceptibilité des plantes à l’infection par
des organismes phytopathogènes (Otto, 2006; Stein, 2005). Chez un grand nombre de souches de B. subtilis échantillonnées, on rapporte la présence de gènes codant pour la
synthèse d’antibiotiques, une vingtaine d’antibiotiques différents rapportés chez cette bactérie. Le génome de B. subtilis comporte en moyenne 4-5% de gènes codant pour la synthèse d’antibiotiques (Ongena et Jacques, 2008).
1.5.2. Bacillus pumilus Meyer et Gottheil
Bacillus pumilus croît entre 5 et 50˚C. Sa croissance est maximale entre 40 et 50˚C
(Gordon et al., 1973). Certaines souches de B. pumilus appliquées sur des plantes diminueraient le développement de certaines maladies. Certaines souches de B. pumilus sont endophytes et stimulent la croissance des plantes. Il a également été suggéré que cette bactérie puisse s’avérer prometteuse en tant qu’agent de lutte biologique (Ren et al., 2013).
B. pumilus produit une large gamme de métabolites antifongiques (Munimbazi et Bullerman,
1998).
1.5.3. Effet sur les polluants
Plusieurs bactéries du genre Bacillus auraient la capacité de dégrader des polluants dans l‘environnement. B. subtilis aurait la capacité de dégrader certains pesticides comme le carbendazime (Salunkhe et al., 2014; Zhang et al., 2014) et le chlorpyrifos (El-Helow et al., 2013). L’acibenzolar-S-méthyl (fongicide), le thiaméthoxam (insecticide) et l’hydroxyde de propamocarbe (fongicide protectant) pourraient également être dégradés par B. pumilus dans des sols (Myresiotis et al., 2012).
1.5.4. Effet stimulant sur la croissance et les défenses naturelles des plantes
Les Bacillus PGPR (plant growth promoting rhizobacteria), c’est-à-dire les rhizobactéries favorisant la croissance des plantes, ont été largement étudiés dans les dernières années (Beneduzi et al., 2012; Benhamou, 2009; Kloepper et al., 2004; Shafi et al., 2017). L’effet PGPR des Bacillus résulte de leur action sur la synthèse de phytohormones chez la plante, une production accrue d’acides gibbérelliques (GAs) et d’acide indole-acétique (AIA) (Chowdappa et al., 2013; Shafi et al., 2017). Il a été documenté que, chez la tomate, B. subtilis permet une augmentation de la production de GAs et d’AIA, une augmentation de la croissance des plants et une augmentation de la synthèse de molécules de défense, soit de superoxyde dismutase, de peroxyde et de polyphénol oxydase (Chowdappa et al., 2013). B. pumilus aurait un effet significatif sur l’induction des réactions de défense systémique chez le pois et le concombre (Jetiyanon et Kloepper, 2002).
1.5.5. Agents de lutte biologique
Les bactéries du genre Bacillus figurent parmi les microorganismes les plus étudiés pour une utilisation en lutte biologique. En effet, plusieurs études montrent l’efficacité des
Bacillus en tant qu’agents de lutte biologique, notamment B. pumilus et B. subtilis contre la
fonte de semis causée par R. solani sur concombre (Huang et al., 2012) et tomate (Asaka et Shoda, 1996), B. pumilus contre le chancre bactérien et à fusiococcum du peuplier (Cytospora chrysosperma, Phomopsis macrospora et Fusicoccum aesculi) (Ren et al., 2013) et B. subtilis contre la pyriculariose du riz causée par Magnaporthe oryzae (He et al., 2019b) et plusieurs maladies du blé (Liu et al., 2009). Bacillus subtilis permettrait également le contrôle biologique de S. sclerotiorum sur le soja (Zhang et Xue, 2010) et d’inhiber le développement de F. oxysporum f.sp. radicis-lycopersici (Baysal et al., 2008) et R. solani chez la tomate (Solanki et al., 2015).
Plusieurs produits à base de différentes souches de Bacillus sont actuellement homologués au Canada, comme le Rhapsody® (B. subtilis souche GB03), le Double Nickel® (B. amyloliquefaciens souche D747), le Stargus® (B. amyloliquefaciens souche F727), le Serenade® MAX (B. subtilis souche QST 713) et le LifegardTM WG (Bacillus
mycoides isolat J) (SAgE pesticides, 2019a) pour n’en nommer que quelques-uns.
Les Bacillus peuvent avoir un effet inhibiteur sur les agents pathogènes par la production de lipopeptides antibiotiques. Parmi les lipopeptides produits par les Bacillus, on retrouve les surfactines, les iturines, les fengycines, les bacillomycines et les subtilines. Les iturines, par leur structure à queue hydrophobe, provoquent des fuites de contenu cellulaire chez l’agent pathogène en s’insérant dans la membrane, ce qui crée des pores. Les iturines peuvent également se lier à des lipopeptides du champignon pathogène. Les fengycines et les subtilines auraient un effet inhibiteur sur la croissance mycélienne des champignons. Les bacillomycines auraient à la fois un effet sur les parois et sur la croissance mycélienne. Les surfactines sont impliquées dans la formation de biofilms et agissent à titre de surfactants (Ongena et Jacques, 2008; Shafi et al., 2017). Il a été rapporté dans la littérature que B. subtilis produit plusieurs de ces composés. En effet, B. subtilis aurait la capacité de produire des subtilines, des subtilosines, des bacillomycines, des iturines, des fengycines et finalement des surfactines (Cao et al., 2012; Ongena et Jacques, 2008). La rhizobactérie
B. pumilus aurait également la capacité de produire plusieurs lipopeptides, notamment des
1.6.
Hypothèses et objectifs de recherche
1.6.1. Hypothèses de recherche
Les hypothèses vérifiées dans le cadre de ce projet de recherche étaient :
- Bacillus pumilus souche PTB180 et B. subtilis souche PTB185 limitent la croissance
mycélienne de plusieurs agents phytopathogènes telluriques et réduisent les symptômes causés par R. solani chez la tomate et le concombre de serre.
- Bacillus pumilus souche PTB180 et B. subtilis souche PTB185 stimulent la
croissance et la production de fruits chez les plants de tomate cultivés en serre.
1.6.2. Objectifs de recherche
Les objectifs spécifiques de cette étude étaient les suivants :
1) Évaluer in vitro l’effet antagoniste des souches PTB180 et PTB185 envers R. solani,
P. ultimum, S. sclerotiorum, F. oxysporum, P. capsici et F. oxysporum f.sp. radicis-lycopersici;
2) Évaluer l’effet de l’addition de PTB180 et de PTB185 dans un substrat inoculé avec
R. solani sur le développement de la pourriture du collet (R. solani) chez des
plantules de concombre et de tomate cultivées en serre;
3) Évaluer l’effet de PTB180 et de PTB185 sur la levée et la mortalité post-levée des graines de tomate semées dans un substrat inoculé avec R. solani;
4) Évaluer l’effet de PTB180 et de PTB185 sur la croissance et la productivité de plants de tomate cultivés en serre.
Chapitre 2 - Matériel et Méthodes
2.1.
Microorganismes
2.1.1. Bacillus pumilus et Bacillus subtilis
Bacillus pumilus PTB180 et Bacillus subtilis PTB185 ont été fournies par la compagnie
Premier Tech (Rivière-du-Loup, Québec, Canada) de l’automne 2017 à l’hiver 2019. Les spores de ces souches ont été conservées dans leur milieu de culture de fermentation à 4˚C pour toute la durée du projet. Les essais ont été réalisés avec des bactéries issues de cuvées de fermentations différentes. Les densités de spores bactériennes des cultures fournies étaient de l’ordre de 1×109 spores/ml de suspension. La souche B. pumilus
PTB180 a été isolée au Mexique et la souche B. subtilis PTB185 a été isolée au Québec.
2.1.2. Agents pathogènes
Différents agents pathogènes, dont des champignons et des oomycètes, ont été utilisés dans le cadre des travaux (Tableau 2). Les agents pathogènes, isolés de différentes plantes, ont tous pour origine les laboratoires de Premier Tech.
Tableau 2. Origine et date de réception des agents pathogènes à l’étude
Agent pathogène Isolé de # de collection chez
Premier Tech Date de réception
Fusarium oxysporum Basilic 3.32 7 octobre 2016
F. oxysporum f.sp. radicis-lycopersici Tomate 3.21 20 décembre 2016
Phytophthora capsici Tomate 4.10 7 octobre 2016
Pythium ultimum n.d. 1.31 7 octobre 2016
Rhizoctonia solani Tomate 2.29 7 octobre 2016
Sclerotinia sclerotiorum n.d. 8.45 7 octobre 2016
n.d.: information non disponible
2.2.
Essais au laboratoire
2.2.1. Effet antagoniste de B. pumilus PTB180 et de B. subtilis PTB185,
utilisés seuls et en mélange (1:1), sur la croissance radiale des
différents agents pathogènes telluriques
Au cours de ces essais, la croissance des agents pathogènes a été évaluée sur milieu gélosé selon la méthode double-couche, qui consiste en deux couches de gélose coulées l’une sur l’autre. L’agent pathogène est ensuite cultivé sur la couche supérieure (Figure 1).
Figure 1. Schéma illustrant la méthode double-couche.
2.2.1.1. Préparation du milieu gélosé double-couche
Le milieu TSA (tryptic soy agar; Difco BD, San Jose, CA, États-Unis), un milieu à base de protéines de soya et d’agar-agar, a été utilisé à 10% de sa concentration (TSA 0,1×). Lorsque le milieu était dilué, l’agar-agar (agar; Fisher Scientific, Waltham, MA, États-Unis) a été ajouté afin d’ajuster sa concentration à 1,5% (15 g/L).
En premier lieu, le TSA 0,1× de la première couche a été préparé comme suit. Après refroidissement à 50˚C dans un bain-marie, le milieu a été inoculé avec PTB180, PTB185 ou le mélange (1:1) des deux bactéries (concentration finale de 1×106 spores/ml) puis versé
à raison de 20 ml par plat de Pétri. Le traitement témoin n’a pas été inoculé avec les bactéries. Les plats de Pétri ont été placés à l’obscurité à la température de la pièce (22˚C) durant 48 heures, puis, une deuxième couche stérile (10 ml) de TSA 0,1× refroidie à 50˚C a été coulée sur la première. Les plats de Pétri ont été placés à 4˚C durant 24 heures et ensuite à la température pièce (22˚C) afin de les tempérer.
2.2.1.2. Préparation des inocula (agents pathogènes)
Les agents pathogènes ont été cultivés sur milieu TSA, à 24˚C (obscurité) pour une période de trois à cinq jours. Une rondelle (8 mm de diamètre) de mycélium de l’un ou l’autre des agents pathogènes a été découpée avec un emporte-pièce métallique dans la portion la plus jeune de la culture, c’est-à-dire en périphérie.
2.2.1.3. Inoculation et croissance des agents pathogènes sur la
double-couche
Une fois que les boîtes de Pétri ont atteint la température pièce, une rondelle de mycélium de l’un ou l’autre des agents pathogènes a été placée au centre. Les boîtes de
Pétri ont ensuite été scellées avec des bandes de paraffine et incubées à l’obscurité (22˚C), jusqu’à ce que les agents pathogènes soumis au traitement témoin aient atteint environ 1,0 cm du bord du Pétri. Pour chacun des agents pathogènes, la croissance radiale du thalle mycélien, basée sur la moyenne de deux diamètres perpendiculaires, a été estimée.
2.2.1.4. Dispositif expérimental et analyses statistiques
Cette expérience comportait quatre traitements : témoin, PTB180, PTB185 et mélange (1:1) des deux bactéries. Les traitements ont été disposés selon un plan en blocs complets aléatoires à six répétitions; chaque plat de Pétri constituant une unité expérimentale. Des expériences indépendantes ont été réalisées pour chacun des agents phytopathogènes. L’analyse de la variance (ANOVA), a été réalisée selon le modèle linéaire généralisé (procédure GLM), à l’aide du logiciel SAS version 9.4. En présence d’une différence significative (p<0,05), les traitements ont été comparés à l'aide d'un test LSD («
least significant difference ») protégé.
2.3.
Essais en serre
2.3.1. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et
en mélange (1:1), sur les plantules de concombre et de tomate
infectées par R. solani
2.3.1.1. Serres
Ces travaux ont été réalisés dans une serre de 25 m2 du Pavillon Abitibi-Price
(Université Laval) sous les conditions suivantes : 25˚C, 70% d’humidité relative, et photopériode de 16 heures.
2.3.1.2.
Traitements à l’étude
Les traitements à l’étude étaient les suivants :
- Témoin sain (substrat ne contenant ni R. solani ni Bacillus) - Témoin R. solani (substrat inoculé avec R. solani)
- Prestop (substrat inoculé avec R. solani et le Prestop® Gliocladium catenulatum Souche J1446)
- PTB180 (substrat inoculé avec R. solani et PTB180) - PTB185 (substrat inoculé avec R. solani et PTB185)
- Mélange (1:1) (substrat inoculé avec R. solani et un mélange [1:1] de PTB180 et de PTB185)
2.3.1.3. Inoculum de R. solani
Un volume de 250 ml de grains d’orge non mondés (Station agronomique de Saint-Augustin, Université Laval) a trempé dans 500 ml d’eau distillée pendant 24 heures à température ambiante (22˚C) dans une bouteille Nalgène d’un litre. Les grains ont ensuite été rincés à l’eau distillée puis égouttés et remis dans la bouteille (sans eau). La bouteille contenant l’orge humidifié a ensuite été autoclavée au cycle liquide 30 minutes. Lorsque les grains stériles ont atteint la température de la pièce, ils ont été inoculés avec 9 rondelles (1,0 cm de diamètre) de PDA (potato dextrose agar; Difco BD) couvertes de mycélium de
R. solani en croissance active. La bouteille a ensuite été entreposée horizontalement à
température pièce à l’obscurité jusqu’à ce que le mycélium ait complètement colonisé les grains d’orge (environ deux semaines). La bouteille a été agitée à des intervalles de 24 à 48 heures.
2.3.1.4. Substrats de culture
Quatre substrats à base de Promix BX sans mycorhizes ont été fournis par Premier Tech. Ces substrats (préparés en format de 3 pieds cubes en usine) étaient traités comme suit: avec PTB180, avec PTB185, avec un mélange (1:1) des deux bactéries, et un substrat non inoculé. Les quantités de PTB180 et PTB185 dans ces substrats sont présentées à l’annexe B. Le substrat Prestop (G. catenulatum) a été préparé en ajoutant le Prestop (Danstar Ferment AG, Zoug, Suisse) selon les recommandations du manufacturier au Promix BX sans mycorhizes (non inoculé).
2.3.1.5. Semis
Les graines de concombre (cultivar Marketmore 70; NORSECO, Laval, QC, Canada) ou de tomate (cultivar Hybride Celebrity Red, NORSECO) ont été semées dans des caissettes de germination de 2×13 cellules contenant l’un ou l’autre des substrats (section 2.3.1.4). Les caissettes de germination ont été mises en serre dans des bacs avec dômes jusqu’à la levée des plantules, puis les dômes ont été retirés. Des plantules de 9 jours pour le concombre et de 14 jours pour la tomate ont été utilisées pour chacune des expériences. L’arrosage a été réalisé au besoin avec de l’eau courante afin de conserver le substrat de croissance humide.
2.3.1.6. Rempotage des plantules et début de la phase expérimentale
Les plantules de concombre et de tomate ont été transférées dans des pots de 1 litre contenant l’un ou l’autre des substrats (section 2.3.1.4). L’inoculum de R. solani (grains
d’orge couverts de mycélium de R. solani) a été disposé en deux parties égales sous la carotte de racine de la plantule et sur le terreau de rempotage près du collet (Figure 2).
Figure 2. Illustration de la méthode d’inoculation des plantules avec Rhizoctonia solani; application de grains d’orge couverts de mycélium de R. solani au niveau des racines et du collet.
Pour le concombre, 10 grains d’orge colonisés par R. solani ont été ajoutés lors du rempotage dans des pots ronds (1000 ml; 15 cm de diamètre). Pour la tomate, 45 grains d’orge ont été ajoutés au moment du rempotage dans des pots carrés (1000 ml; 10 cm sur 10 cm).
Les plantules ont été incubées sous des dômes pendant quatre à cinq jours pour favoriser le développement de la maladie. Le substrat a été maintenu humide tout au long de l’expérience. Les pots ont été placés sur des soucoupes en plastique contenant en permanence un fond d’eau. Une fertilisation avec un engrais liquide 20-20-20 (Plant-Prod 20-20-20 Classic; Plant-Prod, Brampton, ON, Canada) a été réalisée une semaine après le rempotage des plantules à raison de 150 ml par pot.
2.3.1.7. Paramètres mesurés
Deux semaines (concombre) ou trois semaines (tomate) après le rempotage des plantules, les paramètres suivants ont été mesurés : la hauteur, la masse sèche totale et la sévérité des symptômes de la pourriture du collet. La hauteur (du collet jusqu’au méristème apical) des plantules a d’abord été évaluée. Les plantules ont par la suite été déterrées et retirées des pots; les racines ont été soigneusement rincées à l’eau tout en évitant de les briser. La sévérité des symptômes a été évaluée selon une échelle visuelle allant de l’indice 0 (aucun symptôme) à 4 (mort du plant) (Figure 3). Les plantules ont ensuite été mises à sécher (7 jours à 60˚C) et la masse sèche totale de chacune a été déterminée.
Figure 3. Échelle visuelle de sévérité des symptômes de la pourriture du collet allant d’un indice de 0 à 4 pour le concombre et la tomate.
2.3.1.8. Dispositif expérimental et analyses statistiques
Cette expérience comportait six traitements : témoin sain, témoin R. solani, Prestop, PTB180, PTB185 et mélange (1:1) des deux bactéries. Chaque essai a été réalisé selon un plan expérimental en 10 blocs aléatoires complets (Figure 4). L’unité expérimentale consistait en un pot de 1000 ml contenant une plantule. L'ANOVA a été réalisée selon une procédure GLM, à l’aide du logiciel SAS version 9.4. En présence d’une différence significative (p<0,05), les traitements ont été comparés à l'aide d'un test LSD protégé. Les expériences pour la tomate et le concombre ont été réalisées indépendamment. Chaque expérience a été réalisée à quatre reprises pour la tomate et à deux reprises pour le concombre.
Figure 4. Dispositif expérimental en serre. Les plants de tomate ont été placés en blocs comportant les six traitements.
2.3.2. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et
en mélange (1:1), sur le taux de levée des graines de tomate semées
dans un substrat inoculé avec R. solani, sur la mortalité post-levée, la
hauteur et la masse sèche totale des plantules de tomate émergées
2.3.2.1. Serres
Cette expérience a été réalisée dans une serre de 25 m2 du Pavillon Abitibi-Price
sous les conditions suivantes : 25˚C, 70% d’humidité relative, photopériode de 16 heures.
2.3.2.2. Traitements
Les traitements à l’étude étaient les suivants :
- Témoin sain (substrat ne contenant ni R. solani ni Bacillus) - Témoin R. solani (substrat inoculé avec R. solani)
- Témoin commercial Prestop (substrat inoculé avec R. solani et le Prestop®)
- PTB180 (substrat inoculé avec R. solani et PTB180 + trempage des graines dans une suspension de PTB180)
- PTB185 (substrat inoculé avec R. solani et PTB185 + trempage des graines dans une suspension de PTB185)
- Mélange (1:1) (substrat inoculé avec R. solani et un mélange [1:1] de PTB180 et de PTB185 + trempage des graines dans une suspension de PTB180 et de PTB185)
2.3.2.3.
Préparation de l’inoculum de R. solani
Cinquante rondelles (10 mm de diamètre) de PDA couvertes de mycélium en croissance active ont été déposées dans dix erlenmeyers de 250 ml (cinq rondelles par erlenmeyer) contenant 150 ml de milieu PDB (potato dextrose broth; Difco BD). Ces erlenmeyers ont ensuite été incubés à 24˚C (obscurité, sous agitation à 150 rotations par minute). Après sept jours d’incubation, le mycélium a été recueilli par filtration avec un coton à fromage et rincé à l’eau distillée. Le mycélium obtenu de chacun des dix erlenmeyers a été mis en suspension dans 1500 ml d’eau distillée stérile, puis broyé à l’aide d’un mélangeur électrique stérile. La densité a été ajustée à 2,5×105 propagules/ml, à l’aide d’un
hématimètre.
2.3.2.4. Préparation des graines
Les graines de tomate (Celebrity Hybrid Red) ont été trempées dans l’éthanol 70% (30 secondes) et ensuite dans l’eau de Javel 2% (10 minutes). Les graines ont par la suite été rincées à l’eau distillée stérile à trois reprises. Les graines soumises aux traitements
PTB180, PTB185 et mélange (1:1) ont trempé 60 minutes dans 2 ml d’une suspension (1× 105 bactéries/ml) de PTB180, PTB185 et du mélange (1:1) des deux souches,
respectivement.
2.3.2.5. Préparation du substrat de croissance
Chaque plateau de germination a été rempli avec trois litres, soit 462g, de l’un ou l’autre des substrats à l’étude (voir section 2.3.1.4.). Tous les plateaux sauf le plateau soumis au traitement « Témoin sain » ont ensuite été inoculés avec 70 ml d’une suspension de R. solani (2,5×105 propagules/ml). Les substrats contenus dans les plateaux ont été
mélangés uniformément et quinze graines de tomate ont été semées (trois rangs de cinq graines par plateau). Les plateaux ont été placés en serre, sous dômes les sept premiers jours, pour un total de 17 jours. Le substrat a été conservé humide tout au long de l’expérience afin de permettre le développement du mycélium de R. solani (Figure 5).
Figure 5. Mycélium de Rhizoctonia solani dans le substrat humidifié. Le mycélium devient apparent après environ 24 heures.
2.3.2.6. Paramètres mesurés
Dix-sept jours après le semis, les paramètres suivants ont été mesurés : le taux de levée, le taux de mortalité post-levée, la hauteur et la masse sèche totale des plantules. Les taux de levée et de mortalité post-levée ont d’abord été mesurés. La hauteur des plants a été évaluée sur les survivants (de la base de la plantule jusqu’au méristème apical; seulement pour les deux dernières répétitions d’expérience). Les plantules ont été déterrées et les racines ont été rincées soigneusement tout en évitant de les briser. Les plantules ont ensuite été mises à sécher à 60˚C et la masse a été déterminée après 7 jours de séchage.
2.3.2.7. Dispositif expérimental et analyses statistiques
Cette expérience a été répétée à trois reprises de façon indépendante et comportait six traitements : témoin sain, témoin R. solani, Prestop, PTB180, PTB185 et mélange (1:1)
des deux bactéries. L’expérience a été réalisée selon un plan aléatoire en quatre blocs complets. L’unité expérimentale consistait en un plateau de germination de 15 graines de tomate; chaque graine constituant une sous-unité expérimentale. L'ANOVA a été réalisée selon une procédure GLM à l’aide du logiciel SAS version 9.4. En présence d’une différence significative (p<0,05), les traitements ont été comparés à l'aide d'un test LSD protégé.
2.3.3. Effet de B. pumilus PTB180 et de B. subtilis PTB185, utilisés seuls et
en mélange (1:1), sur la croissance et le rendement en fruits de plants
de tomate
2.3.3.1. Serre
L’expérience a été réalisée dans un compartiment de serre du Pavillon Abitibi-Price sur une période de 115 jours (24˚C le jour, 18˚C la nuit; 60% d'humidité relative; photopériode de 16 heures).
2.3.3.2.
Traitements à l’étude
Les traitements à l’étude étaient les suivants :
- Témoin sain (substrat non inoculé avec PTB180 ou PTB185) - PTB180 (substrat inoculé avec PTB180)
- PTB185 (substrat inoculé avec PTB185)
- Mélange (1:1) (substrat inoculé avec un mélange [1:1] de PTB180 et de PTB185)
2.3.3.3. Semis
Des graines de tomate (Micro Tom; Seeds n’ Such, Graniteville, SC, États-Unis) ont été semées dans quatre plateaux de germination de 12 cellules de 600 ml chacune, pour chacun des traitements (4 plateaux par traitement). Les cellules ont été remplies avec l’un ou l’autre des substrats fournis par Premier Tech (section 2.3.1.4.). Une graine de tomate a été semée dans chacune des cellules des plateaux. Ces derniers ont été placés en serre, sous dôme jusqu’à germination (10 jours). Les plantules ont été arrosées au besoin jusqu’au rempotage. Une fertilisation hebdomadaire avec un engrais 20-20-20 a été réalisée à raison de 250 ml par plateau.
2.3.3.4. Rempotage des plantules
Les plantules (un mois suivant le semis dans les caissettes; Figure 6) ont été rempotées jusqu’aux cotylédons dans l’un ou l’autre des substrats fournis par Premier Tech contenus dans des pots ronds (6,5 pouces de diamètre). Après le rempotage, les plantules