Production et qualité du sperme de faux-bourdon durant
la saison de production des reines de l’abeille
domestique (Apis mellifera L.) au Québec
Mémoire
Julie Andrée Pelletier-Rousseau
Maîtrise en biologie végétale -
Maître ès sciences (M.Sc.)
Québec, Canada
iii
Résumé
La reproduction chez la reine de l’abeille domestique (Apis mellifera L.) se fait par copulation avec plusieurs faux-bourdons (polyandrique) lors d’un vol nuptial à l’extérieur de la colonie. Des problèmes de fertilité des reines abeilles sont rapportés et une défaillance de la production et la qualité du sperme des faux-bourdons est mise en cause. Ce projet vise à évaluer l’influence de la lignée génétique, de l’âge du faux-bourdon ainsi que du moment dans la saison sur la production et la qualité du sperme des faux-bourdons dans les colonies d’abeilles du Québec. Les résultats montrent que l’âge et le moment dans la saison influencent la maturité et la production de sperme. Une meilleure compréhension des facteurs influençant l’élevage des faux-bourdons au sein de la colonie d’abeille permettra d’optimiser la fécondation des reines en maximisant la qualité des mâles produits.
v
Abstract
Honeybee (Apis mellifera L.) reproduction is polyandrous: the queen obtains millions of sperm by mating with several drones outside the colony. Since queen fertility problems have been reported, it is important to investigate the variations that exist in drone semen production and quality. The main objective of this project was to assess the influence of breeding line, drone age and breeding timing in the season on semen production and quality. Results showed that drone age and breeding timing are the most influential factors. A better understanding of factors influencing drone rearing within a honeybee colony will ensure optimum honeybee queen mating by maximising the quality of males.
vii
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ...ix
Liste des figures ...xi
Remerciements ...xv
Avant-propos ... xvii
Introduction ... 1
Chapitre I : État des connaissances ... 3
1.1. L’abeille domestique... 5
1.1.2. Biologie ... 5
1.1.3. Castes et tâches dans la colonie ... 6
1.1.4. Reproduction... 7
1.1.4.1. Multiplication par essaimage ... 7
1.1.4.2. Reproduction sexuée ... 8
1.5. La spermathèque ... 9
1.6. Production de reines et contrôle de la reproduction ... 10
1.7. Problèmes de fécondité des reines ... 11
1.8. Les faux-bourdons ... 12
1.8.1. Organe reproducteur ... 13
1.8.2. Spermatogénèse et maturité sexuelle ... 14
1.9. Évaluation de la production et de la qualité du sperme ... 15
1.9.1 Volume de sperme ... 16
1.9.2. Nombre de spermatozoïdes ... 17
1.9.3. Viabilité des spermatozoïdes ... 19
1.9.4. Motilité des spermatozoïdes ... 20
1.10. Objectifs du projet ... 21 1.11. Hypothèses ... 22 Chapitre II ... 23 Résumé ... 26 Abstract ... 27 2.1. Introduction ... 28
viii
2.2. Materials and methods ... 30
2.2.1. Drone rearing and sampling... 30
2.2.3. Semen volume ... 31 2.2.4. Sperm count ... 31 2.2.5. Sperm viability ... 32 2.2.7. Statistical analysis ... 32 2.3 Results ... 33 2.3.1. Drone rearing ... 33 2.3.2. Manual eversion ... 33 2.3.3. Semen volume ... 34 2.3.4. Sperm count ... 34 2.3.5. Sperm viability ... 34 2.4. Discussion ... 35 2.4.1. Drone breeding ... 35 2.4.2. Manual eversion ... 35 2.4.3. Semen volume ... 36 2.5.4. Sperm count ... 37 2.5.5. Sperm viability ... 37 Acknowledgments ... 38
Chapitre III : Conclusion générale ... 45
ix
Liste des tableaux
Tableau 1 : Volume moyen de sperme prélevé par faux-bourdons (Apis mellifera L.), étendue et nombre de faux-bourdons évalués pour différentes études. ... 17 Tableau 2 : Nombre de spermatozoïdes (moyenne ± erreur standard) par faux-bourdon (Apis mellifera L.), nombre de faux-bourdons évalués et technique utilisée pour différentes études... 18 Table 3 : Number of drones marked at emergence and proportion of drones with semen after manual eversion at various ages. ... 39 Table 4 : Results of the single factor Anova with repeated measurements for proportion of drones with semen, volume of semen, sperm count per drone and sperm viability. ... 40
xi
Liste des figures
Figure 1 : Les 3 différentes castes de l’abeille : à gauche, la reine entourée des femelles ouvrières. À droite, le mâle de la colonie, le faux-bourdon. (crédit photo : Andrée Rousseau). ... 7 Figure 2 : Spermathèque de la reine (S) et les 2 glandes spermathècales qui l’accompagnent (tiré de den Boer et al., 2009). ... 10 Figure 3 : Anatomie de l’appareil reproducteur du faux-bourdon (tiré de l’encyclopédie universelle 2013). ... 13 Figure 4 : Éversion partielle (à gauche) et complète (à droite) de l’endophallus avec présence de sperme (coloration beige) au bout de l’organe génital (tiré de Woyke, 2008). ... 14 Figure 5 : Organes génitaux du faux-bourdon : les testicules (T), les vésicules séminales (AT), les glandes accessoires ou glandes à mucus (AG) et le conduit éjaculateur (ED) (tiré de den Boer et al., 2009). ... 15 Figure 6 : Prélèvement du sperme de faux-bourdon sous loupe binoculaire avec une seringue d’insémination Gilmont (crédit photo : Andrée Rousseau). ... 16 Figure 7 : Fluorescence des têtes de spermatozoïdes traités aux colorants SYBR-14 (qui colore en vert les gamètes vivants) et iodure de propidium (qui colore en rouge les gamètes morts). Observation faite à 400x. (crédit photo : Andrée Rousseau). ... 19 Figure 8 : Mean proportion of drones with semen at the tip of the endophallus after manual eversion for the 3 ages (in days) (± se). Different letters indicate significant difference (F2,450 =3.94; p = 0.0202)... 41
xiii
xv
Remerciements
Je tiens tout d’abord à remercier ma directrice de maîtrise Valérie Fournier qui m’a donné toute sa confiance pour réaliser ce projet. Merci également de m’avoir donné ma toute première expérience à la fois en recherche et en entomologie lorsque j’étais au baccalauréat. C’est au sein de son laboratoire que j’ai découvert que je voulais réaliser une maîtrise dans ce domaine et elle m’a donné tous les outils pour y arriver. Merci de toujours m’avoir soutenu dans tous mes projets de stages et de cours à l’étranger!
Je dois beaucoup à mon codirecteur, Pierre Giovenazzo, qui m’a fait découvrir la recherche apicole, m’a confié un projet de maîtrise novateur et stimulant et a cru en mon potentiel dès le départ. Sa façon de guider ses étudiants avec confiance, positivisme et support permet la réalisation de soi et l’apprentissage dans ce merveilleux monde qu’est l’apiculture. J’espère que cette vision m’accompagnera dans mes futurs projets.
Pour le support financier, je tiens à remercier le Conseil pour le développement de l’agriculture du Québec (CDAQ) via le Programme Canadien d’adaptation agricole (PCAA) d’Agriculture et Agroalimentaire Canada AAC). Merci également au Centre de recherche en sciences animales de Deschambault (CRSAD) pour le support matériel. Pour le support financier des stages de perfectionnement que j’ai effectué, je remercie le Centre-Sève ainsi qu’au Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG-Canpolin).
Un gros merci à la très belle équipe apicole du Centre de recherche en sciences animales de Deschambault. Émile Houle pour ses millions de conseils techniques, son immense savoir-faire et sa grande disponibilité. Merci à Michaël Benoît pour ses conseils, ses tapes dans le dos et sa force surhumaine. Merci à Georges Martin d’être la force tranquille qui guide toute l’équipe. Vous êtes des gens passionnés et c’est un réel plaisir de travailler avec vous.
Un merci spécial à Ségolène Maucourt qui m’a assistée autant sur le terrain qu’en laboratoire dans le cadre de ma maîtrise. Malgré le fait que son corps réagissait fortement aux piqûres d’abeilles, elle ne s’est jamais plainte et a gardé le sourire même avec la main enflée comme un pamplemousse! Merci d’avoir partagé les longues heures de comptes de spermatozoïdes et de travail entouré de milliers d’abeilles. Merci aussi à Oliver Samson-Robert qui m’a donné de son temps pour m’aider au laboratoire. Merci pour les fous rires et les discussions enflammées sur les voyages qui font passer les heures plus rapidement.
Merci à mes collègues et amis de l’Envirotron, Mélissa, Joseph, Martine, Paola et Salma pour le support, les conseils, les cafés et les pratiques toujours très sécuritaires dans le laboratoire.
xvi
Merci à l’équipe du Centre de microscopie du pavillon Marchand pour les nombreux conseils en terme de microscopie a fluorescence et pour m’avoir fait confiance dans l’utilisation du matériel en dehors des heures d’ouverture.
Pour l’aide dans les analyses statistiques, je dois remercier monsieur Gaétan Daigle pour sa disponibilité et son expertise. Merci de faire en sorte que je n’ai presque plus peur du logiciel SAS.
Finalement, les derniers, mais non les moindres : merci à ma famille et mes amis qui m’ont épaulée et encouragée durant ces 2 années. Je remercie mes parents pour leur ouverture d’esprit et leurs constants encouragements à poursuivre mes études. Merci à Michèle qui, en parfaite sœur jumelle, a fait une maîtrise en même temps que moi. Nous nous sommes encouragées et découragées à la fois et cela n’aurait pas été pareil sans mon clone! Merci à Anto qui, malgré la distance, m’a toujours soutenue et a réussi à bien gérer mes montagnes russes d’émotions durant ma maîtrise. Merci aussi de me faire croire que tu n’es pas tanné d’entendre parler d’abeilles et d’embarquer avec moi dans cette belle folie. Finalement, merci à mes amis qui se sont intéressés à mon projet et qui ont toujours été là pour me faire décrocher lorsque le besoin se faisait sentir.
xvii
Avant-propos
Le chapitre II de ce mémoire a été rédigé sous forme d’article scientifique en anglais soumis au périodique scientifique The Canadian Entomologist. L’article intitulé «Drone sperm quality (Apis mellifera) in relation to age, genetic line and time of breeding» décrit l’ensemble des travaux effectués dans le cadre de ce projet de maîtrise ainsi que les principaux résultats obtenus. L’auteure principale est la candidate à la maîtrise, Andrée Rousseau. Les coauteurs sont Valérie Fournier Ph.D. professeure au département de phytologie de l’Université Laval et Pierre Giovenazzo Ph.D. chercheur au Centre de recherche en sciences animales de Deschambault et chargé de cours au département de biologie de l’Université Laval. Ces derniers ont apporté corrections et suggestions au manuscrit présenté.
1
Introduction
L’importance de l’abeille domestique pour l’environnement et l’humanité est indéniable. En pollinisant efficacement les plantes, elle permet le maintien de la diversité et assure une qualité de mise à fruit optimale des cultures. L’abeille procure également à l’Humain des produits de la ruche comme le miel, le pollen, la propolis et la gelée royale, qui présentent des vertus nutritionnelles importantes.
L’apiculture mondiale est ébranlée depuis quelques décennies par plusieurs problèmes qui affectent la santé des colonies d’abeilles domestiques. Ces problèmes sont multiples et les principaux sont: l’émergence de nouveaux parasites et pathogènes, l’apparition de résistance des parasites aux moyens de lutte utilisés par les apiculteurs et l’application massive de certaines classes de produits phytosanitaires nocifs pour l’abeille. Ces différents facteurs de stress ont le potentiel d’affaiblir le système immunitaire de l’abeille la rendant plus vulnérable.
D’autres problèmes concernant la fécondité des reines abeilles, soit principalement la durée de la ponte au sein de la colonie, ont également été rapportés un peu partout dans le monde. De jeunes reines fécondes sont rejetées précocement par les colonies puisqu’elles épuisent rapidement leurs réserves de spermatozoïdes censées permettre la ponte pour quelques années. Ces problèmes de fécondité sont inquiétants et source de soucis pour les apiculteurs. Les reines défaillantes doivent être remplacées et ceci interrompt le développement des colonies, réduit leur production en miel et leur efficacité pour la pollinisation des cultures.
Ces problèmes ont soulevé diverses questions dans le monde apicole, à savoir si les problèmes résultent d’une mauvaise fécondation reliée à la qualité réduite du sperme produit par les mâles (faux-bourdons). L’étude de la qualité des faux-bourdons est plutôt récente. Les travaux sur les variations de la qualité du sperme d’abeilles et les facteurs qui l’influencent présentent parfois des résultats qui diffèrent entre les différentes lignées génétiques et la situation géographique.
Des connaissances plus approfondies sur la production et la qualité du sperme des faux-bourdons sont nécessaires afin d’approfondir les connaissances sur la biologie et leur contribution à la performance des colonies d’abeilles domestiques. Au Québec, aucune étude n’a encore été menée sur la production et la qualité du sperme des faux-bourdons et c’est pour combler cette lacune que nous avons réalisé ce travail. L’objectif principal est de vérifier l’influence de la lignée génétique, de l’âge et du moment de l’élevage des faux-bourdons durant la saison apicole sur la production et la qualité du sperme.
3
5
1.1. L’abeille domestique
L’abeille, Apis mellifera Linnaeus (Hymenoptera: Apidae) est originaire d’Europe, du Moyen-Orient et de l’Afrique et est maintenant largement répandue à travers le monde suite à son introduction en Amérique, Australie, Asie et dans les îles du Pacifique au cours des derniers siècles (Seeley, 1995). La diversité des habitats et des conditions climatiques dans lesquelles l’abeille évolue a entrainé la diversification de l’espèce avec une multitude de sous-espèces, ou races, chacune étant bien adaptée aux conditions particulières de la région (Louveaux, 1966). Au Canada, les colonies de l’abeille domestique dépendent des apiculteurs pour leur survie puisqu’elles ne peuvent vivre à l’état sauvage sous nos conditions. De plus, les colonies élevées en climat nordique doivent avoir la capacité de tolérer la longueur et la rigueur de l’hiver (Seeley et Visscher 1985).
La domestication de l’abeille a permis son utilisation comme agent pollinisateur dans plusieurs cultures. Ainsi, les abeilles contribuent au monde agricole par le maintien de la biodiversité au sein des écosystèmes (Le Conte et Navajas, 2008). En plus de permettre la reproduction de plusieurs espèces de plantes, la pollinisation par l’abeille augmente la grosseur et la qualité des fruits (Walters et Taylor, 2006). Au Québec, les cultures de la canneberge (Vaccinium macrocarpon) et du bleuet nain (Vaccinium angustifolium) sont fortement dépendantes de l’abeille domestique pour leur mise à fruit (Morse et Calderone, 2000). En plus des services de pollinisation, l’abeille est connue pour les produits de la ruche qu’elle procure : miel, pollen, propolis, gelée royale et cire.
L’abeille domestique est également l’objet de multiples études ces dernières années, principalement à cause des pertes de colonies massives se produisant un peu partout dans le monde (Potts et al., 2010; Neumann et Carreck, 2010). Les causes de ce déclin sont multiples, mais il semblerait que les interactions entre les prédateurs, les parasites, les pathologies, l’utilisation de plusieurs produits phytosanitaires et les stress environnementaux seraient responsables d’une grande partie de la perte mondiale des colonies (Garcia-Fernandez et Rodriguez, 1995; Potts et al., 2010).
1.1.2. Biologie
L’abeille possède un développement de type holométabole, c’est-à-dire une métamorphose complète, passant par les stades d’œuf, de larve, de pupe et finalement d’adulte (Winston, 1987). On appelle couvain l’ensemble des stades immatures, soit les œufs, les larves et les nymphes. La reine pond des œufs dans les alvéoles construites par les ouvrières. Avant de pondre, la reine détermine d’abord si elle est en présence d’une cellule d’ouvrière ou de faux-bourdon à l’aide de ses pattes avant ou de son abdomen (Gary, 2008; Winston, 1987).
6
Lorsque la reine ne relâche aucun spermatozoïde au moment de la ponte d’un œuf, celui-ci deviendra un individu haploïde, le faux-bourdon. Ainsi, les mâles de la colonie ne possèdent que le bagage génétique de la reine (Page et Laidlaw, 2008). Au contraire, lorsque la reine fertilise l’œuf avec un ou plusieurs spermatozoïdes en même temps que l’œuf, un phénomène appelé polyspermie (Meusel et Moritz, 1993), l’individu produit deviendra une femelle diploïde (Klenk et al., 2004; Seeley, 2010). La plupart du temps, le noyau d’un seul spermatozoïde fusionne avec le noyau de l’œuf alors que les spermatozoïdes dits accessoires dégénèreront rapidement après la fertilisation (Page et Laidlaw, 2008).
Le temps de développement pour chaque caste de l’abeille est variable : 24 jours sont nécessaires pour produire une femelle ouvrière adulte, 21 jours pour le faux-bourdon et seulement 16 jours pour la reine (Winston, 1987). Le stade de l’œuf est de 3 jours pour toutes les castes. Une larve éclot au bout de 3 jours et est nourrie par les abeilles nourricières. C’est la quantité et la composition de l’alimentation larvaire qui déterminera si une femelle deviendra une ouvrière ou une reine (Page et Peng 2001; Laidlaw 2008). En effet, pour les 3 premiers jours du développement larvaire, les larves issues d’œufs fécondés ont le potentiel de se développer autant en abeille ouvrière qu’en reine (Evans et Wheelers, 2000; Winston 2008). Les abeilles nourricières sont chargées d’alimenter les larves en développement avec un mélange de sécrétions de leurs glandes mandibulaires et hypopharyngiennes et de pollen (Winston, 1987). Les larves de reines sont alimentées avec la gelée royale qui contient une plus grande proportion de sécrétions des glandes mandibulaires riche en sucre. De plus, les larves royales reçoivent plus de nourriture que les larves d’ouvrières. L’alimentation particulière des larves destinées à devenir des reines influence la détermination de la caste de la femelle via le système endocrinien, plus particulièrement l’hormone juvénile connue pour sa régulation du développement chez les insectes (Nijhout, 2003). Plus récemment, Kamakura (2011) a identifié une protéine de la gelée royale, la royalactine, qui induit le développement ovarien et la croissance corporelle et diminue le temps de développement des reines.
1.1.3. Castes et tâches dans la colonie
Il existe 3 castes distinctes chez l’abeille domestique : la reine, l’ouvrière et le faux-bourdon (figure 1). Une colonie d’abeilles domestiques est habituellement constituée d’une seule reine, de 10 000 à 60 000 femelles ouvrières et de 0 à quelques milliers de faux-bourdons, dépendamment du moment dans la saison (Winston, 1987). La reine et les ouvrières sont des femelles issues d’œufs fertilisés et donc diploïdes alors que les mâles, appelés faux-bourdons, proviennent d’œufs non fertilisés et sont donc haploïdes (Boes, 2010).
7 Figure 1 : Les 3 différentes castes de l’abeille : à gauche, la reine entourée des femelles ouvrières. À droite, le mâle de la colonie, le faux-bourdon. (crédit photo : Andrée Rousseau).
Comme les fourmis (Hymenoptera : formicidae) et les termites (Isoptera), l’abeille domestique est un hyménoptère eusocial, c’est-à-dire que les castes vivent en colonie et qu’il existe une ségrégation du travail à l’intérieur de celle-ci (Amdam et Page, 2010). Alors que les principales tâches de la reine au cours de sa vie sont la ponte des œufs ainsi que la production de phéromones pour le maintien et le contrôle de la colonie (Winston, 1987), les ouvrières occuperont différentes tâches associées à leur changement de physiologie, principalement dû au développement glandulaire, en relation avec l’âge (Seeley, 1982); c’est le polyéthisme d’âge. Les ouvrières vivent en moyenne de 3 à 6 semaines en été alors que les ouvrières qui passent l’hiver à l’intérieur de la colonie vivent plusieurs mois (Page et Peng, 2001). Les tâches qu’elles occupent au cours de leur vie sont d’abord concentrées à l’intérieur de la colonie (nettoyage des alvéoles, alimentation larvaire, construction des alvéoles, etc.) puis ce sont les abeilles plus âgées qui sont chargées des tâches extérieures, comme la défense de la colonie et la collecte du nectar et du pollen (Seeley, 1982; Winston, 1987).
1.1.4. Reproduction
Une colonie d’abeilles se multiplie de 2 façons : par essaimage, un processus de division naturel de la colonie (Winston, 1987) ainsi que par reproduction via la production et le maintien des mâles (faux-bourdons) dont la seule fonction véritable est la copulation avec les reines vierges d’une population. Cette dernière façon permet l’introduction de nouveaux gènes dans la population (Boes, 2010).
1.1.4.1. Multiplication par essaimage
Le comportement d’essaimage est observé à la fin du printemps-début de l’été chez les colonies d’abeilles populeuses et représente la division de la colonie de façon naturelle (Seeley et al., 2006). La première reine
8
quitte la colonie avec près de la moitié de la population d’ouvrières pour fonder une nouvelle colonie alors qu’une nouvelle reine est élevée au sein de la colonie mère. La tendance des colonies à essaimer semble varier entre les races d’abeilles domestiques (Winston, 1987). Un des premiers signes de la préparation à l’essaimage dans une colonie est la présence de cellules royales, grosses cellules allongées vers le bas, pouvant facilement être identifiées et détruites par l’apiculteur qui souhaite freiner le comportement d’essaimage afin de conserver la totalité de la population d’abeilles à l’intérieur de la ruche (Boucher et al., 2011).
1.1.4.2. Reproduction sexuée
La reproduction de l’abeille domestique est dite polyandrique, c’est-à-dire que la reine s’accouple avec plusieurs mâles, en moyenne une dizaine (Adams, 1977; Woyke, 1960). Lorsque la reine vierge est sexuellement mature, soit 5-6 jours après l’émergence (Gary, 2008), elle effectue de 1 à 3 vols de fécondation (Tarpy et Page, 2001) afin de favoriser l’acquisition d’un nombre maximal de spermatozoïdes. Il semblerait que ce soit le nombre de spermatozoïdes acquis durant un vol qui influencerait la reine à effectuer un vol subséquent (Woyke, 1960).
Durant ces vols nuptiaux, la reine vole jusqu’à 2 kilomètres (Estoup et al., 1995) pour se rendre à l’aire de rassemblement des faux-bourdons où quelques milliers de mâles de plusieurs colonies (jusqu’à 200 colonies) volent à une hauteur du sol variant de 15 à 40 mètres (Baudry et al., 1998). L’aire de rassemblement des faux-bourdons demeure constante pour plusieurs années, mais les processus d’orientation des faux-faux-bourdons et de la reine pour trouver cet endroit demeurent incompris (Baudry et al., 1998). Lorsqu’une reine se rend à l’aire de congrégation des faux-bourdons, ces derniers volent à sa poursuite, attirés par une phéromone, l'acide 9-oxo-2- décénoique (9-ODA) (Koeniger et Koeniger, 2000; Winston, 1987) et par des signaux visuels (Gary, 1963). Il y a alors une succession rapide d’accouplements en vol. Lorsqu’il y a éversion de l’endophallus (organe génital du faux-bourdon) dans la chambre à aiguillon de la reine, le mâle devient paralysé. L’éversion complète de l’endophallus est favorisée par les mouvements actifs de l’abdomen de la reine et le sperme est alors transféré dans ses oviductes (Woyke, 2010); l’éjaculation provoque la rupture des organes génitaux du faux-bourdon qui meurt et tombe au sol (Koeniger, 1990). Une partie de l’endophallus, ainsi que le mucus provenant de l’éjaculat, demeureront coincés dans la chambre à aiguillon de la reine; c’est ce que l’on appelle le «signe de copulation» (Koeniger, 1990; Woyke, 2010). Le «signe de copulation» est facilement retiré par le faux-bourdon suivant à l’aide d’une paire de poils spécialisés de l’endophallus (Koeniger, 1990) alors que les ouvrières retireront le signe du dernier mâle lorsque la reine retournera à la colonie (Franck et al., 2002). L’ensemble de ces copulations laissera environ 87 millions de spermatozoïdes dans les oviductes de la reine
9 dont la majorité sera expulsée alors que seulement 3-5% des spermatozoïdes seront conservés par la reine, soit de 4 à 7 millions. Ces derniers migreront à la spermathèque de la reine où ils seront conservés durant toute sa vie (Roberts et Mackensen, 1951; Woyke, 1964).
Les faux-bourdons ayant copulé avec la reine ne contribuent pas tous de façon égale à la descendance de la reine (Moritz, 1986; Laidlaw et Page, 1984). Il semblerait que l’ordre dans lesquels les copulations ont lieu n’influence pas la fréquence de la descendance du faux-bourdon, mais qu’un plus grand volume d’éjaculat le favoriserait (Schlüns et al., 2004). Le dernier faux-bourdon qui copule avec la reine ne serait pas surreprésenté dans la colonie comme c’est le cas chez plusieurs espèces d’insectes (Franck et al., 2002). Il existe une compétition entre les mâles au site de fécondation pour l’accès à la reine (Koeniger et al. 2005) ainsi qu’une compétition des spermatozoïdes dans la spermathèque pour atteindre l’œuf (Harbo, 1990). La reine peut également exercer un choix cryptique des spermatozoïdes post-copulation puisqu’elle peut manipuler la rétention et l’utilisation des spermatozoïdes (Franck et al. 2002).
Une fois les vols nuptiaux terminés, la reine pourra alors débuter la ponte; elle pondra de 175 000 – 200 000 œufs / an (Gary, 2008) durant toute sa vie, soit de 1 à 3 ans (Page et Peng, 2001; Seeley et Morse, 1978). Une fois la ponte débutée, la reine ne retourne pas se faire féconder de nouveau (Winston, 1987). Ce fait rend la période de copulation extrêmement importante pour le maintien de la productivité de la colonie. Ainsi, une reine qui épuise le contenu de sa spermathèque ne pourra pondre que des œufs non fécondés, donc des faux-bourdons. On qualifie une telle reine de « bourdonneuse » et l’apiculteur devra la remplacer s’il n’y a pas d’œufs fertilisés pondus récemment pour que la colonie élève elle-même une nouvelle reine.
1.5. La spermathèque
La spermathèque (figure 2) est un organe spécialisé de la reine où sont entreposés les spermatozoïdes entre le ou les moments de copulation et celui de la fertilisation des œufs (Baer et al., 2009). C’est un sac d’environ 1.1mm de diamètre connecté à l’oviducte par le conduit spermatique (Phiancharoen et al., 2004). Les spermatozoïdes seront entreposés et maintenus en vie pour quelques années grâce aux sécrétions des glandes accessoires du faux-bourdon et des glandes associées à la spermathèque (King et al., 2011; Collins et al., 2006). La spermathèque d’une reine bien inséminée contient de 4 à 7 millions de spermatozoïdes lui permettant de féconder efficacement les œufs pondus durant sa vie au sein de la colonie. La reine peut
10
pondre jusqu’à 1500 œufs durant une période de 24 heures (Winston, 1987), ce qui représente un taux de ponte de près d’un œuf à la minute.
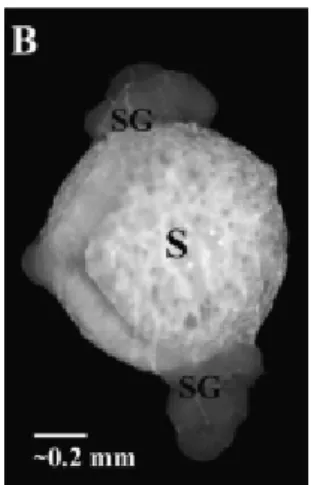
Figure 2 : Spermathèque de la reine (S) et les 2 glandes spermathècales (SG) qui l’accompagnent (tiré de den Boer et al., 2009).
1.6. Production de reines et contrôle de la reproduction
Les éleveurs de reines se spécialisent dans la production massive de cellules royales et/ou de jeunes reines fécondées destinées à la vente aux apiculteurs. Le contrôle de la reproduction chez l’abeille représente un défi substantiel principalement par le fait qu’elle ne se déroule pas à l’intérieur de la colonie, mais en vol à quelques kilomètres du rucher avec plusieurs mâles et les efforts pour réaliser la reproduction à l’intérieur d’une cage se sont avérés vains (Mackenson et Tucker, 1970).
Afin d’assurer la fécondation des jeunes reines, l’éleveur de reines utilise une des deux techniques principales (Laidlaw, 1979) : la fécondation en zone isolée ou l’insémination instrumentale. La fécondation en zone isolée permet le contrôle de la provenance des faux-bourdons qui copuleront avec la reine puisque la zone est saturée des faux-bourdons de la lignée génétique souhaitée pour la fécondation (Collins et Donoghue, 1999). Par contre, Peer (1957) a démontré, en isolant les reines vierges des colonies de faux-bourdons, qu’il pouvait y avoir reproduction jusqu’à une distance de 10.1 miles (16,25 kilomètres), mais qu’une distance supérieure rendait les chances de copulation pratiquement nulles. Cette distance, devrait donc être respectée si l’on veut s’assurer de la paternité des futures abeilles.
L’insémination instrumentale des jeunes reines permet un contrôle complet de la génétique ainsi que la réalisation de croisements spécifiques permettant des développements en recherche et en amélioration des
11 lignées (Cobey, 2007). Cette technique nécessite toutefois l’achat de matériel spécialisé ainsi que le développement d’une main-d’œuvre qualifiée. À travers le monde, ce sont des centaines de milliers de reines qui sont inséminées chaque année et pour ce faire, le sperme d’environ 800 000 faux-bourdons doit être collecté (Woyke, 2010).
Au Québec, bien que l’élevage de reines soit encore peu pratiqué, il est en expansion; en 2012, près de 24 790 reines abeilles ont été produites par quelques apiculteurs (Institut de la statistique du Québec, 2012). Le Canada importe plusieurs dizaines de milliers de reines abeilles provenant principalement de Nouvelle-Zélande, de Californie et d’Hawaï. L’autosuffisance en reines est une préoccupation importante de l’industrie apicole canadienne puisque l’importation de reines constitue un risque de propagation de maladies au pays et qu’un élevage de reines rustiques permet de développer des colonies d’abeilles mieux adaptées à notre environnement, à notre type d’industrie apicole et à la survie de nos longs hivers (Chapleau, 1987).
1.7. Problèmes de fécondité des reines
Depuis une dizaine d’années, les apiculteurs rapportent une augmentation de reines défaillantes, soit des reines bourdonneuses ne pondant que des œufs non fertilisés ainsi que des cas de supersédure (renouvellement spontané par la colonie d’une reine défaillante). Ces informations ont été documentées en Amérique du Nord et un peu partout dans le monde (vanEngelsdorp et al., 2010; Camazine et al., 1998; Rhodes et al., 2004). De plus, Rhodes et al., (2004) ont observé un pourcentage élevé de reines âgées entre 14 et 35 jours dont les spermathèques contiennent moins de 3 millions de spermatozoïdes, ce qui n’est pas suffisant pour le maintien d’une colonie pendant une saison. Rhodes et al., (2004) ont émis l’hypothèse d’un problème au niveau de la reproduction en élevage commercial, soit un nombre insuffisant de faux-bourdons ou une qualité inadéquate du sperme chez ces mâles.
Le remplacement de reines moins bien fécondées représente une augmentation importante des coûts pour l’apiculteur. L’apiculteur aux prises avec une colonie orpheline (sans reine pondeuse) peut soit se procurer une nouvelle reine auprès d’un éleveur de reines ou choisir de laisser la colonie orpheline le soin de s’élever une reine par elle-même. Dans les deux cas, il y a aura une perte de production associée à l’arrêt de ponte et un déclin de population d’abeilles ouvrières (Tarpy et al., 2000). Le temps de développement moyen d’une reine est de 16 jours (Winston 1987) et cela peut prendre jusqu’à 3 semaines avant que la reine soit fécondée et puisse débuter l’oviposition (Tarpy et al., 2000). De plus, le temps de développement de l’œuf jusqu’à l’adulte ouvrière est de 21 jours et la durée de vie de l’adulte ouvrière est de seulement 6 semaines durant la saison active (Page et Peng, 2001). Le déclin de la population d’abeilles ouvrières durant une période de
12
remplacement d’une reine au sein d’une colonie (Tarpy et al., 2000) représente donc des pertes de production importantes pour l’apiculteur.
1.8. Les faux-bourdons
Comme précédemment mentionné, les faux-bourdons sont produits à partir d’œufs non fertilisés (haploïdes), qui ne possèdent qu’une moitié du génome de la reine (Winston, 1987). Leur développement est d’une durée totale de 24 jours; soit 3 jours au stade d’œuf, 6 jours de stades larvaires alimentés par les abeilles nourrices et environ 15 jours pour les stades pré-pupal et pupal (Page et Peng, 2001). Les faux-bourdons ne participent pas à la collecte de nectar et de pollen. Leurs deux seuls rôles connus sont la fécondation des reines vierges ainsi que la participation à la thermorégulation à l’intérieur de la colonie (Harrison, 1987). Les faux-bourdons se nourrissent de pollen et de miel dans les alvéoles en périphérie de la ruche (Moritz et Neumann, 1996).
La production des faux-bourdons au sein de la colonie varie selon la saison (Rowland et McLellan, 1987); leur production débute en mai dans l’hémisphère nord, atteint un nombre maximal tôt à l’été et cesse à l’automne (Free et Williams, 1975). Les faux-bourdons encore vivants en fin de saison sont jetés hors de la colonie pour la période d’hivernage. Puisque les faux-bourdons sont plus coûteux à produire et à maintenir que les ouvrières (Boes, 2010), leur production est corrélée à la disponibilité de la nourriture (McNally et Schneider, 1994; Rowland et McLellan, 1987) et à la taille de la colonie (Lee et Winston, 1987). En conditions naturelles, les colonies tendent à produire les reines vierges ainsi que le nombre maximal de faux-bourdons au moment de la période d’essaimage (Lee et Winston, 1987), ce qui correspond à la fin du printemps-début de l’été au Québec. Ainsi, durant la saison active, les faux-bourdons représentent de 5 à 10% de la colonie (Page et Metcalf, 1984; Seeley et Morse, 1978). Durant les journées chaudes de l’été, tôt en après-midi, les faux-bourdons sortent de la colonie pour effectuer des vols d’orientation ou de fécondation (Coelho, 1991). Les faux-bourdons se rendent alors à l’aire de congrégation située à quelques centaines de mètres de la colonie (Koeniger et al., 2005). Il semble que l’emplacement du site de congrégation demeure constant pour plusieurs années (Baudry et al., 2010) et qu’en moyenne plus de 10 000 faux-bourdons visitent le site chaque année (Keoniger et al., 2005). Les facteurs ou les conditions qui influencent l’endroit où est établie l’aire de congrégation ne sont pas totalement connus (Koeniger et al., 2005) et les faux-bourdons se rassemblent à cet endroit indépendamment de la présence des reines vierges. Baudry et al. (2010) ont étudié la diversité génétique existant au site de congrégation et ont déterminé que les faux-bourdons appartenaient à 240 colonies différentes, ce qui réduit au minimum les risques de consanguinité entre la reine et les faux-bourdons avec lesquels elle s’accouple au sein d’une congrégation.
13
1.8.1. Organe reproducteur
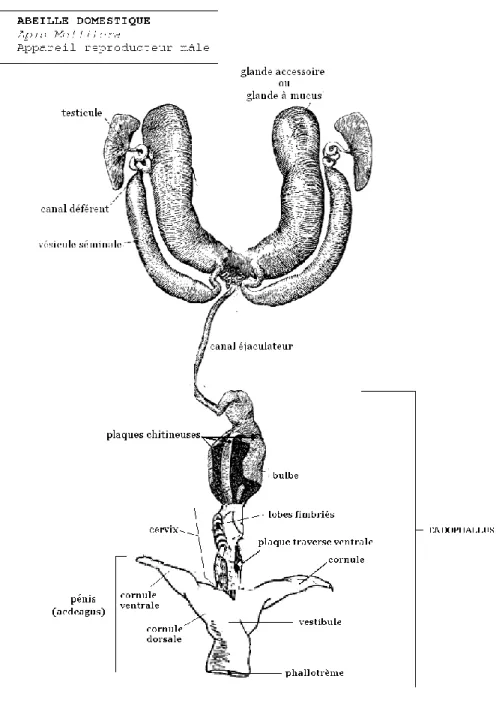
L’organe reproducteur du faux-bourdon est l’endophallus et consiste en un long tube à l’intérieur de l’abdomen composé principalement du bulbe, des cornules, du canal éjaculateur et des plaques chitineuses (figure 3). Les glandes à mucus, les vésicules séminales et les testicules sont rattachés à l’endophallus par le canal éjaculateur.
14
Lorsqu’il y a éjaculation, l’endophallus est expulsé à l’extérieur de l’abdomen (figure 4), c’est le processus d’éversion (Woyke, 2008). Le processus d’éversion se fait naturellement lorsqu’un faux-bourdon agrippe la reine en vol, mais peut également être reproduit de façon manuelle. Puisque l’endophallus en soi ne possède pas de muscle (Bishop, 1920a), son éversion résulte de la contraction musculaire abdominale lorsque le faux-bourdon est excité ou par l’application d’une pression sur le thorax causant l’augmentation de la pression de l’hémolymphe à l’intérieur de l’abdomen (Woyke, 2008).
Figure 4 : Éversion partielle (à gauche) et complète (à droite) de l’endophallus avec présence de sperme (coloration beige) au bout de l’organe génital (tiré de Woyke, 2008).
1.8.2. Spermatogénèse et maturité sexuelle
Les faux-bourdons sont prospermatogéniques, c’est-à-dire que le développement des testicules, ainsi que le processus de spermatogénèse, a lieu avant l’émergence au stade de pupe (Bishop, 1920a; Page et Peng, 2001). Les spermatozoïdes sont produits dans les tubules des testicules (figure 5) durant le stade de nymphe et commencent à migrer vers les vésicules séminales lorsque les faux-bourdons ont 3 jours d’âge adulte (Woyke et Jasinski, 1978); les testicules dégénèrent rapidement après l’émergence du faux-bourdon puisque leur contenu est passé aux vésicules séminales. Les spermatozoïdes sont entreposés dans les vésicules séminales jusqu’à l’éjaculation. Les glandes accessoires, ou glandes à mucus, produisent une partie du fluide séminal qui sera mélangé et éjaculé en même temps que les spermatozoïdes via le conduit éjaculateur (Bishop, 1920b; Mackensen et Tucker, 1970). Le fluide séminal est hautement protéiné et représente une source d’énergie pour les spermatozoïdes et contribuerait également à la capacitation et à la conservation de ceux-ci (Chen, 1984).
15 Figure 5 : Organes génitaux du faux-bourdon : les testicules (T), les vésicules séminales (AT), les glandes accessoires ou glandes à mucus (AG) et le conduit éjaculateur (ED) (tiré de den Boer et al., 2009).
À maturité, chaque faux-bourdon produit entre 1.50 et 1.75 µL de sperme contenant environ 11 millions de spermatozoïdes (Woyke, 1960). Bien que les estimations de la durée de vie des faux-bourdons adultes varient entre 20 et 40 jours (Page et Peng, 2001), il n’existe pas de consensus sur l’âge exact auquel le faux-bourdon atteint la maturité sexuelle ainsi que la durée du potentiel de reproduction chez le faux-bourdon. À maturité, les vésicules séminales sont remplies de sperme et le développement de la glande à mucus est complété (Rhodes, 2008). Bishop (1920a et 1920b) est l’un des premiers à avoir étudié les faux-bourdons. Il a démontré que les faux-bourdons ne sont pas matures à l’émergence et qu’ils subissent un processus de maturation post-émergence d’une durée minimale de 9 à 12 jours. Pour plusieurs auteurs, les faux-bourdons de 10 à 21 jours sont matures et leur sperme possède les qualités optimales pour l’insémination des reines (Harbo et Williams, 1986; Woyke et Jasinsky, 1978).
1.9. Évaluation de la production et de la qualité du sperme
Les problèmes de fécondité rencontrés chez les reines de l’abeille domestique ont incité des chercheurs à vérifier s’il existe des problèmes au niveau de la quantité et de la qualité des spermatozoïdes (Woyke et Jasinsky, 1978; Rhodes et al., 2010; Schluns et al., 2003; Collins, 2000). Plusieurs tests ont été développés afin d’évaluer l’intégrité fonctionnelle et structurelle des spermatozoïdes de l’abeille domestique (Nur et al., 2012). Il est commun d’utiliser le nombre de spermatozoïdes ayant migré jusqu’à la spermathèque de reines inséminées artificiellement comme indice de la qualité du sperme (Collins, 2000; Harbo et Williams, 1987; Woyke et Jasinsky, 1978). D’autres études, moins nombreuses, se sont penchées sur l’évaluation des qualités intrinsèques du sperme sans l’utilisation de l’insémination artificielle (Collins et Donoghue, 1999; Rhodes,
16
2008; Schluns et al., 2003). Pour se faire, le sperme est prélevé directement chez le faux-bourdon. Les principaux tests utilisés visent à évaluer le volume de sperme, le nombre de spermatozoïdes produits par mâle, la viabilité ainsi que la motilité des spermatozoïdes.
1.9.1 Volume de sperme
Le volume de sperme du faux-bourdon peut être obtenu de plusieurs façons, les deux techniques les plus utilisées étant la dissection des vésicules séminales et l’éversion manuelle de l’endophallus (Collins, 2004; Locke et Peng 1993; Rhodes, 2008). Lorsque le faux-bourdon subit une pression sur le thorax ou est exposé aux vapeurs d’éther ou de chloroforme ou est décapité, le sperme passe des vésicules séminales au bulbe de l’endophallus (Laidlaw 2008; Woyke et Jasinsky, 1978). Le sperme peut ensuite être prélevé directement de l’endophallus du faux bourdon à l’aide d’une seringue d’insémination (figure 6) (Mackensen et Tucker, 1970; Laidlaw 2008). Le lavage de l’endophallus éversé, méthode développée par Kaftanoglu et Peng (1984), permet la récolte du sperme sans l’utilisation d’une seringue d’insémination (Collins, 2004), mais ne permet pas d’obtenir le volume de sperme produit par le mâle. Le tableau 1 présente le volume moyen de sperme prélevé par faux-bourdon selon différentes études.
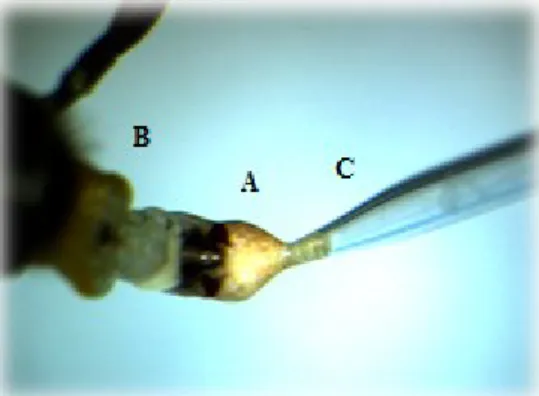
Figure 6 : Prélèvement du sperme (A) d’un endophallus (B) de faux-bourdon sous loupe binoculaire avec une seringue d’insémination (C) Gilmont (crédit photo : Andrée Rousseau).
Les techniques d’éversion manuelle et de dissection des vésicules séminales sont les techniques les plus fréquemment employées afin d’obtenir des indices de qualité et de quantité du sperme du faux-bourdon. Dans cette étude, nous avons choisi d’utiliser la méthode d’éversion manuelle, afin de prélever le sperme des faux-bourdons, pour plusieurs raisons. En effet, contrairement à la dissection des vésicules séminales ou au lavage
17 de l’endophallus, l’éversion manuelle permet d’obtenir une donnée de volume de sperme produit. L’évaluation du volume de sperme produit par le mâle est importante puisque l’on sait que l’efficacité de la migration des spermatozoïdes est dépendante de la quantité de sperme (Cobey, 2007). De plus, les travaux de Schluns et al. (2004) montrent que le nombre de descendants d’un faux-bourdon augmente avec un plus grand volume de sperme. L’éversion manuelle est également la technique utilisée dans maintes études sur les propriétés du sperme de faux-bourdons (Collins and Donoghue 1999; Gençer et Kahya 2011; Nur et al. 2012; Rhodes et al. 2010) et c’est la technique pratiquée pour la collection du sperme dans le cadre de l’insémination instrumentale des reines (Harbo 1985; Mackensen et Tucker, 1970; Laidlaw 2008).
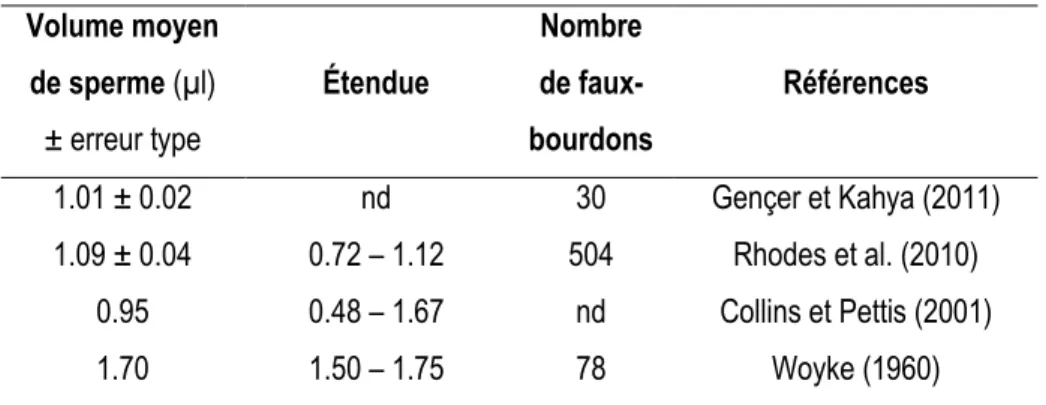
Tableau 1 : Volume moyen de sperme prélevé par faux-bourdons (Apis mellifera L.), étendue et nombre de faux-bourdons évalués pour différentes études.
Volume moyen de sperme (µl) ± erreur type Étendue Nombre de faux-bourdons Références 1.01 ± 0.02 nd 30 Gençer et Kahya (2011) 1.09 ± 0.04 0.72 – 1.12 504 Rhodes et al. (2010) 0.95 0.48 – 1.67 nd Collins et Pettis (2001) 1.70 1.50 – 1.75 78 Woyke (1960)
1.9.2. Nombre de spermatozoïdes
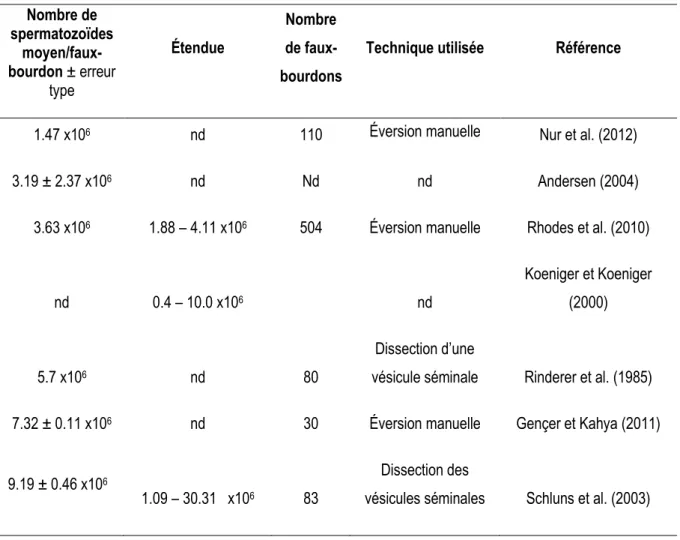
La durée de la vie reproductive de la reine est fortement dépendante du nombre de spermatozoïdes qu’elle aura acquis durant l’unique période de copulation avant le début de la période active de ponte (Harbo, 1979). Tout comme pour l’évaluation du volume de sperme, le nombre de spermatozoïdes peut être obtenu directement des vésicules séminales ou après éversion manuelle de l’endophallus. Des études précédentes ont montré que le nombre de spermatozoïdes produits chez les faux-bourdons matures est hautement variable (Gençert et Kahya, 2011; Koeniger et al., 2005). Les estimations du nombre de spermatozoïdes par faux-bourdon varient de 1 à 30 millions de spermatozoïdes (tableau 2). Selon Koeniger et al. (2005), la grande variabilité retrouvée pourrait être expliquée en partie par les méthodes de compte des spermatozoïdes qui diffèrent selon les études.
Selon Woyke et Jasinsky (1978), l’âge des faux-bourdons serait négativement corrélé au nombre de spermatozoïdes présents dans la spermathèque de reines inséminées. Rhodes (2008) a également souligné
18
l’importance de la lignée génétique sur la production de spermatozoïdes et suggère que les lignées produisant en moyenne moins de 5 millions de spermatozoïdes par faux-bourdon ne devraient pas être utilisées dans les programmes d’amélioration génétique (Rhodes, 1999). Par contre, comme le montre le tableau 2, de nombreuses études montrent que les faux-bourdons possèdent moins de 5 millions de spermatozoïdes. La technique d’éversion manuelle semble résulter en un nombre de spermatozoïdes moyen inférieur à la technique de dissection des vésicules séminales.
Tableau 2 : Nombre de spermatozoïdes (moyenne ± erreur standard) par faux-bourdon (Apis mellifera L.), nombre de faux-bourdons évalués et technique utilisée pour différentes études.
Nombre de spermatozoïdes moyen/faux-bourdon ± erreur type Étendue Nombre de faux-bourdons
Technique utilisée Référence
1.47 x106 nd 110 Éversion manuelle Nur et al. (2012)
3.19 ± 2.37 x106 nd Nd nd Andersen (2004)
3.63 x106 1.88 – 4.11 x106 504 Éversion manuelle Rhodes et al. (2010)
nd 0.4 – 10.0 x106 nd
Koeniger et Koeniger (2000)
5.7 x106 nd 80
Dissection d’une
vésicule séminale Rinderer et al. (1985)
7.32 ± 0.11 x106 nd 30 Éversion manuelle Gençer et Kahya (2011)
9.19 ± 0.46 x106
1.09 – 30.31 x106 83
Dissection des
19
1.9.3. Viabilité des spermatozoïdes
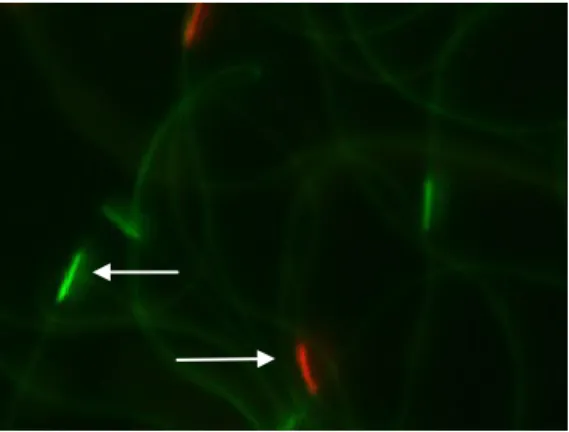
Les travaux de Collins et Donoghue (1999) ont permis de valider l’utilisation des colorants à fluorescence (SYBR-14, Calcéine-AM et l’iodure de propidium) déjà utilisés pour obtenir la viabilité des spermatozoïdes chez les mammifères (Garner et Johnson, 1995) et les oiseaux (Chalah et Brillard, 1998) afin d’obtenir la viabilité des spermatozoïdes de faux-bourdons. Le SYBR-14 et la Calcéine-AM sont des colorants qui ont la capacité d’infiltrer les membranes plasmiques des spermatozoïdes et de colorer l’ADN; les cellules vivantes apparaissent vertes en microscopie à fluorescence (figure 7) (Collins et Donoghue, 1999). L’iodure de propidium pénètre les membranes plasmiques détériorés des spermatozoÏdes morts et en microscopie à fluorescence ils seront colorés rouge.
Figure 7 : Fluorescence des têtes de spermatozoïdes traités aux colorants SYBR-14 (qui colore en vert les gamètes vivants) et iodure de propidium (qui colore en rouge les gamètes morts). Observation faite à 400x. (crédit photo : Andrée Rousseau).
Collins (2004) a identifié la méthode de prélèvement du sperme comme étant le facteur affectant le plus la viabilité des spermatozoïdes d’abeilles collectés pour l’insémination artificielle des reines. Les spermatozoïdes sont sensibles à la contamination bactérienne (Andere et al., 2011) et cette contamination peut réduire significativement la viabilité (Locke et Peng, 1993). Locke et Peng (1993) ont mesuré une diminution significative de la viabilité des spermatozoïdes avec l’augmentation de l’âge : la viabilité maximale mesurée de 86.2% est atteinte à l’âge de 2 semaines alors que pour les faux-bourdons de 4 à 6 semaines, la viabilité des spermatozoïdes diminue progressivement jusqu’à 81.4-80.1%. Les résultats de Rhodes (2008) sont différents de ceux de Locke et Peng puisqu’il a observé une plus grande viabilité des spermatozoïdes des bourdons de 21 et 35 jours, respectivement 81.92% et 80.16% comparativement à la viabilité chez les faux-bourdons de 14 jours de 77.85%.
20
1.9.4. Motilité des spermatozoïdes
Les spermatozoïdes sont entreposés dans la spermathèque sous forme immobile (Verma 1978). La motilité serait activée par la sécrétion des glandes spermathècales (Lensky et Schindler, 1967). Elle peut aussi être activée artificiellement par l’addition des sécrétions de la glande à mucus (aussi appelée glande accessoire, voir figure 5), d’une solution tampon d’un pH compris entre 3.0 et 9.0, ou d’eau distillée (Lensky et Schindler, 1967).
La motilité des spermatozoïdes est essentielle au moment de l’accouplement et l’analyse du pourcentage de spermatozoïdes mobiles permet l’évaluation du potentiel de fertilisation du mâle chez plusieurs espèces (Liu et al., 1991). Chez l’abeille, la motilité spermatique est également cruciale pour la migration des spermatozoïdes jusqu’à la spermathèque de la reine (Lodesani et al., 2004; Verma 1978).
Les spermatozoïdes d’abeilles mesurent environ 230 μm et possède une tête de 8 μm très peu différentiables de la queue de la cellule (Rhodes, 2008). Dans le sperme non dilué ou dans un diluant propice, il est possible d’observer le mouvement ondulatoire de la masse de spermatozoïdes, caractéristique de la motilité de cellules (Lensky et Schindler, 1967). Quand les spermatozoïdes sont placés dans une solution isotonique, la tête ne peut être distinguée de la queue alors qu’en milieu hypotonique, comme dans l’eau distillée, il est possible d’observer les queues de spermatozoïdes vivants enfler par osmose (Nur et al., 2012).
Lensky et Schindler (1967) ont décrit les 3 types de mouvements observés à forte densité chez les spermatozoïdes de faux-bourdons prélevés des vésicules séminales, de l’éjaculat ou de la spermathèque : le mouvement ondulatoire de masse et les mouvements individuels circulaires et de serpentin. Afin d’obtenir la proportion des cellules mobiles, la méthode d’analyse standard consiste à classer les spermatozoïdes, ou un ensemble de spermatozoïdes, en classes de mouvement (Locke et Peng, 1993; Verma, 1978) allant de l’immobilité aux mouvements circulaires.
21
1.10. Objectifs du projet
À notre connaissance, il n’existe pas d’étude sur la qualité des faux-bourdons dans les colonies d’abeilles mellifères au Québec et au Canada. Ce projet vise donc à faire l’évaluation de la qualité des faux-bourdons utilisés dans la fécondation commerciale des reines abeilles au Québec. Par le biais de cette étude, nous voulons exposer les variations saisonnières dans la production et la qualité du sperme des faux-bourdons et comprendre de quelles façons l’âge des mâles, le moment de la saison et la lignée génétique peuvent influencer la production de sperme des faux-bourdons.
Les objectifs spécifiques du projet sont les suivants :
Déterminer si la lignée génétique du faux-bourdon influence la production et la qualité du sperme (volume de sperme, motilité, viabilité et nombre de spermatozoïdes).
Déterminer si le moment durant lequel le faux-bourdon est produit dans la saison apicole québécoise influence la production et la qualité du sperme (volume de sperme, motilité, viabilité et nombre de spermatozoïdes).
Déterminer si l’âge du faux-bourdon influence la production et la qualité du sperme (volume de sperme, motilité, viabilité et nombre de spermatozoïdes).
Cette étude aura un impact dans les programmes de sélection afin d’y inclure la sélection des faux-bourdons présentant un sperme de qualité optimale pour une fécondation favorisant une durée de vie élevée chez les reines.
22
1.11. Hypothèses
L’hypothèse générale du projet est la suivante : il existe des variations de la qualité du sperme de faux-bourdons, soit le volume de sperme, la motilité, la viabilité et le nombre de spermatozoïdes, au cours de la saison apicole québécoise.
Les hypothèses spécifiques sont les suivantes :
La production et la qualité du sperme sont différentes entre les 2 lignées génétiques utilisées (Québec vs. Buckfast).
La production et la qualité du sperme sont supérieures et optimales au milieu de la saison apicole québécoise (i.e. fin juin-début juillet), soit à la période d’essaimage naturel des colonies.
L’âge du faux-bourdon influence négativement la qualité du sperme.
Afin de vérifier ces hypothèses, un dispositif expérimental a été élaboré pour obtenir des faux-bourdons d’âges connus appartenant à 2 lignées génétiques durant la saison apicole québécoise du mois de mai à septembre.
23
25
Drone sperm quality (Apis mellifera) in relation to age, genetic line and time of breeding
Ce manuscrit a été soumis au périodique The Canadian Entomologist pour publication. L’auteure principale est Andrée Rousseau. Les coauteurs sont Valérie Fournier, Ph.D., (Centre de recherche en horticulture, Université Laval) et Pierre Giovenazzo, Ph.D., (Centre de recherche en sciences animales de Deschambault).26
Résumé
La durée de vie de la reine de l’abeille (Apis mellifera Linnaeus) est dépendante du nombre de spermatozoïdes qu’elle acquiert durant les vols nuptiaux. Des remplacements de reines ainsi que de jeunes reines ayant épuisé leurs réserves de spermatozoïdes sont rapportés en Amérique du Nord et des problèmes de fertilité chez les faux-bourdons sont suspectés. Le but de cette étude était d’évaluer les qualités reproductives du bourdon durant la saison de production des reines abeilles de mai à août. Des faux-bourdons de deux lignées différentes ont été élevés à six reprises au cours de la saison apicole 2012 au Centre de recherche en sciences animales de Deschambault, Québec (Canada). Le volume de sperme, le nombre de spermatozoïdes et la viabilité ont été évalués aux âges de 14, 21 et 35 jours de vie. Les résultats montrent que 1) le volume de sperme augmente avec l’âge des faux-bourdons testés; 2) le moment de l’élevage influence la production du sperme et 3) le nombre de spermatozoïdes et la viabilité des gamètes ne semblent pas influencés par la lignée génétique, l’âge ou le moment de l’élevage. Cette étude souligne la nécessité d’en connaître davantage sur l’élevage des faux-bourdons afin d’obtenir des reines abeilles adéquatement fécondées.
27
Abstract
A honey bee (Apis mellifera Linnaeus) queen’s life expectancy is strongly dependent on the number of sperm she obtains by mating with drones during nuptial flights. Unexplained replacements of queens by the colony and young queens showing sperm depletions have been reported in North America, and reduced drone fertility has been a suspected cause. The aim of this study was to evaluate drone reproductive qualities during the queen-rearing season, from May to August. Drones from two different genetic lines were reared six times during the 2012 beekeeping season at our research center in Quebec (Canada). Semen volume as well as sperm number and viability were assessed at the age of 14, 21 and 35 days. Results showed 1) a greater proportion of older drones with semen at the tip of the genitalia after eversion; 2) an influence of rearing date on semen production; and 3) no influence of drone genetic line, age or time of breeding on sperm viability. These results highlight the necessity of better understanding drone rearing and how it can be optimized to ensure optimum honey bee queen mating.
28
2.1. Introduction
The polyandrous mating system of the European honey bee, Apis mellifera Linnaeus (Hymenoptera: Apidae), is unique among domesticated animals (Tarpy and Page 2000; Koeniger 1990). Young queens make 1 to 3 nuptial flights to a drone congregation area (Schluns et al. 2005; Tarpy and Page 2000). A study by Baudry et al. (1998), reported the presence of thousands of drones from 238 colonies in a single day at the congregation area. On average, 14 drones mate with the queen and then die (Estoup et al. 1995). Once she has mated, the queen returns to the hive with approximately 80-90 million spermatozoa in her lateral oviducts (Woyke 1962). An average of 4 to 7 million spermatozoa reaches the spermatheca, where they are stored until used by the queen (Roberts and Mackensen 1951; Woyke 1962).
In recent years, high numbers of deficient queens, i.e. with incidence of early supersedure, unexplained death, premature drone egg laying or interruption of egg laying, have been reported worldwide (Camazine et al. 1998; Rhodes 2008; vanEnglesdorp and Meisner 2010). Epidemiological surveys from the United States and Canada have identified poor queen quality as one of the main concerns for the honey bee industry (vanEngelsdorp et al. 2010, 2011; vanEngelsdorp and Meisner 2010). In their queen mating health study, Tarpy et al. (2012) found that commercially produced queens in the USA show significant variations in viable sperm, with some queens having spermatheca containing less than 20% live sperm. This phenomenon has also been observed in southeastern Australia (Rhodes et al. 2004). There, Rhodes et al. (2010) also found a low number of mature drones and a relatively low average number of sperm per drone. They suggested these particularities may contribute to the low number of sperm in the spermatheca of commercially-produced queens.
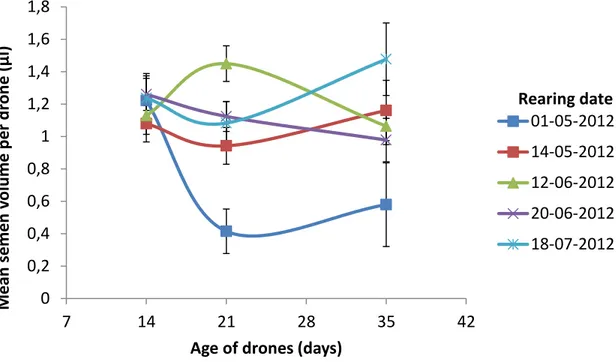
The mating success of queens has been linked to male numbers and sperm quality at the drone congregation area (Cobey 2007; Nur et al. 2012). Several studies have shown that drone age, rearing date and genetic origin affect semen properties (Woyke and Jasinski 1978; Locke and Peng 1993; Zaitoun et al. 2009). Woyke and Jasinski (1978) showed that the number of spermatozoa entering the spermatheca of inseminated queens tends to decrease as drone age increases; 4,097 million spermatozoa were found in queens’ spermatheca inseminated with semen from 2-week old drones, compared to 3,175 million in queens inseminated with semen from 9-week old drones. Zaitoun et al. (2009) found that colonies produced drones from February to July in the semiarid conditions of Jordan. They also found that drones reared in May (swarming period) weighed more, had the highest sperm counts, higher fertility levels (defined as the presence of semen after manual eversion of drones) and less sperm abnormalities than drones sampled during the rest of the year. Drone genetics seem to influence most aspects of sperm production and properties (Rhodes et al. 2010), including semen volume and number of sperm produced by each drone.
29 In northern climates such as that of eastern Canada, beekeeping is characterized by a long overwintering period, followed by one of the shortest active seasons for the honeybee (May to September) around the world. The races commonly bred have been selected for several features essential for high survival rates in this climate. To our knowledge, no information on drone reproductive qualities in northern climates exists, despite the particularities of these environmental conditions. The aim of this study was to evaluate semen quality of drones with different genetic origins, at different ages and at different seasonal breeding periods.
30
2.2. Materials and methods
2.2.1. Drone rearing and sampling
This study was conducted at the Centre de Recherche en Sciences Animales de Deschambault (CRSAD, Deschambault, N 46°40.27', W 10°71.50'), Quebec, Canada. Mature drones were obtained from honey bee colonies with open-mated queens belonging to two different lines: hybrid Italian stock N=4 colonies (Rustique Apiculture, Quebec, Canada) and Buckfast stock N=4 colonies (Keld Branstrup, Denmark). All colonies were fed sucrose syrup 1:1 and protein supplement patties (Global Patties Inc., standard 15% pollen patty) during April before the beginning of drone rearing.
Six successive batches of drones were bred during the 2012 beekeeping season (May 1 and 14, June 12 and 20, July 18 and 28). Drones were obtained by isolating each queen for 48 hours within a queen exclusion cage which allowed nurse bees to feed the queen freely. Each cage held a drone brood cell frame placed in the centre of the brood chamber. After this period, queens were freed from the excluder cage and drone broods were removed and replaced in the centre of the brood chamber. Upon emergence, 300 young drones were marked with a water-based Posca® pen on their upper thorax and returned to their respective colonies. Different colours were used to distinguish different drone cohorts within each colony. Marked drones were released in the honey super and prevented from leaving their colony by placing a queen excluder between the brood chamber and the honey super, which allowed workers to move freely between the two, while confining drones to the honey super.
Thirty marked drones were collected at 14, 21 and 35 days after emergence for semen analysis. When captured, drones were kept alive in a flight cage with young nurse bees and a small incandescent light until evaluation (within 1 hour). In this cage, drones were able to fly and defecate, which helps initiate semen ejaculation (Collins 2004).
31
2.2.3. Semen volume
Semen collection was accomplished by manual eversion of sexual organs as described by Woyke (2008). We selected this technique because it has been used in several studies assessing properties of drone semen (Collins and Donoghue 1999; Gençer et Kahya 2011; Nur et al. 2012; Rhodes et al. 2010) and is also commonly practiced for semen collection in instrumental insemination of honeybee queens (Harbo 1985; Mackensen et Tucker, 1970; Laidlaw 2008).
An initial vertical pressure on the head of the drone with the thumb and index finger produced partial
eversion of the endophallus. Subsequent horizontal pressure from the anterior to the posterior of the
abdomen resulted in full eversion of the genitals. In mature drones, semen is cream-colored and
found at the tip of the genitalia on a bed of white mucus. Using a Harbo Large Capacity Syringe (GS
1100, Fisher Scientific), semen was collected from five drones in each colony for each combination of
drone breeding date and age. Semen was collected only from drones producing at least 0.2 μl (the
minimum amount required for the syringe) and volume was recorded to the nearest 0.1 μl. Care was
taken to avoid mucus collection. Semen from each drone was stored in a separate glass capillary
tube until sperm quality analysis could be performed later on the same day, i.e. within 12 hours of
collection.
2.2.4. Sperm count
Sperm count was conducted using a Neubauer Improved Haemacytometer, BS.748 (depth 0.1 mm, 1/400 mm2). A semen volume of 0.2 µl was diluted in 1.5 ml Tris buffer in a sterile Eppendorf and gently mixed by inversion (Dilution factor = 7500). Sperm were counted in 5 squares (0.1 mm3 = 0.1 µl) at the 4 corners and centre of each end of the haemocytometer, and counts were repeated 3 times (with new slide preparations) under a light microscope at 400x magnification for a total number of sperm in 15 squares for each drone. To obtain sperm numbers per drone, the following formula was applied:
32
2.2.5. Sperm viability
Sperm viability was assessed the day of semen collection using a Live/Dead Sperm Viability Kit (L-7011, Molecular Probes) and a modified version of the method used by Collins and Donoghue (1998). For each drone pool, we used 0.2 µl of semen for the sperm count; the rest of the semen was diluted for the viability test in an individual Eppendorf containing 40 µl Tris Buffer and mixed gently. After allowing SYBR-14 and propidium iodide to thaw and come to room temperature, 1.5 µl of SYBR-14 was added to the semen dilution, mixed and allowed to stain 10 minutes. An additional 1.5 µl was added, mixed and allowed to stain 10 more minutes. In a separate analysis of each individual semen sample, 1.5 μl of stained semen solution was diluted in 1.5 µl Tris Buffer and mixed gently. A drop of this solution was placed on a slide preparation and sperm viability was assessed using a Zeiss Observer Z1 microscope equipped with fluorescence filters. For each slide, five different fields of view were observed (200x), photographed and saved. Five slides of coloured semen were prepared per drone. Each spermatozoid was scored as either alive (green), or, if sperm had lost membrane integrity, dead (red). For each drone, the mean viability percentage was obtained from the five slides.
2.2.7. Statistical analysis
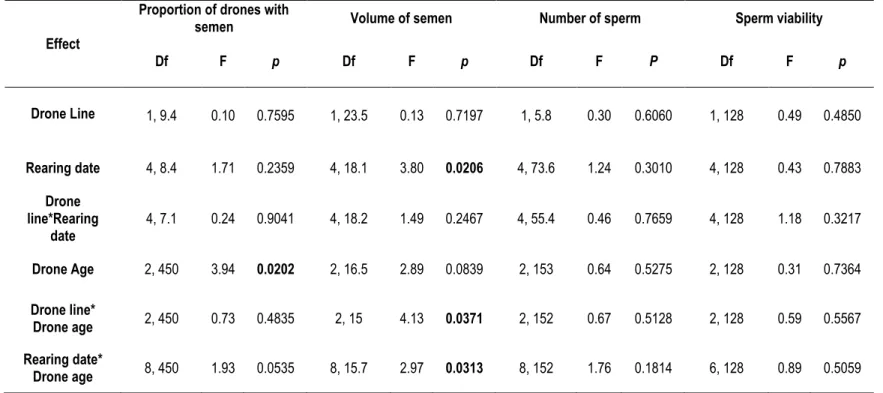
The probabilities of semen presence after manual eversion were compared across drone genetic lines, breeding dates and drone ages using a mixed logit model with repeated measures. Measurements were taken through drones across all breeding dates and drone ages in each colony, the latter being the experimental units for drone genetic lines. We integrated this variability between colonies by using data on individual drones instead of means data for each colony, and added a 4th error term in the model (4 error terms: line, rearing date, age and sampling error, which integrate the variability of pseudo repetitions). Values of semen volume, sperm count and sperm viability were analysed using a mixed Ancova model with the same repeated measurements. For each response variable, the best transformation was chosen among the Box-Cox family to meet the assumptions of the model. In the particular case of sperm viability, angular transformation was chosen, the recommended transformation for percentage variables (Sokal and Rohlf 1995).
When a significant effect was found in any analysis, multiple comparisons were performed using the protected Fisher’s LSD method. The normality assumption was tested using the Shapiro-Wilk’s statistic, while the homogeneity of variances was verified using traditional residuals plots. All analyses were performed at the 0.05 level of significance, and models were adjusted to data using SAS software (SAS Institute Inc., Cary, NC, release 9.4) via the Glimmix and Mixed procedures.