يولعلا ثحبلاو يلاعلا نيلعتلا ةرازو
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique دوحه تعهاـج
ويهاربلإا ريشبلا ي
جيريرعىب جرب
Université Mohamed El Bachir El Ibrahimi- B.B.A. ىىكلاو ضرلاا مىلعو ةايحلاو تعيبطلا مىلع تيلك
Faculté des Sciences de la Nature et de la Vie et des Sciences de la Terre et de l’Univers تيجىلىيبلا مىلعلا نسق
Département des Sciences Biologique
Mémoire
En vue de l’obtention du Diplôme de Master
Domaine : Sciences de la Nature et de la Vie
Filière : science biologique
Spécialité : Microbiologie appliquée
Intitulé
Présenté par : ALLAL Kenza
HAMMA Loubna
Soutenu le: Juillet 2019
Devant le jury :
Président :
M
rMERIBAI Abdelmalek M.C.B. Université de BBA
Encadrant :
M
rSADRATI Nouari M.A.A. Université de BBA
Examinateur :
Mme
IRATNI Nadjet M.A.A. Université de BBA
Année universitaire : 2018/2019
Activités biologiques d’un champignon endophyte
Penicillium sp. isolé à partir d’une plante médicinale
Remerciements
Tous nous remerciements vont d’abords à nôtre DIEU le tout puissant, pour nous avoir donnée
la force et la patience.
Nous tenons a exprimer notre grande gratitude à nos encadreur SADRATI Nouari et Madame
ZERROUG Amina.
Nous remercions infiniment l’ingénieur du laboratoire de phytopathologie monsieur KHALIL, et
Madame WAHIBA ingénieur du laboratoire de microbiologie.
Nous souhaitons également adresser nos sincères remerciements aux Messieurs les membres
du Jury;
A monsieur MERIBAI Abdelmalek de nous avoir honoré de présidé le jury
A Madame IRATNI Nadjet d’avoir accepté d’être notre examinateur
Dédicaces
A mes très chers parents, pour leurs aide, soutien moral et leurs
encouragements tout au long de mes années d’études, que Dieu les protège».
A mon très cher frère AYMEN et mes très chères sœurs NIHADE et
HADILE, pour lesquels je souhaite une longue vie pleine de joie, de santé et
de bonheur, que Dieu les garde.
La grande dédie a mon mari MOHAMED ABD EL GHANI pour son
encouragement et son aide, que Dieu le garde et que la vie nous unisse à
jamais.
À toute famille de mon mari surtout HAYAT et FAYZA.
A mes très chères amies « KENZA, SAMIA, YOUSRA, NAWEL,
BESMA».
Je dédie ce modeste mémoire
Dédicaces
Au nom du Dieu clément et miséricordieux et que le salut du Dieu soit sur son prophète
MOHAMMED
Je dédie ce Modest travail A tout qui sont les plus chère au monde :
«A mes très chers parents, pour leurs aide, soutien moral et leurs
encouragements tout au long de mes années d’études, que Dieu les
protège».
A mes très chers frères Akram avec sa femme Nawal,Omar,Halim avec sa femme Zohra et ses
enfants Hocine et Sabrine et mes très chères sœurs Fatima ,Rahma,Warda Avec leurs maris et
leurs enfants, pour lesquels je
souhaite une longue vie pleine de joie, de santé et de bonheur, que Dieu les garde.
À toute ma famille et à tous ceux qui m'ont soutenu dans ma carrière universitaire
À mes chers amis Souhaila Loubna Yousra Samia Basma Nawal et sa famille et tous mes
collègues de spécialité microbiologie appliquée
فدهت هذه ةساردلا ىلإ ةسارد طاشنلا داضملا تابوركٌملل طاشنلاو ًمٌزنلإا رطفلل Penicillium sp. يذلا مت هلزع هعمجو نم ةقطنم جرب جٌرٌرعوب ( رئازجلا .) مت ذٌفنت طاشنلا داضملا تابوركٌملل ىلع 21 نم اٌرٌتكبلا ةببسملا ضارملأل ؛ناسنلإل ةتس عاونأ نم اٌرٌتكبلا ةٌباجٌإ ،مارغلا ةتسو نم اٌرٌتكبلا ةٌبلس ،مارغلا عون نم رئامخلا ةثلاثو عاونأ نم تاٌرطفلا ةببسملا ضارملأل ةٌتابنلا . مت روثعلا ىلع MEA لضفأك طسو قٌقحتل ىصقأ جاتنإ تابكرملل ةطشنلا ةداضملا اٌرٌتكبلل طسوتمب قطانم طٌبثت ( 1.42 مم ) ةنراقم طئاسولاب ةبلصلا ىرخلأا ةلاخن زرلأا ( .424 مم ) ةلاخنو حمقلا ( 0 مم ) دعب رٌمختلا صلاختسلااو لامعتساب ةثلاث تابٌذم ن -ناسكه مروفورولكلاو و لٌثٌإ ،تاتٌسأ مت لوصحلا ىلع ربكأ طبثت ةطساوب لٌثٌإ تاتٌسأ ةنراقم عم ن -ناسكه مروفورولكلاو عم طسوتم طٌبثت ( 21431 مم ) ( اقفو جئاتنل طاشنلا داضملا ،تاٌرطفلل نإف صلختسم لٌثٌإ تاتٌسلأا طبثٌ ةوقب
Fusarium oxysporium fs. Albedinis اهٌلت Aspergillusniger ، Alternariasp. ةرٌمخلاو C. albicans عم قطانم طبثت 2. و 10 و 22 و 2. ملم ىلع ًلاوتلا . تناك Escherichia coli ًه رثكأ عاونأ اٌرٌتكبلا ةٌساسح ( 12 مم ) ، ًف نٌح تناك اٌرتكب Pseudomonas aeruginosa رثكلأا ةمواقم ( 20 ملم .) ترهظأ جئاتنلا نأ Penicillium sp. هل طاشن داضم مٌثارجلل عساو فٌطلا وهو لاعف دض اٌرٌتكبلا ةبجوم ا مارغل طسوتمب ةقطنم طٌبثت ( 13482 مم ) ةنراقم عم اٌرٌتكبلا ةبلاس مارغلا ( 124.2 ملم ) . رطفلا ًلخادلا Penicillium sp. رهظأ شن طا ًمٌزنا ماه زابٌللل ،زارتسلإاو ثٌح تناك تارشؤملا ةٌمٌزنلأا .42. و 1411 ىلع ًلاوتلا . نم ةٌحان ،ىرخأ مت مت لوصحلا ىلع طاشن طسوتم زولٌلسلل زاٌتوربلاو رشؤمب ًمٌزنلا 14.8 و 2420 ىلع ًلاوتلا . جئاتنلا لصحملا اهٌلع رٌشت ىلإ نأ رطفلا ًلخادلا Penicillium sp. نكمٌ نأ نوكٌ اردصم ادعاو تابكرملل ةطشنلا اٌجولوٌب دض تاببسم ضارملأا و جاتنإ تامٌزنلإا ًتلا نكمٌ نأ دعاست ًف فاشتكا ةٌودأ ةدٌدج تائٌزجو ىرخأ تاذ ةٌمهأ ةٌجولونكتوٌب . تاملكلا ةيحاتفملا : تاٌرطفلا ،ةٌلخادلا موٌلٌسنبلا . ، طاشنلا داضملا ،تابوركٌملل طاشنلا ،ًمٌزنلأا تائٌزجلا ةطشنلا اٌجولوٌب .
La présente étude a pour but d’étudier l’activité antimicrobienne et enzymatique d’un champignon endophyte Penicillium sp. qui a été isolé d’une plante médicinale collectée de la région de Bordj Bou Arréridj (Algérie). L’activité antimicrobienne a été effectuée contre 12 bactéries pathogènes pour l’homme; six à Gram positif et six à Gram négatif, une levure et trois espèces fongiques phytopathogènes. Le MEA était le meilleur milieu donnant une production maximale des composés bioactifs antibactériens avec une moyenne des zones d’inhibition de 24.5 mm par rapport aux autres milieux solides à base de son de riz (4.16 mm) et son de blé (0 mm). Après la fermentation et l’extraction par trois solvants de différentes polarités, n-hexane, chloroforme et acétate d’éthyle, l’effet antibactérien le plus grand a été obtenu par l’extrait d’acétate d’éthyle avec une moyenne d’inhibition de 13,83 mm. Selon les résultats de l’activité antifongique, l'extrait d’acétate d'éthyle à inhiber fortement Fusarium oxysporium fs. Albedinis avec une moyenne des zones d’inhibition de 54 mm suivie par Aspergillus niger, Alternaria sp.et la levure Candida albicans avec des zones d'inhibition de 20,15 et 14 mm respectivement. Escherichia coli était la bactérie la plus sensible (35 mm), tandis que Pseudomonas aeruginosa était la plus résistante (10 mm). Les résultats ont montré que Penicillium sp. a une activité antibactérienne plus efficace contre les bactéries à Gram positif avec une moyenne des zone d’inhibition de 28.91 mm par apport aux bactéries à Gram négatif (25.41 mm). Le champignon endophyte Penicillium sp. a montré des activités enzymatiques significatives de la lipase et de l’estérase, où les indices enzymatiques (IE) étaient respectivement de 4,14 et 3,32. Par contre, les activités cellulosiques et protéolytiques étaient modérées avec un IE de 2,79 et 1,50, respectivement. Nos résultats suggèrent que le champignon endophyte Penicillium sp. peut offrir une source prometteuse pour la production des composés bioactifs contre les agents pathogènes et les enzymes qui pourraient aider à la découverte des nouveaux médicaments et autres molécules d’intérêt biotechnologique.
Mots clés: champignons endophytes, Penicillium sp., activité antimicrobienne, activité
The present study aims to study the antimicrobial and enzymatic activity of the endophytic fungus Penicillium sp. which has been isolated and collected from the Bordj Bou Arréridj region (Algeria). The antimicrobial activity was carried out on 12 pathogenic bacteria for humans; six gram-positive, six gram-negative, one yeast and three phytopathogenic fungal species. MEA was found to be the best medium for maximum production of antibacterial bioactive compounds with an average of inhibition zones (24.5 mm) compared to other solid media, rice bran (4.16 mm) and wheat bran (0 mm). After fermentation and extraction with three solvents n-hexane, chloroform and ethyl acetate, the largest effect of the solvents was obtained by ethyl acetate than n-hexane and chloroform. with a mean of inhibition (13.83 mm). According to the results of the antifungal activity, the ethyl acetate extract strongly inhibited Fusarium oxysporium fs. Albedinis followed by Aspergillus niger, Alternaria sp. and Candida albicans with inhibitory zones of 54, 20, 15 and 14 mm, respectively. Escherichia coli was fond the most sensitive bacterium (35 mm), while Pseudomonas aeruginosa was the most resistant (10 mm). The results showed that Penicillium sp. has broad-spectrum antibacterial activity and is effective against Gram-positive bacteria with an average of the inhibition zone (28.91 mm) compared to the Gram-negative bacteria (25.41 mm). Endophytic fungus Penicillium sp. showed significant enzymatic activities of lipase and esterase, where the enzymatic indices (IE) were 4.14 and 3.32 respectively. On the other hand, cellulosic and proteolytic activities were weak with an IE of 2.79 and 1.50, respectively. Our results suggest that the endophytic fungus Penicillium sp. can offer a promising source for the production of bioactive compounds against pathogens and enzymes that could help to discover new drugs and other molecules of biotechnological interest.
Key words: endophytic fungi, Penicillium sp., Antimicrobial activity, enzymatic activity,
INTRODUCTION………...………..1
CHAPITRE I: Synthèse bibliographique I.1. Les champignons endophytes………...………2
I.1.1. Endophyte: l’origine, l’évolution d’un terme et clarification de son utilisation et de sa définition………..…….2
I.1.2. La biologie et la diversité écologique des champignons endophytes………..…….2
I.1.3. Mode de reproduction et de transmission………..……..4
I.1.3.1. Croissance végétative des hyphes………..………....4
I.1.3.2. Croissance par biais des spores………..…....4
I.1.4. Spécificité de l’hôte………..5
I.1.5. Spécificité des tissus……….…....6
I.1.6. La nature de l’interaction plante/champignons endophytes………..7
I.1.6.1. Généralité du mutualisme endophytes………...8
I.1.7. Rôles des champignons endophytes et plante hôte……….…..8
I.1.7.1. Rôles physiologiques des endophytes……….…..9
I.1.7.1.1. Facilité d’accès aux nutriments……….………....9
I.1.7.1.2. Rôles dans la protection des plantes hôtes contre leurs ennemis naturels…………...9
I.1.7.1.2.1. La protection contre les agents phytopathogènes……….…..9
I.1.7.1.2.2. La protection contre les insectes………10
I.1.7.2. Rôles des endophytes dans la tolérance de l’hôte aux stress biotique et abiotiques……….10
I.1.7.3. Rôles écologiques des endophytes………...11
I.1.8. Endophytes source de métabolites bioactifs………...12
I.1.8.1. Champignons endophytes comme source de substance antibacterienne………..12
I.1.8.2. Champignons endophytes comme source de substance antifongique………..13
I.1.8.3. Champignons endophytes comme source de substance antivirale………...14
I.1.8.4. Champignons endophytes comme source de substance anticancéreuse...14
CHAPITRE II: Matériel et méthodes
II.1 Matériels……….……17
II.1.1 Matériel microbien……….….17
II.1.2 Produits chimiques……….17
II.2.Méthodes………..18
II.2.1. Echantillonnage et isolement………18
II.2.2 Dépistage initial de l'activité antimicrobienne………...18
II.2.2.1 Préparation des microorganismes tests………...18
II.2.2.2 Criblage préliminaire de l’activité antimicrobienne………....18
II.2.3 Sélection de milieux de culture appropriés………20
II.2.4 Fermentation et extraction……….20
II.2.5. Evaluation de l'activité antimicrobienne des extraits bruts……….…..23
II.2.6. Activité enzymatique………23
II.2.6.1. Activité estérasique………24
II.2.6. 2. Activité protéolytique………24
II.2.6. 3. Activité cellulolytique………...24
II.2.6. 4. Activité lipolytique………24
II. 2. 7. Analyse statistique………..24
CHAPITRE III: Résultats et discussion III.1. Dépistage initial de l'activité antimicrobienne………26
III.2. Sélection de milieux de culture appropriés……….29
III.3. Détermination de l'activité antibactérienne des extraits bruts………31
III.4.Détermination de l’activité enzymatique……….36
Conclusion………...38 Références bibliographiques
N° Titre Page Tableau I Critères symbiotiques utilisés pour caractériser les différentes classes
d’endophytes fongiques. 03
Tableau II Pourcentages d’inhibition de la croissance des trois champignons
phytopathogènes en double culture . 27
Tableau III Les zones d’inhibition du champignon endophyte sur les cinq milieux
utilisés PDA, SDA, YES, MEA, YMEA. 31
Tableau IV Activité antifongique de l'extrait de l'acétate d'éthyle, n-hexane et le
chloroforme. 33
N° Titre Page Figure 1 Mode de transmission des champignons endophytes. 05
Figure 2 Quelques substances antimicrobiennes produites par les champignons
endophytes. 13
Figure 3 Structure chimique de paclitaxel. 14
Figure 4 Isopestacine, un antioxydant produit par l’endophyte Pestalotiopsis
microspora isolé à partir Terminalia morobensis. 15
Figure 5 Pestacin un antioxydant produit par l’endophyte P.microsporas isolé
à partir T. morobensis. 16
Figure 6 Cultures pures de champignons endophytes cultivées sur (PDA)
pendant 3 semaines. 19
Figure 7 Technique de diffusion sur gélose. 19
Figure 8 Le protocole d’extraction des métabolites secondaires du champignon
endophyte en milieu solide et en milieu liquide. 22
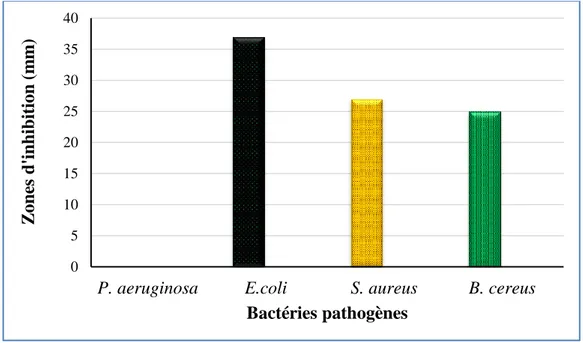
Figure 9 Zones d’inhibition des bactéries pathogènes par le champignon
endophyte. 26
Figure 10 Le dépistage de l’activité antibactérienne du champignon endophyte
contre quatre bactéries pathogènes. 27
Figure 11 Activité antifongique de penicillium sp. sur Aspergillus niger. 28
Figure 12 Activité antifongique de penicillium sp. sur Fusarium oxysporium fs.
Albedinis. 28
Figure 13 Activité antifongique de penicillium sp. sur Alternaria sp. 28
Figure 14 Les moyennes des zones d’inhibitions du champignon endophyte
Penicillium sp. obtenus sur les cinq différents milieux PDA, SDA, YES, MEA, YMEA.
29
Figure 15 Effet des différents milieux de culture sur l’efficacité de l'activité
antibactérienne de Penicillium sp. 30
Figure 16 Choix de type du milieu et de solvant. 32
Figure 17 Les zones d’inhibition de l'extrait de l'acétate d'éthyle contre les trois
Figure 19 Comparaison de l'effet de l'extrait de l'acétate d'éthyle contre les
bactéries à Gram+ et à Gram-. 35
Figure 20 La production des enzymes extracellulaires (lipase, estérase, cellulase
et protéase) par l’endophyte Penicillium sp.. 36
Figure 21 La production d'enzymes extracellulaires par l’endophyte Penicillium
AE Acétate d’Ethyle
CHL Chloroforme
DMSO Dimethylsulfoxide
GN Gélose Nutritive
HA Habitat-Adapted
MEA Malt Extract Agar
MEB Malt Extract Broth
N-H N-Hexane
NHA Non Habitat-Adapted
PDA Potato Dextrose Agar
PDB Potato Dextrose Broth
SDA Sabouraud Dextrose Agar
UFC Unité Formant Colonie YES Yeast Extract Sucrose Agar YMEA Yeast Malt Extract Agar
1
Introduction
La découverte de la pénicilline dans la première moitié du 20ème siècle et tous les antibiotiques développés par la suite sans aucun doute représente l'une des réalisations les plus importantes en médecine. Ces médicaments ont sauvé des millions de vies
(González-Bello, 2017). Malheureusement, la capacité de ces médicaments pour soigner les maladies
infectieuses est maintenant en grave danger en raison de l’émergence et la propagation dans le monde entier de souches qui sont multirésistantes aux antibiotiques. Une recherche intensive des nouveaux agents antimicrobiens efficaces est nécessaire.
Les champignons endophytes sont considérés comme un important réservoir de nouveaux métabolites secondaires bioactifs (Strobel et al., 2004), Ces substances naturelles produites possèdent un large spectre d’activité biologique (Zhang et al., 2006), comprenant des composés antibiotiques, antifongiques, antiviraux, immunosuppresseurs, agents anticancéreux, antioxydants, insecticides et autres substances biologiquement actives (Strobel
et Daisy, 2003; Strobel et al., 2004).
Les microorganismes endophytes (champignons et bactéries) sont ceux qui habitent à l'intérieur d'une plante au moins à une période de leur cycle de vie, et se retrouvent dans les tissus tels que les feuilles, les branches et les racines. Apparemment, ils ne causent aucun dommage à l'hôte, ce qui les distingue des microorganismes phytopathogènes. Leur présence impliquait une interaction symbiotique, dans toutes les plantes étudiées jusqu’à présent
(Carrim et al., 2006).
L’objectif principal de cette étude est l’évaluation de l’activité antimicrobienne et enzymatique d’une souche fongique endophyte Penicillium sp. isolé à partir d’une plante médicinale collectée de la région de Bordj Bou Arréridj (Algérie).
Ce travail est structuré en 3 parties:
La première partie est consacrée à une revue bibliographique mettant l’accent sur les champigons endophytes.
La deuxième partie illustre le matériel et les méthodes utilisées.
Ainsi qu’une troisième partie démontrant les résultats obtenus en ce qui concerne les différentes expériences effectuées.
2
I.1. Les champignons endophytes
I.1.1. Endophyte: Origine, évolution et définition
De Barry (1866), est le premier qui a introduit le terme endophyte. En traduction
littérale, ce mot endophyte est dérivé du grec: « Endo » ou « Endon » c’est-à-dire « intérieur », et « phytes » ou « phyton » c’est-à-dire « plante ». Dans « the dictionnary of the fungi », le mot « Endophyte » désigne l’organisme qui vit dans la plante (Pirttila, 2001;
Schulz et Boyle, 2006).
Depuis lors, le terme endophyte est devenu profondément ancré dans la littérature et différents auteurs ont proposé d’autres définitions similaires, mais plus complexes comme les définitions de Carroll (1986), Petrini, (1991) et Wilson (1993). La définition la plus complète serait que les endophytes sont des bactéries ou des champignons qui, durant tout ou une partie de leur cycle de vie, envahissent les tissus vivants des plantes. Ils causent des infections inapparentes et asymptomatiques, entièrement à l’intérieur des tissus végétaux, mais ne causent aucun symptôme de maladie (Wilson, 1995). Les champignons sont les microorganismes les plus fréquemment isolé en tant qu’endophytes (Strobel et al., 2004).
L’association entre la plante et l’endophyte est, le plus souvent mutualiste. On a longtemps pensé que ces champignons n’avaient aucune fonction, ni aucun intérêt. Cependant, les recherches ont commencé à s’intéresser aux endophytes (Moricca et Ragazzi,
2008) qu’on considère maintenant comme des sources de beaucoup de composés d’intérêt tels
les composés antimicrobiens, antioxydants, anticancéreux, insecticides, etc. (Maheshwari,
2006).
I.1.2. Biologie et diversité écologique des champignons endophytes
Depuis la découverte des endophytes à Darnel (Lolium temulentum), en Allemagne, en 1904 (Tan et Zou, 2001), divers chercheurs ont assimilé les endophytes de différentes manières, ce qui dépend généralement de la perspective dans laquelle les endophytes étaient isolés puis examinés. La nature asymptotique de l'occupation des endophytes dans les tissus des plantes a incité les chercheurs à s'intéresser aux relations symbiotiques ou mutualistes entre les endophytes et leurs hôtes. La biodiversité observée des endophytes suggère qu'il peut également s'agir de saprophytes agressifs ou d'agents pathogènes opportunistes.
Il s'avère que la grande majorité des plantes n'ont pas été étudiées pour leurs endophytes. Il existe donc d’énormes possibilités pour la récupération de nouvelles formes, de nouveaux taxons et biotypes fongiques. Hawksworth et Rossman (1987), ont estimé qu'il
3
pourrait y avoir jusqu'à 1 million d'espèces fongiques différentes, mais environ 100 000 seulement ont été décrites avec une moyenne d’environ 50 espèces d’endophytes par espèce de plante.
La plupart des champignons endophytes appartiennent à l’embranchement des Ascomycota; cependant certains appartiennent à d’autres taxons tels que les Deuteromycota, Basidiomycota, Zygomycota et Oomycota (Saar et al., 2001). Ils ont été isolés à partir de toutes les plantes étudiées à ce jour, des plantes allant des grand arbres (Oses et al., 2008), palmier (Frohlich et al., 2000), les graminées marines (Alva et al., 2002) et même à partir des lichens (Li et al., 2007).
En général, deux grandes groupes des champignons endophytes ont été identifiés, reflétant des différences dans la relation évolutive, la taxonomie, les plantes hôtes et les fonctions écologiques; les endophytes clavicipitacées (endophytes C), qui infectent certaines graminées; et les endophytes non clavicipitacées (endophytes NC), qui peuvent être récupérés à partir de tissus asymptomatiques de plantes non vasculaires, de fougères, de conifères et d'angiospermes.
Comme indiqué dans le tableau I, les endophytes NC représentent un ensemble très diversifié de champignons divisé en trois groupes fonctionnels basés sur un éventail de caractéristiques : les tendances de colonisation des endophytes, les mécanismes de transmission entre les générations d’hôtes, les niveaux de biodiversités dans les plantes et les fonctions écologiques. Contrastant avec cette diversité, les C-endophytes constituent la classe 1 (Rodriguez et al. ,2009).
Tableau I: Critères symbiotiques utilisés pour caractériser les différentes classes
4
I.1.3. Mode de reproduction et de transmission
Les endophytes possèdent deux modes de reproduction:
I.1.3.1. Croissance végétative des hyphes
Elle est accompagnée par la transmission verticale, la croissance se fait complètement à l’intérieur des tissus de la plante hôte (Selosse et Schardl., 2007). Ainsi les hyphes du champignon sont transmis de la plante infectée vers la descendance via les graines
(Saikkonen et al., 2004a).
Le transfert vertical par la graine a principalement été observée chez des endophytes fongiques de la famille des Clavipitacées colonisant les poacées, les cypéracées et les juncacées mais également chez plusieurs espèces graminoïdes telles Pinus spp., Vigna unguiculata, Theobroma caco, Castanea spp., Colophospermum mopane. Une telle transmission n’a pas été observée avec les endophytes fongiques ubiquitaires comme ceux appartenant aux genres Alternaria et Cladosporium (Tintjer, et al., 2008).
I.1.3.2. Croissance par biais des spores
Ce groupe de champignons se transmet horizontalement (Saikkonen et al., 2004), c'est-à-dire le champignon peut être transmis soit par spores sexuées ou asexuées (Saikkonen
et al., 2004b). En général ; la transmission horizontale des endophytes est associée aux tissus
photosynthétiques de la plante (la feuille) (Higgies et al., 2007). Ce mode de transmission nécessite la production des spores externes et leur dispersion aéroportée pour infecter d'autres plantes (Zabalgogeazcoa, 2008).
Les insectes phytophages peuvent également participer à la propagation des endophytes, car les spores de certaines espèces de champignons sont résistantes à la digestion intestinale, et sont présents dans leurs excréments. La transmission horizontale semble être le mécanisme prédominant de la dispersion des espèces endophytes (Zabalgogeazcoa, 2008)
5
Figure1: Mode de transmission des champignons endophytes (Saikkonen et al., 2004).
Epichloё, un champignon endophyte associé aux graminées provoquant une infection systémique peut être transmis soit verticalement, soit sexuellement par des spores (Saikkonen
et al., 1998). Le cycle asexué correspond à une transmission verticale : le mycélium du
champignon endophyte présent dans l’hôte pénètre dans la graine portée par la plante. La graine est disséminée, germe et forme un nouvel individu végétal, progéniture de l’hôte primaire qui est colonisé à son tour par le champignon. Le cycle sexué correspond à une transmission horizontale, le champignon endophyte présent dans l’hôte, après plasmogamie et caryogamie, forme un stroma sur lequel se développent les organes de reproduction sexuée. Les ascospores sont dispersées et permettent la colonisation de l’inflorescence d’une plante voisine. Le mycélium passe dans la graine nouvellement formée qui va être disséminée et germe.
Contrairement à Neotyphodium, un autre genre d’endophyte systémique des graminées qui lui, a totalement perdu sa capacité de propagation contagieuse et sa transmission est strictement verticale (Saikkonen et al., 2004b). Les graines produites par les graminées verticalement infectées par ces champignons donneront toutes des plantes asymptomatiquement infectées (Zabalgogeazcoa, 2008).
Pour les endophytes non systémiques des plantes ligneuses, la transmission se fait horizontalement provoquant généralement des infections locales très limitées, mais ils peuvent être trouvés aussi dans les graines et les glets (Wilson et Carroll, 1994) mais la transmission verticale est rare (Saikkonenet al., 1998).
I.1.4. Spécificité de l’hôte
La spécificité de l’hôte est une relation dans laquelle un micro-organisme est limité à un seul hôte ou un groupe d’espèces apparentées, cette spécificité implique qu’une interaction
6
biochimique complexe se produit entre l’hôte et ses endophytes associés (Holliday, 1998;
Strobel, 2003; Strobel et Daisy, 2003).
Certains champignons auraient une large gamme d’hôtes, tels que Alternerai, Penicillium et Periformosfora, qui ont des hôtes appartenant à des genres ou des familles de plantes différents, contrairement à d’autres endophytes comme par exemple Neotyphodium qui est un champignon endophyte ayant une gamme d’hôtes restreinte, elle est limitée à une ou deux espèces végétales (Zabalgogeazcoa., 2008).
Les relations d'endophytes fongiques avec une ou plusieurs plantes hôtes sont souvent décrites en termes de spécificité d'hôte, exclusivité d’hôte, récurrence et / ou sélectivité d’hôte. La spécificité d’hôte décrit la relation spécifique à un hôte unique ou un groupe d'espèces apparentées et qui ne se produit pas avec des plantes non apparentées dans le même habitat.L’exclusivité d’hôte est l'apparition exclusive d’un événement strictement Champignon saprobique sur un hôte particulier ou sur un nombre restreinte de plantes hôtes apparentées. La fréquence de l'apparition d'un endophyte sur un hôte particulier ou la gamme d'hôtes de plantes est souvent définie comme une récurrence d'hôte. Ce terme prend en compte le fait que l’endophyte peut également se produire sur d'autres plantes hôtes dans le même habitat (Petrini, 1991; Stone et al., 2000; Zhou et al., 2001). Une seule espèce d’endophyte fongique peut également établir des relations avec deux espèces de plantes apparentées, mais démontrer une préférence pour l'une des espèces, cette relation est appelée sélectivité d’hôte.
Nombreuses sont les études qui permettent de dire que les facteurs environnementaux, tels que l’application d’engrais, le stress hydrique et des régimes d’humidité saisonnière, en plus de l’identité de l’espèce de l’hôte, peuvent avoir un effet sur les communautés de champignons endophytes (Suryanarayanan et al., 2002; Seghers et al., 2004; Gonthier et
al., 2006; Fujimura et al., 2008). L’interaction de ces deux facteurs peut aussi avoir un
impact significatif sur la composition endophytique; ( Hoffman et Arnold 2008) ont constaté qu’il y’avait une similitude relativement faible entre les communautés d’endophytes de différentes espèces de la famille des Cupressaceae qui se trouvaient dans la même localité, et entre celles de la même espèce hôte dans différentes localités, contrairement à ce qu’ils ont trouvé pour la même espèce hôte dans la même localité où ils ont observé une grande similitude.
I.1.5. Spécificité des tissus
Beaucoup d’endophytes infectent localement des parties de la plante, se limitant à une petite zone du tissu (Zabalgogeazcoa., 2008). Certains endophytes peuvent être trouvés dans
7
des parties de plantes spécifiques telles que les racines, feuilles, tetis que d’autres peuvent infecter plusieurs de ces pièces, comme les espèces systémiques Neotyphodium et Epichloё infectant les espaces intercellulaires des feuilles, les tiges et les graines de leurs hôte, ils peuvent être isolés à partir de différentes parties de la même plante (Zabalgogeazcoa., 2008). Parfois, les composés chimiques de certains tissus peuvent altérer la colonisation de différents champignons endophytes, cependant certains de ces endophytes peuvent tolérer certaines toxines produites par l’hôte, ce qui influe sur l’abondance, la diversité et la composition en espèces des communautés fongiques (Hammerschmidt, 1999, Osbourn.,
1999, Vanetten et al., 2001 ; Osbourn et al., 2003;). Il y a aussi l’âge de l’hôte ; avec le
temps, les tissus âgés de la plante hôte accumulent de plus en plus d’endophytes contrairement aux tissus jeunes (Zabalgogeazcoa, 2008).
I.1.6. La nature de l’interaction plante/champignons endophytes
Les associations plante-champignon sont le plus souvent assez stables tout au long de la vie de la plante. Elles sont souvent considérées comme mutualistes même si trois types d’interactions peuvent être constatées (Repussard et al., 2013):
- Type I. Antagoniste
La phase de reproduction sexuée de la plante est supprimée par la formation de stromas épiphytes sur les inflorescences en développement. Ceci permet la transmission horizontale du champignon endophyte via une phase de reproduction sexuée et la libération d’ascospores. Les symptômes sont typiques et connus sous le nom de « quenouille » en français ou « choke » (étrangleur) en anglais. Quelques exemples de ce genre d’association sont Epichloe typhina et Dactylis glomerata L., E. glyceriae et Glyceria striata.
- Type II. Pleïotropique
Les stromas se forment sur certaines thalles alors que sur d’autres le champignon se développe dans l’inflorescence qui produit des graines infectées. Cette association, intermédiaire entre les types I et III, est assez fréquente, c’est le cas de Epichloe festucae et Festuca rubra, Epichloe amarillans et Agrostis hiemalis.
- Type III. Mutualiste
Le champignon endophyte croît dans l’ovule en développement au sein d’une inflorescence et « infecte » les semences. Tout au long du développement de la plante, le mycélium est sous une forme strictement endophyte, sa reproduction est asexuée. Ce type de
8
d’interaction se retrouve chez Neotyphodium coenophialum et Lolium arundinaceum, Neotyphodium lolii et Lolium perenne.
Certaines de ces associations peuvent conduire à la synthèse de mycotoxines. La production dans la plante hôte est sous l’influence de différents facteurs tel le génotype de la graminée, le type d’association hôte-endophyte et des facteurs externes tels que le pédoclimat, les apports minéraux ou encore hydriques (Repussard et al., 2013).
I.1.6.1. Généralité du mutualisme endophytes
Les caractéristiques qui pourraient signaler une relation mutualiste entre l’endophyte et son hôte sont (George, 1998):
1) L'endophyte est omniprésent chez un hôte donné sur une vaste étendue géographique et provoque des symptômes minimes de maladie chez la plante hôte.
2) La transmission verticale du champignon se produit à travers la graine hôte ou les propagules végétatifs. Si la transmission des semences ne se produit pas, la transmission horizontale doit être efficace.
3) Le champignon se développe dans les tissus de l'hôte. Si les unités de la section sont dispersées, elles doivent être nombreuses ; si confiné à un organe particulier, une proportion élevée des organes devrait être infectée.
4) Le champignon produit des métabolites secondaires de nature antibiotique ou toxique. 5) L'endophyte est taxonomiquement apparenté à des antagonistes connus des herbivores ou des agents pathogènes (Acremonium, Phomopsis, Lophodermium).
I.1.7. Rôles des champignons endophytes et plante hôte
Les champignons endophytes jouent des rôles vitaux dans divers aspects de vie qui varient de ses effets sur les plantes-hôtes à ses effets sur l’environnement et la vie humaine
(Selim et al., 2012). Une telle interaction bénéfique pourrait être présentée sous trois aspects
différents :
Tout d'abord, certains champignons endophytes pourraient produire différentes hormones végétales pour améliorer la croissance de leurs plantes hôtes. Par exemple, la croissance du blé (Triticum aestivum L.) pourrait être renforcée par Azospirillum sp. sous stress de sécheresse.
Deuxièmement, certains champignons endophytes produiraient différents composés bioactifs, tels que les alcaloïdes, les diterpènes, les flavonoïdes et les isoflavonoïdes, pour augmenter la résistance aux stress biotiques et stress abiotiques de leurs plantes hôtes.
9
Troisièmement, certains champignons endophytes pourraient favoriser l'accumulation de métabolites secondaires par les plantes (Beatriz et Taides, 2017).
I.1.7.1. Rôles physiologiques des endophytes
Grâce aux interactions avec la plante hôte, les champignons endophytes jouent plusieurs rôles bénéfiques qui contribuent à la santé de l’hôte et directement ou indirectement induisent une augmentation de la productivité des plantes, telle que la protection contre les micro-organismes pathogènes, les herbivores, la promotion de la croissance des plantes et la production de métabolites secondaires qui augmentent la résistance de la plante aux stress biotiques et abiotiques ( Beatriz et Taides, 2017).
I.1.7.1.1. Facilité d’accès aux nutriments
Les résultats ont montré que certains champignons endophytes pourraient augmenter la forme et la croissance des plantes hôtes en augmentant le taux d'hormones telles que l'acide indole-3-acétique, l'indole-3-acétonitrile et les cytokinines. Les champignons endophytes pourraient également favoriser la croissance de leur plante hôte en obtenant des éléments nutritifs tels que l'azote et le phosphore utile pour les plantes. Mycena dendrobii pourrait par exemple promouvoir la germination des graines et la croissance de la plante hôte Gastrodia elata en sécrétant de l'acide indole acétique. De plus, Metarhizium robertsii a transféré l'azote directement des insectes à ses plantes hôtes en passant par les hyphes. Fait intéressant, les résultats ont montré que la plupart des hormones ont été produites par des champignons endophytes isolés des racines des plantes hôtes. Quelques références ont également signalé que certaines champignons endophytes pourraient favoriser la croissance et la forme de la plantes hôtes en activant l'expression de certaines enzymes et des gènes. Par exemple, Piriformospora indica a augmenté la croissance des racines du tabac en stimulant l'expression de la nitrate réductase et de l’enzyme dégradant l'amidon (glucan-eau dikinase) (Min et al.,
2016).
I.1.7.1.2. Rôles dans la protection des plantes hôtes contre leurs ennemis naturels I.1.7.1.2.1. La protection contre les agents phytopathogènes
Plusieurs mécanismes peuvent être utilisés par les endophytes pour protéger la plante contre les agents pathogènes, telles que la compétition avec les agents pathogènes pour les
10
sites de colonisation et les nutriments, la production d’antibiotiques, l’induction de résistance dans la plante hôte (Beatriz et Taides, 2017).
Le contrôle biologique des phytopathogènes implique l’utilisation de microorganismes qui réduisent l’activité ou la survie des agents pathogènes chez les plantes. Les mécanismes de biocontrôle les plus couramment décrits sont l'antibiothérapie, la compétition pour l’espace, la compétition pour le fer et d’autres nutriments, le parasitisme et l’induction de résistance chez l'hôte (Beatriz et Taides, 2017).
I.1.7.1.2.2. La protection contre les insectes
La capacité des champignons endophytes à repousser les insectes, induire une perte de poids et de croissance, réduir le développement et même d'augmenter le taux de mortalité des organismes nuisibles, était corrélée avec la production de toxines.
Les champignons endophytes (Clavicipitaceae, Ascomycetes) synthétisent des alcaloïdes au cours de l’infection des plantes, réduisant la survie et le développement de Spodoptera frugiperda chez Graminae et Cyperaceae.
L'expression de la résistance des insectes peut être affectée par plusieurs facteurs, tels que les quantités actives d'allélochimiques, le génotype de la plante, la concentration des endophytes, la fertilité du sol et le génotype de l’endophyte. Le stress hydrique, la température, le pH du sol, les insectes nuisibles et d'autres facteurs peuvent également affecter la production et la concentration de toxines produites par l'endophyte (Rodriguez et al,
2009).
I.1.7.2. Rôles des endophytes dans la tolérance de l’hôte aux stress biotique et abiotiques
Les stress abiotiques, tels que la sécheresse, la salinité, températures extrêmes (chaleur et froid), toxicité des métaux lourds et le stress oxydatif sont des menaces sérieuses pour l'agriculture et entraîner une détérioration de l’environnement. Le stress abiotique est la principale cause de perte des cultures dans le monde, réduisant les moyens de rendements de plus de 50% pour la plupart des plantes cultivées (Monika et Rohit, 2014).
Les recherches ont montré que certains champignons endophytes pouvaient renforcer la résistance des plantes hôtes aux stress biotiques et abiotiques en produisant des composés bioactifs. Les champignons endophytes ont été considérés agir comme un type de déclencheur biologique qui active le système de défense de leur hôte. Par exemple, l’inoculation des
11
plantes cultivées par les champignons endophytes améliore la résistance et le rendement des cultures, et une certaine résistance aux agents pathogènes (Min et al., 2016).
I.1.7.3. Rôles écologiques des endophytes
Les endophytes fongiques font partie intégrante des communautés microbiennes communément associés aux plantes. Ils ont de nombreux rôles écologiques différents qui incluent le mutualisme, commensalisme et parasitisme (Carroll, 1988; Arnold, 2007;
Saikkonen, 2007; Sieber, 2007). Ils se produisent également sur une variété d’hôtes
comprenant des arbres, des arbustes, des herbes, mousses, fougères et lichens (Stone et al.
,2000; Zhang et al., 2006). Bien qu'il y ait beaucoup preuves des effets positifs que les
endophytes confèrent à certains hôtes tels que les graminées, il existe peu d’informations sur le rôle écologique que jouent les endophytes sur d’autres hôtes tels que les arbres.
La plupart des travaux sur les endophytes fongiques de plantes ont été effectués sur des graminées, notamment hautes herbes de fétuque et en se concentrant sur les espèces Acremonium ou Epichloë. Ces champignons sont importants pour la survie de l'hôte et de nombreuses données probantes appuient ce point de vue (Siegel, 1993; Siegel et al., 1987;
Clay 1988, 1990; Funk et al., 1993; Saikkonen et al.,1998). Cependant, il a été proposé que
cette association dépende des conditions environnementales et nutritionnelles disponibilité
(Müller et Krauss, 2005).
Si les ressources nutritionnelles sont limitées, L’association endophyte-hôte peut changer de mutualisme à commensalisme et même à l'antagonisme ou parasitisme. Par exemple, des performances améliorées ont été observées chez les plantes de Festuca pratensis infectés par les endophytes par rapport aux plantes non infectées sur un sol fortement fertilisé et arrosé. Au contraire, dans des conditions de manque d’eau et de nutriments, peu de talles, de racines inférieures et diminution de la biomasse totale ont été observées chez F. pratensis infecté par des endophytes. Dans des conditions de stress, les endophytes sont supposés agir en tant que commensalistes ou antagonistes (Stanosz et al., 2001; Desprez-Loustau et
al.,2006; Slippers et Wingfield, 2007).
Le génotype de l'hôte joue un rôle important dans l'association endophyte-hôte. Un endophyte pourrait ainsi agir en tant que mutualiste, antagoniste ou commensale selon le génotype de l’hôte. Par exemple, Redman et al. (2001) ont démontré que des espèces phytopathogènes bien connus dans le genre Colletotrichum, à savoir C. magna, C. coccodes, C. orbiculare, C. musae, C. lindemuthianum, C. gaminicola, C. glioesporiodes et C.
12
acutatum, ont un mode de vie mutualisme avec les cultivars de tomate et de poivron, et qui étaient connus pour ne pas être susceptibles à ces agents pathogènes.
I.1.8. Endophytes source de métabolites bioactifs
Les champignons endophytes produisent une variété de métabolites secondaires qui, contrairement aux métabolites primaires, jouent un rôle important dans les processus physiologiques de micro-organismes.
Ces composés sont produits pour des raisons spécifiques, telles que la les stresses ou de la prédation, et sont donc liés à l'écologie du producteur organismes. Les métabolites secondaires produits par les champignons endophytes sont également une source potentielle de nouveaux produits naturels bioactifs pouvant avoir des applications dans différents domaines (Beatriz et Taides, 2017).
Les recherches sur les endophytes ont mené à la découverte de nouveaux médicaments utilisables en thérapeutique, directement ou indirectement, avec des propriétés antibactériennes, antivirales, anti-oxydantes, anti-neurodégénératives et immunosuppressives
(Staniek et al., 2008). Ces produits présentent une grete diversité structurale comprenant des
alcaloïdes, stéroïdes, peptides, polykétones, cytochalasines, polykétides, quinols, phénols, flavonoïdes, dérivés des terpenoïdes et autres types de structure (Nisa et al., 2015).
I.1.8.1. Champignons endophytes comme source de substance antibactérienne
Les problèmes de santé dans le monde causés par des bactéries résistantes aux médicaments et les champignons sont en augmentation. Des nouvelles recherches intensives et de nouveaux agents antimicrobiens efficaces sont nécessaires. Les champignons endophytes ont été reconnus comme sources prometteuse pour avoir des métabolites secondaires bioactifs. Une récente étude approfondie a indiqué que 51% des substances biologiquement actives isolées des champignons endophytes étaient avant inconnu.
(Souwalak et al., 2006).
Les antibiotiques sont considérés comme des produits naturels organiques de faible poids moléculaire synthétisés par certains microorganismes à faible concentration contre d'autres microorganismes. Les endophytes sont souvent une source de ces antibiotiques. Il a été observé que les produits naturels provenant de microbes endophytes inhibent ou tuent une grete variété d’agents pathogènes, notamment les phytopathogènes, ainsi que les bactéries, les
13
champignons, les virus et les protozoaires affectant les êtres humains et les animaux (Strobel
et Daisy, 2003).
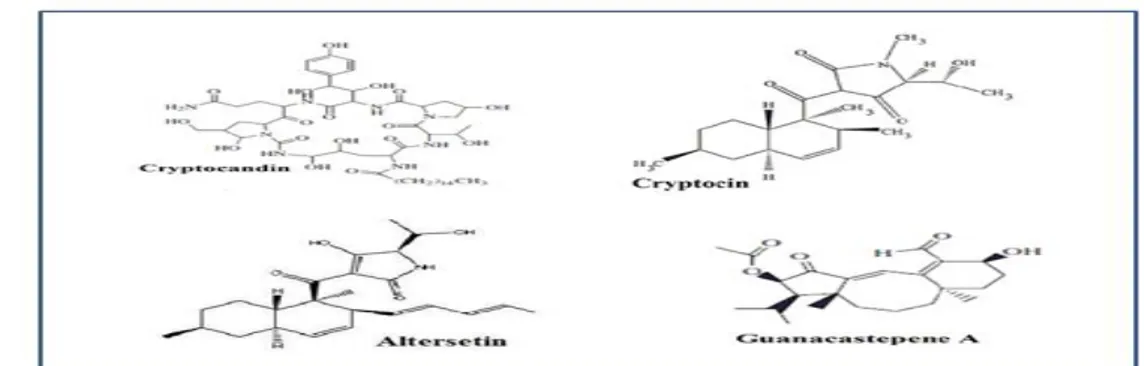
Figure 2: Quelques substances antimicrobiennes produites par les champignons endophytes (Selim et al., 2012).
I.1.8.2. Champignons endophytes comme source de substance antifongique
La griséofulvine est le seul antifongique largement utilisé contre les champignons pathogènes. L’origine de cet antifongique est l’espèce Penicillium griseofulvum. La griséofulvine est fongistatique plutôt que fongicide. Il est utilisé pour le traitement des dermatophytes, car il s'accumule dans les cheveux et la peau.
Des une recherches continues pour avoir de nouveaux antibiotiques pour diverses applications, ont été observé que certains champignons endophytes produisaient un mélange de composés organiques volatils mortels pour une variété de champignons et de bactéries pathogènes pour l'homme et les plantes (Monika et Rohit, 2014).
Le premier de ces champignons endophytes, Muscodor albus, a été isolé de Cinnamomum zeylanicum pousse dans les forêts tropicales humides du Honduras. D'autres espèces telles que M. vitigenus et M. roseus possédaient également un spectre large d'activité antimicrobienne. M. albus isolé de petits membres d'un certain nombre d'arbres et d'espèces de vigne dans le Territoire du Nord de l'Australie capable de produire de l'acide propanoïque, et du naphtalène. Ces isolats ont des applications potentielles comme le traitement de diverses graines, fruits et fleurs coupées, pour réduire ou éliminer les microorganismes nuisibles et pathogènes ou peuvent être utilisés en tant qu'alternative à la fumigation du sol par le bromure de méthyle pour contrôler les agents pathogènes des plantes transmis par le sol (Monika et Rohit, 2014).
Sur des boîtes de Pétri, Cryptosporiopsis quercina, a démontré une excellente activité antifongique contre certains agents pathogènes fongiques pour comme Cetida albicans et Trichophyton spp. Ce dernier a été trouvé produire un peptide antifongigue, appelé
14
cryptocetine. La cryptocetine est également active contre un certain nombre de champignons phytopathogènes, notamment Sclerotinia sclerotiorum et Botrytis cinerea. La cryptocetine et ses composés apparentés sont actuellement à l'étude pour lutter contre un certain nombre de champignons causant des maladies de la peau et des ongles (Strobel, 2002).
I.1.8.3. Champignons endophytes comme source de substance antivirale
Une autre utilisation importante des métabolites secondaires des champignons endophytes est le traitement des maladies d’origine virales. Deux molécules inhibitrices de cytomégalovirus, l’acides cétoniques A et B, ont été isolés après fermentation à l'état solide du champignon endophyte Cytonaema sp. (Strobel et Daisy, 2003).
I.1.8.4. Champignons endophytes comme source de substance anticancéreuse
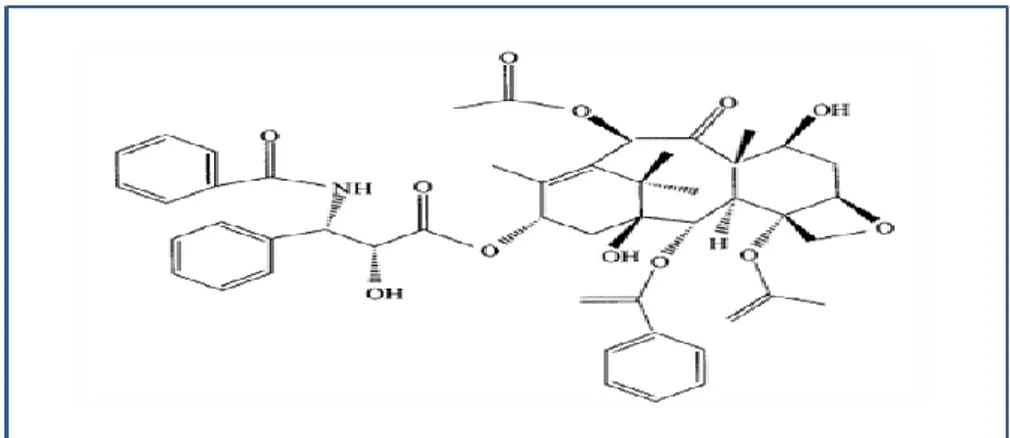
Le taxol ou le paclitaxel et certains de ses dérivés constituent le premier groupe majeur d'agents anticancéreux produits par les endophytes (Figure 3). Le paclitaxel a pour mode d’empêcher les molécules de tubuline de se dépolymériser au cours des processus de division cellulaire. Ce composé est le premier médicament anticancéreux au monde. Il est également utilisé pour traiter un certain nombre d'autres maladies liées à la prolifération des tissus humains (Strobel et Daisy, 2003).
Figure 3: Structure chimique de paclitaxel (Strobel et Daisy, 2003).
Il est important de noter que le taxol se trouve à une très faible concentration dans l'écorce de certaines espèces du genre Taxus, espèces en voie de disparition qui se développe très lentement. En conséquence, l'extraction du taxol par les méthodes traditionnelles à partir de l'écorce de ces espèces est inadéquate et coûteuse pour l'environnement. Par exemple, la production de 1 kg de Taxol, suffisante pour traiter cinq cents patients, nécessite 10 tonnes d'écorce provenant de 300 arbres. Pour protéger les ressources limitées en if et réduire le coût
15
du traitement médicamenteux, la recherche de nouvelles sources de Taxol est toujours utile. Plusieurs nouvelles méthodes ont été utilisées pour la production de Taxol via la synthèse, la semi-synthèse, la culture de cellules de tissu végétal et la fermentation microbienne. En particulier, la fermentation microbienne a montré que l'isolement et l'identification des champignons endophytes producteurs de Taxol seraient une méthode très prospective et un moyen adéquat pour la production d'une grande quantité de Taxol.
Les souches de différents champignons tels que Taxomyces etrenae, Pestalotiopsis microspora, Alternaria sp., Fusarium lateritium, F. solani, F. mairie, Periconia sp., Papulaspor sp., Cephalosporium sp., Ectostroma sp. et Botryodiplodia theobromae, sont reconnues par leur potentielle de production du Taxol (El-Maali et al., 2018).
I.1.8.5. Champignons endophytes comme source de substance antioxydant
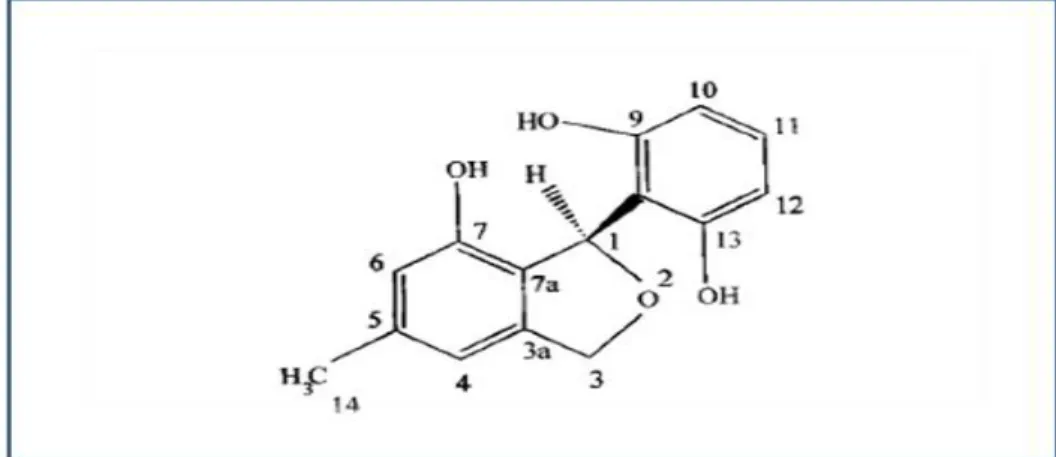
La pestacine et l'isopestacine ont été trouvé possédant des activité antioxydantes mais également antimicrobienne. La structure de l'isopestacine est similitude avec les flavonoïdes qui sont très reconnues par leurs activités antioxydantes (Figure 4). Le composé est capable de piéger les radicaux superoxydes et hydroxyles en solution.
Figure 4: Isopestacine, un antioxydant produit par l’endophyte Pestalotiopsis
microspora isolé à partir Terminalia morobensis (Strobel et Daisy, 2003).
La pestacine a été décrite plus tard à partir du même liquide de culture, se produisant naturellement et possédant également une activité antioxydante puissante (Figure 5). L'activité antioxydante de la pestacine est supérieure d'au moins une fois à celui du trolox, vitamine E comme molécule de référence (Strobel et Daisy, 2003).
16
Figure 5: Pestacin un antioxydant produit par l’endophyte P.microsporas isolé à partir T.
morobensis (Strobel et Daisy, 2003).
I.1.8.6. Les enzymes produites par les endophytes
Les champignons endophytes ont la capacité de produire des enzymes extracellulaires ; comme pectinase, cellulase, lipase, amylase, laccase et protéinases. Ces enzymes fongiques jouent un rôle dans la biodégradation et les processus d’hydrolyses qui sont des mécanismes importantes contre les infections et pour aboutir leur besoin nutritionnel de la plante hôte. (Sunitha et al., 2013). Ils sont donc un intérêt biotechnologique élevé tels que dans le traitement des aliments, la fabrication de détergents, textiles, produits pharmaceutiques, traitement médical et en biologie moléculaire, comme par exemple les Penicillium (Maria et
17
II.1. Matériel
II.1.1. Matériel microbien
Le matériel microbien comprend des bactéries pathogènes provenant de l’hôpital universitaire de Sétif et des champignons phytopathogènes ainsi qu’une levure provenant du laboratoire de microbiologie de l’université de Bordj Bou Arréridj.
Six bactéries à Gram positif: Staphylococcus aureus résistant à la
méticilline (SARM), Micrococcus luteus, Bacillus cereus ATCC 10876, Staphylococcus aureus ATCC 25923, Enterococus faecalis, Microbacterium yannicii, six à Gram négatif: Escherichia coli ATCC 25922, Pseudomonas aeruginosa ATCC 27853, Citrobacter freundii, Acinetobacter baumannii, Salmonella typhimurium et Klebsiella pneumoniae et une levure Candida albicans.
Les champignons phytopathogènes: Aspergillus niger, Fusarium oxysporium fs. Albedinis, Alternaria sp..
II.1.2. Produits chimiques
KH2PO4, MgSO4, Na2HPO4, NH4Cl.
Tween 80, Tween 20.
Glucose (C6H12O6), Agar, Chlorure de sodium (NaCl). Amidon (C6H10O5) n, Sucrose.
Peptone, l’eau peptonée.
Extrait de levure, extrait de malt.
Les milieux de culture solides: Gélose nutritive (GN), Sabouraud dextrose agar (SDA). Les solvants: N-hexane, chloroforme, acétate d’éthyle.
18
II.2. Méthodes
II.2.1. Echantillonnage et isolement
L’isolement du champignon endophyte penicillium sp. a été réalisé par Mr. SADRATI Nouari.
II.2.2. Dépistage initial de l'activité antimicrobienne II.2.2. 1.Préparation des microorganismes tests
Le dépistage de l’activité antibactérienne du champignon endophyte Penicillium sp. a été réalisé en utilisant quatre bactéries pathogènes, deux à Gram positif: Bacillus cereus ATCC 10876 et Staphylococcus aureus ATCC 25923 et deux à Gram négatif: Escherichia coli ATCC 25922 et Pseudomonas aeruginosa ATCC 27853.
Pour tester l’activité antifongique de ce champignon endophyte, trois espèces fongiques ont été utilisé: Aspargilus niger, Fusarium oxysporium fs. Albedinis, Alternaria sp..
Chaque bactérie a été cultivée sur gélose nutritive à 37°C pendant 24 h et diluée jusqu'à ce que la concentration atteigne les UFC / ml par spectrophotométrie (DO = 0,08-0,1 à 625 nm) (Sadrati et al., 2013). Les champignons ont été mis à croitre sur du PDA pendant une dizaine de jours (Zerroug et al., 2018).
II.2.2.2. Criblage préliminaire de l’activité antimicrobienne
Pour évaluer l’activité antimicrobienne du champignon endophyte, deux méthodes ont été utilisées. La première est la technique de diffusion sur gélose pour l’activité antibactérienne, et la deuxième technique est celle de la double culture pour l’activité antifongique.
L'activité antibactérienne du champignon endophyte (Figure 7) a été réalisée selon le protocole expliqué par (Powthong et al., 2013), avec quelques modifications. En bref, des cultures pures du champignon endophyte ont été cultivées à la surface du Potato dextrose agar (PDA) (Extrait de 200 g de pomme de terre Glucose 20 g, Agar 15 g, Eau distillée1000 ml/ pH 5.6) à 28 ° C pendant 3 semaines (Figure 6).
Un petit disque de colonie fongique a ensuite été découpé (diamètre 6 mm) stérilement et placé sur la gélose nutritive préalablement inoculée par les bactéries pathogènes. Un disque
19
de PDA sans champignons a été utilisé comme contrôle négatif. Les boîtes de Pétri ont été mises ensuite dans le réfrigérateur à 4°C pendant 2h pour permettre la diffusion complète des composés antibactériens dans la gélose, puis ces boîtes ont été incubées à 37°C pendant 24 h. L'activité antibactérienne a été déterminée en mesurant les zones d'inhibition produites par les disques du champignon endophyte Penicillium sp. .
Figure 6: Culture pure du champignon endophyte cultivé sur (PDA) pendant 3 semaines.
Figure 7: Technique de diffusion sur gélose.
Pour le dépistage de l’activité antifongique, nous avons utilisé la technique de la double culture décrite par (Rahul et al., 2015). Elle consiste à mettre un disque de 6 mm de diamètre du champignon endophyte Penicillium sp. provenant d’une culture de 7 jours sur une boite de Pétri contenant du PDA, ensuite un autre disque du même diamètre du champignon pathogène est mis à l’autre extrémité de la boite avec une distance de 50 mm entre les deux disques. Chaque boite ainsi que la boite contrôle qui ne contient pas l’endophyte ont été
20
incubés à 28°C. Après sept jours d’incubation, le rayon de chaque champignon pathogène est mesuré dans le sens du champignon endophyte, ainsi que dans les boites contrôles
(Nuangmek et al., 2008; Orole et Adejumo, 2009; Ting et al., 2009). Le pourcentage
d’inhibition est ensuite calculé par la formule suivante:
Pourcentage d’inhibition =
Où :
R1:La croissance radiale de l’agent pathogène dans le contrôle R2: La croissance radiale de l’agent pathogène en double culture
II.2.3. Sélection du milieu de culture approprié
Pour sélectionner le meilleur milieu permettant une meilleure production et une activité antimicrobienne maximale, le champignon endophyte a été cultivé sur la surface de différents milieux de culture PDA, Sabouraud Dextrose Agar (SDA), Yeast Extract Sucrose Agar (YES), Malt Extract Agar (MEA), et Yeast Malt Extract Agar (YMEA) puis incubé à 28°C pendant 3 semaines (Zerroug et al., 2018).
La méthode de diffusion sur gélose a été réalisée comme décrit ci-dessus contre quatre bactéries pathogènes, deux à Gram positif: Bacillus cereus ATCC 10876 et Staphylococcus aureus ATCC 25923 et deux à Gram négatif: Escherichia coli ATCC 25922 et Pseudomonas aeruginosa ATCC 27853.
II.2.4. Fermentation et extraction
Le champignon endophyte a été cultivé sur le milieu liquide sélectionné (MEB) et deux milieux de culture solide, au son de riz et au son de blé, en inoculant deux disques d’agar (6 mm) de la culture fongique pure en croissance active dans des Erlenmeyer de 250 ml contenant 100 ml du milieu liquide MEB, ou du milieu solide au son de riz (2g) ou au son de blé (2g) humidifiés par 7ml d’eux distillée. Tous les Erlenmeyer ont été incubés ensuite pendant 21 jours à 28 ± 2°C.
Pour le MEB, le mycélium fongique a été séparés du filtrat à l'aide d'un papier filtre Whatman (Zerroug1 et al., 2018).
21
Afin de choisir le meilleur solvant d'extraction, trois solvants organiques ont été utilisés, le n-hexane, le chloroforme et l’acétate d'éthyle. La méthode d’extraction a été réalisée en utilisant la méthode expliquée par (Saraswaty et al., 2013) avec quelques modifications. En bref, le filtrat obtenu après fermentation liquide a été extrait avec un volume égal de l’acétate d'éthyle. La solution a ensuite été agitée pendant 30 min. La phase de l’acétate d'éthyle a ensuite été séparée par décantation. La phase aqueuse restante a été ré-extraite à nouveau par les autres solvants en utilisant la même méthode.
En milieu solide (son de riz et son de blé), la méthode d’extraction a été réalisée sur la base de la méthode expliquée par (Dos Santos et al., 2015) avec quelques modifications. Les milieux solides ont été mélangés avec un 100 ml d’acétate d'éthyle, après agitation pendant 1h, la phase organique a été récupérée par filtration. La phase solide restante a été extraite à nouveau par les autres solvants de la même manière. Toutes les phases organiques ont été séchées sous la hotte et redissoutes dans le DMSO et maintenues à 4 ° C.
22
Incubation de champignon endophyte à 28 ° C. dans le PDA pendant 3 semaines
Fermentation en milieu liquide (MEB) Fermentation en milieu solide
à 28 °C pendant 15 jours (Le son de riz et de blé) à 28 ° C p. 15 jours
Filtration à l’aide du papier filtre (Whatman) Extraction à l’acétate d'éthyle
Agitation pendant 30 min Mycélium fongique le filtrat Filtration à l’aide du papier filtre (Whatman)
Extraction à l’acétate d'éthyle
Agitation pendant 30 min Phase organique 1 l’acétate d'éthyle Décantation
Extraction au chloroforme
Phase organique 1 Phase aqueuse Phase organique 2 chloroforme
Extraction au chloroforme Extraction par le n-hexane
Décantation Filtration
Phase organique 2 Phase aqueuse Phase organique finale n-hexane
Extraction par le n-hexane
Décantation Evaporation Evaporation Phase organique finale
Les extraits bruts ont ensuite été remis en suspension dans le DMSO maintenu à 4 ° C
Figure 8: Le protocole d’extraction des métabolites secondaires du champignon endophyte en milieu solide et en milieu liquide.
23
II.2.5. Evaluation de l'activité antimicrobienne des extraits bruts
Méthode des puits
Les extraits ont été testés afin d’évaluer leur activité antimicrobienne en utilisant la méthode des puits (Fatima et al. 2016) contre quatre bactéries; Micrococcus luteus, Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Salmonella typhimurium et trois champignons phytopathogènes; Aspergillus niger, Fusarium oxysporium fs. Albedinis, Alternaria sp. .
Après une analyse statistique, le solvant donnant la meilleur activité a été testé contre 12 bactéries pathogènes pour l’homme: Citrobacter freundii, Acinetobacter baumanni, Salmonella typhimurium, Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, Bacillus cereus, Staphylococcus aureus, (SARM) Staphylococcus aureus résistant à la méticilline, Micrococcus luteus, Enterococcus faecalis, Microbacterium yannicii, la levure Candida albicans et trois champignons phytopathogènes Aspergillus niger, Fusarium oxysporium fs. Albedinis, Alternaria sp. .
Les suspensions bactériennes, de levure et sporales ont été normalisées pour avoir une charge d’environ UFC/ml, pour les bactéries et de UFC/ ml pour la levure et spore/ ml pour les champignons filamenteux à l’aide du spectrophotomètre (Devaraju et
Satish, 2011).
Les bactéries, la levure et les champignons filamenteux ont ensuite été inoculées sur la surface de GN, SDA et PDA respectivement. 30 µl de chaque extrait a été versé dans des puits préalablement formés dans la gélose de chaque milieu (diamètre de 6 mm). Le DMSO a été utilisé comme contrôle négatif. Après une incubation à 37°C pendant 24 h pour les bactéries et 48 heures pour la levure et à 28°C pendant 72 heures pour les champignons filamenteux, le diamètre de chaque zone a été mesuré et utilisée comme indicateur d’activité antimicrobienne (Zerroug et al., 2018).
II.2.6. Activité enzymatique
La production des enzymes extracellulaires par le champignon endophyte a été évaluée en se basant sur la digestion du substrat d’enzyme dissout dans la couche gélosé des milieux. Les diamètres des zones de l'activité enzymatique entourant la colonie et ceux des colonies fongiques ont été mesurés après une incubation à 28°C pendant 24 à 96 heures.